Bacilos Gram + formadores de esporas
Anuncio

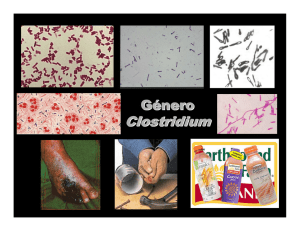
Bacilos grampositivos formadores de esporas: Clostridium. Los bacilos grampositivos formadores de esporas son los Bacillus y los Clostridium., estos se pueden encontrar en muchas partes y dado que forman esporas pueden sobrevirir durante mucho tiempo y en condiciones adversas.. Los Bacillus son aeróbicos y los Clostridium anaeróbicos estrictos. Bacillus y Clostridium poseen una numerosa variedad de especies, sin embargo solo están bien caracterizadas médicamente aquellas que producen enfermedades importantes al hombre. Los Bacillus producen enfermedades como el ántrax e intoxicaciones alimentarias. Los Clostridium producen enfermedades importantes mediadas por toxinas tales como tétanos, gangrena gaseosa, botulismo y colitis seudomembranosa. Especies de Clostridium Son bacilos anaerobios grandes, grampositivos, móviles. Descomponedores de proteínas y/o formadores de toxinas. Son saprofitos (suelo, tracto instestinal). Algunos patógenos causan botulismo, tétanos, gangrena gaseosa y colitis seudomembranosa. Morfología e Identificación A. Microorganismos típicos Las esporas habitualmente son más anchas que el diámetro del bacilo; esta puede ser central, subterminal o terminal. La mayor parte de los clostridium son móviles y tienen flagelos perítricos. B. Cultivo Crecen solo en condiciones anerobias. En placas de agar o tubos de cultivo a los cuales se les ha retirado el aire y se sustituye por nitrógeno con 10% de CO2 . En medio líquido en tubo largo en el cual contiene muestra de tejido o 0,1& de agar y agente reductor, como tioglicolato. Crecen desde el fondo hasta 15 mm antes de la superficie. C. Forma de las colonias Algunos, colonias grandes prominentes con bordes regulares (C. perfringens); otros colonias más pequeñas extendidas en forma de red de finos filamentos (C. tetani). En agar sangre muchos de ellos producen hemólisis. Perfringens produce múltiples zonas de hemólisis alrededor de sus colonias. D. Características de crecimiento Son incapaces de utilizar oxígeno como aceptor final de hidrógeno. No tienen citocromos y citocromo oxidasa y no pueden desdoblar peróxido de hidrógeno, no tienen catalasa y peroxidasa. En presencia de oxígeno acumulan H2O2 hasta niveles tóxicos. Tampoco tienen superóxido dismutasa, acumulan un radical libre tóxico, el anión superóxido. Sólo realizan reacciones metabólicas en un ambiente fuertemente reductor. Pueden fermentar varios azúcares otros pueden digerir proteínas. 1 E. Características antigénicas Comparten algunos antígenos, pero poseen antígenos específicos solubles que permiten diferenciarlos. Clostridium botulinum Causa el botulismo y se distribuye en todo el mundo. Se encuentra en el suelo y en heces de animales. Los tipos de C. botulinum se distinguen por el tipo antigénico de la toxina producida. Sus esporas son muy resistentes, resisten 100ºC 3 a 5 horas. Toxina Durante el crecimiento y la autólisis del C. botulimun se libera toxina. Siete variedades de toxina (A a G). A, B y E (a veces F) causan la enfermedad humana. A y B vinculados con alimentos, E productos de pesca. C “cuello blando” en aves. D, botulismo en mamíferos. Son proteínas neurotóxicas de estructura y acción similar; formadas por cadenas pesadas y ligeras unidas por puentes disulfuro. La cadena pesada enlaza la toxina a la placa terminal y la cadena ligera bloquea la liberación de acetilcolina producida por canales de calcio. Las toxinas se destruyen al calentarlas a 100 ºC por 10 minutos. Un gen viral controla la producción de toxina. Algunas cepas de C. botulinum producen bacteriófagos para convertir otras cepas en toxígenas. Patogenia El botulismo es una intoxicación por ingesta de alimentos contaminados con C. botulinum productor de toxina. Alimentos sazonados con especies, ahumados, empacados al vacío o enlatados en medio alcalino ingeridos sin cocinar. Así germinan las esporas en este medio anaeróbico y luego las formas vegetativas crecen y producen toxina. La toxina impide la liberación de acetilcolina en las sinapsis y uniones neuromusculares. Consecuencia parálisis fláccida. Datos clínicos Síntomas 18 a 24 horas después de ingerir el alimento contaminado; trastornos visuales, incapacidad para deglutir y hablar; la muerte ocurre por parálisis respiratoria o cardíaca. Síntomas gastrointestinales no son notables; no hay fiebre. Conciencia hasta poco antes de la muerte. En USA. El botulismo del lactante es tanto o más común que la variante por ingestión de alimentos contaminados. Pruebas diagnósticas de laboratorio Se puede demostrar la existencia de antitoxina en el suero del paciente y en residuos de alimentos. En el botulismo del lactante se puede demostrar la existencia de C. botulinum y toxina en el contenido intestinal pero no en el suero. Tratamiento Existen potentes antitoxinas a los 3 tipos de toxina botulínica. Se administran por vía intravenosa. Si es necesario, ventilación mecánica. Se reduce la tasa de mortalidad de 65% a 25%. 2 Epidemiología, prevención y control Las esporas pueden contaminar desde el suelo a los vegetales, frutas y otros materiales. Los alimentos enlatados deben calentarse o hervirse durante unos 20 minutos antes de consumirlos para acabar con las esporas. Las técnicas industriales han disminuido las posibilidades de intoxicación, pero hay que tener cuidado con las conservas domésticas. Clostridium tetani Causa el tétanos, se distribuye en el suelo y heces de caballos y otros animales. Se distinguen varios tipos mediante antígenos flagelares. Todos comparten un mismo tipo de antígeno O común (somático) y todos producen el mismo tipo de neurotoxina, la tetanospasmina. Toxina Las células vegetativas producen tetanospasmina y al lisarse las liberan. Un plásmido controla la producción de toxina. La toxina intracelular es un polipéptido que enzimas proteolíticas separan en dos fragmentos de mayor toxicidad. La tetanospasmina inhibe la liberación de acetilcolina. La acción más importante es la inhibición de neuronas postsinápticas espinales impidiendo la liberación de mediadores inhibitorios. Provoca hiperreflexia y espasmo muscular, a veces generalizado. Patogenia El C. tetan no es invasor. La infección es localizada al tejido desvitalizado en el cual se han introducido las esporas. El tejido infectado es pequeño y la enfermedad es toxemia casi en su totalidad. La germinación de esporas y desarrollo se favorece por: 1 tejido necrosado, 2 sales de calcio, 3 infecciones piógenas acompañantes, esto bajaría el potencial oxido reducción. Toxina puede ser transportada via axonal retrógrada o por corriente sanguínea. En el SNC la toxina se fija a los gangliósidos en la médula y tronco. Datos clínicos Incubación de 4 a 5 días hasta semanas. Contracciones tónicas de los músculos voluntarios. Se produce trismus, el paciente no puede abrir la boca. Muerte en conciencia, dolor intenso. Deceso por falla respiratoria. Tasa de mortalidad alta. Diagnóstico Basado en cuadro clínico y lesión. Diagnóstico diferencial establecido con envenenamiento por estricnina. El cultivo anaerobio de tejidos de heridas puede desarrollar C. tetani, pero hay que acompañar esto con la verificación de producción de toxina y neutralización con antitoxina para administrar la antitoxina con fines preventivos o terapéuticos. Prevención y tratamiento Tratamiento no siempre satisfactorio, por lo tanto es más importante la prevención: 1 inmunización activa con toxoide, 2 atención apropiada de heridas contaminadas con tierra, 3 empleo profiláctico de la antitoxina, 4 administración de penicilina. 3 A. Antitoxina Ella puede neutralizar la toxina sólo antes de que esta se fije sobre tejido nervioso. De preferencia administrar antitoxina humana en vez de preparado en animales, debido a la rapidez con que el suero extraño se elimina. 250 a 500 unidades de antitoxina intramuscular suministran protección sistémica adecuada durante 2 a 4 semanas. Debe ser acompañado con inmunización activa con toxoide tetánico. Relajantes musculares, sedantes y ayuda ventilatoria. Dudosa eficacia de la antitoxina para el tratamiento, salvo para el tétanos neonatal. B. Medidas quirúrgicas Desbridamiento quirúrgico es importante, ya que retira el tejido necrosado en el cual pueden proliferar más microorganismos. C. Antibióticos Penicilina inhibe el crecimiento de C. tetan y detiene la producción de toxina. D. Toxoide tetánico Una persona previamente inmunizada que ha sufrido una herida debe ser inyectada con una dosis adicional de toxoide para estimular la producción de antitoxina. Esto puede acompañarse de una dosis de antitoxina si el paciente no ha tenido inmunización previa o reciente. Control El tétanos es prevenible. EL toxoide se produce por detoxificación de la toxina con formalina y luego concentración de ella. Tres inyecciones iniciales luego seguida de una dosis un año después. Inmunización inicial durante el primer año de vida. Al iniciar edad escolar se refuerza con toxoide. A partir de entonces los refuerzos se pueden aplicar cada 10 años para mantener concentraciones séricas mayores a 0,01 unidades de antitoxina por ml. El control es muy difícil debido a la ubicuidad del organismo y a la producción de esporas. Clostridium que producen Infecciones Invasoras (C. perfringens y relacionados) Diferentes Clostridium tóxicos pueden producir infección invasora (incluso mionecrosis y gangrena gaseosa), pero el más común es el C. perfringens. Una toxina del C. perfringens produce envenenamiento alimentario. Toxinas Producen gran cantidad de toxinas y enzimas que propician la propagación de la enfermedad. Estas tienen propiedades mortales, necrosantes y hemolíticas. La toxina alfa del C. perfringens tipo A es una lecitinosa, esta desdobla leticina de las membranas celulares, transformándola en forforilcolina y diglicéridos. La toxina theta es hemolítica y necrosante, pero no es lecitinasa, es colagenasa de tejido subcutáneo y músculo. Algunas cepas de C. perfringens producen enterotoxina. Produce hipersecreción del yeyuno e íleon, con diarrea y pérdida de líquido y electrolitos (se cree por estimulación de adenilciclasa o guanilciclasa). Al ingerir los organismos, estos esporulan en el intestino y forman enterotoxina, que es una proteína idéntica a un componente de la capa de la espora. Produce diarrea intensa en 6 a 18 horas. Esta enfermedad es autolimitada. 4 Patogenia Esporas alcanzan los tejidos por contaminación de las zonas traumatizadas o desde el intestino. Las células vegetativas fermentan carbohidratos y producen gas. Distensión tisular e interferencia del riego sanguíneo junto con la toxina necrosante y hialuronidasa favorecen la propagación de la infección. Necrosis se extiende, aumentan los microorganismos, se produce anemia hemolítica y finalmente la muerte por toxemia grave. La gangrena gaseosa (micronecrosis por Clostridium) es una enfermedad mixta, se pueden observar también cocos y microorganismos gramnegativos. El C. perfringens de tipo C produciría enteritis necrosante. La inmunización con este toxoide parece tener valor preventivo. Datos clínicos Propagación desde una herida contaminada en 1 a 3 días. Crepitación en tejido subcutáneo y músculo, secreción fétida, necrosis rápidamente evolutiva, fiebre, hemólisis, toxemia, choque y muerte. Tratamiento: intervención quirúrgica temprana (amputación) y administración de antitoxina. A veces solo infección produce solo fascitis o celulitis anaerobias. Intoxicación alimentaria por C. perfringens sucede después de ingerir un gran número de bacterias desarrolladas a temperatura ambiente sobre carne. Enfermedad acontece al esporular los organismos en el tracto intestinal. Diarrea sin vómitos en 6 a 18 horas. Enfermedad dura 1 a 2 días. Pruebas diagnósticas de laboratorio A. Muestras Material de heridas, pus, tejido. B. Frotis Presencia de bacilos grandes grampositivos formadores de esporas en frotis de gram sugiere gangrena gaseosa por Clostridium, regularmente no se encuentran esporas. C. Cultivo Se inocula en medio con carne picada y glucosa y en medio con tioglicolato, sobre placas agar sangre en condiciones anaerobias. Estas se pueden trasladar a medios con leche; al obtenerse un coágulo disgregado por gas se sugiere C. perfringens. Se pueden identificar por reacciones con azúcares con tioglicolato, leche, hemólisis y formación de colonias. La actividad lecitinasa se evalúa en precipitado formado en yema de huevo. En agar no hacen esporas. Tratamiento Desbridamiento quirúrgico de la zona afectada. Penicilina. Tratamiento hiperbárico de tejidos afectados. Antitoxinas en personas con heridas contaminadas y mucho tejido desvitalizado (no hay evidencia de eficacia). Intoxicación alimentaria por enterotoxina solo requiere tratamiento sintomático. Prevención y control Limpieza temprana y adecuada de heridas, desbridamiento y antimicrobianos. No se debe confiar solamente en antitoxinas. Toxoides aun no son empleados en clínica. 5