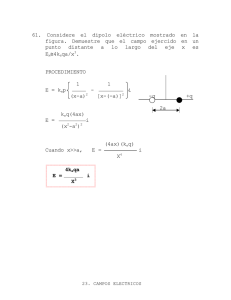
Documento 381579
Anuncio

EJERCITO NACIONAL LICEOS DEL EJÉRCITO SESION 2 LABORATORIO DE QUÍMICA GRADOS UNDECIMO EQUILIBRIO QUÍMICO LOGRO Identificar los aspectos que alteran las condiciones de equilibrio de un proceso químico EQUILIBRIO QUÍMICO Y PRINCIPIO DE LECHATELIER FUNDAMENTO TEÓRICO Al presentarse una transformación física o química, podemos analizar la posibilidad de re reversibilidad del proceso, es decir, el hecho de que la reacción sea factible tanto en sentido directo (de reactivos a productos) como en sentido inverso (de productos a reactivos). Evaluemos el caso de un cambio de estado o transformación física, cuando el agua pasa de estado líquido a gaseoso, a temperatura diferente del punto de ebullición (100°C, 1 atm.) y en un sistema cerrado, en el que se permite el intercambio de calor entre el sistema de estudio y su entorno, pero no se permite el intercambio de materia. Es lógico que a temperatura ambiente, se logre un equilibrio dinámico entre las moléculas de la superficie que pasan al estado gaseoso y las moléculas gaseosas del entorno, que pasan al estado líquido. Al incrementar la temperatura, se incrementa la presión de vapor y por tanto el equilibrio favorece el pasa de líquido a gas en comparación con el sistema inicial (lo contrario se observa si se disminuye la temperatura), y con el tiempo se logra un nuevo equilibrio. Es factible cambiar las condiciones de un sistema y variar incluso el sentido de la reacción. Estas condiciones dependen del sistema objeto del estudio y son en general cambio en la temperatura, la presión, el volumen, las concentraciones de reactivos y productos, y otros agentes como solvente y catalizadores. El equilibrio, solo puede ser alcanzado por procesos que sean “reversibles”. En el ejemplo anterior, las moléculas gaseosas pueden pasar al estado líquido y el proceso contrario, el paso de las moléculas líquidas al estado gaseoso, también es factible, así que se trata de un proceso reversible. Si se considera una reacción química reversible, en la que el reactivo R se transforma en el producto P (R = P). Este proceso solo alcanzará el equilibrio cuando todas las fuerzas que actúan sobre él, estén balanceadas, lo cual se verifica cuando la velocidad de transformación o desaparición del reactivo R es igual a la velocidad de transformación o aparición del producto P, esto es “la velocidad en sentido directo y sentido inverso se iguala en el equilibrio”. Lo anterior puede ser representado a través de una ecuación de equilibrio para unas condiciones de presión y temperatura dadas: Keq = P R Donde Keq es la constante de equilibrio, P la concentración de los productos y R la concentración de los reactivos. Al cambiar posteriormente las condiciones del sistema, éste tiende a buscar el balance de sus fuerzas y restablece un equilibrio conservando su Keq; el valor de Keq será diferente del primero si se modifican las condiciones de temperatura. Si se considera una reacción química reversible , en la que el reactivo R se transforma en el producto P ( R = P). Este proceso solo alcanzará el equilibrio cuando todas las fuerzas que actúan sobre él, estén balanceadas, lo cual se verifica cuando la velocidad de transformación o desaparición del reactivo R es igual a la velocidad de transformación o aparición del producto P, esto EJERCITO NACIONAL LICEOS DEL EJÉRCITO SESION 2 LABORATORIO DE QUÍMICA GRADOS UNDECIMO EQUILIBRIO QUÍMICO es “la velocidad en sentido directo y sentido inverso se iguala en el equilibrio”. Lo anterior puede ser representado a través de una ecuación de equilibrio para unas condiciones de presión y temperatura dadas: Keq = P R Donde Keq es la constante de equilibrio, P la concentración de los productos y R la concentración de los reactivos. Al cambiar posteriormente las condiciones del sistema, éste tiende a buscar el balance de sus fuerzas y restablece un equilibrio conservando su Keq; el valor de Keq será diferente del primero si se modifican las condiciones de temperatura. Si se considera una reacción química reversible, en la que el reactivo R se transforma en el producto P ( R = P). Este proceso solo alcanzará el equilibrio cuando todas las fuerzas que actúan sobre él, estén balanceadas, lo cual se verifica cuando la velocidad de transformación o desaparición del reactivo R es igual a la velocidad de transformación o aparición del producto P, esto es “la velocidad en sentido directo y sentido inverso se iguala en el equilibrio”. Lo anterior puede ser representado a través de una ecuación de equilibrio para unas condiciones de presión y temperatura dadas: Keq = P R donde Keq es la constante de equilibrio, P la concentración de los productos y R la concentración de los reactivos. Al cambiar posteriormente las condiciones del sistema, éste tiende a buscar el balance de sus fuerzas y restablece un equilibrio conservando su Keq; el valor de Keq será diferente del primero si se modifican las condiciones de temperatura. Principio de Le Chatelier: “Cuando un agente externo provoca un cambio que rompe el equilibrio de un sistema, se produce una respuesta contra la causa que lo alteró, con el objetivo de restablecer bajo las nuevas condiciones, un equilibrio” PROCEDIMIENTO 1. Análisis de equilibrio con indicadores. Tomara un tubo de ensayo, adicionar 5 ml de agua y unas gotas de indicador (Fenolftaleína). Observar color y registrar. Adicionar unas gotas de NaOH (1M). Agrega posteriormente gotas de HCl (1M). Repetir el procedimiento y discutir lo observado. 2. Equilibrio cromato de potasio-dicromato de potasio. En un tubo de ensayo con 2 ml de una solución de K2CrO4 (1 M), adicionar 5 gotas de HCl (1M) y posteriormente 5 gotas de NaOH (1 M) . Discutir sus observaciones. 3. En un tubo de ensayo con 5 ml de agua adicionar CaCO3 sólido. Agrega lentamente y con agitación HCl (1 M) hasta que el precipitado desaparezca. Escribe conclusiones. LABORATORIO DE QUÍMICA GRADOS UNDECIMO EQUILIBRIO QUÍMICO EJERCITO NACIONAL LICEOS DEL EJÉRCITO SESION 2 ANÁLISIS DE RESULTADOS. 1. ¿Cómo puede alterar un catalizador el equilibrio químico? 2. Considere el siguiente sistema en equilibrio en fase gaseosa: N2 + 3H2 = 2 NH3 + 22 Kcal La reacción en sentido directo es exotérmica y en sentido inverso endotérmica. ¿Qué pasa si se aumenta la temperatura? Manual de Prácticas de Química General. Universidad Nacional de Colombia. Medellín.