VALORACION DE AUXINAS
Anuncio

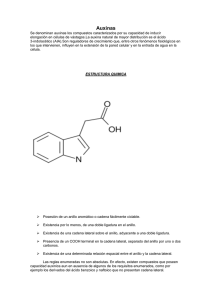
TRABAJO SEMESTRAL AG-3030 PPRINCIPIOS DE PROPAGACION DE PLANTAS Por: Ortega Sandoval Dirección e-mail: [email protected] Tema: Auxinas Resumen: La primera hormona animal conocida fue la testosterona nueve años después fueron reconocidas las auxinas como hormona de crecimiento vegetal en 1,871. La primera auxina endógena fue identificada en 1,934 y su estructura corresponde al ácido-3indolacético (AIA). En la práctica agrícola el AIA y sus análagos químicos estructurales todavía se utiliza de una forma empírica, a pesar de la antigüedad de su descubrimiento. En este trabajo destacamos los aspectos que debemos conocer para comprender la forma en que se sintetiza y metaboliza el AIA con el objeto de manipular los niveles en los tejidos, para controlar el crecimiento vegetal de una forma práctica. Es importante comprender los niveles endógenos de AIA. Existe un pool, o varios, de AIA en la planta. El tamaño de estos pools depende de las “entradas” y “salidas” que en ellos se produzcan y de la velocidad de uso del AIA en los procesos promotores del crecimiento ( S. Bandurski 1,992; P.Slovin y D.Cohen 1.992). Las condiciones medioambientales externas determinan la velocidad con que se utiliza el AIA, ya que la velocidad de crecimiento de la planta se modifica de acuerdo a su medio ambiente particular ( Barcelo 1,995). En cuanto a la biosíntesis existe suficiente información para demostrar que el AIA se sintetiza a partir del triptófano (Bidwell 1,993) Los principales procesos orgánicos que controla las auxinas son: iniciación de la radícula y raices adventicias, retención de flores y frutos, paso de flor a fruto, juventud del follaje (interacción compleja) y tropismos . las auxinas a bajas concentraciones estimulan el metabolismo y desarrollo y a concentraciones altas la deprimen (Rojas 1,993) Se menciona los requerimientos estructurales de la actividad auxinica de manera que facilite la síntesis de reguladores del crecimiento ( Barcelo 1,995) Las auxinas intervienen basicamente en dos estados del enraizamiento: El primero, en el cual se forman los meristemos radiculares, estado inicial de su crecimiento. Este a su vez se puede dividir en un estado activo de acción de las auxinas en el cual debe haber una continua presencia de auxinas, pudiendo estas venir de los brotes terminales o laterales o de una aplicación externa, y una segunda etapa, la cual se puede denominar como de auxinas inactivas, ya que estas están presentes en la raíz cuatro días mas pero no tienen ningún efecto adverso en su formación. En la segunda etapa se da la elongación de los primordios radicales, en esta la nueva raíz atraviesa la corteza hasta emerger de la epidermis del tallo, para esto un sistema vascular ya se formó en la nueva raíz y se ha fusionado a los tejidos vasculares del tallo, una vez llegado a éste punto ya no hay mayor respuesta a las auxinas.(Hartmann, 1997). Referencias: Hartmann, H.T.,D.E.Kester, F.T.Davies,Jr.,and R.L..Geneve.1,997. Plant Propagatión: Principles and Practices.6ta edición., Pretince Hall. Englewood cliffs,N.J. Pg:20-24, 357-361,289-291. J. Azcon-Bieto y M. Talon. Madrid.1,996. Fisiología y bioquímica Vegetal. 1ra edicióN. EDIGRAFOS.pg: 285-299. Barcello Coll Juan. Madrid.1995.Fisiologia Vegetal 7° edición. Ediciones PIRAMIDE pg:354-357. Bidwell r.g.s. México.1,993. Fisiologia Vegetal .1° edición. AGT editor S.A. PG Control Hormonal del Desarrollo de Planta. Pg: 599-608 Rojas Gardeñas Manuel 1,993. Control hormonal del Desarrollo de las Plantas. Pg:2833. CONTENIDO 1. VALORACION DE AUXINAS El primer problema que hay que abordar cuando intentamos valorar el contenido auxínico de un tejido es la extracción de las auxinas contenidas en ese tejido. Los trabajos de Thimann pusieron de manifiesto que las auxinas se encuentran en la planta en tres formas una de fácil extracción por métodos de difusión, otro algo más difícil de extraer que requiere el empleo de solventes orgánicos y, por último, una tercera forma de auxina cuya extracción requiere métodos enérgicos, como puede ser hidrólisis con NaOH o el empleo de enzimas proteolíticos. De aquí surgió el concepto de auxina ligada, de tal forma que ésta sería la auxina fisiológicamente activa, mientras que la auxina que se extrae por difusión sería el exceso que se encuentra en equilibrio con la auxina combinada. El hecho de que la auxina se encuentra bajo diferentes formas hace pensar que la auxina combinada puede encontrarse en dos o más formas activas uniéndose la molécula de AIA a péptidos de cadena suficientemente larga para hacerla insoluble o asociada formando glicósidos. 2. LOCALIZACION DE LA AUXINA Se ha podido comprobar que las auxinas están ampliamente distribuidas en el reino vegetal. Las cantidades de AIA que se miden oscilan entre 1 y 100µg por Kg de peso seco, aunque con las modernas técnicas de extracción y corrección de las pérdidas a lo largo del proceso los valores máximos en algunos tejidos pueden ser incluso tres veces mayores. En cuanto a la distribución de la auxina en los distintos órganos o tejidos, se ha visto, utilizando el test de epicótilo de guisante, que en la plántula de trigo existía alto contenido en el ápice del coleóptilo que iba disminuyendo a medida que se descendía a lo largo del mismo, alcanzándose el mínimo en la base y un incremento a medida que se progresaba hacia el ápice de la raíz, siendo el valor en este punto menor que el que existe en el ápice del coleóptilo. 3. CURVA OPTIMA En todos los ensayos en que se mide elongación, el tejido crece a medida que lo hace la concentración de auxina hasta un cierto valor máximo. En este punto hay una inflexión y al aumentar la concentración, la elongación disminuye. 4. BIOSINTESIS DE LA AUXINA Existe información suficiente para demostrar que el AIA se sintetiza a partir de triptófano. Esta transformación pueden llevarla a cabo microorganismos e incluso se puede producir una conversión oxidativa cuando el triptófano se encuentra en presencia de peroxidasas y de radicales libres. Las vías de síntesis del AIA se basan en la evidencia obtenida a partir de la presencia de intermediarios y su actividad biológica y el aislamiento de enzimas capaces de convertir in vivo estos intermediarios en AIA. Queda por definir en que órgano o tejido se lleva a cabo la biosíntesis de las auxinas en condiciones naturales. Aunque se han realizado diversos estudios sobre la distribución de la auxina en la planta, hay que hacer notar que lo que se mide en un momento dado es el balance entre síntesis, metabolismo y transporte, tanto de entrada como de salida. También conviene añadir que el hecho de que un órgano sea capaz de sintetizar AIA a partir de triptófano sólo nos dice que ese sistema dispone de la maquinaria necesaria para realizarlas en las condiciones del experimento. Mediante distintas líneas de evidencia se ha podido llegar a sugerir cuáles son los órganos o tejidos más probables en llevar a cabo la síntesis de AIA en la planta. Sin duda, en el ápice del coleóptilo de las gramíneas se sintetiza AIA. Como ya hemos visto, el máximo contenido de esta hormona se localiza en el ápice y puede establecerse un gradiente hacia la base. Se han hecho objeciones a esta hipótesis, como que la auxina que hay en el ápice no se sintetiza in situ, sino que procede de las semillas y es transportada al ápice a donde se desplaza por el xilema. Esto se apoya en que en líquidos de gutación de coleóptilos decapitados se detecta AIA. Sin embargo, la capacidad de los coleóptilos para convertir C-triptofano en AIA hace pensar que los coleóptilos son capaces de sintetizar su propia auxina. En tallos de diferentes especies se ha encontrado AIA, así como en cambium, xilema y floema de Acer, Fraxinus y Populus. Se piensa que el AIA del tallo está en tránsito procedente de otros lugares de síntesis, aunque algo puede sintetizarse in situ y, probablemente, esta capacidad será mayor en tallos jóvenes. La producción de auxina se sugiere que puede estar ligada al cambium de tal forma que la autólisis del contenido celular de células de xilema en diferenciación libera triptófano que es convertido en AIA. En hojas se ha encontrado AIA y parece que su contenido decrece con la edad, aunque puede haber un nuevo aumento en tejido senescente, probablemente a causa del aumento de triptófano como consecuencia de la proteolisis. Si se añade C-triptófano a hojas, éstas son capaces de transformarlo en AIA, aunque sean más eficientes las hojas más jóvenes. Hay que considerar la posibilidad de que los elevados niveles de AIA que se miden en tejidos jóvenes pueden ser consecuencia de la presencia de sustancias protectoras que eviten su oxidación, y no de una elevada actividad biosintética. Las semillas en desarrollo son un importante centro de producción de AIA, como se ha demostrado en semillas de maíz, que alcanzan su máximo cuando aún están como leche y, al madurar, el AIA forma ésteres con el mio-inositol. En óvulos de algodón también se han medido cantidades elevadas de AIA. En frutos, el contenido en AIA aumenta tras la polinización alcanzándose un máximo; así, en fresas se pasa de 3.6 mg de AIA a 127 mg de AIA por frutos a los 12 días de la polinización e iguales máximos se encuentran en manzanas, uvas, tomates y otros. En raíces se ha detectado AIA, aunque más bien parece que procede de las partes aéreas. Se ha visto que en raíces de maíz, hay más en la estela que en el córtex y más contenido aún en la cofia. Se puede concluir que los lugares más importantes de síntesis de auxina son: las hojas jóvenes en expansión, el tejido cambial, los ovarios inmaduros y semillas en desarrollo. Sin embargo, otros tejidos también tienen la capacidad de sintetizar AIA (hojas maduras, tallos y raíces). Se ha propuesto una hipótesis basada en que los lugares de síntesis activa de auxina están asociados con la muerte de las células, ya sea durante la diferenciación vascular, la digestión del endospermo o la senescencia de las hojas. Según esto, el triptófano es el factor limitante para la síntesis de auxinas y el nivel del triptófano en células vivas es normalmente demasiado bajo para que haya síntesis. Al morir la célula se libera triptófano mediante autólisis de las proteínas, lo que hace que aumente la concentración de triptófano y pueda llevarse a cabo la síntesis de AIA. 5. TRANSPORTE DE LAS AUXINAS Una hormona se caracteriza por moverse en el organismos vegetal desde un punto de síntesis hasta su lugar de acción. A pesar de algunas objeciones, está claro que existe un movimiento de las auxinas a través del organismo; este desplazamiento de un lugar a otro se denomina transporte de la auxina, aunque los mecanismos que participan en este proceso no sean totalmente conocidos. El transporte de auxinas ha sido medido y estudiado en diferentes tipos de tejidos y de estos estudios ha podido llegarse a la conclusión de que la velocidad de transporte es: a) Independiente de la longitud del tejido. b) Independiente de la concentración de auxina en el bloque donador, lo que a su vez nos indica que no se trata de un proceso de difusión. c) Varía con la edad y tipo de tejidos, es mayor en coleóptilos de maíz a 25°C (15 mm x h-1) que en raíces (5 mm x h-1). En coleóptilos varía del ápice (parte joven) a la base (parte vieja). d) También está influido por la temperatura; así, el AIA en segmentos de raíces se desplaza con una velocidad de 0.2 mm x h-1 a 1°C y de 8 mm x h-1 a 31°C. La peculiaridad más notable del transporte auxínico es que se realiza de forma polar, es decir, en un segmento de tallo irá siempre en dirección basipétala, en un segmento de raíz irá en dirección aceopétala (se desplazaría hacia el ápice de la raíz). La polaridad del transporte de auxina fue puesta de manifiesto por Went en coleóptilos de avena. Posteriormente se demostró en otros tejidos, tanto de tallos como de raíces. En plantas intactas, la dirección del movimiento depende de la zona de aplicación de la hormona, y se desplaza desde el lugar de aplicación (fuente) hasta el lugar de consumo (sumidero). Así, si se aplica una auxina en hojas adultas, irá a donde vayan los productos de la fotosíntesis que esa hoja exporta a través del floema. Existe trabajos que apoyan la presencia de auxinas en la corriente transpiratorias del xilema. 6. CATABOLISMO AUXINICO La concentración de auxina en las plantas puede regularse no sólo por su tasa de síntesis y la velocidad de transporte hacia y desde el órgano que se considere, sino por los mecanismos de inactivación; de hecho, está claramente demostrado que el AIA es inactivado fácilmente por casi todos los tejidos vegetales. A veces la inactivación del AIA puede lograrse mediante conjugación del AIA con otras moléculas como azúcares o aminoácidos. Se ha detectado en plantas el ácido indol-3-acetil L-aspértico. En ciertos casos cuando se aplica AIA exógeno se detecta indol-3-acetil glucosa. El catabolismo del AIA puede realizarse mediante dos vías: la oxidación descarboxilativa de la cadena lateral y la oxidación en las posiciones 2 y 3 del anillo indólico sin descarboxilación. 7. RECEPTORES DE LAS AUXINAS Las plantas aunque carecen de sistema nervioso, poseen, al igual que los animales, un sistema hormonal de comunicación a larga distancia mediante el cual las células diana traducen la señal hormonal en una respuesta específica. Aunque se desconoce cuáles son los mecanismos que regulan esta transmisión se piensa que pueden parecerse a los que funcionan en los animales. El hecho de que tenga que existir una separación de cargas tan precisa para que haya actividad auxínica, el que, 2,4-D sea una auxina fuerte y su isómero 2,6-D (2,6dicloro fenoxiacético) sea casi inactivo, o las diferencias de actividad entre los isómeros ópticos, ha llevado a la búsqueda de receptores específicos de auxinas en la célula vegetal tan precisos que sólo cabe pensar en una proteína. El problema está en la localización subcelular de esos receptores. Estos receptores son proteínas que se unen de forma específica y reversible a la señal química; tras realizarse la unión experimentan un cambio conformacional, pasando de una forma inactiva a una forma activa, poniendo en marcha un programa molecular que conduce a la respuesta característica. Tras ensayar diversos sustituyentes y estudiar su comportamiento como auxinas, se llegó a la conclusión de que, para que existiera actividad, era necesaria la presencia de una carga fraccional positiva en el anillo, situada a una distancia de 0.50 nm de la carga negativa del grupo carboxilo. Esta distancia entre la carga positiva y negativa se da siempre entre los compuestos con actividad auxínica, sean indólicos, fenoxiacéticos, benzoicos o picolínicos, incluso en la auxina sin anillo carboximetildimentil-ditiocarbamato puede adoptar una configuración plana que recuerda a un anillo y en esta situación el átomo de N toma una ligera carga positiva situada a 0.50 nm del grupo carboxilo. Cabe pensar que, merced a esta configuración, las auxinas se unirán al receptor que presente una distribución de cargas situadas a la misma distancia. 8. RECEPTORES DE LAS AUXINAS Las plantas, aunque carecen de sistema nervioso, poseen, al igual que los animales, un sistema hormonal de comunicación a larga distancia mediante el cual las células diana traducen la señal hormonal en una respuesta específica. Aunque se desconoce cuáles son los mecanismos que regulan esta transmisión se piensa que pueden parecerse a los que funcionan en los animales. Estos receptores son proteínas que se unen de forma específica y reversible a la señal química; tras realizarse la unión experimentan un cambio conformacional, pasando de una forma inactiva a una forma activa, poniendo en marcha un programa molecular que conduce a la respuesta característica. La búsqueda de receptores para auxinas en plantas se ha basado en el estudio de dos respuestas características: la proliferación de callos e inducción de raíces o tallos regulado por el balance auxinas/citoquininas y la elongación del coleóptilo o secciones de tallo. En callos desarrollados a partir de médula de tabaco se encontró que existían tres clases de proteínas que actuaban como receptores, perfectamente distinguibles por su capacidad de ligamiento y su localización. Dos de estas proteínas estaban ligadas a membranas y localizadas en el plasmalema, una de ellas presenta a pH 4 elevada afinidad con el ácido naftilftalámico (NPA), un potente inhibidor sintético del transporte de AIA: ligaría el AIA en la zona del plasmalema que limita con el citoplasma y lo transportaría a través de la membrana al apoplasto. La otra proteína tiene una afinidad mayor por el AIA 10-7 M a pH 5 y no liga NPA, se localiza en la parte exterior de la membrana plasmática, dada la elevada concentración de auxinas necesaria para la inducción de raíces en el callo de médula de tabaco y la baja afinidad de esta proteína por las auxinas naturales podría estar implicada en el proceso de regeneración radicular. En fracciones solubilizadas de tejidos homogeneizados se localiza una tercera proteína citoplásmica/nuclear a muy baja concentración, con elevada afinidad por el AIA 2.5 nM a pH 7.5, superior a la de las proteínas de membrana, la existencia de esta proteína hace pensar que jugaría un papel análogo al que explica el mecanismo de acción de las hormonas esteroides en células animales: la auxina controlaría directamente la actividad transcripcional en el núcleo al acoplarse con el receptor citoplásmico/nuclear. En coleóptilos de maíz se han buscado receptores que ayudarán a explicar la respuesta más característica de las auxinas, es decir, la elongación celular, llegándose a la evidencia de que existen tres fracciones membranosas con capacidad de ligar auxinas. Estas fracciones son el retículo endoplásmico, el tonoplasma y la membrana plasmática. Para el receptor del retículo endoplásmico la constante de afinidad frente a ANA es 0.50.7 µM y la afinidad del receptor frente a varias auxinas y compuestos relacionados guarda bastante paralelismo con la actividad promotora del crecimiento de los mismos. A pesar de que en los coleóptilos de maíz el retículo endoplásmico es el receptor mayoritario en el control de la acción de la auxina sobre el crecimiento, en el caso de células de callo de médula de tabaco ya hemos visto que no se localiza ningún receptor en RE, por tanto no puede generalizarse que éste receptor localizado en el RE sea el punto central para la acción de las auxinas. 9. MECANISMO DE ACCION Cuando un tejido le suministramos auxina algunas respuestas se observan en periodos de tiempo que pudiéramos denominar cortos, inferiores a 15 minutos y, para poder observar otros, hay que dejar que transcurran periodos de tiempo más largos. Se suponían que las primeras ocurrían antes de que fuera posible una activación genética primaria por efecto de la auxina, en los segundos cabía la activación genética; sin embargo, veremos que estas premisas están sometidas a amplia discusión. Cuando se aplica auxina a un tejido con capacidad de respuesta de crecimiento hay un periodo de latencia de duración variable antes de que aumente la tasa de crecimiento. Tras ese periodo, que casi nunca es inferior a 8 minutos, la tasa de crecimiento aumenta rápidamente durante 30-60 minutos hasta alcanzar el máximo; posteriormente, la tasa de crecimiento puede hacerse estable, alcanzar un segundo máximo o incluso disminuir. El periodo de latencia varía de unos tejidos a otros, aumenta al disminuir la concentración de auxina aplicada o se alarga al disminuir la temperatura, pero no puede eliminarse el periodo de latencia ni con temperatura elevada, ni con alta concentración de auxina ni eliminando la cutícula que rodea al tejido. El retraso no se puede relacionar por tanto con el tiempo que tarda en penetrar la auxina. 9.1 Efecto Sobre los Acidos Nucleicos y Proteínas Para mantener un crecimiento continuado es necesaria la síntesis de RNA y proteínas, pero además está demostrado que las auxinas pueden estimular la síntesis de proteínas y RNA en tejidos en crecimiento. Las auxinas favorecen la síntesis de algunos polipéptidos mientras que reprime la de otros. Se ha visto que hay cambios en los productos de traducción que pueden ocurrir rápidamente tras la aplicación de auxina. Las auxinas pueden modular rápidamente los niveles de m-RNA en diferentes órganos de diversas especies. El aumento de m-RNA puede ser debido a una mayor tasa de transcripción como consecuencia de la aplicación de auxina. Así, se ha demostrado que a los 5 minutos se obtenían valores apreciables y a los 15 minutos de aplicar auxina se obtenían valores de transcripción del 50 por 100 del máximo. Estos y otros experimentos indican que el aumento de m-RNA está controlado, en parte a nivel de transcripción. La rapidez de la inducción de la transcripción (5-15 min), el hecho de que solamente algunos c-DNA son afectados por la auxina y que esta transcripción se efectúe sin depender de la síntesis de proteínas, sugiere que la transcripción puede ser una respuesta muy próxima al mecanismo de acción primario de las auxinas. 9.2 El Efecto Acido de Crecimiento Un posible receptor de auximas estaría situado en el plasmalema. Se ha propuesto por Morré y colaboradores que las membranas plasmáticas de células de soja contienen un factor regulador que es liberado específicamente por las auxinas y que estimula la actividad RNA-polimerasa. Esta interacción auxina/plasmalema podría transmitirse al núcleo al libera un receptor que interacciona con una RNA polimerasa específica. Como consecuencia, se alteraría la transcripción de DNA y se producirían cambios cualitativos y cuantitativos en la síntesis de RNA. Podría darse un paso más y suponer que la interacción de la axina con el receptor libera H+ del plasmalema en la pared celular y, como consecuencia del descenso del pH, se produce la relajación de la pared. El retículo endoplasmático (RE) en células de coleóptilo de maíz ha sido citado como lugar de localización de un receptor muy afín para la auxina; según esto, Ray propone un modelo para explicar la acción de la auxina en el que la acción primaria se ejercería en el retículo endoplasmático: al combinarse la auxina con el receptor se induce el transporte de H+ desde el citoplasma a los espacios interiores de las cisternas del RE. Una vez en el interior de las cisternas, los H+ serían transportados junto con las proteínas excretadas por el RE, probablemente mediante el aparato de Golgi. La relación entre los efectos rápidos que causa la auxina y aquellos que se realizan a más largo plazo puede explicarse a través de una estimulación de la síntesis de proteínas como consecuencia de una mayor secreción de éstas al lumen del RE y cuyo transporte estaría acoplado a la secreción de H+ a través de las mismas membranas; aunque esta interpretación se vería complicada con la extrusión simultánea de Ca, regulada por la auxina. 10. EFECTO DE ESTIMULOS AMBIENTALES Y HORMONALES SOBRE EL NIVEL DE AUXINAS Tanto la luz como la gravedad tienen un fuerte efecto sobre el transporte lateral del AIA y, por tanto, sobre la distribución de las auxinas en la planta. Otros factores ambientales, como la temperatura y la sequía, pueden influir notablemente sobre los niveles de auxina. Así, por ejemplo, si sometemos una planta de trigo de invierno a temperaturas bajas durante 40 días, el contenido de AIA-oxidasa se hace 10 veces mayor; como consecuencia, el nivel de AIA será bajo, aunque no se han realizado medidas directas. La carencia de agua parece disminuir el contenido de AIA, pues, cuando a las plantas de trigo sometidos a sequía se les pulveriza AIA, el crecimiento se acelera considerablemente. También parece que la sequía inhibe el trasporte polar de AIA (2-14C). La influencia que ejercen las hormonas sobre las auxinas puede ser porque actúan sobre su transporte, síntesis, conjugación y oxidación de las mismas. Por ejemplo, la aplicación de AIA exógeno parece que actúa mediante un retrocontrol a través de la síntesis, conjugación u oxidación, regulando la acción de enzimas implicadas en cada uno de estos procesos. La aplicación de giberelinas acarrea un aumento en el contenido de auxinas, como se ha demostrado en gran número de especies. El mecanismo mediante el cual se consigue tal efecto nos es desconocido. Con un efecto estimulante sobre el contenido auxínico actúan también las citoquininas, probablemente no por atraer auxinas desde otros lugares de la planta a la zona de aplicación de la citoquinina sino por estimular su síntesis. Los callos pueden sintetizar su propio AIA. El etileno actúa reduciendo los niveles de auxina en varias plantas, aunque se piensa que podría ser a través de la activación de AIA-oxidasa no hay pruebas suficientes en este sentido. 11. AUXINAS SINTETICAS Tras el descubrimiento del AIA, se pensó que, si una estructura tan simple era capaz de producir respuestas tan notables sobre el crecimiento, tendría que haber más compuestos con propiedades análogas; muchos investigadores comenzaron a ensayar diferentes moléculas para ver si tenían las propiedades descritas para el AIA, y así, pronto se descubrió que también era capaz de favorecer el crecimiento de las células el ácido indenoacético, el ácido 2-benzofuranacético, el ácido 3-benzofuranacético, el ácido naftalenacético y una serie de compuestos. Posteriormente, se vio que otros compuestos que poseían anillo indólico también resultaban activos, como el ácido 3-indolpirúvico, y el ácido indolbutírico derivados del naftaleno como el ácido naftil-1-acético y el ácido naftoxi-2-acético. Por último, el hecho de que algunos ácidos fenoxiacéticos tenían actividad auxínica llevó al descubrimiento del 2,4-diclorofenoxiacético (2,4-D) con una gran actividad. A partir de aquí se desarrolló una amplia gama de moléculas con actividad auxínica, como el ácido 2-metil, 4-cloro fenoxiacético (MCPA) y el ácido 2,4,5-triclorofenoxiacético (2,4,5-T), ambos con propiedades herbicidas cuando se emplean a concentraciones elevadas y utilizados como armas químicas en la guerra de Vietnam. 12. FUNCIONES DE LA AUXINA Aunque en el estudio de cada uno de los procesos fisiológicos que iremos abordando en los siguientes capítulos se hará especial mención al papel que juegan las auxinas y, naturalmente, las restantes sustancias reguladoras, vamos a hacer un pequeño resumen a título de anticipo del papel que estas sustancias juegan a lo largo de la vida de la planta en los distintos procesos por los que atraviesa. En algunos tejidos las auxinas controlan la división celular, como sucede en el cambium. Si a tallos decapitados de Coleus se les aplica AIA, el número de elementos de xilema que se forman es proporcional a la cantidad de AIA aplicado. El desarrollo de las técnicas de cultivo de tejidos fue posible gracias a la acción de las auxinas sobre la división celular. Asi, un trozo de zanahoria colocado en un medio de cultivo sin auxinas sufre una cuantas divisiones y se muere, pero si se añade AIA a una concentración de 10-6M se dividen las células de forma rápida y puede durar muchos años. En otros casos, es necesaria la presencia de otras hormonas para garantizar una división celular continuada. Sin embargo, conviene llamar aquí la atención sobre los cultivos de tejidos adaptados; son aquellos cultivos que, tras varias transferencias en un medio con auxinas, se hacen frágiles y semitransparentes a la vez que son capaces de sintetizar su propia auxina. El proceso de rizogenésis está íntimamente ligado con la división celular, siendo práctica normal en horticultura y, sobre todo, en los viveros, aplicar auxinas a los esquejes para favorecer el enraizamiento. Hay otros muchos procesos de correlación, como la dominancia apical o procesos de abscisión en que también las auxinas juegan un papel importante. 12.1 Las Auxinas y la Expresión Génica Una vez que se ha producido la unión de la auxina, bien sea un solo factor de unión o bien a varios, la percepción por la célula de esta unión debe traducirse en una respuesta. Varios laboratorios han abordado este problema mediante el estudio del efecto de las auxinas sobre la expresión génica (Theologis, 1986). La utilidad del enfoque es doble: 1. La comprensión de la función de los genes específicamente activados por las auxinas podría llevar a un conocimiento directo de los mecanismos de respuesta hormonal. Las auxinas inducen un grupo específico de mRNAs. En la soja, el tratamiento con auxinas activa un grupo de genes que codifica para varios polipéptidos de pequeño tamaño (8-10 kDa) en 2-5 minutos. Estos pequeños mRNAs inducidos por las auxinas (small auxin upregulated mRNAs SAUR), también se expresan a los pocos minutos de haberse producido el estímulo geotrópico (Guilfoyle y cols., 1992). Otros mRNAs también se activan además por calor (heat shock) y metales pesados y pueden estar implicados en aspectos más generales de la activación metabólica. 2. Mediante el estudio de los promotores de los genes activados por las auxinas podría llegarse a comprender cuáles son las primeras etapas del mecanismos de acción de las auxinas. Aunque este enfoque es potencialmente muy interesante, debe señalarse que hasta la fecha ninguno de los genes conocidos, cuya expresión se activa por las auxinas, se ha relacionado con los efectos fisiológicos específicos de estas hormonas y, en general, en la mayor parte de los casos se desconocen sus funciones bioquímicas. CONTENIDO 1. VALORACION DE AUXINAS 2. LOCALIZACION DE LA AUXINA 3. CURVA OPTIMA 4. BIOSINTESIS DE LA AUXINA 5. TRANSPORTE DE LAS AUXINAS 6. CATABOLISMO AUXINICO 7. RECEPTORES DE LAS AUXINAS 8. RECEPTORES DE LAS AUXINAS 9. MECANISMOS DE ACCION 10. 9.1 Efecto Sobre los Acidos Nucleicos y Proteínas 9.2 El Efecto Acido de Crecimiento EFECTO DE ESTIMULOS AMBIENTALES Y HORMONALES SOBRE EL NIVEL DE AUXINAS 11. AUXINAS SINTETICAS 12. FUNCIONES DE LA AUXINA 12.1 Las Auxinas y la Expresión Génica