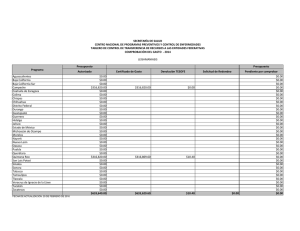
DIAZ CARDENAS ANGELA MARIA.pdf
Anuncio

UNIVERSIDAD DE GUAYAQUIL FACULTAD PILOTO DE ODONTOLOGÍA ESCUELA DE POSTGRADO “DR. JOSÉ APOLO PINEDA” “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DEL MSP DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” TESIS PRESENTADA COMO REQUISITO PARA OPTAR POR EL GRADO DE MAGÍSTER EN EPIDEMIOLOGÍA MAESTRANTE DRA. ANGELA MARIA DÍAZ CÁRDENAS TUTOR DR. MARIO PAREDES CRUZ, M.Sc. GUAYAQUIL – ECUADOR 2014 UNIVERSIDAD DE GUAYAQUIL FACULTAD PILOTO DE ODONTOLOGÍA ESCUELA DE POSTGRADO “DR. JOSÉ APOLO PINEDA” “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DEL MSP DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” TESIS PRESENTADA COMO REQUISITO PARA OPTAR POR EL GRADO DE MAGÍSTER EN EPIDEMIOLOGÍA MAESTRANTE DRA. ANGELA MARIA DÍAZ CÁRDENAS TUTOR DR. MARIO PAREDES CRUZ, MSc. GUAYAQUIL – ECUADOR 2014 UNIVERSIDAD DE GUAYAQUIL FACULTAD PILOTO DE ODONTOLOGÍA ESCUELA DE POSTGRADO “DR. JOSÉ APOLO PINEDA” Esta Tesis cuya autoría corresponde a la DRA. ANGELA MARIA DÍAZ CÁRDENAS ha sido aprobada, luego de su defensa pública, en la forma presente por el Tribunal Examinador de Grado nominado por la Universidad de Guayaquil, como requisito parcial para optar por el Grado de MAGÍSTER EN EPIDEMIOLOGIA. _______________________ Dr. Washington Escudero Doltz PRESIDENTE DEL TRIBUNAL _______________________ Dra. Elisa Llanos Rodríguez M.Sc. MIEMBRO DEL TRIBUNAL _______________________ Dr. Enrique Vélez Celaa M.Sc. MIEMBRO DEL TRIBUNAL _______________________ Ab. Mercedes Morales López SECRETARIA FACULTAD PILOTO DE ODONTOLOGÍA CERTIFICADO DE ACEPTACIÓN DEL TUTOR Certifico: Que he analizado el Trabajo de Tesis presentado como requisito previo a la aprobación para optar por el Título de MAGÍSTER EN EPIDEMIOLOGIA. El problema de investigación se refiere a: “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DEL MSP DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” Presentado por la Maestrante Dra. Angela María Cárdenas con C.I. # 0905315420. ____________________________ Dr. Mario Paredes Cruz, M.Sc. TUTOR Díaz CERTIFICADO DEL GRAMÁTICO LCDA. TERESA CONTRERAS DE ORTIZ, con domicilio ubicado en Av. Vicente Trujillo y Dolores Sucre; por medio del presente tengo a bien CERTIFICAR: Que he revisado la tesis de grado elaborada por la Dra. Angela María Díaz Cárdenas con C.I. 0905315420 previo a la obtención del título de MAGÍSTER EN EPIDEMIOLOGIA. Tema de Tesis: “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DEL MSP DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” La tesis revisada ha sido escrita de acuerdo a las normas gramaticales y de sintaxis vigentes de la lengua española. ____________________________ Lcda. Teresa Contreras de Ortiz C.I.1200559233 REG. 1006-06-696258 TELEF. 0984968172 DEDICATORIA Este trabajo lo dedico a Dios, por haberme brindado la salud, vida, sabiduría y entendimiento para que alcanzara a llegar hasta este momento muy importante de mi profesión. A mi progenitora Blanca Leonor, que me enseño a ser una mujer luchadora e inculcarme la superación constante. A José Vicente, mi hijo por su cariño y apoyo, a pesar de la distancia física, por compartir momentos significativos y estar dispuesto a ayudarme en todo momento, sin importar nuestras diferencias de opiniones. AGRADECIMIENTO Deseo expresar de todo corazón mi imperecedero agradecimiento al personal Docente y Administrativo de la Maestría en Epidemiología de la Universidad de Guayaquil, Facultad Piloto de Odontología, Escuela de Postgrado “Dr. José Apolo Pineda”, que nos transmitieron sus conocimientos y aportes valiosos que se plasman en este trabajo de investigación. Al Dr. Mario Paredes, por su amistad y haber dirigido para llegar a feliz término este trabajo de tesis, indicándome correctamente sus sugerencias. A la Dirección Provincial de Salud de Santo Domingo de los Tsáchilas que facilitaron los medios y por su colaboración, de manera incondicional, en las diferentes etapas para la realización de la investigación. Quiero también exponer, mi agradecimiento a mis compañeros, amigas/os y a todas las personas que de una u otra manera me han acompañado en esta jornada, brindándome su apoyo para que se lleve efecto y se culmine con éxito. A mi Dios, Padre Todopoderoso, que no por ser mencionado al final, no haya sido el pilar fundamental que me ha dado la fortaleza para continuar con mis sueños y poder realizarlos. . INDICE GENERAL PAG. 1. INTRODUCCIÓN 1.1. Objetivos 1.1.1. Objetivo general 1.1.2. Objetivos específicos 1.2. Hipótesis 1.3. Variables 1.3.1. Operacionalización de las variables 2. MARCO TEÓRICO 3. MATERIALES Y MÉTODOS 3.1. Materiales 3.1.1 Lugar de la Investigación 3.1.2 Caracterización de la zona de trabajo 3.1.3 Periodo de la Investigación 3.1.4 Recursos empleados 3.1.4.1 Humanos 3.1.4.2 Físicos 3.1.5 Universo y muestra 3.1.6 Criterios de inclusión y exclusión 3.2 Método 3.2.1 Tipo de Investigación 3.2.2 Diseño de la Investigación 3.2.3 Procedimientos de la Investigación 3.2.4 Análisis de los Información 1 4 4 5 5 5 6 8 35 35 35 35 36 36 36 36 37 37 37 38 38 38 4. RESULTADOS Y DISCUSIÓN 4.1 Prevalencia de Leishmaniasis. 40 40 4.2 Relación de casos de Leishmaniasis con factores de riesgo 42 4.3 Plan de Acción en medidas de prevención contra la Leishmaniasis 58 INDICE GENERAL PAG. 5. CONCLUSIONES Y RECOMENDACIONES 5.1 Conclusiones 5.2. Recomendaciones 64 64 65 6. BIBLIOGRAFÍA 66 7. ANEXOS 73 REPOSITORIO NACIONAL EN CIENCIA Y TECNOLOGÍA FICHA DE REGISTRO DE TESIS TÍTULO Y SUBTÍTULO: “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DEL MSP DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” AUTOR/ES: Dra. Ángela Díaz TUTOR: Dr. Mario Paredes Cruz, M.SC. Cárdenas REVISORES: Dr. Mario Paredes Cruz, M.SC. INSTITUCIÓN: Facultad: Piloto de Odontología, Escuela de Universidad de Guayaquil Postgrado “Dr. José Apolo Pineda” CARRERA: Maestría en Epidemiología FECHA DE PUBLICACIÓN: No. DE PÁGS: 76 16 de Mayo del 2014 TÍTULO OBTENIDO: Máster en Epidemiología ÁREAS TEMÁTICAS: Salud Pública, Epidemiología, Medicina Tropical, Infectología PALABRAS CLAVE: Leishmania, leishmaniasis cutánea, leishmaniasis mucosa, prevalencia, zoonosis, factores de riesgo, endémica RESUMEN: Se realizó un estudio observacional de tipo descriptivo, su objetivo fue una determinación de Leishmaniasis en pacientes atendidos en las Unidades de Salud del Ministerio de Salud Pública en la Provincia de Santo Domingo de los Tsáchilas, desde el año 2009 – 2011. La prevalencia de Leishmaniasis es de aproximadamente del 4%, que no es significativo de acuerdo a la hipótesis en esta investigación No. DE REGISTRO (en base de No. DE CLASIFICACIÓN: datos): DIRECCIÓN URL (tesis en la web): ADJUNTO PDF: x SI NO x CONTACTO CON Teléfono: E-mail: X AUTOR/ES 0994384619 [email protected] x CONTACTO EN LA INSTITUCIÓN: Nombre: * Teléfono: * E-mail: * Quito: Av. Whymper E7-37 y Alpallana, edifcio Delfos, teléfonos (593-2) 2505660/1; y en la Av. 9 de octubre 624 y Carrión, edificio Promete, teléfonos 569898/9. Fax: (593 2) 2509054 RESUMEN En el Ecuador no se registra una prevalencia de Leishmaniasis, esta enfermedad constituye uno de los eventos infecciosos más importantes, en el que no existe control adecuado según la OMS. Esta enfermedad es debida a factores económicos, sociales y culturales, con poblaciones asentadas en zonas rurales, que están en riesgo a contraer la enfermedad. Su objetivo fue una determinación de Leishmaniasis en pacientes atendidos en las Unidades de Salud del Ministerio de Salud Pública en la Provincia de Santo Domingo de los Tsáchilas, desde el año 2009 – 2011, realizando un estudio observacional de tipo descriptivo. De las 3803 atenciones realizadas en el período 2009 -2011 con problemas de tipo dérmico se determinaron con diagnóstico positivo para Leishmania el 3,8%; determinando que hubo una diferencia ligeramente significativa en cuanto en el sexo masculino, que quizás sea por el tipo de ocupación propia en la zona. El grupo etario mayormente afectado fue de 15 a 44 años con el 40,25%, seguido del grupo de 5 a 14 años con el 23,27% pero se presenta en toda edad. La presentación en el tiempo se observó que hacia finales e inicio del siguiente año es el período de mayor contagio, el mismo que concuerda con el inicio de la época invernal donde las condiciones ambientales favorecen la transmisión. El sitio de mayor procedencia fue Alluriquin con 17,30%. Según ocupación, mayormente fueron en los estudiantes, agricultor, QQDD, Jornalero, que coincide con las personas que están en un ambiente familiar y junto a la naturaleza. El sitio mayor de las lesiones fue las extremidades con 65,72%, seguido de la cabeza, que son áreas del cuerpo expuestas. La prevalencia de Leishmaniasis es de aproximadamente del 4%, que no es significativo de acuerdo a la hipótesis en esta investigación. La prevención y control disponibles en la actualidad son limitadas, por lo que es trascendental que las personas que están expuestas en especial de las áreas rurales estén involucradas en la realización de acciones para reducir el contacto entre el humano y el vector. PALABRAS CLAVE: LEISHMANIA, LEISHMANIASIS CUTÁNEA, LEISHMANIASIS MUCOSA, PREVALENCIA, ZOONOSIS, FACTORES DE RIESGO, ENDÉMICA. SUMMARY In Ecuador there is no prevalence recorded for the Leishmaniasis, this disease is one of the most important infectious events in which there is no adequate control according to OMS. This disease is due to economic, social and cultural factors, with populations in rural areas, who are at risk of contracting the disease. Its objective was a determination of Leishmaniasis in patients treated at the Health Units of the Ministry of Health in the province of Santo Domingo de los Tsáchilas was made, since 2009 until 2011, with an observational descriptive study. For the 3803 patients attended in the period 2009 -2011 with dermal type problems, 3.8% were determined positive for Leishmania diagnosis, where a marginally significant difference was found in male, this is perhaps for the type of occupation in the area. The most affected age group was 15 to 44 years with 40.25%, followed by the group of 5 to 14 years with 23.27% but it occurs in all ages. The presentation time was observed towards the end and beginning of the next year, which is the most contagious period, consistent with the onset of the winter where environmental conditions favor transmission. The site of more origin was Alluriquin with 17.30%. According occupation were mostly students, farmers, QQDD, Journeyman, which matches people who are in a familiar environment and with nature. The largest site was extremity injuries with 65.72%, followed by the head, which are areas of the body exposed. The prevalence of Leishmaniasis is approximately 4%, which is not significant according to the assumption in this investigation. The prevention and control available today are limited, so it is vital that people who are exposed especially in rural areas are involved in the implementation of measures to reduce contact between human and vector. KEYWORDS: LEISHMANIA, LEISHMANIASIS SKIN, LEISHMANIASIS MUCOSAL, PREVALENCE, ZOONOSIS, RISK FACTORS, ENDEMIC. 1. INTRODUCCIÓN Las Leishmaniasis son un grupo de enfermedades parasitarias zoonóticas, que constituyen un importante problema de salud pública en todo el mundo, debido a su magnitud e impacto negativo a nivel psicológico, socio-cultural, económico en la población al igual que otras enfermedades transmisibles como Lepra, Paracoccidiomicosis, Cromomicosis, Tuberculosis cutánea, entre otras. (22, 40, 27) Es causada por un protozoario hemoflagelado del género Leishmania; el parásito se multiplica en algunos vertebrados que actúan como reservorios, es transmitida a los seres humanos mediante la picadura de flebótomos o Lutzomyias, conocido comúnmente como “Manta Blanca” y que previamente de un reservorio infectado se ha alimentado. La Leishmaniasis es una enfermedad endémica tan antigua como el hombre, en donde existen esculturas cerámicas en el viejo y en el nuevo mundo (periodo prehispánico) que demuestran la presencia de esta enfermedad. (10, 11, 40) El incremento de la incidencia ha llevado a que la clasifique la Organización Mundial de la Salud (OMS) como una de las grandes endemias, actualmente en la categoría 1, y es considerada una de las 5 enfermedades infecciosas más importantes, para la cual no existe control adecuado. (8, 23, 53) La Leishmaniasis es una enfermedad de prevalencia alta en muchas regiones tropicales y subtropicales del mundo, tales como el este y sureste de Asia, Oriente Medio, norte y este de África, el sur de Europa (cuenca del Mediterráneo) y en las Américas se extiende desde el sur de Estados Unidos (Texas) hasta el norte de Argentina. La distribución geográfica de la Leishmaniasis está limitada por la distribución del vector, la presencia de diversos reservorios El número se debe principalmente a los cambios del 1 medio ambiente generados por el hombre, lo que aumenta la exposición humana al vector. (8, 24, 51) En los últimos años, se viene considerando a la Leishmaniasis como una enfermedad emergente y re-emergente junto con otras también transmitidas por artrópodos. (7, 22, 40) Las Leishmaniasis se presentan con un amplio espectro de manifestaciones clínicas en el hombre. Las manifestaciones clínicas de la enfermedad pueden abarcar un amplio abanico de signos, que van desde las formas inaparentes (cutáneas y mucocutáneas) en personas inmunocompetentes hasta las formas muy graves (viscerales) que pueden tener un curso fatal si no se tratan. (22, 11) La Organización Mundial de la Salud (OMS) reporta que la Leishmaniasis está presente al menos en 88 países a nivel mundial de los cuales 72 se encuentran en vías de desarrollo (24 países del continente americano). La Organización Mundial de la Salud considera que son endémicas en 88 países de las regiones tropicales y subtropicales, 72 en desarrollo y 16 desarrollados. (10, 38, 40) Se estima que anualmente dos millones de personas son afectadas y de estas, la cuarta parte son casos de Leishmaniasis visceral. (55) Las manifestaciones clínicas de la enfermedad pueden abarcar un amplio abanico de signos, que van desde las formas inaparentes en personas inmunocompetentes hasta las formas muy graves que pueden tener un curso fatal si no se tratan. Las repercusiones sociales ocasionan impacto negativo por las secuelas que produce deformantes e irreversibles. (38) Entre los factores de riesgo se tienen la pobreza, producto de las políticas económicas que predispone a la población a la migración e invasión sobre todo de bosques y urbanización sin ningún tipo 2 de infraestructura sanitaria a lo que se suma el limitado acceso a los servicios de salud, por lo puede considerársela como una enfermedad ocupacional, debido a que está directamente relacionada con actividades laborales en zonas donde esta enfermedad es endémica en plantaciones de clima tropical, subtropical y valles Andinos. Las viviendas rústicas y los bajos niveles de higiene aumentan los riesgos de transmisión domiciliaria y peri domiciliaria, debido a que la vivienda está rodeada de vegetación, asociada a un mayor riesgo de transmisión de la enfermedad, porque permite que el vector ingrese fácilmente a los hogares. (6) La Leishmaniasis tiene alta vulnerabilidad, la transmisión del parasito puede ser influenciada por los cambios de clima, lo que se acentuara más a medida que evidencien incrementos en la humedad y temperatura. (4) El Ministerio de Salud Pública (MSP) a través del Proceso Control y Mejoramiento de la Salud Pública, mediante el Subproceso de Epidemiologia es el encargado de realizar el control de la Leishmaniasis, en coordinación con el Servicio Nacional de Control de Enfermedades transmitidas por vectores Artrópodos (SNEM), llevando el registro de todos los casos que se diagnostican en todas las dependencias del MSP, los cuales en coordinación además realiza el control y distribución de los insumos y la organización del sistema de diagnóstico y tratamiento de los casos. El número de casos de Leishmaniasis ha aumentado en forma notable en los últimos años. Así, esta patología está entre las principales enfermedades de notificación obligatoria, el número de casos reportados en el Ecuador para el año 2007 fue de 1185 casos, en el año 2008 con esta patología 1.479 casos en el sistema de notificación de enfermedades de vigilancia epidemiológica EPI 2. (21) En el Ecuador, se reportan la forma cutánea andina o 'UTA' y la forma mucocutánea o selvática. Se estima que el 75% a 80% de 3 los casos reportados corresponden a la forma cutánea y el 10% a 25%, a la forma mucocutánea. (14) Por su ubicación geográfica, en nuestro país la Leishmaniasis cutánea constituye un problema de salud pública, debido a su amplia distribución principalmente a nivel rural de las regiones Costa, Sierra (valles Andinos con una altitud entre los 1.200 a 2.400 metros sobre el nivel del mar) y Oriente; registrándose casos en 22 de las 24 provincias del Ecuador. No cabe duda de la magnitud del problema, por lo que se hace necesario disponer de información y el estudio proporcionará datos reales importantes en determinar la presencia de casos de Leishmaniasis y los factores de riesgo en la población de Santo Domingo de los Tsáchilas, lo que servirá de base para implementar medidas preventivas adecuadas sobre todo para los grupos más vulnerables y evitar su propagación. (21) Con la información generada en el presente estudio se diseñó una propuesta educativa sobre medidas de prevención que permitan reducir la prevalencia, actuando sobre los factores de riesgo que más inciden en este evento de salud. 1.1 OBJETIVOS 1.1.1 OBJETIVO GENERAL Determinar la Prevalencia y factores de riesgo de Leishmaniasis en pacientes atendidos en las Unidades de Salud de Santo Domingo de los Tsáchilas del Ministerio de Salud Pública, durante el período 2009 al 2011. 4 1.2.2. OBJETIVOS ESPECÍFICOS Establecer la prevalencia de Leishmaniasis en pacientes atendidos en la red del Ministerio de Salud Pública, de Santo Domingo de los Tsáchilas. Relacionar los casos de Leishmaniasis con los factores de riesgo como edad, género, procedencia, ocupación, tipo de lesión. Desarrollar acciones locales a través de un Plan de Acción en medidas de prevención contra la Leishmaniasis. 1.2 HIPÓTESIS La prevalencia de Leishmaniasis en Santo Domingo de los Tsáchilas en los pacientes atendidos en las Unidades de Salud de la Red Pública de Santo Domingo de los Tsáchilas durante el período del 2009 al 2011 es del 5%. 1.3 VARIABLES Dependiente: Prevalencia de Leishmaniasis. Independiente: Edad, Género, Procedencia, Ocupación, Tipo de lesión. 5 1.3.1. OPERACIONALIZACIÓN DE VARIABLES Variable Edad Género Procedencia Ocupación Instrucción Prevalencia de Leishmania 6 Definición Tiempo que una Persona ha vivido después del nacimiento Diferencia de Género Dimensión 1 año adelante Masculino Femenino Lugar donde Zona urbana vivió o visito los 6 últimos meses Zona rural Indicador en Grupos de edad (0-5; 6 -10, 11 – 15, entre otros) % de mujeres % de hombres % de personas de la ciudad % de personas del campo Agropecuario Comerciante Quehaceres Trabajo que domésticos % de personas desempeña los 6 Estudiantes por actividad últimos meses Jornaleros Artesanos Choferes Otros Ninguna Primaria % de personas Escolaridad Secundaria por nivel Superior Número de casos existentes de Leishmaniasis en % identificación un momento Casos antiguos y de Leishmania de dado/ Total de la nuevos casos antiguos y población nuevos existente en el momento dado por 100 Tipo de lesión producida por Leishmania Cutánea Diagnóstico clínico de la Mucosa lesión por Cutánea mucosa Leishmania Otros % de personas por determinación de lesión 7 2. MARCO TEÓRICO La Leishmaniasis corresponde al conjunto de enfermedades tropicales, entre las cuales se encuentran el Dengue, Fiebre amarilla, Chagas, Paludismo, Cólera y Lepra, entre otras. Se trata de enfermedades que históricamente han afectados a los países ubicados en zonas tropicales y subtropicales, sin embargo en las últimas décadas se han vuelto una problemática de incidencia mundial. La Leishmaniasis agrupa varias infecciones que pertenecen al grupo de enfermedades parasitarias zoonóticas causada por protozoarios del género Leishmania; el parásito se multiplica en algunos vertebrados que actúan como reservorios. La enfermedad es transmitida a los seres humanos mediante, por la picadura del mosquito hembra que en Europa, Asia y África, es el género Phlebotomus, y en América, el género Lutzomyia. Esta picadura puede producirse a nivel intradomiciliario, peri domiciliario o silvestre, ocurriendo generalmente en horas crepusculares, que son las horas pico de la actividad del vector. (34, 46) El incremento de la transmisión de la enfermedad, se puede atribuir a diversos factores, entre otros, al aumento de las actividades humanas en ambientes silvestres en donde existe la transmisión enzoótica, la adaptación de los vectores al peri domicilio y domicilio, y la urbanización de la parasitosis en la forma tegumentaria. (45) Las Leishmaniasis se presentan con un amplio espectro de manifestaciones clínicas en el hombre. Las diversas formas clínicas de la Leishmaniasis constituyen un serio problema de salud pública en el mundo. Los cuadros clínicos producidos son diversos y dependen de la especie infectante y la inmunidad del hospedero. La especie 8 infectante está determinada por el vector que la transmite y, a su vez, la presencia del vector está determinada por las condiciones ecológicas de cada región; principalmente a los cambios del medio ambiente generados por el hombre, lo que aumenta la exposición humana al vector. (49, 18) Estas enfermedades se caracterizan por comprometer la piel, mucosas y vísceras, según la especie de Leishmania, son enfermedades crónicas de patogenicidad baja y morbilidad relativa. Algunas lesiones se infectan secundariamente, mientras que en otras también pueden aparecer lesiones satélites. (11, 22, 40) Se localizan más frecuentemente en partes expuestas del cuerpo, especialmente en las extremidades y la cara; evolucionan crónicamente y pueden aumentar en extensión y profundidad, diseminarse a distancia o involucionar espontáneamente. Las dos formas básicas de esta enfermedad: Leishmaniasis cutánea y la Leishmaniasis visceral, depende de la especie de Leishmania de que se trate y de la respuesta inmunitaria a la infección. La forma cutánea tiende a curarse espontáneamente dejando lesiones que, según la especie de Leishmania de que se trate, pueden llegar a provocar Leishmaniasis cutánea difusa, Leishmaniasis recidivans o Leishmaniasis mucocutánea, con consecuencias estéticas desastrosas para el paciente. La Leishmaniasis visceral, que es la forma más grave de esta enfermad, resulta fatal en casi todos los casos, si no se trata. Pueden producirse brotes epidémicos con altas tasas de mortalidad. Una proporción variable de casos de Leishmaniasis visceral puede convertirse en un tipo de Leishmaniasis cutánea conocida como Leishmaniasis dérmica post-kala-azar, afección que requiere un tratamiento prolongado y costoso. (28) 9 No se dispone de datos fiables sobre la prevalencia y la incidencia que permitan llevar a cabo una evaluación exhaustiva del impacto de la Leishmaniasis. La falta de disponibilidad de datos objetivos se debe a los factores siguientes: i) la transmisión de la enfermedad se produce en zonas rurales remotas; ii) muchos casos no se diagnostican porque los pacientes no reciben atención médica, y iii) sólo en 33 de los 88 países endémicos la Leishmaniasis es una enfermedad de notificación obligatoria. Puesto que nunca se ha llevado a cabo un amplio estudio prospectivo y el cuadro general siempre se ha construido con los datos fragmentarios disponibles, sólo se pueden formular estimaciones sobre la prevalencia e incidencia efectivas. En algunos casos, por razones culturales o por falta de acceso al tratamiento, la tasa de letalidad de las mujeres es tres veces superior a la de los hombres. La carga de morbilidad se calcula en 2 090 000 años de vida ajustados en función de la discapacidad (de los que 1 249 000 corresponden a hombres y 840 000 a las mujeres), y es una de las más altas entre las enfermedades transmisibles. (39) En el Perú, la Leishmaniosis constituye una endemia que afecta a 13 departamentos de los 24 que lo conforman, es la segunda endemia de tipo tropical y la tercera causa de morbilidad por enfermedades transmisibles después de la Malaria y la Tuberculosis. Se han reportado un promedio de 7 000 a 9 000 casos probados, anualmente. Para 1997 se estimó que la población en riesgo de infección era de 1 187 104 habitantes. La zona endémica comprende aproximadamente el 74% del área total del país (951 820 km2). (34) En el Ecuador, se reportan la forma cutánea andina o 'uta' y la forma mucocutánea o selvática. Se estima que el 75% a 80% de los casos reportados corresponden a la forma cutánea y el 10% a 25%, a la forma mucocutánea. Las áreas endémicas, en donde la 10 población infantil es la más afectada, la infección se produce a nivel intra o peri domiciliaria; en cambio, la infección en adultos de sexo masculino suele ocurrir en áreas peri selváticas, relacionándose con actividades laborales en campos petroleros, mineros, actividades militares, apertura de carreteras, etc. Los resultados encontrados, demuestran que la Leishmaniasis tiene alta vulnerabilidad transmisión del parasito puede ser influenciada por los cambios de clima, lo que se acentuara más a medida que evidencien incrementos en la humedad y temperatura. (14, 40) Esta problemática de salud reviste particular importancia dado de que no se han efectuados estudios en la provincia de Santo Domingo de los Tsáchilas para recoger datos más precisos sobre la prevalencia. 2.1. DESCRIPCIÓN DE LA LEISHMANIA El agente etiológico de la Leishmaniasis es un protozoario hemoflagelado, dimórfico, intracelular obligado que infecta macrófagos y células dendríticas de piel y vísceras del hombre y diversos mamíferos. Del género Leishmania, que pertenece al reino Protista, subreino Protozoa, orden Kinetoplastida y a la familia Trypanosomatidae. (5, 10, 24, 29) Existen en todo el mundo cerca de 30 especies que infectan a los animales, de las cuales 21 pueden infectar al hombre. En el nuevo mundo, existen reconocidas un total de 20 especies del genero Leishmania, llamadas Leishmanias neotropicales, de las cuales 14 son conocidas que infectan al hombre (34) Más de 20 especies son patógenas para los seres humanos. Las más importantes especies de Lutzomyia en la transmisión de 11 Leishmaniasis son: L. trapidoi, L. hartmanni, L. gomezi, L. welcomei, L. olmeca, L. umbrátiles y L. flaviscutellata, para la enfermedad autóctona del continente americano, y L. longipalpis y L. evansi para leishmaniosis visceral. En Ecuador se presentan 4 especies de Lutzomyia que son trapidoi, hartmanni, gomezi en la costa y L. Ayacuchensis en la sierra. (22, 24) En la actualidad, el género Leishmania se divide en dos subgéneros, según su desarrollo en el intestino de los flebótomos vectores: Leishmania, en el intestino medio o anterior, el cual se localiza en el área supra pilórica, próxima a la probóscide y Viannia, en el intestino posterior, medio y anterior de los flebótomos. Existen más de 20 especies de Leishmania que son patógénicas para los seres humanos. (10, 22) En la superficie externa del parásito está formada en gran parte por la glucoproteína de 63 kilodaltons (gp63) con actividad de metaloproteasa y el lipofosfoglucano (LPG) que es un glucofosfolípido fijado a la membrana mediante GPI (glucosilfosfatidil-inositol) modificado, compuesto de una larga cadena de dominios repetitivos de fosfosacáridos. Estas moléculas sobresalen en la membrana del verme y participan en los procesos de adaptación del parásito a su complejo ciclo de vida en el insecto, reservorios y el humano. Las distintas especies de Leishmanias se distinguen por presentar diferencias en el LPG, de manera específica en las cadenas que se ramifican desde la columna central de fosfosacáridos. (10) La Leishmania presenta un kinetoplasto, el cual contiene 10.000.000 pares de bases de ADN mitocondrial (ADNm) que representan hasta 20% del ADN total del parásito y forman una compleja red de maxicírculos y minicírculos. 12 El genoma nuclear está compuesto por secuencias de ADN que codifican proteínas, transcriben ARNs y posee altas secuencias repetitivas no codificadoras presenta además citoplasma delimitado por membrana citoplasmática que en su parte interna presenta microtúbulos, posee ribosomas, retículo endoplásmico y un aparato de Golgi. Su genoma varía entre cepas e incluso entre clones de la misma cepa por lo que es capaz de realizar intercambio de material genético, sobre todo en la fase del ciclo evolutivo en la que parasita al mamífero. (10, 30) Este parásito se presenta en las siguientes formas morfológicas dependiendo de la fase de su ciclo biológico y medio donde habita. Promastigote.- Es una estructura fusiforme de 14 a 20 micras de largo por 2 a 4 µm de ancho, posee un núcleo central y en el extremo anterior presenta un Kinetoplasto alargado del cual sale un flagelo de 20 a 25 micras de largo que se exterioriza en el extremo anterior, está presente en el intestino del vector, y en los cultivos in vitro; es una forma de transición que se reproduce por fisión binaria. (9, 10, 22) Amastigote.- Es un pequeño corpúsculo esférico u ovalado y constituye la forma de división intracelular en los macrófagos y células dendríticas en la piel y diversos órganos (hígado, bazo) de hospederos finales. (43) Esta forma proviene de la diferenciación de los promastigotes metacíclicos y tienen la capacidad de infectar a otras células, presentan un diámetro de entre 2-5 µm, con un núcleo redondo, kinetoplasto en forma de bastón, posee un corto flagelo interno dentro de una bolsa visible al microscopio electrónico. Se multiplican por fisión binaria y repletan la célula, que termina por romperse, y salen los parásitos para continuación infectar células vecinas. (9, 10) 13 2.2 TAXONOMÍA La ubicación sistemática de la Leishmania es la siguiente: REINO: Protista SUB REINO: Protozoo PHYLLUM: Sarcomastigophora SUB PHYLLUM: Mastigophora Diesing CLASE: Zoomastigophorea ORDEN: Kinetoplastida FAMILIA: Trypanosomatidae GÉNERO: Leishmania SUB GÉNERO: Viannia y Leishmania Subgénero Viannia: Complejo Leishmania (Viannia) braziliensis: Especies: L. (V.) braziliensis y L. (V.) peruviana. Complejo Leishmania (Viannia) guyanensis: Especies: L. (V.) guyanensis, L. (V.) panamensis, L. (V.) shawi. Complejo Leishmania (Viannia) naiff: Especies: L. (V.) naiff. Complejo Leishmania (Viannia) lainsoni: 14 Especies: L. (V.) lainsoni. Complejo Leishmania (Viannia) colombiensis: Especies: L. (V.) colombiensis. Subgénero Leishmania: Complejo Leishmania (Leishmania) mexicana: Especies: L. (L.) mexicana y L. (L.) pifanoi. Complejo Leishmania (Leishmania) amazonensis: Especies: L. (L.) amazonensis y L. (L.) garnhami. Complejo Leishmania (Leishmania) donovani: Especies: L. (L.) donovani y L. (L.) Archibaldi. Complejo Leishmania (Leishmania) infantum: Especies: L. (L.) infantum y L. (L.) chagasia. Complejo Leishmania (Leishmania) trópica: Especies: L. (L.) trópica. Complejo Leishmania (Leishmania) major: Especies: L. (L.) major y L. (L.) major like. Complejo Leishmania (Leishmania) aethiopica: Especies: L. (L.) aethiopica. NOMBRE CIENTÍFICO: Leishmania spp (22, 8) 2.3 CICLO EVOLUTIVO El ciclo biológico del agente etiológico se da preferentemente en el ambiente silvestre, en donde involucra vectores de la familia Psychodidae del género Lutzomyia llamado manta blanca y 15 reservorios selváticos (roedores, zarigüeya, perezoso, armadillo) y doméstico (perro). El contagio tiene origen en el momento de la picadura del vector al mismo tiempo en que éste succiona la sangre este regurgita y deposita entre 10 a 100 promastigotes metacíclicos que penetran en la dermis. La saliva del mosquito tiene un rol en el establecimiento de la infección, debido a que reduce la producción del óxido nitroso por los macrófagos activados; esta forma parasitaria cuando ingresan a los tejidos y son fagocitados por los macrófagos de la piel, células de Langerhans o monocitos circulantes, luego se diferencian dentro de ellos a la forma de Amastigote que por fisión binaria se reproducen y forman nidos que llevan al rompimiento de la célula. Los Amastigotes liberados infectan células vecinas en el caso de Leishmaniasis cutánea; en el caso de Leishmaniasis visceral esta forma viaja a través de la linfa y el torrente circulatorio llega a diferentes órganos y tejidos, invaden otras células continuando la reproducción como Amastigotes. (10, 47, 52) El insecto hembra no parasitado que necesita sangre para el desarrollo de los huevos, ingurgita macrófagos con amastigotes de un mamífero infectado, luego pasan al tubo digestivo del vector en donde son lisados por enzimas; ya en el intestino del insecto inicia un proceso de maduración y diferenciación que dura entre 4 a 25 días, para posteriormente transformarse en promastigote procíclico, que se adhieren al epitelio del intestino medio del mosquito mediante su LPG. El promastigote procíclico a continuación se convierte en promastigote metacíclico infectivo, se desprende del epitelio intestinal por una duplicación de la LPG y migra a la faringe y cavidad bucal del díptero de donde son inoculados en la piel del hospedador en el momento de la picadura del insecto, completando el ciclo biológico de esta parasitosis. (8, 10, 22) 16 2.4 PATOGENICIDAD Y VIRULENCIA Los daños ocasionados por las Leishmaniasis sobre los diferentes tejidos se deben a la acción mecánica que es producida por la invasión y movimiento de los vermes, las acciones tóxicas producidas por sus antígenos de superficie y la acción exfoliativa producida al tomar los nutrientes del hospedador. Entre los antígenos de superficie más importantes tenemos el Gp 63 y LPG que participan en la adherencia a la célula hospedadora, son los marcadores serológicos de la enfermedad y participan en la invasión a los tejidos. (10) La manosa presente en el LPG se puede unir a la lectina de unión a mananos (MBL) y a la proteína C reactiva (proteínas de la fase aguda del hospedero). La unión de LPG a MBL activa el complemento por la vía de las lectinas; La LPG cuando se une a la proteína C reactiva también activa el complemento por unión de esta a C1q, que es el primer componente de la vía clásica del componente. La activación de ambas vías del complemento asegura un incremento de C3b y C3bi en la superficie del verme, y ello hace posible la opsonización y fagocitosis por los receptores CR1 y CR3. La metaloproteasa gp63 favorece también la opsonización y fagocitosis del parásito mediante su capacidad de degradar C3b y C3bi. La LPG de la Leishmania se une al receptor de manosa-fucosa y el receptor Fc de inmunoglobulinas de los macrófagos lo que le permite al parásito una fagocitosis rápida y lo protege de los mecanismos líticos del complejo de ataque de la membrana del complemento. Dentro del macrófago del hospedador, el verme también utiliza LPG y gp36 para inhibir los mecanismos 17 leishmanicidas del macrófago como la acción de hidrolasas lisosomales y cascadas de iones oxigenados. (10, 24) La Leishmania para protegerse de enzimas hidrolíticas presentes en el intestino del vector, utiliza las moléculas de superficie LPG y gp63; también resiste la destrucción por complemento en el torrente sanguíneo por cambios estructurales en su LPG ocurridos durante su diferenciación a promastigotes metacíclicos, estos cambios generan la formación de un espeso glucocáliz el cual es impenetrable para el complejo de ataque a la membrana C5b-9. Durante el período de transformación de promastigote a amastigote el LPG a través de dominios repetitivos de fosfosacáridos inhibe la fusión fagosoma-lisosoma y mediante su disminución y expresión de otros glucoconjugados resiste el ambiente inhóspito, rico en hidrolasas y pH ácido. La LPG debido a su naturaleza aniónica y sus uniones características de galactosa β1, 4 –manosa forman una barrera protectora en el amastigote que contra la degradación de metabolitos tóxicos de oxígeno generados durante el estallido oxidativo. La proteína cinas-C (PKC) se inhibe por la LPG debido a que esta se une al calcio. Otro mecanismo de evasión que presenta la Leishmania es la alteración en la fosforilación-desfosforilación de proteínas que se llevan a cabo por cinasas y fosfatasas, lo cual interfiere con las vías de señalización de la célula hospedadora, dado lugar a la inhibición del complejo mayor de histocompatibilidad (MHC) y moléculas coestimuladoras B7-1 (CD80) y CD40, así como a las alteraciones en la producción de citocinas. Inhibe la producción de IL-12 y TNF α y estimula la producción de Il 10 y TGF β en el macrófago lo cual disminuye la expresión de iNOS y por consiguiente la producción de NO limitando la capacidad de la Leishmanicida del macrófago, con lo que interfiere en la presentación del antígeno y la activación de la respuesta inmune adaptativa. La Leishmania inhibe aproximadamente el 40% de los 18 genes del macrófago limitando su función como célula efectora y presentadora de antígeno. La saliva del insecto transmisor también favorece la supervivencia del promastigote metacíclico, ya que contiene un péptido denominado maxadilán, que es capaz de suprimir la producción de TNF α y óxido nitroso. A diferencia de los macrófagos las células dendríticas no pueden eliminar eficientemente a la Leishmania y se considera que esta célula favorece la persistencia del parásito y posibilita una infección latente que reaparece con la inmunosupresión del hospedero. Cuando se inhibe la producción de óxido Nitroso, IL 12, IFN g, incrementa la susceptibilidad a Leishmania; además evidencias recientes resaltan la necesidad de mecanismos citotóxicos en la respuesta a patógenos intracelulares que inhiben a la célula huésped. (10) La virulencia de las Leishmaniasis, está asociado al tipo de especie y variedad genética de los genes gp63, A2, PMI (fosfomanosaisomerasa), GDPMP (GDP manosapirofosforilasa), CPA (proteasas de cisteína), GPI (Glicofosfatidil inositol), LPG 1, 2 (lipofosfoglicano), HSP 70, HSP 100 (histonas), TR (Tripanotion reductasa), DI (disulfito isomerasa), Lma11 y ATPasa (calcio y ATPasa) todos ellos codifican para moléculas que intervienen en la invasión, evasión e inmunopatologías; también depende de la susceptibilidad del hospedero al parásito así como a la localización, factores ambientales, inmunidad y multiplicación del parásito en diferentes especies de transmisores y hospederos. Diferentes cepas del parásito presentan grandes variaciones relacionadas con preferencia por determinado hospedero, distribución geográfica, virulencia y tropismo tisular. (10, 44) 19 la virulencia del parásito se reconoce en la actualidad lo siguiente: i) la infectividad varia incluso entre clones de una misma especie de Leishmania; ii) los amastigotes son generalmente más infectivos que los promastigotes; iii) los promastigotes móviles activos de la fase estacionaria del crecimiento son más infectivos que la forma delgada y grande de la fase de crecimiento logarítmica; iv) los promastigotes frecuentemente pierden la infectividad después de largos períodos de cultivo in vitro; v) los cambios en la virulencia que son observados en las diferentes fases de crecimiento o después de cultivos prolongados se desarrolla paralelamente a cambios bioquímicos y antigénicos en el parásito, y vi) durante el proceso de diferenciación del promastigote (metacíclico) a amastigote hay un incremento en la expresión de ciertos genes que probablemente pre adapta al parásito para sobrevivir en el medio hostil de los fagolisosomas del macrófago. El parásito puede conservar su capacidad infectante hasta dos semanas después de extraída la sangre y conservada a 4 °C. (10) La mayoría de los ratones susceptibles inoculados con la cepa ecuatoriana de Leishmania mexicana, presentan lesiones superficiales cubiertas con costras gruesas en la piel dependiendo del sitio de inoculación entre los 3 a 6 meses. En la necropsia del roedor se observa costras y parenquimatosis en los sitios inoculados, en la dermis los histiocitos son predominantes en los cortes histológicos y en su mayoría se encuentra amastigotes en grandes vacuolas, particularmente en la parte central de las lesiones; los linfocitos, neutrófilos, eosinófilos y células plasmáticas rodean a los macrófagos parasitados, también se evidencia de necrosis focal en la dermis profunda. (10, 25) La L. donovani causante de Leishmaniasis visceral, se disemina desde el sitio de inoculación para multiplicarse en células reticuloendoteliales, en especial macrófagos del bazo, hígado, 20 ganglios linfáticos y medula ósea; esto se acompaña de hiperplasia del bazo; la L. tropica, L. major, L. Mexicana, L. braziliensis y otras formas dermotrópicas inducen una lesión dérmica en el sitio de inoculación del insecto. En la Amazonía sudamericana, la L. braziliensis causa Leishmaniasis mucocutánea o nasofaríngea con lesiones de crecimiento lento pero extensas en las mucosas nasofaríngea o palatina y al cabo de meses o después de 20 años aparecen erosiones que pueden destruir el tabique nasal y proseguir ocasionando la muerte por asfixia debida al bloqueo de la tráquea, inanición o infección respiratoria; la infección por L. braziliensis guyanensis con frecuencia se disemina a lo largo de las vías linfáticas, donde aparece una cadena lineal de lesiones no ulcerosas. (13) En diversos trabajos se concluye que el aumento de la concentración de citoquinas y de óxido nitroso puede desarrollar una actividad Leishmanicida en el tejido infectado. Por lo tanto la Leishmaniasis puede producir alteraciones en la piel, en la mucosa nasofaríngea y en diversos órganos como bazo, hígado y médula ósea. 2.6. TRANSMISIÓN Y EPIDEMIOLOGÍA El reservorio natural lo constituyen las zarigüeyas (Didelphis marsupialis, Caluromys lanatus), armadillo (Dasypus novemcinctus), perezosos (Choloepus hoffmani didactylus y Bradypus variegatus ephippiger), ardillas (Sciurus granatensis y Sc. Vulgaris), cusumbo (Potos flavus), ratas (Rattus rattus), oso hormiguero (Tamandra tetradactyla) y perro (Canis familiaris); el perro es un reservorio potencial para Leishmania en la costa y sierra ecuatoriana y es transmitida al hombre comúnmente por los flebótomos hematófagos que en nuestro país se han descrito las 21 especies trapidoi, hartmanni, gomezi en la costa y ayacuchensis en la sierra. (26) La Leishmaniasis se da, por la transmisión vectorial ente reservorios - humanos y entre humanos (L. visceral), por trasplantes de órganos, transfusión de sangre contaminada, por accidentes de laboratorio y verticalmente a través de la placenta (de la madre infectada al feto). (15, 50) El insecto que transmite esta enfermedad al estar sano puede infectarse si pica a una persona que tenga este padecimiento, y así adquirir la capacidad de seguir propagando este parásito. (50) De las múltiples formas de transmisión conocidas, la transmisión por vectores es el principal mecanismo en condiciones naturales pero también se atribuyen las picadas infectivas que entran en contactos con cortes abiertos. (15) Desde que fue descrito el parásito en lesiones cutáneas en 1909 por Lidenbery y en 1910 la reporto a nivel de mucosa. (22) Se ha informado de casos de Leishmaniasis en todos los continentes, a excepción de Australia y la Antártida. (32) La Leishmaniasis cutánea y mucocutánea es una enfermedad de alta prevalencia en muchas áreas tropicales y subtropicales del mundo. Descrita en 24 países de América, extendiéndose del sur de los Estados Unidos (Texas) hasta el norte de Argentina. Esta enfermedad constituye un grave problema de salud pública por los altos costos que representa a nivel psicológico, socio-cultural y económico. Mundialmente, se estima que existan 200 millones de personas expuestas al riesgo de infección, y 300000 casos anuales de Leishmaniasis cutánea. (34) La Leishmaniasis a nivel mundial afecta a 88 países, 67 del viejo mundo y 21 en América. 72 países en desarrollo y 13 se 22 encuentran en países menos desarrollados. El 90% de los casos de Leishmaniasis visceral se presenta en cinco países: Bangladesh, India, Nepal, Sudan y Brasil y el 90% de los casos de Leishmaniasis cutánea se dan en siete países: Afganistán, Argelia, Brasil, Irán, Perú, Arabia Saudí y Siria. La incidencia anual se estima en 1.5 millones de casos de Leishmaniasis cutánea, Leishmaniasis mucocutánea y Leishmaniasis cutánea difusa y 500 000 casos de Leishmaniasis visceral. Existen 12 millones de casos, 350 millones de personas en riesgos de contraer la enfermedad y unas 59 000 muertes anuales causadas por la Leishmaniasis. Globalmente, alrededor de 350 millones se considera, que están en riesgo de infectarse y enfermar. Cada año, un estimado de 1.5 a 2 millones de niños y adultos desarrollan los síntomas de la enfermedad (forma cutánea y mucocutánea 1-1.5 millones; forma visceral 0.5 millones), y la incidencia de la infección es mayor cuando se presentan otras infecciones. La Leishmaniasis se asocia con unos 2.4 millones de personas con discapacidad y alrededor de 70 mil muertes por año. (20, 35) En México esta enfermedad es altamente endémica de la región sureste del país, la población en riesgo incluye a más de nueve millones de habitantes en 149 municipios de 13 estados. En un Estudio realizado en diferentes centros de salud (región sureste) durante el periodo del 2000 al 2009 se registraron 67 casos de Leishmaniasis, de los cuales 43% (29 casos) fueron mujeres y el 57 % (38 casos) hombres; el grupo etario más afectado fue el de 0 – 4 años con 45 % (30 casos). Los estados más afectados fueron Chiapas 52% y Tabasco 10%; la forma clínica más frecuente fue la visceral con 28% (19 casos), cutánea con 16% (11 casos), mucocutánea con 2% (1 caso) y en el 54% (36 casos) no se especificó. (12) 23 Colombia en el año 2001, los departamentos con mayores tasas de incidencia de Leishmaniasis cutánea por 100.000 habitantes fueron: Risaralda (17.47 x 100.000 hab), Boyacá (10.98 x 100.000 hab), Tolima (9.32 x 100.000 hab), Caquetá (31.5 x 100.000 hab) y Putumayo (13.2 x 100.000 hab). (Ver tabla No 2 y gráfica No 1). El promedio de la tasa de incidencia de Leishmaniasis cutánea para este año fue de 13.02 y la mediana de 10.98 casos nuevos de Leishmaniasis. En cuanto a la Leishmaniasis mucocutánea se reportaron 56 casos correspondientes a una tasa de 0.13 x 100.000 hab.; el departamento de mayor tasa es Huila con 0.84 x 100.000 hab. (8 casos). Para Leishmaniasis visceral la tasa total fue de 0.07 x 100.000 hab. y el departamento con mayor tasa fue Córdoba con 1.88 x 100.000 hab. (25 casos). El número de casos de Leishmaniasis sin especificar que se han reportado para el año 2001, alcanzo 1085 casos y los departamentos con mayor número de casos sin especificar fueron Caldas (208) y Cundinamarca (435). (37) En el Perú la Leishmaniasis constituye la segunda endemia de tipo tropical y la tercera causa de morbilidad por enfermedades transmisibles luego de la Malaria y Tuberculosis. Para 1997, se estimó que la población en riesgo de infección era de 1187104 habitantes; teniendo como zona endémica aproximadamente el 74% del área total del país (951820 km2), extendiéndose a través de los Andes y los valles interandinos para la Leishmaniasis cutánea y a las zonas de selva alta y selva baja en la Leishmaniasis mucocutánea. Durante 1999 se reportó un total de 4645 casos entre aquellos casos confirmados y probables de las formas cutáneas y mucocutáneas; con una tasa de incidencia acumulada para el país de 17,22 x 100000 hab., para la Leishmaniasis cutánea y de 1,19 x 100000 hab., para la Leishmaniasis mucocutánea. (34) La Leishmaniasis en el Perú, la constituye una endemia tropical que afecta a 12 departamentos, es la segunda endemia de tipo 24 tropical y la tercera causa de morbilidad por enfermedades transmisibles luego de la malaria y la tuberculosis; se reporta anualmente un promedio de 7 000 a 9 000 casos probados. Para 1997 se estimó que la población en riesgo de infección era de 1 187 104 habitantes. La zona endémica comprende aproximadamente el 74% del área total del país (951 820 km2), se extiende a través de los Andes y los valles interandinos entre los 600 y los 3 000 metros sobre el nivel del mar, para la Leishmaniasis cutánea, y a las zonas de selva alta y selva baja por debajo de los 2 000 metros, para la Leishmaniasis mucocutánea. (48) En Ecuador los dos primeros casos fueron presentados por el Dr. Alfredo J. Valenzuela en 1921 en dos pacientes proveniente de la provincia de Esmeraldas. La distribución geográfica e incidencia de las infecciones humanas de Leishmania han sido informadas en 20 provincias del país. (22) Los casos se registraron desde el nivel del mar hasta los aproximadamente 2700 m de altitud, principalmente de las zonas rurales. Una correa endémicas se forma a lo largo de las laderas occidentales de los Andes que implican nuevos asentamientos en Imbabura, Pichincha, Cotopaxi, Bolívar y Cañar. Las formas de Leishmaniasis cutánea y Leishmaniasis mucocutánea han sido registradas en 6 provincias amazónicas (Amunarriz 1991). Desde 1986 en Ecuador se han reportado casos en los valles de Paute (2300-2500 msnm), Alauís (2300-2700 msnm), y Huigra (12001500 msnm). Dadas las diferencias en el tamaño de la población, la incidencia más alta tasa se encuentra en la región del Pacífico. El número de casos disminuido de manera constante durante la década de 1990, pero aumentó repentinamente en los últimos cuatro años, con más del 75% de los casos se producen en la región del Pacífico. La mayoría de los casos ocurren en los departamentos situados en las 25 llanuras del Pacífico y en la vertiente occidental de los Andes, tales como Esmeraldas, Pichincha, Manabí, Los Ríos y Guayas. (16) 2.7 CLÍNICA Las manifestaciones clínicas de la Leishmaniasis pueden ser cutáneas, mucocutánea y visceral. La leishmaniosis cutánea es la forma más frecuente del padecimiento y se puede presentar en dos formas: una localizada (LCL) y otra difusa (LCD). La LCL se distingue por la presencia de lesiones secas que luego se ulceran pueden ser únicas o múltiples, redondeadas, de bordes indurados, fondo limpio e indoloro que aparecen 15 a 20 días después de la picadura del vector infectado, algunas veces estos pacientes se curan de manera espontánea en un lapso de seis meses a dos años, excepto cuando la lesión ocurre en la oreja, donde es crónica y mutilante. (10, 31) La LCD se caracteriza por falta de respuesta inmune celular hacia antígenos de Leishmania, lo que permite la diseminación del parásito por el líquido tisular, la linfa o la vía sanguínea con desarrollo de lesiones nodulares en toda la piel, salvo en el cuero cabelludo. En el continente americano hay tres especies del complejo L. mexicana y pueden causar ambas formas clínicas: Leishmania (L) mexicana, Leishmania (L) amazonensis y L (L) pifanoi. La leishmaniosis mucocutánea (LMC) o espundia cursa con invasión y destrucción de la mucosa nasofaríngea y puede ser muy desfigurante. Las especies causantes de esta forma clínica pertenecen el complejo L. brazilienses: L (V) braziliensis, L (V) guyanensis, L (V) panamensis y L (V) peruviana. Esta forma 26 clínica se desarrolla después que desaparecen las lesiones cutáneas y en ocasiones puede presentarse hasta 20 años después, además se presenta reacción inflamatoria que ocurre en la mucosa nasal, bucal y faríngea que conllevan a la degeneración del tabique nasal. El paciente puede presentar como sintomatología catarro nasal, ardor y respiración forzada, hemorragia al extraerse las costras, y si hay infecciones sobre agregadas la secreción es purulenta y puede profundizarse la lesión mucosa y continuar con la mucosa del vestíbulo y labio superior. Este proceso puede extenderse a la piel de la nariz semejando una rinofimia, hasta que se presenta la ulceración de la piel, pueden destruirse después las alas nasales, quedando sólo los orificios de los elementos óseos. La proliferación del borde del tabique que queda puede llevar a la obstrucción de las fosas nasales. En ciertos casos se presentan formaciones pseudo-poliposas, siendo la dificultad respiratoria la más saltante. También se describe una forma atrófico-costrosa, donde a veces sólo se presentan abundantes costras que dificultan la respiración, siendo su remoción muy dolorosa. (10, 34) La Leishmaniasis visceral (LV) es letal en 100% de los casos si no se recibe tratamiento, con una tasa de mortalidad que puede llegar hasta el 15%, se presenta con hepatoesplenomegalia, fiebre intermitente, pérdida de peso, anemia y caquexia, en la India esta enfermedad se conoce como Kala-azar o enfermedad negra en virtud de la hiperpigmentación observada en pacientes de esa región. La LV constituye un problema de salud pública, en especial en individuos inmunosuprimidos como aquellos infectados con VIH; después de la recuperación de la LV es posible observar leishmaniosis cutánea. (10) 2.8 DIAGNÓSTICO El diagnóstico diferencial de la enfermedad varía de acuerdo a la forma clínica en que se manifieste. Existen diversos métodos 27 generalmente sencillos para el diagnóstico de la enfermedad como son: Frotis de la lesión: Se realiza lavado y desinfección de la zona, luego se presiona con firmeza los bordes de la lesión hasta que empalidezca; en el borde interno, hacer una pequeña incisión con hoja de bisturí tratando de levantar la piel, secar la sangre con gasa y raspar el tejido. Con el material obtenido hacer un frotis delgado en una lámina porta objeto. Prueba de Intradermorreacción de Montenegro: Consiste en la aplicación de un antígeno extracto soluble preparado a partir de promastigotes procedentes de cultivo. La leishmanina se aplica intradérmicamente en la cara anterior del antebrazo izquierdo del paciente y se hace la lectura entre 48 a 72 horas como máximo. (3) Microscopía electrónica con de tinción negativa: se utiliza muestra de sangre o cultivo de agar sangre infectadas con el verme. A continuación dicha muestra se la fija con glutaraldehído al 2% durante 10 minutos a 4°C. Posteriormente, tras una centrifugación a baja velocidad, se rompen las membranas celulares del sedimento y se vuelve a centrifugar el sobrenadante para eliminar los restos celulares. Después se recoge el sobrenadante, el cual se ultracentrífuga a 35.000 rpm durante 30 minutos a 4°C; finalmente se realiza una adsorción a una rejilla. Luego se realiza diversos lavados con diferentes tampones y se procede a deshidratar la muestra mediante lavados con etanol. Una vez incluida la muestra en la mesch se lo polimeriza en estufa para luego hacer cortes ultra finos con el ultra micrótomo, a continuación se tiñe mediante doble incubación en acetato de uranilo y citrato de plomo; finalmente se visualiza en el microscopio electrónico. (2) Inoculación en Animales: Se utiliza ratones blancos o hámster dorados machos de 100 g a 150 g y 7 semanas de edad, se le 28 inocula solución de promastigote por vía cutánea (nasal o plantar), luego de seis meses se examinan los ratones en búsqueda de lesiones. (17, 25, 54) Hemocultivo: Los medios de cultivo son sencillos sean líquidos o difásicos con procedimiento práctico de aplicación, pero requiere de esterilidad absoluta y ambiente estable para el desarrollo del parásito, ha sido de exitosa aplicación aún en pacientes con baja parasitemia. Son fáciles de cultivar y se dan por lo general a las 3 a 4 semanas. El medio de cultivo idóneo para la Leishmaniasis el Novy MacNeal-Nicolle (NNN), en los cuales se hallan las formas de promastigotes. La temperatura a la que desarrollan en los medios de cultivo varía entre 22 a 26°C. (17, 34, 54) ELISA: (acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay, Ensayo por inmunoabsorción ligado a enzimas) es una técnica de inmunoensayo en la anticuerpo cual un antígeno inmovilizado se detecta mediante un enlazado a una enzima capaz de generar un producto detectable como cambio de color o algún otro tipo; en ocasiones, con el fin de reducir los costos del ensayo, nos encontramos con que existe un anticuerpo primario que reconoce al antígeno y que a su vez es reconocido por un anticuerpo secundario que lleva enlazado la enzima anteriormente mencionada. La aparición de colorantes permite medir indirectamente mediante espectrofotometría el antígeno en la muestra. Reacción en cadena de la Polimerasa (PCR): Es un método que permite detección de secuencias genéticas del virus mediante la amplificación basada en la secuencia de ácidos nucleicos y consiste primeramente la extracción del acido nucleico de la célula, para a continuación preparar el master mix de reacción; para seguidamente realizar la mezcla del master mix con el ácido 29 nucléico; subsiguientemente se procede a amplifica los segmentos genéticos en un termociclador a diferentes temperaturas, para posteriormente hacerlo migrar en un gel de agarosa o policrilamina y luego teñirlo con Bromuro de Etidio o cyber green para finalmente visualizarlo en un Transiluminador o en un aparato de fotodocumentación. (17, 54) Inmuno Fluorescencia Indirecta: La IFI posee una sensibilidad del 99%, pero tiene varias desventajas: consta de varias fases, se necesita un microscopio especial de luz ultravioleta y la interpretación que es subjetiva, que debe de correr a cargo de un técnico experto. La IFI es un método utilizado para todos los tipos de leishmaniosis, para detectar y medir los anticuerpos (inmunidad humoral), en contra de antígenos de Leishmania, por medio de una reacción in vitro, que utiliza como antígenos a formas promastigotes de Leishmania obtenidas de cultivo. En el método se utiliza un microscopio con luz ultravioleta que incide sobre la reacción serológica, en una lámina portaobjetos, interpretándose como positivas las muestras que muestran fluorescencia. (33) 2.9 INMUNIDAD Una vez que el Leishmania ha ingresado al organismo se encuentra con la primera línea de defensa innata celular que son los macrófagos y células dendríticas utilizando sus receptores para poder penetrar; al ser sensibilizados estos secretan TNF α, IL1, IL 12 y otras citocinas que van a tratar de inhibir al parásito y provocar una respuesta de fase aguda (liberadas por macrófagos en respuesta de la infección) y esto conlleva a la aparición de fiebre y demás síntomas; todo esto conlleva a cambios transitorios en la integridad de las uniones del endotelio y en especial el endotelio de ciertos órganos como piel, el hígado, bazo. 30 La respuesta inmune adaptativa comienza por el reconocimiento de péptidos presentados por células presentadoras de antígenos a los linfocitos T en los órganos linfoideos y comienza cuando el verme penetra en el macrófago y es captada en el citosol como moléculas extrañas por el proteosoma dentro de los cuales se hidrolizan en péptidos de 5 a 15 aminoácidos. Estos péptidos liberados en el citosol, son conducidos hacia el Retículo endoplásmico (RE) e introducidos en sus cisternas por proteínas transportadoras. Inmediatamente después de su síntesis en el núcleo las cadenas de antígenos linfocitario humano (HLA) también ingresan en el RE, donde se ensamblan en CMH clase I.; dentro de las cisternas del RE los péptidos antigénicos se asocian con moléculas CMH I y forman CMH 1– Ag y este pasa después del RE al sistema de Golgi. Finalmente se desprende en vesículas que son transferidas a las membrana plasmática de la célula presentadora, en el cual queda expuesta y puede interaccionar con el receptor de la célula TH 1 para activar a su vez a linfocito T citotóxicos y a las células NK lo que permite que sean detectadas, eliminadas por lisis o apoptosis. La Leishmania ha desarrollado genéticamente mecanismos de le permite evadir el sistema inmune. También la Leishmania se puede adherir a los receptores Fc de los macrófagos, monocitos y células dendríticas cuando el verme está revestido con un anticuerpo. De hecho el anticuerpo aumenta la infectividad de estos microorganismos proporcionándoles nuevos receptores y estimulando la absorción del parasito por parte de la célula diana. (1, 42) 2.10 TRATAMIENTO El tratamiento está esencialmente basado en el uso de antimoniales pentavalentes, como el antimoniato de meglumina y 31 el estibogluconato de antimonio y sodio, aunque pueden presentar efectos secundarios ya que es irritante al tracto gastrointestinal. Ambos medicamentos por recomendaciones de la OMS se utilizan por vía intramuscular en dosis de 20 mg de antimonio por kilogramo de peso por día durante 20 días; el tratamiento puede repetirse a intervalos de 15 días hasta 3 veces. La dosis es aplicable tanto en niños como adultos, ponderada con relación al peso. En México se han dado buenos resultados con la aplicación de antimonio de meglumina en forma intralesional con aplicación parenteral; para esto es recomendable la combinación de una dieta rica proteínas, así como la vigilancia del paciente mediante electrocardiograma y realización de pruebas de funcionamiento renal y hepático, dado su toxicidad. En caso de resistencia a los fármacos anteriores se emplea anfotericina B y pentamidina. La primera se recomienda de 1 mg/Kg/día, en la que se requiere una dosis acumulativa total de 0,7 a 3 gramos, dependiendo del tipo de leishmaniosis y de la respuesta al tratamiento de cada paciente. La anfotericina B debe administrarse indefectiblemente en ambiente hospitalario, controlando los posibles efectos adversos. La pentamidina se aplica por vía intramuscular en dosis de 3 a 4 mg/kg tres veces por semana durante 5 a 25 semanas hasta que desaparezca la lesión y en caso de leishmaniosis visceral hasta que no haya parásitos en la pulpa esplénica; este producto puede ocasionar aborto, por lo que no es recomendable durante el embarazo. Es considerada como medicamento de primera elección para aquellos pacientes que presentan Leishmaniasis Mucocutánea mutilante y Leishmaniosis visceral de cuidado y grave, ya que posee una mejor respuesta terapéutica. También es de primera elección para las embarazadas. 32 Estudios realizados en la India y Brasil han revelado que la miltefosina (hexadecil-fosfocolina) por vía oral parece una excelente alternativa, debido a la susceptibilidad del parásito al calor. (10, 33) El Nifurtimox (Lampit) utilizado para la enfermedad de Chagas presenta cierta acción en la Leishmaniasis cutánea a 10mg./kg./día, durante 30 días. Se ha determinado que en casos de Leishmaniosis localizadas se curan rápidamente con la inyección intralesional única de glucantime (antimonio de Nmetilglucamina). (22) 2.11 PREVENCIÓN Y CONTROL Las estrategias de prevención van dirigidas directamente a tres componentes principales: al control de la transmisión vectorial, vigilancia periódica de reservorios y a la atención a personas infectadas. Para el control de vectores comprende acciones como la eliminación de criaderos de mosquitos, uso de métodos de barreras como rejillas metálicas, repelentes, uso de ropa adecuada para disminuir la exposición al vector. De igual forma el establecimiento de un sistema de investigación entomológica relacionada en la infestación de domicilios y peridomicilios. También se debe realizar estudios epidemiológicos activos en reservorios salvajes y domésticos para la detección de Leishmania en ellos y de esta forma reportar posibles casos endémicos para de esta manera prevenir posibles brotes. En cuanto a la vigilancia entomológica se analiza la detección y eliminación de reinfestaciones y focos residuales en los vectores; y para la vigilancia epidemiológica se realiza diagnóstico precoz y tratamiento de casos agudos. Las acciones deben tener continuidad temporal para evitar reinfestaciones-rebrotes y contigüidad geográfica, cubriendo todas las zonas de riesgo. 33 Se ha desarrollado la primera generación de vacunas que consiste en un lisado de Leishmania combinado con una baja concentración de BCG (bacilo de Calmette-Guerin) como coadyuvante. También se ha presentado vacunas basadas en moléculas recombinantes con el ADN de Leishmania. (1, 10, 42) 34 3. MATERIALES Y MÉTODOS 3.1 MATERIALES 3.1.1 LOCALIZACIÓN La investigación se realizó en las unidades de salud de la red del Ministerio de Salud Pública de Santo Domingo de los Tsáchilas, que cuenta con 1 unidad Hospitalaria de referencia Provincial: el Hospital General “Dr. Gustavo Domínguez Zambrano”; 2 Jefaturas de Salud: Área de Salud N°.17, Centro de Salud Augusto Egas, con 14 Unidades Operativas (SCS Urbanos: Asistencia Municipal, Santa Martha, Rumiñahui, 30 de Julio, El Paraíso , Defensores de Paquisha y SCS Rurales: Las Mercedes, Libertad del Toachi, Alluriquin, San Vicente del Nila, Luz de América, El Esfuerzo, Santa María del Toachi, San Gabriel del Baba; y el Área de Salud N° 22, Centro de Salud Los Rosales con 11 Unidades Operativas (SCS Urbanos: La Modelo, Nueva Aurora, Montoneros de Alfaro, Juan Eulogio Paz y Miño, Ciudad Nueva, SCS Rurales: Las Delicias, Nuevo Israel, Puerto Limón, San Jacinto del Búa, Valle Hermoso). (19) 3.1.2 CARACTERIZACIÓN DE LA ZONA DE TRABAJO La Provincia Tsáchilas se encuentra ubicada en la parte noroccidental de la cordillera de los Andes, limitada al Norte con las Provincias de Pichincha y Esmeraldas; al Sur las provincias de: Los Ríos y Cotopaxi; hacia el Este los cantones de Quito y Mejía; al Oeste: la provincia de Manabí. Su capital es Santo Domingo de los Colorados, situada a una altura de 655 msnm de clima subtropical con temperatura promedio de 22 ºC y un volumen de precipitación de 3000 a 4000mm anuales, su extensión territorial tiene una superficie de 3.523 km². 35 La Provincia está conformada por 7 Parroquias rurales: Alluriquín, Luz de América, Puerto Limón, San Jacinto del Búa, Valle Hermoso, Santa María del Toachi y El Esfuerzo; 7 pre parroquias: Las Delicias, Nuevo Israel, Las Mercedes, El Placer del Toachi, San Gabriel del Baba y Julio Moreno Espinosa. Para el año 2010 la proyección de la población según el censo del INEC, alcanza 335.712 habitantes, de los cuales 49.63% son hombres y el 50.37% mujeres. La mayoría de la población (69%) vive en la zona urbana y el 31% vive en zonas rurales; con una densidad demográfica de 95 habitantes por Km², dedicados principalmente a las actividades agrícolas y comerciales. (41) 3.1.3 PERÍODO DE INVESTIGACIÓN La investigación fue realizada en los años 2009 al 2011 3.1.4 RECURSOS EMPLEADOS 3.1.4.1 Humanos Maestrante Tutor 3.1.4.2 Físicos • Equipo de cómputo portátil y accesorios. • Historias clínicas e Instrumentos de recolección de datos • Memory Flash 2 GB, HP • Cámara Digital Sony. 36 3.1.5 UNIVERSO Y MUESTRA 3.1.5.1 UNIVERSO Fueron todos los pacientes atendidos en las unidades de salud de Santo Domingo de los Tsáchilas durante el período 2009 al 2011. 3.1.5.2. TAMAÑO DE LA MUESTRA La muestra fue similar al universo considerando los criterios de inclusión y exclusión. 3.1.6. CRITERIOS DE INCLUSIÓN / EXCLUSIÓN 3.1.6.1 Criterios de inclusión Pacientes atendidos con sospecha de Leishmaniasis Pacientes atendidos durante el período 2009 - 2011. Pacientes con información completa. Pacientes atendidos en la Red de Unidades de Salud del MSP de Santo Domingo de los Tsáchilas. 3.1.6.2 Criterios de exclusión Pacientes atendidos fuera del período 2009 - 2011. Pacientes con información incompleta. Pacientes que no son atendidos en la Red de Unidades de salud del MSP. Pacientes que no sean de Santo Domingo de los Tsáchilas. 3.2 MÉTODO 3.2.1 TIPO DE INVESTIGACIÓN Fue de tipo Descriptivo, retrospectivo, longitudinal. 37 3.2.2 DISEÑO DE LA INVESTIGACIÓN No experimental 3.2.3 PROCEDIMIENTOS DE LA INVESTIGACIÓN Para este transcendental estudio se procedió a solicitar los respectivos permisos al Jefe del Departamento de Epidemiología y al Director de la Dirección Provincial de Salud de Santo Domingo de los Tsáchilas para poder ejecutar la investigación. Luego se realizó una investigación minuciosa de las fichas epidemiológicas que llegaron, así mismo se indagara los resultados de los casos reportados por el departamento de Epidemiología proveniente de los diferentes unidades de salud de la provincia; además se utilizó información registrada en el formulario EPI 2 del Ministerio de Salud Pública Nacional. (Anexo 1) Los resultados obtenidos de esta investigación fueron los necesarios para alcanzar los objetivos propuestos y de esta manera cumplir con el estudio. 3.2.4 ANÁLISIS DE LA INFORMACIÓN La información se obtuvo a través de fichas de recolección de datos para obtener la información de los profesionales de la salud, luego se procedió a procesar la respectiva base de datos en el Software EPI- INFO versión 3.5.3 (2011), donde se ingresaron, y analizaron los datos y se complementó la presentación de la información (elaboración de gráficos) con Microsoft Office Excel 2007. 38 Se efectuó análisis de frecuencias de las variables compatibles a la pruebas para evaluar la posible asociación entre variables y establecer hipótesis de esta investigación. 39 4. RESULTADOS Y DISCUSIÓN De los datos obtenidos en esta investigación se realizaron tablas y gráficos que fueron diseñadas con relación a las variables seleccionadas de diagnóstico, género, edad, procedencia, semanas epidemiológicas, ocupación, sitio de lesión, que a continuación se detallan: 4.1 PREVALENCIA DE LEISHMANIASIS TABLA N° 1. LEISHMANIASIS SEGÚN DIAGNÓSTICO, DURANTE EL PERÍODO 2009 -2011 AÑOS 2009 DIAGNÓSTICO No. Positivo 99 % 3,11 2010 No. 159 % 5,47 2011 No. 60 % 2,70 PERÍODO No. 318 % 3,83 Negativo 3080 96,89 2746 94,53 2159 97,30 7985 96,17 Total 3179 100,00 2905 100,00 2219 100,00 8303 100,00 Fuente: Estadística Dirección Salud Santo Domingo Tsáchilas. Elaborado: Dra. Angela Díaz 40 de los GRÁFICO N° 1. LEISHMANIASIS SEGÚN RESULTADO DURANTE EL PERÍODO 2009 -2011 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: se observa en personas atendidas en los centros de salud del cantón Santo Domingo durante el período 2009-2011 según diagnóstico, se obtuvo una positividad para Leishmaniasis del 3,83%. 41 4.2 RELACIÓN DE CASOS DE LEISHMANIASIS CON FACTORES DE RIESGO TABLA N° 2. POSITIVOS CON LEISHMANIASIS, SEGÚN SEXO Y AÑOS DE ESTUDIO AÑOS 2009 2010 2011 % PERÍODO SEXO No. % No. % No. No. % Femenino 38 38,38 64 40,25 31 51,67 133 41,80 Masculino 61 61,62 95 59,75 29 48,33 185 58,20 TOTAL 99 100,00 159 100,00 60 100,00 318 100,00 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 42 GRÁFICO N° 2. POSITIVOS CON LEISHMANIASIS, SEGÚN SEXO Y AÑOS DE ESTUDIO Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: Se observa el porcentaje de casos positivos de Leishmaniasis en pacientes atendidos en los centros de salud del cantón Santo Domingo según sexo, obteniéndose en el año 2009 al 2011 en el sexo masculino el 58,20% y femenino con 41,80%, cabe resaltar en el año 2009 el masculino tuvo 61,62% y el femenino 38,38% entre lo más importante; y de lo revisado en los años de estudio se encontró que hubo una diferencia ligeramente significativa en cuanto en el sexo masculino. 43 TABLA N° 3. POSITIVOS CON LEISHMANIASIS, SEGÚN GRUPO ETARIO Y AÑOS DE ESTUDIO AÑOS 2009 2010 2011 PERÍODO GRUPO ETARIO No. % No. % No. % No. % < 1 año 1 1,01 2 1,26 2 3,33 5 1,57 1 - 4 años 14 14,14 11 6,92 13 21,67 38 11,95 5 a 14 años 24 24,24 36 22,64 14 23,33 74 23,27 15 a años 36 36,36 73 45,91 19 31,67 128 40,25 45 y más años 24 24,24 37 23,27 12 20,00 73 44 22,96 Total 99 100,00 159 100,00 60 100,00 318 100,00 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 44 GRÁFICO N° 3. POSITIVOS CON LEISHMANIASIS, SEGÚN GRUPO ETARIO Y AÑOS DE ESTUDIO Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: se observa el porcentaje de casos positivos de Leishmaniasis en pacientes atendidos en las Unidades de Salud de Santo Domingo según grupo etario, en la que se obtuvo en el período de estudio que el grupo mayormente afectado fue de 15 a 44 años con el 40,25%, seguido del grupo de 5 a 14 años con el 23,27% y de 45 y más años con 22,96%, entre otros; cabe mencionar que este evento se presenta en toda edad pero en los grupos más dinámicos. 45 TABLA N° 4. POSITIVOS CON LEISHMANIASIS, SEGÚN SEMANA EPIDEMIOLÓGICA Y AÑOS DE ESTUDIO 2009 2010 2011 SEMANA No. % No. % No. % No. % 1 6 6,06 8 5,03 4 6,67 18 5,66 2 3 3,03 8 5,03 1 1,67 12 3,77 3 0 0,00 4 2,52 5 8,33 9 2,83 4 3 3,03 19 11,95 3 5,00 25 7,86 5 0 0,00 1 0,63 3 5,00 4 1,26 6 3 3,03 3 1,89 1 1,67 7 2,20 7 0 0,00 8 5,03 3 5,00 11 3,46 8 0 0,00 5 3,14 1 1,67 6 1,89 9 2 2,02 2 1,26 0 0,00 4 1,26 10 4 4,04 7 4,40 1 1,67 12 3,77 11 1 1,01 6 3,77 2 3,33 9 2,83 12 4 4,04 3 1,89 0 0,00 7 2,20 13 0 0,00 3 1,89 1 1,67 4 1,26 14 2 2,02 9 5,66 1 1,67 12 3,77 15 1 1,01 2 1,26 3 5,00 6 1,89 16 1 1,01 3 1,89 1 1,67 5 1,57 17 4 4,04 3 1,89 1 1,67 8 2,52 46 PERÍODO 18 0 0,00 2 1,26 0 0,00 2 0,63 19 2 2,02 5 3,14 0 0,00 7 2,20 20 0 0,00 2 1,26 0 0,00 2 0,63 21 1 1,01 2 1,26 0 0,00 3 0,94 22 1 1,01 0 0,00 1 1,67 2 0,63 23 0 0,00 0 0,00 0 0,00 0 0,00 24 2 2,02 3 1,89 0 0,00 5 1,57 25 2 2,02 8 5,03 1 1,67 11 3,46 26 2 2,02 0 0,00 1 1,67 3 0,94 27 1 1,01 1 0,63 2 3,33 4 1,26 28 0 0,00 1 0,63 0 0,00 1 0,31 29 1 1,01 4 2,52 0 0,00 5 1,57 30 0 0,00 2 1,26 2 3,33 4 1,26 31 1 1,01 0 0,00 3 5,00 4 1,26 32 1 1,01 4 2,52 1 1,67 6 1,89 33 1 1,01 2 1,26 0 0,00 3 0,94 34 0 0,00 0 0,00 1 1,67 1 0,31 35 3 3,03 2 1,26 2 3,33 7 2,20 36 1 1,01 3 1,89 0 0,00 4 1,26 37 3 3,03 0 0,00 3 5,00 6 1,89 38 3 3,03 0 0,00 0 0,00 3 0,94 47 39 0 0,00 1 0,63 0 0,00 1 0,31 40 2 2,02 1 0,63 2 3,33 5 1,57 41 6 6,06 1 0,63 2 3,33 9 2,83 42 6 6,06 1 0,63 2 3,33 9 2,83 43 6 6,06 2 1,26 0 0,00 8 2,52 44 1 1,01 3 1,89 1 1,67 5 1,57 45 0 0,00 1 0,63 0 0,00 1 0,31 46 0 0,00 0 0,00 0 0,00 0 0,00 47 0 0,00 0 0,00 0 0,00 0 0,00 48 0 0,00 3 1,89 1 1,67 4 1,26 49 10 10,10 3 1,89 1 1,67 14 4,40 50 2 2,02 3 1,89 1 1,67 6 1,89 51 7 7,07 2 1,26 0 0,00 9 2,83 52 0 0,00 3 1,89 2 3,33 5 1,57 Total 99 100,00 159 100,00 60 100,00 318 100,00 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 48 GRÁFICO N° 4. POSITIVOS CON LEISHMANIASIS, SEGÚN SEMANA EPIDEMIOLÓGICA. PERÍODO 20092011 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: se observa según semana epidemiológica, los casos positivos de Leishmaniasis en pacientes atendidos en las Unidades de Salud de Santo Domingo, de la que se obtuvo en el período de estudio que la presentación de la enfermedad fue mayormente en la semana 4 con el 7,86%, con importancia entre la semana 1 a 4 con variaciones de presencia de casos, y además se observa entre la semana 49 a 52 el inicio a la mayor transmisión, por lo que se presta atención entre las semanas 49, 50, 51, 52, 1, 2, 3 y 4 como el período de contagio que coincide con el inicio de la temporada invernal en este territorio. 49 TABLA N° 5. POSITIVOS CON LEISHMANIASIS, SEGÚN PROCEDENCIA AÑOS PROCEDENC IA Abraham Calazacón Alluriquín Bombolí Cayambe Chiguilpe Coca - Orellana Cube Esmeraldas El Carmen Manabí El Esfuerzo Julio Moreno La Concordia La Unión Esmeraldas Las Mercedes Libertad Toachi Luz de América MonterreyConcordia Muisne Esmeraldas Nuevo Israel Patricia Pilar 50 2009 No % . 2010 No % . 2011 No % . PERÍOD O No % . 10 15 6 1 10 0 10,10 15,15 6,06 1,01 10,10 0,00 6 30 13 0 18 1 3,77 18,87 8,18 0,00 11,32 0,63 6 10 4 0 0 0 10,00 16,67 6,67 0,00 0,00 0,00 22 55 23 1 28 1 6,92 17,30 7,23 0,31 8,81 0,31 1 1,01 0 0,00 0 0,00 1 0,31 2 3 0 1 2,02 3,03 0,00 1,01 1 3 2 2 0,63 1,89 1,26 1,26 2 2 0 0 3,33 3,33 0,00 0,00 5 8 2 3 1,57 2,52 0,63 0,94 0 2 1 1 0,00 2,02 1,01 1,01 1 6 0 4 0,63 3,77 0,00 2,52 0 4 0 1 0,00 6,67 0,00 1,67 1 12 1 6 0,31 3,77 0,31 1,89 0 0,00 0 0,00 1 1,67 1 0,31 0 0 4 0,00 0,00 4,04 0 5 2 0,00 3,14 1,26 1 2 0 1,67 3,33 0,00 1 7 6 0,31 2,20 1,89 Los Ríos Pedernales Manabí Pedro Vicente Maldonado Pichincha Puerto Limón Puerto Quito Pichincha Quinindé Esmeraldas Río Toachi Río verde – Esmeraldas San Gabriel del Baba San Jacinto del Búa San miguel de los BancosPichincha San Lorenzo parroquia 5 de junio Esmeraldas San Vicente del Búa Santa María del Toachi Santo Domingo Tandapi Pichincha Valle Hermoso 1 1,01 0 0,00 0 0,00 1 0,31 2 3 2,02 3,03 0 2 0,00 1,26 0 1 0,00 1,67 2 6 0,63 1,89 0 0,00 2 1,26 1 1,67 3 0,94 1 0 1,01 0,00 6 0 3,77 0,00 0 2 0,00 3,33 7 2 2,20 0,63 11 11,11 12 7,55 4 6,67 27 8,49 1 1,01 2 1,26 0 0,00 3 2 2,02 6 3,77 2 3,33 10 3,14 0 0,00 1 0,63 0 0,00 1 0,31 1 1,01 0 0,00 0 0,00 1 0,31 4 4,04 0 0,00 0 0,00 4 1,26 2 6 2,02 6,06 5 3,14 1 17 10,69 8 1,67 8 2,52 13,33 31 9,75 0 6 0,00 6,06 1 7 0,00 6,67 0,63 4,40 0 4 0,94 1 0,31 17 5,35 51 Zaracay TOTAL 2 2,02 4 2,52 4 6,67 10 3,14 100,0 15 100,0 100,0 31 100,0 99 0 9 0 60 0 8 0 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: se observa los casos positivos de Leishmaniasis en pacientes atendidos en las Unidades de Salud de Santo Domingo según procedencia, obteniéndose en el período de estudio que mayormente se tuvo la presencia de esta patología en Alluriquín con 17,30%, seguido de Santo Domingo con 9,75%, Chiguilpe con 8,81%, Abraham Calazacón con 6,92%, Valle hermoso 5,35% entre otros. Cabe indicar, que llegan pacientes de parroquias de provincias aledañas como es de la Parroquia Río Verde de Esmeraldas con 8,49%. 52 TABLA N° 6. POSITIVOS CON LEISHMANIASIS, SEGÚN OCUPACIÓN Y AÑOS DE ESTUDIO OCUPACIO N Agricultor Albañil Auxiliar Enfermería Chofer Cocinero Comerciante Contador Conscripto Desempleada Empleada Enfermera Estudiante Guardia Jornalero Medico Mensajero Modista NA Niños Policía Prescolar Profesora 2009 No % . 12 12,12 2 2,02 2010 No % . 24 15,09 2 1,26 2011 No % . 3 5,00 0 0,00 PERÍOD O No % . 39 12,26 4 1,26 1 0 0 6 0 5 0 2 0 24 1 7 1 1 0 21 0 0 0 0 0 6 1 6 0 4 1 3 0 48 0 6 2 2 1 3 15 1 3 1 1 1 0 7 1 0 1 2 1 16 0 1 0 0 0 11 5 0 0 0 2 7 1 19 1 9 2 7 1 88 1 14 3 3 1 35 20 1 3 1 1,01 0,00 0,00 6,06 0,00 5,05 0,00 2,02 0,00 24,24 1,01 7,07 1,01 1,01 0,00 21,21 0,00 0,00 0,00 0,00 0,00 3,77 0,63 3,77 0,00 2,52 0,63 1,89 0,00 30,19 0,00 3,77 1,26 1,26 0,63 1,89 9,43 0,63 1,89 0,63 1,67 1,67 0,00 11,67 1,67 0,00 1,67 3,33 1,67 26,67 0,00 1,67 0,00 0,00 0,00 18,33 8,33 0,00 0,00 0,00 0,63 2,20 0,31 5,97 0,31 2,83 0,63 2,20 0,31 27,67 0,31 4,40 0,94 0,94 0,31 11,01 6,29 0,31 0,94 0,31 53 QQDD Universitaria Vaquero 16 0 0 TOTAL 99 16,16 0,00 0,00 100,0 0 28 1 1 15 9 17,61 0,63 0,63 100,0 0 10 16,67 54 0 0,00 1 0 0,00 1 100,0 31 60 0 8 16,98 0,31 0,31 100,0 0 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 54 GRÁFICO N° 5. POSITIVOS CON LEISHMANIASIS, SEGÚN OCUPACIÓN. PERÍODO 2009-2011 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 55 Análisis y discusión: se observan los casos positivos de Leishmaniasis en pacientes atendidos en las Unidades de Salud de Santo Domingo según ocupación, obteniéndose en el período de estudio que mayormente fueron en los estudiantes con 27,67%, agricultor 12,26%, Quehaceres domésticos (QQDD) con 16,98%, niños con 6,29% (infantes), Jornalero con 4,40%, entre otros; cabe indicar que concuerda con preferencia en las personas que están en un entorno familiar y vínculo con la naturaleza. TABLA N° 7. POSITIVOS CON LEISHMANIASIS, SEGÚN SITIO DE LESIÓN Y AÑOS DE ESTUDIO 2009 SITIO DE No. % LESIÓN 2010 2011 PERÍODO No. % No. % No. % Cabeza 30 30,30 41 25,79 13 21,67 84 26,42 Tronco 5 5,05 16 10,06 4 6,67 25 7,86 Extremidades 64 64,65 102 64,15 43 71,67 209 65,72 100,00 159 100,00 60 100,00 318 100,00 TOTAL 99 Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz 56 GRÁFICO 6. POSITIVOS CON LEISHMANIASIS, SEGÚN SITIO DE LESIÓN Y AÑOS DE ESTUDIO Fuente: Estadística Dirección Salud Santo Domingo de los Tsáchilas. Elaborado: Dra. Angela Díaz Análisis y discusión: se observan los casos positivos de Leishmaniasis según el sitio de lesión, obteniéndose en el período de estudio que mayormente fue en las extremidades con 65,72%, seguido de la cabeza con 26,42%; esto expresa que los sitios de las lesiones observados son brazos, manos, piernas, pies, cara y cuello que enuncia los sitios del cuerpo humano que están el mayor tiempo descubiertos. 57 4.3 PLAN DE ACCION EN MEDIDAS DE PREVENCIÓN CONTRA LA LEISHMANIASIS Antecedentes. En el mundo aproximadamente alrededor de 350 millones están considerados en riesgo de infectarse y enfermar. Cada año, un estimado de 1.5 a 2 millones de niños y adultos desarrollan los síntomas de la enfermedad (forma cutánea y mucocutánea 1-1,5 millones; forma visceral 0,5 millones), y la incidencia de la infección es mayor cuando se presentan otras infecciones. La Leishmaniasis se asocia con unos 2,4 millones de personas con discapacidad y alrededor de 70 mil muertes por año. (36) La distribución de la Leishmaniasis es mundial y se ha informado de casos de Leishmaniasis en todos los continentes, a excepción de Australia y la Antártida. En los países de América, la enfermedad puede encontrarse en México y Suramérica. A su vez, esta enfermedad presenta mayor transmisión durante las épocas de lluvia en países como el Ecuador. Cabe indicar, que se ha observado el incremento de la incidencia de casos sospechosos de Leishmaniasis en estos últimos años que son atendidos en la red de Unidades de Salud del Ministerio de Salud Pública en Santo Domingo; por lo que es importante realizar un Plan de Acción como herramienta a través de la cual se integre la actividad preventiva de riesgos. Objetivo general Proponer recomendaciones de prevención contra la Leishmaniasis para los pacientes que acuden a la Red de Salud del MSP de la ciudad de Santo Domingo, y comunidad, con la finalidad de proteger a la población y combatir la enfermedad. 58 Objetivo específicos Impartir los conocimientos necesarios sobre la Leishmaniasis en los pacientes que acuden a las Unidades de Salud del MSP. y comunidad a través de casa abierta, conferencias y talleres, para que impulse cambios de comportamientos para combatir la enfermedad. Promover la prevención de la Leishmaniasis, contribuyendo con información, educación para la salud de las personas, a través de conversatorios, exposiciones y talleres para que aprendan como prevenir la enfermedad, mejorando las condiciones de autocuidado y autoprotección 59 OBJETIVO Impartir los conocimientos necesarios sobre la Leishmaniasis para combatir esta enfermedad. 60 ACTIVIDAD Educación a la población respecto a los modos de transmisión, factores de riesgos de la Leishmaniasis. TAREAS METODOLOGIA SEM ANA SEM 1 ANA 2SEM ANA 3SEM ANA 4SEM ANA 5SEM ANA 6 Cronograma de actividades Colocación de stand con temas relacionados Realización de casa a síntomas, formas de abierta con contagio, factores de exposición del tema riesgo, prevención, de Leishmaniasis tratamientos de Leishmaniasis entre otros Enseñanza y educación de formas Conferencia y fórum de trasmisión de la de preguntas y enfermedad y como respuestas evitarlas Charlas sobre factores de riesgo y Exposición, análisis y posibles discusión del tema consecuencias Promover la prevención de la Leishmaniasis contribuyendo con información, educación para la salud de las personas, para que aprendan como prevenir la enfermedad. Aprender comportamientos que favorezca la salud, que permitan concienciar a la población, el porqué es necesario medidas de autocuidado Enseñar comportamiento que favorezca la salud y evitar la Leishmaniasis. Exposición sobre la enfermedad. Se trabajara con tarjetas Conversatorios e de preguntas de la ilustración sobre comunidad para dar medidas de respuestas a las autocuidado inquietudes relacionadas al tema de Leishmaniasis. Enseñanzas sobre Exposiciones con autoprotección folletería en sala de utilizando métodos esperas de las unidades de barrera, que de salud, visitas protejan piel de domiciliarias y en las sitios como escuelas con grupos extremidades y de teatros cabeza 61 Brindar a la comunidad el conocimiento necesario para que aprendan como prevenir la enfermedad 62 Conferencia y taller con preguntas y respuestas donde se trate problemas de los Orientaciones de participantes. Se recomendaciones de trabajara en grupo, medidas preventivas discutirán y analizaran los hábitos que tienen en su familia y se dará las alternativas para cambiarlos. Grupos de interés La importancia de las medidas preventivas radica en el conocimiento de la población objeto que haya recibido la capacitación respectiva y en especial de los sitios de riesgos identificados como de transmisión; para ello, se ha visualizado los diferentes grupos de interés, los mismos que son: Personas dedicadas a labores de quehaceres domésticos y niños que acuden a las Unidades de Salud del MSP., y en las escuelas. Personas que trabajen con énfasis en actividades agrícolas y jornaleros. Personas en el cual sus labores las realizan en el inicio de la etapa lluviosa. Al público en general que asiste a las Unidades de Salud de la Red pública de la Dirección Provincial de Santo Domingo de los Tsáchilas por atención médica. 63 5. CONCLUSIONES Y RECOMENDACIONES 5.1 CONCLUSIONES De las 3803 atenciones realizadas en el período 2009 -2011 con problemas de tipo dérmico se determinaron con diagnóstico positivo para Leishmaniasis 318 pacientes que corresponde al 3,8%; y de estos casos en el período de estudio, se determinó que hubo una diferencia ligeramente significativa en cuanto en el sexo masculino, que quizás sea por el tipo de ocupación propia en la zona. Además, el grupo mayormente afectado fue de 15 a 44 años con el 40,25%, seguido del grupo de 5 a 14 años con el 23,27% pero se presenta en toda edad. En cuanto a la presentación de la enfermedad en el tiempo, y se observó que hacia finales e inicio del siguiente año es el período de mayor contagio que concuerda con el inicio de la época invernal donde las condiciones ambientales favorecen la transmisión. De acuerdo a la procedencia, el sitio de procedencia fue de Alluriquín con 17,30%, seguido de Santo Domingo con 9,75%, Chiguilpe con 8,81%, Abraham Calazacón con 6,92%, Valle hermoso 5,35% entre otros, es decir de las áreas rurales aledañas al cantón Santo Domingo. Según ocupación, mayormente fueron en los estudiantes con 27,67%, agricultor 12,26%, Quehaceres domésticos (QQDD) con 16,98%, niños o infantes, Jornalero, que coincide con las personas que están en un ambiente familiar y junto a la naturaleza. En lo que respecta al sitio de lesión, mayormente fueron las extremidades con 65,72%, seguido de la cabeza, que muestra que 64 son áreas del cuerpo expuestas y el mayor tiempo están descubiertas. Se concluye que la prevalencia de Leishmaniasis en Santo Domingo de los Tsáchilas en los pacientes atendidos en las Unidades de Salud de la Red Pública de Santo Domingo de los Tsáchilas durante el período del 2009 al 2011 es de aproximadamente del 4%, que no es significativo de acuerdo a la hipótesis planteada en esta investigación. 5.2 RECOMENDACIONES Es de conocimiento que la Leishmaniasis es una enfermedad de transmisión vectorial con amplio espectro clínico e importante diversidad epidemiológica y su presencia está directamente vinculada a la pobreza, pero otros factores sociales además de los ambientales y climáticos, influyen directamente en su comportamiento, por lo que es importante continuar con investigaciones en los sitios de mayor transmisión encontrados en Santo Domingo. El diagnóstico temprano de la enfermedad es la herramienta fundamental ya permite instaurar el tratamiento específico lo más pronto posible y así controlar su evolución, aliviar los signos y síntomas y mejorar la calidad de vida de los pacientes quienes están expuestos a complicaciones o a desfiguración y un gran estigma social por las secuelas físicas y sicológicas que puede causar la Leishmaniasis mucocutánea. Las instrumentos de prevención y control disponibles en la actualidad son limitadas, por lo que es trascendental que las personas que están expuestas en especial de las áreas rurales estén involucradas en la realización de acciones para reducir el contacto entre el humano y el vector. 65 6. BIBLIOGRAFÍA 1. Abbas, A., Lichtman, A., & Pillai, S. (2012). Inmunología celular y molecular. Madrid, 7: ELSEVIER. 2. Amano, Y., & Díaz, L. (2012). Introducción a la Microscopía Electrónica. Principios – Aplicaciones, INH y MT “LIP”, 2, 22. 3. Ampuero, J. (2000). Leishmaniasis. Serie de documentos técnicos. No 8. Lima. 4. Aparicio, M. (2000). Estudio de la vulnerabilidad y adaptación de la salud humana ante los efectos del cambio climático en Bolivia. MDSP. La Paz, 92. 5. Ash, L., & Oriehel, T. (2000). Atlas de Parasitología Humana. 5ta ed. Buenos Aires: Panamericana. 6. Asilian, A., Jalayer, T., Nilforoosshzadeh, E., Ghassemi, R., Peto, R., & Wayling, S. (2003). Treatment of cutaneous Leishmaniasis with aminoside (paramomycin) ointment: double- blind, randomized trial in the Islamic Republic of Iran. Bulletin of the World Health Organization, 81, 353 - 9. 7. Ashford, R. (2000). The Leishmaniases as emerging and reemerging zoonoses. Int. J. Parasitol, 30, 1269-81. 8. Ausina, V., & Moreno, S. (2006). Tratado SEIMC de enfermedades Infecciosas y Microbiología clínica. 1ed. Madrid: Panamericana. 66 9. Atías, A. (2005). Parasitología Médica 3ra ed. Santiago: MEDITERRANEO. 10. Becerril, M. (2008). Parasitología Médica. 2da ed. México D.F: Mc Graw-Hill Interamericana. 11. Becerril, M., & Romero, R. (2004). Parasitología Médica de las moléculas a la enfermedad. 1ra ed. México D.F: Mc Graw-Hill Interamericana. 12. Boletín epidemiológico de México. (2011, Diciembre 15). Sistema Nacional de vigilancia epidemiológica, 50 (28). Extraido el 14 de Septiembre del 2012, desde http:// www.dgepi.salud.gob.mx/boletin. 13. Brooks, G., Butel, J., & Morse, S. (2000). Microbiología Médica de Jawetz, Melneck y Adelberg. 16va ed. México D.F.: Manual Moderno. 14. Calero, G., & Zuñiga, R., (2006). Leishmaniasis en el Ecuador experiencias clínicas y terapéuticas. Rev. Cient. Derm, (3), 1-6. 15. Chongo, M., & García, R., (2010, Agosto 10). Leishmaniasis y transfusión, 3 (1), 6 – 12. Extraído el 28 de Febrero del 2013 desde http//www.medigraphic.com/pdfs 16. Chiliquinga, F., & Castro, J. (2012). Determinación de vectores de Leishmania ssp en la provincia de Bolívar. Universidad. Estatal de Bolívar. (Tesis de Grado). 67 17. Cooper, M. (2002). La Célula. Replicación, mantenimiento y reorganización del ADN genómico, 2da edición. Madrid: MARBAN, (5), 211. 18. Cuba, C. (2000). Diagnóstico parasitológico de la Leishmaniasis tegumentaria americana. Rev. Med. Exp. (17), 39 – 49. 19. Dirección Provincial de Salud de Santo Domingo de los Tsáchilas. (2013). Reporte Médico – Epidemiológico. 20. Dey, A. Singh, & S. 2006. Transfusion transmitted leishmniasis: a case report and Review of literatura. Ind J. Med. Micro, 24 (3), 165 – 70. Pubmed: 16912434. 21. El Ministerio de Salud Pública del Ecuador. (2013). Proceso Control y Mejoramiento de la Salud Pública. Subproceso de Epidemiologia. Leishmaniasis en el Ecuador. 22. Fernández, T. (2011). Medicina Tropical. Patologías tropicales: aspectos científicos, sociales y preventivos. 3ra ed. Universidad de Guayaquil, SENACYT, FUNDACYT. 23. Flisser, A., & Pérez – Tamayo, R. (2006). Leishmaniasis. Aprendizaje de la parasitología basada en problemas. (41), 394 - 409. 24. Guerrat, R., Walker, D., & Weller, P. (2003). Enfermedades Infecciosas Tropicales. 1ra ed. Madrid: ELSEVIER-SCIENCE. 25. Hashiguchi, Y., & Gómez, E. (1997). Estudios sobre la Leishmaniasis en el Nuevo Mundo y su Transmisión con 68 especial referencia al Ecuador. Serie de reportes de Investigación. No. 3. 26. Hashiguchi, Y., & Gómez, E. 1996. Estudios sobre la Leishmaniasis en el Nuevo Mundo y su Transmisión con especial referencia al Ecuador. Serie de reportes de Investigación. No. 2. 27. Información Científica Dermatológica. (1997). Las Leishmaniasis en Perú. Folia Dermatológica Peruana.; 8 (2), 12 - 14 28. Informe de un Comité de expertos de la OMS. (1990). Lucha contra la Leishmaniasis. Ginebra, Organización Mundial de la Salud, (OMS, Serie de Informes Técnicos, Nº 793). 29. Joklik, W., Willet, H., & AMOS B. (1999). Microbiología de Zinsser. 20va ed. Buenos Aires: Panamericana. 30. Madigan M. Martino J., & Parker J. (2005). Biología de los Microorganismos de Brock. 10 ma ed. Madrid: PEARSON, Prentice Hall. 31. Markell, E., Voge, M., & John, D. 1990. Parasitología Médica. 6ta ed. Madrid: Interamericana Mc Graw-Hill. 32. Medlineplus. (2013, Marzo 22). LEISHMANIASIS. (1), 1 - 4. Extraído 25 de Marzo del 2013, desde http:// www.nlm.nih.gov/medlineplus/spanish/ency. 33. Ministerio de Salud Pública de Paraguay. (2011). Manual de Diagnóstico y Tratamiento de Leishmaniosis en Paraguay. 69 34. Ministerio de Salud del Perú. (2000). Oficina General de Epidemiología. Módulos Técnicos. Serie de Monografías. Leishmaniasis. Lima, 8 - 83. 35. Murray, H., Berman, J., Davies, C., & Saravia N. (2005). Advances in Leishmaniasis. Rev. Lancet. 366 (1), 156177. Pubmed: 16257344. 36. OPS/OMS. (2011, Octubre 10). Leishmaniasis en las Américas: Situación actual y desafíos para el control. Extraído 12 de marzo del 2012, desde http:// www.slideshare.net/.../Leishmaniasis-en-las-amricassituacion-actual. 37. OPS, OMS, MSP, Instituto Nacional de Salud de Colombia. (2001, Noviembre 10). Leishmania. Sistema nacional de vigilancia en Salud Pública. 45 (1). Extraído el 28 de Marzo del 2013, desde http://www.col.opsoms.org/sivigila/2001/BOLE45_2001.htm 38. Organización Mundial de la Salud (OMS). (2009). Leishmania/HIV co-infection in south-western Europe. 1 – 12. Extraído el 25 Enero del 2013, desde http:// www.who.int/emcdocuments/Leishmaniasis/docs/ wholeish200042.pdf 39. Organización Mundial de la Salud. (2006). Control de la Leishmaniasis. Informe del Consejo Ejecutivo 118ª reunión Punto 5.1 del orden del día provisional, 11 de mayo de 2006 40. Palomeque, J., León, H., & Beltran E. (2004 Julio 8). Leishmania y Chagas. MSP, Direcc. Prov de Salud del Oro, OPS. Machala. 70 41. Provincia de Santo Domingo de los Tsáchilas. (2012 Marzo 18). Extraído el 8 de Marzo del 2013, desde Http//es.wikipedia.org /.../ Provincia_de_Santo_Domingo_de_los_Tsáchilas 42. Regueiro, J., López, C., González, S., & Martínez, E. (2002). La inmunidad en acción frente a virus, bacterias, hongos y parásitos. Inflamación. Inmunología, Biología y Patología del Sistema Inmune. Madrid: Panamericana, 127 – 134. 43. Restrepo, A., Robledo, J., Leiderman, E., Restrepo, M., Botero, D., & Bedoya, V. 2003. Enfermedades Infecciosas. Fundamentos de Medicina. 6ta ed. Medellín: Corporación para Investigaciones Biológicas. 44. Rodríguez N. (2009). Factores de virulencia de Leishmania y su relación con el desarrollo de la Leishmaniasis. Revista de Dermatología Venezolana, 41 (3), 1 – 7. Extraído el 25 Ene. 2013, desde http://en: svdcd.org.ve/revista/2003/41/3/DV-3-03-Rev-Leishmaniaw.pdf 45. Romero, P., & Sánchez, J. (2007). Una mirada a la epidemiología y al control de la Leishmaniasis zoonótica en Colombia. Biosalud, (6), 99 - 111. 46. Sáenz, E., & Chávez, M. (2004). Leishmaniasis en el Hospital Militar Central: Estudio clínico-epidemiológico. Revista de Dermatología. Perú, (14), 110 – 20. 47. Sánchez, L., Sáenz, E., Pancorbo, J. Zegarra, R., Garcés, N., & Regis, A. (2004). Leishmaniasis. Rev. Derm. Perú, 14 (2), 85-86 71 48. Sánchez, L., Sáenz, E., Pancorbo, J., Zegarra, R., Garcés, N., & Regis, A. (2004 Agosto). Leishmaniasis. Revista Dermatol. Peru, 14 (2). Extraído el 28 de Marzo del 2013 desde http://revistas.concytec.gob.pe/scielo.php?pid 49. Sánchez, L., Sáenz E., Pancorbo, J., Zegarra, R., Garcés, N., & Regis A. (2004). Leishmaniasis. Dermatol. Peru. 14 (3). Extraído el 29 de Marzo del 2013 desde http://revistas.concytec.gob.pe/scielo.php?pid 50. Uribarren, T. (2012 Septiembre 8). Leishmaniosis o Leishmaniasis. Universidad Autónoma de México, UNAM, 1 - 3. Extraído el 25 Feb. 2013], desde http:// www.facmed.unam.mx/deptos/microbiologia/parasitologia /leishmaniosis.html 51. Vidyashankar, C., & Noel, G. (2002). Leishmaniasis. Rev. Medicine Journal. 2002, 3 (1), 1 - 19. 52. Wallace, P., & Geoffrey, P. (2008). Atlas de Medicina Tropical y Parasitología. 6ta ed. Londres: ELSEVIER MOSBY. 53. Willey, J., Sherwood, L., & Woolverton, C. (2009). Microbiología de Prescott, Harley y klein. 7ma ed. Madrid: Mc Graw-Hill-Interamericana. 54. Winn, W., & Allen S. 2008. Diagnóstico microbiológico. 6ta ed. Madrid: Panamericana. 55. World Health Organization. (2005). Division of Control of Tropical diseases. Leishmaniasis control. Extraído el 5 de Febrero del 2013, desde http://www.who.int/healthtopics/Leishmaniasis.htm. 72 7. ANEXOS ANEXO 1. CARTA DE ACEPTACIÓN DEL LA DIRECCIÓN PROVINCIA DE SALUD DE SANTO DOMINGO DE LOS TSÁCHILAS. Santo Domingo, 14 de febrero de 2013. Sr. Dra. Kathya Tinizaray DIRECTORA PROVINCIAL DE SALUD STO. DGO. DE LOS TSÁCHILAS Ciudad. De mi consideración: Reciba un cordial saludo y a la vez solicito de la manera más comedida se digne autorizar a los señores profesionales de Epidemiología y Estadísticas de la Dirección Provincial de Salud de Santo Domingo de Tsáchilas, su colaboración para el levantamiento de la información de Leishmaniasis por motivo de la realización de mi Tesis de Grado, cuyo tema es: “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” Por la atención que brinde a la presente, quedo de usted muy agradecida. Atentamente, Dra. Angela Díaz Cárdenas 73 ANEXO 2. FICHA DE RECOLECCIÓN DE DATOS. “PREVALENCIA Y FACTORES DE RIESGOS DE LEISHMANIASIS EN PACIENTES ATENDIDOS EN LAS UNIDADES DE SALUD DE SANTO DOMINGO DE LOS TSÁCHILAS. 2009 – 2011” Área: No……………………........Código:……………………………… … Procedencia:……………………………………………………… ………… Sexo:……………………………...Edad:………………………… ………... Ocupación: Agropecuario Comerciante Quehaceres domésticos Estudiantes Jornaleros Artesanos Choferes Otros Instrucción:…………………………….. Datos clínicos:…………………………………………………………… 74 …………………………………………………………………… ……… …………………………………………………………………… ……… Diagnóstico:……………………………………………………… ……… Tipo de lesión: Cutánea Mucosa Cutánea mucosa Visceral Papular Verrugosa Otros Tratamiento:……………………………………………………… ……… Antecedentes de la Persona: Se ha trasladado a otros sitios: SI NO ¿Dónde?............................................................................................ .................. Presencia de Factores de Riesgo. 75 Vive en ambiente silvestre: SI ___ NO ___ Existen reservorios: (especifique) Existen mosquitos: Cuál?: (especifique) Otros:…………………….……………………………………… …………………………. ………………………………………….. Responsable Fecha:…………………………………. 76