TIPOS DE ENLACE
Anuncio

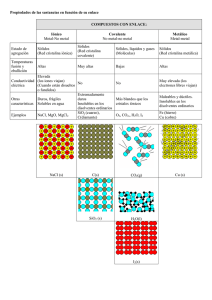
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace. Los tipos fundamentales de enlace son el iónico, el covalente y el metálico. A continuación se describen cada uno de los tipos de enlace y sus características principales. Enlace iónico El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo). Un ejemplo de sustancia con enlace iónico es el cloruro sódico; de esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Otro ejemplo es Enlace covalente En química, las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten un electrón, es decir se unen por uno de sus electrones del último orbital, el cual depende del número atómico del átomo en cuestión. Fuerzas intermoleculares A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas de inducción (ion o dipolo permanente producen en una molécula no polar una separación de cargas por el fenómeno de inducción electrostática) y fuerzas de dispersión (aparecen en tres moléculas no polares). Propiedades de los compuestos covalentes Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles fuerzas de cohesión. La mayor parte de las sustancias covalentes, a temperatura ambiente, son gases o líquidos de punto de ebullición bajo (por ejemplo el agua). En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes no polares y no lo son en disolventes polares. Se conocen algunos sólidos covalentes prácticamente infusibles e insolubles, que son excepción al comportamiento general descrito. Un ejemplo de ellos es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los átomos que las forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red es necesario romper estos enlaces, los cual consume enormes cantidades de energía ENLACE METÁLICO El enlace metálico es el que mantiene unidos los átomos de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos con otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales de tres tipos principalmente: 1. 1. Cúbica centrada en las caras o red cúbica compacta (Cu, Ag, Au, Pt, etc.) 2. 2. Hexagonal compacta (Mg, Zn, Cd, etc). 3. 3. Cúbica centrada en el cuerpo (metales alcalinos), Las propiedades físicas de los metales son muy diferentes a las de los demás compuestos y la teoría que intente explicar este enlace deberá dar también cumplidas respuestas a todas estas características especiales. Estas son: 1. Estado natural. Aunque en general todos son sólidos a temperatura ambiente, excepto el mercurio, sus puntos de fusión y de ebullición varían notablemente. Son duros, cuanto más compacta sea su estructura, mayor es sus dureza y sus puntos de fusión y de ebullición. 2. Conductividad. Las conductividades térmicas y eléctricas son muy elevadas, lo que sugiere una estructura de electrones muy libres, con gran facilidad de movimiento. 3. Brillo metálico. Los metales con sus superficies pulidas no absorben prácticamente la luz, sino que la reflejan, de ahí su color plateado; existen unos pocos que sí absorben alguna radiación, por lo que reflejan el color complementario al absorbido. Oro-Amarillo, Cobre-Rojizo. 4. Ductilidad y maleabilidad. Son fácilmente maleables debido a que cualquier plano del cristal puede deslizarse sobre otro plano, y los electrones deslocalizados evitan que aparezcan fuerzas repulsivas como sucedía con los cristales iónicos. 5. Emisión de electrones. Debido a la libertad que gozan los electrones de valencia dentro de la estructura cristalina, es muy fácil arrancarlos aportando una cantidad de energía no muy elevada como la que proporciona un haz de luz (efecto fotoeléctrico), o la que proporciona el calor (efecto termoiónico). 6. Densos. Excepto los alcalinos. 7. Altos puntos de fusión y de ebullición. Excepto el mercurio. 8. Insolubles en agua y en disolventes orgánicos. Algunos reaccionan con el agua y desprenden hidrógeno. Tipo de enlace Tipo de estructura Ejemplo de estructura Propiedades características Cloruro de potasio, KCl Sólidos cristalinos. Puntos de fusión elevados. Puntos de ebullición elevados. Solubles en agua. Conducen la electricidad fundidos o en disolución. No conducen la electricidad en estado sólido. Metano, CH4 Fundamentalmente líquidos y gases. Puntos de fusión bajos. Puntos de ebullición bajos. Insolubles en agua. No conducen la electricidad. Enlace iónico Red iónica Ejemplo: KCl Enlace covalente Moléculas simples Ejemplo: CH4 Moléculas gigantes Ejemplo: C Diamante, C Sólidos. Puntos de fusión elevados. Puntos de ebullición elevados. La solubilidad y conductividad varían de una sustancia a otra. Enlace metálico Red metálica Plata, Ag Sólidos cristalinos. Puntos de fusión elevados. Puntos de ebullición elevados. Insolubles en agua. Dúctiles y maleables. Ejemplo: Ag Esta Tabla Ejemplifica Los Tipos De Enlace 1. Enlace covalente, extraído desde http://es.wikipedia.org/wiki/Enlace_covalente 2. Enlace iónico, extraído desde http://quimera.ugto.mx/imagenes.html 3. Enlace metálico, extraído desde http://pagina.jccm.es/edu/ies/joseisbert/Pagina%20Carmen%20Lopez%20Garcia/E NLACE%20METALICO.htm 4. Enlace Covalente, extraído dede http://www.textoscientificos.com/quimica/enlaces