QUÍMICA I
Anuncio

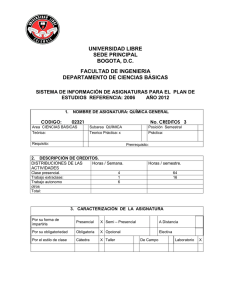
QUÍMICA I Septiembre 2011 EDUCACIÓN (Mención Biología y Química) EB003 Teoría: 2H/S Práctica: 2H/S Taller: 0H/S Créditos: 6 Año: III RELACION CON OTRAS MATERIAS: Cálculo I, Física I, Laboratorio de Química, Química II, Química Orgánica y Bioquímica. JUSTIFICACIÓN El educador en el área de química, en su labor de despertar en el alumno la curiosidad y el asombro por todo cuanto le rodea, ha de poseer un conocimiento amplio de los fenómenos naturales y los materiales, para poder sobrevivir en él y mejorar su calidad de vida. Los procesos tecnológicos y científicos desarrollados en los últimos años, hacen cada vez más evidente la necesidad del estudio de la química como una ciencia vital. Para ello, la química viene a posicionarse como una de las bases de todas las demás ciencias naturales, ya que se basa en el estudio de la materia, su composición y transformación; así como también las leyes que rigen estos cambios. MARCO CONCEPTUAL La química puede definirse como la ciencia que investiga a la materia, su composición y transformación. Las evidentes conexiones entre campos científicos, tales como la fisicoquímica, electroquímica, la bioquímica, la termodinámica y termoquímica entre otros, hacen que esta definición tenga un carácter amplio. Dentro de este mundo de los fenómenos naturales y los materiales; las matemáticas juegan un papel fundamental como instrumento para cuantificar y, en consecuencia, comparar los diferentes valores y magnitudes asociados a cada uno de ellos, así como para derivar relaciones experimentales que los describan con exactitud. En esta materia se trata de integrar conceptos básicos, como nomenclatura, estequiometría, estructura atómica y concentración de soluciones, que proporcionan los antecedentes necesarios para muchos de los experimentos y problemas a resolver. OBJETIVOS Fomentar en el estudiante el desarrollo de una actitud positiva hacia la actividad científica. Capacitar al estudiante con el conocimiento básico de la química que le permita desarrollar una actitud crítica hacia los materiales de su entorno y su consumo. Promover los valores del progreso científico y tecnológico, y de la educación en ciencias, para permitir la formación de ciudadanos capaces de participar en el desarrollo de su propia sociedad tecno-científica. Enseñar al estudiante las leyes fundamentales en que se sustentan las diferentes ramas de la química y sus campos de aplicación. Desarrollar competencias en: el manejo de la nomenclatura de los diversos compuestos químicos y en la resolución de problemas relacionados con la estequiometría y reacciones químicas. Enfatizar el carácter interdisciplinar de la química y la utilidad de su conocimiento para la formación personal y el ejercicio de la profesión. Semana/Fecha 1 (4-10-10) 2-4 (11,18 y 25/10/10) 5-7 (1-8 y 15/11/10) 8-9-10 (22 y 29 /11; 6/12/10) 11 (13/12/10) 12-14 (03-10 y 17/01/11) 15-17 (24-31/01; 07/02//11) 18-20 (14,21 y 28/02/11) 21-22 1 Contenido Introducción. Entrega del contenido programático y explicación del método de evaluación. UNIDAD I Materia y Energía: Materia-Estados. Elementos y compuestos. Sustancias puras y mezclas. Propiedades características de las sustancias. Ley de conservación de la masa y Ley de la conservación de energía UNIDAD II Estructura electrónica de los átomos: átomos, moléculas y iones. Modelos atómicos. Teoría atómica de la materia. Naturaleza ondulatoria de la luz. Energía cuantizada y fotones. Modelo de Bohr del átomo de hidrógeno. El comportamiento ondulatorio de la materia. Mecánica cuántica y orbitales atómicos. Descripción del átomo según la mecánica cuántica. Números cuánticos. Orbitales atómicos. Representaciones de orbitales. Configuraciones electrónicas UNIDAD III Nomenclatura: Moléculas y compuestos moleculares. Iones y compuestos iónicos. Nombre de los compuestos inorgánicos. Metodología didáctica1 y evaluación2 Investigación Prueba Corta (25/10/10) Investigación Bibliografía Burns pp. 19-41 Chang pp. 2-28 Burns pp. 83-118 121-159 Chang pp. 36-45 Investigación Prueba Corta (22/11/10) 1er. Examen Parcial VACACIONES DE NAVIDAD (17/12/10 al 03/01/11) UNIDAD IV La tabla periódica: Propiedades periódicas de los elementos. Desarrollo de la tabla periódica. Capas de electrones y tamaño de los átomos. Afinidades electrónicas. Metales, no metales y metaloides. Tendencias de grupo de metales activos. Tendencia de grupo de no metales selectos UNIDAD V Enlaces Químicos: Enlaces iónicos, enlaces covalentes. Electronegatividad. Enlaces covalentes polares. Enlaces metálicos. Conductividad, solubilidad. La forma de las moléculas. Estructuras moleculares y tabla periódica. Nombres, fórmulas y usos de compuestos inorgánicos Investigación Burns pp.161-189 Chang pp. 46-50 Investigación Prueba Corta (24/01/11) Burns pp.191-223 225-252 UNIDAD VI Reacciones acuosas y soluciones. Cantidades Químicas. Composición de soluciones. Propiedades de solutos en solución acuosa. Ácidos, bases y sales. Reacciones de óxido-reducción. Balanceo de ecuaciones de óxido reducción. Investigación Burns pp.255-280 283-305 UNIDAD VII Investigación Explicación por parte del profesor, investigación por parte de los alumnos, desarrollo de ejercicios y problemas. La evaluación de la materia estará compuesta de una nota previa (70%) y un examen final (30%). A su vez, la nota previa quedará constituida por 3 exámenes parciales, de 20% cada uno, el promedio de las pruebas cortas realizadas durante el año, con un valor de 30% y el promedio de las investigaciones realizadas durante el año, con un valor de 10% 2 (07,14/03/11) Semana/Fecha 23 (21/03/11) 24-26 (28/03; 04,25/04/11) 27-28 (02,09/05/11) 29-30 (16,23/05/11) Estequiometría y ecuaciones químicas: Ecuaciones Químicas. Pesos atómicos y moleculares. El mol. Fórmulas empíricas. Reactivo limitante. Rendimiento teórico Contenido 2do. examen parcial UNIDAD VIII Equilibrio químico: Concepto de equilibrio. La constante de equilibrio. Equilibrio heterogéneo. Cálculo de constantes de equilibrio. El Principio de Le Chatelier UNIDAD IX Gases: Características de los gases. Presión. Las leyes de los gases. La ecuación del gas ideal. Mezcla de gases y presiones parciales. Teoría cinética molecular UNIDAD X Fuerzas intermoleculares, líquidos y sólidos: Comparación molecular de líquidos y sólidos. Fuerzas intermoleculares. Cambios de fase. Presión de vapor. 31-32 (30/05; 06/06/11) UNIDAD XI Cinética química: Velocidades de reacción. Dependencia de la velocidad con la concentración. El cambio de la concentración con el tiempo. Temperatura y velocidad. Mecanismos de reacción. Catálisis. 33 (13/06/11) 34 (20/06/11) 35 (27/06/11) 3er. Examen parcial Prueba Corta (07/03/11) Metodología didáctica3 y evaluación4 Investigación Prueba Corta (02/05/11) Investigación Investigación Prueba corta (30/05/11) Bibliografía Brown Bursten Le May pp. 343-366 Brown Bursten Le May pp. 383-401 Brown Bursten Le May pp. 492-522 REPASO EXAMEN FINAL BIBLIOGRAFÍA BROWN, LE MAY, BURSTEN: Química, la ciencia central. 7ma. Edición. México 1998. Prentice-Hall Hispanoamericana. CHANG, Raymond: Química. 7ma. Edición. 2002. Editorial Mc.Graw Hill. SCHAUM´S: 3000 solved problems in Chemistry. 1988. Mc.Graw Hill. MORTIMER, Charles: Química. Grupo Editorial Iberoamericana. México 1983. BRADY, James; HUMISTON, Gerard: Química Básica BURNS, Ralph: Fundamentos de Química. México 1996. Prentice-Hall Hispanoamericana. Nombre de los elaboradores: Froila Degwitz; Debbie de Carrera 3 Explicación por parte del profesor, intervención de los alumnos, desarrollo de ejercicios y problemas. La evaluación de la materia estará compuesta de una nota previa (70%) y un examen final (30%). A su vez, la nota previa quedará constituida por 3 exámenes parciales, de 25% cada uno y el promedio de las pruebas cortas realizadas durante el año, con un valor de 25%. 4