Química “El magnesio: un importante elemento” Nombre del alumno/a:
Anuncio
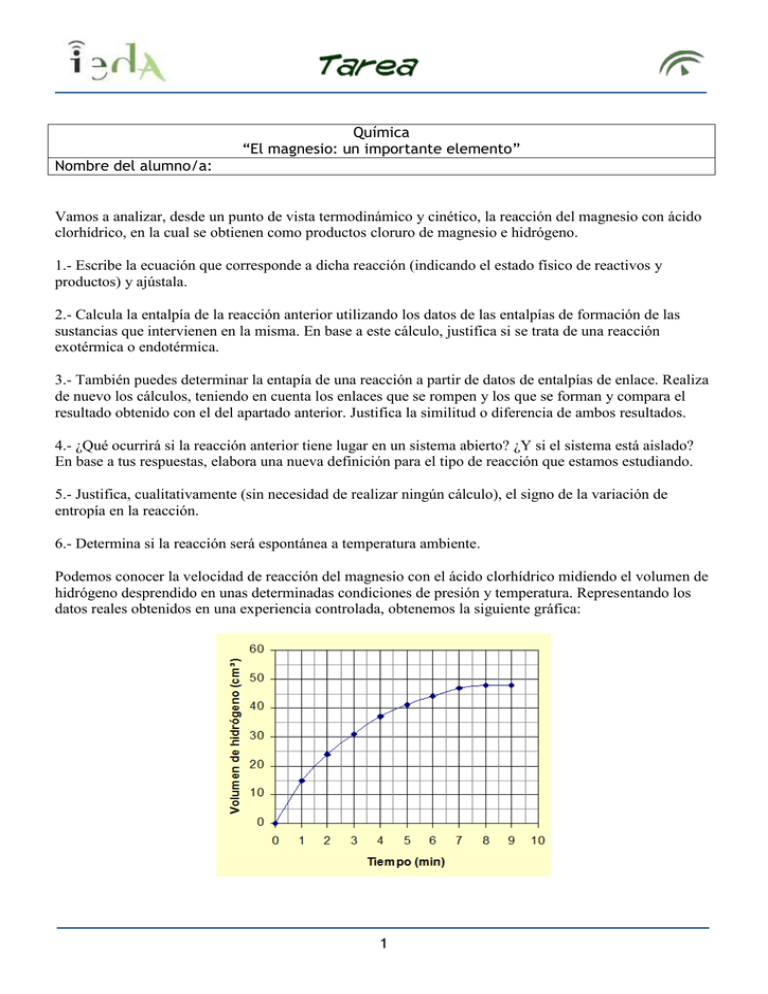
Química “El magnesio: un importante elemento” Nombre del alumno/a: Vamos a analizar, desde un punto de vista termodinámico y cinético, la reacción del magnesio con ácido clorhídrico, en la cual se obtienen como productos cloruro de magnesio e hidrógeno. 1.- Escribe la ecuación que corresponde a dicha reacción (indicando el estado físico de reactivos y productos) y ajústala. 2.- Calcula la entalpía de la reacción anterior utilizando los datos de las entalpías de formación de las sustancias que intervienen en la misma. En base a este cálculo, justifica si se trata de una reacción exotérmica o endotérmica. 3.- También puedes determinar la entapía de una reacción a partir de datos de entalpías de enlace. Realiza de nuevo los cálculos, teniendo en cuenta los enlaces que se rompen y los que se forman y compara el resultado obtenido con el del apartado anterior. Justifica la similitud o diferencia de ambos resultados. 4.- ¿Qué ocurrirá si la reacción anterior tiene lugar en un sistema abierto? ¿Y si el sistema está aislado? En base a tus respuestas, elabora una nueva definición para el tipo de reacción que estamos estudiando. 5.- Justifica, cualitativamente (sin necesidad de realizar ningún cálculo), el signo de la variación de entropía en la reacción. 6.- Determina si la reacción será espontánea a temperatura ambiente. Podemos conocer la velocidad de reacción del magnesio con el ácido clorhídrico midiendo el volumen de hidrógeno desprendido en unas determinadas condiciones de presión y temperatura. Representando los datos reales obtenidos en una experiencia controlada, obtenemos la siguiente gráfica: 1 7.- Calcula la velocidad media de reacción en el primer minuto y entre los minutos 5 y 6. Justifica los resultados obtenidos. 8.- ¿Por qué la curva se hace horizontal al final de la reacción? La siguiente gráfica representa la reacción anterior, pero con una misma cantidad de magnesio y con concentraciones de ácido clorhídrico diferentes: 9.- ¿Qué influencia tiene para la reacción el haber aumentado la concentración de uno de los reactivos? Explica tu respuesta aplicando la teoría de las colisiones. En determinadas condiciones, la reacción anterior es de orden parcial 1 respecto al magnesio y de orden parcial 2 respecto al ácido clorhídrico. 10.- Escribe la ecuación de velocidad correspondiente, indicando el orden global de la reacción y las unidades de K. Para calentar la comida en misiones del ejército, se utilizan los llamados “calentadores sin llama”, que contienen magnesio, hierro y sal común. Cuando se añade agua, se produce la reacción: 11.- ¿Qué papel desempeñan el hierro y la sal en la reacción? ¿Influyen al valor de la variación de entalpía de la reacción? 2











