PROPIEDADES FISICAS DE SUSTANCIAS PURAS
Anuncio

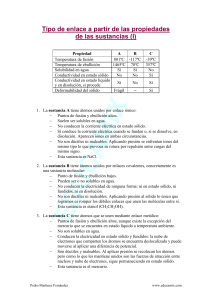
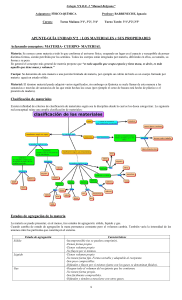
PROPIEDADES FISICAS DE SUSTANCIAS PURAS Las sustancias puras se caracterizan por sus propiedades, las cuales se clasifican en propiedades físicas y químicas. Las propiedades físicas son aquellas que pueden observarse sin alterar la composición química de la sustancia. Algunos ejemplos de propiedades físicas lo son el color, el olor, y la densidad. Las propiedades químicas de una sustancia son la recopilación de las reacciones químicas que esta sustancia lleva a cabo. En esta experiencia de laboratorio tendremos la oportunidad de caracterizar varias sustancias puras estudiando algunas de sus propiedades físicas. Estas son: @ densidad – esta propiedad se define como la masa de una sustancia contenida en una unidad dada de volumen. La fórmula es: D= masa/volumen. @ solubilidad – esta se define como la cantidad máxima de sustancia que puede disolverse en un volumen dado de disolvente a una cierta temperatura y que resulte en un sistema estable. Cualitativamente, se clasifican las sustancias como solubles ( se disuelven completamente), poco solubles (una muy pequeña cantidad se disuelve y luego no se disuelve más), e insoluble ( no se disuelve nada). @ punto de fusión – se define como la temperatura a la cual un sólido se derrite y se encuentran ambas fases presentes (sólido y líquido). @ punto de ebullición – se define como la temperatura a la cual hierve un líquido y están presentes ambas fases (líquido y gas). 8 Instrucciones: Parte I: Las siguientes preguntas serán contestadas en grupos de 4 ó 5 estudiantes. Tienen 35 minutos para llevar a cabo esta parte. 1. Lean y discutan detenidamente la definición de densidad. Cómo pueden obtenerse los datos necesarios para calcular la densidad de un líquido? a. ¿Con qué instrumento de medida se puede obtener el volumen del líquido con una mayor precisión? b. ¿Con qué se puede medir la masa de un líquido? c. Escriban un procedimiento posible que incluya la cristalería y el equipo que necesitarían. 2. ¿Cómo pueden obtenerse los datos para calcular la densidad de un sólido cilíndrico? (El volumen de un cilindro = r2h, donde r = radio y h = altura del cilindro). 9 3. Escriban un procedimiento para llevar acabo esta tarea. Incluyan los equipos que necesitarían. 4. Luego de leer la definición de solubilidad, escriban un procedimiento para decidir si la sustancia bajo estudio ( el líquido y el sólido) son solubles, poco solubles o insolubles. 5. Luego de leer la definición de punto de ebullición, escriba un procedimiento para obtener el punto de ebullición de un líquido. Incluyan un listado del equipo necesario. 10 Parte II: Luego de tener el visto bueno para comenzar sus pruebas, y una vez el (la) profesor(a) haya dividido el trabajo, llene la siguiente información: Para la muestra líquida: 1. Escriba tres características de la muestra. 2. Pruebas de solubilidad: En agua: s___ ps ___ En etanol: s ___ ps ___ i____ i____ 3. densidad del líquido: masa : ________________________ volumen : ______________________ Cálculo de densidad: 4. Punto de ebullición: __________________ 11 Para el sólido # 1 (polvo) 1. Escriba tres características : 2. Pruebas de solubilidad: En agua: s___ ps ___ i____ En etanol: s ___ ps ___ i____ 3. Punto de fusión : _____________________ Para el sólido # 2 (cilindro): 1. Escriba tres características 12 2. Densidad: Masa: _________________________________ Radio: _________________________________ Altura: ________________________________ Cómputo de volumen: Cómputo de densidad: Parte III: Llene la siguiente tabla con los datos obtenidos para el líquido y los sólidos Temperatura Sustancia Solubilidad (C) Fusión Ebull. Masa (g) Volumen mL Radio (cm) Altura (cm) líquido Sólido # 1 Sólido # 2 13 14