MODULO II POTENCIALES Y ENLACES
Anuncio
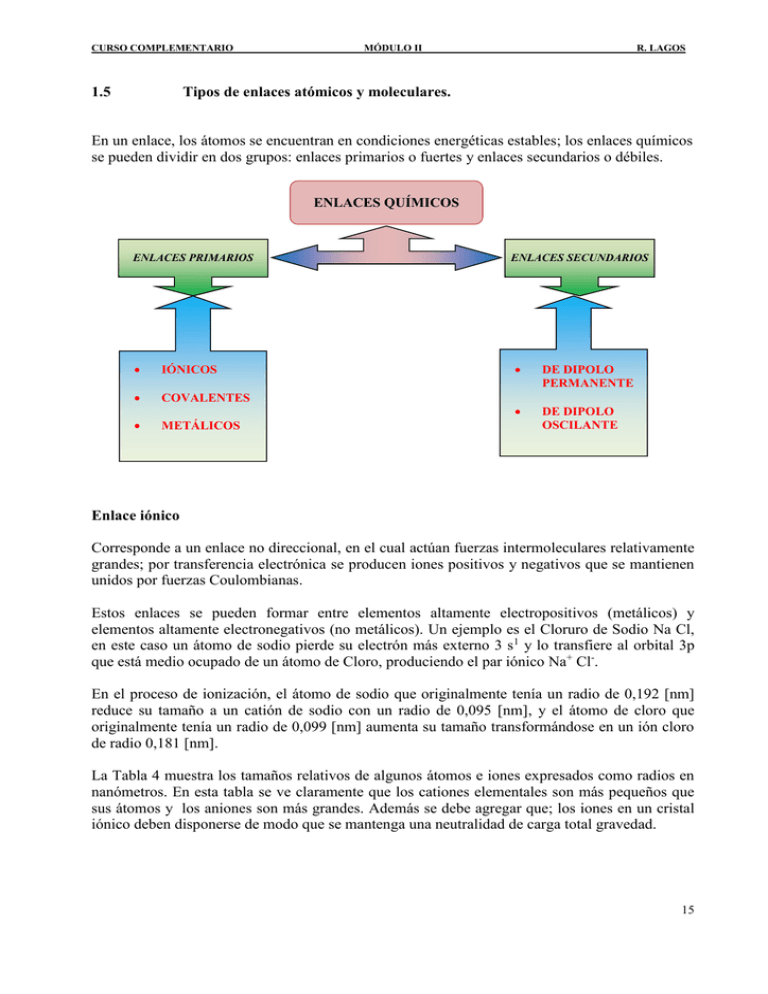
CURSO COMPLEMENTARIO 1.5 MÓDULO II R. LAGOS Tipos de enlaces atómicos y moleculares. En un enlace, los átomos se encuentran en condiciones energéticas estables; los enlaces químicos se pueden dividir en dos grupos: enlaces primarios o fuertes y enlaces secundarios o débiles. ENLACES QUÍMICOS ENLACES PRIMARIOS IÓNICOS COVALENTES METÁLICOS ENLACES SECUNDARIOS DE DIPOLO PERMANENTE DE DIPOLO OSCILANTE Enlace iónico Corresponde a un enlace no direccional, en el cual actúan fuerzas intermoleculares relativamente grandes; por transferencia electrónica se producen iones positivos y negativos que se mantienen unidos por fuerzas Coulombianas. Estos enlaces se pueden formar entre elementos altamente electropositivos (metálicos) y elementos altamente electronegativos (no metálicos). Un ejemplo es el Cloruro de Sodio Na Cl, en este caso un átomo de sodio pierde su electrón más externo 3 s1 y lo transfiere al orbital 3p que está medio ocupado de un átomo de Cloro, produciendo el par iónico Na+ Cl-. En el proceso de ionización, el átomo de sodio que originalmente tenía un radio de 0,192 [nm] reduce su tamaño a un catión de sodio con un radio de 0,095 [nm], y el átomo de cloro que originalmente tenía un radio de 0,099 [nm] aumenta su tamaño transformándose en un ión cloro de radio 0,181 [nm]. La Tabla 4 muestra los tamaños relativos de algunos átomos e iones expresados como radios en nanómetros. En esta tabla se ve claramente que los cationes elementales son más pequeños que sus átomos y los aniones son más grandes. Además se debe agregar que; los iones en un cristal iónico deben disponerse de modo que se mantenga una neutralidad de carga total gravedad. 15 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Tabla 4. Radios de los átomos e iones en [nm] (Extraida del texto “Fundamentos de la Ciencia e Ingeniería de los materiales ) Elemento Hidrógeno HCarbono Radio 0,046 0,208 0,077 Elemento Helio Radio 0,05 Elemento Litio Li+ Oxígeno O2Aluminio Radio 0,157 0,060 0,060 0,140 0,143 Elemento Berilio Be2+ Fluor FSilicio Radio 0,113 0,031 0,071 0,136 0,117 Elemento Boro Radio 0,097 Nitrógeno 0,071 Neón 0,160 Sodio Na+ Azufre S2Escandio 0,192 0,095 0,104 0,184 0,160 Magnesio Mg2+ Cloro ClTitanio 0,160 0,065 0,099 0,181 0,147 Fósforo 0,110 Argón 0,192 Vanadio 0,128 Potasio K+ Cromo 0,238 0,133 0,128 Calcio Ca2+ Manganeso 0,197 0,148 0,118 Hierro 0,124 Cobalto 0,125 Níquel 0,125 Cobre 0,128 Zinc 0,137 Galio 0,135 Germanio 0,139 Arsénico 0,125 0,251 0,148 0,140 Estroncio Sr2+ Tecnecio 0,215 0,148 0,127 0,116 0,198 0,181 Bromo BrCirconio 0,119 0,195 0,160 0,147 Rubidio Rb+ Molibdeno Selenio Se2Itrio Kriptón 0,197 Niobio Rutenio 0,125 Rodio 0,134 Paladio 0,137 Plata 0,144 Cadmio 0,148 Indio 0,144 Estaño 0,158 Antimonio 0,138 0,143 0,221 Xenón 0,218 Praseodimio Cesio Cs+ Neodimio 0,270 0,169 0,217 0,135 Yodo ICerio 0,136 0,216 Bario Ba2+ Prometio Telurio Te2+ Lantano Disprosio Samario Europio Gadolinio Terbio Holmio Erbio Tulio Iterbio Lutecio 0,173 Hafnio 0,144 Tántalo 0,143 Wolframio 0,141 Renio 0,138 Osmio 0,135 Iridio 0,135 Platino 0,139 Oro 0,144 Mercurio 0,155 Talio 0,171 Plomo 0,175 Bismuto 0,182 Polonio Astato Radón Francio Radio Actinio Torio Protactinio Uranio Neptunio Plutonio Americio Curio Berquelio Californio Einsteinio Fermio Mendelevio Nobelio Laurencio En general, el tamaño aumenta conforme a un elemento se le añaden niveles sucesivos al incrementar el número cuántico principal. Sin embargo, hay algunas excepciones en que el tamaño se reduce. Los elementos alcalinos del grupo 1A son ejemplos de átomos cuyo tamaño crece conforme se añade cada capa electrónica. El litio (n = 2) tiene un radio atómico 0,157 [nm], mientras que el Cesio (n = 6) tiene un radio atómico de 0,270 [nm]. Como conclusión el tamaño atómico será importante en el estudio de la difusión atómica en aleaciones metálicas. 16 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Considerando los efectos eléctricos entre los átomos, se puede apreciar que existen distintos tipos de fuerzas, el origen de las fuerzas depende del tipo de enlace particular que existe entre los átomos; la magnitud de la fuerza depende de la distancia interatómica. Los niveles más externos de los átomos empiezan a solaparse y aparece una fuerza repulsiva FR elevada. La fuerza resultante o fuerza neta entre los dos átomos es: FNETO = FA + FR Fuerza de atracción FA Energía de Repulsión ER Fuerza resultante FN Separación interatómica ao Fuerza de repulsión FR Energía Resultante EN Eo Energía de Atracción EA (a) Figura 8 (b) La figura (a) representa cada una de las fuerzas atractiva y repulsiva entre átomos, en cambio la figura (b), representa la suma de ambas acciones en función de la distancia de separación. En el equilibrio, los centros de los átomos permanecerán separados una distancia ro. Para muchos átomos ro es aproximadamente igual a 0.3 [nm] (3Å). Para dicha interacción, la energía se expresa por; F N dr r E F A dr F R dr E A ER ro es la distancia a la cual la energía potencial presenta un mínimo. La energía de enlace de estos átomos corresponde a la energía de este punto mínimo y representa la energía necesaria para separar estos dos átomos una distancia infinita. Las sustancias sólidas, se caracterizan por tener valores elevados de energía de enlace, mientras que en el estado gaseoso estos valores son bajos, en estado líquido las energías de enlace tienen valores intermedios. Generalmente la temperatura de fusión y las propiedades cohesivas reflejan la magnitud de la energía de enlace de los materiales sólidos. La fuerza de atracción entre el par iónico son fuerzas de Coulomb, es decir: FA (Z1 e) (Z 2 e) 4 o a 2 Z1 Z 2 e 2 4 o a 2 La fuerza repulsiva entre un par iónico ha resultado ser experimentalmente proporcional a la distancia de separación iónica a y puede escribirse como: 17 CURSO COMPLEMENTARIO MÓDULO II FR R. LAGOS n b a n 1 Donde a es la distancia de separación inter-iónica, b y n son constantes; n varía generalmente de 7 a 9, siendo 9 para el Na Cl. Sustituyendo las ecuaciones anteriores para determinar la fuerza neta entre el par iónico, se obtiene: Z1 Z 2 e 2 nb FNETA 2 4 o a a n1 La energía potencial total E entre un par de iones de cargas opuestas, por ejemplo Na+ Cl-, a los que se les aproxima hasta estar muy juntos es igual a la suma de las energías asociadas con la atracción y repulsión entre los iones, lo que puede escribirse conforme a la siguiente ecuación: E NETA Z1 Z 2 e 2 4 o a b an El término energía de atracción de la expresión anterior, representa la energía liberada cuando los iones se acercan y es negativa porque el producto de (+Z1) (-Z2) es negativo. El término de la energía repulsiva, representa la energía absorbida cuando los iones se aproximan y , es positiva. La suma de las energía asociadas con la atracción y la repulsión de los iones es igual a la energía total, que es mínima cuando la distancia de separación entre los iones es igual a la energía Total, que es mínima cuando la distancia de separación entre los iones es la distancia de equilibrio a0 (ver Figura 8) Los iones en un cristal iónico deben disponerse de modo que se mantenga una neutralidad de carga local. Por ejemplo Ca F2, el ordenamiento iónico implica que debe haber dos iones F- por cada ion Ca2+. Nota: Las energías reticulares y los puntos de fusión de sólidos con enlaces iónicos son relativamente altas. De igual modo como el tamaño del ion se incrementa conforme se avanza en un grupo en la tabla periódica, la energía reticular disminuye. Ejemplos 1.- Determine la fuerza de atracción Coulombiana entre un par de iones Na + y Cl- que acaban de ponerse en contacto. Use la tabla anterior para ver los radios iónicos. 2.- Si la fuerza atractiva entre un par de iones Mg2+ y del S2- es 1,49 10-8 [N] y si el ion S2- tiene un radio de 0,184 [nm], calcular un valor para el radio iónico del ion Mg2+ en nanómetros. 3.- Calcular la energía potencial neta de un par iónico sencillo Na+ Cl-. 18 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Tabla 5. Energías de enlace y temperaturas de fusión para distintos sólidos. Tipo de Enlace Tipo de Sustancia IÓNICO Li Cl NaCl K Cl Rb Cl Cs Cl MgO Ca O Sr O Ba O Energía de Enlace kJ/mol eV/átomo (kcal/mol) ion, molécula 829 (198) 4.3 766 (183) 4.0 686 (164) 3.6 670 (160) 3.5 649 (155) 3.4 3932 (940) 20.4 3583 (857) 18.6 3311 (792) 17.2 3127 (748) 16.2 Temperatura de Fusión (°C) 613 801 776 715 646 2800 2580 2430 1923 COVALENTE Si C (Diamante) 450 (108) 713 (170) 4.7 7.4 1410 >3550 METÁLICO Hg Al Fe W 68 (16) 324 (77) 406 (97) 849 (203) 0.7 3.4 4.2 8.8 -39 660 1538 3410 (*) Todos los valores son negativos para la formación de enlace. 1.6 Enlace Covalente El enlace covalente se forma entre átomos con pequeñas diferencias en electronegatividad y próximos en la tabla periódica. Los átomos generalmente comparten sus electrones externos s y p con otros átomos, de manera tal que cada átomo alcanza la configuración electrónica de gas noble. Cada uno de los átomos contribuye con un electrón para formar el par de electrones y las energías de ambos átomos enlazados covalentemente son menores (mayor estabilidad) como consecuencia de la interacción de los electrones. Tabla 6. Electronegatividades de los elementos. Li 1,0 Na 1,0 K 0,9 Rb 0,9 Cs 0,9 Fr 0,9 Be 1,5 Mg 1,3 Ca 1,1 Sr 1,0 Ba 0,9 Ra 0,9 Se 1,2 Y 1,1 La 1,1 Ac 1,0 Ti V Cr Mn 1,3 1,5 1,6 1,6 Zr Nb Mo Tc 1,2 1,3 1,3 1,4 Hf Ta W Re 1,2 1,4 1,4 1,5 Lantánidos 1,0 – 1,2 Actínidos 1,0 – 1,2 Fe 1,7 Ru 1,4 Os 1,5 Co 1,7 Rh 1,5 Ir 1,6 Ni 1,8 Pd 1,4 Pt 1,5 Cu 1,8 Ag 1,4 Au 1,4 Zn 1,7 Cd 1,5 Hg 1,5 B 2,0 Al 1,5 Ga 1,8 In 1,5 Ti 1,5 C 2,5 Si 1,8 Ge 2,0 Sn 1,7 Pb 1,6 H 2,1 N 3,1 P 2,1 As 2,2 Sb 1,8 Bi 1,7 O 3,5 S 2,4 Se 2,5 Te 2,0 Po 1,8 F 4,1 Cl 2,9 Br 2,8 I 2,2 At 2,0 19 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS 1.7 Molécula de Hidrógeno Dos átomos de Hidrógeno contribuyen con sus electrones 1s1 a la formación del par electrónico que forma el enlace covalente. (Ver Figura 9) H + H Átomos de Hidrógeno H H Molécula de Hidrógeno Enlace covalente En el proceso de enlace de formación de la molécula de Hidrógeno, la energía potencial de los átomos de Hidrógeno disminuye y se libera energía. Son ejemplos de enlaces covalentes las moléculas biatómicas F2 ; O2 y electrones p entre los átomos) Energía Molécula de Hidrógeno N2 (comparten + Distancia de separación + + Emin Enlace Covalente Par de átomos ao Figura 9. Tabla 7. Enlace CC CC CC CH CN CO CO CF C Cl OH OO O Si NO NH FF HH ao = 2 R Enlace covalente del átomo de Hidrógeno y gráfico de energía potencial. Energías y longitudes de enlace de algunos enlaces covalentes. Energía de enlace [kJ/mol] [kcal/mol] 370 88 680 162 890 213 435 104 305 73 360 86 535 128 450 108 340 81 500 119 220 52 375 90 250 60 430 103 160 38 435 104 Longitud de enlace [nm] 0,154 0,13 0,12 0,11 0,15 0,14 0,12 0,14 0,18 0,10 0,15 0,16 0,12 0,10 0,14 0,074 20 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS 1.8 El Carbono Es un elemento básico en los materiales poliméricos, su configuración electrónica es 1s2 2s2 2p2. En muchos casos el Carbono forma cuatro enlaces covalentes de igual fuerza, esto ocurre por el fenómeno de Hibridación (uno de los orbitales 2s es promovido a un orbital 2p para formar así cuatro orbitales híbridos s p3 equivalentes) Aún cuando en el proceso de Hibridación se necesita energía para promover el electrón 2s al estado 2p, la energía necesaria para esta formación queda compensada en exceso por la disminución de energía (se libera energía) que acompaña al proceso de formación del enlace. 109,5º El Carbono en la forma del diamante presenta enlace covalente tetraédrico s p3. Figura 10. Un átomo de Carbono con cuatro orbitales equivalentes sp3 dirigidos simétricamente hacia los vértices de un tetraedro. 1.9 Enlace Metálico. Este enlace se presenta en los metales sólidos, en ellos los átomos están ordenados en una estructura cristalina. (Ver Figura ) Un ejemplo es el Cobre, en este caso cada átomo está rodeado de 12 vecinos más próximos. Los electrones de valencia no están, por lo tanto, asociados exclusivamente a núcleo particular alguno y, así, se extienden entre todos los átomos en forma de una nube de carga electrónica de baja densidad o gas electrónico. Los electrones de valencia están débilmente unidos a los núcleos de iones positivos y pueden separarse fácilmente del metal cristalino por lo que se denominan electrones libres. En el enlace metálico, los electrones de valencia más externos de los átomos son compartidos por muchos átomos circundantes, y así, en general, el enlace metálico es no direccional. Energía + Distancia interatómica Emin Par de átomos metálicos ao ao = 2 R Figura 11. Energía distancia de separación, para un par de átomos metálicos. 21 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Las energías de enlace y los puntos de fusión de los diferentes metales varían mucho. En general, a menos número de electrones de valencia por átomos implicados en el enlace metálico, mayor es el carácter metálico del enlace. Es decir, los electrones de valencia son más libres para moverse. En el caso de los metales alcalinos, las energías de enlace y puntos de fusión son relativamente bajos. Por ejemplo. Na (Sodio) 108 [kJ/mol] o, 25.9 [kcal/mol] 97,9 [ºC] K (Potasio) 89,6 [kJ/mol] o 21,4 [kcal/mol] 63,5 [ºC] Tabla 8. Energías de enlace, puntos de fusión y configuración electrónica de los metales del cuarto periodo de la Tabla periódica. Z Elemento 19 20 21 22 23 24 25 26 27 28 29 30 31 32 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge Configuración Electrónica 4s1 4s2 3d1 4s2 3d2 4s2 3d3 4s2 3d5 4s1 3d5 4s2 3d6 4s2 3d7 4s2 3d8 4s2 3d10 4s1 4s2 4s2 4p1 4s2 4p2 Energía de enlace [kJ/mol] [kcal/mol] 89,6 21,4 177 42,2 342 82 473 113 515 123 398 95 279 66,7 418 99,8 383 91,4 423 101 339 81,1 131 31,2 272 65 377 90 Punto de fusión [ºC] 63,5 851 1397 1812 1730 1903 1244 1535 1490 1455 1083 419 29,8 960 Núcleos de iones positivos Electrones de valencia en la forma de nubes de carga electrónica Figura 12 Diagrama esquemático bidimensional de átomos enlazados metálicamente. 22 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS CARACTERÍSTICAS DE LOS ENLACES ATÓMICOS PRIMARIOS DE LOS MATERIALES SÓLIDOS IONICO COVALENTE METÁLICO Los átomos de un elemento metálico dan fácilmente sus electrones de valencia a los átomos de un no-metal. Todos los átomos adquieren la configuración estable de los gases inertes, para ello se ionizan cargándose eléctricamente El NaCl (Cloruro sódico) es un material iónico clásico, el Sodio Na adquiere la configuración del Ne y una carga positiva Na+, después de la transferencia electrónica, el ion Cloro tiene una carga negativa Cl- y una configuración idéntica a la del Argón. Las fuerzas atractivas del enlace son fuerzas de Coulomb EA q q K z1e z 2 e A K 1 2 r r r z1 y z2 son los valencias de los dos tipos de iones. Análogamente la energía repulsiva es: EA B rn n8 El enlace es no direccional, tiene el mismo valor en todas las direcciones. En los cerámicos el enlace predominante es el iónico. Valores entre 600 a 1500 kJ/mol, de 3 a 8 eV/átomo. Esto se refleja en las altas temperaturas de fusión. Los materiales son duros, frágiles y son aislantes eléctricos como térmicos. Se consigue compartiendo electrones con átomos vecinos. Los electrones compartidos se consideran de ambos átomos. El metano CH4 es un ejemplo de este enlace, en el cual el átomo de Carbono tiene cuatro electrones de valencia, mientras que cada uno de los átomos de Hidrógeno tiene un único electrón de valencia. Cada átomo adquiere una configuración electrónica del Helio He. Dos electrones de valencia 1s, así el Carbono tiene 8 electrones, cuatro de los cuales son los electrones adicionales compartidos, uno de cada Hidrógeno y la configuración electrónica del Neón. El enlace covalente es direccional, existe entre átomos específicos y sólo en la dirección que hay electrones compartidos. Algunos ejemplos son los elementos no metálicos H2, Cl2, F2, CH4, H2O, HNO3, HF. Aparece en el Diamante (Carbono), Silicio, Germanio, Arseniuro de Galio (GaAs), Antimoniuro de Iridio (IrSb), Carburo de Silicio (SiC). El número de enlaces covalentes posibles para un átomo particular depende del número de electrones de valencia. Para N’ electrones de valencia, un átomo puede enlazarse covalentemente, como máximo, con 8-N’ átomos, por ejemplo para el Cloro, N’ = 7 y por lo tanto 8 – N’ = 1, es decir, un átomo de Cloro puede enlazarse con un único átomo, como en la molécula de Cl2. Para el Carbono C, N’ = 4, por lo tanto 8- N’ = 4 y así cada átomo de Carbono tiene cuatro electrones para compartir. Son muy fuertes como en el caso del diamante (duro, TFUSIÓN > 3550 °C) típico de los materiales poliméricos. Metales y Aleaciones 2 a lo mas 3 electrones de valencia. Los electrones de valencia no pertenecen a ningún átomo en particular, son libres de circular en todo el metal. El núcleo y los electrones que no son de valencia forman cationes que poseen una carga positiva igual al total de electrones de valencia por átomo. Es no direccional El enlace puede ser fuerte o débil, los valores de las energías van desde 68 kJ/mol (0.7 eV/átomo) para el Hg a 850 kJ/mol (8.8 eV/átomo) para el Tungsteno. Las temperaturas de fusión son –39 °C y 3410 °C respectivamente. Dan origen a buenos conductores de la electricidad y del calor 23 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS 1.10 Enlace Secundario (Enlaces de Van der Waals) Los enlaces secundarios son relativamente débiles y la energía va de 4 hasta 42 [kJ/mol] (1 hasta 10 [kcal/mol]). La fuerza se deben a los dipolos eléctricos contenidos en los átomos o moléculas. +q + q : carga del dipolo -q d - d : vector relativo desde el centro de la carga negativa hacia el centro de la carga positiva Se define el momento dipolar como un vector que va desde la carga negativa hacia la carga positiva del dipolo como el producto de la carga por el vector d. =qd Los dipolos interaccionan mediante fuerzas Coulombianas, y sus unidades son [C m] o [Debyes]; la relación entre las unidades anteriores es: 1 [Debyes] = 3,34 10-30 [C m] Existen dos tipos de enlaces secundarios entre los átomos o moléculas que involucran dipolos eléctricos: Dipolos oscilantes (He, Ne, Ar, Kr, Xe, Rn). La licuefacción y la solidificación de los gases nobles a bajas temperaturas y alta presión se atribuye a enlaces por dipolos oscilantes. Tabla 9 Energías de enlace, puntos de fusión y ebullición de los gases nobles a presión atmosférica. Radio atómico [nm] 0,05 0,160 0,192 0,197 0,218 - Gas Noble Helio Neón Argón Kriptón Xenón Radón Punto de Fusión [ºC] - 272,2 - 248,7 - 189,2 - 157,0 - 112,0 - 71,0 Punto de Ebullición [ºC] - 268,9 - 245,9 - 185,7 - 152,9 - 107,1 - 61,8 24 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Dipolos permanentes CH4 (Metano) ; H2O (Agua) Tabla 10 Momentos dipolares experimentales de algunos compuestos (Debyes) Compuestos Momento Dip. H2O 1,84 H2 0,00 CO2 0,00 CCl4 0,00 CH3Cl 2,00 CHCl3 1,10 HCl 1,03 NH3 1,46 Enlaces Mixtos. Entre los enlaces primarios, es posible tener las siguientes combinaciones de tipos de enlaces mixtos: 1. Iónico – Covalente 2. Metálico – Covalente 3. Metálico – Iónico 4. Iónico – Covalente – Metálico. Para el enlace mixto Iónico – Covalente, cuanto mayor es la diferencia de electronegatividad de los elementos involucrados en un enlace mixto Iónico – Covalente, mayor es el grado de carácter iónico del enlace. Linus Carl Pauling, propuso la siguiente ecuación para determinar el porcentaje de carácter iónico de enlace en un compuesto AB. XA y XB son las electronegatividades de los átomos A y B en el compuesto. Muchos compuestos semiconductores tienen enlaces mixtos Iónico – Covalente. Por ejemplo los Compuestos Ga As y Zn Se. Ejemplo. Demuestre que el compuesto Zn Se tiene un mayor porcentaje de carácter iónico que el compuesto Ga As. Suponga que XGa = 1,8 ; XAs = 2,2 ; XZn = 1,7 ; XSe = 2,5 25 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS Ejercicios 1] ¿Qué es un isótopo?. ¿Por qué los pesos atómicos de los elementos no son números enteros? 2] Escribir la configuración electrónica para los siguientes iones: P5+, P3-, Sn4+, Se2-, I-, Ni2+. 3] El óxido cálcico (CaO) presenta predominantemente enlace iónico. ¿Cuáles son los dos gases inertes que tienen idénticas configuraciones electrónicas a los iones Ca2+ y O2-. 4] Con respecto a la configuración electrónica, ¿qué tienen en común todos los elementos del grupo IA de la tabla periódica? 5] Calcular la fuerza de atracción entre un ion Ca2+ y un ion O2-, cuyos centros están separados una distancia de 1.0 nm. 6] Calcule la fuerza de atracción entre un par de iones K+ y Cl- justo en contacto. Considere los valores de la Tabla 4. 7] Calcule la fuerza de atracción entre un par de iones Ca2+ y S2- justo en contacto. Considere los valores de la Tabla 4. 8] Calcule la energía potencial neta para el par iónico K+Cl- usando el valor de la constante b obtenido a partir del problema 6. Tome para n el valor 9. 9] Calcule la energía potencial neta para el par iónico Ca2+ y S2- usando el valor de la constante b obtenido a partir del problema 7. Tome para n el valor 9. 10] Calcule el radio iónico del ion F- en [nm] sabiendo que la fuerza atractiva entre un par de iones F- y Na+ es de 4,439 10-9 [N] y que el radio iónico del Na es de 0,095 [nm]. 11] Calcule el radio iónico del ion Sr2+ en [nm] sabiendo que la fuerza atractiva entre un par de iones Sr2+ y S2- es de 9,544 10-9 [N] y que el radio iónico del S2- es de 0,184 [nm]. 12] Compare el porcentaje de carácter iónico para los siguientes compuestos semiconductores Zn S y Ga P. 13] Compare el porcentaje de carácter iónico para los siguientes compuestos semiconductores Cd S y In As. 14] La energía potencial entre dos iones contiguos, EN, se puede considerar como resultante de la suma de las ecuaciones mostradas en la tabla anterior, es decir, EN A B n r r Calcular la energía de enlace, Eo, en función de los parámetros A, B y n utilizando el siguiente procedimiento: Diferenciar EN con respecto de r, e igualar la expresión a cero, ya que la gráfica de E N en función de r tiene un mínimo en Eo. Hallar el valor de r en función de A, B y n, cuando la distancia interiónica es ro. Hallar una expresión para Eo sustituyendo ro en la ecuación anterior. 26 CURSO COMPLEMENTARIO MÓDULO II R. LAGOS 15] Para el par iónico Na+ y Cl- las energías atractiva y repulsiva EA y ER respectivamente, dependen de la distancia entre iones r, según las siguientes relaciones: EA 1.436 r ER 7.32 106 r8 Para estas expresiones, las energías están dadas en electronvoltios para el par Na+ y Cl- y r es la distancia en nanómetros. La energía resultante EN es la suma de las dos anteriores. En un mismo gráfico representar EN, EA y ER, en función de r a 1.0 nm. En este gráfico representar: la distancia de equilibrio ro entre los iones Na+ y Cl- y la magnitud de la energía de enlace Eo entre ambos iones. Determinar matemáticamente los valores de ro y Eo utilizando las soluciones del problema anterior y compárelo con la gráfica. 16] La energía potencial EN entre dos iones contiguos a veces se representa por la expresión EN C r r D exp donde r es la separación interiónica y C, D, y son constantes cuyo valor depende del material específico. Encontrar una expresión para la energía de enlace E o en función de la separación interiónica y de las constantes D y . Referencias [1] William F. Smith. “Fundamentos de la Ciencia e Ingeniería de Materiales” [2] William D. Callister, Jr. “Introducción a la Ciencia e Ingeniería de los Materiales” [3] Jasprit Singh. “Dispositivos Semiconductores” 27
