Qu mica, Preguntas para ir introduci ndonos en el tema
Anuncio

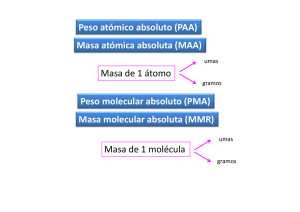
QUÍMICA CICLO 2015 PREGUNTAS PARA IR INTRODUCIENDONOS EN EL TEMA: 1­ Se analiza un sistema material que contiene: colorante, agua, arena y trozo de corcho, qué conjunto de métodos de separación y/o fraccionamiento emplearía para obtener los distintos componentes?: a) Decantación, Destilación, Cristalización. b) Filtración, Cristalización, Flotación, c) Decantación, Destilación, Flotación. d) Decantación, Destilación, Centrifugación. Pasos para su resolución: ● Dibuje el sistema material y clasifiquelo. ● ¿cuándo utiliza métodos de separacion de fases y cuando metodos de fraccionamiento? ¿cuales conoce? ● ¿que separaria primero de manera tal que no pierda ningún componente? ● Elija la secuencia correcta de pasos. 2­ Indique como clasifica cada elemento del siguiente grupo :(sustancia simple, compuesta, solución, o mezcla ) Jugo de frutas ­ Semillas en agua­ Azúcar húmeda­ Agua de lluvia­ Oxigeno gaseoso­ Bicarbonato de sodio. Pistas: Repase los conceptos de mezcla, solución , sustancia simple y compuesta. Describa la composición química de aquellos ejemplos que conoce. Ej: Agua de lluvia: estña formada por agua y otras sustancias como minerales, óxidos etc. 3­ Clasifica las siguientes propiedades en intensivas o extensivas: Olor Gusto Longitud Índice de Refracción Pistas: Busque la definción de esas propiedades. ¿Cuando una propiedad es intensiva y cuando extensiva? ¿Cual de esas propiedades cambia si cambia la cantidad de masa? 4­ En el siguiente link: Modelos Atómicos encontrará un prezi con información sobre modelos atómicos, en base a lo que muestra en su recorrido conteste las siguientes preguntas: I) Cuales son las ideas principales del Atomismo de Demócrito? II) ¿Que diferencias observa entre la estructura de la materia propuesta por Demócrito y la propuesta por Aristóteles? III) Transcriba los postulados de Dalton sobre la estructura de la materia. Link: Modelo de Dalton IV) Observe los videos en los que se muestra los experimentos que realizó Thompson utilizando rayos catódicos... a) ¿Como se comportan los rayos catódicos cuando el investigador acerca el imán? b) ¿A que se debe ese comportamiento? ¿Que son los rayos catódicos? c) ¿cual será la función del molinete en el segundo experimento? d) ¿que busca comprobar Thompson con estos experimentos? V) ¿Cual es el comportamiento de las partículas alfa en el experimento de Rutherford y a qué se debe? VI) ¿Que diferencias observa entre el modelo atómico de Rutherford y el de Borh? VII) Observe la imagen que se muestra en el recuadro correspondiente al modelo atómico actual. a) Que es lo que esta dibujado en la misma? b) ¿que son los electrones para Schrondinger? c) porqué es un modelo probabilístico? d) averigüe que significa que la energía esté "cuantificada". En base a todo lo antes explorado: Indica la veracidad o falsedad de las siguientes proposiciones referidas a modelos atómicos: a) Los modelos atómicos difieren entre sí en la posición de las subpartículas atómicas. b) La importancia de los modelos atómicos reside en que permiten explicar los caracterìsticas de la materia. c) El modelo de Dalton incluye las partículas subatómicas d) El principio de incertidumbre le permitió a Rutherford construir su modelo. 5­ Explore la tabla periódica y luego complete el siguiente cuadro: Conceptos previos necesarios: Defina Número másico y número atómico. ¿que relación guardan esos números con la cantidad de partículas subatómicas? ¿Cómo se calcula la cantidad de neutrones? ¿Qué es un catión y un anión? ¿Cual es la partícula subatómica que varia en los iones respecto al elemento neutro? ¿Que es la configuración electrónica? ¿Cuantos niveles y subniveles hay en un átomo según el modelo actual? ¿Como se completan esos niveles y subniveles con electrones? Símbolo Z A p e­ N Configuración Electrónica C 6 6 Fe 56 26 S 32 16 K+ 20 1s22s22p63s23p6 O­2 10 8 Mn 25 55 Ag 108 [Kr] 5s2 4d9 Rb+ 85 37 Zn 30 35 6­ El oxígeno tiene 3 isótopos 168O (99,759%) con masa atómica 15,99491 umas, 178O (0,037%) con un masa atómica de 16,99914 umas y 188O (0,204%) con una masa de 17,99916. ¿Cuál es la masa atómica del oxígeno? Pistas: Defina Isótopos. Lea de donde proviene la masa atómica expresada en la tabla periódica. Transcriba la fórmula para calcularla a partir de los datos del problema. 7­ Completar la siguiente tabla, donde la columna de masas atómicas está referida a los que aparecen en la tabla periódica: Elemento Masa atómica umas Masa de un mol de átomos umas gramos Ca 2,41 .1025 40.078 umas 79.904 umas P 40.078 51.9961 8­ Dadas las siguientes especies: Nota: Las letras corresponden a una nomenclatura genérica de los elementos y no a sus símbolos químicos. 16 8 B­2 C+1 (grupo IA, período 4 y A= 39) D (A=59, Z= 27) a) ¿Cuántos protones, neutrones y electrones posee cada una? Dar la configuración electrónica de ellas. b) Ubicarlas en la tabla periódica. (Para mayor información consutar este link: Sobre la tabla periódica) c) ¿Cuáles son elementos representativos, de transición y de transición interna? d) ¿Cuáles son metales, no metales o gases nobles? e) Ordenarlos según electronegatividad creciente y según radio atómico creciente. 9) Dadas las siguientes configuraciones electrónicas: i. 1s22s22p63s1 ii. 1s22s22p4 Indicar: a)Grupo y período al que pertenecen los elementos b) Número de protones c) Compare la electronegatividad, potencial de ionización y carácter metálico entre ambos. 10­ Dadas las siguientes sustancias químicas: HCl Cl2 NaCl HF Br2 SiO2 Na HNO3 NH4I a) Indica el enlace que presentan los átomos que las forman b) ¿Qué fuerzas intermoleculares tienen? Conceptos necesarios para su resolución: Diferenciar entre enlace iónico covalente y metálico Diferenciar fuerzas intermoleculares (London, dipolo­dipolo, puente hidrógeno) 11­ Escribir las fórmulas de los óxidos correspondientes a los siguientes metales y nombrarlos +1 +2 +3 Li Ca Al +2 +3 Co Co +2 Pb +4 Pb +1 Au +3 Au +3 Cr +6 Cr +4 Mn +6 S +7 Cl +5 I +1 Br 12­ Idem para los siguientes no metales: +2 +4 C C +1 N +2 N +3 N +4 N +5 N +4 S 13­ Escribir las fórmulas de los hidróxidos correspondientes a los siguientes metales y nombrarlos Na, Mg, Al, Zn, Cu, Fe 14­ Dadas las siguientes fórmulas, dar las nomenclaturas correspondientes e indicar si se trata de óxidos ácidos o básicos, hidróxidos, hidruros, oxácidos o hidrácidos a) H2S b) HClO3 c) HK d) NiO e) P4O6 f) Ba(OH)2 g) HClO2 h) SiO2 i) NH4OH j) HF k) Ag2O l) H3PO4 m) CaH2 15­ Transcriba las definiciones de mol,número de avogadro, volumen molar, densidad­ Luego calcule el número de moléculas presentes en: a) 10 litros de O3 medidos en condiciones normales. b) 0,7 moles de O2. c) 4,8 g de H2O2. d) 500 ml de etanol (C2H5OH). (δ del alcohol= 0.8 g/ml) 16­ Dada la siguiente reacción: Fe + HCl → FeCl2 + H2 a) b) c) d) Balancearla ¿Cuántos moles de HCl reaccionan con 7 gramos de Fe? ¿Cuántos gramos de HCl se requieren para obtener 0.25 moles de sal? ¿Cuantos gramos de Fe se requieren para que reacconen totalmente 0.4 moles de HCl: