pract_enlac_1_bach
Anuncio
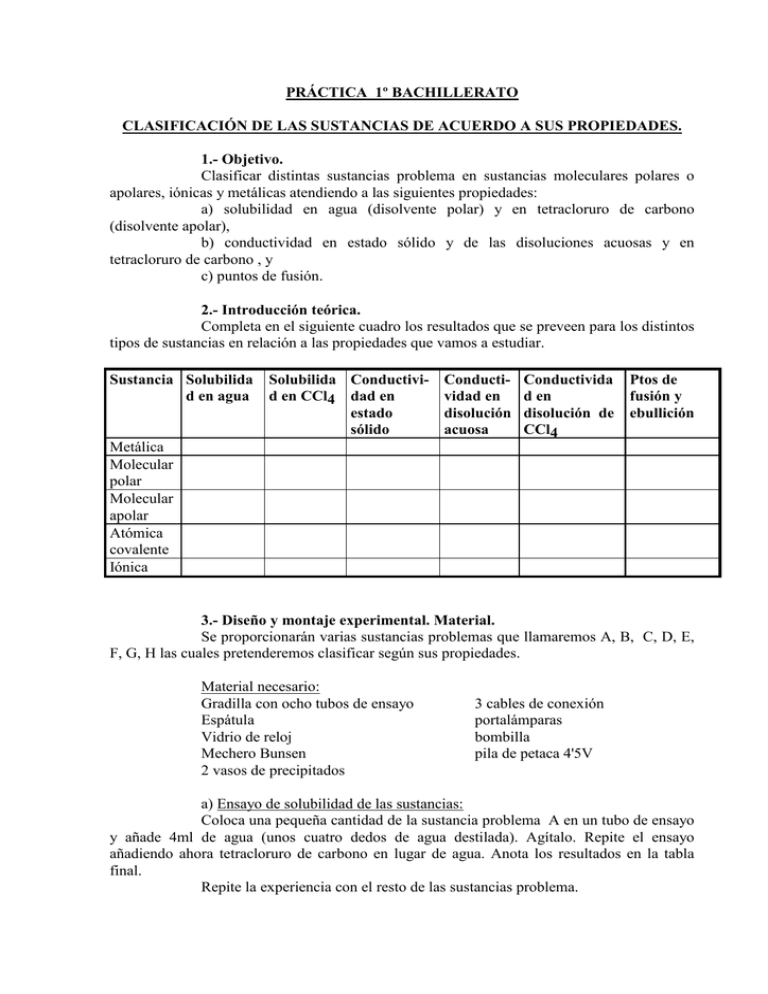
PRÁCTICA 1º BACHILLERATO CLASIFICACIÓN DE LAS SUSTANCIAS DE ACUERDO A SUS PROPIEDADES. 1.- Objetivo. Clasificar distintas sustancias problema en sustancias moleculares polares o apolares, iónicas y metálicas atendiendo a las siguientes propiedades: a) solubilidad en agua (disolvente polar) y en tetracloruro de carbono (disolvente apolar), b) conductividad en estado sólido y de las disoluciones acuosas y en tetracloruro de carbono , y c) puntos de fusión. 2.- Introducción teórica. Completa en el siguiente cuadro los resultados que se preveen para los distintos tipos de sustancias en relación a las propiedades que vamos a estudiar. Sustancia Solubilida d en agua Solubilida Conductivi- Conductid en CCl4 dad en vidad en estado disolución sólido acuosa Conductivida d en disolución de CCl4 Ptos de fusión y ebullición Metálica Molecular polar Molecular apolar Atómica covalente Iónica 3.- Diseño y montaje experimental. Material. Se proporcionarán varias sustancias problemas que llamaremos A, B, C, D, E, F, G, H las cuales pretenderemos clasificar según sus propiedades. Material necesario: Gradilla con ocho tubos de ensayo Espátula Vidrio de reloj Mechero Bunsen 2 vasos de precipitados 3 cables de conexión portalámparas bombilla pila de petaca 4'5V a) Ensayo de solubilidad de las sustancias: Coloca una pequeña cantidad de la sustancia problema A en un tubo de ensayo y añade 4ml de agua (unos cuatro dedos de agua destilada). Agítalo. Repite el ensayo añadiendo ahora tetracloruro de carbono en lugar de agua. Anota los resultados en la tabla final. Repite la experiencia con el resto de las sustancias problema. b) Ensayo de conductividad eléctrica. Para la comprobación de la conductividad se montará un circuito de corriente continua con una pila de petaca de 4'5V, conectada en serie con una bombilla y dos electrodos. Probar previamente su funcionamiento uniendo los electrodos( es decir, cerrando el circuito) y viendo cómo luce la bombilla. Antes de ver si las sustancias problema conducen, comprobaremos si los disolventes utilizados (agua y tetracloruro de carbono ) conducen la corriente eléctrica. Anota los resultados. Se comprobará la conductividad tanto de los sólidos como de las disoluciones obtenidas en el apartado b) : primero poniendo en contacto los dos electrodos con las sustancias problema y, segundo, introduciendo los electrodos dentro de los tubos de ensayo antes obtenidos (procurando que no se toquen entre sí los electrodos), y observando si luce la bombilla. La mayor o menor luminosidad de la bombilla será un índice del grado de conductividad de las sustancias. Lavar los electrodos tras cada operación, con agua destilada y secar con papel de filtro, todo ello habiendo desconectado la corriente. Anotar los resultados obtenidos en el cuadro final. # Dibuja el esquema correspondiente al ciercuito eléctrico montado. c) Ensayo del punto de fusión. Se calentará unas pequeñas cantidades de las sustancias problema sólidas en tubos de ensayo durante un minuto cada una. Se considerará que tienen bajo punto de fusión aquellas que en dicho tiempo hayan fundido, y alto punto de fusión las que no lo hayan hecho en ese tiempo. 4.- Resultados. Se presentarán los resultados de las experiencias anteriores en los siguientes apartados y tabla: - Conductividad del agua destilada: _________________ - Conductividad del teracloruro de carbono: _______________ Sustancia Solubilidad en agua Solubilidad Conductividad Conductividad Conductividad Puntos de en CCl4 en su estado en disolución en CCl4 fusión natural acuosa A B C D E F G H 5.- Interpretación. La experiencia no sirve para nada si no se realiza este apartado. En base a los resultados previstos en el apartado 2, realizar la correspondiente clasificación de las sustancias problema: A B C D E F G H Tipo de sustancia 6.-Comentarios. Averigua de tu profesor de qué sustancias se trata y realiza un comentario sobre el acierto de tus predicciones. NOTA PARA EL PROFESOR: Las sustancias investigadas son: A- cinc Zn B- Bromuro de potasio KBr C- Azufre S8 D- Aluminio Al E- Arena SiO2 F- Sacarosa (C,H,O) G- Iodo I2 H- Alcohol etílico C2H5OH

