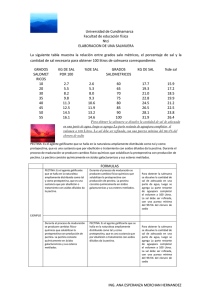
CD-6413.pdf
Anuncio

ESCUELA POLITÉCNICA NACIONAL FACULTAD DE INGENIERÍA QUÍMICA Y AGROINDUSTRIA DISEÑO DE UN PROCESO PARA LA OBTENCIÓN DE PECTINA DE LA CORTEZA DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.). PROYECTO PREVIO A LA OBTENCIÓN DEL TÍTULO DE INGENIERA QUÍMICA LUISIANA AUGUSTA GALEAS LEMA [email protected] DIRECTOR: ING.MARCELO ALBUJA [email protected] CO-DIRECTOR: ING.MARCELO SALVADOR [email protected] Quito, Julio 2015 © Escuela Politécnica Nacional (2015) Reservados todos los derechos de reproducción DECLARACIÓN Yo, Luisiana Augusta Galeas Lema, declaro que el trabajo aquí escrito es de mi autoría; que no ha sido previamente presentado para ningún grado o certificación profesional; y, que he consultado las referencias bibliográficas que se incluye en este documento. La Escuela Politécnica Nacional puede hacer uso de los derechos correspondientes a este trabajo, según lo establecido por la Ley de Propiedad intelectual, por su Reglamento y por la normativa institucional vigente. _________________________ Luisiana Augusta Galeas Lema CERTIFICACIÓN Certifico que el presente trabajo fue desarrollado por Luisiana Augusta Galeas Lema bajo mi supervisión. ________________________ Ing. Marcelo Albuja DIRECTOR DEL PROYECTO ________________________ Ing. Marcelo Salvador CODIRECTOR DEL PROYECTO AGRADECIMIENTOS A Dios por permitirme culminar este objetivo con sabiduría y fortaleza, por impulsar mis pensamientos y guiar mis acciones. A mis padres, Norma y Luis, que con sus sacrificios fomentaron en mí el espíritu de superación y trabajo; gracias por soportar mi mal genio y por depositar su total confianza en mí. A mi hermano y hermanas Danilo, Pao y Liz de quienes recibí su apoyo durante este largo trajinar; y en especial a mis sobrinos Ximenita, Danna y José que con sus locuras alegraron mis días. A mi enamorado Alejandro por su cariño, apoyo y motivación por culminar este proyecto en momentos de desánimo. A mi ñaña Euge, ñaño Pato y Dani por su amor y preocupación, que aunque no estemos cerca siempre están pendientes de mí. Al Ing. Marcelo Albuja por su dirección y predisposición de ayuda para alcanzar el término de este proyecto. Al Ing. Marcelo Salvador por sus conocimientos y amistad, quien estuvo presto a solucionar las inquietudes generadas en el desarrollo del proyecto. A Don Ca, Ing. Mario Aldás, Carlitos y Lore por su colaboración y consejos, por su ejemplo de seres humanos y profesionales; en sí a todos quienes conforman el Laboratorio de Operaciones Unitarias gracias por su amabilidad y apoyo. A mis amigas y amigos Letty, Tania, Andre, Gaby, Mafer y Cris quienes compartieron conmigo las diferentes etapas de la carrera y de quienes recibí una valiosa amistad. DEDICATORIA A lo más valioso que Dios me dio, mis padres, Luis y Norma, quienes consagraron sus días para guiarme y educarme. i ÍNDICE DE CONTENIDO PÁGINA RESUMEN xiv INTRODUCCIÓN xv 1. REVISIÓN BIBLIOGRÁFICA 1 1.1. El limón Tahití (Citrus latifolia Tanaka) 1.1.1. Generalidades 1.1.2. Clasificación botánica 1.1.3. Nombres comunes 1.1.4. Descripción botánica 1.1.4.1. Planta 1.1.4.2. Hojas 1.1.4.3. Flor 1.1.4.4. Fruto 1.1.5. Condiciones climáticas y edáficas de cultivo 1.1.5.1. Condiciones Climáticas 1.1.5.2. Condiciones Edáficas 1.1.6. Siembra y fertilización 1.1.7. Cosecha 1.1.8. Composición nutricional 1.1.9. Aplicaciones industriales y propiedades 1.1.10. Producción en el Ecuador 1.1.10.1. Producción en el cantón Patate 1 1 1 2 2 2 2 3 3 5 5 6 7 7 8 9 11 12 1.2. Pectina 1.2.1. Ubicación 1.2.2. Estructura 1.2.2.1. Protopectina 1.2.2.2. Pectina 1.2.3. Esterificación de las pectinas y su categorización 1.2.3.1. Contenido de metóxilos 1.2.3.2. Grado de esterificación 1.2.3.3. Pectinas muy esterificadas 1.2.3.4. Pectinas poco esterificadas 1.2.4. Propiedades de modificación 1.2.4.1. Formación de geles y resistencia 1.2.5. Métodos de extracción 14 14 15 16 16 19 19 19 20 21 22 22 24 ii 1.2.6. 1.2.7. 1.2.8. 2. 1.2.5.1. Extracción con soluciones ácidas 1.2.5.2. Extracción con previa aplicación de ondas microondas 26 1.2.5.3. Extracción enzimática Usos y aplicaciones Normalización de la pectina Demanda de pectina en el ecuador 27 28 30 30 METODOLOGÍA 2.1. Caracterización del limón de la variedad Tahití (Citrus latifolia Tan.) 2.1.1. Selección de la materia prima 2.1.2. Caracterización de las muestras 2.1.2.1. Caracterización física 2.1.2.2. Caracterización química 2.1.3. Análisis estadístico 2.2. Determinación de la cinética de reacción para la obtención de la pectina 2.2.1. Número de repeticiones 2.2.2. Tratamiento previo 2.2.3. Proceso para la extracción de pectina del limón de la variedad Tahití (Citrus latifolia Tan.) 2.2.3.1. Procedimiento 2.2.4. Determinación de los parámetros cinéticos de la obtención de la pectina 2.3. Determinación de la cinética de secado de la pectina gel 2.3.1. Obtención del la mejores condiciones del proceso de deshidratación de la pectina 2.3.2. Análisis del perfil de deshidratación, modelización y cinética 2.4. Caracterización de la pectina obtenida de la corteza del limón 2.5. Diseño del reactor para la hidrólisis y del secador de la pectina a escala piloto. 2.5.1. Diseño del reactor para la hidrólisis a escala piloto 2.5.2. Diseño del secador de la pectina a escala piloto 2.5.3. Costos de materia prima, insumos y de producción de pectina 25 33 34 34 35 36 36 36 37 37 37 38 38 41 42 42 43 43 44 45 46 47 iii 3. RESULTADOS Y DISCUSIÓN 3.1. Resultados de la caracterización del limón de la variedad Tahití (Citrus latifolia tan.) 3.1.1. Resultados de la selección de la materia prima 3.1.2. Resultados de la caracterización del limón tahití 3.2. Resultados de la determinación de la cinética de reacción para la obtención de la pectina 3.2.1. Resultado del número de repeticiones 3.2.2. Resultados del tratamiento previo 3.2.3. Resultados del proceso de la extracción de pectina el limón de la variedad tahití (Citrus latifolia Tan.) 3.2.4. Resultados de la determinación de los parámetros cinéticos de la obtención de la pectina 3.3. Resultados de la determinación de la cinética de secado de la pectina gel 3.3.1. Resultados de la obtención del la mejores condiciones del proceso de deshidratación de la pectina 3.3.2. Resultados del análisis del perfil de deshidratación, modelización y cinética 3.4. Resultados de la caracterización de la pectina obtenida de la corteza del limón 48 48 48 49 53 53 53 57 62 67 67 71 79 3.5. Resultados del diseño del reactor para la hidrólisis y del secador de la pectina a escala piloto. 3.5.1. Resultados del diseño del reactor para la hidrólisis a escala piloto 3.5.1.1. Cuerpo, tapa y fondo 3.5.1.2. Sistema de agitación y calentamiento 3.5.2. Resultados del diseño del secador a escala piloto 3.5.2.1. Armario, bandejas y cámara de secado 3.5.2.2. Sistema de ventilación 3.5.2.3. Sistema de calentameinto 3.5.3. Resultados de costos de materia prima, insumos y de producción de pectina 102 4. 107 CONCLUSIONES Y RECOMENDACIONES 82 83 83 86 90 90 96 99 4.1. Conclusiones 107 4.2. Recomendaciones 109 iv REFERENCIAS BIBLIOGRÁFICAS 111 ANEXOS 126 v ÍNDICE DE TABLAS PÁGINA Tabla 1. 1. Clasificación Botánica del limón Tahití 1 Tabla 1. 2. Contenido nutricional del limón Tahití 8 Tabla 1. 3. Total de exportaciones del limón Tahití del Ecuador 12 Tabla 1. 4. Exportaciones del limón Tahití en los últimos cuatro años 12 Tabla 1. 5. Área planta 13 Tabla 1. 6. Producción y rendimiento del área cosechada del limón Tahití. 13 Tabla 1. 7. Porcentaje de pectina en ciertos vegetales y frutos 15 Tabla 1. 8. Tiempo de gelificación de pectinas 23 Tabla 1. 9. Países proveedores de pectina al Ecuador 31 Tabla 1. 10. Industrias importadoras de materias pécticas en el Ecuador 31 Tabla 2. 1. Equipos 33 Tabla 2. 2. Materiales 33 Tabla 2. 3. Reactivos 34 Tabla 3. 1. Resumen de las características físicas del fruto de la variedad Tahití 51 Resumen de las características químicas del fruto de la variedad Tahití 52 Tabla 3. 3. Resultado visual de la pectina obtenida a 75 °C y 91 °C 54 Tabla 3. 4. Condiciones de extracción definidas en el tratamiento previo para el limón Tahití 57 Tabla 3. 5. Grados Brix reportados durante el proceso de Lavado II 59 Tabla 3. 6. Rendimiento en base seca y húmeda de pectina de diferentes limoneros 60 Rendimiento en base seca y húmeda de pectina de diferentes especies 61 Tabla 3. 2. Tabla 3. 7. vi Tabla 3. 8. Resultados de la cuantificación de pectina a diferentes tiempos de extracción (pH 1,5; relación 1/3) 62 Tabla 3. 9. Expresiones de la velocidad de reacción 64 Tabla 3. 10. Factor de correlación según el orden de reacción 66 Tabla 3. 11. Ecuaciones de linealización como Reacción de Primer orden 67 Tabla 3. 12. Condiciones de deshidratación de la pectina gel 68 Tabla 3. 13. Contenido de metóxilos a las condiciones de 1,4 y 1,8 m/s de aire 70 Tabla 3. 14. Datos de humedad de pectina a diferentes intervalos de tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire 71 Datos de la rapidez de deshidratación respecto al tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire 76 Parámetros del proceso de deshidratación de la pectina a 50,0 °C y 1,8 m/s de aire 78 Características del producto final del limón Tahití (Citrus latifolia Tan.) 80 Tabla 3. 18. Importaciones anuales, mensuales y diarias de pectina 82 Tabla 3. 19. Componentes de la carga de cada reactor batch 84 Tabla 3. 20. Dimensiones del reactor batch para la extracción de pectina 85 Tabla 3. 21. Espesor calculado, por corrosión y nominal del reactor 86 Tabla 3. 22. Dimensiones de la tapa y fondo del reactor 86 Tabla 3. 23. Características y dimensiones del agitador 87 Tabla 3. 24. Dimensiones de la chaqueta de calentamiento 88 Tabla 3. 25. Alimentación del gel, agua a eliminar y tiempo de secado de la pectina 90 Tabla 3. 26. Área de diseño del secador 91 Tabla 3. 27. Características y dimensiones de las bandejas 92 Tabla 3. 28. Dimensiones de las carro y cámara de secado 93 Tabla 3. 15. Tabla 3. 16. Tabla 3. 17. vii Tabla 3. 29. Condiciones térmicas de entrada y salida del aire 96 Tabla 3. 30. Parámetros del ventilador para el secado de pectina gel. 98 Tabla 3. 31. Dimensiones del ventilador para el secado de pectina gel. 98 Tabla 3. 32. Características de las resistencias con aletas 100 Tabla 3. 33. Áreas del diagrama PFD. 102 Tabla 3. 34. Detalle de los costos de los cítricos e insumos 102 Tabla 3. 35. Detalle de los costos de servicios industriales 104 Tabla 3. 36. Detalle de los costos de mano de obra 105 Tabla 3. 37. Recopilación de los elementos de producción de 2400 kg de pectina al año 105 Valores de los parámetros estadísticos para la determinación del número de repeticiones 133 Tabla AXI. 1. Registro de los datos de humedad 147 Tabla AXI. 2. Registro de los datos de cenizas 147 Tabla AXI. 3. Peso de las muestras libre de humedad y cenizas 148 Tabla AXI. 4. Consumo de NaOH para la determinación de las propiedades estructurales 148 Reporte de peso equivalente, metóxilos, ácido galacturónico y ET 148 Tabla AXII. 1. Clases de cabezas para tanques cilíndricos 153 Tabla AXII. 2. Dimensiones de la cabeza estándar para un diámetro de 34 in 159 Tabla AXIII. 1. Condiciones térmicas de entrada y salida del aire 174 Tabla AXIII. 2. Condiciones de humedad del aire para la deshidratación de pectina 175 Detalle del consumo de energía de los equipos requeridos para generación de 2400 kg/año de pectina 187 Tabla AVI. 1. Tabla AXI. 5. Tabla AXIV. 1. viii ÍNDICE DE FIGURAS PÁGINA Figura 1. 1. Flor y fruto de la variedad Tahití 4 Figura 1. 2. Corte transversal del limón 4 Figura 1. 3. Propiedades del limón 14 Figura 1. 4. Pared celular 14 Figura 1. 5. Estructura de un fragmento de cadena de ácido galacturónico 16 Figura 1. 6. Estructura de la región rugosa 18 Figura 1. 7. Representación del modelo estructural de la pectina 19 Figura 1. 8. Pectina muy esterificada 21 Figura 1. 9. Pectina poco esterificada 22 Figura 1. 10. Método de enlace entre pectinas para la generación del hidrogel 24 Figura 1. 11. Acción de la endo-poligalacturonasa (endo-PG) y pectinesterasa (PE) 28 Figura 2. 1. Tabla colorimétrica del Limón Persa o Tahití 35 Figura 2. 2. Esquema del sistema de extracción utilizado en el laboratorio de Operaciones Unitarias 40 Figura 2. 3. Parámetros de caracterización del producto 44 Figura 2. 4. Parámetros del costo de producción de pectina 47 Figura 3. 1. Frutos del limón Persa o Tahití seleccionados para el estudio 48 Figura 3. 2. Valores del diámetro ecuatorial del Limón Persa o Tahití 49 Figura 3. 3. Valores del peso por unidad del limón Persa o Tahití. 50 Figura 3. 4. Porcentaje de corteza por unidad del limón Persa o Tahití. 51 Figura 3. 5. Variables del tratamiento preliminar de extracción. 53 Figura 3. 6. Generación de pectina (pH 1,5 y 3,0), en el tratamiento preliminar de extracción 55 ix Figura 3. 7. Prueba de precipitación de pectina, (izquierda) relación 1/3, (derecha) relación (1/6) en el tratamiento preliminar de extracción 57 Esquema de la secuencia de operaciones unitarias para la obtención de pectina del limón Tahití o Persa a escala de laboratorio 58 Valor medio y rango de desviación del rendimiento en base seca de pectina del Limón Persa o Tahití, de acuerdo a las seis repeticiones 59 Representación de la masa de pectina en función del tiempo de tratamiento, repetición 1, 2 y 3 63 Representación de la masa de pectina en función del tiempo de tratamiento, repetición 4, 5 y 6 63 Método integral de linealización de los datos de extracción R2, reacción de primer orden 65 Método integral de linealización de los datos de extracción R2, reacción de segundo orden 65 Perfil de deshidratación de pectina a 50,0 °C, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s 69 Perfil de deshidratación del periodo de velocidad constante, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s 69 Perfil de deshidratación de pectina, generado por los datos en base húmeda 73 Etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire 74 Modelización de las etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire 75 Velocidad de deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s 77 Figura 3. 20. Aspecto físico del producto del limón de la variedad Tahití 79 Figura 3. 21. Valores medios de las propiedades estructurales de la pectina del limón Tahití (Citrus latifolia Tan.) 81 Diseño del reactor y agitador para la hidrólisis de la protopectina 89 Figura 3. 8. Figura 3. 9. Figura 3. 10. Figura 3. 11. Figura 3. 12. Figura 3. 13. Figura 3. 14. Figura 3. 15. Figura 3. 16. Figura 3. 17. Figura 3. 18. Figura 3. 19. Figura 3. 22. x Figura 3. 23. Parámetros para la estimación del espesor de lana de vidrio en el secador requeridos por el programa ECOWIN GREEN 94 Figura 3. 24. Resultados del programa ECOWIN GREEN 94 Figura 3. 25. Diseño del armario portador de bandejas para la pectina gel 95 Figura 3. 26. Diseño del secador de la pectina gel a escala piloto 101 Figura 3. 27. Diagrama de flujo del proceso de obtención de pectina del limón Tahití (Citrus latifolia Tan.) a escala piloto 103 Porcentaje de intervención de los elementos de producción para la generación de 2400 kg/año de pectina. 105 Figura AI. 1. Tamaño de muestra para análisis de frutos medianos 127 Figura AII. 1. Clasificación del limón Tahití de acuerdo a sus propiedades físicas 128 Linealización de los datos de extracción R1, reacción de primer orden 137 Linealización de los datos de extracción R1, reacción de segundo orden 137 Linealización de los datos de extracción R3, reacción de primer orden 138 Linealización de los datos de extracción R3, reacción de segundo orden 138 Linealización de los datos de extracción R4, reacción de primer orden 139 Linealización de los datos de extracción R4, reacción de segundo orden 139 Linealización de los datos de extracción R5, reacción de primer orden 140 Linealización de los datos de extracción R5, reacción de segundo orden 140 Linealización de los datos de extracción R6, reacción de primer orden 141 Linealización de los datos de extracción R6, reacción de segundo orden 141 Figura 3. 28. Figura AVII. 1. Figura AVII. 2. Figura AVII. 3. Figura AVII. 4. Figura AVII. 5. Figura AVII. 6. Figura AVII. 7. Figura AVII. 8. Figura AVII. 9. Figura AVII. 10. xi Figura AVIII. 1. Modelización de las etapas de la velocidad deshidratación de la pectina del limón Tahití a 50 ̊C y 1,8 m/s de aire 142 Metodología de caracterización de la pectina del limón de la variedad Tahití 150 Figura AXII. 1. Volumen de cabezas torriesféricas 155 Figura AXII. 2. Velocidad de pérdida por corrosión 159 Figura AXII. 3. Relaciones entre las dimensiones del reactor y agitador 160 Figura AXII. 4. Relaciones de las dimensiones del agitador 161 Figura AXII. 5. Comportamiento del número de potencia. 162 Figura AXIII. 1. Especificaciones de los perfiles de acero inoxidable 168 Figura AXIII. 2. Especificaciones de los ángulos de acero inoxidable 168 Figura AXIII. 3. Especificaciones de ruedas giratorias 171 Figura AXIII. 6. Rangos de diseño para la presión estática 176 Figura AXIII. 7. Característica de la boca de captación de aire para el secado 176 Figura AXIII. 8. Parámetros del ventilador axial 179 Figura AXIII. 9. Dimensiones del ventilador axial 180 Figura AX. 1. Figura AXIII. 10. Especificaciones de resistencias con aletas 182 xii ÍNDICE DE ANEXOS PÁGINA ANEXO I Extracto de la norma NTE INEN 1750 (1994): Hortalizas y frutas frescas. Muestreo 127 ANEXO II Extracto de la norma NTE INEN 1757 (2008): Frutas frescas. Limón. Requisitos 128 ANEXO III Extracto de la norma INEN 0389 (1986): Conservas vegetales. Determinación de la concentración del ión hidrógeno (pH) 129 ANEXO IV Extracto de la norma NTE INEN 0381 (1986): Conservas vegetales. Determinación de la concentración del ión hidrógeno (pH) 130 ANEXO V Extracto de la norma NTE INEN 0381(1986): Determinación de sólidos solubles. Método refractométrico 132 ANEXO VI Determinación del número de repeticiones para el análisis de la cinética de extracción 133 ANEXO VII Metodología del análisis cinético de la extracción de pectina del limón Tahití 135 ANEXO VIII Determinación de la humedad crítica y velocidad constante a las condiciones de 50 °C y 1,8 m/s de aire 142 ANEXO IX Normas AOAC: Humedad y cenizas 144 ANEXO X Método de valoración ácido - base para análisis de las pectinas 146 xiii ANEXO XI Registro de las características y propiedades estructurales de la pectina del limón Tahití 147 ANEXO XII Determinación de la producción a escala piloto y síntesis de cálculos para el diseño del reactor para la hidrólisis 149 ANEXO XIII Síntesis de cálculos para el diseño secador de pectina a escala piloto 164 ANEXO XIV Demanda energética de los principales equipos descritos en el PFD del proceso de extracción a escala piloto 183 xiv RESUMEN El presente estudio tiene como objetivo el diseño de un proceso para la obtención de pectina a partir de la corteza del limón de la variedad Tahití (Citrus latifolia Tan.), para lo cual se emplearon frutos provenientes de la Asociación de productores Quinlata del cantón Patate, provincia de Tungurahua, los mismos que fueron seleccionados bajo el parámetro colorimétrico verde oscuro. Se determinaron las propiedades físicoquímicas de los limones, con lo que se obtuvieron valores promedios de 6,04 cm de diámetro longitudinal con un peso unitario de 69,7225 g y un porcentaje de corteza del 35,43 % con un nivel de madurez 2. El proceso de extracción fue evaluado a escala de laboratorio, donde las variables de operación fueron la temperatura, pH, tiempo y la relación masa de corteza/volumen de medio. Se definieron como las mejores condiciones del tratamiento 75 °C; 1,5; 80 min y 1/3; cuyo efecto representó el incremento de pectina por cantidad de materia prima empleada. Se obtuvo el perfil de extracción a los tiempos de 15, 25, 35, 45, 60 y 80 min; donde se determinó que la reacción de obtención de pectina corresponde a una de primer orden con un factor de velocidad de 0,0286 min-1. Se obtuvo el perfil de deshidratación de la pectina coloidal a 50 °C y una velocidad de aire 1,8 m/s, del cual se determinó una humedad crítica de 11,8731 kg de agua/kg de pectina seca, una de equilibrio de 0,0556 kg de agua/kg de pectina seca y un tiempo de secado de 11,41 h bajo una velocidad constante de 1,3527 kg agua/m2h. La pectina se caracterizó como un producto con 5,86 % de humedad en base húmeda y 1,21 % de cenizas; con propiedades estructurales de 2 456,4505 peso equivalente; 3,55 % metóxilos; 27,47 % ácido galacturónico y 72,85 % grado de esterificación. Se diseñó un reactor tipo batch a escala piloto con una capacidad de 0,87 m3 y un secador con un área de 31,78 m2, que permitan producir 10 kg de pectina con un costo de fabricación de 199,30 $/kg. xv INTRODUCCIÓN En la actualidad el aditivo denominado pectina, es requerido por la industria ecuatoriana en alrededor de 48,55 t por año (Banco Central del Ecuador, 2014) con tendencia a incrementar, cuya demanda no es abastecida nacionalmente; por lo que el país se ve obligado a importar. La nula existencia de industrias enfocadas a su producción, hace de sus consumidores un mercado potencial. La pectina se comercializa sólida, de apariencia blancuzca-amarillenta (FAO, 2009, p. 1); siendo las modas o cortezas de cítricos sus principales reservas. Según los datos estadísticos del INEC en el 2013, los cultivos nacionales generaron 10 915 t de limones y limas, definiéndole al Ecuador como un país altamente citrícola, cuya producción se ve favorecida por la continua cosecha que obedece a las características tropicales que posee (Corpei, 2009, p.3). Pese a ello la industrialización de dichos frutos no ha evolucionado; pues estos se destinan en su mayoría como frutos de consumo inmediato; siendo esta la causa de una gran contradicción latinoamericana como lo es exportar la materia prima e importar sus productos (Corpei, 2009, p.3). La importancia de las pectinas se basa principalmente en su propiedad para transformar la viscosidad de los alimentos, tornándoles más espesos; es por ello de su uso en productos que requieren dicha textura como lo son: mermeladas y conservas (Chasquibol, Arroyo y Morales, 2008, p. 180). En otras aplicaciones se la utiliza como excipiente envolvente y desintegrador en la formulación de cápsulas de fármacos; por su clasificación como fibra soluble se la utiliza en procedimientos para disminuir el peso corporal y control de niveles de colesterol (Mamani, Ruiz y Veiga, 2011, p. 85). Los limones con una madurez menor presentan en sus tejidos una cantidad superior de pectina, debido a la baja actividad de las enzimas degradadoras de esta; por lo que es necesario evaluar su obtención a partir de frutos ecuatorianos como el Tahití para fomentar su tecnificación. 1 1. REVISIÓN BIBLIOGRÁFICA 1.1. EL LIMÓN TAHITÍ (Citrus latifolia Tanaka) 1.1.1. GENERALIDADES El limón Tahití o Persa (Citrus latifolia Tanaka) es calificado como una lima ácida y es resultado de la combinación de dos especies de cítricos: la lima mexicana (Citrus aurantifolia) y la cidra (Citrus medica linn) (Malo, Campbell, Balerdi y Crane, 2012, p. 1). Dicho fruto es originario de la isla Tahití, en Oceanía y se ha distribuido en regiones tropicales y subtropicales, siendo los principales países productores: México, Brasil, España y Argentina. En el Ecuador se localiza en el Litoral, Imbabura, Pichincha, Tungurahua, Bolívar y Napo (UTEPI, 2006, pp. 17-18). 1.1.2. CLASIFICACIÓN BOTÁNICA La clasificación botánica del limón Tahití se detalla en la Tabla 1.1. Tabla 1. 1. Clasificación Botánica del limón Tahití Nombre Científico Citrus latifolia Tan. Género Citrus Especie Latifolia Clase Dicotiledóneas Subclase Arquiclamídeas Orden Geraniales Suborden Geraniineas Familia Rutaceae Subfamilia Aurantioideas (Cañizares, Sanabría y Rojas, 2005, p. 68) 2 1.1.3. NOMBRES COMUNES Limón Thaití o limón de Persia en Estados Unidos y Sudamérica, en México se lo conoce como limón sin semilla; y en otros idiomas: Seedles Lime, Persian Lime, Bears Lime y Limettier-Limonellenbaum (Malo et al., 2012, p. 1). 1.1.4. DESCRIPCIÓN BOTÁNICA 1.1.4.1. Planta El árbol presenta una altura máxima de 5 m, un tronco corto y varias ramificaciones que se extienden en distintas direcciones, varias de ellas tienden a la base del árbol. Sus ramas están dotadas de pequeñas espinas y forman una copa frondosa y redondeada (Malo et al., 2012, p. 1; Orduz, León y Arango, 2009, p. 8) Este limonero se caracteriza por no presentar periodos de inactividad vegetativa, únicamente a temperaturas bajas reduce su crecimiento, favoreciendo así su productividad (Jasso et al., 2011, pp. 203-204). Dicho árbol frutal se diferencia de los demás limoneros por alcanzar mayores alturas, mantener su follaje y producir frutos de mayor diámetro (Orduz et al., 2009, p. 6). 1.1.4.2. Hojas Las hojas son de color verde, de forma elíptica y lanceolada, alargadas de 2,5 a 9,0 cm, su borde es levemente dentado y su peciolo cilíndrico (Cañizares et al., 2005, p. 68). Se encuentran de forma alternada en las ramas y se mantienen en ellas por tiempo aproximado de 3 años (Malo et al., 2012, p. 1). 3 1.1.4.3. Flor De forma continua en el año se tiene la presencia de la yema floral, la cual es pequeña, ovalada y de color blanco con tintes violeta; a partir de ella se desarrolla la flor alcanzando un tamaño de 2,5 cm. Las flores se ubican de manera solitaria o en conjunto y su corola está formada por 5 pétalos libres que despiden un aroma característico intenso (Malo et al., 2012, p. 1). 1.1.4.4. Fruto El tamaño del fruto oscila de 5 a 7 cm de diámetro, de 76 g de masa media, su forma es ovoide y uno de sus extremos se reduce ligeramente hasta terminar en un pequeño abultamiento (Malo et al., 2012, p. 1; Orduz et al., 2009, p. 8). El fruto no tiene semillas en su interior, por la esterilidad de su polen y su crecimiento se da naturalmente en la planta, por acción de hormonas internas (Orduz et al., 2009, p. 8). La morfología del fruto es particular de los cítricos, presenta un flavedo liso y de color verde oscuro, de 2 mm de espesor; a medida que avanza al estado de madurez su tonalidad cambia a amarilla y su espesor se reduce. El área del albedo es blanca, blanda y gruesa; y la región interna está dividida en pequeñas secciones donde se almacena el jugo (Malo et al., 2012, p. 1). En la Figura 1.1 y Figura 1.2 se observa la flor y la estructura del fruto de la variedad Tahití. 4 Figura 1. 1. Flor y fruto de la variedad Tahití (Orduz et al., 2009, p. 8) Figura 1. 2. Corte transversal del limón (Fréderique, 2014, p.2) 5 1.1.5. CONDICIONES CLIMÁTICAS Y EDÁFICAS DE CULTIVO 1.1.5.1. 1.1.5.1.1. Condiciones Climáticas Temperatura Esta variedad de limón presenta buena resistencia a diversos climas, sin embargo el clima cálido, tropical o subtropical es el que favorece su crecimiento. El brote floral se da de manera continua en climas que mantengan su temperatura entre 22 y 28 °C; y de forma temporal al reducir a los 12 °C (Piña, Laborem, Monteverde, Magaña, Espinoza y Rangel, 2006, p. 435). Generalmente el periodo desde que la flor nace hasta que se obtiene el fruto adecuado para cosecha dura 2 meses, lo cual se ve ralentizado por las bajas temperaturas incrementando el tiempo hasta 4 meses (Malo et al., 2012, p. 2). 1.1.5.1.2. Precipitación y humedad relativa Estos árboles demandan anualmente entre 1 000 a 2 000 mm de agua para su desarrollo, por lo que en épocas de bajas precipitaciones se utiliza acoplamientos de riego, a fin de no afectar la producción (Piña et al., 2006, p. 435). La humedad relativa de la región no debe ser elevada para un óptimo cultivo, ya que un valor alto puede mejorar la textura del fruto pero lo vuelve vulnerable a enfermedades (Escobar, 2008, p. 27). 1.1.5.1.3. Nivel Se localiza en regiones de 500 a 1200 msnm, por su requerimiento de climas calientes, lo cual está directamente relacionado (Piña et al., 2006, p. 435). 6 1.1.5.1.4. Vientos La frecuencia máxima del viento en las zonas de cultivo debe ser de 20 km/h, debido a las consistencia y frondosidad de su copa (Escobar, 2008, p. 27). 1.1.5.2. Condiciones Edáficas 1.1.5.2.1. Suelo Se adaptan en territorios francos arenosos, permeables, sin exceso salino y con una profundidad mayor a 2 m. No se desarrollan en suelos calcáreos (Malo et al., 2012, p. 2). 1.1.5.2.2. pH El suelo óptimo para el cultivo presenta un pH de 5,5 a 7,0; siendo su límite básico 8,5. El pH está en función de los minerales a absorber, por tal razón es necesario considerar las características de solubilidad de los mismos (Pinto, 2008, p. 51). 1.1.5.2.3. Pendiente Un factor determinante en la localización de las plantaciones es la pendiente, la cual no debe sobrepasar los 28 °, a fin de evitar el desgaste del terreno (Escobar, 2008, p. 32). 1.1.5.2.4. Humus Un contenido de 3 a 4 % es adecuado para el cultivo (Barrera, 2008, p. 1). 7 1.1.6. SIEMBRA Y FERTILIZACIÓN El Limón Persa se obtiene mediante injerto de tipo escudete en patrones de las variedades: Limón Macrofila, Mandarino Cleopatra, Volkameriana y Citrumelo Swingle. La inserción de la yema se realiza a 30 cm de altura de planta patrón y dura 5 días hasta acoplarse y brotar en él (Malo et al., 2012, p. 1; Piña et al., 2006, p. 435). La siembra se realiza mediante el método de ahoyado, en una profundidad de 40 cm y con la adición de materia orgánica e insecticida. La distancia entre sitios es de 3 a 6 m (Orduz y Mateus, 2012, p. 72). La poda debe ser moderada asegurándose mantener las ramas productivas, se la realiza de forma manual conservando un dimensión horizontal de 2 a 3 m (Malo et al., 2012, p. 3). Riego por gravedad, goteo o aspersión con una frecuencia promedio de 2 días por semana y en épocas secas hasta 4 días por semana (Orduz y Mateus, 2012, p. 84). El desarrollo y la producción están relacionados con la fertilización, sus necesidades de nitrógeno, fósforo y potasio son 5,00 kg, 2,00 kg y 1,88 kg por tonelada de fruta respectivamente (Orduz y Mateus, 2012, pp. 72-73). 1.1.7. COSECHA La recolección de los frutos se realiza continuamente en el año y cuando su corteza haya adquirido un color verde brillante y una acidez entre 4 – 7 %. Esta operación se efectúa manualmente mediante la flexión de su rabillo o utilizando tijeras adecuadas, los frutos más altos se los obtiene mediante ganchos, evitando que sufran daños al desprenderse. 8 Se debe evitar la recolección de los frutos cuando presenten agua en su superficie ya que esta incrementa la posibilidad de sufrir alteraciones en su corteza, adherencia de hongos y fracturación de las vesículas internas caracterizada por el manchamiento de la piel (Pinto, 2008, p. 54). 1.1.8. COMPOSICIÓN NUTRICIONAL La riqueza nutricional que posee el limón se expone en la Tabla 1.2. Tabla 1. 2. Contenido nutricional del limón Tahití Componente Cantidad /100g de fruto Potasio 135,0 mg Vitamina C o ácido ascórbico 52,0 mg Calcio 16,0 mg Fósforo 13,0 mg Sodio 10,0 mg Glúcidos 9,6 g Proteínas 0,8 g Lípidos 0,6 g Ácido cítrico 4,7 g Agua 90 % Calorías 19 kcal (Fréderique, 2014, p. 17) Dentro de su género, el limón es el fruto que mayor cantidad de ácido ascórbico posee, el cual se ve fortalecido por la presencia de Riboflavina que inhibe su pérdida por oxidación. Además presenta un elevado contenido de minerales y bajo porcentaje de calorías que le convierte en una importante fuente nutricional. De forma particular su corteza presenta abundante pectina y aceite esencial, en el cual se ha registrado: Citral (5%) 9 Limoneno (90 %) Canfeno Pineno (alfa y beta) Cumarina Iso-pulegol Terpineno (alfa y gamma) Felantreno Beta-bergamoteno (Mejías y Aflallo, 2007, p. 59). Sus hojas poseen cafeína y entre otros compuestos el limón presenta: Bioflavonoides: Quercetina, limotricina, hesperidina, vitamina B1, B2 y B6 Hierro, Magnesio Ácido málico, caféico (Jordá, 2011, p. 666). 1.1.9. APLICACIONES INDUSTRIALES Y PROPIEDADES La demanda artesanal e industrial de esta variedad es extensa, aprovechándose todos los componentes de su fruto, así como también las flores de su árbol. El zumo se emplea en la preparación de bebidas, el cual se comercializa como concentrado o jugo. Se elabora aderezos y aliños para alimentos, para dotar de un sabor agrio o evitar la oxidación de ciertos vegetales; y por su alto contenido de ácido cítrico, se lo emplea en su proceso de obtención con carbonato de barita y ácido sulfúrico hasta formar cristales blancos de múltiples aplicaciones en el campo alimentico y farmacéutico (Malo et al., 2012, p. 3). La principal aplicación del pericarpio es la producción de pectina como modificador de la reología de alimentos, el pericarpio puede provenir directamente de cosechas designadas a este fin o de residuos industriales (de bebidas, licores). 10 La corteza húmeda o seca se emplea en formulaciones alimenticias para ganado porcino y vacuno por su alto porcentaje de fibra, que conjuntamente con suplementos propone un alimento adecuado para animales (Albarracín, Prieto, Barnes, Paz y Genta, 2011, p. 1). El aceite aromático se extrae de la corteza oleosa y se lo utiliza como material desinfectante o fragancia; se lo obtiene mediante la técnica de arrastre de vapor o raspadura con un rendimiento de 10 mL/kg de limón. También se comercializa refinado mediante su desterpenación para evitar el enranciamiento y mejorar sus propiedades, el cual se lo utiliza en bebidas (Fréderique, 2014, p. 14; Ortuño, 2006, p. 11). La aplicación en perfumería es amplia, también de la flor blanca del limonero se extrae el Neroli petalae, muy apetecido por su aroma dulce y por sus beneficios en tratamientos de la piel. Por su contenido de antioxidantes (flavonoides) se consume el fruto como tal, al cual se le atribuyen beneficios medicinales contra el envejecimiento de la piel y propiedades anticancerígenas. Por su riqueza en limoneno es calificado como desintoxicante del organismo; y por el elevado índice de ácido ascórbico y minerales es un regenerador de las células sanguíneas previniendo enfermedades como la anemia (Mejías y Aflallo, 2007, p. 241). En la Figura 1.3 se sintetizan las propiedades del limón, con las cuales se fundamenta la acción positiva de este cítrico al ser consumido por el ser humano, es así que Morales (2011), lo califica como una fuente de más de mil beneficios químico-medicinales (p. 104). 11 Figura 1. 3. Propiedades del limón (Fréderique, 2014, p. 18) 1.1.10. PRODUCCIÓN EN EL ECUADOR La variedad Tahití llegó al Ecuador en la década de los cincuenta, su proporción de árboles asciende a 269 683 (INEC, 2013), ubicados en las regiones Costa, Sierra y Amazónica, donde se destacan las provincias de Manabí, Guayas, El Oro, Pichincha, Imbabura, Tungurahua, Bolívar, Loja y Napo (UTEPI, 2006, pp. 22-23). En el Ecuador la producción del limón Tahití o Persa está mayoritariamente encaminada a la exportación a países como: Estados Unidos, Canadá, Puerto Rico, Francia y a las Antillas Holandesas y de Guadalupe, cuyos mercados se ven abastecidos por la continua producción del país, que al poseer regiones de características tropicales propicia el desarrollo de los cultivos durante todo el año. Según el Banco Central del Ecuador en los últimos cuatro años se ha exportado un total de 680,31 t, como se indica en la Tabla 1.3. 12 Tabla 1. 3. Total de exportaciones del limón Tahití del Ecuador País Cantidad (t) Estados Unidos 555,25 Canadá 48,26 Guadalupe 26,09 Puesto Rico 25,46 Francia 25,27 Antillas Holandesas 0,01 Total de exportaciones 630,31 (Banco Central del Ecuador, 2014) Estados Unidos interfiere con mayor relevancia en las importaciones del limón Tahití ecuatoriano registrando 555,25 t en el periodo del 2010 al 2013, pues a pesar de también producirlo, su cosecha es estacional por lo que tiende a las importaciones para cubrir sus necesidades. Las exportaciones se han incrementado notablemente a medida de los años, por las mejoras en las condiciones de comercialización del país con el exterior, que han categorizado al producto ecuatoriano como un fruto competitivo y de calidad logrando posesionarse en mercados altamente estrictos, como se indica en la Tabla 1.4. Tabla 1. 4. Exportaciones del limón Tahití en los últimos cuatro años Año Cantidad (t) 2010 17,46 2011 22,86 2012 150,85 2013 439,14 (Banco Central del Ecuador, 2014) 1.1.10.1. Producción en el cantón Patate En el área agrícola del cantón Patate el cultivo asociado presenta mayor superficie, esto corresponde a cultivos combinados de diversas clases de cítricos, 13 que comúnmente lo realizan agricultores empíricos que satisfacen el mercado interno de la provincia y del país, sin cumplimiento de parámetros estrictos de cosecha. Sin embargo un porcentaje más bajo reserva zonas determinadas para el cultivo del limón, las cuales reciben asistencia técnica adecuada, a fin de intervenir en mercados más exigentes. En la Tabla 1.5 se observa el área plantada, productiva y cosechada de limón en el cantón Patate. Tabla 1. 5. Área plantada, productiva y cosechada de limón en el Cantón Patate Modo de cultivo Área plantada (hm2) Área productiva (hm2) Área cosechada (hm2) Asociado 48,14 23,42 23,39 Solo 5,91 5,49 5,49 (INEC, 2010) Los monocultivos presentan mayor eficiencia, por las ventajas de esta condición, al tratar regularmente con maquinaria y fertilizantes que permiten normalizar las características del fruto. La producción total del limón corresponde a 100,21 t, con una generación promedio de 137 kg por árbol en cada cosecha. La producción y el rendimiento del área cosechada se observa en la Tabla 1.6. Tabla 1. 6. Producción y rendimiento del área cosechada del limón Tahití. Modo de cultivo Producción (t) Rendimiento (t/hm2) Asociado 64,45 2,76 Sólo 35,76 6,51 Total 100,21 - (INEC, 2010) 14 1.2. PECTINA 1.2.1. UBICACIÓN El término pectina se utiliza de forma general para nombrar a las sustancia pécticas y se definen como polisacáridos complejos de elevado peso molecular, se localizan en los tejidos de reserva de varios vegetales y cítricos. Constituyen la mayor parte de las laminillas intermedias del fruto verde y se encuentran en las membranas celulares y, en pequeña proporción, en todos los tejidos de la planta (Mohmen, 2008, p. 266). La pectina se encuentra en la pared celular entrecruzada por otros polisacáridos como la hemicelulosa, celulosa y lignina, los cuales se enlazan a través de puentes de hidrógeno. La pectina acopla y adhiere internamente las células, proporcionando rigidez y firmeza a la pared (Lodish et al., 2005, p. 232; Velasco, Romero, Salamanca y López, 2009, p. 106). La estructura de la pared celular se presenta en la Figura 1.4. Figura 1. 4. Pared celular (Velasco et al., 2009, p. 107). 15 El albedo, capa blanca y esponjosa de los cítricos, es una fuente importante de pectina, que representa hasta el 50% del material seco, específicamente la pectina extraída de la corteza del limón verde presenta excelentes propiedades de homogeneidad, viscosidad y gelificación. Así también los residuos del plátano y la pulpa de remolacha son fuentes ricas en pectina (Srivastava y Malviya, 2011, p. 12). En la Tabla 1.7, se presenta el porcentaje de pectinas sobre materia fresca y seca de ciertos vegetales y frutos. Tabla 1. 7. Porcentaje de pectina en ciertos vegetales y frutos Producto Porcentaje de pectina sobre: Materia Fresca Materia Seca Cáscaras de plátano - 20 Corteza de naranja 4 35 Corteza de limón 3 32 Corteza de limón verde - 50 Pulpa de remolacha 1 28 (Srivastava y Malviya, 2011, pp. 12-13; Vasquez, Ruesga, D’addosio, Páez y Marín, 2008, p. 318) El porcentaje de pectina varía según la especie del fruto y su estado de maduración. La actividad de la enzima pectinesterasa se incrementa a medida que evoluciona el estado de maduración del fruto, por lo que el porcentaje de pectina insoluble (protopectina) disminuye de las cáscaras, perdiendo su firmeza y quedando más susceptible al ataque de hongos y microorganismos (Guidi y Arandina, 2010, p. 68; Monsalves, Loyola y Muñoz, 2009, p. 10). 1.2.2. ESTRUCTURA En la década del 80 la pectina fue descubierta por Braconnot, químico experto en la extracción de componentes activos de las plantas, quién al observar las 16 características de gelificación de ciertos frutos identificó por primera vez este tipo de polisacárido, denominándole pectina (Leclere, Van y Michiels, 2013, p. 1). La palabra pectina se usa de modo universal para designar “sustancias pécticas” y engloba los siguientes nombres: protopectina y pectina. 1.2.2.1. Protopectina La protopectina es la sustancia péctica madre presente de forma abundante en las laminillas medias de las paredes celulares de plantas verdes, la cual al someterla al calentamiento en una solución de ácido o por acción de enzimas es hidrolizada a pectina soluble (pectina). Se la califica como pectina insoluble al agua (Monsalves et al., 2009, p. 10). 1.2.2.2. Pectina Bioquímicamente la pectina está definida como un grupo de polisacáridos ricos en ácido galacturónico, con unidades de arabinosa y galactosa en intervalos raros; pueden presentar además ramnosa, fructosa y xilosa (Sandoval, 2005, p. 119). Los fragmentos de ácido galacturónico se observan en la Figura 1.5, los cuales presentan una forma piranosa. Figura 1. 5. Estructura de un fragmento de cadena de ácido galacturónico (Wang, Liao, Feng, Zhang, Li y Wang, 2012, p. 257) 17 Los grupos de ácido galacturónico que forman la unidad de la pectina, se unen por medio de enlaces glucosídicos α (1-4) para dar origen a moléculas fibrilares constituidas por muchas unidades. Las macromoléculas poseen una variabilidad de pesos hasta 200 000 daltons (Cerón y Cardona, 2011, pp. 67-68). 1.2.2.2.1. Modelo estructural de la pectina La estructura de la pectina es compleja y todavía se encuentra en debate, siendo el modelo estructural más aceptado aquel que está compuesto por dos regiones importantes: lisa y rugosa; que forman su columna vertebral e involucran tres dominios de polisacáridos presentes en todas los tipos de pectina: homogalacturonano y ramnogalacturonano I y II. Estos tres dominios se unen covalentemente formando la red péctica en toda la pared celular primaria y laminillas intermedias (Schols, Coenen y Voragen, 2009, p. 20; Willats, Knox y Mikkelsen, 2006, p. 98). El homogalacturonano (HGA) es un homopolímero lineal en el que las fracciones de ácido D-galacturónico están unidas por enlaces α(1-4), esta estructura contiene alrededor de 100 a 200 fracciones de ácido D-galacturónico. El HGA es un dominio muy extenso y abundante de pectina que es sintetizado en el aparato de Golgi y depositado en la pared celular; los residuos de ácido D-galacturónico se encuentran en un 70 a 80% metilados en el C-6 y a la vez pueden presentar acetilación en los carbonos C-3 y C-2. Los residuos de ácido galacturónico también pueden ser sustituidos en el C-3 con residuos de xilosa, formándose el xilogaluctoronato (Mohmen, 2008, p. 267) El dominio ramogalacturonano se divide en dos tipos: ramnogalacturonano I y ramnogalacturonano II. El ramnogalacturonano I (RG I) es un polímero heterogéneo y se adhiere al homogalacturonato mediante enlaces glicosídicos; su estructura está formada por más de 100 repeticiones del disacárido α (1-2) - Lramnosa - α(1-4) - D-galacturónico, como se distingue en la Figura 1.6 (Leclere et al., 2013, p. 2). 18 Figura 1. 6. Estructura de la región rugosa (Chasquibol et al., 2008, p. 179) En dicho dominio del 20 al 80% de los residuos de ramnosa están ramificados en el carbono C-4 con cadenas laterales de residuos neutros, los cuales pueden variar en tamaño desde 1 a 50 residuos, generando una familia extensa de polisacáridos. Las cadenas laterales presentan generalmente L-ramnosa, Dgalacturónico, L-arabinosa y D-galactosa (Leclere et al., 2013, p. 2; Willats et al., 2006, p. 98). El ramnogalacturonano II presenta una estructura muy distinta al RG I, contiene azúcares inusuales como: metilfucosa, metilxilosa, ácido acérico, apiosa, 3desoxi D -manno ácido -2-octulosónico, etc.; representado en la Figura 1.7 (Leclere et al., 2013, p. 2). El modelo estructural de las regiones: homogalacturonano y ramnogalacturonano se observan en la Figura 1.7. 19 Figura 1. 7. Representación del modelo estructural de la pectina (Leclere et al., 2013, p. 2) 1.2.3. ESTERIFICACIÓN DE LAS PECTINAS Y SU CATEGORIZACIÓN 1.2.3.1. Contenido de metóxilos El contenido de metóxilos se define al total de grupos carboxilos presentes en forma de éster metílicos (-COOCH3) en la molécula de pectina; su contenido se relaciona directamente con su esterificación. 1.2.3.2. Grado de esterificación El grado de esterificación es una característica importante de las pectinas, se expresa como porcentaje y está definido como la relación entre la cantidad de 20 esterificaciones de los grupos carboxilos con metanol y el contenido de ácido ácido galacturónico. Para determinar el grado de esterificación se presenta la siguiente ecuación [1.1] (Kanmani, Dhivya, Aravind y Kumaresan, 2014, p. 305): 𝐸𝑇 (%) = 176 𝑥 𝑀𝑋% 𝑥 100 31 𝑥 𝐺% [1.1] Donde: ET: Grado de esterificación MX: Contenido de metóxilos G: Contenido de ácido galacturónico anhidro Los valores de 176 y 31 corresponden al peso equivalente del ácido galacturónico y el peso molecular del metóxilo respectivamente. Según los dos parámetros antes mencionados las pectinas se categorizan en dos grupos: 1.2.3.3. Pectinas muy esterificadas Se califica como pectinas muy esterificadas o ricas en grupos metoxi aquellas que presentan un elevado número de ésteres metílicos, por tal razón su porcentaje de esterificación es igual o mayor al 50% (Cerón y Cardona, 2011, p. 67). Las pectinas ricas en grupos metoxi al disolverse generan geles estables en medios cuyo pH es menor a 3,4 y un porcentaje de azúcar elevado, superior al 60%; y son irreversibles al exponerse en el calor. Para la elaboración de confituras y jaleas se requiere un mínimo de 60% de azúcar, por tal razón dichas 21 pectinas son muy utilizadas en su elaboración; además se las aplica como estabilizadores de bebidas lácteas ácidas y como agentes de viscosidad en zumos de frutas sin la alteración del sabor, proporcionando un sabor de zumo muy limpio (Cerón y Cardona, 2011, p. 67; Monsalves et al., 2009, p. 10). 1.2.3.4. Pectinas poco esterificadas Cuando el porcentaje de grupos carboxilos metilados presentes en la cadena de lineal de ácido galacturónico es bajo, se denominan pectinas poco esterificadas. Este tipo de pectinas presentan un porcentaje de esterificación menor al 50% (Cerón y Cardona, 2011, p. 67). Estas pectinas forman geles en presencia de pequeñas cantidades de iones divalentes, en concentraciones de azúcar muy inferiores a las que normalmente se suele utilizar en las mermeladas y jaleas, o bien sin que exista azúcar alguno. Sus geles presentan estabilidad cuando el pH y el azúcar se encuentran en los rangos de 2,5 - 6,5 y 10 - 25% respectivamente (Cerón y Cardona, 2011, p. 67). Al no requerir cantidades elevadas de azúcar las pectinas poco esterificadas se las utiliza en productos dietéticos, yogures naturales y conservas con bajo nivel de azúcar (Chasquibol et al., 2008, p. 192). En las Figuras 1.8 y 1.9 se esquematiza las estructuras de las pectinas. Figura 1. 8. Pectina muy esterificada (Imeson, 2010, p. 245) 22 Figura 1. 9. Pectina poco esterificada (Imeson, 2010, p. 245) 1.2.4. PROPIEDADES DE MODIFICACIÓN 1.2.4.1. Formación de geles y resistencia La gelificación es la capacidad de las pectinas en formar soluciones coloidales, por lo que se precisa otros agentes como: ácido, agua y azúcar, los cuales deben estar en proporciones adecuadas. La molécula de pectina presenta una alta afinidad por la molécula de agua, ya que posee grupos oxhidrilos (-OH) que le otorgan polaridad; dando lugar a la formación de puentes de hidrógeno con el agua. Al disolverse la pectina, sus moléculas se esparcen en el medio y se genera fácilmente la heterólisis de sus radicales carboxi (-COO-); por tal razón se añade sacarosa, que al ser una sustancia también polar interacciona con el agua interfiriendo en la relación aguapectina y a la vez incrementando la unión pectina-pectina (grupos ésteres) que favorece la formación de una estructura tridimensional (Kastner, Einhorn-Stoll y Senge, 2012, p. 43; O’Brien, Philp y Morris, 2009, p. 1818). Otro agente que se adiciona para favorecer la interacción pectina-pectina es el ácido, el cual permite mantener estables los grupos carboxilos de la pectina, evitando su ionización; que provoca que se separen (Kastner et al., 2012, p. 43). 23 Las moléculas de pectinas no se unen completamente, poseen secciones definidas de interacción, donde las moléculas se entrecruzan y dan lugar a una red tridimensional en cuyo interior se almacena agua, a la que se denominada hidrogel (Imeson, 2010, p. 250). El grado de esterificación es directamente proporcional a la velocidad de gelificación, es por ello que, para pectinas de elevado grado de esterificación el tiempo de formación del gel es menor, como se presenta en la Tabla 1.8. Además se debe considerar la temperatura, manteniéndola en un rango de 55-85 °C, con el fin de alcanzar una gelificación normal (Edwards, 2007, p. 126). Tabla 1. 8. Tiempo de gelificación de pectinas Tipo de pectina Grado de esterificación (%) Tiempo de gelificación (s) De gelificación rápida > 72 20-70 De gelificación normal 64 - 72 100-135 De gelificación lenta < 64 180-250 (Edwards, 2007, p. 126; Imeson, 2010, p. 250) La diferencia de tiempos se fundamenta en la complejidad de la vía de gelificación de las pectinas con ET bajo, menor al 64 %; al necesitar calcio para enlazar las moléculas de pectina y acoplarse adecuadamente como gel. Para este tipo de pectinas las fuerzas de cohesión del gel dependen de la cantidad de calcio añadida y este del número de radicales carboxi (Shukla, Jain, Verma, K. y Verma, S., 2011, p. 85). Los factores ligados directamente con la resistencia del gel son el ET y el peso molecular, es por ello que la extensión de las cadenas de pectina define la transformación de la textura de la solución y la dificultad a fluir del hidrogel (Kanmani et al., 2014, p. 304). En la Figura 1.10 se esquematizan los enlaces entre cadenas de pectina según la categoría a la que pertenecen. 24 Figura 1. 10. Método de enlace entre pectinas para la generación del hidrogel (Shukla et al., 2011, p. 84) 1.2.5. MÉTODOS DE EXTRACCIÓN Existen métodos físicoquímicos y enzimáticos, a través de los cuales se obtiene pectina de distinta calidad; pues dicho producto depende directamente del tratamiento que haya sido utilizado. Los métodos de extracción de pectina incluyen: extracción en medio ácido, asistida por microondas y extracción con enzimas. La extracción en medio ácido constituye el método convencional, el cual requiere aproximadamente 30 min a 1 hora para obtener un buen rendimiento de pectina, y si el periodo de calentamiento directo se extiende la pectina sufre degradación térmica. La extracción por calentamiento en microondas utiliza la energía discipada por el campo electromagnético para incrementar la porosidad de la corteza, y la extracción enzimática requiere enzimas generadas por microorganismos que despolimericen la estructura de la protopectina (Srivastava y Malviya, 2011, p. 13). 25 1.2.5.1. Extracción con soluciones ácidas La extracción de la pectina es un proceso complejo en el que la hidrólisis, extracción y solubilidad de las moléculas de pectina de los tejidos de la fruta se efectúan bajo la influencia de varios factores, siendo los principales: la temperatura, el pH y el tiempo de tratamiento (Chakraborty y Ray, 2011, p. 391). A escala industrial el método más utilizado es la extracción de pectina en medio acuoso acidificado, el cual se realiza a temperaturas entre 60 ̊ C - 95 C ̊ y en un rango de pH de 1,5 – 3,0. Los ácidos inorgánicos más comúnmente utilizados son: ácido clorhídrico, sulfúrico y fosfórico; y entre ácidos orgánicos y sus sales: ácido cítrico, ácido oxálico, oxalato de amonio, ácido tartárico, entre otros (Sánchez, Aguilar, Contreras y Nevárez, 2011, p. 79; Srivastava y Malviya, 2011, p. 13). Dentro de los ácidos citados, el clorhídrico, es aquel que permitó la recuperación máxima de pectina para la especie Citrus pseudolimon Tan.; es por ello, de su preferencia para el ensayo con cítricos (Flores, Mariños, Rodríguez, N. y Rodríguez, D., 2014, p. 79). La presencia del ácido en medio acuoso a temperaturas elevadas ayuda a un rápido y brusco rompimiento de las paredes celulares de la corteza del fruto, dando lugar a la hidrólisis de la protopectina. Generalmente la extracción con ácidos produce pectinas con alto grado de esterificación, mientras que las sales pectinas con bajo grado (Sánchez et al., 2011, p. 79). El tiempo de extracción puede variar de 30 minutos a horas y constituye un factor relevante en dicho proceso; ya que, si el periodo de tiempo es muy pequeño la cantidad extraída va a ser baja, mientras que si se extiende demasiado la pectina tiende a degradarse (Monsalves et al., 2009, p. 10). Después de dicho tratamiento se precipita la pectina del extracto obtenido, para este fin se utiliza sales de aluminio, sales de cobre, pectato de calcio y alcoholes, 26 entre ellos: etanol, metanol y 2-propanol; debido a la capacidad de coagular o gelificar la pectina en presencia de dichas sustancias. El etanol es el agente precipitante más utilizado, ya que la aplicación de las demás sustancias involucra procesos de lavado y purificación (con agua o etanol ácido para eliminar iones metálicos) y por ende mayor costo (Cerón y Cardona, 2011, p. 69). De forma específica, al analizar la influencia del pH y el tiempo de calentamiento durante la extracción de pectina de la corteza seca de limones Citrus genuina, se encontró un máximo rendimiento al trabajar a un pH 2,5 y 90 min. La pectina obtenida se caracterizó como una de bajo índice de metóxilo (Chakraborty y Ray, 2011, p. 392). 1.2.5.2. Extracción con previa aplicación de ondas microondas La extracción asistida por microondas, consiste en el calentamiento delimitado de la matriz (modas de fruta) mediante ondas microondas, lo que provoca el aumento de la temperatura y presión en el pericarpio (Srivastava y Malviya, 2011, p. 13). El fenómeno de transformación de la energía electromagnética en energía térmica ocurre por la rotación y alineación de los dipolos, ocasionando que las moléculas roten y se friccionen, emitiendo energía en forma de calor (Fernández et al., 2010, p. 2). En dicho proceso la presión se acumula en el interior del material, incrementándose rápidamente; lo que da lugar al fraccionamiento de la estructura celular, los tejidos y la liberación las sustancias intracelulares; mientras que el aumento de temperatura inactiva las enzimas que degradan la pectina (Sánchez et al., 2011, p. 79; Srivastava y Malviya, 2011, p. 13). Particularmente para la extracción de pectina del albedo de la naranja Valencia de la región tropical de Colombia, se han estudiado tratamientos a una frecuencia de 2450 MHz y una potencia de 600 W, donde el mayor rendimiento correspondió a 9,50 % (base seca). Así también se trató a pieles de manzana con una potencia 27 de 499,99 W y un tiempo de 20 min, donde se obtuvo un rendimiento de 0,315 g por 2 g de piel seca (Barón y Villa, 2014, p. 153). Dicho método reduce el tiempo, se requiere un periodo de 15 a 20 minutos para la extracción, sin embargo el costo operativo es alto (Srivastava y Malviya, 2011, p. 13). El pretratamiento con microondas incrementa la solubilidad de la pectina, a la vez que dicho gel presenta mayor resistencia (Barón y Villa, 2014, p. 148-149). 1.2.5.3. Este Extracción enzimática método se microorganismos: basa en la utilización endo-poligalacturonasa de enzimas (Aspergillus generadas niger, por Aspergillus kawachii), endo-celulasa (Trichoderma sp.) y endo-arabinasa (A. niger ), de las cuales la primera permite una mayor solubilización de la pectina. Las endopoligalacturonasas actúan sobre el homogalacturonano, que constituye la estructura principal de las sustancias pépticas, rompiendo mediante hidrólisis sus enlaces glucosídicos; mientras que las otras enzimas señaladas atacan las cadenas laterales. Las enzimas pectinesterasa y pectinmetilesterasa también se las utiliza, para disminuir el porcentaje de metóxilos de las pectinas como se observa en la Figura 1.11 (Sánchez et al., 2011, p. 80) Dicho método se ha aplicado en la obtención de pectina de la cáscara deshidratada de mango y se obtuvo un rendimiento del 32,50 %; utilizando la endo-poligalacturonasa como enzima. Así también se utilizó dicha enzima en la extracción de pectina del limón y se la comparó con el rendimiento obtenido con el tratamiento general, donde se alcanzó un rendimiento del 17,60 % y 20,20 %, respectivamente; observándose la disminución del rendimiento con el método enzimático (Contreras, Voget, Vita y Espinoza, 2006, p. 163). La ventaja de este método lo constituye las condiciones no severas de la reacción y el bajo consumo de energía; calificándolo como un método amigable con el medio ambiente (Contreras et al., 2006, p. 163; Flores et al., 2014, p. 81). 28 Figura 1. 11. Acción de la endo-poligalacturonasa (endo-PG) y pectinmetilesterasa (PME) (Menezes y Choudhari, 2011, p. 228) 1.2.6. USOS Y APLICACIONES La principal aplicación de las pectinas se debe a su capacidad de gelificar y estabilizar ciertos alimentos, su acción favorece las propiedades reológicas de mermeladas, jaleas, lácteos, jugos, etc. Según Pons, García, Contreras y Acevedo (2009), el aditamento de pectina en una concentración de 0,15 % favorece la firmeza y viscosidad del yogurt, pues genera un producto de mejor calidad respecto al estándar (p. 447). En la industria alimenticia, se la utiliza en gran porcentaje para combatir la sinéresis de mermeladas y conservas; pues una de las causas de este fenómeno es la deficiencia de pectina; que ocasiona la compresión del gel y por ende la expulsión del líquido presente, lo que constituye un grave problema en la elaboración de dichos productos (Monsalves et al., 2009, p. 10; Colquichagua y Ortega, 2005, p. 17). Es considerada fibra dietética, al formar geles de alta viscosidad que inhiben la asimilación de compuestos en el estómago e intestino; y al combinarse con el agua generan una capa hidrofílica que evita que el colesterol y las sales biliares 29 atraviesen el intestino. Es por ello que se le añade a varios alimentos, al igual que a la hemicelulosa y a la celulosa (Srivastava y Malviya, 2011, pp. 10-11). Así se justifica su aplicación en tratamientos de reducción de peso y control de niveles de colesterol en la sangre, donde el consumo de al menos 6 g/día de pectina es necesario para establecer un efecto significativo en la reducción del colesterol (Kadajji y Betageri, 2011, p.1972). Además, actúa como desintoxicante por su capacidad de adherencia a cationes que permite eliminarlos del tracto gastrointestinal, con gran eficiencia en la remoción específica de plomo y mercurio (Shukla et al., 2011, p. 85). La elaboración de recubrimientos comestibles es un nuevo campo de aplicación de la pectina, produce películas con propiedades mecánicas y de permeabilidad adecuada destinadas como barreras de preservación de alimentos; durante su fabricación es necesaria la adición de sales de calcio para mejorar la resistencia al agua. Además, se ha comprobado que la aplicación de radiación gama e inmersión en cloruro cálcico (CaCl2) mejora la resistencia a la tracción, elongación a la rotura y permeabilidad al vapor de agua de la película biodegradable (Sánchez et al., 2011, p. 78). En el ámbito farmacéutico, la pectina se la utiliza en las formulaciones como gelificante instantáneo del paracetamol y ambrosol, para que su liberación en el interior del estómago se realice lentamente y se controle su velocidad de disipación; así también la adición de iones divalentes permite mejorar dicho control, siempre y cuando se encuentren en dosis adecuadas, las cuales oscilan entre 15 a 30 mg/g pectina (Mamani et al., 2011, pp. 84-85). Las pectinas obtenidas de cítricos se han aplicado en la medicina para combatir el cáncer, por su capacidad de bloquear su propagación y disminuir la dimensión del tumor; con mayor relevancia en el cáncer de colon. La inclusión de pectina en el consumo humano permite incrementar los ácidos grasos, los cuales intervienen en el cuidado de las células de colon evitando su degeneración; además que mejora el tránsito intestinal (Mamani et al., 2011, p. 91). 30 1.2.7. NORMALIZACIÓN DE LA PECTINA Según el Codex Alimentarius, la pectina está calificada como aditivo alimentario autorizado y seguro; que no presenta peligro alguno al ser consumida por los seres humanos. Los aditivos alimentarios son sustancias no consumidas de forma regular ni directa por las personas, no constituyen un componente esencial en la elaboración de alimentos y pueden o no presentar características nutricionales; su adición en productos alimenticios se realiza para mejorar sus propiedades organolépticas (Codex Alimentarius Codex Stan 192, 1995, p.3). De acuerdo al Código Europeo, se califica a la pectina como Agente Gelificante, Espesante y Estabilizante, al igual que el alginato, carragenano, agar, ácido algínico, monoestearato, etc.; cuya función es transformar la textura de los alimentos. Su característica más importante es la formación de geles estables a diferentes condiciones; además de ser sustancias con baja o nula asimilación en el organismo (García, 2010, p. 2). En el Ecuador la norma INEN 192:2013 se fundamenta en la norma del Codex Alimentarius y se especifica a la pectina 440 como coadyuvante, definiendo las categorías de los alimentos en los que se usa: Zumos de frutos Concentrados para zumos de frutos Néctares de frutos Concentrados para néctares de frutos 1.2.8. DEMANDA DE PECTINA EN EL ECUADOR El Ecuador y varios países de Sudamérica importan pectina, mientras la fuente principal de este aditivo, los cítricos, se cultivan en gran porcentaje en sus 31 campos sin contar con un adecuado enfoque industrial. Según los registros del Banco Central en el periodo: enero 2010 a diciembre 2013, el principal proveedor de pectina del Ecuador es México, como se observa en la Tabla 1.9. Tabla 1. 9. Países proveedores de pectina al Ecuador País Cantidad (t) México 60,28 Colombia 46,00 Alemania 21,25 Estados Unidos 21,81 Brasil 22,00 Francia 13,90 Bélgica 4,00 España 3,03 Dinamarca 0,85 China 0,90 Perú 0,15 Chile 0,03 (Banco Central, 2014) El país ha importado un total de 194,18 t de materias pécticas en los últimos cuatro años, de proveedores como Estados Unidos y Francia, que son los países que mayor proporción de limón Tahití ecuatoriano consumen. Dicha cantidad es requerida por 19 industrias presentes en el país, cuyos nombres se especifican en la Tabla 1.10. Tabla 1. 10. Industrias importadoras de materias pécticas en el Ecuador ADITMAQ CIA. LTDA ALITECNICO COMERCIO E INSUMOS PARA IND. ALIMENTOS ALPINA PRODUCTOS ALIMENTICIOS ALPIECUADOR COMERCIAL DANESA CIA. LTDA ECUAJUGOS S.A. ECUAVEGETAL S.A. ESPECTROCROM CIA.LTDA. 32 Tabla 1.10. Industrias importadoras de materias pécticas en el Ecuador (continuación …) INDUSTRIA DE PRODUCTOS ALIMENTICIOS INPROLAC INDUSTRIAS LÁCTEAS TONI S.A. INDUSTRIAS REUNIDAS CIA. LTDA. JAMES BROWN PHARMA C.A. NEW YORKER S.A. PLASTIQUIM S.A. PRODUCTOS DE SEGURIDAD INDUSTRIAL PROSEIN CIA.LTDA PROVEQUIM C.A. QUÍMICA SUIZA INDUSTRIAL DEL ECUADOR QSI S.A. RESIQUIM S.A. SUMESA S.A. SUPERQUÍMICOS C.A. (Banco Central del Ecuador, 2014) Las industrias nombradas anteriormente se dedican a la producción de alimentos como bebidas, jugos, lácteos, pastas, mermeladas, etc. que solicitan la pectina en sus procesos como ingrediente para adquirir la textura que demanda el consumidor; mientras que otras se dedican a la comercialización local de materias primas, agregados y químicos. 33 2. METODOLOGÍA Para la ejecución experimental del presente estudio se utilizaron los siguientes equipos, materiales y reactivos, como se indican en las Tablas 2.1, 2.2 y 2.3: Tabla 2. 1. Equipos Equipo Marca Modelo Capacidad Sensibilidad Agitador de vidrio con motor Talboys. Engineering Corp. 104 5000 rpm 2% Agitador magnético Stuart SM27 1W - Anemómetro Amprobe TMA40-A 0,4-32,0 m/s 0,1 m/s Balanza analítica Ohaus Champ II CD-11 5,0000 kg 0,0001 kg Balanza analítica Ae Adam PW 124 120,0000 g 0,0001g Baño termostático Julabo 20B 30 L - Calibrador Mitutoyo - 150,00 mm 0,02 mm Hielera Scotsman ECF75AE-1A 53 kg - Estufa Memmert SFE-A00 200,0 °C 0,1 °C pH-metro Hanna H198127 14,0 0,1 Plancha eléctrica Scientific Support PC-100 50 Watts - Refractómetro Llinsham & Stanless Epic Inc. 33 0-50 °Bx 0,00-25,00 °Bx 1 °Bx 0,25 °Bx 80203 150 °C 1 °C 73A0G11B 100 °C 2 °C Termómetro Termostato Thomas Scinetific Tabla 2. 2. Materiales Material Capacidad (mL) Vaso de precipitación 50, 250,1000 y 4000 Bureta 25 Matraz Erlenmeyer 250 34 Tabla 2.2. Materiales (continuación …) Pipeta 10 Balones 500 y 1000 Filtro de tela - Bandeja 0,0456 m2 Mortero - Cuchillo - Imán de agitación Bolsas herméticas - Tabla 2. 3. Reactivos 2.1. Material Casa Comercial Pureza Hidróxido de sodio Laquin S.A. Reactivo Ácido clorhídrico Merck 37 % Etanol Laquin S.A. 96 % Fenolftaleína Laquin S.A. 2% Rojo fenol Laquin S.A. 2% Cloruro de Sodio Laquin S.A. Reactivo CARACTERIZACIÓN DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.) 2.1.1. SELECCIÓN DE LA MATERIA PRIMA La recolección de las muestras de los frutos del limonero de la variedad Tahití se realizó directamente en la Granja de la Asociación de Productores Agropecuarios Quinlata del cantón Patate, en la provincia de Tungurahua. Esta etapa se efectuó manualmente mediante la torcedura del rabillo de fruto y bajo la utilización de la tabla colorimetría específica del limón Persa o Tahití, elaborada por Bosquez, Domínguez, Perez, Bautista, Díaz de León y Rivera 35 (2008) en su estudio sobre este cítrico y cuyo patrón de selección fue el color verde oscuro número 2, como se indica en la Figura 2.1. Figura 2. 1. Tabla colorimétrica del Limón Persa o Tahití (Bosquez et al., 2008, p. 165) La selección de los frutos fue aleatoria, es decir se desprendieron aquellos que se encontraban tanto en las ramas superiores, laterales e inferiores de la copa del árbol. Posteriormente se escogieron las muestras libres de daños físicos o alteraciones del flavedo por microorganismos y se descartaron aquellas que presentaban algún índice de daño. Los frutos se agruparon y colocaron en una canastilla plástica para evitar daños por golpes e inmediatamente se llevaron al Laboratorio de Operaciones Unitarias para su experimentación y almacenamiento bajo refrigeración a 10 ̊C. 2.1.2. CARACTERIZACIÓN DE LAS MUESTRAS Para dicha etapa se utilizó la norma NTE INEN 1750 (1994): Hortalizas y frutas frescas. Muestreo, por lo que se tomaron 2 kg de fruto como muestra para ensayos en laboratorio, lo que correspondió a 30 unidades para su análisis físico y 50 ml de zumo para el análisis químico (6 repeticiones). En el Anexo 1 se indica el extracto de la norma mencionada. 36 2.1.2.1. Caracterización física Los frutos verdes fueron caracterizados mediante la determinación de los siguientes parámetros: peso del fruto, diámetro ecuatorial y porcentaje de la corteza, cuya metodología aplicada para los dos primeros se fundamentó en la sección 8 de la norma NTE INEN 1757 (2008): Frutas Frescas. Limón. Requisitos, Anexo II. El porcentaje de corteza se evaluó mediante el desprendimiento del albedo y flavedo, el cual se pesó y se relacionó directamente con el peso unitario del fruto. 2.1.2.2. Caracterización química Para la caracterización química se extrajo el zumo de limón y se filtró adecuadamente, con el fin de evitar la presencia de vesículas que obstruyan su succión para los ensayos. Se evaluó la acidez, definida como potencial de hidrógeno y cantidad de ácido cítrico, cuyo procedimiento se realizó de acuerdo a las normas NTE INEN 0389 (1986) y 0381 (1986) respectivamente. Otro parámetro determinado fue la presencia de sólidos solubles, los cuales se caracterizaron en referencia a la norma NTE INEN 0380 (1985). De forma detallada en los Anexo III, IV, V se expone la metodología aplicada. 2.1.3. ANÁLISIS ESTADÍSTICO Se realizó un análisis estadístico mediante la determinación de la media aritmética como medida de tendencia central, así como la desviación estándar como parámetro de dispersión o desviación de los datos. 37 2.2. DETERMINACIÓN DE LA CINÉTICA DE REACCIÓN PARA LA OBTENCIÓN DE LA PECTINA 2.2.1. NÚMERO DE REPETICIONES Para la determinación del número de repeticiones para el análisis cinético de la pectina, se aplicó el modelo estadístico específico para casos cuando se ignora la variabilidad los datos, el cual se expone en la ecuación 2.1 (Lozano, 2011, p. 57): #𝑟𝑒𝑝𝑒𝑡𝑖𝑐𝑖𝑜𝑛𝑒𝑠 = R(1 − R)Zβ + 1,4Zα R2 [2.1] Donde: R: Rendimiento esperado Zβ: Nivel de certeza o confiabilidad Zα: Potencia estadística Se utilizaron los valores de Zα y Zβ estándar los cuales corresponden a 1,960 y 0,842, que significan un 95% de confiabilidad y 80% de potencia estadística, respectivamente, como se indica en el Anexo VI. Para el factor del rendimiento esperado se utilizó un valor de 0,700; que establece que el 70% tiene posibilidad de ocurrencia. 2.2.2. TRATAMIENTO PREVIO Se realizaron pruebas preliminares del proceso de extracción para definir sus condiciones óptimas. Inicialmente se evaluaron las temperaturas de 75 ± 2 °C y de ebullición; se seleccionó aquella que generaba una pectina con una coloración acorde a la norma INS 40: Pectinas (FAO, 2009, p. 1). 38 Para la selección del pH se consideró lo mencionado por Menezes y Choudhari (2011), la protopectina de reservas cítricas se libera en medios con un potencial de hidrógeno de 1,5 a 3,0 (p. 241) en base a ello se experimentó con los dos extremos del rango, en un periodo de 10 a 100 min. Además, según Muñoz (2010), la relación 1/3 correspondiente a cáscara fresca/medio, influye positivamente en la extracción (p. 46), por lo que bajo este valor constante, se evaluaron los parámetros anteriores; sin embargo Sudhakar y Maini (2000), manifiestan que con relación de 1/6 los resultados son significativos (p. 216), por lo que se ensayó con dicha relación. Considerando el mayor rendimiento de producto extraído se seleccionaron los valores de pH, tiempo y relación corteza/medio óptimos, para continuar con los ensayos posteriores. 2.2.3. PROCESO PARA LA EXTRACCIÓN DE PECTINA DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.) 2.2.3.1. Procedimiento Selección y lavado de los frutos Se seleccionaron los frutos de color verde oscuro, con apariencia saludable, sin la presencia de manchas o lesiones del flavedo por microorganismos. Su lavado se efectuó con agua para eliminar impurezas propias del cultivo, los frutos se escurrieron y se colocaron individualmente sobre una toalla absorbente para su posterior tratamiento. 39 Desprendimiento de la corteza El descortezamiento se realizó mediante un cuchillo, asegurándose la total separación de las secciones verdes y blancas del fruto, las cuales seguidamente fueron cortadas en rectángulos de 10 a 15 mm, para incrementar el contacto con el medio de extracción. Este proceso se realizó hasta alcanzar 500 g de cáscara por ensayo. Escaldado La corteza fue sometida a una etapa de escaldado durante 10 min en agua destilada, bajo la proporción de 5/10 (g de corteza/ ml de agua), a fin de desactivar las enzimas que fraccionan la macromolécula de pectina. El proceso se realizó en un recipiente de acero inoxidable, el cual se colocó sobre una plancha eléctrica para alcanzar la ebullición del agua destilada. Posteriormente el contenido se filtró y se procedió al lavado de la corteza tratada. Lavado de la corteza tratada La corteza se sumergió en agua destilada y se realizó el lavado hasta reducir la presencia de azúcares en el agua residual, los cuales fueron determinados mediante su observación en el refractómetro, cuya lectura final fue 0 °Bx. Extracción Esta etapa se desarrolló de acuerdo al esquema expuesto en la Figura 2.2, para lo cual se preparó un baño termostático a 75 ± 2 °C, donde se sumergió el reactor con 1500 ml de agua acidulada con ácido clorhídrico a pH de 1,5 y se esperó hasta que se alcance el equilibrio térmico. 40 Seguidamente se añadieron 500 g de corteza del fruto fresco para la extracción durante 10, 25, 35, 45, 60 y 80 min, mediante agitación continua y leve. Se debe acotar que el agua que se utilizó fue agua destilada, para evitar la presencia de iones que interfieran en la extracción. Agitador Termostato Termómetro Baño termostático Figura 2. 2. Esquema del sistema de extracción utilizado en el laboratorio de Operaciones Unitarias Filtración I y enfriamiento Se retiraron los residuos de corteza mediante su separación por un filtro, aplicando presión para expulsar todo el líquido retenido. Seguidamente el extracto se colocó en un recipiente rodeado de hielo en escarcha para disminuir la temperatura y parar la reacción al tiempo determinado. Separación por coagulación Una vez que el extracto alcanzó la temperatura de 25 °C se añadió etanol 96 % utilizando la relación 6/10 (ml de etanol/ml de extracto), por la propiedad de la pectina de coagular en presencia de alcoholes. Se mantuvo en reposo durante 60 min hasta que el coágulo alcance su estabilidad. 41 Filtración II La separación del precipitado se efectuó a través de un filtro de liencillo, mediante pequeños movimientos circulares y vibratorios. El precipitado se retiró con una paleta y se colocó en la bandeja de secado. Secado Esta etapa se llevó a cabo en una estufa de bandejas a la temperatura de 50 °C hasta alcanzar el equilibrio, definido por el valor constate del peso de la muestra. Molienda y almacenamiento La reducción de tamaño de la pectina se realizó en un mortero, por la pequeña cantidad de materia obtenida, sin embargo a las condiciones que se obtuvo mayor rendimiento se realizó en un molino de cuchillas alcanzando un tamaño de partícula de 250 um, malla # 60. La pectina se almacenó en bolsas con sello hermético, las cuales fueron debidamente etiquetadas según el tiempo de extracción y el número de repetición correspondiente. 2.2.4. DETERMINACIÓN DE LOS PARÁMETROS CINÉTICOS DE LA OBTENCIÓN DE LA PECTINA El análisis cinético se enfocó en la reacción de Solubilización de la protopectina, la cual ocurre hasta el tiempo en el que se alcanza el mayor rendimiento en el proceso extractivo, determinado en el tratamiento previo. 42 Se efectuaron seis repeticiones de extracción mediante el procedimiento descrito en la sección 2.2.3., donde se obtuvo el peso de pectina. Se graficaron los valores en cada tiempo y se definió el perfil de extracción. El orden de reacción se analizó considerando la ley de la velocidad para una reacción de primer y segundo orden, se graficaron sus ecuaciones de linealización en función del contenido de protopectina y se determinó su ajuste utilizando como criterio el mejor factor de correlación. A partir de la pendiente de la ecuación de la recta generada en los gráficos, se determinó el valor promedio de la constante de velocidad. 2.3. DETERMINACIÓN DE LA CINÉTICA DE SECADO DE LA PECTINA GEL 2.3.1. OBTENCIÓN DEL LA MEJORES CONDICIONES DEL PROCESO DE DESHIDRATACIÓN DE LA PECTINA Para la determinación de las mejores condiciones del proceso de deshidratación de la pectina en estado coloidal hasta obtenerla sólida, se aplicó el método cuantitativo de gravimetría. El método cuantitativo de gravimetría durante el proceso de deshidratación considera el pesado del material a medida que incrementa el tiempo al que es sometido a condiciones de secado, el cual se realizó hasta lograr un valor constante en el peso. La diferencia de peso en el tiempo representa la cantidad de agua que es evaporada y se elimina por efecto de la temperatura y flujo de aire a la que es expuesto el material. Para ello, previamente se desecó la bandeja a utilizar durante 5 min y se pesó, las dimensiones de la bandeja son de 0,19 x 0,24 m; en ella se colocó el gel hasta generar un espesor aproximado de 1,2 mm. 43 De forma específica el proceso de deshidratación señalado en la sección 2.2.3.1. se experimentó en el secador de bandejas del Laboratorio de Operaciones Unitarias a la temperatura de 50 °C y a diferentes flujos de aire 1,4 y 1,8 m/s, considerando que el rango del secador oscila de 1,3 a 2,0 m/s. La evaluación de las condiciones se basó en la influencia sobre la propiedad de los grupos metóxilos y el tiempo requerido en alcanzar el equilibrio, a fin de evitar la alteración de la calidad del producto. 2.3.2. ANÁLISIS DEL PERFIL DE DESHIDRATACIÓN, MODELIZACIÓN Y CINÉTICA El análisis del perfil de deshidratación consistió en la identificación de las etapas de secado, para lo cual se consideró como frontera de división la humedad crítica. El punto crítico se determinó gráficamente en la figura humedad sobre tiempo, posteriormente se ajustaron ciertas curvas a cada una de las etapas, a fin de obtener expresiones matemáticas que permitan modelar dichos periodos. Para definir la cinética de deshidratación se determinaron los valores de velocidad por intervalo de tiempo, mediante la aplicación de la razón diferencial de la humedad y el tiempo. Se graficó la trayectoria de la velocidad respecto a la humedad, donde se identificó el valor de la rapidez con la que se efectúa la eliminación del agua en la fase constante y el valor crítico. 2.4. CARACTERIZACIÓN DE LA PECTINA OBTENIDA DE LA CORTEZA DEL LIMÓN Para este objetivo se consideró como parámetros de calidad y propiedades estructurales aquellos descritos en la Figura 2.3, mediante los procedimientos 44 indicados en las normas AOAC y mediante métodos estandarizados como el de Owens. Parámetros fisicoquímicos Propiedades estructurales Color Peso equivalente Humedad AOAC 925.10 Proporción de metóxilos Cenizas insolubles en ácido AOAC 942.05 y AOAC 920.46 Proporción de ácido galacturónico Grado de esterificación Método de Owens Figura 2. 3. Parámetros de caracterización del producto De forma detallada en el Anexo IX y X se muestran los procedimientos experimentales seguidos para cada uno de los parámetros antes mencionados. 2.5. DISEÑO DEL REACTOR PARA LA HIDRÓLISIS Y DEL SECADOR DE LA PECTINA A ESCALA PILOTO. En primer lugar se definió la producción de pectina a escala piloto mediante los datos de la sección 1.2.8., se consideró el 5 % de la demanda diaria de pectina para definir la producción de los equipos a diseñar. El cálculo de la producción a escala industrial se presenta en el Anexo XII. 45 2.5.1. DISEÑO DEL REACTOR PARA LA HIDRÓLISIS A ESCALA PILOTO Para el diseño del reactor, se consideraron las mejores condiciones de extracción evaluadas experimentalmente y en base a las cuales se seleccionó el tipo de reactor apto para tratar la alimentación. La constante de reacción definida mediante el tratamiento de la sección 2.2.4., el contenido y concentración inicial de protopectina fueron parámetros utilizados para definir el volumen del reactor mediante el balance de masa en el equipo; así también el volumen de carga se estableció considerando la mejor relación materia prima/medio ácido. Con un factor de seguridad del 20% se determinó el volumen nominal del equipo (API 2350, 2005, p. 18). Se consideró una relación entre las dimensiones del reactor de 1,0 a 2,0 (Ahmed y Rahman, 2012, p. 850) y se determinó el diámetro interno del reactor; este valor se corroboró con la dimensiones estándares de fabricación. Se seleccionó el tipo de fondo y tapa, su espesor se definió mediante la ecuación [AXII.19] que involucra presión y material de diseño; al cual se añadió el valor de espesor corroído con una velocidad extrema o insatisfactoria. Considerando la naturaleza de la alimentación y temperatura de trabajo se seleccionó el tipo de material apto para el diseño. Entre los accesorios del reactor se diseñó el agitador y la chaqueta de calentamiento, el primero se basó en las proporciones estándares de acuerdo al diámetro y altura nominal del equipo, señalas por McCabe, Smith y Harriott (2007), se definió del tipo de flujo a tratar y el número de potencia con lo que se encontró el requerimiento energético para la acción de este accesorio. El segundo, el sistema de calentamiento, se determinó la dimensión del anular entre el reactor y chaqueta, en base a ello se estableció el diámetro de la chaqueta, y las condiciones del flujo que atravesará dicha sección. En el anexo AXII se detalla el algoritmo seguido para el diseño del reactor de hidrólisis para el proceso de extracción, a la temperatura de 75 °C. 46 2.5.2. DISEÑO DEL SECADOR DE LA PECTINA A ESCALA PILOTO Para el diseño del secador de la pectina en estado coloidal, se definió una humedad entre 0 a 12 %, como lo exige la norma INS 40: Pectinas para este coadyuvante. Aplicando la modelización de las etapas de deshidratación definidas en la sección 1.3.2., se determinó el tiempo de operación, cantidad de agua a retirar y área real de secado; a la que se añadió un factor de sobredimensionamiento para definir el área de diseño. En el equipo de deshidratación se diseñaron dos áreas: en primer punto aquella donde ocurre el proceso como tal, denominada cámara de secado, cuyas dimensiones se establecieron considerando las del armario de bandejas. Se determinó el área y el número de bandejas por bastidor hasta un máximo de 40. El esqueleto se diseñó con barras y ángulos de acero inoxidable y se determinó su peso, con el que se estableció el número de ruedas aptas para soportar dicho valor. Mediante el programa ECOWIN GREEN facilitado por empresa Fiber Glass, el cual requiere de datos como: temperatura del exterior, temperatura de trabajo, emisividad, velocidad el viento y posición del equipo se estimó el espesor del aislante para mantener la temperatura interna en 50 °C. En la cámara externa se diseñó el ventilador y sistema de calentamiento. El primer accesorio se diseñó considerando el flujo de aire, presión estática, de fricción y nivel permisible de sonido; el segundo se definieron resistencias que satisfagan el requerimiento energético por convección entre el aire y el gel; y la energía del gel en incrementar su temperatura. En el Anexo AXIII se detalla el procedimiento seguido para el diseño del secador a escala piloto. 47 2.5.3. COSTOS DE MATERIA PRIMA, INSUMOS Y DE PRODUCCIÓN DE PECTINA Para el análisis económico fue imprescindible construir el diagrama de flujo del proceso estudiado, que involucra los principales equipos y la tabla de resumen de corrientes, realizada con los resultados del balance de masa y energía. Se realizó el balance de masa para la generación de 10 kg/día de pectina, con lo que se definió la cantidad de materia prima (limones) y la cantidad de insumos: agua, ácido clorhídrico 37 % y alcohol etílico 96 %. Mediante el balance energético se establecieron los kilogramos de consumo de vapor durante los procesos de escaldado y extracción, con lo que se calcularon los litros de combustible para el procesamiento del caldero y el consumo eléctrico de cada equipo. Mediante la adición de los tres elementos básicos descritos en la Figura 2.4 y la producción anual de 2 400 kg, se estimó el costo de producción de la pectina del limón Tahití (Citrus latifolia Tan.) Mano de obra Servicios industriales Materia Prima e insumos Figura 2. 4. Parámetros del costo de producción de pectina 48 3. RESULTADOS Y DISCUSIÓN A continuación se exponen los resultados obtenidos en el presente estudio, los cuales se describen de acuerdo con los objetivos y la experimentación antes señalada. En base a disertaciones relacionadas con el tema se analizará el rendimiento del fruto verde de la variedad Tahití (Citrus Latifolia Tan.) como materia prima en la obtención de la pectina. 3.1. RESULTADOS DE LA CARACTERIZACIÓN DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.) 3.1.1. RESULTADOS DE LA SELECCIÓN DE LA MATERIA PRIMA Se seleccionaron las muestras frutales de forma cualitativa, según el color verde oscuro, expuesto en la gama de colores de la Figura 2.1, correspondiente a un estado de madurez 2. El color de los frutos seleccionados se observa en la Figura 3.1. Figura 3. 1. Frutos del limón Persa o Tahití seleccionados para el estudio 49 3.1.2. RESULTADOS DE LA CARACTERIZACIÓN DEL LIMÓN TAHITÍ El análisis físico se realizó a 30 unidades de los frutos recolectados de la Asociación Quinlata del cantón Patate., en las cuales se determinó el diámetro, peso por unidad y porcentaje de corteza. Dichas propiedades se midieron de acuerdo a los métodos inscritos en la norma NTE INEN 1757 particular para limones, que engloba las clases Tahití, Sutil y Meyer. Los resultados se exponen en las Figuras 3.2 y 3.3. Diámetro ecuatorial (cm) 6,60 6,40 6,20 6,00 5,80 5,60 5,40 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 Número de repeticiones Diámetro (cm) Media LSDesviación Calibre mediano LIDesviación Figura 3. 2. Valores del diámetro ecuatorial del Limón Persa o Tahití El diámetro medio es de 6,04 cm, cuyos datos reportan una desviación estándar de ± 0,17 cm, lo cual define el rango en el que se encuentran la mayor cantidad de muestras, siendo este de 5,87 a 6,21 cm. De acuerdo a la clasificación de calibres de la norma NTE INEN 1757:2008, expuesta en el Anexo II, el fruto recolectado corresponde a un limón de tamaño mediano cuyo rango de diámetro se encuentra de 5,50 a 6,50 cm. Sin embargo de acuerdo a la característica del peso se lo ubica en el rango de fruto pequeño por poseer un peso unitario menor a 140 g. 50 En la Figura 3.3 se observa el valor medio del peso del fruto de 69,7225 g, con una dispersión de ± 3,8830 g, donde el rango de dicha característica es de 65,8395 a 73,6055 g. 80,0000 Peso Unitario (g) 75,0000 70,0000 65,0000 60,0000 55,0000 50,0000 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 Número de repeticiones Peso Unitario Media LIDesviación LSDesviación Figura 3. 3. Valores del peso por unidad del limón Persa o Tahití. Dentro de las partes del cítrico la sección de interés constituye la corteza, ya que en el interior de la pared celular se encuentra la pectina, en base a ello se definió el contenido de pericarpio de 35,43 ± 3,69 %, que representa el flavedo como la parte verde y el albedo como la sección blanca. En comparación con otras especies, como el limón Sutil y el limón Eureka el contenido de corteza es mayor, ya que estos presentan valores de 19,98 % y 20, 28%; con ello se define que aproximadamente la mitad del fruto es apto para el tratamiento. Además la textura del albedo es carnosa y suave facilitando la absorción del catalizador durante la extracción. En la Figura 3.4 se observa el valor medio de contenido de corteza del limón Tahití. 51 Porcentaje de corteza (%) 50 45 40 35 30 25 20 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 Número de repeticiones % de corteza Media LIDesviación LSDesviación Figura 3. 4. Porcentaje de corteza por unidad del limón Persa o Tahití. Al comparar las Figuras 3.2, 3.3 y 3.4, se observa que la mayoría de datos presentan una relación directa entre las tres características, ya que a mayor diámetro, mayor es su peso unitario y por ende su contenido de corteza. Los ensayos realizados en la extracción se efectuaron con 0,5 kg de corteza, si el porcentaje medio por unidad de fruto es de 35,43 % se utilizaron aproximadamente 21 frutos por ensayo. De forma global las características físicas del limón utilizado en el presente estudio se presentan en la Tabla 3.1. Tabla 3. 1. Resumen de las características físicas del fruto de la variedad Tahití Parámetro Valor Color Verde oscuro #2 Diámetro 6,04 ± 0,17 cm Peso Unitario 69,7225 ± 3,8830 g Porcentaje de corteza 35,43 ± 3,69 % 52 El análisis químico del zumo reportó los siguientes resultados de acidez (titulable o pH) y contenido de sólidos solubles, los cuales se presentan en la Tabla 3.2. Tabla 3. 2. Resumen de las características químicas del fruto de la variedad Tahití Parámetro Marca pH 2,00 ± 0,100 Acidez titulable 4,70 ± 0,18 % Sólidos solubles 8,20 ± 0,40 °Bx Grado de madurez 1,74 ± 0,18 Mediante la razón de sólidos solubles y acidez titulable se determinó el nivel de maduración, correspondiendo a un valor aproximado de 2, lo que se corrobora su ubicación en la segunda etapa de la gama colorimétrica de madurez de la Figura 2.1. Dicho parámetro engloba las propiedades internas del fruto, de forma específica para el limón su valor de recolección no está estandarizado, ya que esta etapa básicamente se detecta mediante la degradación de la clorofila es decir mediante el grado de coloración de corteza externa. De acuerdo a los parámetros anteriores, el limón cumple con los requisitos de calibre para su consumo como producto fresco, ya sea como fruto pequeño o mediano, pero no cumple con la característica principal visible de maduración, el color; ya que posee un color verde oscuro a diferencia del verde claro brillante que debe presentar el limón listo para su comercialización. Esto define una ventaja de industrialización de esta clase de limón, ya que sin alcanzar su estado de cosecha destinada para la alimentación directa constituye una opción de materia prima para la extracción de pectina, debido al mayor contenido que presentan los frutos inmaduros; lo que implica a la vez ahorro en costos de mantenimiento del cultivo (riego y fertilización). 53 3.2. RESULTADOS DE LA DETERMINACIÓN DE LA CINÉTICA DE REACCIÓN PARA LA OBTENCIÓN DE LA PECTINA 3.2.1. RESULTADO DEL NÚMERO DE REPETICIONES El número de repeticiones u observaciones experimentales se obtuvo al aplicar la ecuación [2.1], la cual arrojó un valor de 6 para asegurar resultados 95% estadísticamente confiables, con una pequeñísima diferencia entre ellos. Considerando el desconocimiento de la desviación estándar que pueda presentar la constante cinética de la extracción de pectina, se aplicó dicha ecuación, la cual es específica para estudios cuando no se dispone de información sobre la versatilidad de los resultados a obtener. Su cálculo se presenta en el Anexo VI. 3.2.2. RESULTADOS DEL TRATAMIENTO PREVIO El tratamiento de extracción involucra el análisis de cuatro parámetros, lo cuales se presentan en la Figura 3.5. Temperatura • 75 °C • 91 °C pH • 1,5 • 3,0 Tiempo • 10, 25, 35, 45, 60, 80, 90 y 100 min Relación cáscara/medio • 1/3 • 1/6 Figura 3. 5. Variables del tratamiento preliminar de extracción. En primer lugar se analizó el efecto de la temperatura, se trabajó a la temperatura de ebullición en la ciudad de Quito que corresponde a 91 ̊C y a una temperatura menor de 75 C ̊ ±2C ̊ . El tratamiento se realizó por 60 min, a pH de 3,0 del medio con ácido clorhídrico y con una relación 1/3 correspondiente a peso de corteza fresca y volumen del medio acidulado. 54 En la Tabla 3.3 se presenta el resultado visual de la pectina obtenida a 75 °C y 91 °C. Tabla 3. 3. Resultado visual de la pectina obtenida a 75 °C y 91 °C Condiciones de temperatura Resultado visual Características Tebullición 91°C Tonalidad verde oscuro con secciones de color café 75 °C Tonalidad cremabeige. * Las imágenes corresponden a la pectina obtenida después del proceso de secado. En la Tabla 3.3 se distingue una diferencia relevante de tonalidades de pectina. La pectina extraída a la temperatura de ebullición presenta un color verde oscuro, que en el mercado es una tonalidad inaceptable para este aditivo alimentario. El color verde es resultado de la condición severa de temperatura a la que fue sometida la corteza, que provocó la desintegración del flavedo durante la 55 “cocción” y con ello la liberación del pigmento natural del limón (clorofila), el cual alteró la apariencia del producto y su calidad. A la temperatura de 75 °C la pectina presenta un color crema-beige, el cual es característico de las pectinas, por lo que se seleccionó como la adecuada para la extracción. Una vez definida la temperatura de 75 ± 2 °C, se analizó la extracción bajo las condiciones de pH del medio de 1,5 y 3,0; cuya experimentación se realizó a los tiempos de 10, 25, 35, 45, 60, 80, 90 y 100 min. En la Figura 3.6 se observan los resultados obtenidos a los diferentes valores de pH. El máximo rendimiento al trabajar en un medio a pH de 1,5 corresponde a 14,76 %, el cual es superior al alcanzado a pH 3,0 de 6,89 %, lo que evidencia el incremento del rendimiento al reducirse el valor del potencial de hidrógeno, es Pectina (g pectina/100 g de corteza seca) decir, al incrementar la cantidad de ácido en el medio de extracción. 16,0000 14,0000 12,0000 10,0000 Frontera de extracción 8,0000 6,0000 4,0000 2,0000 0,0000 0 20 40 60 80 100 120 Tiempo de reacción (min) 1,5 3,0 Figura 3. 6. Generación de pectina (pH 1,5 y 3,0), en el tratamiento preliminar de extracción 56 Dicho efecto es consecuencia de la capacidad de los ácidos de penetrar en los sólidos; por tal razón a mayor cantidad de ácido, la penetración ocurre fácilmente, generando mayor contacto con las sustancias pécticas en el interior de la estructura celular y convirtiendo la pectina insoluble en soluble (Seggiani, Puccini, Pierini, Giovando y Forneris, 2009, p. 577). Además, la Figura 3.6 describe una tendencia a incrementar el rendimiento de pectina conforme el tiempo del tratamiento al que es sometida la corteza es mayor, alcanzando un límite de tiempo en el que el porcentaje es el máximo y después disminuye; con ello se determina la frontera entre dos fases de extracción: 1. Solubilización de la protopectina 2. Descomposición de la pectina soluble Para la curva generada a pH 1,5 el mayor rendimiento se presenta a los 80 min con un valor de 14,76 %, de allí este se reduce hasta 11,76 % a los 100 min , ya que la pectina contenida en los tejidos de la corteza se acaba y toma lugar la formación de productos de degradación del producto de interés. Considerando los resultados antes mencionados, se seleccionaron como condiciones de trabajo el pH de 1,5 y el tiempo de tratamiento máximo de 80 min. Otro parámetro importante lo constituye la relación de corteza fresca y medio acidulante, por lo que se experimentó con una relación mayor 1/6, cuyos resultados no concordaron con lo reportado bibliográficamente; ya que al adicionar etanol en el extracto, la precipitación fue baja y dispersa, como se observa en la Figura 3.7. El resultado negativo se puede atribuir a la gran cantidad de agua que tuvo la pectina para solubilizarse debido a su carácter hidrofílico, impidiendo la acción absorbente y deshidratante del etanol; que por ende reprime la generación del coágulo. 57 Figura 3. 7. Prueba de precipitación de pectina, (izquierda) relación 1/3, (derecha) relación (1/6) en el tratamiento preliminar de extracción En base a dicho resultado se descartó la relación 1/6 y se mantuvo la relación 1/3 con la que se obtuvo mayor rendimiento; con ello se definieron las mejores condiciones de extracción, las cuales se resumen en la Tabla 3.4. Tabla 3. 4. Condiciones de extracción definidas en el tratamiento previo para el limón Tahití Temperatura (°C) 75 ± 2 pH Tiempo máximo (min) Relación cortezamedio (g/mL) 1,5 80 1/3 3.2.3. RESULTADOS DEL PROCESO DE LA EXTRACCIÓN DE PECTINA DEL LIMÓN DE LA VARIEDAD TAHITÍ (Citrus latifolia Tan.) En la Figura 3.8 se esquematiza el proceso al que fueron sometidos los limones de la variedad Tahití para la extracción de la pectina. El proceso engloba las operaciones unitarias de: selección y lavado I, desprendimiento de la corteza, escaldado de la corteza, lavado II, extracción, filtración I, enfriamiento, separación, filtración II, secado, molienda y almacenamiento; de acuerdo a la metodología descrita en la sección 2.2.3. 58 Limones Tahití Agua (10 ml/ 5 g corteza) Agua (10 ml/ 5 g corteza) Agua Selección Lavado I Descortezamiento 10 a 15 mm Limones de desecho Impurezas Pulpa y semillas Corteza Escaldado Tebullición 10 min Lavado II Corteza Agua Etanol (6 ml/ 10 ml extracto) Secado T= 50 ° C Filtración II Coagulación Agua residual con sólidos solubes HCl 37% Corteza y extracto Hielo en escarcha Enfriamiento 25 ° C Extracción T: 75 °C , pH: 1,5 c/m: 1/3 Filtración I Extracto Desechos de corteza Agua y etanol Molienda 250 um Almacenamiento Pectina Figura 3. 8. Esquema de la secuencia de operaciones unitarias para la obtención de pectina del limón Tahití o Persa a escala de laboratorio 59 En referencia al proceso de Lavado II y mediante el análisis del registro de los grados Brix expuestos en la Tabla 3.5, se confirma que al efectuar una sola vez el lavado de la corteza, la lectura de los sólidos solubles se reduce notablemente. Con ello se asegura la exclusión de los azúcares naturales presentes en ella, que puedan obstruir la extracción de la pectina al presentar una estructura polimérica similar. Tabla 3. 5. Grados Brix reportados durante el proceso de Lavado II Parámetro Grados Brix (°Bx) Agua residual del escaldado 2,3 ± 0,5 Agua residual del lavado (1) 0,0 En la Figura 3.9 se aprecia el rendimiento promedio máximo de pectina extraída de la especie Citrus latifolia Tan., cuyo valor en base seca y húmeda es de 14,49 ± 0,43 % y 2,90 ± 0,09 % respectivamente, siendo la humedad de la corteza de 80 %. El rendimiento en base húmeda concuerda con el expresado en la Tabla 1.7 para la corteza de limón del 3 %. 15,5 Porcentaje de extracción (kg pectina/kg corteza seca) 15 14,5 14 13,5 13 12,5 0 1 2 3 4 5 6 7 Número de repeticiones Porcentaje Media LSDesviación LIDesviación Figura 3. 9. Valor medio y rango de desviación del rendimiento en base seca de pectina del Limón Persa o Tahití, de acuerdo a las seis repeticiones 60 En la Tabla 3.6 se resumen los porcentajes generados por otras especies de limón mediante recopilación bibliográfica. Tabla 3. 6. Rendimiento en base seca y húmeda de pectina de diferentes limoneros Especie de Citrus Condiciones de extracción Rendimiento % (g de pectina/g de corteza seca) Rendimiento % (g de pectina/g de corteza húmeda) Limón Tahití Citrus latifolia Tan (albedo y flavedo) HCl 37%; pH 1,5; 75 ± 2 °C ; 1/3; 80 min 14,49 ± 0,43 2,90 ± 0,09 Limón Sutil Citrus x Aurantifolia Swingle (albedo y septos) HCl 6N; pH 2,2; 95 °C ; 1/4; 40 min - 2,30 Limón injertado Citrus genuina (albedo) HCl; pH 2,5; Tebullición; 25 g (cs)/3L; 90 min 20,54 - Limón Eureka Citrus Limon (albedo) HCl; pH 2,2-2,3; 95-100 °C; 30 min - 2,53 (Grunauer, 2009, p. 40) La optimización de la hidrólisis de la protopectina depende sustancialmente del tipo de materia prima, variedad y estado de maduración. Al no existir estudios específicos sobre dicha especie, se relacionó su rendimiento con frutos de varios limoneros, distinguiéndose un pequeño incremento respecto al Limón Sutil de características de madurez aproximadas (pHzumo= 2,44). En comparación con el Limón Eureka de tamaño, apariencia y madurez similar (pHzumo= 2,25), el rendimiento también es mayor lo que ratifica la adecuada selección de las condiciones extracción y su eficiencia. Sin embargo con los resultados bibliográficos para los limones injertados Citrus genuina el rendimiento del limón estudio es menor, debido a la diferencias en su grado de madurez. Los limones injertados presentan un grado de madurez de 1,5 menor al determinado en el limón de estudio; lo que ratifica que mientras el fruto madura el contenido de pectina disminuye. 61 Al comparar las condiciones del tratamiento aplicado, existe una diferencia notable en la temperatura y tiempo de extracción respecto al limón Sutil y Eureka. Las temperaturas elevadas (Tebullición) alteran la coloración del producto, es por ello que se optó por reducir la temperatura obteniéndose mejores resultados en rendimiento y apariencia, como se verificó con los resultados de la Tabla 3.3. En la Tabla 3.7 se presentan los rendimientos de pectina de especies como: naranja valencia, cocona, maracuyá, manzana e inflorescencias de girasol. Tabla 3. 7. Rendimiento en base seca y húmeda de pectina de diferentes especies Fruto Condiciones de extracción Rendimiento % (g de pectina/g de corteza seca) Rendimiento % (g de pectina/g de corteza húmeda) Limón Tahití Citrus latifolia Tan (albedo y flavedo) HCl 37%; pH 1,5; 75 ± 2 °C ; 1/3; 80 min 14,49 ± 0,43 2,90 ± 0,09 Naranja valencia Citrus sinensis HCl 37%; pH 2,0; Tebullición ; 3/10; 40 min - 6,50 Cocona (Colanum sessiliflorum) HCl; pH 1,7; 93 ± 2 °C; 1/3; 75 min 9,33 - Maracuyá (Passiflora edulis var. flavicarpa degener) HCl; pH 2,0; Tebullición ; 1(cs)/25; 60 min 10,00 - Manzana Pachacamac HCl; pH 1,6; 1(cs)/16; 95 °C ; 75 min 27,80 - Inflorescencias del girasol (Helianthus anntttts L) SHMP y HCl; pH 5,0; 1(cs)/20; 65 °C ; 20 min 10,67 - 11,53 - (Muñoz, 2010, p. 50; Cuesta y Muñoz, 2010, p. 95) Al compararlo con otras materias primas se concluye que el limón Persa contiene un porcentaje medio de pectina respecto a la naranja, cocona, maracuyá, manzana y girasol; como se observa en la Tabla 3.7. Su contenido sobrepasa ligeramente al presente en la cocona, maracuyá y cabezas del girasol; pero es menor al que se obtiene de la manzana y la naranja. Con ello se establece que las modas del limón Persa son buenas reservas de pectina. 62 3.2.4. RESULTADOS DE LA DETERMINACIÓN DE LOS PARÁMETROS CINÉTICOS DE LA OBTENCIÓN DE LA PECTINA El proceso de extracción de pectina involucra dos periodos que ocurren secuencialmente, como se observa en la Figura 3.6. El análisis cinético se centró en la primera fase: Conversión de la Protopectina a Pectina, la cual es catalizada por el ácido clorhídrico presente en el medio de extracción, como se resume en la ecuación [3.1]. 𝑘 [3.1] 𝑃𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 → 𝑃𝑒𝑐𝑡𝑖𝑛𝑎 𝐻𝐶𝑙 Donde: k: constante de la velocidad de la reacción. De acuerdo a la metodología descrita en la Figura 3.8 se obtuvo el peso de pectina en los ciclos de 10, 25, 35, 45, 60 y 80 min. En la Tabla 3.8 se presenta el contenido de pectina por 100 g de corteza seca o 500 g de corteza húmeda, en cada una de las repeticiones. Tabla 3. 8. Resultados de la cuantificación de pectina a diferentes tiempos de extracción (pH 1,5; relación 1/3) Tiempo (min) Pectina (g) R1 R2 R3 R4 R5 R6 10 4,3253 4,7610 4,2958 4,4986 3,7938 2,9972 25 6,9524 7,7245 7,1633 7,0839 6,2462 5,6049 35 10,0617 10,1521 8,8134 8,5724 9,3112 8,1935 45 11,9266 11,2654 11,1605 11,0653 11,0784 10,1736 60 13,0119 12,7152 13,5743 12,3448 13,1355 12,1282 80 14,7590 14,4995 15,0241 14,6815 14,2779 13,6753 R:Repetición 63 Con los datos experimentales de la Tabla 3.8 se elaboraron las trayectorias de la evolución de la extracción hasta los 80 min, los cuales se representan en las Figuras 3.10 y 3.11. 16,0000 14,0000 Pectina (g) 12,0000 10,0000 8,0000 6,0000 4,0000 2,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo de reacción (min) R1 R2 R3 Figura 3. 10. Representación de la masa de pectina en función del tiempo de tratamiento, repetición 1, 2 y 3 16,0000 14,0000 Pectina (g) 12,0000 10,0000 8,0000 6,0000 4,0000 2,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo de reacción (min) R4 R5 R6 Figura 3. 11. Representación de la masa de pectina en función del tiempo de tratamiento, repetición 4, 5 y 6 64 En las seis repeticiones se confirma un patrón de ascenso a medida que el tiempo de extracción incrementa, siendo los datos de 60 y 80 min los de menor aumento a causa del agotamiento del catalizador y del contenido en sí de la protopectina en la matriz de las paredes celulares. Además se aprecia una leve disminución del rendimiento en las dos últimas repeticiones (R5 y R6); dicho comportamiento se justifica en que durante el almacenamiento del fruto hasta su experimentación, este pudo sufrir la liberación de la protopectina por efecto de enzimas; a pesar de estar en condiciones adecuadas de refrigeración. Es por ello que al momento de la extracción con ácido los resultados son ligeramente menores. Los parámetros cinéticos: el orden y la velocidad de reacción se determinaron en términos de la protopectina contenida en la corteza. Los datos de rendimiento se modelaron según las linealizaciones correspondientes para una reacción de Primer y Segundo Orden, cuyas expresiones se detallan en la Tabla 3.9. Tabla 3. 9. Expresiones de la velocidad de reacción Reacción Velocidad de reacción Ecuación de Linealización Primer Orden 𝑑[𝑃] 𝑑𝜃 𝑣 = 𝑘 [𝑃] ln[𝑃] = ln[𝑃]𝑜 + 𝑘𝜃 ln 𝑚𝑃 = ln 𝑚𝑜 + 𝑘𝜃 Segundo Orden 𝑣 = 𝑘 [𝑃]2 1 1 = − 𝑘𝜃 [𝑃] [𝑃]𝑜 𝑣= [P]: Concentración de protopectina, g/mL mP: Masa de protopectina, g θ: Tiempo, min De acuerdo a los factores de correlación que arrojó el tratamiento de los datos, se determinó su correspondencia con una reacción de primer orden pues su valor se aproxima de mejor forma a 1, a diferencia de aquellos valores generados por la linealización de segundo orden; como se distingue en la Tabla 3.10. En las Figuras 3.12 y 3.13 se observa la aplicación del método integral y en el Anexo VII se detalla el procedimiento seguido para todas las repeticiones. 65 2,5000 ln (mP) 2,0000 1,5000 y = -0,0289x + 2,8555 R² = 0,9882 1,0000 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 2 Figura 3. 12. Método integral de linealización de los datos de extracción R2, reacción de primer orden 1400,0000 1200,0000 1/ [P] (mL/g) 1000,0000 y = 18,404x - 312,17 R² = 0,9031 800,0000 600,0000 400,0000 200,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 2 Figura 3. 13. Método integral de linealización de los datos de extracción R2, reacción de segundo orden 66 Tabla 3. 10. Factor de correlación según el orden de reacción Número de repetición Correlación Reacción Primer Orden Correlación Reacción Segundo Orden 1 0,8255 0.7411 2 0,9882 0,9031 3 0,9937 0,9371 4 0,9746 0,8693 5 0,9957 0,9646 6 0,9996 0,9287 Dicho resultado define a la reacción de Conversión de la Protopectina a Pectina como una reacción de orden 1, lo cual es sustentado por el trabajo investigativo de Khalikov, Mukhiddinov, Asoev y Degtyarev (1994), que concuerdan en lo mencionado (Khalikov et al., 1994, p. 734) Sin embargo, su índice de linealización difiere de una correlación perfecta en pequeña proporción, cuya causa puede atribuirse a la complejidad del procedimiento para la cuantificación gravimétrica de pectina; ya que, las operaciones unitarias que prosiguen a la extracción pueden ser susceptibles a pequeños errores experimentales; a pesar de ello la correspondencia con una reacción de primer orden es notoria. Una vez definido el orden se determinó la constante de la reacción, cuyo valor corresponde a la pendiente de las ecuaciones de linealización, las cuales se detallan en la Tabla 3.11. El valor promedio de la constante de velocidad es de 0,0286 min-1 con una desviación estándar de 0,0082 lo que indica una repetitividad en los datos. 67 Tabla 3. 11. Ecuaciones de linealización como Reacción de Primer orden Número de repetición Linealización Reacción Primer orden Velocidad de reacción (min-1) Velocidad de reacción (s-1) 1 y = 0,0122 x + 1,7969 0,0122 0,00020 2 y = 0,0289 x + 2,8555 0,0289 0,00048 3 y = 0,0329 x + 3,1461 0,0329 0,00055 4 y = 0,0312x + 3,0861 0,0312 0,00052 5 y = 0,0329 x + 3,0480 0,0329 0,00055 6 y = 0,0335 x + 3,1138 0,0335 0,00056 0,0286 ± 0,0082 0,00048 ± 0,00014 Velocidad de reacción promedio El valor de la constante de velocidad guarda relación con el reportado, para las influorescencias del girasol de 0,000283 s-1. En cambio al compararla con el de la manzana su valor es menor, pues es de 0,00098 y 0,00097 s-1 como lo determinaron Minkov, Minchev y Paev (Minkov, Minchev y Paev, 1996, p. 107). Este comportamiento se justifica en el orden, pues al ser de 1 su velocidad de reacción depende directamente de la concentración del reactivo (protopectina en la corteza del fruto). Es por ello de la similitud con el girasol, ya que su contenido de pectina es cercano, como se distingue en la Tabla 3.7; lo que difiere de las manzanas, ya que estas contienen mayor cantidad. 3.3. RESULTADOS DE LA DETERMINACIÓN DE LA CINÉTICA DE SECADO DE LA PECTINA GEL 3.3.1. RESULTADOS DE LA OBTENCIÓN DEL LA MEJORES CONDICIONES DEL PROCESO DE DESHIDRATACIÓN DE LA PECTINA 68 Después del proceso de coagulación de la pectina, esta requiere ser sometida a un proceso de deshidratación como se distingue en la Figura 3.8, pues se comercializa sólido; por dicha razón fue precisa la determinación de las mejores condiciones de secado. La deshidratación se realizó en el secador de bandejas del Laboratorio de Operaciones Unitarias y se trabajó a velocidades de aire de 1,4 m/s y 1,8 m/s; valores dentro del rango de funcionamiento del equipo en mención. La pectina es un producto termolábil, a temperaturas elevadas sufre daños en su estructura, que al recibir calor disminuye su propiedad de gelificación (Grunauer, 2009, p. 63), por lo que se definieron los 50,0 °C como la temperatura del tratamiento de secado. Las condiciones a las que se experimentó dicho proceso se resumen en la Tabla 3.12. Tabla 3. 12. Condiciones de deshidratación de la pectina gel Condiciones Temperatura (°C) Velocidad de aire (m/s) 1 50,0 1,4 2 50,0 1,8 Los resultados de humedad en base seca de la pectina coloidal respecto al tiempo a las diferentes condiciones se presentan en la Figura 3.14. Al comparar el comportamiento de la deshidratación a una velocidad de aire de entre 1,4 m/s y a 1,8 m/s, se distingue una reducción en la pendiente del perfil generado a menor velocidad, con valores de 3,6081 y 4,3471 (kg de agua/kg de pectina seca x h) respectivamente, correspondientes a la primera fase donde el líquido libre se elimina y se produce una reducción considerable de la humedad del gel, como se distingue en la Figura 3.15. 69 Humedad (kg de agua/kg de pectina seca) 35,0000 30,0000 25,0000 20,0000 15,0000 10,0000 5,0000 0,0000 0,0000 2,0000 4,0000 6,0000 8,0000 10,0000 12,0000 14,0000 16,0000 Tiempo (h) v= 1,4 m/s v=1,8 m/s Figura 3. 14. Perfil de deshidratación de pectina a 50,0 °C, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s Humedad (kg de agua/kg de pectina seca) 35,0000 30,0000 y = -3,6081x + 31,507 R² = 0,9998 25,0000 20,0000 y = -4,3471x + 30,923 R² = 0,9997 17,0746 15,0000 13,5356 10,0000 5,0000 0,0000 0,0000 1,0000 2,0000 3,0000 4,0000 5,0000 Tiempo (h) v=1,4 m/s v= 1,8 m/s Figura 3. 15. Perfil de deshidratación del periodo de velocidad constante, para las condiciones de velocidad de aire de 1,4 y 1,8 m/s 70 En la Figura 3.14 y 3.15 se evidencia que un aumento en el flujo de aire durante el proceso de eliminación del agua y del etanol contenido en la pectina coloidal, va directamente relacionado con un crecimiento de la velocidad de deshidratación; y con de ello la disminución del tiempo requerido para tal proceso, es por ello que para un mismo tiempo de 4 h el valor de la humedad alcanzado difiere de 17,0746 y 13,5346 (kg de agua/kg de pectina seca x h), para los tratamientos de 1,4 m/s y 1,8 m/s respectivamente. Al analizar el perfil a las condiciones de 50,0 °C y 1,4 m/s se observa que la pectina en estado sólido alcanza el equilibrio aproximadamente a las 13,50 h que corresponden a 830 min; mientras que para la curva generada a 50,0 °C y 1,8 m/s el tiempo en alcanzar un peso constante es de 11,83 h que equivale a 743 min. La diferencia de tiempo es alrededor 1,67 h que corresponde a 127 min. Un menor tiempo de secado involucra considerablemente una reducción de costos de operación, por tal razón este factor constituye un aspecto importante en la selección de las mejores condiciones; sin embargo es necesario evaluar si se produjo alteración alguna sobre una propiedad de calidad. Para ello se analizó la característica estructural del producto como lo es el porcentaje de metóxilos, cuyo parámetro es directamente proporcional a la capacidad de gelificar, como lo fundamenta en la sección 1.2.4.1.Los resultados del porcentaje de metóxilos se presentan en la Tabla 3.13. Tabla 3. 13. Contenido de metóxilos a las condiciones de 1,4 y 1,8 m/s de aire Condiciones de deshidratación Contenido de metóxilos (%) Temperatura (°C) Velocidad de aire (m/s) 50,0 1,4 1,6946 50,0 1,8 3,8722 En base a los datos experimentales reportados en la Tabla 3.12 se determina la influencia de la velocidad de deshidratación sobre el porcentaje de metóxilo. La 71 pectina deshidratada a una velocidad menor 1,4 m/s reporta una disminución en dicha propiedad respecto a la obtenida a 1,8 m/s; cuyo resultado puede atribuirse a la prolongación del tiempo al que es sometida la pectina coloidal a las condiciones de secado hasta reducir su humedad, lo que afecta negativamente en los ésteres de su cadena por la acidez del coloide. Considerando los resultados de las Figura 3.14 y 3.15; y de la Tabla 3.13 se definieron como condiciones óptimas de deshidratación para la pectina obtenida del limón Tahití un flujo de aire de 1,8 m/s y una temperatura de 50,0 °C. 3.3.2. RESULTADOS DEL ANÁLISIS DEL PERFIL DE DESHIDRATACIÓN, MODELIZACIÓN Y CINÉTICA El análisis cinético de la deshidratación de la pectina en estado coloidal hasta obtenerla sólida se realizó sobre el perfil generado a las mejores condiciones: 50,0 °C y 1,8 m/s; en el cual se determinó el tiempo y la velocidad de secado. El secado se llevó a cabo en una bandeja de dimensiones 0,19 x 0,24 m, cuya superficie expuesta fue la cara superior, con un espesor de material de aproximadamente 1,2 cm. Los resultados periódicos de peso de pectina respecto al tiempo registrados durante el ensayo, con sus respectivos valores de humedad en base seca y húmeda calculados se presentan en la Tabla 3.14. Tabla 3. 14. Datos de humedad de pectina a diferentes intervalos de tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire Tiempo (min) Tiempo (h) Peso de pectina (kg) Humedad en base seca (kg de agua/kg de pectina seca) Humedad en base húmeda (%) 0 0,0000 0,4520 30,8086 96,8562 73 1,2167 0,3810 25,8121 96,2703 119 1,9833 0,3310 22,2935 92,7069 178 2,9637 0,2700 18,0007 94,7370 72 Tabla 3.14. Datos de humedad de pectina a diferentes intervalos de tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire (continuación ….) Tiempo (min) Tiempo (h) Peso de pectina (kg) Humedad en base seca (Kg de agua/kg de pectina seca) Humedad en base húmeda (%) 243 4,0500 0,2030 13,2857 93,00 312 5,2000 0,1420 8,9930 89,99 359 5,9833 0,1080 6,6003 86,84 418 6,9667 0,0760 4,3483 81,30 443 7,3833 0,0640 3,5039 77,80 464 7,7333 0,0560 2,9409 74,53 493 8,2167 0,0460 2,2372 69,11 523 8,7167 0,0380 1,6742 52,61 553 9,2167 0,0310 1,1816 54,16 583 9,7167 0,0250 0,7593 43,16 613 10,2167 0,0200 0,4075 28,95 643 10,7167 0,0160 0,1260 11,19 710 11,8333 0,0150 0,0556 5,27 770 12,8233 0,0150 0,0556 5,27 788 13,1333 0,0150 0,0556 5,27 Una vez definidos los valores de humedad en cada intervalo se graficaron las curvas de deshidratación de la pectina, las cuales se presentan en las Figuras 3.16 y 3.17. Las trayectorias generadas presentan la forma típica de deshidratación de sólidos, la Figura 3.16 muestra el comportamiento de la humedad en base húmeda expresada como porcentaje, donde se distingue una humedad inicial elevada de 96,86 %, debido a su estado coloidal por los residuos de la precipitación previa (retención de agua y etanol); la cual disminuye a medida que el tiempo al que es expuesto el coágulo en el secado se incrementa. El descenso del porcentaje de humedad se da de forma parabólica, alcanzando una humedad de equilibrio de 5,2667 %, con un peso de pectina extraída de 15,0241 g. 73 120,00 Humedad (%) 100,00 80,00 60,00 40,00 20,00 0,00 0,0000 2,0000 4,0000 6,0000 8,0000 Tiempo (h) 10,0000 12,0000 14,0000 Figura 3. 16. Perfil de deshidratación de pectina, generado por los datos en base húmeda La Figura 3.17 muestra el perfil de deshidratación obtenido al representar los datos de la humedad en base seca contra el tiempo de secado de la pectina, los cuales se tabularon en la Tabla 3.14. En la Figura 3.17 se distinguen dos etapas, considerando como límite de división la humedad crítica. La etapa antecrítica involucra los primeros cinco datos de humedad correspondientes a los 262 min o 4,36 h, donde el agua contenida en el coloide se elimina a la temperatura de bulbo húmedo del aire de 24,4 ̊C (dato medido experimentalmente). Dicho periodo involucra la mayor reducción de la humedad correspondiente a 18,9355 kg de agua/kg de pectina seca. Esta etapa presenta un comportamiento lineal debido a la evaporación del líquido superficial y libre de la pectina (velocidad constante); a lo que le prosigue un cambio de direccionamiento, donde el punto flexión corresponde a la humedad crítica, como se esquematiza en la Figura 3.17. 74 Humedad (kg agua/ kg pectina seca) 35,00 30,00 25,00 Etapa Antecrítica 20,00 15,00 Xc Humedad Crítica 10,00 Etapa Postcrítica 5,00 0,00 0,00 2,00 4,00 𝜃c 6,00 8,00 10,00 12,00 14,00 Tiempo (h) Figura 3. 17. Etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire Donde: Xc: Humedad de pectina (kg de agua/kg de pectina seca) 𝜃c: Tiempo en el que se alcanza la humedad crítica (h) El comportamiento de la etapa antecrítica puede expresarse mediante la siguiente correlación lineal, donde el R2 es 0,9997 valor cercano a 1, lo que indica su adecuado ajuste de linealización. La ecuación [3.2] que describe dicho comportamiento es: X = −4,3471 θ + 30,923 Donde: X: Humedad de la pectina (kg de agua/kg de pectina seca) 𝜃: Tiempo de secado (h) [3.2] 75 La etapa posterior a las 4,36 h concierne la etapa postcrítica que representa una curva polinómica hasta alcanzar el equilibrio. Para este periodo en la superficie del gel ya se formó una costra, convirtiéndose esta en una barrera que tornó difícil la eliminación del agua; ocasionando la disminución de la velocidad de secado. La ecuación [3.3] expresa el comportamiento en la sección después del punto crítico: X = 0,2264 θ2 − 5,2364 θ + 30,069 [3.3] Dichas linealizaciones permiten modelar las etapas de deshidratación de la pectina, como se observa en la Figura 3.18. Humedad (kg agua/ kg pectina seca) 35,00 30,00 25,00 y = -4,3471x + 30,923 R² = 0,9997 20,00 15,00 10,00 y = 0,2264x2 - 5,2364x + 30,069 R² = 0,9966 5,00 0,00 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 Tiempo (h) Figura 3. 18. Modelización de las etapas de la deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s de aire El tiempo en el que ocurre la eliminación del agua de manera uniforme de 4,36 h es menor al tiempo en que la rapidez decrece de 7,19 h; esto se origina por los parámetros de control siendo inicialmente la rapidez de evaporación del agua y después la rapidez de difusión internamente en la pectina. 76 Con el fin de divisar de mejor forma la variación de la velocidad de secado, se determinaron sus valores como una relación diferencial entre la humedad y el tiempo; la cual expresa analíticamente las pendientes de la curva generada en la Figura 3.17, como se distingue en la ecuación [3.4]. 𝑊= 𝑆 ∆𝑋 𝐴 ∆𝜃 [3.4] Donde: S: Peso de pectina seca, (kg) A: Área expuesta al secado, (m2) ∆X: Variación de humedad en base seca, (kg de agua/kg de pectina seca) ∆𝜃: Variación de tiempo, (h) Para ello se consideró el área de la superficie superior de la bandeja con pectina que corresponde a 0,0456 m2. En la Tabla 3.15 se exponen los valores de la rapidez de deshidratación de la pectina respecto a la humedad media. Tabla 3. 15. Datos de la rapidez de deshidratación respecto al tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire 1,2167 X media (kg de agua/kg de pectina seca) 28,3103 1,9833 4,1067 W ( kg de agua/m2h) 1,2797 24,0528 4,5895 1,4302 2,9637 20,1471 4,3655 1,3604 4,0500 15,6432 4,3523 1,3563 5,2000 11,1393 3,7328 1,1632 5,9833 7,7966 3,0545 0,9518 6,9667 5,4743 2,2901 0,7136 7,3833 3,9261 2,0267 0,6316 7,7333 3,2224 1,6085 0,5013 8,2167 2,5890 1,4560 0,4537 Tiempo (h) (∆x/∆𝜃) 77 Tabla 3.15 Datos de la rapidez de deshidratación respecto al tiempo, durante el proceso de deshidratación a 50,0 °C y 1,8 m/s de aire (continuación ….) Tiempo (h) X media (kg de agua/kg de pectina seca) (∆x/∆𝜃) W ( kg de agua/m2h) 8,7167 1,9557 1,1260 0,3509 9,2167 1,4279 0,9852 0,3070 9,7167 0,9704 0,8445 0,2632 10,2167 0,5834 0,7037 0,2193 10,7167 0,2667 0,5630 0,1754 11,8333 0,0908 0,5630 0,0196 12,8233 0,0556 0,0000 0,0000 13,1333 0,0556 0,0000 0,0000 Los datos de Xmedia y W de la Tabla 3.15 se representaron en la Figura 3.19, para definir el comportamiento de la velocidad de deshidratación de la pectina, en la cual se visualiza un tramo recto que indica una velocidad constante durante los primeros cuatro valores de la humedad media, con un rango estrecho de 1,2797 a 1,3563 kg de agua/ m2h; corroborando el comportamiento lineal de la Figura 3.17. 1,6000 1,4000 Velocidad constante Punto crítico W(kg/m^2h) 1,2000 y = 0,0009x + 1,342 R² = 1 1,0000 0,8000 Velocidad decreciente 0,6000 0,4000 y = 0,1041x + 0,1167 R² = 0,9502 0,2000 0,0000 0,0000 5,0000 10,0000 15,0000 20,0000 25,0000 30,0000 35,0000 Xmedia (kg de agua/ kg de pectina seca) Figura 3. 19. Velocidad de deshidratación de la pectina del limón Tahití a 50,0 °C y 1,8 m/s 78 De igual manera, en la Figura 3.19 la expresión de la variación de la velocidad puede ser expresada mediante ajustes lineales, para lo cual se definieron las ecuaciones de las rectas generadas en las dos etapas definidas en la Figura 3.17. Etapa antecrítica: 𝑊 = 0,001 𝑋 + 1,342 [3.5] Etapa postcrítica: 𝑊 = 0,1041 𝑋 + 0,1167 [3.6] Mediante la intersección de las rectas se determinaron las coordenadas de (Xc; Wa) Anexo VIII, las cuales corresponden a una humedad crítica de 11,8731 kg de agua/ kg de pectina seca y un velocidad en la etapa antecrítica de 1,3527 kg de agua/m2 h. El tiempo de secado depende de la variación de la humedad con la velocidad y al considerar las ecuaciones [3.5] y [3.6], se determinó que se requirió de 11,83 h para alcanzar una humedad 0,0556 kg agua/ kg de pectina seca como humedad de equilibrio. En la Tabla 3.16 se resumen los parámetros cinéticos obtenidos del análisis de la deshidratación de la pectina del limón Tahití a las condiciones de 50,0 °C y 1,8 m/s de flujo de aire. Tabla 3. 16. Parámetros del proceso de deshidratación de la pectina a 50,0 °C y 1,8 m/s de aire Parámetros Valor Tiempo de secado hasta el equilibrio (h) 11,83 Humedad de equilibrio (kg de agua/kg de pectina seca ) 0,0556 Humedad crítica (kg de agua/kg de pectina seca ) 11,8731 Tiempo crítico (h) 4,36 Velocidad de secado constante (kg de agua/m2h) 1,3527 79 3.4. RESULTADOS DE LA CARACTERIZACIÓN DE LA PECTINA OBTENIDA DE LA CORTEZA DEL LIMÓN En la Figura 3.20 se muestra una imagen del producto obtenido bajo la experimentación de las mejores condiciones descritas en la Tabla 3.4. El producto presenta un aspecto de polvo fino con un tamaño de partícula de 250 um malla #60, su color es amarillo claro con ligera tonalidad blanca de modo que cumple con lo señalado por la FAO en la norma INS 40: Pectinas (FAO, 2009, p. 1). La tonalidad clara que posee la pectina del limón Tahití es preferida por su mínimo efecto sobre el aspecto final del alimento al que se le añade. Figura 3. 20. Aspecto físico del producto del limón de la variedad Tahití La evaluación de características del producto se definieron mediante las normas AOAC y bajo el método especifico de la determinación de las propiedades estructurales como lo es la valoración ácido-base de Owens señalado en los Anexos IX y X. Sus resultados promedios y su desviación estándar se presentan en la Tabla 3.17 y Figura 3.21, sus cálculos se encuentran desarrollados en el Anexo XI. 80 Tabla 3. 17. Características del producto final del limón Tahití (Citrus latifolia Tan.) Parámetros Valor Humedad (%) 5,86 ± 0,44 Cenizas insolubles en ácido (%) 1,21 ± 0,15 Peso Equivalente (g/ eq) 2 456,4505 ± 339,4869 La norma INS 40 manifiesta que la humedad que deben presentar las pectinas debe ser menor a 12%, con lo cual concuerda el producto obtenido ya que su valor es menor 5,86 ± 0,44. En relación con el valor reportado por productos de otras fuentes también es menor, es así de la diferencia con respecto al obtenido del limón Eureka de 11,12 % y de la cocona de 10,92% (Muñoz, 2010, p. 50). El valor bajo de dicho parámetro evita que la pectina se convierta en un medio de proliferación de microorganismos, pues la carencia de agua inhibe su desarrollo; asegurando su inocuidad alimenticia. A la vez que una humedad baja facilita la trituración del producto después del proceso de deshidratación. El segundo parámetro, cenizas, sobrepasa ligeramente el mencionado por la norma ˂ 1 %, atribuido probablemente al método de precipitación en alcohol que no actuó de forma completamente eficaz debido a la mala solubilidad de cenizas o sustancias inorgánicas que fueron captadas en el coágulo, dando lugar a un valor superior de 1,21% ± 0,15. En comparación con otras fuentes presenta similitud en su exceso, de acuerdo a la pectina del maracuyá que manifiesta un 1,4 % (Cuesta y Muñoz, 2010, p. 95; Kumar, Nayagi, Punichelvana y Afandi, 2013, p. 8). En la Tabla 3.16 se observa un valor elevado de los gramos-equivalentes de 2.456,4505 ± 339,4869 respecto al producto reportado de la cocona y los limones Eureka, siendo estos de 1 643,17 g/eq y 1 130 g/eq respectivamente; sin embargo respecto la pectina del maracuyá como materia prima, su valor es cercano de 2.370 g/eq (Cuesta y Muñoz, 2010, p. 95; Muñoz, 2010, p. 50). Dicho parámetro indica una elevada concentración de fragmentos piranosos de ácido galacturónico en la estructura de la pectina extraída. 81 80,00 72,85 % 70,00 Porcentaje (%) 60,00 50,00 40,00 27,49 % 30,00 20,00 10,00 3,55 % 0,00 Metóxilos Ácido Galacturónico Esterificación Figura 3. 21. Valores medios de las propiedades estructurales de la pectina del limón Tahití (Citrus latifolia Tan.) La agrupación de los esteres metílicos presentes en el homogalacturonano de la pectina del limón Tahití alcanza un porcentaje de 3,55 ± 0,83 %, mientras que la presencia de los elementos individuales de ácido galacturónico corresponden a 27,49 ± 5,45 %, y mediante su relación, el grado de esterificación promedio es de 72,85 ± 3,20 %. Según dichos parámetros el producto extraído del limón Tahití se categoriza como de elevado ET, ya que su proporción sobrepasa al 50 % como se fundamenta en la sección 1.2.3.3.; de esta manera se le atribuye un tiempo corto para la formación de geles de entre 20 a 70 s, definidos en la Tabla 1.8 (Edwards, 2007, p. 126; Imeson, 2010, p. 250). Además se corrobora lo mencionado por Sánchez et al. (2011), que indica que la extracción en medios ácidos genera pectinas con alto ET (p. 79). Respecto a la pectina del limón Eureka y del maracuyá su ET es menor; ya que, estas presentan un porcentaje de 76,50 % y 90,90 % respectivamente; mientras que en relación a la cocona su valor es mayor, ya que esta reporta un valor de 65,98 %. (Muñoz, 2010, p. 50; Cuesta y Muñoz, 2010, p. 95). 82 En base a dicho resultado la pectina obtenida puede distribuirse como un aditivo de rápida gelificación, al igual que la pectina 105 de Cimpa S.A.S. en cuya ficha comercial reportan un ET entre 62-73%; con humedad menor al 12%, tamaño de partícula de 250 um, de coloración crema y sin presencia de olor ni sabor (Cimpa, 2013, p. 1). Sin embargo la presencia de los fragmentos de ácido galacturónico menor al 65 % (Norma ISN. 40), indica que la pectina no presenta una pureza adecuada, lo cual se atribuye a la presencia de otros azúcares que intervinieron durante el precipitado de la misma o a la larga extensión del ramal ramnogalacturonano (Kumar et al., 2013, p. 8). 3.5. RESULTADOS DEL DISEÑO DEL REACTOR PARA LA HIDRÓLISIS Y DEL SECADOR DE LA PECTINA A ESCALA PILOTO. Para el diseño de los equipos a escala piloto se determinó inicialmente la producción diaria, la cual se estableció de acuerdo a las necesidades del país de pectina; es decir, a partir de los datos estadísticos de importaciones registrados por el Banco Central del Ecuador en los últimos años, lo cual se expone en la Tabla 3.18. Tabla 3. 18. Importaciones anuales, mensuales y diarias de pectina Importaciones Valor Anual (t) 48,55 Mensual (t) 4,05 Diaria (kg) 202,27 (Banco Central del Ecuador, 2014) Considerando el concepto de escala piloto como: modelo de una planta industrial a iguales condiciones, para análisis e investigación operativo, con requerimiento 83 de menores costos económicos (Anaya y Pedroza, 2008, p. 33); se consideró el 5 % de las importaciones diarias, lo que equivale aproximadamente a 10 kg de pectina sólida. 3.5.1. RESULTADOS DEL DISEÑO DEL REACTOR PARA LA HIDRÓLISIS A ESCALA PILOTO El diseño del reactor se realizó considerando las mejores condiciones de extracción obtenidas según datos experimentales y expuestas en las Tabla 3.4. El tipo de reactor seleccionado es un batch o discontinuo; ya que, la corteza y el medio acidulado son cargados en el reactor y requieren 80 min de contacto para solubilizar el producto; una vez finalizado dicho periodo, se descarga el contenido; no existen flujos por lo que se consideró dicho clase de reactor para el diseño. 3.5.1.1. Cuerpo, tapa y fondo El volumen de carga se estimó mediante el balance de masa en el reactor expresado en la ecuación [3.7], que involucra la constante de reacción previamente determinada de 0,0286 min-1. Se consideró una conversión del 90%. −𝑟𝑃 𝑉 = 𝑁𝑃𝑜 𝑉1 = 𝑑 𝑋𝑃 𝑑𝑡 [3.7] 𝑁𝑃𝑜 1 𝑥 ln ( ) = 1,40 𝑚3 𝑘 𝑡 𝐶𝑃𝑜 1 − 𝑋𝑃 [3.8] Aplicando el rendimiento de la extracción y la mejor relación corteza/ medio, el volumen de carga corresponde a: 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 = 𝑁𝑃𝑒𝑐𝑡𝑖𝑛𝑎 𝑥 100 = 345, 05 𝑘𝑔 0,2 𝑥 𝜂 [3.9] 84 𝑉𝑠 = 3 𝑥 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 = 1 035,15 𝐿 [3.10] 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 + 𝑉𝑠 = 1,44 𝑚3 𝜌𝑐𝑜𝑟𝑡𝑒𝑧𝑎 [3.11] 𝑉2 = Los valores de los volúmenes son muy similares, sin embargo para el diseño se consideró el volumen 2 que involucra resultados evaluados experimentalmente. En base a ello se estableció la operación de dos reactores en paralelo a fin de evitar un equipo de gran tamaño, por lo que se definió la carga por reactor de 0,72 m3. En la Tabla 3.19 se detallan los componentes de la alimentación por reactor. Tabla 3. 19. Componentes de la carga de cada reactor batch Componente Valor Corteza fresca (kg) 172,53 Ácido clorhídrico (L) 4,14 Agua (L) 513,44 El volumen nominal debe presentar cierta holgura del ocupado por el de carga o alimentación; según la mención en la norma API 2350: Protección contra sobrellenado para tanques (2005), se propone un 20 % (p. 18), por lo que se asumió dicho valor. 𝑉𝑛𝑜𝑚𝑖𝑛𝑎𝑙 = 1,2 𝑥 𝑉𝑟𝑒𝑎𝑐𝑡𝑜𝑟 = 0,87 𝑚3 [3.12] El volumen nominal involucra el volumen del cilindro y fondo del reactor; en primer lugar se consideró una relación 1,5 entre las dimensiones y se definió un diámetro de 0,84 m; 33,07 in. Dicho valor se aproximó a las dimensiones estándares de cabezas y casco recopiladas por Megyesy (2008) y se ajustó a un diámetro de 34 in, cuyo volumen de fondo es de 0,05 m3. 85 Se recalculó la altura y se estableció una relación de 1,6; adecuada según las relaciones típicas para tanques y reactores expuestas por Ahmed y Rahman (2012), que oscila entre 1,0 y 2,0 (p. 850). En el anexo AXII se presenta la descripción detallada del diseño del reactor y accesorios. En la Tabla 3.20 se tabularon las dimensiones del reactor para la extracción de pectina. Tabla 3. 20. Dimensiones del reactor batch para la extracción de pectina Parámetro Valor Altura reactor (m) 1,41 Diámetro interno del reactor (m) 0,86 Altura carga (m) 1,15 La tapa y el fondo del reactor se diseñaron considerando la presión de vapor y la presión hidrostática a soportar por las paredes del equipo. Se seleccionó de tipo torriesférico por características de: menor costo, presión máxima de trabajo de 15 bar y por ser la adecuada para reactores con un radio entre 15 a 300 cm (Sinnott, 2005, p. 817; Bueno, 2014, p. 73). Además que es imprescindible que el fondo del reactor presente una forma curva a fin de evitar aristas sin tráfico de flujo donde tiende a acumularse el material. El espesor de la base y tapa calculado corresponde aproximadamente 3 mm, se consideró un tiempo de vida útil por corrosión de 10 años, con lo que se definió un espesor del equipo de 18 mm. Sin embargo de acuerdo a las especificaciones comerciales de tapas estándar de Steel Company (Megyesy, 2008, pp. 324-326), se seleccionó un espesor de ¾ in , que equivale a 19,05 mm. La medida de 19,05 mm se consideró como espesor nominal de todo el equipo; en la Tabla 3.21 se expone el valor del espesor calculado, por corrosión y nominal del reactor batch. 86 Tabla 3. 21. Espesor calculado, por corrosión y nominal del reactor Parámetro Valor Espesor calculado (mm) 3,00 Espesor por corrosión (mm) 18,00 Velocidad de corrosión (mm/año) 1,50 Espesor nominal (mm) 19,05 Mediante el diámetro del reactor y el espesor del mismo se definieron las características dimensionales de la tapa y el fondo, las cuales se presentan en la Tabla 3.22. Tabla 3. 22. Dimensiones de la tapa y fondo del reactor Parámetro Valor Diámetro (cm) 86,36 Radio de curvatura (cm) 5,72 Profundidad (cm) 15,40 El reactor está destinado a contener una solución de ácido clorhídrico, sin embargo su concentración es pequeña, es decir la solución es muy diluida, por tal razón se seleccionó como adecuado el acero inoxidable austenítico por su resistencia a ácidos como el clorhídrico y sulfúrico. De forma específica se seleccionó el acero inoxidable 904L con elevado índice de resistencia a la corrosión de 35 (IMOA, 2012, p. 13-14); a la vez que, se establece adecuado del tipo 316 con un revestimiento interior de fibra de vidrio. 3.5.1.2. Sistema de agitación y calentamiento El proceso de extracción requiere agitación, por tal razón para cumplir con dicha operación se seleccionó un impulsor que proporcione un movimiento radial. 87 En la Tabla 3.23 se especifican las características y dimensiones del agitador diseñado. Tabla 3. 23. Características y dimensiones del agitador Parámetro Valor Tipo Turbina de disco Número de palas 6 Diámetro (cm) 28,67 Ubicación respecto al cilindro (cm) 38,33 Diámetro del disco (cm) 25,55 Longitud de la pala (cm) 9,58 Altura de la pala (cm) 7,67 Los resultados presentados en la Tabla 3.23 dependen directamente del diámetro del reactor y la altura de llenado, pues su cálculo se fundamentó en razones estándares definidas por McCabe et al. (2007). El movimiento circulatorio creado en el interior del reactor y su localización a un nivel de 38,33 cm de la base del cilindro, permiten mayor contacto de la corteza con el medio ácido, beneficiando la extracción. La velocidad de giro en el reactor es de 250 rpm, que arroja un número de Reynolds de 3 x 103, lo cual indica un flujo ligeramente turbulento; beneficioso, ya que si cayera en un estado de turbulencia considerable la corteza se desintegraría alterando el resultado final del producto. El número de potencia correspondiente es de 5,5 y mediante la expresión [3.13] se precisó 1 HP para que el impulsor gire a la velocidad indicada. 𝑃 = 𝑁𝑝 𝑛3 𝐷𝑎 5 𝜌𝑚 = 1,00 HP [3.13] Sin embargo para su diseño se recomienda u a potencia mayor en un 15% (De la Morena, 2013, p. 62) por lo que la potencia necesaria aproximadamente equivale a 1,20 HP. 88 El requerimiento energético para elevar la temperatura de la solución ácida equivale a 246 765,88 kJ, valor alto debido a que la variación de temperatura a la que se expone la alimentación también lo es (57 °C), en base a ello se determinó la utilización de una chaqueta de calentamiento. La chaqueta es el sistema más utilizado para proporcionar energía calorífica a diversos procesos, pues el calor latente entregado por el vapor es considerable (Hernández, Montiel, Reyes y Zaragoza, 2013, p.88). Se descartó la utilización de resistencias sumergibles o serpentines internos debido al tratamiento con solución ácida, que provocaría su corrosión. Sinnott (2005), menciona una separación entre camisa y reactor de 50 mm para equipos de pequeña y mediana capacidad (p. 775), a partir de dicha consideración se determinó el diámetro de la chaqueta, el cual se observa en la Tabla 3.24. Tabla 3. 24. Dimensiones de la chaqueta de calentamiento Parámetro Valor Ancho chaqueta (m) 0,05 Diámetro chaqueta (m) 1,00 Por el anular generado entre el reactor y la chaqueta se definió como necesario vapor saturado a 150 psi y 181,62 °C; cuyo fluido transferirá una energía de 21009,2 kJ/ kg para incrementar la temperatura durante el proceso de extracción. En la Figura 3.22 se presenta el diseño final del reactor para la extracción de la pectina del limón Tahití, incluidos sus accesorios: agitador y chaqueta. 89 Figura 3. 22. Diseño del reactor y agitador para la hidrólisis de la pectina a escala piloto 90 3.5.2. RESULTADOS DEL DISEÑO DEL SECADOR A ESCALA PILOTO 3.5.2.1. Armario, bandejas y cámara de secado Considerando las mejores condiciones de secado evaluadas experimentalmente en la sección 3.3.1, así como la naturaleza del producto se determinó la utilización de un secador batch para el tratamiento de la pectina; lo que obedece a características de producción menores a 150 kg/h, tiempo extenso de reducción del contenido de agua y naturaleza de gel o pasta de la alimentación (McCabe et al., 2007, pp. 853 -869). Se diseñó un equipo de forma rectangular, cuyas dimensiones de la cámara de secado corresponden las del carro móvil portador de bandejas con cierto espacio libre, de manera que al ingresar este al secador calce correctamente. Para el diseño del mismo y mediante la aplicación de la norma INS 40: Pectinas se consideró una humedad final del producto del 10,00 %, a partir de ello se definió la masa de alimentación de la pectina en estado coloidal, la cantidad de agua a eliminar y el tiempo de secado hasta alcanzar dicha humedad, los cuales se presentan en la Tabla 3.25. Tabla 3. 25. Alimentación del gel, agua a eliminar y tiempo de secado de la pectina Parámetro Valor Pectina alimentación (kg) 286,28 Agua a eliminar (kg) 276,28 Pectina producto (kg) 10,00 Tiempo de secado (h) 11,41 En la Tabla 3.25 se observa una amplia diferencia entre la masa de alimentación y la masa del producto final, lo cual se debe al elevado contenido de humedad; es así que para producir 10,00 kg; el secador debe disponer de un área para almacenar aproximadamente 30 veces el valor del producto. El área de secado se definió mediante expresión del tiempo que involucra los periodos ante y postcrítico 91 como se señala en la ecuación [3.14], para ello se consideró la modelización de la Figura 3.19. 𝜃= 𝑋𝑐 𝑆 𝑋𝑜 − 𝑋𝑐 𝑑𝑋 [ +∫ ] 𝐴 𝑊𝑐 𝑋𝑓 0,1041 𝑋 + 0,1167 [3.14] Para su diseño se estableció un factor de 10 % sobre el requerimiento real (Sinnott, 2005, p. 13). En la Tabla 3.26 se presenta el área real y de diseño del equipo deshidratador. Tabla 3. 26. Área de diseño del secador Parámetro Valor Área real (m2) 28,89 Área de diseño (m2) 31,78 Tomando en cuenta el elevado valor de superficie de secado se definieron dos bastidores. Se determinó un área por bandeja de 0,49 m2 que corresponde a la sección superior expuesta de dimensiones de 75 x 65 cm, valores dentro de los recomendados por McCabe et al. (2007). El número de bandejas se definió mediante la relación [3.15]. 𝑁 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = Á𝑟𝑒𝑎 𝑑𝑒 𝑑𝑖𝑠𝑒ñ𝑜 Á𝑟𝑒𝑎 𝑏𝑎𝑛𝑑𝑒𝑗𝑎 [3.15] 𝑁 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 65,19 ≈ 66 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 La distribución de bandejas por bastidor vertical es de 33, lo cual concuerda con lo señalado por McCabe et al. (2007), quien define como máximo 40 por sección (p.854). En la Tabla 3.27 se resumen las características individuales de las bandejas. 92 Tabla 3. 27. Características y dimensiones de las bandejas Parámetro Valor Material Acero inoxidable 316 Número 33 Longitud (cm) 75 Ancho (cm) 65 Alto (cm) 2 Se seleccionó como material acero inoxidable 316, debido a sus buenas características de resistencia ante componentes como agua, alcohol etílico y pectina; además de su favorable trabajo a temperaturas menores a los 800 °C. El coloide en la bandeja alcanza un espesor 1,2 cm; por lo que se definió una altura de 2,0 cm para evitar derrames; y un espacio libre entre bandejas de 4 cm. Para el esqueleto del bastidor se consideraron perfiles cuadrados de 20 y 50 mm de ancho, 6 de posición vertical y 4 horizontal, formándose un cubo. Cada 6 cm en los perfiles verticales se establecieron pestañas o ángulos para soporte de las bandejas, siendo estos de 30 mm de ancho. Mediante la densidad el acero de 7800 kg/m3 (Megyesy, 2008, p. 360) se definió el peso del armario y bandejas. 𝑃𝑒𝑠𝑡𝑟𝑢𝑐𝑡𝑢𝑟𝑎 + 𝑃𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 293,29 𝑘𝑔 [3.16] Los bastidores son estructuras móviles por lo que se definió la implantación ruedas giratorias que soporten el peso total de armario, incluido el material a deshidratar. 𝑃𝑐𝑎𝑟𝑟𝑜 = 𝑃𝑔𝑒𝑙 + 𝑃𝑒𝑠𝑡𝑟𝑢𝑐𝑡𝑢𝑟𝑎 + 𝑃𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 579,57 𝑘𝑔 [3.17] M&S Equipamientos comercializa ruedas con una capacidad de carga de 160 kg, en base a ello se definió la implantación de cuatro ruedas, las mismas que se ubicarán en los vértices de la estructura metálica permitiendo su desplazamiento. 93 Su temperatura máxima de trabajo es de 80 °C, adecuada ya que se trabaja a una temperatura menor a esta. Considerando la altura total de la rueda 12,80 cm, dimensiones de bandeja y soportes metálicos se definieron la altura, ancho y profundidad del armario; así como de la cámara, con espacio adicional de 15 cm, como se distingue en la Tabla 3.28. En el Anexo XIII se detalla el diseño del secador. Tabla 3. 28. Dimensiones de las carro y cámara de secado Parámetro Altura Ancho Profundidad Dimensiones carro (m) 2,15 1,59 0,69 Dimensiones cámara (m) 2,30 1,75 0,85 En la Figura 3.25 se presenta la vista frontal y lateral del armario, con los dos bastidores. Para mantener internamente la temperatura de 50 °C, se definió la utilización de un aislante térmico. El gradiente de temperatura entre el ambiente y el interior no es alto, pero el elevado costo de la utilización de energía eléctrica en un tiempo extenso de 11,41 h de operación, obliga la implantación de lana de vidrio en las paredes laterales y cubierta de la cámara interna o cámara de secado. El espesor del aislante 3,81 cm (1,5 in) se estimó mediante la ecuación [3.18] obtenida por transferencia de calor, como se describe en el Anexo XIII. 𝑇𝑜𝑝 −𝑇𝑠 𝑡𝑎𝑖𝑠𝑙𝑎𝑛𝑡𝑒 = 𝑘 𝑅𝑠 ( 𝑇 −𝑇 ) = 3,81 𝑐𝑚 𝑠 𝑎 [3.18] La empresa FIBER GLASS proveedora de lana de vidrio, facilitó su programa ECOWIN GREEN, el cual al introducir las variables señaladas en la Figura 3.23, se obtiene el espesor adecuado del aislante. 94 Figura 3. 23. Parámetros para la estimación del espesor de lana de vidrio en el secador requeridos por el programa ECOWIN GREEN Figura 3. 24. Resultados del programa ECOWIN GREEN En la Figura 3.24 se estableció como resultado un espesor 3,81 cm (1,5 in) de lana de vidrio; lo que corrobora el valor obtenido mediante la ecuación [3.18], el cual permite una eficiencia energética considerable del 92,72 %. La aplicación del espesor mencionado en las paredes del deshidratador es imperioso a fin de mantener la temperatura de trabajo y minimizar las pérdidas energéticas al ambiente, ya que sin dicho material se perderían alrededor de 340,73 W/m 95 Figura 3. 25. Diseño del carro móvil portador de bandejas para la pectina gel 96 3.5.2.2. Sistema de ventilación Con el fin de mantener el movimiento del aire para la deshidratación se determinaron tres parámetros primordiales para la selección del ventilador, entre ellos: flujo volumétrico del aire, presión estática y nivel sonoro. La caída en el contenido de humedad de la pectina se relaciona al incremento de la humedad del aire en el deshidratador, desde las condiciones iniciales a aquellas de descarga, como se describe en la ecuación [3.19]. [3.19] 𝐺𝑎 (𝑌𝑠 − 𝑌𝑒 ) = 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 (𝑋𝑜 − 𝑋𝑓 ) Es por ello que experimentalmente se registraron las temperaturas de bulbo húmedo y seco a la entrada y salida del dámper del equipo, que permitieron definir las propiedades del aire, las cuales se exponen en la Tabla 3.29. Dichos parámetros definidos se evaluaron a nivel de Quito de 2 800 msnm y 0,72 atm, su cálculo detallado se encuentra en el Anexo XIII. Tabla 3. 29. Condiciones térmicas de entrada y salida del aire Temperatura Entrada Salida Temperatura de bulbo seco 68 °F / 20,0 °C 118 °F / 47,8 °C Temperatura de bulbo húmedo 60 °F / 15,6 °C 76 °F / 24,4 °C 0,0136 0,0176 Volumen especifico (m3/kg) 1,18 1,31 Densidad (kg/m3) 0,85 0,76 Humedad Absoluta (kg de agua/ kg de aire seco) Remplazando los valores de la humedad absoluta del aire y las condiciones de humedad del coágulo de 30,8086 a 0,1111 kg agua/kg de pectina seca en la ecuación [3.19], se definió el flujo de aire necesario para su deshidratación; y 97 mediante un factor de sobredimensionamiento del 20 % se consideró el flujo de diseño. 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 (𝑋𝑜 − 𝑋𝑓 ) 𝑚3 𝐺𝑎 = = 7 143,02 (𝑌𝑠 − 𝑌𝑒 ) ℎ 𝐺𝑎 = 1,2 𝑥 7143,02 𝐺𝑎𝑑𝑖𝑠𝑒ñ𝑜 𝑚3 ℎ 𝑚3 = = 8 571,62 ℎ El elevado valor del flujo volumétrico se fundamenta en la naturaleza de la pectina, con aspecto coloidal o gel, que contiene 96,8562 % de humedad, es decir únicamente el 3,1438 % del material es pectina pura, es así que para retirar toda el agua o etanol contenido requiere una cantidad de aire realmente significante. Según Greenheck (2010), para la ventilación en equipos o sistemas sin ductos, la presión estática de diseño oscila de 0,05 a 0,20 inca (p. 17), se consideró el valor del límite superior ya en el secador el aire es succionado directamente no atraviesa por ductos circulares ni rectangulares. Además se determinaron las perdidas friccionales en la cámara de secado de 2,3 mmca. 𝑃𝑠 = 0,20 𝑖𝑛 𝑐𝑎 = 5,08 𝑚𝑚𝑐𝑎 𝛥𝑃𝑝é𝑟𝑑𝑖𝑑𝑎𝑠 = 2,30 𝑚𝑚𝑐𝑎 Con el fin de mantener el movimiento del aire se seleccionó un ventilador tipo axial helicoidal, el cual se definió por sus particularidades de caudal de trabajo elevado, presiones menores, bajo coste, corta dimensión longitudinal y de uso extendido para ventilación directa y forzada (Rayaprolu, 2012, p. 28). 98 En las Tablas 3.30 y 3.31 se muestran las características de operación del ventilador OTAM y sus dimensiones, el cual fue seleccionado según los parámetros de diseño anteriormente definidos. Tabla 3. 30. Parámetros del ventilador para el secado de pectina gel. Parámetro Valor Modelo OTAM 710 3 Caudal volumétrico (m /h) 8 916 Presión estática (mmca) 11 Velocidad de rotación (rpm) 850 Nivel de ruido (dBA) 65 Potencia (HP) 1 (OTAM, 2011, p. 7) Tabla 3. 31. Dimensiones del ventilador para el secado de pectina gel. Parámetro Valor Peso (kg) 52 Diámetro de los álabes (m) 0,712 Ancho incluido motor (m) 0,491 Altura total (m) 1,000 (OTAM, 2011, p. 10) Según los datos de la Tabla 3.30 el movimiento de los álabes genera un nivel sonoro de 65 dBA, el cual se encuentra dentro del rango permitido para zonas industriales, como lo señala el Anexo 5 del TULAS, que especifica un máximo de 70 dBA (Registro oficial de normas técnicas ambientales N°41, 2007, p. 39) La posición del ventilador se definió en la parte posterior de la cámara de secado, para impulsar el aire en dicha sección. 99 3.5.2.3. Sistema de calentamiento Además de la cámara de secado se estableció en el equipo una cámara externa, en la que se ubica el ventilador y el sistema de calentamiento que permita elevar la temperatura del aire en su recorrido. La cantidad de calor necesario en el proceso de secado se estimó mediante la ecuación [3.20] (Ahmed y Rahman, 2012, p. 518), que expresa el fenómeno gobernador como lo es la convección, transfiriendo el calor del gas al cuerpo húmedo, especialmente durante la fase inicial cuando no existe resistencia a liberar el agua y etanol atrapado en el gel. El área de secado constituye el área de diseño señalada en la Tabla 3.26. [3.20] 𝑄 = ℎ 𝐴𝑑𝑖𝑠𝑒ñ𝑜 (𝑇 − 𝑇𝑓 ) La dirección del flujo del aire es paralela al alimento, tomando en cuenta dicho aspecto se definió el coeficiente de transferencia expresado en la ecuación [3.21]. ℎ = 0,0175 𝐺 0,8 = 15,57 𝑘𝑐𝑎𝑙 𝑚2 ℎ °𝐶 [3.21] Aplicando la ecuación [3.20], en un intervalo entre la temperatura de trabajo y la de bulbo húmedo del aire, se definió la cantidad de calor. 𝑄 = 13,46 𝑘𝑊 Es imperioso considerar la cantidad de calor requerido por el gel para incrementar su temperatura. 𝑄𝑔𝑒𝑙 = 𝑚𝑔𝑒𝑙 𝑥 𝐶𝑝𝑔𝑒𝑙 𝑥 ∆𝑇 = 1,02 𝑘𝑊 𝑄𝑟𝑒𝑠𝑖𝑠𝑡𝑒𝑛𝑐𝑖𝑎𝑠 = 1,10 𝑥 (𝑄 + 𝑄𝑔𝑒𝑙 ) = 15,93 𝑘𝑊 [3.22] 100 El medio calefactor constituyen las resistencias eléctricas, para lo cual se añadió un 10 % al calor total a causa de posibles pérdidas. Para este deshidratador se definió utilizar resistencias tipo aletas, las cuales por su configuración (mayor superficie conectiva) permiten disipar rápidamente la energía térmica generada. Las características de las aletas seleccionadas se presentan en la Tabla 3.32. La potencia por resistencia generada es de 3 500 W, por lo que se estimó según el requerimiento energético 5 unidades, cuya longitud es adecuada considerando que se ubicaran en la parte posterior baja de la cámara de secado. Tabla 3. 32. Características de las resistencias con aletas Parámetro Valor Material Acero inoxidable 304 Potencia (W) 3 500 Longitud (m) 1,055 Ancho (m) 0,040 (RCI, 2015, p. 1) En la Figura 3.26 se observa el diseño del deshidratador, incluidas su sección interna y sus accesorios. 101 Figura 3. 26. Diseño del secador de la pectina gel a escala piloto 102 3.5.3. RESULTADOS DE COSTOS DE MATERIA PRIMA, INSUMOS Y DE PRODUCCIÓN DE PECTINA En la Figura 3.27 se esquematiza el Diagrama PFD del tratamiento de las cortezas del limón Tahití (Citrus latifolia Tan.) para la extracción de la pectina, en el cual se sintetiza el balance de masa y energía realizado bajo las mejores condiciones experimentales de la Tabla 3.4, a fin de generar diariamente 10 kg o 2 400 kg al año. En el proceso sólido-líquido de la Figura 3.31 se establecieron tres áreas como se describen en la Tabla 3.33, las cuales se enumeran de acuerdo al orden de interferencia; cada sección está conformada por uno o más equipos que cumplen una función determinada. Tabla 3. 33. Áreas del diagrama PFD. Área Descripción 100 Tratamiento del albedo y flavedo 200 Extracción ácida 300 Tratamiento de la pectina En la estimación de los costos de producción se consideraron aquellos recursos que intervienen directamente con la fabricación del aditivo, como lo son: limones e insumos, servicios y fuerza laboral. En la Tabla 3.34 se tabulan los valores de los cítricos e insumo requeridos. Tabla 3. 34. Detalle de los costos de los cítricos e insumos Parámetro Consumo diario Costo unitario Consumo anual Costo anual ($) Limones 991,64 kg 0,66 $/kg * 237 993,60 kg Agua 1,72 m3 0,72 $/m3 412,80 m3 297,22 HCl 37% 8,28 L 1,36 $/L ** 1 987,20 L 2 702,59 Etanol 96 % 626,48 L 2,00 $/L ** 150 355,20 L TOTAL *Referencia: Asociación Quinlata, Patate **Referencia: Casa de los Químicos S.A., Ecuador 157 075,77 300 710,40 460 785,98 103 Agua 10 11 3 CR-101 6 8 1 Limones PC-103 Agua LV-102 91 LV-102 2 4 ME-104 Limones de desecho 7 5 Agua residual 14 13 Vapor 9 Pulpa y semllas Agua 150 Agua residual 12 Agua Agua 16 15 15 HCl Vapor HCl 17 18 RE-201 150 Vapor 75 RE-202 75 19 Etanol y agua Etanol y agua Etanol 96 % 27 23 25 20 F-301 25 28 29 24 26 TP-302 F-303 22 21 Corteza Agua Pectina MC-305 Agua SB-304 50 30 18 Figura 3. 27. Diagrama de flujo del proceso de obtención de pectina del limón Tahití (Citrus latifolia Tan.) a escala piloto 104 Analizando los valores de la Tabla 3.34 se distingue que los rubros que mayor relevancia económica presentan corresponden al etanol, lo cual es justificable considerando, que durante el proceso de coagulación se adiciona el 60 % del volumen del extracto, este rubro podría optimizarse con la recuperación y reutilización del alcohol. Además el valor de la materia prima es alta, ya que, la corteza como única parte útil para la extracción corresponde el 35,43 % del cuerpo entero del fruto, demandando un número aproximado de 14 224 limones. De la Figura 3.27 también se obtuvo la cantidad de agua como servicio industrial y la cantidad de vapor con el que se determinó el requerimiento de diésel; el consumo eléctrico se definió de la operación de los equipos; cuyo detalle se expone en el Anexo XIV. En la Tabla 3.35 se presenta el detalle de costos por servicios industriales. Tabla 3. 35. Detalle de los costos de servicios industriales Parámetro Consumo diario Agua 3 2,89 m Combustible Energía eléctrica Costo unitario 3 Consumo anual Costo anual($) 0,72 $/m 3 652,80 m 499,39 17,47 L 0,31 $/L 3 472,80 L 1 076,57 204,56 kWh 0,12 $/kWh 49 094,40 kWh 5 891,33 TOTAL 7 467,29 En la Tabla 3.35 es notorio que la energía eléctrica ingiere en un 79 % de los valores por servicios, este costo describe la alta demanda energética del secador y su extenso rango de operación de 11,41 h. El diésel representa el 14 % y el agua el 7 %, que abarca los procesos de lavado, escaldado y enfriamiento. El desglose del costo eléctrico se presenta en Tabla AXIV.1. En la Tabla 3.36 se detalla el salario recibido por los operados de la planta piloto, que representan el rubro de la mano de obra. 105 Tabla 3. 36. Detalle de los costos de mano de obra Parámetro Número Operador 2 Sueldo mensual Sueldo anual más beneficios ($) ($) 354,00 $ 5 034,33 $ Sueldos ($) 10 068,66 10 068,66 TOTAL La recopilación de los costos de producción de 2 400 kg/año de pectina se presenta en la Tabla 3.37. Tabla 3. 37. Recopilación de los elementos de producción de 2400 kg de pectina al año Concepto Materia prima e insumos Valor ($/kg) 191,99 Servicios industriales y mano de obra 7,31 COSTOS TOTALES DE PRODUCCIÓN 199,30 En la Figura 3.28 se esquematiza el porcentaje de intervención de los elementos de producción descritos en la Tabla 3.37. 4% Materia Prima e Insumos Servicios y Mano de obra 96% Figura 3. 28. Porcentaje de intervención de los elementos de producción para la generación de 2 400 kg/año de pectina. 106 Mediante la relación de los costos y la cantidad a producir anualmente de 2 400 kg, se definió el valor del kilogramo de pectina obtenida del limón Tahití (Citrus latifolia Tan.) mediante el proceso fisicoquímico planteado, de 199,30 $; como se indica en la Tabla 3.37. De acuerdo a la Figura 3.28, el concepto de materia prima e insumos constituye casi la totalidad del valor de producción, justificable debido al bajo rendimiento de la corteza de 2,90 % (base húmeda), que obliga a un consumo elevado de cítricos e insumos. A pesar que la pectina constituye un producto con un alto costo en el mercado; el valor de producción es sumamente elevado, equivalente a cuatro veces del valor de expendio del producto importado por Laquim de 52,76 $/kg, con lo que se establece que el proceso no es económicamente rentable. Sin embargo se debe acotar la necesidad de estudiar un mecanismo de recuperación del etanol, o a la vez partir de corteza de desecho para reducir costos, lo que implicaría un nuevo estudio ya que el presente es específicamente de la variedad Tahití. 107 4. CONCLUSIONES Y RECOMENDACIONES 4.1. CONCLUSIONES De la caracterización física del limón Tahití (Citrus latifolia Tan.) de la Granja de la Asociación de Productores Agropecuarios Quinlata del cantón Patate, Provincia Tungurahua, se obtuvo un diámetro promedio de 6,04 ± 0,17 cm y un peso unitario promedio de 69,7225 ± 3,8830 g; con una proporción de albedo y flavedo próxima a la mitad de su peso unitario, siendo esta de 35,43 ± 3,69 %; cuya sección es la reserva de pectina. Resultados de la caracterización química definieron al limón Tahití (Citrus latifolia Tan.) con una acidez de 2,00 ± 0,10 de pH y un porcentaje de 4,70 ± 0,17 % considerando la neutralización del ácido cítrico presente; y el contenido de sólidos solubles en el zumo del fruto de 8,20 ± 0,40 °Bx. Se estableció un estado de madurez de 1,74 ± 0,18, valor aproximado a 2, lo que corrobora el nivel de recolección según la apariencia física. Del tratamiento preliminar de extracción se determinó la temperatura de 75 °C como la mejor, de acuerdo al efecto beige en la tonalidad de la pectina obtenida y la mejor condición de potencial de hidrógeno de 1,5 por generar un rendimiento superior de 14,76 % respecto al 6,89 % a pH 3,0. De acuerdo al comportamiento extractivo en función del tiempo a pH 1,5, se establecieron los 80 min como la cumbre de extracción; a partir del cual se produce un declive; divisándose dos etapas en el proceso de obtención de pectina. La mejor relación corteza/medio en la operación unitaria de extracción fue de 1/3, debido a la formación de un coágulo grande y consistente en la adición de alcohol etílico para su separación. 108 El rendimiento promedio de extracción de pectina del albedo y flavedo del limón Tahití (Citrus latifolia Tan.) bajo las mejores condiciones de extracción fue de 14,49 ± 0,43 % en base húmeda y de 2,90 ± 0,09 % en base seca; y al comparar dicho valor con el presentado bibliográficamente de las especies Sutil y Eureka es superior. Del análisis cinético de extracción se determinó que la reacción de Solubilización de la Protopectina involucra una reacción de primer orden hasta alcanzar los 80 min, según el método integral de velocidad de reacción. Además según la pendiente de la gráfica se determinó el valor de la constante de reacción de 0,0286 min-1. Se establecieron como las mejores condiciones de deshidratación de la pectina coloidal los 50,0 °C y 1,8 m/s de aire, cuyo tratamiento produjo un menor tiempo de secado concatenado con una baja interferencia en el porcentaje de metóxilos del producto. Del análisis cinético del perfil de deshidratación del gel bajo las mejores condiciones se determinó un tiempo de secado de 11,83 h, una velocidad constante de 1,3527 kg de agua/m2h, una humedad crítica y de equilibrio de 11,8731 y 0,0556 kg de agua/kg de pectina seca respectivamente. De la caracterización del producto final se determinó un contenido de agua de 5,86 %, el cual cumple con la norma INS 40: Pectinas expuesta con la FAO; y un contenido de cenizas superior al permitido de 1,21 %. De acuerdo a las propiedades estructurales se definió a la pectina como una sustancia de 2 456,4505 g/eq, 3,55 % de metóxilos, 27,49 % de ácido galacturónico y 72,85 % grado de esterificación. Del diseño del reactor para la hidrólisis se obtuvo un equipo con capacidad nominal de 0,87 m3, con una relación dimensional de 1,6, que involucra 1,41 109 m de altura y 0,86 m de diámetro; un espesor de 19,05 mm; tapa y fondo torriesférica. Del diseño de los equipos auxiliares al reactor se estableció un agitador de turbina de 6 palas, con diámetro de 28,67 cm y un motor de 1,20 HP. Además una chaqueta con un anular de 0,05 m, por la que se atraviesa vapor a 150 psi. Del diseño del secador se determinó un área nominal de 31,78 m2, bandejas de 0,75 x 0,65 m, ubicadas en un armario con dos bastidores de 33 unidades. Las dimensiones del armario se establecieron en 2,15 x 1,59 y 0,69 m y las de la cámara de secado mayores en 0,15 m; con un aislamiento de lana de vidrio de 3,81 cm. Del diseño de los equipos auxiliares al secador se estableció un ventilador con un diámetro de alabes de 0,712 m, que proporciona un flujo de 8916 m3/h y soporta una presión estática de 11 mmca. Para el sistema de calentamiento se establecieron 5 resistencias tipo aletas, que generan 3,5 kW cada una. El costo de producción por kilogramo de pectina es de 199,30 $, valor sumamente elevado al producto importado, con lo que se concluye una no rentabilidad del proceso de extracción. 4.2. RECOMENDACIONES Evaluar el efecto en el rendimiento de extracción de otras sustancias precipitantes no convencionales como: sales de aluminio, sales de cobre, pectato de calcio, etc.; a diferentes proporciones del extracto. Se recomienda analizar la inclusión de un proceso de evaporación o concentración, para reducir tiempo, energía y costos en el proceso de 110 deshidratación de la pectina coloidal, cuya operación demanda gran cantidad de energía eléctrica. Analizar profundamente la extracción de la pectina del limón Tahití por el método enzimático y bajo el previo tratamiento en microondas de las cortezas. Evaluar un proceso para la recuperación y reutilización del alcohol etílico residual del proceso de coagulación, ya que se consume de una cantidad elevada de dicha sustancia. Estudiar la implantación de un proceso integral de aprovechamiento de los recursos del fruto, además de la corteza, la pulpa y el zumo, como lo es la extracción de aceite, elaboración de alimento, etc.; a fin de optimizar la industrialización del limón Tahití. 111 REFERENCIAS BIBLIOGRÁFICAS 1. Acerosotero. (2015). Catálogos de acero. Recuperado de http://www.acerosotero.cl/pdf/catalogo_aceros_otero.pdf (Enero, 2015) 2. Ahmed, J. y Rahman, M. (2012). Handbook of Food Process Design. Reino Unido, Oxford: Blackwell Publishing Ltd. 3. Albarracín, P., Prieto, D., Barnes, N., Paz, D. y Genta, H. (2011). Elaboración de dietas utilizando cáscara de limón en alimento para ganado bovino. Recuperado de http://www.produccion- animal.com.ar/tablas_composicion_alimentos/38-limon.pdf (Noviembre 2014) 4. Anaya, A. y Pedroza, H. (2008). Escalamiento, el arte de la ingeniería química: Plantas piloto, el paso entre el huevo y la gallina. Tecnología, Ciencia, Educación, 23(1), 31-39. Recuperado de http://www.teschi.edu.mx/TESCHI-web/TESCHIpapelera/%20cevm/diapositvas/Anexos%20Modelos/Anexos%20Model o%20Empresa/Escalamiento/escalamiento.%20El%20arte%20de%20la %20ingenier%EDa%20Qu%EDmica.pdf (Enero, 2015) 5. AOAC. (2005). Official Methods of Analysis (18va. ed.). Maryland, Estados Unidos: AOAC International 6. API 2350. (2005). Overill Protection for Storage Tanks in Petroleum Facilitis. Recuperado de https://law.resource.org/pub/us/cfr/ibr/002/api.2350.2005.pdf (Enero, 2015) 7. ATTSU. (2015). Calderas de vapor. Recuperado http://www.attsu.com/pdf/2_doc1es.pdf (Enero, 2015) de 112 8. Badmus, A., Raji, A. y Akinoso, R. (2013). Effect of process parameters on work index, milling efficiency and some technological properties of yam flour using attrition mill. Food and Bioprocess Technology, 6(1), 160168. Recuperado de http://link.springer.com/article/10.1007%2Fs11947-012-0838-1#page-1 (Enero, 2015) 9. Banco Central del Ecuador. Estadística. (2014). Comercio Exterior, Información Recuperado de http://www.portal.bce.fin.ec/vto_bueno/seguridad/ComercioExteriorEst.j sp (Junio, 2014) 10. Barón, R. y Villa, A. (2014). Microwave assisted extraction of essential oil and pectin from orange peel in different stages of maturity. Revista de la Facultad de Agronomía, 31(1). 145-158. Recuperado de http://revfacagronluz.org.ve/PDF/enero_marzo2014/v31n1a201414515 8.pdf (Agosto, 2014) 11. Barrera, M. (2008). Ficha de Producto de El Salvador hacia el Mercado de la Unión Europea UE25. Recuperado de http://www.zvdesign.org/cajadeherramientas/images/stories/fichas/elsalvador/sv-limon-persa.pdf (Noviembre, 2014) 12. Bosquez, E., Domínguez, J., Perez, L., Bautista, S., Díaz de León, F. y Rivera, F. (2008). Efecto del acondicionamiento con calor en la susceptibilidad al daño por frío de lima persa (Citrus latifolia Tanaka). Revista Internacional de Botánica Experimental Phyton, 77(1), 161-174. Recuperado de http://revistaphyton.fund- romuloraggio.org.ar/vol77/BOSQUEZ_M.pdf (Junio, 2014) 13. Bueno, P. (2014). Preparar y acondicionar los equipos principales e instalaciones auxiliares de la planta química. Málaga, España: IC Editorial 113 14. Cañizares, A., Sanabría, M. y Rojas, E. (2005). Anatomía de la hoja de Lima Tahití (Citrus latifolia Tanaka). Revista UDO Agrícola, 5(1), 68-73. Recuperado de http://www.bioline.org.br/pdf?cg05009 (Noviembre 2014) 15. Cerón, I. y Cardona, C. (2011). Evaluación del proceso integral para la obtención de aceite esencial y pectina a partir de cáscara de naranja. Ingeniería y Ciencia, 7(13), 65-86. Recuperado http://www.scielo.org.co/pdf/ince/v7n13/v7n13a04.pdf de (Septiembre, 2014) 16. Chakraborty, A. y Ray, S. (2011). Development of a process for the extraction of pectin from citrus fruit wastes viz. lime peel, spent guava extract, apple pomace etc. Journal of Food Safety, 13(1), 391-397. Recuperado de http://www.internetjfs.org/articles/Development%20of%20a%20Process %20for%20the%20Extraction%20of%20Pectin%20from%20Citrus%20F ruit%20Wastes%20viz.%20Lime%20peel,%20Spent%20guava%20extr act,%20Apple%20pomace%20etc.pdf (Noviembre, 2014) 17. Chasquibol, N., Arroyo, E. y Morales, J. (2008). Extracción y caracterización de pectinas obtenidas a partir de frutos de la biodiversidad peruana. Ingeniería Industrial, 1(26), 175-199. Recuperado de http://fresno.ulima.edu.pe/sf%5Csf_bdfde.nsf/imagenes/105977FBB132 5E100525756D004EA62A/$file/09-26-chasquibol.pdf (Noviembre, 2014) 18. Cimpa. (2013). Ficha Técnica Pectina Rápida. Recuperado de http://cimpaltda.com/modulo/quimicos/pectina%20rapida%20105.pdf (Enero, 2015) 19. Codex Alimentarius Codex Stan 192. (1995). Norma general para los aditivos alimentarios. Recuperado de 114 http://www.codexalimentarius.net/gsfaonline/docs/CXS_192s.pdf (Noviembre, 2014) 20. Colquichagua, D. y Ortega, E. (2005). Procesamiento de mermeladas de frutas nativas. Lima, Perú: Punto impreso 21. Contreras, J., Voget, C., Vita, E. y Espinoza, J. (2006). Enzymatic Extraction of lemon pectin by endo- poligalacturonase from Aspergillus niger. Food Science Biotechnology, 15 (2), pp. 163-167. Recuperado de http://www.dbpia.co.kr/Journal/ArticleDetail/1602913 (Noviembre, 2014) 22. Corpei. (2009). Perfil de limones y limas. Recuperado de http://www.pucesi.edu.ec/pdf/limon.pdf (Junio, 2014) 23. CORMEX. (2015). Molino para plástico. Recuperado de http://www.molinoparaplastico.com/molino-30.php (Enero, 2015) 24. Cuesta, M. y Muñoz, R. (2010). Extracción de pectina a partir de la corteza de maracuyá amarillo (Passiflora edulis var. flavicarpa degener). Revista Politécnica, 31(1), 91-96. Recuperado de http://www.revistapolitecnica.epn.edu.ec/ojs2/index.php/revista_politecn ica2/article/viewFile/195/pdf (Marzo, 2015) 25. De la Morena, J. (2013). La carga en motores eléctricos: factor esencial para su rendimiento energético. Recuperado de file:///C:/Users/ADMINMINEDUC/Downloads/ITJkh2VQD8B9yqMi1JqbYh34BM7IvaRDk3laN3 dK4b9jngYxLzKLWC.pdf(Diciembre, 2014) 26. Edwards, W. (2007). The science of bakery products. Cambridge, Reino Unido: Royal Society Chemestry 27. Escobar, W. (2008). Factores de producción y comercialización frutícola: cítricos. En Gómez, G., Caicedo, A. y Gil, L. (Ed). Tecnología para el 115 cultivo de cítricos de en la Región Caribe Colombiana. Bogotá, Colombia: Produmedios 28. Escoda, S. (2014). Manual práctico de ventilación. Recuperado de http://es.slideshare.net/YeisonTorres/catalogo-para-seleccion-deelementos-en-ventilacion (Enero, 2015) 29. FAO. (2009). Pectins. Recuperado de http://www.fao.org/ag/agn/jecfa- additives/specs/monograph7/additive-306-m7.pdf (Junio, 2014) 30. Fernández, Y., Fidalgo, B., Zubizarreta, L., Bermúdez, J., Calvo, E., Ruisánchez, E., Juárez, E., Arenillas, A. y Menéndez, J. (2010). Procesos térmicos asistidos por microondas sobre materiales carbonosos. Boletín del Grupo Español del Carbón, 1(16), 1-7. Recuperado de http://www.gecarbon.org/Boletines/articulos/boletinGEC_016_art.1.pdf (Noviembre 2014) 31. Flores, R., Mariños, D., Rodríguez, N. y Rodríguez, D. (2014). Optimización de las condiciones de extracción de pectina a partir de cáscara de limón francés (Citrus medica) utilizando la metodología de superficie de respuesta. Agroindustrial Science, 3(2), 77-89. Recuperado de http://revistas.unitru.edu.pe/index.php/agroindscience/article/view/500/4 75 (Noviembre, 2014) 32. Fréderique, J. (2014). El limón astuto (2da. ed.). Buenos Aires, Argentina: Ateneo 33. García, J. (2010). Lista de los aditivos alimentarios permitidos actualmente en la Unión Europea y sus números E. Recuperado http://histolii.ugr.es/EuroE/NumerosE.pdf (Diciembre, 2014) de 116 34. GREENHECK. (2010). Fundamentos de ventilación. Recuperado de http://www.greenheck.com/es/pdf/fan_fundamentals_spanish.pdf (Enero, 2015) 35. Grunauer, C. (2009). Influencia del Secado sobre la Captación de Agua de Pectina extraída a partir del Citrus x Aurantifolia Swingle. (Proyecto de titulación previo a la obtención del título de Ingeniero en Alimentos no publicado). Escuela Politécnica del Litoral, Guayaquil, Ecuador. 36. Guidi, A. y Arandia, M. (2010). Obtención de pectina a partir de la cáscara de maracuyá mediante hidrólisis ácida. Journal Boliviano de Ciencias, 7(21), 67-71. Recuperado de http://www.revistasbolivianas.org.bo/pdf/jbc/v7n21/a14_v7n21.pdf (Noviembre, 2014) 37. Hernández, A., Montiel, M., Reyes, J. y Zaragoza, C. (2013). Diseño y modelado de un bioreactor tipo batch y continuo para aplicaciones de control automático. Recuperado de http://eventos.cicese.mx/amca2013/papers/0164.pdf (Enero 2015) 38. IMARCA. (2015). Lavadora de vegetales. Recuperado de http://www.imarca.com.ve/Lavadora-general-de-Alimentos.php (Enero, 2015) 39. Imeson, A. (2010). Food stabilisers, thickeners and gelling agents. Oxford, Reino Unido: John Wiley & Sons Ltd. 40. IMOA International Molybdenium Association. (2012). Directrices prácticas para la fabricación de aceros inoxidables duplex. Recuperado de http://www.worldstainless.org/Files/ISSF/non-imagefiles/PDF/Practical_Guidelines_for_the_Fabrication_of_Duplex_Stainles s_Steels_Spanish_version.pdf (Enero, 2015). 117 41. INEC. (2010). Censo Nacional Agropecuario. Recuperado de http://www.ecuadorencifras.gob.ec/censo-nacional-agropecuario/ (Enero, 2015) 42. INEC. (2013). Encuesta de Superficie y Producción Agropecuaria Continua ESPAC-2013. Recuperado de http://www.ecuadorencifras.gob.ec/estadisticas-agropecuarias-2/ (Enero, 2015) 43. Instituto Ecuatoriano de Normalización INEN 0380. (1986). Conservas vegetales. Determinación de sólidos solubles. Método refractométrico. Recuperado de http://normaspdf.inen.gob.ec/pdf/nte/380.pdf (Junio, 2014) 44. Instituto Ecuatoriano de Normalización INEN 0381. (1986). Conservas vegetales. Determinación de acidez titulable. Método potenciométrico de referencia. Recuperado de https://law.resource.org/pub/ec/ibr/ec.nte.0381.1986.pdf (Junio, 2014) 45. Instituto Ecuatoriano de Normalización INEN 0389. (1986). Conservas vegetales. Determinación de la concentración del ión hidrógeno (pH). Recuperado de https://law.resource.org/pub/ec/ibr/ec.nte.0389.1986.pdf (Junio, 2014) 46. Instituto Ecuatoriano de Normalización INEN 1750. (1994). Hortalizas y frutas frescas, Muestreo. Recuperado de https://law.resource.org/pub/ec/ibr/ec.nte.1750.1994.pdf (Junio, 2014) 47. Instituto Ecuatoriano de Normalización INEN 1757. (2008). Frutas frescas, Limón, Requisitos. Recuperado de https://law.resource.org/pub/ec/ibr/ec.nte.1757.2008.pdf (Junio, 2014) 118 48. Instituto Ecuatoriano de Normalización INEN CODEX 192. (2003). Norma general del Codex para los aditivos alimentarios. Recuperado de http://www.normalizacion.gob.ec/wpcontent/uploads/downloads/2014/ACTUALIZACION/04112014/192CODEX-UNIDO.pdf (Septiembre, 2014) 49. Jasso, J., Lozano, M., Barroso, H., Morales, D., Guillén, H., Chan, Y. y Magaña, L. (2011). Fluctuación poblacional de Diaphorina citri Kuwayama (Hemiptera: Psyllidae) en limón Persa Citrus latifolia Tan. en la etapa de desarrollo. Recuperado de http://www.senasica.gob.mx/includes/asp/download.asp?IdDocumento= 22601&IdUrl=43659 (Noviembre, 2014) 50. JERSA. (2015). Clasificadora tipo rodillos. Recuperado de http://www.logismarket.com.mx/ip/maquinaria-jersa-clasificadoras-defrutas-y-verduras-ficha-tecnica-clasificadora-tipo-rodillos-833792.pdf (Enero, 2015) 51. Jordá, M. (2011). Diccionario práctico de gastronomía y salud. Madrid., España: Ediciones Díaz de Santos 52. KAAE. (2015). Stainless steel apple slicing machine manufactured in Wuxi Kaae. Recuperado de http://wxkean.en.alibaba.com/product/1998923437213561834/Stainless_steel_Apple_slicing_machine_manufactured_in_ Wuxi_Kaae.html (Enero, 2015) 53. Kadajji, V. y Betageri, G. (2011). Water soluble polymers for pharmaceutical applications. Polymers, 3 (4), 1972-2009. doi: 10.3390/polym3041972 54. Kanmani, P., Dhivya, E, Aravind, J. y Kumaresan, K. (2014). Extraction and Analysis of Pectin from Citrus Peels: Augmenting the Yield from Citrus 119 limon Using Statistical Experimental Design. Iranica Journal of Energy & Environment, 5(3), 303-312. doi: 10.5829/idosi.ijee.2014.05.03.10 55. Kastner, H., Einhorn-Stoll, U. y Senge, B. (2012). Structure formation in sugar containing pectin gels e Influence of Ca2+ on the gelation of lowmethoxylated pectin at acidic pH. Food Hydrocolloids, 27(1), 42-49. doi: 10.1016/j.foodhyd.2011.09.001 56. Khalikov, D., Mukhiddinov, M., Asoev, M. y Degtyarev, V. (1994). Some kinetic features of the hydrolysis of protopectin. Chemistry of Natural Compounds, 30(6), 734-738. Recuperado de http://link.springer.com/article/10.1007%2FBF00630614 (Marzo, 2015) 57. Kumar, R., Nayagi, Y., Punichelvana, A. y Afandi, A. (2013). Optimized Extraction Condition and Characterization of Pectin from Kaffir Lime. Journal of Agriculture and Forestry Sciences, 1(2), 1-11. Recuperado de http://www.isca.in/AGRI_FORESTRY/Archive/v1i2/1.ISCA-RJAFS- 2013-002.pdf (Enero, 2015) 58. Leclere, L., Van, P. y Michiels, C. (2013). Anti-cancer activities of pH or heatmodificated pectin. Journal Frontiers in Pharmacology, 4(128), 1-8. doi: 10.3389/fphar.2013.00128 59. LEE INDUSTRIES. (2015). Super Jacket Trunnion Mounted. Recuperado de http://leeind.com/wp-content/uploads/2011/04/img-capacity-3.jpg (Enero, 2015) 60. Lodish, H., Berk, A., Marsudaira, P., Kaisener, C., Kriger, M., Scott, M., Zipursky, L. y Darnell J. (2005). Biología celular y molecular (5ta. ed.). Montevideo, Uruguay: Médica Panamericana S.A. 61. Lozano, W. (2011). Determinación del número mínimo de observaciones en investigación, obviando las estimaciones de la varianza de datos. 120 Revista de Didáctica Ambiental, 1(10), 54-61. Recuperado de http://www.didacticaambiental.com/revista/numero10/6.-.pdf (Marzo, 2014) 62. M&S Equipamientos. (2006). Rueda giratoria con freno. Recuperado de http://www.mysequipamientos.com.ar/contenidos/accesorios/ruedas/rue da-giratoria-con-freno.html (Enero, 2015) 63. Malo, S., Campbell, C., Balerdi, C. y Crane, J. (2012). Limón persa en Florida. Recuperado de http://edis.ifas.ufl.edu/pdffiles/HS/HS27300.pdf (Noviembre, 2014) 64. Mamani, P., Ruiz, R. y Veiga, M. (2011). Pectina:Usos Farmacéuticos Aplicaciones Terapéuticas. y Recuperado de http://www.analesranf.com/index.php/aranf/article/viewFile/1165/1338 (Agosto, 2014) 65. McCabe, W., Smith, J. y Harriott. P. (2007). Operaciones unitarias en ingeniería química (7ma. ed.). México, México: McGraw Hill 66. Megyesy E. (2008). Pressure Vessel Handbook (14va. ed.). Estados Unidos; PV Publishing Inc. 67. Mejías, M. y Aflallo, A. (2007). La salud está en su despensa: El poder curativo de los alimentos. Madrid, España: EDAF, S.L. 68. Menezes, E. y Choudhari, M. (2011). Pre-treatment of Textiles Prior to Dyeing. En Hauser, P. (Ed.). Textile Dyeing, (pp. 221-240). Rijeka, Croacia: InTech 69. Minkov, S., Minchev, A. y Paev, K. (1996). Modelling of the hydrolysis and extraction of apple pectin. Journal of Food Engineering, 29(1), 107-113. doi: 10.1016/0260-8774(95)00039-9 121 70. Mohmen, D. (2008). Pectin structure and biosynthesis. Current opinion in plant biology, 11(3), 266-277. doi: 10.1016/j.pbi.2008.03.006 71. Monsalves, C., Loyola, N. y Muñoz, J. (2009). Extracción de pectinas de vitis labrusca cv. Concord para producir jaleas. Idesia (Arica), 27(3), 9-14. Recuperado http://www.scielo.cl/pdf/idesia/v27n3/art02.pdf (Agosto, 2014) 72. Morales, A. (2011). Frutoterapia, nutrición y salud (9na. ed.). Madrid, España: EDAF 73. Muñoz, F. (2010). Extracción y caracterización de la pectina obtenida a partir del fruto de dos ecotipos de cocona (Solanum Sessiliflorum), en diferentes grados de madurez; a nivel de planta piloto. (Tesis de maestría no publicada). Universidad de Colombia, Bogotá, Colombia. 74. O’Brien, A., Philp, K. y Morris, E. (2009). Gelation of high-methoxy pectin by enzymic de-esterification in the presence of calcium ions: a preliminary evaluation. Carbohydrate research, 344(14), 1818-1823. doi: 10.1016/j.carres.2008.09.029 75. Orduz, J., León, G. y Arango, L. (2009). Lima ácida Tahití: Opción agrícola para los llanos orientales de Colombia. Recuperado de http://corpomail.corpoica.org.co/BACFILES/BACDIGITAL/56499/56499. pdf (Noviembre, 2014) 76. Orduz, J. y Mateus, D. (2012). Fisiología de la floración y fructificación en los cítricos. En Garcés, L. (Ed.). Cítricos: Cultivo, poscosecha e industrialización. Itaguí, Colombia: Artes y Letras S.A.S. 77. Ortuño, M. (2006). Manual práctico de aceites esenciales, aromas y perfumes. Madrid, España: Aiyana 122 78. OTAM. (2011). Ventilador Axiais. Recuperado de http://www.solerpalau.com.br/public/files/folders/0b513pt_avr_032_201 1_j.pdf (Enero, 2015) 79. Pinto, M. (2008). Consideraciones sobre cosecha y postcosecha en cítricos. En Gómez, G., Caicedo, A. y Gil, L. (Ed). Tecnología para el cultivo de cítricos de en la Región Caribe Colombiana. Bogotá, Colombia: Produmedios 80. Piña, G., Laborem, G., Monteverde, E., Magaña, S., Espinoza, M. y Rangel, L. (2006). Crecimiento, producción y calidad de frutos en limeros ‘persa’ sobre 11 portainjertos. Agronomía Trop, 56(3), 433-448. Recuperado de http://sian.inia.gob.ve/repositorio/revistas_ci/Agronomia%20Tropical/at5 603/pdf/pina_g.pdf (Noviembre, 2014) 81. Pons, A. I., García, O., Contreras, J. y Acevedo, I. (2009). Elaboración y evaluación de las características sensoriales de un yogurt de leche caprina con jalea Agrícola, 9(2), semifluida 442-448. de piña. Revista Científica Recuperado http://dialnet.unirioja.es/servlet/articulo?codigo=3308607 UDO de (Noviembre, 2014) 82. Rayaprolu, K. (2012). Boilers: A Practical Reference. Nueva York, Estados Unidos: CRC Press 83. RCI. (2015). Resistencia con aletas. Recuperado de http://www.resistenciasrci.es/pdf/comercial/resist_aletas.pdf (Enero, 2015) 84. Registro oficial de normas técnicas ambientales N°41. (2007). Recuperado de http://www.efficacitas.com/efficacitas_es/assets/Registro%20Oficial%20 Normas%20Tecnicas%20Ambientales.pdf (Enero 2015) 123 85. Sánchez, D., Aguilar, C., Contreras, J. y Nevárez, G. (2011).Moléculas pécticas: extracción y su potencial aplicación como empaque. Revista Tecnociencia Universidad Autónoma de Coahuila. 5 (2). 76-82. Recuperado de http://tecnociencia.uach.mx/numeros/v5n2/data/Moleculas_pecticas_ext raccion_y_su_potencial_aplicacion_como_empaque.pdf (Junio, 2014) 86. Sandoval, E. (2005). Técnicas aplicadas al estudio de la anatomía vegetal. Recuperado de http://books.google.com.ec/books?id=5aD01sQ9v3wC&printsec=frontc over&hl=es&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=fals e (Noviembre 2014) 87. Schols, H., Coenen, G. y Voragen, A. (2009). Reveling pectin´s structure. En Schols, H., Visser, R. y Voragen, A. (Ed.). Pectin and Pectinases, (pp. 19-31). Amsterdam, Holanda: Wageningen Academic Publishers 88. Seggiani, M., Puccini, M., Pierini, M., Giovando, S. y Forneris, C. (2009). Effect of different extraction and precipitation methods on yield and quality of pectin. International Journal of Food Science and Technology, 44(3), 574-580. Recuperado de http://lib.gen.in/next/MTAuMTExMS9qLjEzNjUtMjYyMS4yMDA4LjAxOD Q5Lng=/seggiani2009.pdf (Marzo, 2014) 89. Shukla, S., Jain, D., Verma, K. y Verma, S. (2011). Pectin-based colonspecific drug delivery. Chronicles of Young Scientists, 2(2), 83-89. doi: 10.4103/2229-5186.82978 90. Singh, R, y Heldman, D. (2009). Introduction to Food Engineering (4ta. ed.). Londres, Reino Unido : Academic Press 91. Sinnott, R. (2005). Coulson & Richardson’s Chemical Engineering (4ta. ed.). Oxford, Reino Unido: Elsevier 124 92. Silowash, B. (2010). Piping Systems Manual. Nueva York, Estados Unidos: McGraw Hill 93. Srivastava, P. y Malviya, R. (2011). Source of pectin, extraction and its applications in pharmaceutical industry-An overview. Indian Journal of Natural Products and Resources, 2(1), 10-18. Recuperado de http://nopr.niscair.res.in/bitstream/123456789/11534/1/IJNPR%202%28 1%29%2010-18.pdf (Noviembre, 2014) 94. Sudhakar, D. y Maini, S. (2000). Isolation and characterization of mango peel pectins. Journal of Food Processing Preservation, 24(3), 209-227. Recuperado de http://lib.gen.in/next/MTAuMTExMS9qLjE3NDUtNDU0OS4yMDAwLnRi MDA0MTQueA==/sudhakar2000.pdf (Marzo, 2014) 95. UTEPI. (2006). Lima y Limón: Estudio agroindustrial en el Ecuador. Recuperado de https://www.unido.org/fileadmin/user_media/Publications/Pub_free/Lima _y_limon_estudio_agroindustrial_en_el_Ecuador.pdf (Noviembre 2014) 96. Vasquez, R., Ruesga, L., D’addosio, R., Páez, G. y Marín, M. (2008). Extracción de pectina a partir de la cáscara de plátano (Musa AAB, subgrupo plátano) Agronomía, 25(2), clon Hartón. Revista 318-333. de la Facultad Recuperado de de http://revfacagronluz.org.ve/PDF/abril_junio2008/v25n2a088.pdf (Septiembre, 2014) 97. Velasco, J., Romero, T., Salamanca, C. y López, R. (2009). Biología. Madrid, España: Editex 98. Wang, A., Liao, Q., Feng, J., Zhang, P., Li, A. y Wang, J. (2012). Apple pectinmediated green synthesis of hollow double-caged peanut-like ZnO 125 hierarchical superstructures and photocatalytic applications. CrystEngComm, 14(1), 256-263. doi: 10.1039/c1ce05830d 99. Willats, W., Knox, J. y Mikkelsen, J. (2006). Pectin: new insights into an old polymer are starting to gel. Trends in Food Science & Technology, 17(3), 97-104. Recuperado de hub.bz/f0c4eaa664233803f2dc262d85ef9f6e/willats2006.pdf (Noviembre, 2014) http://sci- 126 ANEXOS 127 ANEXO I EXTRACTO DE LA NORMA NTE INEN 1750 (1994): HORTALIZAS Y FRUTAS FRESCAS. MUESTREO Para el análisis de las propiedades físicas y químicas del limón de estudio Citrus Latifolia Tan. se consideró el tamaño muestral definido según la sección de 4.4 de la norma NTE INEN 1750 (1994) para frutos de tamaño medio, como se distingue en la Figura AI.1. Figura AI. 1. Tamaño de muestra para análisis de frutos medianos 128 ANEXO II EXTRACTO DE LA NORMA NTE INEN 1757 (2008): FRUTAS FRESCAS. LIMÓN. REQUISITOS La determinación experimental del diámetro y peso del limón de la variedad Tahití se basó en el procedimiento señalado en la sección 8 de la norma NTE INEN 1757 (2008). Diámetro longitudinal Tomar al fruto de sus extremos en posición ecuatorial. Colocar las mordazas del calibrador en los extremos del limón sin causar alteración del pericarpio. Marcar el valor del diámetro. Peso Encender la balanza analítica marca Ae Adam. Colocar el limón sobre el platillo, de manera que este permanezca inmóvil. Registrar el valor del fruto en gramos. Además, en la sección 4 de dicha norma se define la clasificación del limón de acuerdo a sus propiedades físicas: diámetro y peso, como se distingue en la Figura AII.1 Figura AII. 1. Clasificación del limón Tahití de acuerdo a sus propiedades físicas 129 ANEXO III EXTRACTO DE LA NORMA INEN 0389 (1986): CONSERVAS VEGETALES. DETERMINACIÓN DE LA CONCENTRACIÓN DEL IÓN HIDRÓGENO (pH) La medición del pH del zumo de limón de la variedad Tahití se basó en el procedimiento de la norma NTE INEN 0389 (1986) y su adaptación al laboratorio. Procedimiento Extraer manualmente el zumo de los limones. Filtrar el zumo para eliminar las vesículas y semillas presentes. Homogenizar el líquido filtrado mediante leves movimientos del recipiente contenedor. Tomar una alícuota de zumo y colocarla en un vaso de precipitación de 50 mL. Encender el pH-metro y lavar sus electrodos con agua destilada. Sumergir los electrodos en la alícuota líquida, evitando el contacto con las paredes de vaso. Registrar el pH, una vez que este haya alcanzado un valor estable. Es imperioso que el pH-metro sea calibrado previamente con las soluciones buffer. 130 ANEXO IV EXTRACTO DE LA NORMA NTE INEN 0381 (1986): CONSERVAS VEGETALES. DETERMINACIÓN DE LA CONCENTRACIÓN DEL IÓN HIDRÓGENO (pH) Mediante la adaptación al laboratorio de la sección 6 de la norma 0381 (1986) se determinó el porcentaje de acidez del zumo de limón de la variedad Tahití. Procedimiento Filtrar y homogenizar la muestra. Tomar una alícuota de 3 mL de muestra y colocarla en un erlenmeyer. Colocar dos o tres gotas de fenoftaleína. Añadir gradualmente la solución base (NaOH 0,1 N) en el erlenmeyer y agitar de forma continua hasta observar el viraje colorimétrico. Registrar el consumo en mL de la solución base. La acidez titulable se determina mediante el tratamiento de la ecuación [AV.2]: Acidez = VNaOH x NNaOH x 𝑓NaOH x MAC g de ácido citrico = VM 1000 mL de muestra % Acidez = 𝐴 x 100 ρM Donde: A: Acidez, (g/1000 mL) VNaOH: Volumen de la solución base, (mL) NNaOH: Concentración de la solución base, (eq/L) [AV.1] [AV.2] 131 fNaOH: factor de la base MAC: Peso-equivalente del ácido cítrico, (g/meq) VM: Volumen de la muestra, (mL) ρM: densidad de la muestra, (g/L) 132 ANEXO V EXTRACTO DE LA NORMA NTE INEN 0381(1986): DETERMINACIÓN DE SÓLIDOS SOLUBLES. MÉTODO REFRACTOMÉTRICO La determinación del contenido de Brix o sólidos solubles en el zumo de limón de la variedad Tahití, se fundamentó en el procedimiento descrito en la sección 6 de la norma NTE INEN 0381(1986). Procedimiento Agitar el zumo de limón Tahití en el recipiente contenedor. Succionar mediante un gotero una alícuota de zumo. Colocar dos gotas sobre el prisma del refractómetro. Enfocar el refractómetro a la luz y registrar el valor de los grados Brix. Retirar cuidadosamente la muestra del prisma. Limpiar el equipo con agua destilada y papel libre de pelusas. 133 ANEXO VI DETERMINACIÓN DEL NÚMERO DE REPETICIONES PARA EL ANÁLISIS DE LA CINÉTICA DE EXTRACCIÓN El número de repeticiones se calculó mediante el modelo estadístico propuesto por Lozano (2011), que engloba términos como: el nivel de certeza, potencia estadística y el rendimiento esperado; cuyos valores que se presentan en la Tabla AVI.1. Tabla AVI. 1. Valores de los parámetros estadísticos para la determinación del número de repeticiones Parámetro Valor Nivel de certeza (Zα) 95% ; 1,960 Potencia estadística (Zβ) 80 % ; 0,842 Rendimiento esperado 0,700 Estadísticamente los valores habituales de certeza y potencia estadística para investigaciones son de 95% y 80% respectivamente (Lozano, 2011, p. 56). Se consideró un 70% de posibilidad de ocurrencia, con el fin de acaparar posibles errores que podrían intervenir en la extracción e impedirían el resultado positivo de pectina. Debido a ello se descartó el valor de 1; a pesar que los resultados del tratamiento previo constataron la existencia de pectina cuantificable en la corteza del limón de estudio. Dichos valores de reemplazaron en la ecuación [2.1]: n= 0,7(1 − 0,7)0,842 + 1,4 x 1,960 0,72 n = 5,9609 ≈ 6 134 Con ello se establece como necesario seis datos de la constante cinética de extracción para obtener un resultado estadísticamente confiable del valor de dicho parámetro. 135 ANEXO VII METODOLOGÍA DEL ANÁLISIS CINÉTICO DE LA EXTRACCIÓN DE PECTINA DEL LIMÓN TAHITÍ Para la definición de los parámetros cinéticos se dedujeron las ecuaciones de linealización según el orden correspondiente, a partir de la ley universal de velocidad de reacción expresada en la ecuación [AVII.1]. 𝑣= 𝑑[𝑃] 𝑑𝜃 [AVII.1] Donde: [P] : Concentración de protopectina θ : tiempo 1. Reacción de primer orden 𝑑[𝑃] = 𝑘 [𝑃] 𝑑𝜃 [AVII.2] La ecuación AVII.2 se integra y se obtiene: ln[𝑃] = ln[𝑃]𝑜 + 𝑘𝜃 ln [𝑃] = 𝑘𝜃 [𝑃]𝑜 𝑚𝑃 ln 𝑚𝑣 = 𝑘𝜃 𝑝𝑜 𝑣 [AVII.3] 136 ln 𝑚 = 𝑘𝜃 𝑚𝑜 ln 𝑚𝑃 = ln 𝑚𝑃𝑜 + 𝑘𝜃 [AVII.4] Donde: mP : Masa de protopectina v: Volumen del reactor 2. Reacción de segundo orden 𝑑[𝑃] = 𝑘 [𝑃]2 𝑑𝜃 [AVII.5] La ecuación AVII.5 se integra y se obtiene: 1 1 = − 𝑘𝜃 [𝑃] [𝑃]𝑜 [AVII.6] La linealización de segundo orden involucra el término de concentración de pectina (masa/volumen), para ello se consideró volumen constante, es decir durante toda la extracción se mantuvo el volumen inicial, es así que se determinó la densidad aparente de la corteza húmeda, siendo esta 0,8435 g/mL, lo que define el volumen que ocupan los 500 g de corteza de 592,77 mL; y por ende el volumen total ocupado en el reactor de 2092,77 mL. A partir de las ecuaciones AVII.4 y AVII.6 se realizaron los gráficos de linealización, en los cuales se distingue el factor de correlación y el valor de la pendiente como valor de la velocidad de reacción, resumidos en las Tablas 3.9 y 3.10. Para la linealización de los datos de extracción de la Tabla 3.7, de las seis repeticiones, se excluyó el primer dato experimental obtenido a los 10 min, pues 137 se considera tiempo insuficiente para la impregnación y acción del catalizador en la estructura vegetativa. 2,5000 ln (mP) 2,0000 1,5000 y = 0,0122x + 1,7969 R² = 0,8255 1,0000 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 1 Figura AVII. 1. Linealización de los datos de extracción R1, reacción de primer orden 1400,0000 1/ [P] (mL/g) 1200,0000 y = -2,4991x + 319,88 R² = 0,7411 1000,0000 800,0000 600,0000 400,0000 200,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 1 Figura AVII. 2. Linealización de los datos de extracción R1, reacción de segundo orden 138 2,5000 ln (mP) 2,0000 1,5000 1,0000 y = -0,0329x + 3,1461 R² = 0,9937 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 3 Figura AVII. 3. Linealización de los datos de extracción R3, reacción de primer orden 1400,0000 1200,0000 1/ [P] (mL/g) 1000,0000 y = 19,113x - 378,96 R² = 0,9371 800,0000 600,0000 400,0000 200,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 3 Figura AVII. 4. Linealización de los datos de extracción R3, reacción de segundo orden 139 2,5000 ln (mP) 2,0000 1,5000 y = -0,0312x + 3,0861 R² = 0,9746 1,0000 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 4 Figura AVII. 5. Linealización de los datos de extracción R4, reacción de primer orden 1400,0000 1200,0000 y = 18,582x - 369,28 R² = 0,8693 1/[P] (mL/g) 1000,0000 800,0000 600,0000 400,0000 200,0000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 4 Figura AVII. 6. Linealización de los datos de extracción R4, reacción de segundo orden 140 2,5000 2,0000 ln (mP) 1,5000 1,0000 y = -0,0329x + 3,048 R² = 0,9957 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 5 Figura AVII. 7. Linealización de los datos de extracción R5, reacción de primer orden 1400 1200 1/ [P] ((mL/g) 1000 y = 20,261x - 380,73 R² = 0,9646 800 600 400 200 0 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 5 Figura AVII. 8. Linealización de los datos de extracción R5, reacción de segundo orden 141 2,5000 ln (mP) 2,0000 1,5000 1,0000 y = -0,0335x + 3,1138 R² = 0,9996 0,5000 0,0000 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 6 Figura AVII. 9. Linealización de los datos de extracción R6, reacción de primer orden 1600 1400 1/ [P] (mL/g) 1200 y = 20,916x - 426,17 R² = 0,9287 1000 800 600 400 200 0 0 10 20 30 40 50 60 70 80 90 Tiempo (min) Repetición 6 Figura AVII. 10. Linealización de los datos de extracción R6, reacción de segundo orden 142 ANEXO VIII DETERMINACIÓN DE LA HUMEDAD CRÍTICA Y VELOCIDAD CONSTANTE A LAS CONDICIONES DE 50 °C Y 1,8 m/s DE AIRE 1,6000 1,4000 1,2000 y = 0,0009x + 1,342 R² = 1 W(kg/m^2h) 1,0000 0,8000 0,6000 0,4000 y = 0,1041x + 0,1167 R² = 0,9502 0,2000 0,0000 0,0000 5,0000 10,0000 15,0000 20,0000 25,0000 30,0000 35,0000 Xmedia (kg de agua/ kg de pectina seca) Figura AVIII. 1. Modelización de las etapas de la velocidad deshidratación de la pectina del limón Tahití a 50 ̊C y 1,8 m/s de aire Las rectas que se ajustan a las etapas de deshidratación constituyen las ecuaciones [AVIII.1] y [AVIII.2]: 𝑦1 = 0,1041 𝑥 + 0,1167 [AVIII.1] 𝑦2 = 0,0009𝑥 + 1,3420 [AVIII.2] Igualando las ecuaciones anteriores. 0,1041 𝑥 + 0,1167 = 0,0009𝑥 + 1,3420 143 𝑥 = 11,8731 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 𝑘𝑔 𝑑𝑒 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑋𝑐 = 11,8731 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 𝑘𝑔 𝑑𝑒 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 Despejando x de la ecuación [AVIII.2]. 𝑥= 𝑦2 − 1,3420 0,0009 [AVIII.3] Reemplazando [AVIII.3] en [AVIII.1] y considerando y1=y2=y. 𝑦1 = 0,1041 𝑦 = 1,3527 𝑦2 − 1,3420 + 0,1167 0,0009 𝐾𝑔 𝑎𝑔𝑢𝑎 ℎ 𝑚2 𝑊𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 = 1,3527 𝐾𝑔 𝑎𝑔𝑢𝑎 ℎ 𝑚2 144 ANEXO IX NORMAS AOAC: HUMEDAD Y CENIZAS La metodología aplicada para la determinación de los parámetros de humedad y cenizas de la pectina se fundamentó en las normas AOAC 925.10, 942.05 y 920.46. NORMA AOAC 925.10: HUMEDAD Colocar el crisol y la tapa en la estufa a 130 ± 3 °C durante un periodo de 60 min. Trasportar el crisol cubierto al desecador y mantenerlo en el interior hasta alcanzar la temperatura ambiente. Registrar el peso del crisol y la tapa. Colocar aproximadamente 2 g de pectina en el crisol. Ingresar el crisol descubierto con la muestra y la tapa a la estufa de secado, previamente calentada a 130 ± 3 °C por 60 min. Cubrir el crisol en el interior de la estufa, trasportarlo al desecador, descubrirlo y dejar que alcance la temperatura ambiente. Registrar el nuevo peso del crisol y la muestra. Para la determinación del contenido de cenizas insolubles en ácido se realizó el procedimiento descrito por las normas AOAC 942.05 y 920.46. NORMA AOAC 942.05: CENIZAS Colocar una cantidad de 2 g de pectina al crisol, previamente secado y tarado. Introducir el crisol con el contenido en la mufla a 600 °C. Mantener el crisol en calentamiento durante un tiempo de 2 h. 145 Transferir directamente el crisol al desecador, enfriarlo y pesarlo. NORMA AOAC 920.46: CENIZAS INSOLUBLES EN ÁCIDO A la ceniza obtenida del ensayo bajo la norma 942.05. adicionar ácido clorhídrico 2,5 N. Cubrir el crisol y calentarlo en un baño de agua durante un rango de 5 min. Filtrar la solución resultante a través de un filtro libre de cenizas. Lavar los residuos con agua caliente. Retornar los residuos del papel filtro al crisol y calcinar la ceniza. Calentar nuevamente con ácido, filtrar, lavar e incinerar los residuos. Pesar las cenizas insolubles en ácido y registrar su valor. Expresar el resultado en relación al contenido de pectina libre de humedad. 146 ANEXO X MÉTODO DE VALORACIÓN ÁCIDO - BASE PARA ANÁLISIS DE LAS PECTINAS La determinación de las propiedades estructurales de la pectina se realizó en función del método de Owens, el cual se describe en la Figura AXI.1 (Kanmani et al., 2014, p. 305). Solución 1: 5 g Pectina + 1 g Cloruro sódico + 100 ml agua destilada + rojo fenol Titulación con sosa cáustica 0,1 N a la solución 1 Solución 2: Solución 1 titulada + 25 ml (0,25 N NaOH )+ 30 min Solución 3: Solución 2 + + 25 ml (0,25 N HCl) + rojo fenol Titulación de solución 3 con 0,1 N NaOH Figura AX. 1. Metodología de caracterización de la pectina del limón de la variedad Tahití 147 ANEXO XI REGISTRO DE LAS CARACTERÍSTICAS Y PROPIEDADES ESTRUCTURALES DE LA PECTINA DEL LIMÓN TAHITÍ Tabla AXI. 1. Registro de los datos de humedad Muestra Pectina inicial (g) Pectina final (g) Humedad (%) 1 2,2950 2,1646 5,6819 3 15,000 14,2099 5,2667 4 2,0801 1,9450 6,4949 5 3,5831 3,3817 5,6208 6 2,1633 2,0285 6,2312 PROMEDIO 5,86 ± 0,44 *Muestra 2 se evaluó a las condiciones de secado de 1,4 m/s y 50 ̊ C; condiciones diferentes a las óptimas por lo que se descartó de la presente tabla Tabla AXI. 2. Registro de los datos de cenizas Muestra Pectina (g) Cenizas (g) Pectina sin humedad (g) Cenizas (%) 1 3,1120 0,0407 2,9352 1,3866 3 2,5640 0,0263 2,4290 1,0828 4 2,3177 0,0252 2,1672 1,1628 5 2,6506 0,347 2,5016 1,3871 6 2,5744 0,0248 2,4140 1,0273 PROMEDIO 1,21 ± 0,15 148 Tabla AXI. 3. Peso de las muestras libre de humedad y cenizas Muestra Muestra pectina (g) Contenido de agua (g) 1 0,6260 3 Contenido de cenizas (g) Pectina libre de humedad y cenizas (g) 0,0356 0,0005 0,5899 0,5750 0,0303 0,0003 0,5444 4 0,5679 0,0369 0,0004 0,5306 5 0,5457 0,0307 0,0004 0,5146 6 0,6059 0,0378 0,0004 0,5678 Tabla AXI. 4. Consumo de NaOH para la determinación de las propiedades estructurales 1 Titulación solución 1 (mL NaOH) 2,2 Titulación solución 3 (mL NaOH) 5,5 3 2,0 6,8 4 1,9 4,4 5 2,5 8,2 6 2,8 6,4 Muestra Tabla AXI. 5. Reporte de peso equivalente, metóxilos, ácido galacturónico y ET Peso equivalente (g/eq) Metoxilos (%) Ácido galacturonico (%) ET (%) 1 2681,3636 2,89 22,97 71,43 3 2722,0000 3,87 28,45 77,27 4 2792,6316 2,57 20,90 69,84 5 2058,4000 4,94 36,60 76,64 6 2027,8571 3,49 28,52 69,57 Promedio 2456,4505 ± 339,4869 3,55 ± 0,83 27,49 ± 5,45 72,85 ± 3,20 Muestra 149 ANEXO XII DETERMINACIÓN DE LA PRODUCCIÓN A ESCALA PILOTO Y SÍNTESIS DE CÁLCULOS PARA EL DISEÑO DEL REACTOR PARA LA HIDRÓLISIS Para el diseño de los equipos: reactor de hidrólisis y el secador de la pectina gel, inicialmente se definió la producción diaria, según los datos de la sección 1.2.8. 𝑃𝑟𝑜𝑑𝑢𝑐𝑐𝑖ó𝑛 𝑎𝑛𝑢𝑎𝑙 = 194,18 𝑡 𝑡 = 48,55 4 𝑎ñ𝑜 𝑃𝑟𝑜𝑑𝑢𝑐𝑐𝑖ó𝑛 𝑚𝑒𝑛𝑠𝑢𝑎𝑙 = 48,55 𝑃𝑟𝑜𝑑𝑢𝑐𝑐𝑖ó𝑛 𝑑𝑖𝑎𝑟𝑖𝑎 = 4,05 𝑡 1 𝑎ñ𝑜 𝑡 𝑥 = 4,05 𝑎ñ𝑜 12 𝑚𝑒𝑠𝑒𝑠 𝑚𝑒𝑠 𝑡 1 𝑚𝑒𝑠 𝑡 𝑘𝑔 𝑥 = 0.20 = 202,27 𝑚𝑒𝑠 20 𝑑í𝑎𝑠 𝑑í𝑎 𝑑í𝑎 La producción a escala piloto se consideró el 5 % de las importaciones. 𝑃𝑟𝑜𝑑𝑢𝑐𝑐𝑖ó𝑛 𝑑𝑖𝑎𝑟𝑖𝑎 𝑎 𝑒𝑠𝑐𝑎𝑙𝑎 𝑝𝑖𝑙𝑜𝑡𝑜 = 5% 𝑥 202,27 𝑃𝑟𝑜𝑑𝑢𝑐𝑐𝑖ó𝑛 𝑑𝑖𝑎𝑟𝑖𝑎 𝑎 𝑒𝑠𝑐𝑎𝑙𝑎 𝑝𝑖𝑙𝑜𝑡𝑜 = = 10,11 𝑘𝑔 𝑑𝑖𝑎 𝑘𝑔 𝑑í𝑎 ≈ 10 𝑘𝑔 𝑑𝑒 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠ó𝑙𝑖𝑑𝑎 𝑑í𝑎 REACTOR PARA LA HIDRÓLISIS Volumen Reactor Batch Para la definición de su volumen se realizó el correspondiente balance de masa de la protopectina (reactante) [AVIII.1], según el orden de la reacción previamente determinado. 150 [ 𝐸𝑛𝑡𝑟𝑎 𝐷𝑒𝑠𝑎𝑝𝑎𝑟𝑖𝑐𝑖ó𝑛 𝑆𝑎𝑙𝑒 𝐴𝑐𝑢𝑚𝑢𝑙𝑎𝑐𝑖ó𝑛 ]−[ ]−[ ]=[ ] 𝑑𝑒 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑑𝑒 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑑𝑒 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑑𝑒 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝐷𝑒𝑠𝑎𝑝𝑎𝑟𝑎𝑐𝑖ó𝑛 𝐴𝑐𝑢𝑚𝑢𝑙𝑎𝑐𝑖ó𝑛 −[ ]=[ ] 𝑑𝑒 𝑙𝑎 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑑𝑒 𝑙𝑎 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 [AXIII.1] [AXIII.2] [ 𝐷𝑒𝑠𝑎𝑝𝑎𝑟𝑎𝑐𝑖ó𝑛 ] = 𝑟𝑃 𝑉 𝑑𝑒 𝑙𝑎 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 [AXIII.3] [ 𝑑 𝑁𝑃 𝑑 𝑋𝑃 𝐴𝑐𝑢𝑚𝑢𝑙𝑎𝑐𝑖ó𝑛 = − 𝑁𝑃𝑜 ]= 𝑑𝑒 𝑙𝑎 𝑝𝑟𝑜𝑡𝑜𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑑𝑡 𝑑𝑡 [AXIII.4] −𝑟𝑃 𝑉 = 𝑁𝑃𝑜 𝑑 𝑋𝑃 𝑑𝑡 𝑋𝑃 [AXIII.5] 𝑑 𝑋𝑃 −𝑟𝑃 [AXIII.6] 𝑑 𝑋𝑃 𝑘 𝐶𝑃 [AXIII.7] 𝑉𝑥𝑡= 𝑋𝑃 𝑁𝑃𝑜 𝑑 𝑋𝑃 ∫ 𝑘 𝑥 𝐶𝑃𝑜 0 (1 − 𝑋𝑃 ) [AXIII.8] 𝑉𝑥𝑡= 𝑁𝑃𝑜 1 𝑥 ln ( ) 𝑘 𝑥 𝐶𝑃𝑜 1 − 𝑋𝑃 [AXIII.9] 𝑁𝑃𝑜 1 𝑥 ln ( ) 𝑡 𝑥 𝑘 𝑥 𝐶𝑃𝑜 1 − 𝑋𝑃 [AXIII.10] 𝑉𝑥 𝑡 = 𝑁𝑃𝑜 ∫ 0 𝑋𝑃 𝑉 𝑥 𝑡 = 𝑁𝑃𝑜 ∫ 0 𝑉= Donde: NPo: contenido inicial de protopectina, (kg) CPo: concentración inicial de la protopectina, (kg/L) k: constante de la velocidad de reacción, (min-1) V: volumen del reactor ocupado, (L) Xp: conversión de la protopectina 151 t: tiempo, min 𝑉= 11,11 𝑘𝑔 1 𝑥 ln ( ) 𝑘𝑔 1 − 0,9 80 min 𝑥 0,0286 𝑚𝑖𝑛−1 𝑥(0,008 𝐿 ) 𝑉 = 1397,60 𝐿 = 1,40 𝑚3 Además es imprescindible considerar los parámetros de la Tabla 3.4 definidos como las condiciones óptimas de la reacción, por lo que según la relación entre la materia prima y el disolvente también se definió el volumen de carga en el reactor. Según el valor medio del rendimiento de la corteza en base seca del limón Tahití reportado en la Figura 3.9, se define la cantidad de materia prima utilizar: 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑠𝑒𝑐𝑎 = 10 𝑘𝑔 𝑑𝑒 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑥 100 𝑘𝑔 𝑑𝑒 𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑠𝑒𝑐𝑎 = 69,01 𝑘𝑔 14,49 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 Considerando la humedad de la corteza fresca del 80% se requiere: 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 = 69,01 𝑘𝑔 = 345, 05 𝑘𝑔 0,2 Volumen del medio: [AVIII.11] 𝑉𝑚𝑒𝑑𝑖𝑜 á𝑐𝑖𝑑𝑜 = 3 𝑥 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 𝑉𝑚𝑒𝑑𝑖𝑜 á𝑐𝑖𝑑𝑜 = 3 𝑥 345, 05 = 1035,15 𝐿 Para alcanzar un pH de 1,5 es necesario: 𝑉𝐻𝐶𝐿 37% = 1035,15 𝐿 𝑚𝑒𝑑𝑖𝑜 á𝑐𝑖𝑑𝑜 𝑥 0,008 𝐿𝐻𝐶𝑙 37% = 8,28 𝐿𝐻𝐶𝑙 37% 1 𝐿 𝑚𝑒𝑑𝑖𝑜 á𝑐𝑖𝑑𝑜 152 𝑉𝐴𝑔𝑢𝑎 = 1 035,15 𝐿 𝑚𝑒𝑑𝑖𝑜 á𝑐𝑖𝑑𝑜 − 8,28 𝐿𝐻𝐶𝑙 37% = 1 026,87 𝐿 𝑑𝑒 𝑎𝑔𝑢𝑎 Con ello se define un volumen total de carga al reactor de: 𝑉𝑐𝑎𝑟𝑔𝑎 = 1 035,15 𝐿 + 345, 05 𝑘𝑔 𝑥 1𝐿 = 1 444,22 𝐿 = 1,44 𝑚3 0,8435 kg El volumen determinado mediante el balance de masa en el reactor y según la relación corteza/solución son similares, sin embargo para el diseño se consideró el volumen de 1,44 m3, definido mediante datos experimentales. Se establece la operación de dos reactores en configuración paralelo, con un volumen de carga por reactor de 722,11 L. 𝑉𝑐𝑎𝑟𝑔𝑎 𝑝𝑜𝑟 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 = 1 444,22 𝐿 = 722,11 𝐿 = 0,72 𝑚3 𝑝𝑜𝑟 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 2 La composición de la carga por cada reactor es de: 𝑚𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 = 172,53 𝑘𝑔 𝑉𝐻𝐶𝐿 37% = 4,14 𝐿 𝑉𝐴𝑔𝑢𝑎 = 513,44 𝐿 De acuerdo a lo estipulado en el Apéndice B de la norma API 2350, para el volumen nominal de tanques se sugiere el de 1,2 del volumen de llenado (API 2350, 2005, p. 18). 𝑉𝑛𝑜𝑚𝑖𝑛𝑎𝑙 𝑑𝑒𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 = 1,2 𝑥 𝑉𝑐𝑎𝑟𝑔𝑎 [AVII.12] 𝑉𝑛𝑜𝑚𝑖𝑛𝑎𝑙 𝑑𝑒𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 = 1,2 𝑥 722,11 𝐿 = 866,53 𝐿 = 0,87 𝑚3 La proporción entre las dimensiones típicas de tanques de producción señaladas por Ahmed y Rahman (2012), oscilan entre 1,0 y 2,0 (p. 850); la relación de diseño del reactor cilíndrico deberá encontrarse dentro de dicho rango. 153 Es importante que la base y la cabeza del reactor presenten una estructura curva a fin de evitar aristas sin tráfico de flujo, así como la acumulación de residuos (McCabe et al., 2007, p. 260); por ello se seleccionó su tipo de entre tres clases, las cuales se muestran en la Tabla AXII.1. Tabla AXII. 1. Clases de cabezas para tanques cilíndricos Tipo Descripción Representación Esfera y cabeza 1 hemisférica 2 Cabeza elipsoidal 2:1 Cabeza ASME bridada y 3 alabeada (Megyesy, 2008, pp. 18-20) Se seleccionó para el diseño el tipo 3 para las tapa y el fondo, ya que su costo es menor respecto a las otras clases, su presión máxima de trabajo es de 15 bar y se las diseña para equipos de con un radio entre 15 cm a 300 cm, convirtiéndose en la de mayor demanda; se descartó la número 2 por ser de elevado costo y la 1 pues esta es preferible para tanques horizontales (Sinnott, 2005, p. 817; Bueno, 2014, p. 73). 154 Para el cálculo de las dimensiones del reactor se siguió el siguiente procedimiento: 𝑉𝑛𝑜𝑚𝑖𝑛𝑎𝑙 𝑑𝑒𝑙 𝑟𝑒𝑎𝑐𝑡𝑜𝑟 = 𝑉𝑓𝑜𝑛𝑑𝑜 + 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑜 [AXII.13] 𝐻 = 1,5 𝐷 [AXII.14] 𝐻 = 1,5 𝑥 (2 𝑟) = 3 𝑟 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑜 = 𝜋 𝑥 𝑟 2 𝑥 𝐻 [AXII.15] 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑜 = 𝜋 𝑥 𝑟 2 𝑥 3 𝑟 = 3𝜋 𝑥 𝑟 3 [AXII.16] Se consideró que el volumen del cilindro representa el volumen de carga sin el factor de seguridad. 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑜 = 0,72 𝑚3 0,72 𝑚3 = 3𝜋 𝑥 𝑟 3 𝑟 = 0,42 𝑚 𝐷 = 2 𝑥 0,42 𝑚 = 0,84 𝑚 𝑥 39,37 𝑖𝑛 = 33,07 𝑖𝑛 1𝑚 Con el valor del diámetro calculado se procedió a seleccionar el diámetro existente para cabezas torriesféricas, además de su volumen; como se muestra en la Figura AXII.1. 155 Figura AXII. 1. Volumen de cabezas torriesféricas (Megyesy, 2008, p. 403) Se seleccionó el diámetro aproximado al calculado que corresponde a 34 in (0,86 m), que comprende un volumen de cabeza de 1,88 pies3. 𝑉𝑓𝑜𝑛𝑑𝑜 = 1,88 𝑝𝑖𝑒𝑠 3 𝑥 (0,3048 𝑚)3 = 0,05 𝑚3 1 𝑝𝑖𝑒𝑠 3 Sin embargo como el volumen del fondo es menor al de seguridad, se determinó nuevamente el volumen del cilindro, mediante la diferencia del volumen nominal y el volumen del fondo antes determinado. 𝑉𝑐𝑖𝑙𝑖𝑛𝑑𝑟𝑜 = 0,87 𝑚3 − 0,05 𝑚3 = 0,82 𝑚3 Con dicho valor de volumen del cilindro se calculó nuevamente la altura. 2 0,86 0,82 𝑚 = 𝜋 𝑥 ( 𝑚) 𝑥 𝐻 2 3 𝐻 = 1,41 𝑚 156 La proporción entre las dimensiones del tanque es de: 𝐻 1,41 = = 1,6 𝐷 0,86 Con una relación de 1,6 se definieron como adecuadas las dimensiones de 1,41 m de altura y 0,86 m de diámetro interno para el reactor. Presión de diseño Presión hidrostática El contenido de la mezcla heterogénea en el reactor ejerce una presión hidrostática sobre las paredes, por lo que se requiere determinar su valor y considerarla dentro del término de la presión de diseño. [AXII.17] 𝑃ℎ𝑖𝑑𝑟𝑜𝑠𝑡á𝑡𝑖𝑐𝑎 = 𝜌𝑚 𝑥 𝑔 𝑥 𝐻 Densidad de la solución ácida: 𝑔 𝑔 8 𝑚𝐿𝐻𝐶𝑙 37% 𝑥 1,19 𝑚𝐿 + 992 𝑚𝐿 𝐻2 𝑂 𝑥 0,999 𝑚𝐿 𝑔 𝜌𝑠 = = 1000,53 1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝐿 𝜌𝑠 = 1000,53 𝑘𝑔 𝑚3 Densidad de la suspensión (corteza-agua acidulada): 𝜌𝑚 = 517,58 𝐿𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 𝑥 1 000,53 𝜌𝑚 = 956,07 𝑘𝑔 𝑚3 𝑘𝑔 1 𝑚3 𝑥 + 172,53 𝑘𝑔𝑐𝑜𝑟𝑡𝑒𝑧𝑎 𝑓𝑟𝑒𝑠𝑐𝑎 𝑚3 103 𝐿 722,11 𝐿 157 𝑃ℎ𝑖𝑑𝑟𝑜𝑠𝑡á𝑡𝑖𝑐𝑎 = 956,07 𝑘𝑔 𝑚 𝑥 9,8 𝑥 1,41 𝑚 = 13 210,98 𝑃𝑎 𝑚3 𝑠2 𝑃ℎ𝑖𝑑𝑟𝑜𝑠𝑡á𝑡𝑖𝑐𝑎 = 13 210,98 𝑃𝑎 = 13,21 𝑘𝑃𝑎 Presión de vapor de la solución ácida a 75 ̊C La presión de vapor de la solución se determinó como la presión de vapor del agua a 75 ̊C, debido a que la solución se encuentra muy diluida como se distingue con las fracciones molares. 𝑔 1 000 𝑚𝐿 4,14 𝐿 𝑥 1,19 𝑚𝐿 𝑥 1𝐿 𝑛𝐻𝐶𝑙 37% = = 134,98 𝑚𝑜𝑙 𝑔 36,5 𝑚𝑜𝑙 𝑔 1 000 𝑚𝐿 513,44 𝐿 𝑥 0,999 𝑚𝐿 𝑥 1𝐿 𝑛𝐴𝑔𝑢𝑎 = = 28 495,92 𝑚𝑜𝑙 𝑔 18 𝑚𝑜𝑙 𝑋𝐻𝐶𝑙 37% = 𝑛 134,98 𝑚𝑜𝑙 = = 0,0047 𝑛𝐻𝐶𝑙 37% + 𝑛𝐴𝑔𝑢𝑎 134,98 𝑚𝑜𝑙 + 28 495,92 𝑚𝑜𝑙 𝑋𝐴𝑔𝑢𝑎 = 1 − 0,0047 = 0,9953 La presión de vapor del agua se determinó a la temperatura de 75 ̊C, siendo esta de 289,49 mmHg. 𝑃𝑣𝑠 = 𝑃𝑣𝐻2𝑂 = 289,49 𝑚𝑚𝐻𝑔 𝑥 1 𝑎𝑡𝑚 1,0134 𝑥 105 𝑃𝑎 𝑥 = 38 601,21 𝑃𝑎 760 𝑚𝑚𝐻𝑔 1 𝑎𝑡𝑚 𝑃𝑣𝑠 = = 38,60 𝑘𝑃𝑎 La presión total en el interior del tanque corresponde a la suma de la presión hidrostática más la presión de vapor. 158 𝑃𝑇 = 𝑃ℎ + 𝑃𝑣𝑠 [AXIII.18] 𝑃𝑇 = 13,21 𝑘𝑃𝑎 + 38,60 𝑘𝑃𝑎 = 51,81 𝑘𝑃𝑎 Megyesy (2008), menciona que la presión para diseñar el reactor debe ser el mayor valor entre la presión de trabajo multiplicada por un factor del 1,10 y 30 psi (p. 15), a partir de lo cual se aceptaron los 30 psi ya que el valor obtenido de la sumatoria de las presiones internas es menor al estipulado. Espesor del fondo y tapa Tanto el espesor del fondo, tapa y cuerpo del reactor deben presentar correspondencia, por lo que se definió el espesor del fondo como el espesor de todo el equipo, mediante la siguiente correlación [AVII.19] (Megyesy, 2008, p. 20) según el tipo de fondo seleccionado: 𝑡= 0,885 𝑥 𝑃 𝑥 𝐷 𝑆 𝑥 𝐸 − 0,1 𝑃 [AXII.19] Donde: t: Espesor, (in) P: Presión de diseño, (psi) S: Esfuerzo del material, (psi) E: Eficiencia de la soldadura D: Diámetro interno del reactor, (in) Se consideró la soldadura a tope por doble cordón, con una eficiencia del 0,7 (Megyesy, 2008, p. 142). El esfuerzo máximo del acero inoxidable es de 11 000 psi, a una temperatura mayor a la de trabajo (> 75 ̊C) de 400 ̊F (Megyesy, 2008, p. 160). 𝑡= 0,885 𝑥 30 𝑝𝑠𝑖 𝑥 34 𝑖𝑛 = 0,12 𝑖𝑛 = 2,98 𝑚𝑚 ≈ 3 𝑚𝑚 11 000 𝑝𝑠𝑖 𝑥 0,7 − 0,1 𝑥 30 𝑝𝑠𝑖 159 Se debe considerar por lo menos una duración del equipo de 8 a 10 años, por tal razón se le añade su ipy, es decir su consumo por año debido a la corrosión, para cual se seleccionó la velocidad a condiciones extremas, de 1,5 mm/y, como se muestra en la Figura AXIII.2. Figura AXII. 2. Velocidad de pérdida por corrosión (Sinnott, 2005, p. 817) 𝑖𝑝𝑦 = 1,5 𝑚𝑚 𝑥 10 𝑎ñ𝑜𝑠 = 15 𝑚𝑚 𝑎ñ𝑜 𝐸𝑠𝑝𝑒𝑠𝑜𝑟 𝑡𝑜𝑡𝑎𝑙 𝑑𝑒𝑙 𝑒𝑞𝑢𝑖𝑝𝑜 = 3 𝑚𝑚 + 15 𝑚𝑚 = 18 𝑚𝑚 = 0.71 𝑖𝑛 Considerando el valor del espesor calculado y el diámetro del equipo de 0,71 in y 34 in respectivamente, se seleccionó la cabeza estándar comercializada por Steel Company (Megyesy, 2008, pp. 324-326), cuyas características dimensionales se presentan en la Tabla AXII.2. Tabla AXII. 2. Dimensiones de la cabeza estándar para un diámetro de 34 in Componentes Cantidad Diámetro (in) 34,00 Espesor (in) ¾ Radio de curvatura (in) 2,250 Profundidad (in) 6,063 (Megyesy E., 2008, pp. 324-326) De esta manera se define el espesor del equipo de ¾ in. 160 Agitador La carga en el reactor debe mantenerse en constante agitación durante los 80 min, por lo que se diseñará un agitador de paletas, que proporcionará un flujo radial y tangencial. El impulsor se diseñó considerando las relaciones geométricas establecidas por McCabe et al. (2007) y Singh y Heldman (2009), definidas en relación al diámetro del reactor y la altura de llenado de la alimentación, como se distingue en las Figura AXII.3. Figura AXII. 3. Relaciones entre las dimensiones del reactor y agitador (McCabe et al., 2007, p. 262; Singh y Heldman, 2009, p. 711) Donde: C: Altura del agitador respecto al punto base del cuerpo cilíndrico, (m) D: Diámetro interno del reactor, (m) H: Altura de llenado del reactor, (m) Da: Diámetro del impulsor, (m) Para la aplicación de las proporciones de la Figura AXII.3, se determinó la altura de llenado; es decir, aquella que ocupa el agua acidulada y corteza del limón Tahití. 𝑉𝑐𝑎𝑟𝑔𝑎 = 0,72 𝑚3 − 0,05 𝑚3 = 0,67 𝑚3 161 2 0,86 0,67 𝑚 = 𝜋 𝑥 ( 𝑚) 𝑥 𝐻𝐶 2 3 𝐻𝑐𝑎𝑟𝑔𝑎 = 1,15 𝑚 Aplicando las correlaciones de la Figura AXIII.3. 1,15 𝑚 = 0,38 𝑚 = 38,33 𝑐𝑚 3 0, 86 𝑚 𝐷𝑎 = = 0,29 𝑚 = 28,67 𝑐𝑚 3 𝐶= Además para definir el ancho y longitud de las paletas existen correlaciones según el diámetro del reactor, como se distinguen en la Figura AXII.4. Figura AXII. 4. Relaciones de las dimensiones del agitador (McCabe et al., 2007, p. 262; Singh y Heldman, 2009, p. 711) Aplicando las correlaciones de la Figura AXII.4. 2 (38,33 𝑐𝑚) = 25,55 𝑐𝑚 3 38,33 𝑐𝑚 𝐿= = 9,58 𝑐𝑚 4 38,33 𝑐𝑚 𝑊= = 7,67 𝑐𝑚 5 𝑑= 162 Potencia del impulsor Su cálculo se basó en la relación definida por (McCabe et al., 2007, p. 277), descrita en la ecuación [AXII.20]. Se determinó el Reynolds, con 250 rpm, valor considerado de acuerdo al rango de operación de este tipo de agitador industrial de entre 30 a 500 rpm (Ahmed y Rahman, 2012, p. 841). 𝐷𝑎 2 𝑛 𝜌𝑚 𝑅𝑒 = 𝜇𝑚 [AXII.20] 𝑘𝑔 𝑟𝑒𝑣 1 𝑚𝑖𝑛 (0,29 𝑚)2 𝑥 250 𝑚𝑖𝑛 𝑥 60 𝑠 𝑥 956,07 3 𝑚 𝑅𝑒 = = 3602,39 ≈ 3 𝑥 103 1𝑝 0,1 𝑃𝑎 𝑠 93 𝑐𝑝 𝑥 100 𝑐𝑝 𝑥 1 𝑝 Según la correspondencia en la curva de la turbina de disco con el Re obtenido se determinó un Np de 5,5. Figura AXII. 5. Comportamiento del número de potencia. (McCabe et al., 2007, p. 275) 163 𝑃 = 𝑁𝑝 𝑛3 𝐷𝑎 5 𝜌𝑚 [AXII.18] Donde: P: Potencia, (kW) Np: Número de potencia N: Velocidad de agitación, (rev/s) Da: Diámetro del agitador, (m) ρm: Densidad de la suspensión, (kg/m3) 250 3 28,67 5 𝑃 = 5,5 𝑥 ( ) 𝑥 ( ) 𝑥 956,07 = 736,81𝑊 = 0,74 𝑘𝑊 60 100 𝑃 = 0,74 𝑘𝑊 𝑥 1 𝐻𝑃 = 0,99 𝐻𝑃 ≈ 1 𝐻𝑃 0,746 𝑘𝑊 Para el motor del agitador se diseña la potencia con un factor del 15% superior (De la Morena, 2013, p. 62). 𝑃 = 1,15 𝑥 1 𝐻𝑃 = 1,15 𝐻𝑃 ≈ 1,20 𝐻𝑃 164 ANEXO XIII SÍNTESIS DE CÁLCULOS PARA EL DISEÑO SECADOR DE PECTINA A ESCALA PILOTO Cantidad de pectina gel a secar Considerando los datos de humedad de la Tabla 3.13 se determinó la masa de pectina a alimentar al secador para la producción a escala piloto. Se consideró que el producto alcanza una humedad del 10 % en base húmeda. 𝐻𝑓 = 10 % 𝑋𝑓 = 0,10 𝑘𝑔 𝑎𝑔𝑢𝑎 = 0,1111 1 − 0,10 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑋𝑜 = 30,8086 𝑘𝑔 𝑎𝑔𝑢𝑎 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 Mediante la aplicación de la ecuación [AXIII.1] se determinó el peso de la pectina seca de la producción a escala piloto. 𝑋= (𝑃𝑒𝑠𝑜 𝑑𝑒 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑓𝑖𝑛𝑎𝑙 − 𝑃𝑒𝑠𝑜 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎) 𝑃𝑒𝑠𝑜 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 0,1111 [AXIII.1] 10 𝑘𝑔 − 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑘𝑔 𝑎𝑔𝑢𝑎 = 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 = 9,00 𝑘𝑔 La alimentación con una humedad de 30,8086 kg de agua/ kg de pectina seca corresponde a: 165 𝑃𝑔𝑒𝑙 − 9,00𝑘𝑔 𝑘𝑔 𝑎𝑔𝑢𝑎 = 30,8086 9,00 𝑘𝑔 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑃𝑔𝑒𝑙 = 286,28 𝑘𝑔 Tiempo de deshidratación de la alimentación hasta la humedad de diseño Considerando el comportamiento del equipo de laboratorio similar al de escala piloto, se definió el tiempo de deshidratación hasta el 10%, para lo cual se aplicaron las integrales de la ecuación [AXIII.2] según la etapa de secado: ante y postcrítica. 𝑆 𝑋𝑖 𝑑𝑋 𝜃= ∫ 𝐴 𝑋𝑓 𝑊 𝜃𝑎𝑛 = 𝜃𝑎𝑛 [AXIII.2] Periodo antecrítico 𝑆 𝑋𝑜 − 𝑋𝑐 𝐴 𝑊𝑐 [AXIII.3] 𝑘𝑔 𝑎𝑔𝑢𝑎 0,01421 𝑘𝑔 𝑠ó𝑙𝑖𝑑𝑜 𝑠𝑒𝑐𝑜 (30,8086 − 11,8731 ) 𝑘𝑔 𝑠ó𝑙𝑖𝑑𝑜 𝑠𝑒𝑐𝑜 = 𝑘𝑔 𝑎𝑔𝑢𝑎 0.0456 𝑚2 1,3527 ℎ 𝑚2 𝜃𝑎𝑛 = 4.36 ℎ Periodo poscrítico En dicha etapa se consideró la ecuación de linealización [3.6]. 𝜃𝑝𝑠 𝑋𝑐 𝑆 𝑑𝑋 = ∫ 𝐴 𝑋𝑓 0,1041 𝑋 + 0,1167 [AXIII.4] 166 𝜃𝑝𝑠 = 𝜃𝑝𝑠 𝑆 𝑋𝑐 + 1,12104 𝑥 9,60615 𝑥 ln( ) 𝐴 𝑋𝑓 + 1,12104 𝑘𝑔 𝑎𝑔𝑢𝑎 11,8731 + 1,12104 0,01421 𝑘𝑔 𝑠ó𝑙𝑖𝑑𝑜 𝑠𝑒𝑐𝑜 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 = 𝑥 9 ,60615 𝑥 ln ( ) 𝑘𝑔 𝑎𝑔𝑢𝑎 0.0456 𝑚2 0,1111 + 1,12104 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝜃𝑝𝑠 = 7,05 ℎ El tiempo total de secado hasta alcanzar 10 % de humedad es de: 𝜃 = 4,36 ℎ + 7,05 ℎ = 11,41 ℎ Cantidad de agua a retirar [AXII.5] 𝐿 = 𝑆 (𝑋𝑖 − 𝑋𝑓 ) 𝐿 = 9 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 (30,8086 𝑘𝑔 𝑎𝑔𝑢𝑎 𝑘𝑔 𝑎𝑔𝑢𝑎 − 0,1111 ) 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝐿 = 276,28 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 Área requerida El área requerida para el secado se determinó mediante la sumatoria de las expresiones [AXIII.3] y [AXIII.4]. 𝜃= 𝑆 𝑋𝑜 − 𝑋𝑐 𝑋𝑐 + 1,12104 [ + 9,60615 𝑥 ln ( )] 𝐴 𝑊𝑐 𝑋𝑓 + 1,12104 [AXIII.6] 𝐴 = 𝑆 𝑋𝑜 − 𝑋𝑐 𝑋𝑐 + 1,12104 [ + 9,60615 𝑥 ln ( )] 𝜃 𝑊𝑐 𝑋𝑓 + 1,12104 [AXIII.7] 167 𝑘𝑔 𝑎𝑔𝑢𝑎 9 𝑘𝑔 𝑠ó𝑙𝑖𝑑𝑜 𝑠𝑒𝑐𝑜 (30,8086 − 11,8731 ) 𝑘𝑔 𝑠ó𝑙𝑖𝑑𝑜 𝑠𝑒𝑐𝑜 𝐴= ( 𝑘𝑔 𝑎𝑔𝑢𝑎 11,41 ℎ 1,3527 ℎ 𝑚2 𝑘𝑔 𝑎𝑔𝑢𝑎 11,8731 + 1,12104 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 + 9,60615 𝑥 ln ( )) 𝑘𝑔 𝑎𝑔𝑢𝑎 0,1111 + 1,12104 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 Á𝑟𝑒𝑎 𝑟𝑒𝑞𝑢𝑒𝑟𝑖𝑑𝑎 = 28,89 𝑚2 Se consideró un factor de sobredimensionamiento del 10% (Sinnott, 2005, p. 13). Á𝑟𝑒𝑎 𝑑𝑖𝑠𝑒ñ𝑜 = 1,1 𝑥 28,89 𝑚2 = 31,78 𝑚2 McCabe et al. (2007), señala como típico bandejas de 75 a 80 cm de ancho (p. 854); considerando dichas dimensiones se propuso unas bandejas de 75 cm x 65 cm. El espesor de cada bandeja es de 2 cm y el espacio entre ellas de 4 cm. Á𝑟𝑒𝑎 𝑏𝑎𝑛𝑑𝑒𝑗𝑎 = 0,75 𝑥 0,65 = 0,49 𝑚2 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = Á𝑟𝑒𝑎 𝑑𝑒 𝑑𝑖𝑠𝑒ñ𝑜 Á𝑟𝑒𝑎 𝑏𝑎𝑛𝑑𝑒𝑗𝑎 31,78 𝑚2 = 65,19 ≈ 66 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 (0,75 𝑥 0,65) 𝑚2 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 𝑝𝑜𝑟 𝑏𝑎𝑠𝑡𝑖𝑑𝑜𝑟 = 66 = 33 𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 2 Estructura del carro Para definir el la estructura metálica del carro compuesto por dos bastidores se determinó la utilización de: 168 Perfiles cuadrados para la estructura principal. Figura AXIII. 1. Especificaciones de los perfiles de acero inoxidable (Acerosotero, 2015, p. 40) Se colocarán perfiles de forma vertical un número de 6, donde 4 de ellos se colocarán al extremo del carro, con una dimensión de 20 mm y 2 de ellos en la división entre bastidores, con un diámetro mayor de 50 mm. Ángulos cuadrados de 30 mm de ancho para la el soporte de las bandejas, que al requerir 33, se utilizarán 132 ángulos. Figura AXIII. 2. Especificaciones de los ángulos de acero inoxidable (Acerosotero, 2015, p. 40) 169 Cabe mencionar que dichas selección se basó en las dimensiones típicas en bastidores, las cuales se verificaron en carros de bandejas y secadores de la Planta Piloto de Alimentos. Ruedas giratorias El carro debe ser movible para su transporte, es por ello que se seleccionaron las ruedas más apropiadas considerando el peso tanto de la alimentación como de la estructura metálica. Para ello se consideró la densidad del acero inoxidable 304 de 7800 kg/m3 (Megyesy, 2008, p. 360). Peso de perfiles en posición vertical: 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝑉 = 7800 𝑘𝑔 𝑥 [4 (20 𝑚𝑚 𝑥 20 𝑚𝑚 − 17 𝑚𝑚 𝑥 17 𝑚𝑚)(33𝑥 60 𝑚𝑚) 𝑚3 (10−3 𝑚)3 + 2 ((50 𝑚𝑚 𝑥 50 𝑚𝑚 − 47 𝑚𝑚 𝑥 47 𝑚𝑚)(33𝑥 60 𝑚𝑚))] 𝑥 (1 𝑚𝑚)3 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝑉 = 15,85 𝑘𝑔 Peso de perfiles en posición horizontal: 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝐻 = 7800 𝑘𝑔 𝑥 [4 (20 𝑚𝑚 𝑥 20 𝑚𝑚 𝑚3 − 17 𝑚𝑚 𝑥 17 𝑚𝑚) 1590 𝑚𝑚] 𝑥 (10−3 𝑚)3 (1 𝑚𝑚)3 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝐻 = 5,51 𝑘𝑔 Peso de ángulos: 𝑃á𝑛𝑔𝑢𝑙𝑜𝑠 = 7800 𝑘𝑔 𝑥 [132 (30 𝑚𝑚 𝑥 1,5 𝑚𝑚 + 30 𝑚𝑚 𝑥 1,5 𝑚𝑚)(650 𝑚3 (10−3 𝑚)3 + 20 𝑚𝑚)] 𝑥 (1 𝑚𝑚)3 170 𝑃á𝑛𝑔𝑢𝑙𝑜𝑠 = 62,08 𝑘𝑔 Peso estructura: 𝑃𝑒𝑠𝑡𝑟𝑢𝑐𝑡𝑢𝑟𝑎 = 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝑉 + 𝑃𝑃𝑒𝑟𝑓𝑖𝑙𝑒𝑠𝐻 + 𝑃á𝑛𝑔𝑢𝑙𝑜𝑠 𝑃𝑒𝑠𝑡𝑟𝑢𝑐𝑡𝑢𝑟𝑎 = 15,85 𝑘𝑔 + 5,51 𝑘𝑔 + 62,08 𝑘𝑔 = 83,44 𝑘𝑔 Peso de bandejas: 𝑃𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 7800 𝑘𝑔 𝑥 33[ (2 𝑥 650 𝑚𝑚 𝑥 1,5 𝑚𝑚 𝑥 20 𝑚𝑚 ) 𝑚3 + (2 𝑥 750 𝑚𝑚 𝑥 1,5 𝑚𝑚 𝑥 20 𝑚𝑚 ) (10−3 𝑚)3 + (750 𝑚𝑚 𝑥 650 𝑚𝑚 𝑥 1,5 𝑚𝑚 )] 𝑥 (1 𝑚𝑚)3 𝑃𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 = 209,85 𝑘𝑔 Peso a soportar las ruedas: 𝑃𝑐𝑎𝑟𝑟𝑜 = 𝑃𝑔𝑒𝑙 + 𝑃𝑒𝑠𝑡𝑟𝑢𝑐𝑡𝑢𝑟𝑎 + 𝑃𝑏𝑎𝑛𝑑𝑒𝑗𝑎𝑠 [AXIII.8] 𝑃𝑐𝑎𝑟𝑟𝑜 = 286,28 𝑘𝑔 + 83,44 𝑘𝑔 + 209,85 𝑘𝑔 = 579,57 𝑘𝑔 Considerando la capacidad de carga de la rueda y su condición térmica de trabajo, cuyas características se exponen en la Figura AXIII.3 se definió un número de 4, las mismas que serán colocas en los vértices de la estructura. 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑟𝑢𝑒𝑑𝑎𝑠 = 𝑃𝑒𝑠𝑜 𝑐𝑎𝑟𝑟𝑜 𝐶𝑎𝑝𝑎𝑐𝑖𝑑𝑎𝑑 𝑟𝑢𝑒𝑑𝑎 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑟𝑢𝑒𝑑𝑎𝑠 = 579,57 𝑘𝑔 160 𝑘𝑔 [AXIII.9] 171 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑟𝑢𝑒𝑑𝑎𝑠 = 3,62 ≈ 4 Figura AXIII. 3. Especificaciones de ruedas giratorias (M&S Equipamientos, 2006, p. 1) De esta manera se definen las dimensiones de la estructura de metálica portadora de pectina. 𝐿𝑐𝑎𝑟𝑟𝑜 = 0,02 + 0,75 + 0,05 + 0,75 + 0,02 = 1,59 𝑚 𝐻𝑐𝑎𝑟𝑟𝑜 = 0,02 + 33 𝑥 0,06 + 0,02 + 0,128 = 2,15 𝑚 𝐴𝑐𝑎𝑟𝑟𝑜 = 0,02 + 0,65 + 0,02 = 0,69 𝑚 Se considera cierto espacio libre para facilitar la entrada del armario con las bandejas, la base se encontrará a nivel del suelo. Las dimensiones de cámara de secado son: 𝐿𝑐á𝑚𝑎𝑟𝑎 = 1,75 𝑚 𝐻𝑐á𝑚𝑎𝑟𝑎 = 2,30 𝑚 𝐴𝑐á𝑚𝑎𝑟𝑎 = 0,85 𝑚 172 Aislamiento térmico 𝑄𝑝 = 𝑇𝑜𝑝 − 𝑇𝑠 𝑇𝑠 − 𝑇𝑎 = 𝑅𝑙 𝑅𝑠 [AXIII.10] Donde: Qp: Calor que se disipa, (btu/h pie2) Rl: Resistencia por conducción de la lana de vidrio, (h pie2 °F/btu) Rs: Resistencia de la superficie para aire inmóvil, (h pie2 °F/btu) Ts: Temperatura de la superficie, (°F) Top: Temperatura caliente de operación del equipo, (°F) Ta: Temperatura del ambiente, (°F) 𝑅𝑙 = 𝑅𝑠 𝑥 𝑇𝑜𝑝 − 𝑇𝑎 𝑇𝑠 − 𝑇𝑎 𝑡𝑒𝑞 𝑇𝑜𝑝 − 𝑇𝑎 = 𝑅𝑠 𝑥 𝑘 𝑇𝑠 − 𝑇𝑎 𝑡𝑒𝑞 = 𝑘 𝑥 𝑅𝑠 𝑥 𝑇𝑜𝑝 − 𝑇𝑎 𝑇𝑠 − 𝑇𝑎 Se considera la [AXIII.11] temperatura de la superficie externa mayor hasta 5 °C a la ambiental. 𝑇𝑎 = 18 °𝐶 = 64,4 °𝐹 𝑇𝑠 = 18 + 4 = 22 °𝐶 = 71,6 °𝐹 𝑇𝑚 = 𝑇𝑜𝑝 + 𝑇𝑠 50 + 22 = = 36°𝐶 = 96,8 °𝐹 2 2 Según la temperatura media se determinó el valor de la conductividad térmica del aislante (Silowash, 2010, p. 148), que corresponde a: 173 𝐾96,8 °𝐹 = 0,235 𝑏𝑡𝑢 𝑖𝑛 ℎ 𝑝𝑖𝑒𝑠 2 °𝐹 Considerando la diferencia entre la temperatura superficial y de operación o caliente (0 a 5 °C), velocidad del aire (nula) y la emisión de la superficie (Acero inoxidable 0,4) se seleccionó el valor de Rs (Silowash, 2010, p. 148). 𝑅𝑠 = 0,81 ℎ 𝑝𝑖𝑒𝑠 2 °𝐹 𝑏𝑡𝑢 Reemplazando la ecuación [AXIII.11] 𝑡𝑎𝑖𝑠𝑙𝑎𝑛𝑡𝑒 = 0,235 𝑏𝑡𝑢 𝑖𝑛 ℎ 𝑝𝑖𝑒𝑠 2 °𝐹 122 − 64,4 𝑥 0,81 𝑥 = 1,50 𝑖𝑛 ℎ 𝑝𝑖𝑒𝑠 2 °𝐹 𝑏𝑡𝑢 71,6 − 64,4 VENTILADOR Mediante el correspondiente balance de masa para la deshidratación de 286,28 kg de coloide, se definió el flujo de aire necesario: 𝐺𝑎 (𝑌𝑠 − 𝑌𝑒 ) = 𝑃𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 (𝑋𝑜 − 𝑋𝑓 ) Donde: Ga: flujo de aire, (m3/h) Ye: humedad el aire a la entrada, (kg de agua/kg de aire seco) Ys: humedad del aire a la salida, (kg de agua/kg de aire seco) Ppectina seca: peso de pectina seco, (kg) Xo: humedad inicial de la pectina, (kg de agua/kg de pectina seca) Xf: humedad final de la pectina, (kg de agua/kg de pectina seca) [AXIII.12] 174 𝐺𝑎 (0,0176 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 − 0,0136 ) 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒 𝑠𝑒𝑐𝑜 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒 𝑠𝑒𝑐𝑜 = 9 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑘𝑔 𝑎𝑔𝑢𝑎 (30,8086 11,41 ℎ 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 − 0,1111 𝐺𝑎 = 6 053,41 𝑘𝑔 𝑎𝑔𝑢𝑎 ) 𝑘𝑔 𝑝𝑒𝑐𝑡𝑖𝑛𝑎 𝑠𝑒𝑐𝑎 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒 𝑠𝑒𝑐𝑜 ℎ 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒 𝑠𝑒𝑐𝑜 𝑚3 𝑚3 𝐺𝑎 = 6 053,41 𝑥 1,18 = 7 143,02 ℎ 𝑘𝑔 ℎ Propiedades del aire Mediante la disposición de un termómetro de bulbo seco y de bulbo húmedo en el dámper de entrada y salida del aire en el deshidratador de bandejas durante la experimentación, se midieron sus condiciones. En la Tabla AXIII.1 se presentan las condiciones térmicas de entrada y salida del aire para secado de la pectina húmeda. Tabla AXIII. 1. Condiciones térmicas de entrada y salida del aire Temperatura Condiciones de Entrada Condiciones de salida Temperatura de bulbo seco 68,0 °F / 20,0 °C 118,0 °F / 47,8 °C Temperatura de bulbo húmedo 60,0 °F / 15,6 °C 76,0 °F / 24,4 °C Con las condiciones de la Tabla AXIII.1 en la carta psicométrica a nivel de Quito de 2800 msnm, se determinó la cantidad de agua por aire seco, las cuales se presentan en la Tabla AXIII.2. 175 Tabla AXIII. 2. Condiciones de humedad del aire para la deshidratación de pectina Condición kg agua/ kg aire seco Entrada 0,0136 Salida 0,0176 El volumen específico a la entrada se definió mediante la ecuación AXIII.13. 𝑉𝑒 = ( 1 𝑌𝑒 𝑅𝑇 + ) 𝑀𝑔 𝑀𝑣 𝑃 [AXIII.13] Donde: Ve: Volumen especifico a la entrada, (m3/kg) Mg: Peso molecular del aire, (kg/kgmol) Mv: Peso molecular del vapor de agua, (kg/kgmol) T: Temperatura de entrada del aire, (K) Ye: Contenido de humedad a la entrada, (kg de agua/kg de aire seco) P: Presión al nivel de Quito, (atm) R: Constante universal de los gases, (m3 atm/kgmol K) 1 𝑉𝑒 = ( + 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 28,8 𝑘𝑔 𝑚𝑜𝑙 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 𝑚3 𝑎𝑡𝑚 0,082 (20 + 273 𝐾) 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒 𝑠𝑒𝑐𝑜 𝑘𝑔𝑚𝑜𝑙 °𝐾 ) 𝑘𝑔 𝑑𝑒 𝑎𝑔𝑢𝑎 0,72 𝑎𝑡𝑚 18 𝑘𝑔 𝑚𝑜𝑙 0,0136 𝑚3 𝑉𝑒 = 1,18 𝑘𝑔 𝜌𝑒 = 1 𝑉𝑒 𝜌𝑒 = 1 1 𝑘𝑔 = = 0,85 3 𝑉𝑒 1,18 𝑚 [AXIII.14] 176 Presión de diseño Para la presión estática se consideró el extremo superior en el rango de diseño para casos en el que no existen ductos, la cual se presenta en la Figura AXIII.6. Figura AXIII. 4. Rangos de diseño para la presión estática (GREENHECK, 2010, p. 17) 𝑃𝑠 = 0,20 𝑖𝑛𝑐𝑎 = 5,08 𝑚𝑚𝑐𝑎 Se seleccionó una boca de captación tipo cabina de autoregulable para su posición en el equipo. Dicha ventilación centralizada se aplica para el ingreso del aire necesario para la deshidratación, sus pérdidas por presión se definieron mediante la presión dinámica. Figura AXIII. 5. Característica de la boca de captación de aire para el secado (Escoda, 2014, p. 32) Mediante la velocidad se estableció la presión en sentido del flujo del aire (Escoda, 2014, p. 38): 𝑃𝑑 = 𝜌𝑒 𝑥 𝑣2 2 [AXIII.15] 177 Donde: Pd: Presión dinámica, mmca 𝑚 2 𝑘𝑔 (1,8 𝑠 ) 𝑃𝑑 = 0,85 3 𝑥 𝑚 2 𝑃𝑑 = 1,37 𝑃𝑎 𝑥 1 𝑖𝑛𝑐𝑎 25,4 𝑚𝑚𝑐𝑎 𝑥 = 0,14 𝑚𝑚𝑐𝑎 249,1 𝑃𝑎 1 𝑖𝑛𝑐𝑎 Perdidas por fricción El ventilador debe vencer las pérdidas de carga, es decir la fricción producida al atravesar el aire por la boca y cabina del secador. Para el cálculo de las pérdidas por fricción de la boca se utilizó el mecanismo del factor n (Escoda, 2014, p. 56), el cual se basa en la ecuación [AXIII.16]. 𝑃𝑐 = 𝑛 𝑥 𝑃𝑑 [AXIII.16] Donde: Pc: pérdida de carga, (mmca) n: factor de pérdidas de cargas El factor n para la boca seleccionada corresponde a 1,25, como se fundamenta por (Escoda, 2014, p. 59). 𝑃𝑐𝑏𝑜𝑐𝑎 = 1,25 𝑥 0,14 𝑚𝑚𝑐𝑎 = 0,18 𝑚𝑚𝑐𝑎 Las pérdidas por fricción según la longitud de corriente de flujo de aire en la cabina: ℎ𝑓 = 𝑓 𝑥 𝐿 𝑣2 𝑥 𝐷𝑒 2 𝑔 [AXIII.17] 178 Donde: hf: Pérdidas por fricción, (mca) f: Factor de fricción de Darcy v: velocidad del aire, (m/s) De: Diámetro equivalente de la cámara de secado, (m) G: Gravedad, (m2/s) 𝐷𝑒𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑡𝑒 = 𝑅𝑒 = 2 (2,30 𝑥 1,75) = 1,99 𝑚 2,30 + 1,75 𝑣 𝑥 𝐷𝑒 𝜇 [AXIII.18] 𝑚 1,8 𝑠 𝑥 1,99 𝑚 𝑅𝑒 = = 200 111,73 = 2 𝑥 105 1,79 𝑥 10−5 𝑚2 /𝑠 є 𝐷𝑒𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑡𝑒 = 0,045 𝑚𝑚 = 0,00002 1 990 𝑚𝑚 Donde: Є/Dequivalente: Rugosidad relativa Mediante la ubicación en el diagrama de Moddy del Re y la relación entre el diámetro y la rugosidad del acero, se determinó un factor inicial de Darcy, a partir del cual se ejecutó la iteración en la ecuación [AXIII.19] para cumplir con dicha igualdad. 1 є/𝐷𝑒𝑞 2,51 = −2 log ( + ) 3,7 𝑅𝑒 √𝑓 √𝑓 [AXIII.19] Considerando la igualdad de la ecuación [AXIII.19] se determinó un factor de 0,0158. 179 𝑚 (1,8 𝑠 )2 1,75 𝑚 ℎ𝑓 = 0,0158 𝑥 𝑥 = 0,0023 𝑚𝑐𝑎 1,99 𝑚 2 (9,8 𝑚 ) 𝑠2 ℎ𝑓 = 2,30 𝑚𝑚𝑐𝑎 La sumatoria de la presión dinámica, estática y las pérdidas generadas en la cabina: 𝑃𝑇 = 0,14 + 5,08 + 0,18 + 2,30 = 7,70 𝑚𝑚𝑐𝑎 Según los parámetros antes determinados se seleccionó el ventilador: Figura AXIII. 6. Parámetros del ventilador axial (OTAM, 2011, p. 7) 180 Figura AXIII. 7. Dimensiones del ventilador axial (OTAM, 2011, p. 10) 181 REQUERIMIENTO ENERGÉTICO Para determinar el requerimiento energético de la cámara de secado se evaluó el calor mediante transmisión por convección según la expresión [AXIII.20], se consideró un área de secado de 31,78 m2 (Ahmed y Rahman, 2012, p. 518). [AXIII.20] 𝑄 = ℎ 𝐴𝑠𝑒𝑐𝑎𝑑𝑜 (𝑇 − 𝑇𝑓 ) Donde: Q: calor requerido para el secado, (kcal/h) h: coeficiente de convección, (kcal/m2 h °C) T: temperatura de bulbo seco del aire, (°C) Tf: temperatura de bulbo húmedo del aire, (°C) Considerando la dirección del aire se definió el coeficiente de convección según la expresión [AXII.21]. ℎ = 0,0175 𝐺 0,8 [AXIII.21] 6053,41 𝑘𝑔 𝑑𝑒 𝑎𝑖𝑟𝑒/ℎ 𝑘𝑔 𝐺=( ) = 4 858,27 2 0,712 𝑚 𝑥 1,75 𝑚 𝑚 ℎ Aplicando la ecuación AXIII.21. ℎ = 0,0175 𝑥 4858,270,8 = 15,57 𝑘𝑐𝑎𝑙 𝑚2 ℎ °𝐶 Aplicando la ecuación AXIII.20: 𝑄 = 15,57 𝑘𝑐𝑎𝑙 𝑥 31,78 𝑚2 𝑥 (47,8 °𝐶 − 24,4 °𝐶) 𝑚2 ℎ °𝐶 𝑄 = 11 578,66 𝑘𝑐𝑎𝑙 1𝑊 𝑥 = 13 463,56 𝑊 = 13,46 𝑘𝑊 𝑘𝑐𝑎𝑙 ℎ 0,86 ℎ 182 Además el calor necesario para calentar el alimento: [AXIII.22] 𝑄𝑔𝑒𝑙 = 𝑚𝑔𝑒𝑙 𝑥 𝐶𝑝𝑔𝑒𝑙 𝑥 ∆𝑇 𝑄𝑔𝑒𝑙 = 286,28 𝑘𝑔 𝑥 4,18 𝑄𝑔𝑒𝑙 = 41882,76 𝑘𝐽 𝑥 𝑄𝑔𝑒𝑙 = 𝑘𝐽 𝑘𝑔 ̊𝐶 1 𝑘𝑐𝑎𝑙 4,18 𝑘𝐽 𝑥 (50 °𝐶 − 15 °𝐶) = 41 882,76 𝑘𝐽 = 10 019,80 𝑘𝑐𝑎𝑙 10 019,80 𝑘𝑐𝑎𝑙 1𝑊 𝑥 = 1 021,12 𝑊 = 1,02 𝑘𝑊 𝑘𝑐𝑎𝑙 11,41 ℎ 0,86 ℎ Energía total: 𝑄 = 1,10 𝑥 (13,46 𝑘𝑊 + 1,02 𝑘𝑊) = 15,93 𝑘𝑊 Se seleccionaron resistencias con aletas de 40 mm de ancho y de 1 055 mm de longitud; de la cuales se requieren aproximadamente 5 para generar el calor necesario. Las resistencias se ubicaran de forma horizontal, cuya longitud es adecuada a la longitud de la cámara de 2,30 m. 𝑁ú𝑚𝑒𝑟𝑜 𝑑𝑒 𝑟𝑒𝑠𝑖𝑠𝑡𝑒𝑛𝑐𝑖𝑎𝑠 = 15,93 𝐾𝑊 = 4,55 ≈ 5 𝑟𝑒𝑠𝑖𝑠𝑡𝑒𝑛𝑐𝑖𝑎𝑠 𝑊 1 𝐾𝑊 3500 𝑟𝑒𝑠𝑖𝑠𝑡𝑒𝑛𝑐𝑖𝑎 𝑥 1000 𝑊 Figura AXIII. 8. Especificaciones de resistencias con aletas (RCI, 2015, p. 1) 183 ANEXO XIV DEMANDA ENERGÉTICA DE LOS PRINCIPALES EQUIPOS DESCRITOS EN EL PFD DEL PROCESO DE EXTRACCIÓN A ESCALA PILOTO CONSUMO DE ENERGÍA ELÉCTRICA Clasificadora de frutos Para la selección de la clasificadora CR-101 de limones se consideraron los siguientes parámetros: Capacidad real = 991,64 kg Capacidad nominal = 1,2 Carga real: 1 189,97 kg Diámetro del limón = 6,04 ± 0,17 cm Peso unitario del limón = 69,7225 ± 3,8830 g Catálogo: Ficha A GENERALIDADES Tipo: Clasificadora tipo rodillos 36-2 Marca: JERSA Material: Acero inoxidable 304 Capacidad: 1500 kg/h Diámetro de selección: 2 o 5, de 11 a 160 mm Rodillos: cédula 40 ¼ in Potencia: 1 HP Alimentación:: 220 a 440 V DIMENSIONES: (JERSA, 2015, p.1) 184 Lavadora de frutos Para la selección del equipo de lavado por inmersión LV-102 se consideraron los siguientes parámetros: Carga real = 989,65 kg Carga nominal = 1,2 Carga real: 1 187,58 kg Catálogo: Ficha B GENERALIDADES Marca: IMARCA C.A. Material: Acero inoxidable 304 Capacidad: 1200 A 1500 kg Energía: Bomba de aire: 3,75 kW Bomba de ciclo: 3 kW Correa: 0,37 kW Alimentación: 220 V Presión bomba (máxima): 36 kPa DIMENSIONES: Largo (cm) Ancho (cm) Altura (cm) 340 116 148 (IMARCA, 2015) Cortadora y picadora Para la selección del equipo pelador y picador de la piel de los limones PC-103 se consideraron los siguientes parámetros: Carga real = 987,67 kg Capacidad nominal =1,2 Carga real: 1 185,20 kg → 16 999,48 limones Peso unitario del limón = 69,7225 ± 3,8830 g Diámetro del limón = 6,04 ± 0,17 cm 185 Catálogo: Ficha C GENERALIDADES Fabricante: WUXI KAAE Material: Acero inoxidable 304 Capacidad: 80 a 100 unidades/min Diámetro fruto: 4 a 10 cm Peso fruto: 40 a 120 g Espesor de corteza: 0,5 a 3 mm Potencia: 2,18 kW Alimentación: 220 V DIMENSIONES: Largo (cm) Ancho (cm) Altura (cm) 220 220 190 (KAAE, 2015) Lavadora de corteza Para la selección de la lavadora para la corteza escaldada se consideraron los siguientes parámetros: Carga real= 345,74 kg Carga nominal = 1,2 Carga real: 414,89 kg Considerando que la carga nominal se encuentra dentro del rango presentado por equipo LV-102 de 1 200 a 1 500 kg/h se establece reutilizar dicho equipo para este proceso. 186 Molino Para la selección del equipo MC-305 se consideraron los siguientes parámetros: Capacidad real = 10 kg Capacidad nominal= 1,2 Capacidad real: 12 kg Diámetro de alimentación= 100 mm Diámetro producto= 250 um Mediante ecuación de Bond AXIV.1 se determinó la energía para triturar la pectina hasta 250 um, considerando los tamaños de alimentación y producto. Se estimó un Wi de 0,25 KWh/t (Badmus, Raji y Akinoso, 2013, p. 160). 𝑃 = 10 ∗ 𝑊𝑖 ∗ ( 𝑚 1 √𝑋𝑝 − 1 √𝑋𝑎 ) Donde: P: Energía de molienda, (kW) m: Cantidad de alimentación, (t/h) Wi: Índice de trabajo, (kWh/t) Xp: Tamaño del producto, (mm) Xa: Tamaño de la alimentación, (mm) 𝑃 = 10 ∗ 0,012 𝑡 𝑘𝑊ℎ 1 1 ∗ 0,25 ∗( − ) 0,25 ℎ 𝑡 √0.25 √100 𝑃 = 0, 23 𝑘𝑊 𝑥 𝑃 = 0,31 𝐻𝑃 1 𝐻𝑃 = 0,31 𝐻𝑃 0,746 𝑘𝑊 [AXIV.1] 187 Catálogo: Ficha D GENERALIDADES Fabricante: COR-MEX Material: Acero al carbono Boca: 150 x 155 mm Potencia: 3 HP Número de cuchillas: 4 Capacidad: 30 a 60 kg de alimentación Diámetro producto: 0,22 a 0,50 um DIMENSIONES: Longitud (cm) Altura (cm) 107 117 (CORMEX, 2015) Tabla AXIV. 1. Detalle del consumo de energía de los equipos requeridos para generación de 2400 kg/año de pectina Equipo Potencia (kW) Tiempo de operación (h) Consumo eléctrico (KW h) CR-101 1,34 0,79 1,06 LV-101 7,12 1,34 9,54 PC-103 2,18 2,83 6,17 RE-201/RE-202 3,22 1,50 4,83 SB-304 15,93 11,41 181,76 MC-305 3,00 0,40 1,20 TOTAL 204,56 188 CONSUMO DE VAPOR Caldero Para la selección del caldero se consideró el consumo de vapor definido en la Figura 3.27, obtenido mediante el balance energético durante los procesos de escaldado y extracción que requieren calentamiento indirecto con vapor. 𝑚𝑣𝑇𝑂𝑇𝐴𝐿 = 𝑚𝑣𝐸𝑆𝐶𝐴𝐿𝐷𝐴𝐷𝑂 + 𝑚𝑣𝐸𝑋𝑇𝑅𝐴𝐶𝐶𝐼Ó𝑁 𝑚𝑣𝑇𝑂𝑇𝐴𝐿 = 152,47 𝑘𝑔 + 159,64 𝑘𝑔 = 312,11 𝑘𝑔 𝑑í𝑎 Se definió el tiempo de operación del caldero en el día, que involucra el tiempo requerido por los equipos de inactivación de las enzimas de la corteza y de extracción. Tiempo operación del RE-201 para la extracción Tiempo de calentamiento de la solución previo a la reacción de hidrólisis: 𝜃𝑐𝑒𝑥𝑡 = − 𝑚𝑠 𝐶𝑝𝑠 𝑇𝑠𝑎𝑡 − 𝑇𝑐 ln ( ) 𝑈𝐴 𝑇𝑠𝑎𝑡 − 𝑇𝑜 [AXIV.2] Donde: θcextracción: Tiempo requerido para el para elevar la temperatura de la solución ácida previo a la extracción, (s) ms: Cantidad de la solución ácida, (kg) Cps: Capacidad calorífica de la solución, (kJ/kg °C) U: Coeficiente de transferencia de calor, (W/ m2 °C) A: Área de transferencia, (m2) Tsat: Temperatura de saturación del vapor a 150 psi Tc: Temperatura que se desea alcanzar, (°C) To: Temperatura inicial de la solución, (°C) 189 Propiedades del vapor Presión: 150 psi Temperatura: 181,62 °C Calor latente: 2009,2 J/g Área de transferencia: 𝐴 = 2 𝜋 𝑟𝐻 = 2 𝜋 ( 0,86 𝑚) 𝑥 1,41 𝑚 = 3,81 𝑚2 2 Coeficiente de transferencia de calor: Figura AVIII.4. Rangos del coeficiente de transferencia de calor para calentamiento con chaqueta (Sinnott, 2005, p. 638) 517,85 𝑘𝑔 𝑥 4,18 𝜃𝑐𝑒𝑥𝑡 = − 500 𝜃𝑐𝑒𝑥𝑡 = 486,64 𝑠 𝑥 𝑘𝐽 103 𝐽 𝑥 𝑘𝑔 ̊𝐶 1 𝑘𝐽 𝑊 𝑥 3,81 𝑚2 𝑚2 ̊𝐶 181,62 − 75 ln ( ) 181,62 − 18 1 𝑚𝑖𝑛 = 8,11 ≈ 9 𝑚𝑖𝑛 60 𝑠 𝜃𝑇𝑂𝑇𝐴𝐿𝑒𝑥𝑡 = 9 min + 80 min = 89 𝑚𝑖𝑛 Tiempo operación del ME-104 para escaldado El tiempo de calentamiento de la solución previo al escaldado, se definió mediante la ecuación [AXIV.2] aplicada para el caso de extracción, con la diferencia en la 190 alimentación y el área de transferencia, para lo cual se selección de catálogo el equipo. Marmita Para la selección de la marmita ME-104 requerida para el proceso de escaldado se consideraron los siguientes parámetros: 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑟𝑒𝑎𝑙 = 346,43 𝑘𝑔 𝑥 1𝐿 1 𝑚3 𝑚3 𝑥 + 692,17 𝑘𝑔 𝑥 = 1,10 𝑚3 0,8435 kg 1 000 𝐿 999 𝑘𝑔 𝑉𝑜𝑙𝑢𝑚𝑒𝑛 𝑛𝑜𝑚𝑖𝑛𝑎𝑙 = 1,2 𝑥 1,10 𝑚3 = 1,32 𝑚 𝑚3 𝑃𝑟𝑒𝑖ó𝑛 𝑑𝑒 𝑣𝑎𝑝𝑜𝑟 = 150 𝑝𝑠𝑖 Catálogo: Ficha E GENERALIDADES Fabricante: LEE-INDUSTRIES Material: Acero inoxidable 304 Capacidad: 1,5 m3 Fuente de calentamiento: línea de vapor Presión de vapor: desde 30 psi Sección interna: Canasta semiesférica con agujeros DIMENSIONES: A (cm) B (cm) C (cm) D (cm) E (cm) F (cm) 137 107 178 52 2,54 12,7 (LEE INDUSTRIES, 2015) 191 Área de transferencia: 𝐴 = 2 𝜋 𝑟𝐻 = 2 𝜋 ( 1,37 𝑚) 𝑥 1,07 𝑚 = 4,61 𝑚2 2 Aplicando la ecuación [AXIV.2]. 𝑘𝑔 𝑘𝐽 103 𝐽 𝑥 4,18 𝑥 181,62 − 75 𝑘𝑔 ̊𝐶 1 𝑘𝐽 𝑚3 ln ( ) 𝑊 181,62 − 18 2 500 2 𝑥 4,6 𝑚 𝑚 ̊𝐶 692,17 𝜃𝑐𝑒𝑠𝑐𝑎𝑙𝑑𝑎𝑑𝑜 = − 𝜃𝑐𝑒𝑠𝑐𝑎𝑙𝑑𝑎𝑑𝑜 = 489,71 𝑠 𝑥 1 𝑚𝑖𝑛 = 8,17 ≈ 9 𝑚𝑖𝑛 60 𝑠 𝜃𝑇𝑂𝑇𝐴𝐿𝑒𝑠𝑐𝑎𝑙𝑑𝑎𝑑𝑜 = 9 min + 10 min = 19 𝑚𝑖𝑛 Tiempo de operación de caldero: 𝜃𝐶𝐴𝐿𝐷𝐸𝑅𝑂 = 𝜃𝑇𝑂𝑇𝐴𝐿𝑒𝑥𝑡 + 𝜃𝑇𝑂𝑇𝐴𝐿𝑒𝑠𝑐𝑎𝑙𝑑𝑎𝑑𝑜 = 108 𝑚𝑖𝑛 𝑑í𝑎 Potencia del caldero 𝑃𝑜𝑡𝑐𝑎𝑙𝑑𝑒𝑟𝑜 = 312,11 𝑘𝑔 kJ 𝑑í𝑎 60 𝑚𝑖𝑛 1 𝑏𝑡𝑢 1 𝐵𝐻𝑃 𝑥 2009,2 𝑥 𝑥 𝑥 𝑥 𝑑í𝑎 kg 108 𝑚𝑖𝑛 1ℎ 1,055 𝑘𝐽 33475 𝑏𝑡𝑢 ℎ 𝑃𝑜𝑡𝑐𝑎𝑙𝑑𝑒𝑟𝑜 = 9,86 𝐵𝐻𝑃 𝑃𝑜𝑡𝑑𝑖𝑠𝑒ñ𝑜 𝑐𝑎𝑙𝑑𝑒𝑟𝑜 = 11,84 𝐵𝐻𝑃 Consumo de combustible (diésel) 𝑚𝑑𝑖𝑒𝑠𝑒𝑙 = 𝑚𝑣𝑇𝑂𝑇𝐴𝐿 𝑥 𝜆𝑣 𝑃𝑐𝑎𝑙ó𝑟𝑖𝑐𝑜 [AXIV.3] 192 𝑘𝑔 kJ 𝑥 2009,2 𝑘𝑔 𝑑í𝑎 kg = = 14,85 𝑘𝑐𝑎𝑙 4,18 𝑘𝐽 𝑑í𝑎 10 100 𝑥 𝑘𝑔 1 𝑘𝑐𝑎𝑙 312,11 𝑚𝑑𝑖𝑒𝑠𝑒𝑙 𝑉𝑑𝑖𝑒𝑠𝑒𝑙 = 14,85 𝑘𝑔 𝐿 𝐿 𝑥 = 17,47 𝑑í𝑎 0,85 𝑘𝑔 𝑑í𝑎 193 Catálogo: Ficha F GENERALIDADES Fabricante: ATTSU Material: Acero al carbono (ATTSU, 2015)