MACHETE4Energía y Metabolismo
Anuncio

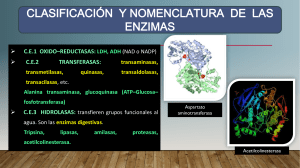
CONCEPTOS ENERGÍA RELACIONADOS CON LA Energía: es la capacidad de realizar un trabajo, es decir la capacidad de cambiar el estado o el movimiento de la materia. Primera ley de la termodinámica o ley de la conservación de la energía: la energía no se crea ni se destruye, sino que se transforma de un tipo de energía en otro Energía útil y energía no útil: la energía útil es la que permite realizar un trabajo. El calor es un tipo de energía no aprovechable por los seres vivos, es decir, energía no útil. Un proceso espontáneo es el que no requiere energía de activación y por el contrario,un proceso no espontáneo requiere energía de activación Proceso exergónico: es un proceso en el cual el contenido energético al inicio es mayor que en el estado final. Por lo tanto en dicho proceso se ha liberado energía al medio. Proceso endergónico: es un proceso en el cual el contenido energético inicial es menor que en el estado final. Por lo tanto en dicho proceso se ha entregado energía al sistema . Entropía: es una forma de cuantificar el desorden de un sistema. A mayor entropía, mayor desorden. Segunda ley de la termodinámica: En toda transformación energética parte de la energía inicial se transforma en calor. Por eso la Segunda Ley dice que el universo tiende al desorden o que la entropía del universo siempre está en aumento, porque la energía útil (que permite el orden) se transforma en no útil (calor). METABOLISMO – ENZIMAS METABOLISMO Conjunto de reacciones químicas que permiten las transformaciones de la materia y energía en los seres vivos. Las reacciones se clasifican, desde el punto de vista metabólico, en: anabólicas (reacciones de síntesis o construcción) catabólicas (reacciones de degradación) Las reacciones se clasifican desde el punto de vista energético en: endergónicas (necesitan energía) exergónicas (requieren energía) Las reacciones anabólicas son endergónicas y las catabólicas son exergónicas. Están acopladas por un intermediario energético: el ATP Las reacciones anabólicas-endergónicas siempre se acoplan con la ruptura de ATP y las reacciones catabólicas-exergónicas se acoplan con la síntesis de ATP. Para procesos anabólicos ENERGIA + ATP AMP+Pi ENERGIA De procesos catabólicos ENZIMAS Son catalizadores biológicos, aceleran las reacciones químicas disminuyendo la energía de activación. Reacción química: proceso por el cual una o más sustancias (sustratos o reactivos) se transforman o combinan para dar como resultado otras sustancias (productos) Energía de activación: energía mínima necesaria para que una reacción química comience. La mayoría son proteicas. Hay algunas pocas que son ARN catalíticos (ribozimas). Características de las enzimas: son específicas respecto al sustrato son eficientes en pequeñas cantidades no se alteran en el curso de la reacción no alteran el equilibrio de la reacción Se clasifican en: Mecanismo de acción enzimática: La enzima reconoce al sustrato específico debido al sitio activo. Enzima + sustrato complejo enzima/sustrato producto + enzima Hay dos modelos que intentan explicar como es la relación enzima/sustrato al momento de formarse el complejo enzima/sustrato: ajuste inducido y llave cerradura. - Hay varios factores que pueden afectar o modificar la velocidad de reacciones catalizadas por enzimas: a) Concentración de sustrato A mayor concentración de sustrato mayor velocidad, hasta llegar a la velocidad máxima o saturación enzimática (todas las enzimas están ocupadas catalizando la reacción) b) Temperatura A mayor temperatura mayor velocidad, hasta alcanzar la temperatura óptima. A temperaturas mayores a la óptima la velocidad disminuye debido a una posible desnaturalización. c) pH : La relación entre actividad de una enzima y el pH depende mucho de que enzima se trate. A pH extremos las proteínas pueden desnaturalizarse y su actividad disminuye. Hay enzimas que no ven afectada su actividad con el pH. Otras tendrán un pH óptimo ácido o básico. d) Presencia de inhibidores: son moléculas que cuando se unen a las enzimas disminuyen su actividad. Los hay reversibles e irreversibles. Dentro de los reversibles encontramos los inhibidores competitivos (el inhibidor se une al sitio activo) y no competitivos (el inhibidor se une en un sitio diferente al sitio activo). Inhibidor competitivo Inhibidor no competitivo Regulación de la actividad enzimática Puede darse a tres niveles regulación de la síntesis de enzimas regulación de la degradación de enzimas regulación de la actividad catalítica Regulación de la actividad catalítica: hay distintos casos: a) Sistemas multienzimáticos: conjunto de enzimas que participan de una misma vía metabólica. El producto final inhibe a la primera enzima. A Enz 1 Enz 2 Enz 3 B C D b) Efectos alostéricos: las enzimas alostéricas se diferencian de las demás enzimas porque pueden sufrir cambios conformacionales (en su estructura espacial) en respuesta a la unión de moduladores o ligandos. Los moduladores positivos cambian la forma de la enzima de manera que mejora la unión enzima/sustrato. Los moduladores negativos tienen el efecto contrario. c) Modificación covalente: hay enzimas que se activan o inactivan si se les une covalentemente cierto grupo químico. Hay otras que se activan cuando se les elimina una cierta porción de aminoácidos. d) Compartimentalización: separación de las distintas enzimas metabólicas en compartimientos separados (en eucariontes exclusivamente) e) Isoenzimas: distintas formas estructurales de una misma enzima.