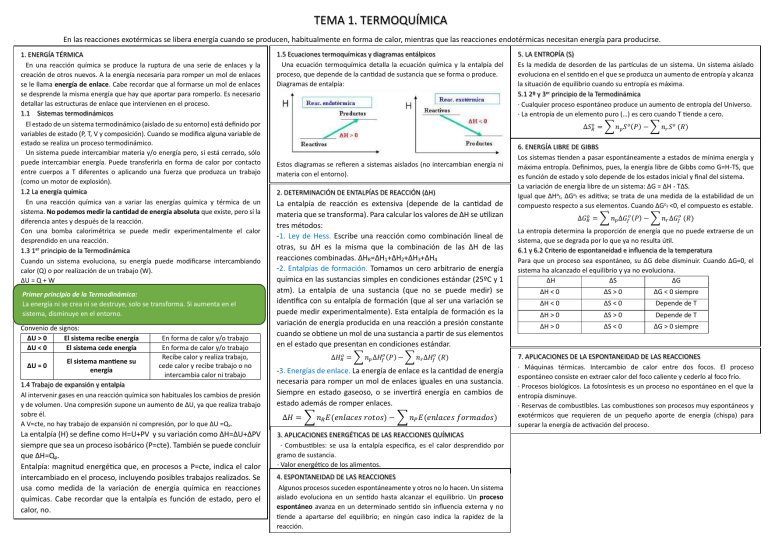
TEMA 1. TERMOQUÍMICA En las reacciones exotérmicas se libera energía cuando se producen, habitualmente en forma de calor, mientras que las reacciones endotérmicas necesitan energía para producirse. 1. ENERGÍA TÉRMICA En una reacción química se produce la ruptura de una serie de enlaces y la creación de otros nuevos. A la energía necesaria para romper un mol de enlaces se le llama energía de enlace. Cabe recordar que al formarse un mol de enlaces se desprende la misma energía que hay que aportar para romperlo. Es necesario detallar las estructuras de enlace que intervienen en el proceso. 1.1 Sistemas termodinámicos El estado de un sistema termodinámico (aislado de su entorno) está definido por variables de estado (P, T, V y composición). Cuando se modifica alguna variable de estado se realiza un proceso termodinámico. Un sistema puede intercambiar materia y/o energía pero, si está cerrado, sólo puede intercambiar energía. Puede transferirla en forma de calor por contacto entre cuerpos a T diferentes o aplicando una fuerza que produzca un trabajo (como un motor de explosión). 1.2 La energía química En una reacción química van a variar las energías química y térmica de un sistema. No podemos medir la cantidad de energía absoluta que existe, pero sí la diferencia antes y después de la reacción. Con una bomba calorimétrica se puede medir experimentalmente el calor desprendido en una reacción. 1.3 1er principio de la Termodinámica Cuando un sistema evoluciona, su energía puede modificarse intercambiando calor (Q) o por realización de un trabajo (W). ∆U = Q + W Primer principio de la Termodinámica: La energía ni se crea ni se destruye, solo se transforma. Si aumenta en el sistema, disminuye en el entorno. Convenio de signos: ∆U > 0 El sistema recibe energía ∆U < 0 El sistema cede energía ∆U = 0 El sistema mantiene su energía En forma de calor y/o trabajo En forma de calor y/o trabajo Recibe calor y realiza trabajo, cede calor y recibe trabajo o no intercambia calor ni trabajo 1.4 Trabajo de expansión y entalpía Al intervenir gases en una reacción química son habituales los cambios de presión y de volumen. Una compresión supone un aumento de ∆U, ya que realiza trabajo sobre él. A V=cte, no hay trabajo de expansión ni compresión, por lo que ∆U =Qv. La entalpía (H) se define como H=U+PV y su variación como ∆H=∆U+∆PV siempre que sea un proceso isobárico (P=cte). También se puede concluir que ∆H=Qp. Entalpía: magnitud energética que, en procesos a P=cte, indica el calor intercambiado en el proceso, incluyendo posibles trabajos realizados. Se usa como medida de la variación de energía química en reacciones químicas. Cabe recordar que la entalpía es función de estado, pero el calor, no. 1.5 Ecuaciones termoquímicas y diagramas entálpicos Una ecuación termoquímica detalla la ecuación química y la entalpía del proceso, que depende de la cantidad de sustancia que se forma o produce. Diagramas de entalpía: 5. LA ENTROPÍA (S) Es la medida de desorden de las partículas de un sistema. Un sistema aislado evoluciona en el sentido en el que se produzca un aumento de entropía y alcanza la situación de equilibrio cuando su entropía es máxima. 5.1 2º y 3er principio de la Termodinámica · Cualquier proceso espontáneo produce un aumento de entropía del Universo. · La entropía de un elemento puro (…) es cero cuando T tiende a cero. ∆𝑆𝑅𝑜 = 𝑛𝑝 𝑆 𝑜 ሺ𝑃ሻ − 𝑛𝑟 𝑆 𝑜 ሺ𝑅ሻ Estos diagramas se refieren a sistemas aislados (no intercambian energía ni materia con el entorno). 2. DETERMINACIÓN DE ENTALPÍAS DE REACCIÓN (∆H) La entalpía de reacción es extensiva (depende de la cantidad de materia que se transforma). Para calcular los valores de ∆H se utilizan tres métodos: -1. Ley de Hess. Escribe una reacción como combinación lineal de otras, su ∆H es la misma que la combinación de las ∆H de las reacciones combinadas. ∆HR=∆H1+∆H2+∆H3+∆H4 -2. Entalpías de formación. Tomamos un cero arbitrario de energía química en las sustancias simples en condiciones estándar (25ºC y 1 atm). La entalpía de una sustancia (que no se puede medir) se identifica con su entalpía de formación (que al ser una variación se puede medir experimentalmente). Esta entalpía de formación es la variación de energía producida en una reacción a presión constante cuando se obtiene un mol de una sustancia a partir de sus elementos en el estado que presentan en condiciones estándar. ∆𝐻𝑅𝑜 = 𝑛𝑝 ∆𝐻𝑓𝑜 ሺ𝑃ሻ − 𝑛𝑟 ∆𝐻𝑓𝑜 ሺ𝑅ሻ -3. Energías de enlace. La energía de enlace es la cantidad de energía necesaria para romper un mol de enlaces iguales en una sustancia. Siempre en estado gaseoso, o se invertirá energía en cambios de estado además de romper enlaces. ∆𝐻 = 𝑛𝑅 𝐸ሺ𝑒𝑛𝑙𝑎𝑐𝑒𝑠 𝑟𝑜𝑡𝑜𝑠ሻ − 𝑛𝑃 𝐸ሺ𝑒𝑛𝑙𝑎𝑐𝑒𝑠 𝑓𝑜𝑟𝑚𝑎𝑑𝑜𝑠ሻ 3. APLICACIONES ENERGÉTICAS DE LAS REACCIONES QUÍMICAS · Combustibles: se usa la entalpía especifica, es el calor desprendido por gramo de sustancia. · Valor energético de los alimentos. 4. ESPONTANEIDAD DE LAS REACCIONES Algunos procesos suceden espontáneamente y otros no lo hacen. Un sistema aislado evoluciona en un sentido hasta alcanzar el equilibrio. Un proceso espontáneo avanza en un determinado sentido sin influencia externa y no tiende a apartarse del equilibrio; en ningún caso indica la rapidez de la reacción. 6. ENERGÍA LIBRE DE GIBBS Los sistemas tienden a pasar espontáneamente a estados de mínima energía y máxima entropía. Definimos, pues, la energía libre de Gibbs como G=H-TS, que es función de estado y solo depende de los estados inicial y final del sistema. La variación de energía libre de un sistema: ∆G = ∆H - T∆S. Igual que ∆Hof, ∆Gof es aditiva; se trata de una medida de la estabilidad de un compuesto respecto a sus elementos. Cuando ∆Gof <0, el compuesto es estable. ∆𝐺𝑅𝑜 = 𝑛𝑝 ∆𝐺𝑓𝑜 ሺ𝑃ሻ − 𝑛𝑟 ∆𝐺𝑓𝑜 ሺ𝑅ሻ La entropía determina la proporción de energía que no puede extraerse de un sistema, que se degrada por lo que ya no resulta útil. 6.1 y 6.2 Criterio de espontaneidad e influencia de la temperatura Para que un proceso sea espontáneo, su ∆G debe disminuir. Cuando ∆G=0, el sistema ha alcanzado el equilibrio y ya no evoluciona. ∆H ∆S ∆G ∆H < 0 ∆S > 0 ∆G < 0 siempre ∆H < 0 ∆S < 0 Depende de T ∆H > 0 ∆S > 0 Depende de T ∆H > 0 ∆S < 0 ∆G > 0 siempre 7. APLICACIONES DE LA ESPONTANEIDAD DE LAS REACCIONES · Máquinas térmicas. Intercambio de calor entre dos focos. El proceso espontáneo consiste en extraer calor del foco caliente y cederlo al foco frío. · Procesos biológicos. La fotosíntesis es un proceso no espontáneo en el que la entropía disminuye. · Reservas de combustibles. Las combustiones son procesos muy espontáneos y exotérmicos que requieren de un pequeño aporte de energía (chispa) para superar la energía de activación del proceso. PROBLEMAS EBAU TERMODINÁMICA 1. ANDALUCÍA 2007 2. ANDALUCÍA 2007 3. ANDALUCÍA 2007 4. ANDALUCÍA 2007 5. ANDALUCÍA 2007 6. ANDALUCÍA 2007 7. ANDALUCÍA 2007 8. ARAGÓN 2023 SOLUCIONES 1. 2. 3. 4. 5. 6. 7.