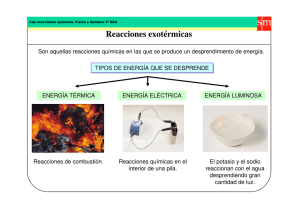
Ecuaciones y Reacciones químicas Objetivo : - Interpreta un cambio químico a través de una ecuación química - Clasifica las reacciones químicas según el cambio químico que ocurre. - Balancea ecuaciones químicas por simple inspección Las reacciones químicas se deben a interacciones entre moléculas, átomos e iones; los cuales dan lugar a nuevas moléculas, átomos e iones. Así al combinarse ciertas sustancias ocurre cambios químicos o reacciones químicas en que los átomos se agrupan para originar nuevas sustancias. Para representar las reacciones químicas se recurre a las ecuaciones químicas. Una ecuación química son notaciones abreviadas usadas para describir las reacciones químicas. Terminología o simbología Significado Reactivos Del lado izquierdo de la reacción Productos Del lado derecho de la reacción Reacción irreversible Reacción reversible Catalizador Mn Indica un catalizador arriba de la flecha (ac) Solución acuosa (l) Liquido (s) Sólido (g) o Gas o liberación de gas Precipitado o solido insoluble en la solución º Calor necesario Ejemplo Determine las partes y los componentes de la ecuación Hierro más azufre Fe(s) + Ss) Hierro solido produce azufre en polvo __________________________ Reactivos sulfuro ferroso FeS(s) sulfuro ferroso solido ___________________ productos Balance de ecuaciones químicas por el método de simple inspección o tanteo Este método consiste en contar y comparar el número de átomos de cada elemento en ambos lados de la ecuación. Para igualar aquellos elementos que no están balanceados , se colocan coeficientes delante de la fórmula para conseguir el equilibrio de los átomos. Ejemplo: H2 g) + l 2 (g) 2Hl (g) Reacciones reversibles e irreversibles a.- Las Rx. Reversibles son aquellas donde se realizan simultáneamente en dos sentidos. Ejemplo: H2 g) + Cl 2 (g) 2HCl (g) b.- Las rx. Irreversibles son aquellas donde los reactivos reaccionan completamente para convertirse en productos. Ejemplo: K (g) + H2 O (l) KOH(ac) + H2 (g) Rx. Químicas donde se intercambia calor: a. Rx . exotérmicas: es cuando una reacción química se produce o libera calor. Ejemplo: combustión, fermentación , respiración. H< 0 2 Cu (s) + CO2 (g) C (s) + 2 CuO (s) H = - 200 kJ/mol b.- Rx. Endotérmicas : estas reacciones necesitan energía para que ocurra las transformaciones químicas. Ejemplo: la fotosíntesis. H>0 6CO2 (g) + 6H2 O (l) C6 H12 O6 (s) + O2 (s) H = + 200 kJ/mol aller # 5 Reacciones y ecuaciones químicas I parte Identifique el significado de cada símbolo en las siguientes ecuaciones químicas. a.- 2 K ClO3 (s) 2K Cl (ac) b.- 3H2 (g) + N2 (g) c.- Fe(C2 H3 O2)2 (ac) + II parte + 3O 2 (g) 2NH 3 (g) 2 K I Ac) Fe I 2 (s) + 2 K C2 H3 O2 (ac) balancee por simple inspección o tanteo las siguientes ecuaciones: 1.- MgCl2 (ac) + (NH 4)2 CO 3 (ac) 2.- Al(s) + O2(g) MgCO 3(s) Cu(NO 3) 2 (ac) 4.- PCl5(s) + H 2O l) H3 PO 4 (ac) )5- TiCl4 l) TiO 2 (s) + 7.- Ni(s) Ni3 N2 (s) 8.- Sb2 O3 (s) + NaO H(ac) K Cl (s) H Cl (g) Fe3( PO 4) 2 (s) N2(g) + + HCl (g 6.- FeCl2 (ac) + Na3 PO 4 (ac) + NH4 Cl (ac) Al2 O3 (s) 3.- KNO3 (ac) + CuCl 2 ( ac) + H 2 O(l) + NaSbO2 (ac) 9- MnO2(s) + Al (s) Al2 O 3 (s) 10.- CaC2 (s) + H2 O (l) C2H 2 (g) + Na Cl (ac) + H2 O l) + Mn (s) + Ca(OH) 2 (ac) III Parte Indique si las siguientes Rx. absorben o liberan calor o sea endotérmicas o exotérmicas 1.- C(s) + O2(g) CO2 (g) H = - 94,1 kcal C6 H12 (g) H = + 206kcal 2- C2 H6 (g) + 3H2(g) 3.- 2H2(g) + O2(g) 2H2 O(g) H = + 115,6 kcal 4.- 2F(g) + O2(g) 2OF2 (g) H = - 46 kcal 5 – N2(g) + 2 O2(g) 2 NO2 (g) H = - 16,2kcal