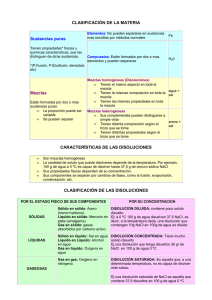
SOLUCIONES O DISOLUCIONES I. INTRODUCCION Una disolución es una dispersión homogénea de un soluto en un disolvente. El soluto es la sustancia que se encuentra en menor proporción en una disolución, es la fase dispersa. El disolvente o fase dispersante es la sustancia que se encuentra en mayor proporción. En la Figura 1 se muestra la representación de una disolución; ten en cuenta que se tienen muchísimas más partículas azules (representan al disolvente) que anaranjadas (representan al soluto). Las disoluciones que conoces más comúnmente son las de un sólido disuelto en un líquido, sin embargo, también se tienen de un gas disuelto en un gas o en un sólido, un líquido disuelto en otro líquido, en un gas o en un sólido, y un sólido disuelto en otro sólido o en un gas, como se explicó en el tema de mezclas. (Gutiérrez Franco & López Cuevas, 2017) Una solución se define como una mezcla íntima y homogénea de dos o más sustancias. Estas sustancias pueden hallarse en forma de átomos (como el cobre y el zinc que forman el latón), iones (como el cloruro de sodio disuelto en agua) o moléculas (como el azúcar de mesa disuelta en agua). En las soluciones verdaderas, la mezcla es íntima hasta el nivel de los átomos, iones y moléculas individuales. Por ejemplo, en una solución de sal o de azúcar en agua no hay masas de cristales flotando por ahí, sino iones individuales de sal y moléculas de azúcar distribuidos al azar entre las moléculas de agua. ( BURNS, 2011) Una solución o disolución se caracteriza por ser un sistema químico homogéneo, también denominado sistema monofásico. En este tipo de sistema, cada porción elemental de su volumen, por más pequeña que sea, presenta una composición química y propiedades idénticas a las de cualquier otra parte del mismo. Este estado homogéneo se alcanza mediante la mezcla de dos o más sustancias en proporciones variables, dando como resultado una mezcla uniforme con características consistentes en toda su extensión. Esta uniformidad es fundamental para entender y predecir el comportamiento de las disoluciones en diferentes contextos químicos y físicos. (Hurtado, Cortez, de la Cruz, 2018) Molaridad (M) El método más común que los químicos emplean para expresar la concentración de las soluciones es la molaridad (se abrevia M), la cual se define como el número de moles de soluto disueltos en un litro de solución. 𝑀𝑜𝑙𝑎𝑟𝑖𝑎𝑑𝑎 (𝑀) = 𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑠𝑢𝑙𝑢𝑡𝑜 𝑙𝑖𝑡𝑟𝑜𝑠 𝑑𝑒 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 Porcentaje en volumen Se enfoca en la proporción de volumen del soluto con respecto al volumen total en una solución. 𝑃𝑜𝑟𝑐𝑒𝑛𝑡𝑎𝑗𝑒 𝑒𝑛 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 (𝑣⁄𝑣) = 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 × 100% 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑡𝑜𝑡𝑎𝑙 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Porcentaje en masa El porcentaje en masa de soluto es la proporción de la masa del soluto en relación con la masa total de la solución. 𝑃𝑜𝑟𝑐𝑒𝑛𝑡𝑎𝑗𝑒 𝑒𝑛 𝑚𝑎𝑠𝑎(𝑝⁄𝑝) = 𝑚𝑎𝑠𝑎 𝑑𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 × 100% 𝑚𝑎𝑠𝑎 𝑡𝑜𝑡𝑎𝑙 𝑑𝑒 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 Porcentaje en peso/volumen El porcentaje de peso/volumen se refiere a la proporción de masa o volumen del soluto respecto a la masa o volumen total de la disolución. 𝑝𝑒𝑠𝑜 𝑑𝑒 𝑙𝑢𝑡𝑜 𝑃𝑜𝑟𝑐𝑒𝑛𝑡𝑎𝑗𝑒 𝑒𝑛 𝑝𝑒𝑠𝑜⁄𝑣𝑜𝑙𝑢𝑚𝑒𝑛 (𝑝⁄𝑣) = 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 𝑑𝑒 𝑙𝑎 𝑑𝑖𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 (𝑚𝑙) × 100% Normalidad (N) Cuantifica la cantidad de equivalentes de soluto puro presentes en un litro de solución. 𝑁𝑜𝑟𝑚𝑎𝑙𝑖𝑑𝑎𝑑 (𝑁) = 𝑛𝑢𝑚𝑒𝑟𝑜 𝑑𝑒 𝑒𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑡𝑒𝑠 (𝑔) 𝑙𝑖𝑡𝑟𝑜𝑠 𝑑𝑒 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 (𝑙) II. OBJETIVO Garantizar la preparación de una solución de cloruro de sodio de alta pureza y precisión, que sea adecuada para su uso en un experimento específico en el laboratorio. Cada paso está diseñado para asegurar la exactitud y la consistencia en la preparación de la solución. Esto incluye la descontaminación de los dispositivos de laboratorio para evitar cualquier contaminación externa, la determinación precisa de la masa de la sal, la disolución cuidadosa en agua y el ajuste del volumen final de la solución. III. METODOLOGIA a) Materiales • Vaso precipitado • Cuentagotas • Fiola b) Equipos • Balanza analítica c) Reactivos • NaCl (sal de mesa) • Agua destilada 3.1. PROCEDIMENTO • En el primer paso, procedemos a realizar una meticulosa descontaminación de todos los dispositivos de laboratorio pertinentes, con el fin de garantizar la pureza del proceso en la preparación de la solución. • En el segundo paso, procedemos a la cuidadosa manipulación de la sal, donde se procede a determinar su masa exacta mediante un análisis gravimétrico, siendo en este caso de 0.2931 gramos. • En el tercer paso, llevamos a cabo la disolución de la sal previamente pesada en 10 mililitros de agua dentro de un recipiente de precipitados, seguido de su trasvase a una fiola. • En el cuarto paso, se realiza un enjuague meticuloso del recipiente de precipitados por tres veces utilizando igualmente 10 mililitros de agua, vertiendo los lavados a la misma fiola hasta alcanzar un volumen total de 40 mililitros. • En el quinto paso, completamos el volumen de la solución a 50 mililitros, añadiendo agua hasta alcanzar el volumen deseado, procediendo luego a su ajuste mediante el aforo. • Finalmente, en el sexto paso, se concluye la preparación de la solución de cloruro de sodio, lista para su utilización en el experimento planificado. IV. RESULTADO Calcular el peso de NaCl con los siguientes datos: NaCl 99.9% ⟶ 100 L NaCL 0.1M 0,5% Usaremos las siguientes formulas: 𝑀= 𝑛° 𝑣(𝑙) (1) 𝑛° = 𝑊 𝑃𝑀 (2) Reemplazamos: En (1) 0,1 𝑀 = 𝑛° 1𝑙 0,1 𝑀(1𝑙) = 𝑛° 0,1 𝑚𝑜𝑙 = 𝑛° En (2) 0,1 𝑚𝑜𝑙 = 𝑊𝑁𝑎𝐶𝑙 58,44 𝑔/𝑚𝑜𝑙 0,1 𝑚𝑜𝑙(58,44 𝑔/𝑚𝑜𝑙) = 𝑊𝑁𝑎𝐶𝑙 5,844 𝑔 = 𝑊𝑁𝑎𝐶𝑙 ¿Cuánto de NaCl 99.9% necesitamos para preparar 50 ml de solución NaCl 0.1M? 𝑀= 𝑛° 𝑣(𝑙) 0,1 𝑚𝑜𝑙 = 𝑛° 0,05 𝑙 0,1 𝑚𝑜𝑙(0,05 𝑙) = 𝑛° 0,005 𝑚𝑜𝑙 = 𝑛° 𝑛° = 0,005 𝑚𝑜𝑙 = 𝑊 𝑃𝑀 𝑊𝑁𝑎𝐶𝑙 58,44 𝑔/𝑚𝑜𝑙 0,005 𝑚𝑜𝑙(58,44 𝑔⁄𝑚𝑜𝑙) = 𝑊𝑁𝑎𝐶𝑙 0,2922 = 𝑊𝑁𝑎𝐶𝑙 Calcular la molaridad en la solución si el peso real de NaCl es 0.2922 g 𝑀= 𝑛° 𝑣(𝑙) (1) 𝑛° = 𝑊 𝑃𝑀 (2) En (2) 𝑛° = 0,2922 𝑔 58,44𝑔/𝑚𝑜𝑙 𝑛° = 0,005 𝑚𝑜𝑙 En (1) 𝑀= 0,005 𝑚𝑜𝑙 0,05 𝑙 𝑀 = 0,1𝑚𝑜𝑙. 𝑙 ∴ La molaridad de la solución es 0,1 𝑚𝑜𝑙. 𝑙. V. CONCLUCION • Para preparar 50 ml de una solución de NaCl 0.1M, se necesitan aproximadamente 0.2922 gramos de NaCl con un porcentaje de pureza del 99.9% para que la relación sea exacta de 0,1 𝑚𝑜𝑙. 𝑙. VI. BIBLIOGRAFIA BURNS, R. (2011). Fundamentos de quimica. Mexico: Pearson Educación de México, S.A. Gutiérrez Franco, M. E., & López Cuevas, L. (2017). Química 2. México: Pearson Educación. Hurtado, M. E., Cortez, A. B., de la Cruz, E. D., & Poémape, C. R. (2018). Química El nuevo enfoque universitario. La Libertad.