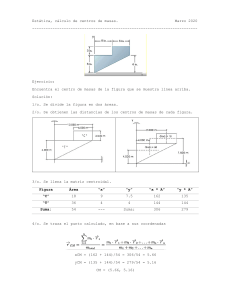
LEYES PONDERALES DE LA QUÍMICA Son aquellas que rigen el comportamiento de la materia en los cambios químicos, en función de las masas de las sustancias que participan 1. Ley de Lavoisier Conocida como ley de la conservación de la masa, establece que: “Siempre que ocurre un cambio químico, la masa total de las sustancias reaccionantes, es exactamente igual a la masa total de las sustancias que se producen en la reacción”. 2. Ley de Proust Conocida como ley de las Proporciones definidas o composición constante, esta ley establece que: “Un compuesto químico, siempre contiene los mismos elementos combinados en la misma proporción de masa”. Esto significa, por ejemplo que cualquier muestra de agua, sea cual fuere el sitio de donde se la obtenga, siempre tendrá 88,82% de Oxígeno y 11,18% de Hidrógeno, por lo que su composición nunca variará. DETERMINACION DE LA COMPOSICION CENTESIMAL: Cuando la fórmula de un compuesto es conocida, el porcentaje de cada uno de los elementos del compuesto, se calcula aplicando la siguiente ecuación: %𝐸𝑙𝑒𝑚𝑒𝑛𝑡𝑜 = (𝑁° á𝑡𝑜𝑚𝑜𝑠)(𝑃𝑒𝑠𝑜 𝑎𝑡ó𝑚𝑖𝑐𝑜) 𝑥 100 𝑃𝑒𝑠𝑜 𝑚𝑜𝑙𝑒𝑐𝑢𝑙𝑎𝑟 3. Ley de las proporciones múltiples “Cuando dos elementos se combinan entre sí para formar más de un compuesto, las masas de un elemento que se combinan con una masa fija del otro elemento en los diferentes compuestos guardan una relación de números enteros pequeños”. 𝐶𝑙 𝑂 Cloro= constante 𝐶𝑙 𝑂 𝐶𝑙 𝑂 Oxígeno= varía de 1,3,5 y 7 𝐶𝑙 𝑂 4. Ley de Ricther Conocida como ley de las Proporciones reciprocas, establece que: “Las masas de los elementos diferentes que se combinan con la misma masa de un elemento dado, son las mismas que reaccionaran entre sí, múltiplos o submúltiplos de esas masas para obtener otros compuestos”. + 2𝐻 𝑂 4g 2g 12 g 32 g 16 g 96 g 2𝐻 𝑂 36 g 18 g 108 g 5. Ley Volumétrica de Gay Lussac Conocida como ley de los Volúmenes de combinación, establece que: “Bajo las mismas condiciones de presión y temperatura, los volúmenes de los gases que reaccionan entre si y de sus productos gaseosos están en la relación de números enteros simples y sencillos”. 6. Ley de Avogadro Establece que: “Volúmenes iguales de gases, en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas”. + 𝑁 1 mol 1 volumen 3𝐻 3 mol 3 volúmenes Referencia Bibliográfica: Escobar, L. (2014). Fundamentos de Química General. Ed. López. 2𝑁𝐻 2 mol 2 volúmenes