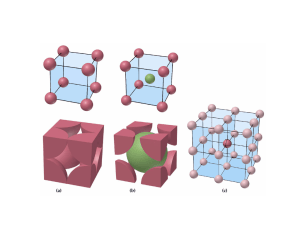
TEMA 3. ESTRUCTURA DE LOS SÓLIDOS 1. INTRODUCCIÓN ¿Por qué estudiar los sólidos? • • • Todos los compuestos son sólidos en condiciones adecuadas de P y T. Muchos sólo existen como sólidos. La mayoría de los materiales que nos rodean son sólidos Los sólidos, especialmente los cristales, han sido siempre fascinantes Los materiales actuales cubren un rango muy amplio de propiedades: • • Propiedades Mecánicas o Metales/Aleaciones: Titanio, hierro, cobre. o Cemento: Ca3 SiO5 o Cerámicas, arcillas, silicatos o Lubricantes: Grafito, Sulfuros de Molibdeno o Abrasivos: SiC, Diamante, Corindón Propiedades Eléctricas o Conductores: Cu, Ag. o Semiconductores: Si, GaAs. o Superconductores: Nb3 Sn, YBa2Cu3O7 , Bi2Sr2Ca2Cu3O10 o Electrolitos sólidos LiI o Piezoeléctricos: a Cuarzo (SiO2 ). Estudio de los sólidos: categorías según sus propiedades. • • • • Propiedades Ópticas o Pigmentos: TiO2, o Luminóforos: Y2O3 :Eu o Láseres: YAG: Nd o Dobladores de frecuencia: LiNbO3 Catalizadores o Zeolitas, perovskitas Propiedades Magnéticas o CrO2 , Fe3O4 para almacenamiento de información o Magnetoresistivos Sensores o Sensores de oxígeno (disolución sólida ZrO2 /CaO ) CLASIFICACIÓN EXTENSIVA: Ineficaz Estructura de un solido: diferentes niveles • Estructura atómica o Distribución de los átomos en el sólido red cristalina o Varios sólido + Diferente organización Diferente comportamiento Misma fórmula de los átomos y propiedades o SiO2 -> cuarzo ▪ Transparente Vis, Uv ▪ Material Óptico ▪ Ordenación de los átomos muy compacta y estricta: elevada cristalinidad o Sílices porosas ▪ Elevada superficie (1000m2 /g) ▪ Tamiz molecular selectivo ▪ Ordenación de átomos muy abierta y poco estricta: poros de tamaño muy homogéneo o Grafito ▪ Negro ▪ Conductividad eléctrica ▪ Exfoliación: lubricante sólido ▪ Reactividad frente a la intercalación ▪ DIAMANTE: Incoloro, Aislante eléctrico, Muy duro ▪ NITRURO DE BORO: Blanco, Aislante eléctrico, No reactivo para intercalación, Estable hasta altas temperaturas (refractarios y lubricantes a T altas) La relación ESTRUCTURA-PROPIEDADES es muy importante, no es biunívoca Aplicación práctica ESTRUCTURA ELECTRÓNICA Nuevo nivel estructural Propiedades físico/químicas Estructura Materiales (Relación entre propiedades y estructuras) • • Estructura microscópica o Alta resistencia a la compresión o Elevada fluidez a la temperatura de colada o Frágiles -> Baja resistencia a la tracción. o Dúctil-> Resistente a la tracción o FUNDICIONES: Hierro con más de 2.1% de carbono Estructura macroscópica o La materia en estado condensado se muestra con morfologías diferentes ->CONFORMADO: así diferentes propiedades según el conformado. o Diferente resistencia mecánica según la sección o el perfil o Diferente reactividad según el estado de agregación (Reactividad aluminio polvo> Reactividad laminas aluminio) 2. TIPOS DE SÓLIDOS 2.1. Según su estructura electrónica -> Características de enlace • • ELECTRONEGATIVIDAD: capacidad de un átomo de atraer hacia sí los electrones de enlace. El TIPO DE ENLACE entre dos átomos dependerá de su DIFERENTE ELECTRONEGATIVIDAD. 2.2. Según su estructura atómica -> Ordenación de los átomos (iones) • Sólidos cristalinos o PERIODICIDAD: a lo largo de cada dirección los motivos átomos o grupos de átomos) se encuentran a distancias fijas. o HOMOGENEIDAD: cada motivo está rodeado del mismo número y tipo de motivos. o ANISOTROPÍA: la distancia entre los motivos depende de la dirección según la que mida. ORDEN A LARGO ALCANCE • Sólidos amorfos -> átomo dispuesto de forma no periódica ORDEN A CORTO ALCANCE 3. QUÍMICA ESTRUCTURAL Se trata de la ciencia que estudia las estructuras atómicas. • • • Descripción del orden espacial de los átomos Razones que llevan a ese orden Propiedades que resultan de ese orden Clasificación sistemática de los tipos estructurales Aplicación Relaciones entre los tipos estructurales moléculas de sólidos. Herramientas periodicidad (repetición regular de un motivo), simetría (armonía en la proporción y distribución entre las partes de un conjunto) Cristal:sólido cuyos componentes se disponen de forma periódica • • MOTIVO -> unidad estructural que se repite RETÍCULO -> periodicidad del motivo ESTRUCTURA CRISTALINA-> posición de los átomos en el sólido CELDA UNIDAD: reproduce completamente el cristal cuando se repite de forma periódica en las tres direcciones del espacio. Se trata de la parte más pequeña de un cristal que posee todas las propiedades de simetría del mismo. • • • • Volumen mínimo Máxima simetría Elementos que definen una celda-> parámetros de celda o Dos vectores que definen un paralelogramo o Ángulo que forman los vectores Tipos de celda A-> 1 B-> 2 C->2 D->1 Si combinamos diferentes geometrías y diferentes centrados tenemos 5 celdas posibles: jPosición de los motivos en la celda: ▪ ▪ Un solo motivo por celda: no es relevante Unidades enteras de los parámetros de celda o sumas de ambos ▪ Varios motivos: si es relevante indicar la posición o Necesidad de indicar los motivos respecto de los ejes o Ejes de referencia-> parámetros de celda o Ejes de posición -> coordenadas relativas Distáncia entre motivos ▪ ▪ RED BIDIMENSIONAL -> dos posibles elecciónes RED TRIDIMENSIONAL-> apilamiento de capes 3.1. Sistemas cristalográficos 3.2. Tipos de celda + pág.41 4. CRISTALOQUÍMICA DESCRIPTIVA • • • Toda la información necesaria en la CELDA UNIDAD Punto de vista químico: mejor visualización de la estructura con porciones más extensas. o enfatizar características propias de los átomos. o relacionar estructuras -> “tipos estructurales” y “estructuras derivadas” Descripción alternativa DOS MODELOS: o EMPAQUETAMIENTO COMPACTO DE ESFERAS o POLIEDROS DE COORDINACIÓN CONCATENADOS. o son aproximaciones o individualmente no son útiles en todos los casos o son complementarios 4.1. Modelo de empaquetamiento compacto de ESFERAS POSTULADOS: • • • • uso más eficaz del espacio máxima simetría mayor número de contactos esferas rígidas e idénticas 1º CAPA DE EMPAQUETAMIENTO COMPACTO 2ºCAPA DE EMPAQUETAMIENTO COMPACTO 3ºCAPA DE EMPAQUETAMIENTO COMPACTO • Índice de coordinación de cada esfera=12 • Porcentaje máximo de ocupación del espacio= 74% 4.1.1. Celdas de empaquetamiento compacto: HEXAGONAL ABABAB.... (HCP) Empaquetamiento hexagonal compacto •La celda unidad que corresponde a este empaquetamiento es Hexagonal a= b, c = 1.63 a, α= β = 90 °, µ = 120 4.1.2. Celdas de empaquetamiento compacto: CÚBICO ABCABC…(CCP) empaquetamiento cúbico compacto •La celda unidad que corresponde a este empaquetamiento es Cubica centrada en las caras. a = b =c, α = β = µ = 90° 4.1.3. Localización de huecos en la estructura CCP 4.1.4. Localización de huecos en la estructura hexagonal compacta 4.1.5. Empaquetamiento no compacto de esferas • • • 4.1.6. Sólidos que se pueden describir como empaquetamiento compacto de esferas. Metales o Buena aproximación al modelo Sólidos moleculares o Buena aproximación para moléculas muy simétricas. o Kitaigorodskii: Adaptación a moléculas no simétricas. o Átomos: gases nobles-> todos, menos el He, tienen estructura de Empaquetamiento Cúbico Compacto. Nº de coordinación molecular = 12 (3+6+3, igual que en los empaquetamientos compactos de esferas). En el plano 6 o Moléculas simétricas: buena aproximación, CH4, H2 Sólidos iónicos o Adaptación del modelo: Empaquetamiento Compacto de aniones, cationes en los huecos. o Tipo del hueco a ocupar: relación de radios iónicos. 4.1.7. Estructuras derivadas de empaquetamiento compacto 5. ESTRUCTURAS 5.1. Estructura tipo NaCl • • Cúbico compacto ABCABC… Empaquetamiento cúbico compacto de ClNa+ en todos los huecos octaédricos • Cl-: rodeado de 6 Na+. • Na+: rodeado de 6 Cl-. • Posiciones de Cl- y Na+ equivalentes (se pueden intercambiar). • Na4Cl4 -> NaCl • Compuestos con estructura NaCl: o Haluros alcalinos MX (Exc. Cs) y AgF, AgCl,AgBr o Hidruros alcalinos MH o Monóxidos (MO) y monosulfuros (MS) de Mg,Ca, Sr, Ba 5.2. Estructura tipo NiAs • Hexagonal compacto ABAB… • Empaquetamiento compacto de átomos de As. Átomos de Ni los huecos octaédricos. • Ni: rodeado de 6 As. • As: rodeado de 6 Ni. • Las posiciones de cationes y aniones no son intercambiables. • Ni: entorno octaédrico • As: prisma trigonal • Estructura tipo AX 5.3. Estructura tipo Wurtzita (ZnS) • Empaquetamiento hexagonal compacto de átomos de S átomos de Zn los huecos tetraédricos • S: rodeado de 4 Zn. BeO, ZnO, NH4F • Zn: rodeado de 4 S. • Las posiciones de cationes y aniones son intercambiables. • Zn: entorno tetraédrico // S: entorno tetraédrico 5.4. Estructura tipo Blenda de Zinc (ZnS) • Estructura tipo AX • Empaquetamiento cúbico compacto de átomos de S. átomos de Zn los huecos tetraédricos • S: rodeado de 4 Zn. • Zn: rodeado de 4 S. • Las posiciones de cationes y aniones son intercambiables. • Zn: entorno tetraédrico • S: entorno tetraédrico • Blenda y wurzita sólo se diferencian en la secuencia del empaquetamiento. Son dos estructuras muy próximas energéticamente. 5.5. Estructura tipo Fluorita (CaF2) • • Estructura tipo AX2 Empaquetamiento cúbico compacto de Ca2+ F- en todos los huecos tetraédricos. • coordinación del F tetraédrica (IC=4). • coordinación del Ca es un cubo (IC=8). • todos los huecos octaédricos de la estructura están vacantes. Estructura tipo Antifluorita (Na2O): • Empaquetamiento cúbico compacto de O2• Na+ en todos los huecos tetraédricos 5.6. Estructura tipo CsCl • Cada átomo de Cs está rodeado de: 8 átomos de Cl (d = 3.56 Å). • Otros compuestos que cristalizan en esta estructura son: CsBr, CsI, TlCl, TlBr, TlI y NH4Cl • Los compuestos con cationes voluminosos: pueden acomodar en su entorno hasta ocho aniones. • IC=14 -> 68% espacio • Huecos octaédricos y tetraédricos • No empaquetamiento compacto • Estructura cúbica centrada en el cuerpo 6. MODELO DE ENTRAMADO DE POLIMEROS DE COORDINACIÓN • • • Modelo alternativo y complementario. Desarrollado para estructuras “iónicas”. Herramientas: o Unidades fundamentales de construcción: ▪ Poliedros de aniones alrededor de cada catión • menor tamaño de los cationes-> definen la coordinación. • varios cationes diferentes, un solo anión. o Formación de entramados 3d ▪ Compartición de elementos estructurales entre los poliedros. • vértices, aristas o caras. 6.1. Poliedros alrededor de un catión Los más habituales son los tetraédricos y octaédricos 6.2. Formación de estructuras por compartición de vértices de octaedros • • • Formación de cadenas: cada octaedro comparte dos vértices en trans Formación de planos: cada cadena comparte dos vértices en trans (por octaedro) con otras tantas cadenas. Formación de Redes Tridimensionales: los octaedros comparten todos los vértices con seis octaedros diferentes. (Sólo comparten vértices) 6.3. Formación de estructuras por compartición de aristas de octaedros • • • Formación de cadenas: cada octaedro comparte dos aristas en trans. Formación de planos: cada cadena comparte dos aristas en cis (por octaedro) con otras tantas cadenas Formación de Redes Tridimensionales: o Cara sobre cara (NiAs) o Cara sobre hueco (NaCl) 6.4. Otras formas de conectar octaedros • • Cadenas por compartición de aristas Compartición de vértices entre cadenas 6.5. Formación de estructuras por compartición de vértices de tetraedros BLENDA WURZITA CaF2