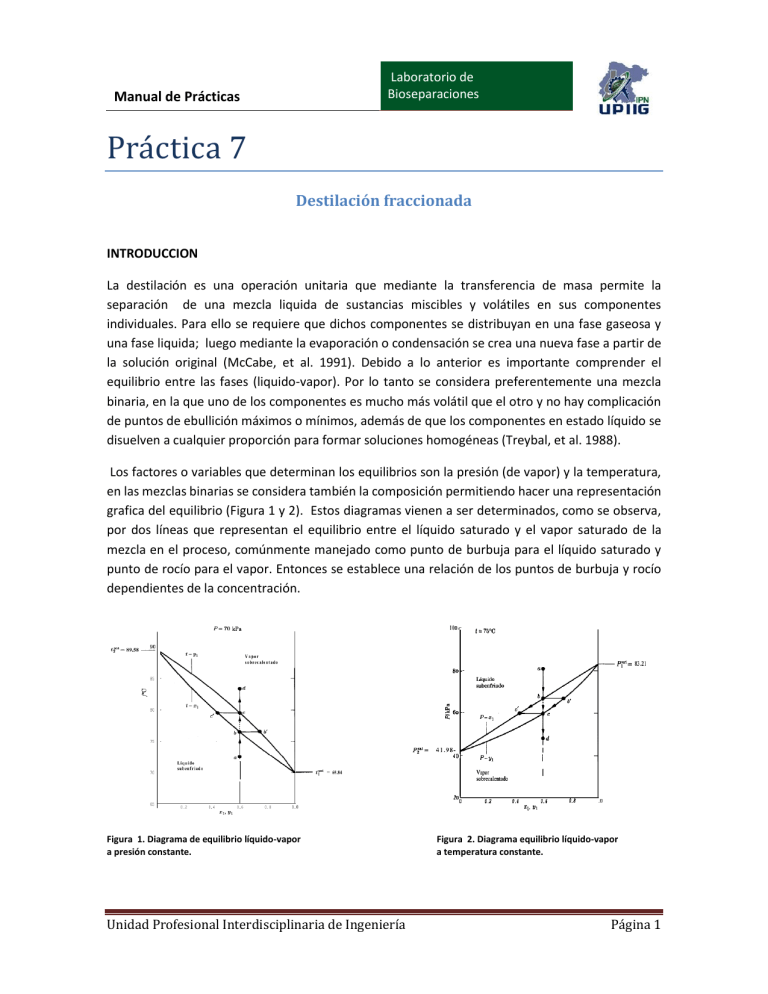
Laboratorio de Bioseparaciones Manual de Prácticas Prácticá 7 Destilación fraccionada INTRODUCCION La destilación es una operación unitaria que mediante la transferencia de masa permite la separación de una mezcla liquida de sustancias miscibles y volátiles en sus componentes individuales. Para ello se requiere que dichos componentes se distribuyan en una fase gaseosa y una fase liquida; luego mediante la evaporación o condensación se crea una nueva fase a partir de la solución original (McCabe, et al. 1991). Debido a lo anterior es importante comprender el equilibrio entre las fases (liquido-vapor). Por lo tanto se considera preferentemente una mezcla binaria, en la que uno de los componentes es mucho más volátil que el otro y no hay complicación de puntos de ebullición máximos o mínimos, además de que los componentes en estado líquido se disuelven a cualquier proporción para formar soluciones homogéneas (Treybal, et al. 1988). Los factores o variables que determinan los equilibrios son la presión (de vapor) y la temperatura, en las mezclas binarias se considera también la composición permitiendo hacer una representación grafica del equilibrio (Figura 1 y 2). Estos diagramas vienen a ser determinados, como se observa, por dos líneas que representan el equilibrio entre el líquido saturado y el vapor saturado de la mezcla en el proceso, comúnmente manejado como punto de burbuja para el líquido saturado y punto de rocío para el vapor. Entonces se establece una relación de los puntos de burbuja y rocío dependientes de la concentración. Figura 1. Diagrama de equilibrio líquido-vapor a presión constante. Unidad Profesional Interdisciplinaria de Ingeniería Figura 2. Diagrama equilibrio líquido-vapor a temperatura constante. Página 1 Laboratorio de Bioseparaciones Manual de Prácticas Para la construcción de dichos diagramas se requiere por tanto determinar las temperaturas, las composiciones y las presiones de vapor de los elementos de la mezcla a través de la Ley de Antoine y/o de la Ley de Raoult dependiendo de las consideraciones que se hagan (Smith, et al., 1996 ). En la destilación deben ser aplicados balances tanto de materia como de energía para conocer el comportamiento de los fenómenos de transferencia de ambas. Para ello se considerará en el sistema los flujos másicos o volumétricos, caloríficos y composiciones entrantes y salientes, temperaturas o presiones según sea el caso. Un balance sencillo de materia y energía se muestra a continuación de acuerdo con la figura 3. BALANCE TOTAL F=D+W Para el componente A FzF= DzD + Wxw Balance de entalpía QB + FHF = DHD, + WHW, + QC + QL Donde QL representa todas las pérdidas de energía del sistema. Condensador Q G1, Y1,HG1 D Des ) Enrique D, zD, HD tilad Ln G n+1L cimient Alim o(mol/tiempo) xn Yn+1o F, zF, HF oenta QP H Hyn+1x (mol/tiempo) ción Lm Ğm+1 (Ener oAgotam Res xm Ym+1 gíat/i iento W, x , H iduo W W empo HRehervidor H HQ (energía /tiempo Ln Lm ym+1 (mol/tiempo) L W (energía/tiempo) ) o Figura 3. Componentes de un sistema de destilación con sus respectivas entradas y salidas de materia y energía. Los balances y por tanto la transferencia de masa y energía vendrán a ser afectados por condiciones propias del sistema como es el caso del reflujo pues determina las etapas que se deberán emplear Unidad Profesional Interdisciplinaria de Ingeniería Página 2 Manual de Prácticas Laboratorio de Bioseparaciones en el proceso y la eficiencia de operación de estas etapas que puede ser conocida mediante relaciones como la eficiencia global (ηo), local (η’) o la eficiencia de Murphree (ηM) (Treybal, et al. 1988). OBJETIVO GENERAL Identificar los mecanismos asociados con el proceso de destilación fraccionada en una columna de platos, relacionando los conceptos con las variables de operación al momento de efectuar el desarrollo experimental, permitiéndose colaborar en conjunto. Objetivos particulares • • • Describir los procesos de transferencia de masa y energía en un equilibrio líquido vapor que suceden en una columna de platos al efectuar una destilación fraccionada. Analizar la influencia del establecimiento de reflujo en las concentraciones finales de los productos de destilación. Conocer el valor de la eficiencia teórica (global y de cada plato) a través del uso de correlaciones y comparar estos valores con los obtenidos experimentalmente. MATERIALES Y EQUIPO Tubos eppendorf Refractómetro Cronómetro Multímetro 2 Probetas de 1000mL Sistema de Destilación Didáctico PS-DA-480/DEL Alcohol etílico Agua Cuestionario pre-laboratorio 1. ¿Cómo se definen Q’ , Q’’ y cuál es su expresión? Unidad Profesional Interdisciplinaria de Ingeniería Página 3 Manual de Prácticas Laboratorio de Bioseparaciones 2. Mencione las características necesarias en una mezcla para que se pueda separar por medio de destilación 3. ¿Qué datos se deben conocer para realizar un diagrama de composición a presión constante? 4. Mencione al menos 2 aplicaciones biotecnológicas de la destilación DESARROLLO EXPERIMENTAL 1.- Preparar 6L de mezcla agua-etanol a la proporción de 6:4, medir la refracción que presenta. Posteriormente transferir la mezcla total al hervidor 2.- Encender el hervidor hasta alcanzar, al menos, la temperatura 60°C para llevar a cabo una destilación lenta. 3.- Encender el flujo de la bomba que alimenta el condensador, así como colocar el reflujo a la máxima capacidad. 4.- Tomar muestras cada 10min de los platos de la torre de fraccionamiento. 5.- Colocar las muestras en el refractómetro y registrar la refracción. 6.- De ser necesario, tomar la refracción del extracto y del destilado. 7.- Realizar cálculos necesarios para cumplir con los objetivos. Cuestionario post- laboratorio 1. ¿Qué significa que las líneas de operación de toda la torre de destilación (sección de enriquecimiento y agotamiento) coincidan con la línea diagonal de 45° en un diagrama 𝑥 − 𝑦 de una curva de equilibrio? Discuta su respuesta. 2. ¿Qué es un azeotropo? ¿cuál es la diferencia entre azeotropos en mezclas con punto de ebullición máxima y con punto de ebullición mínima? 3. Bajo qué condiciones se da que ϕ = 1 y γ = 1, y ¿Qué implica al realizar cálculos de punto de roció y punto de burbuja? Referencias Unidad Profesional Interdisciplinaria de Ingeniería Página 4 Manual de Prácticas Laboratorio de Bioseparaciones Geankoplis, C. J. (2006). Procesos de transporte y principios de procesos de separación. México: Editorial Continental. Pedro J. Martínez de la Cuesta, E. R. (2004). Operaciones de separación en Ingeniería Química, Métodos de Cálculo. Madrid: Pearson Prentice Hall. Warren L. McCabe, J. C. (1991). Operaciones Unitarias en Ingeniería Química. Madrid: McGraw Hill. Treybal, R. (1998). Operaciones de transferencia de masa. Mc Graw Hill. Unidad Profesional Interdisciplinaria de Ingeniería Página 5


![practica 5[1]](http://s2.studylib.es/store/data/007425075_1-61f96af50a4c20310ac423e2aba15d52-300x300.png)