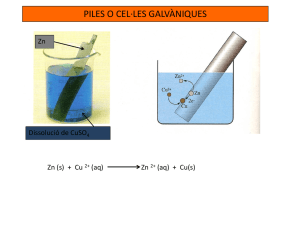
Recubrimientos metálicos en la Antigüedad Según Julve (2009): “La práctica de revestir un metal con otro metal o de un no-metal con un metal data de tiempos muy remotos, pudiéndose afirmar que la cerámica antigua fue el primer caso” (p. 227). El historiador Herodoto (padre de la historia) cuenta como, hacia el año 530 a.C., Polícrates de Samos engañó a los espartanos pagándoles con estáteras de plomo revestidas de oro. Este hecho no constituía un caso aislado pues parece ser que en aquella época la circulación de monedas griegas plateadas era relativamente común. Asimismo, en el imperio romano circulaban monedas oficiales llevando recubrimiento de plata. También los trofeos de la civilización protohistórica de Italia, de unos 3000 años de antigüedad, constituidos por enseres artísticos en los que el metal está unido a un material inerte como vasos y otras cerámicas decoradas con láminas metálicas dan fe de esta práctica. Luigi Galvani y la electricidad animal Luigi Galvani fue un anatomista y médico italiano que marcó el nacimiento de la electroquímica de forma científica al descubrir la electricidad animal Jiménez (2020) afirma: “El descubrimiento fue accidental, mientras disecaba una pata de rana; su bisturí tocó accidentalmente un gancho de bronce del que colgaba la pata, con lo cual se produjo una pequeña descarga, y la pata se contrajo espontáneamente” (párr. 2). Es así como inicia sus experimentos con ancas de ranas sometidas a la influencia de la electricidad artificial, producida con su máquina electrizante que estaba formada por dos metales diferentes y los fluidos naturales extraídos desde una rana disecada, lo cual provocaba que las extremidades convulsionaran. Mediante repetidos y consecuentes experimentos, Galvani identificó a la electricidad animal con la fuerza vital que animaba los músculos de la rana. Alessandro Volta y la pila voltaica El físico italiano Alessandro Giuseppe Volta invento la pila voltaica, la cual fue construida a partir del descubrimiento que hizo Luigi Galvani en la década de 1780 de cómo un circuito de dos metales y una pata de rana podían hacer que la pata de rana respondiera. Se sabe que Volta apiló varios pares de discos de cobre y zinc alternados, separados por cartón empapado en salmuera (la cual vendría a ser el electrolito), esto con la finalidad aumentar la conductividad del electrolito. Cuando los contactos superior e inferior estaban conectados por un cable, una corriente eléctrica fluía a través de la pila y el cable de conexión. Con esta pila se pudo lograr por primera vez un flujo más o menos constante de corriente eléctrica. John Daniell y la pila dependiente solo de iones metálicos Zinc-Cobre La pila Daniell o celda de Daniell, también llamada celda de gravedad fue inventada en 1836 John Frederic Daniell, un químico británico y meteorólogo. Esta pila significo una gran mejora sobre la pila voltaica que fue la primera celda galvánica desarrollada. La celda Daniell original consiste de un ánodo de zinc metálico central inmerso en una vasija de barro poroso que contiene una disolución de sulfato de zinc. La vasija de barro, a su vez, está sumergida en una disolución de sulfato de cobre contenida en una vasija de cobre de mayor diámetro, que actúa como cátodo de la celda. Para esto también se usó una barrera porosa (vasija de barro) que evitó que los iones de cobre de la disolución de sulfato de cobre alcancen el ánodo de zinc y sufran una reducción directa. Esto haría ineficaz la celda porque se llegaría al equilibrio y no se generaría la corriente eléctrica. Las semirreacciones que tienen lugar en esta son: Semirreacciones en la pila Daniell Electrodo (signo) Proceso químico Ánodo (electrodo negativo) Oxidación del Zn Semirreacción Potencial (V) Zn(s) → Zn2+(aq) + 2 e- Eº=-0,76 V Cátodo (electrodo positivo) Reducción del Cu2+ Cu2+(aq) + 2 e- → Cu(s) Eº=+0,34 V La fuerza electromotriz, o voltaje o tensión teórica de esta pila es de 1,10 voltios, y la reacción química que tiene lugar es: Zn (s) + Cu2+ (ac) Zn2+ (ac) + Cu (s) E° = 1,10 V