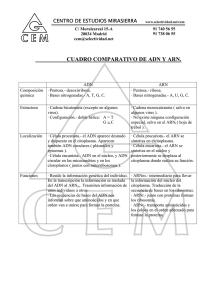
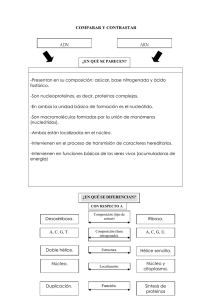
BC1 - 1RA PARTE MEMB PLASM Separa una cél del medio externo. En una cél eucarionte hay varias membs internas que compartimentalizan. Funciones: • recibir la info del medio extracelular • ingreso y egreso de susts de forma regulada • crecimiento y movilidad celular Estructura: modelo de mosaico fluido. Lípidos y prots, en > medida por HdC. Los lípidos se organizan en una bicapa lipídica y son barrera para molécs hidrosolubles. Las prots de la memb tienen diversas funciones: receptoras de señales externas, transportadoras de susts por la memb, prots de anclaje, etc. Los lípidos que están en la memb se dividen en 3 grupos: 1. fosfolípidos 2. Colesterol 3. Esfingolipidos (forman glucoesfingolipidos. Gangliosidos y cerebrosidos). Fosfolípidos: alcohol (glicerol) que se une a 2 ácidos grasos y a un grupo fosfato. Una de las cadenas hidrocarbonadas de los ácidos grasos suele tener un doble enlace entre 2 C, desvía la cadena. El grupo fosfato es la única parte polar de la moléc: cabeza hidrófila o polar, el resto es hidrofóbica: colas hidrofóbicas o no polares. Son molécs anfipáticas, tienen una parte hidrofílica y otra hidrofóbica. Hay ≠ tipos de fosfolípidos según el grupo que tengan unido al grupo fosfato, ej: la fosfatidiletanolamina, la fosfatidilserina o la fosfatidilcolina. La esfingomielina y la esfingosina son esfingolípidos derivados del esfingol al que se le unen ácidos grasos, antipáticos y pueden formar, junto con monosacáridos u oligosacáridos, los glucoesfingolipidos. Los fosfolípidos de la memb son antipáticos y toman su formación más estable en forma de bicapa, las cabezas polares actúan con el medio acuoso intra o extracelular y las colas hidrofóbicas interactúan entre sí. Los lípidos pueden rotar y moverse lat, pueden cambiar de una capa la otra (flip-flop). Colesterol: Tiene un grupo polar en un extremo, el resto es no polar. Está entre molécs de fosfolípidos, en el espacio que deja una cola hidrocarbonada insaturada. Dan rigidez a la memb. Cuanto más colesterol menos fluido será la memb. Glucolípidos: en la cara externa de la memb plasm, no hay HdC en la cara interna de la memb. Las 2 caras no son =. La bicapa es asimétrica por los lípidos en cada capa: fosfatidilserina, fosfatidiletanolamina, fosfatidilinositol solo están en la cara interna, fosfatidilcolina y colesterol están en ambas. La fluidez de la memb depende de varios factores: • disminuye a > cantidad de colesterol y esfingolipidos, • disminuye cuanto más largas son las colas hidrofóbicas de los fosfolípidos, • aumenta con el nro de enlaces dobles en los ácidos grasos del fosfolípido, no se unen fuertemente a las colas hidrocarbonadas con un doble enlace y genera una memb más fluida, • aumenta con la temperatura, aumenta el mov de las molécs en general. Glucocáliz: conjunto de HdC en la parte extracelular de la memb, siempre están unidos a lípidos y prots → glucolípidos, glucoprots y proteoglucanos. Funciones: crear un microambiente apto para la actividad de las enzimas que actúan en la matriz extracelular, proteger la cél del medio externo e intervenir en el reconocimiento cél-cél y en procesos de adhesión celular. PROTEINAS Dentro de las prots de la memb están las prots integrales o transmembs: atraviesan toda la memb plasm y están unidas covalentemente a ella, las prots extrínsecas o periféricas que no están fuertemente unidas a la memb y en general establecen uniones débiles con otras prots. Dentro de las prots integrales están las de paso simple, de paso múltiple, los canales, las unidas a lípidos. De ≠ maneras las prots periféricas se pueden 1 encontrar del lado citosólico de la memb o del lado extracelular. Las prots pueden difundir lateralmente en la bicapa. Una prot integral de memb tiene AA en contacto con los fosfolípidos de la memb que son no polares para poder interactuar con las colas hidrofóbicas de los lípidos; los AA que están por fuera de la bicapa están en contacto con el citosol y el medio extracelular son hidrofílicos para poder interactuar con el agua. Funciones: transportar una moléc por la memb, anclaje de la cél al asociarse con prots del citoesqueleto o con prots de la matriz extracelular, recibir señales del exterior y pasarlas al interior de la cél, enzimáticas. TRANSPORTE A TRAVES DE LA MEMB Los sts disueltos en un solvente tienden a igualar [] por una memb por la que hacen difusión simple al moverse del lugar de > [] al de < [], se mueven a favor del gradiente de [] y llegan al equilibrio. Son molécs pequeñas sin carga e hidrofóbicas. Las molécs pueden transportarse por difusión facilitada o transporte pasivo, hay prots que ayudan a atravesar las molécs en la memb, a favor del gradiente de [] y no se gasta energía. En el transporte activo, las molécs se mueven en contra del gradiente de [] con gasto energético. Las molécs polares más grandes como monosacáridos, aminoácidos, nucleótidos no pueden difundir por la memb, los iones aunque son pequeños tienen carga y esto hace que no puedan atravesar la memb. AGUA: OSMOSIS El H2O realiza difusión simple, ósmosis. Va a entrar a una cél con mucha [] de st respecto al medio externo celular, lo que puede hacer estallar la cél y va a salir con poco st respecto del medio externo. • • • Si el medio externo tiene la misma [st] que el interno de la cél, el medio es isotónico para la cél. [medio int] = [cél]. [medio int] > [cél]. Medio hipertónico. [medio int] < [cél]. Medio hipotónico TRANSPORTE PASIVO O DIFUSION FACILITADA Por 2 tipos de prots: Transportadoras, carrier, permeasas: pueden desplazar pequeñas molécs de un lado a otro modificando su conformación, es a favor del gradiente de concentración. Su vel es > y transporta molecs organicas pequeñas (-los lípidos). Transporte específico; canales iónicos: poros hidrofílicos que dejan pasar iones inorgánicos, a favor del gradiente de [], lo hacen a > vel, transporte específico. Canales especiales para el agua, acuaporinas. Se abren en un lapso breve y luego se cierran, está regulada por señales específicas. Los canales son poros hidrofílicos formados por prots complejas con varios polipéptidos o subunidades proteicas. La selección del ión depende del tamaño del poro de los AA cargados que revisten el poro del canal. Las céls tienen una composición iónica interna ≠ a la del medio externo. El Na es abundante fuera de la cél, el K es abundante dentro de las céls, el Ca es bajo dentro de las céls. Para que estas [] se mantengan, las céls tiene que gastar energía → transporte activo. TRANSPORTE ACTIVO Gasta energía o ATP para transportar los sts en contra del gradiente de [], hay 3 tipos: cotransportadores, bombas ATP y bombas impulsadas por luz. Hay ≠ tipos de bombas. Dentro de las bombas P esta la bomba Na-K++ (saca Na, entra K), la bomba de Ca (saca Ca del citosol hacia afuera de la cél) y la memb del REL de las céls musculares para acumular Ca, las bombas de protones mantienen bajo el pH del estómago o en el interior de los lisos. 2 La bomba de Na K funciona en todas las céls. Saca 3 iones Na y entran 2 K en contra del gradiente de [] de c/u, hidroliza 1 ATP y se autofosforila, genera un gradiente electroquímico y una ∆ de cargas. El interior de la cél va a ser más negativo que el exterior. Las prots que transportan 2 molécs son co-transportadores, hacen el transporte acoplado. Transporta 2 sts, uno a favor de gradiente de [] que da la E para impulsar el transporte del 2do st que es en contra de gradiente de []. Si los 2 sts se mueven en la misma dirección → simporte, si 2 sts se mueven en direcciones opuestas → antiporte, las prots que transportan una moléc como el transportador de glucosa → uniportadores. TRANSPORTE EN MASA Involucra a una parte de la memb, gasta mucha E y es independiente de la [sts]. Endocitosis y exocitosis. La endocitosis se divide en fagocitosis (bacterias, fragmentos de bacterias, partículas grandes) y pinocitosis (se fagocita líquido con sts diluidas). La particula es internalizada, se rodea con memb plasm y se forman vesículas que son endocitadas e internalizadas dentro de la cél. Exocitosis: se liberan vesículas afuera de la cél. Hay fusión de la memb plasm con la memb de la vesícula y se puede liberar el contenido fuera de la cél. BC1 - PARTE 2 TRANSDUCCIÓN DE SEÑALES Y SEÑALES INTERCELULARES En una comunicación típica entre céls, la cél señalizadora produce un tipo especial de molécs señal que es detectada por la cél blanco o diana que tiene prots receptoras que reconocen y responden a dicha moléc señal. Las molécs señal pueden ser prots, péptidos, AA, nucleótidos, esteroides, derivados de ácidos grasos o gases. • Mecanismo de señalización endocrina: una cél endocrina produce una señal, hormona, y la secreta hacia la sangre, que es distribuida a todo el organismo • Mecanismo de secreción paracrina: las céls liberan señales hacia el fluido extracel cercano, actúan como mediadores locales. • Mecanismo de señalización autocrina: las propias céls señalizadoras pueden responder a mediadores locales que ellas producen. • Mecanismo de señalización neuronal: las señales se transmiten por los axones, por la liberación de una moléc señal, neurotransmisor, alcanzan a la cél diana. • En la señalización dependiente de contacto una moléc señalizadora unida a la superficie celular se une una prot receptora de una cél adyacente. El tiempo que se toma una cél para responder a una señal extracelular puede ∆ según lo que va a suceder una vez recibido el mensaje. Algunas señales extracelulares actúan con rapidez (seg – min), en estos casos la señal afecta la actividad de las prots y otras molécs dentro de la cél diana. Otras respuestas demandan > T, ej el crecimiento la división celular cuando son desencadenados por las molécs señalizadoras apropiadas, la rta a estas señales necesita cambios en la expresión génica y producción de nuevas prots. Las molécs de señalización extracelular pertenecen a dos clases: la primera clase son molécs demasiado grandes o hidrófilas para atravesar la memb plasm de la cél diana, estas se unen a receptores de la superficie de las céls diana para transmitir sus msjs por la memb, a receptores de memb. La segunda clase son molécs lo pequeñas o hidrófobas que se deslizan por la memb plasm, suelen activar enzimas o unirse a prots receptoras intracelulares que regulan la expresión génica. Una clase importante de molécs señalizadoras que se unen receptores intracelulares son las hormonas esteroideas, muchas son derivadas del colesterol (ej cortisol, estradiol y testosterona), existen las hormonas 3 tiroideas. Todas son hidrófobas y atraviesan la memb plasm por difusión simple. La unión de la hormona esteroide al receptor intracelular induce un cambio de formación del receptor que le permite liberarse de prots inhibitorias → el complejo hormona-receptor activado se traslade al núcleo. Dentro, el complejo hormonareceptor activado se une a regiones reguladoras del gen diana y activa o reprime la transcripción Hay 2 tipos de rtas hormonas esteroideas: en la rta primaria o temprana el complejo hormona-esteroide receptor intracelular activan genes de rta primaria induciendo la síntesis de prots → de rta primaria. Estas pueden inhibir la transcripción de genes de rta secundaria, produciendo prots de rta secundaria de forma indirecta. La gran mayoría de las molécs señalizadoras son muy grandes o hidrofílicas para atravesar la memb plasm, se unen a receptores de la superficie celular. La prot receptora hace el 1er paso de la transducción de señales se le une la señal extracelular lo que genera como respuesta nuevas señales intracelulares. El proceso de señalización intracelular resultante actúa como una carrera de relevo molecular en la que el msj es pasado corriente abajo de una moléc de señalización intracelular a otra, c/u activa o genera la sig moléc señalizadora de la vía hasta que se activa una enzima metabólica, el citoesqueleto toma una nueva config, un gen es activado o desactivado. Resultado final → respuesta celular. Los componentes de estas vías cumplen una o más funciones: transmitir la señal, amplificar la señal o intensificarla, pueden recibir señales de más de una vía de señalización intracelular e integrarlas antes de transmitir una señal y distribuir esta señal a más de una vía de señalización creando una respuesta compleja. Hay tres clases principales de receptores en la superficie celular: • los receptores acoplados a canales iónicos permiten un flujo de iones que cambia el potencial de memb y genera una corriente eléctrica, • los receptores acoplados a prots G activan prots de unión a GTP triméricas unidas a la memb, prots G, que activan una enzima o un canal iónico de la memb plasm lo cual desencadena una cascada de otros efectos, • los receptores acoplados a enzimas actúa ellos mismos como enzimas o se asocian con enzimas en el interior de la cél, cuando son estimuladas las enzimas activan ∆ vías de señalización intracel. Los receptores acoplados a canales iónicos, o canales iónicos regulados por ligando, actúan simple y directo, receptores son responsables de la transmisión rápida de señales por la sinapsis del sist nervioso. Ej: traducen una señal química en forma de un pulso de neurotransmisor enviado al exterior de la cél diana en una señal eléctrica en forma de un cambio de voltaje por la memb plasm de la cél diana, cuando se une el neurotransmisor este tipo de receptor modifica su conformación de manera de abrir o cerrar un canal iónico de la memb plasm lo que posibilita el flujo de determinados tipos de iones. Impulsados por sus gradientes electroquímicos, los iones se precipitan hacia el interior o exterior de la cél lo que genera un cambio del potencial de memb en alrededor de un milisegundo, este cambio puede desencadenar un impulso nervioso, facilitar o dificultar que otros neurotransmisores lo hagan. Los receptores acoplados a prots G median en las rtas a una gran ∆ de molécs de señalización extracelular (hormonas, mediadores locales y neurotransmisores). Estos están formados por una sola cadena polipeptídica que atraviesa la memb 7 veces. Las prots G acopladas a estos receptores están formadas por 3 U proteicas, por un lado ἀ con actividad GTP-asa y por el otro lado ẞỿ. La unión de una señal extracelular al receptor modifica su conformación lo que a su vez modifica la conformación de la prot G unida a él, la alteración de la subunidad ἀ de la prot G le permite intercambiar su GDP por GTP, esto desencadena un cambio conformacional que activa tanto la subunidad ἀ como al complejo ẞỿ que ahora pueden interactuar con sus prots dianas preferidas en la memb plasm. 4 1. Cuando una subunidad ἀ activada según esa prot diana produce su activación o su desactivación mientras las dos permanecen en contacto, 2. en el término de segs la subunidad ἀ hidroliza su GTP, que desactiva y la disocia de su prot diana 3. la subunidad ἀ se re-asocia con el complejo ẞỿ y vuelve a formar una prot G inactiva. La prot g está lista para acoplarse a otro receptor activado. Las prots dianas de la prot G activada pueden ser canales iónicos o enzimas. Muchas señales extracels que actúan por receptores acoplados a prots G inciden en la actividad de la enzima adenilato ciclasa, como consecuencia modifican la [2do mensajero] a AMPc dentro de la cél. El AMPc ejerce sus efectos por la activación de la enzima prot kinasa A o PKA, la PKA activada modifica la actividad de otras prots intracelulares por fosforilación. Veamos dos ejemplos: Otra de las enzimas diana de la prot G activada es la fosfolipasa C. Activada, degrada una moléc lipídica (componente de la memb plasm) generando 2 2dos mjeros: inositol trifosfato o IP3 y diacilglicerol o DAG. El IP3 (hidrosolubles) difunde al citosol, el DAG queda incluido en la memb plasm. El IP3 liberado al citosol, se une a canales de Ca en la memb del RE y los abre, aumentando el Ca citosólico, el Ca es una señal de activación para ∆ prots. El DAG, junto con el Ca, ayuda a activar a la enzima prot kinasa c (PKC) que es reclutada desde el citosol a la cara citosólica de la memb plasm. La PKC fosforila su propio conjunto de prots intracels, propaga aún más la señal. Los receptores acoplados a enzimas son prots transmembs que tienen sus dominios de unión al ligando en la superficie externa de la memb plasm. El dominio citoplasmático del receptor actúa por sí mismo como una enzima o forma un complejo con otra prot que actúa como una enzima. Su moléc señal son mediadores locales que pueden actuar en [] muy bajas. Los receptores están involucrados en el crecimiento, diferenciación, supervivencia y migración celular. El mecanismo de acción de estos receptores: Un dímero de la moléc señal induce que 2 molécs receptoras se acerquen entre sí en la memb y formen un dimero. El contacto entre las porciones intracels de los 2 receptores adyacentes activa la función de kinasa y c/receptor fosforila al otro produciendo un receptor tirosina kinasa activo. La tirosina fosforilada del receptor actúan como sitios de unión para una gran ∆ de prots de señalización intracel, que son fosforilada y activadas. Existen 3 prots dianas de los receptores tirosina kinasa activados: RAS, fosfoinositidina 3-kinasa (PI3K) y la jak-STAT, la mayoría de los receptores tirosina kinasa activados tienen como prot diana una pequeña prot, RAS, unida por una cola lipídica a la cara citoplasmática de la memb plasm. RAS es una GTPasa monomérica, activa cuando está unida a GTP e inactiva cuando está unida a GDP. Activo, RAS promueve la activación de una cascada de fosforilación en la que una serie de prots kinasas se fosforilan y se activan entre sí consecutivamente un dominó. Este sist de transmisión incluye un módulo de 3 kinasas: cascada de señalización de MAP kinasa. Al final de la cascada de MAP kinasa, fosforila ∆ prots efectoras, incluidos ciertos reguladores de la transcripción, modifica su capacidad para controlar la transcripción de genes. El cambio del patrón de expresión génica puede estimular la proliferación celular, promover la supervivencia de la cél o inducir su diferenciación. PI3K. Una señal extracelular de supervivencia activa un receptor tirosina kinasa, el cual recluta y activa a PI3K. Fosforila un fosfolípido de inositol asociado a la memb. El fosfolípido de inositol fosforilado resultante atrae prots de señalización intracel. Una de estas prots de señalización es AKT, prot kinasa activada en la memb por fosforilación mediada por otras dos prots kinasas (1 y 2). Activada la AKT, es liberada de la memb plasm y promueve la supervivencia celular. Fosforilar y desactivar la prot BAD, en su forma no fosforilada, promueve la apoptosis. Al ser fosforilada por AKT, BAD libera a BCL2 que bloquea la apoptosis. 5 JAK-STAT. Los receptores no tienen actividad tirosina kinasa intrínseca, se deben asociar a kinasa citoplasmáticas, jak. Ej con prolactina: La unión de la prolactina a sus receptores acoplados a enzimas hace que las tirosina kinasa asociadas, jak 1 y 2, se fosforilen y activen entre sí. Las jak activadas fosforilan las prots receptoras. Las prots STAT, reguladores de la transcripción, en el citosol), son unidas después a la fosfotirosina del receptor, y las jak los fosforilan y activan. Las STAT activadas se disocian de las prots receptoras, se dimerizan y migran al núcleo., Con otros reguladores de la transcripción, activan la transcripción de genes que codifican las prots de la leche. BC 2 CITOESQUELETO Red compleja de fils que se extiende por todo el cito de la cél eucariota. Es una estructura muy dinámica que se arma y desarma constantemente. Las prots del citoesqueleto ocupan toda la cél. Está formado por 2 grupos de prots, las prots filamentosas y prots asociadas a los fils. • • • Las prots filamentosas son 3: Fils finos de actina o microfils: 7-9 nanómetros, fils intermedios: 10 nanómetros fils gruesos o microtúbulos: 25 nanómetros. Las prots asociadas se dividen en 3 tipos: • • • función motora función estructural estabilizando los fils función de polimerización que ayudan a crecer los fils. FILS INTERMEDIOS Están en el citoplasma como en el núcleo, resisten tensión mecánica, tienen función estructural en la cél, tienen una distribución especial que es tej específica. Las queratinas son específicas del tej epitelial; las vimentinas están en el tej conectivo, céls musculares y neuroglia, los neurofils están en las neuronas. Las láminas nucleares están en el núcleo de todas las céls animales. Formados por ≠ prots o monómeros que se unen entre sí en espiral formando dímeros → tetrámeros → termino terminal → 8 tetrámeros alineados en forma la por enlaces no covalentes → filamento. Los ≠ monómeros que forman los fils intermedios se dividen en 4 grupos: queratinas, vimentinas, neurofils y láminas nucleares. Su principal diferencia es el grupo amino y carboxiterminales. Hay queratinas básicas, ácidas. c/ epitelio tiene una combinación particular de queratinas Vimentinas: en el tej conectivo, desmina en las céls musculares y la prot fibrilar glial ácida en los astrocitos Hay 3 tipos de láminas nucleares y tres de neurofils. Los fils de queratina se extienden de un lado a otro de la cél epitelial e intervienen en las uniones cél-cél del epitelio o demosomas, así como las uniones cél-matriz (hemidesmosomas). Demosomas: las queratinas se unen a una placa de prots de anclaje que se une a prots integrales de memb de la familia de las caderinas. Las caderinas de una cél se unen con las caderinas de la cél contigua. Hemidesmosoma: las queratinas se unen a una placa de prots de anclaje que se une a otras prots integrales de membs (integrinas) que se unen a la laminina de la matriz extracelular epitelial. Distribuye la tensión generada por el estiramiento de la piel, si hay fallas en las queratinas los epitelios se rompen. La epidermólisis ampollar simple es una enfermedad genética en donde el gen de la queratina está mutado y no se forman correctamente los fils de queratina. Los neurofils están en las neuronas y forman el citoesqueleto de axón La plectina es una prot asociada a los fils intermedios que los estabiliza y refuerza por uniones cruzadas, mutaciones en el gen de la platina provoca una enfermedad que combina a la epidermólisis ampollar simple (fallan las queratinas), distrofia muscular (fallan las desminas) y degeneración nerviosa (fallan los neurofils). 6 La lámina nuclear son los fils intermedios que tapizan y refuerzan la superficie de la memb nuclear interna, formados por la prot lámina. La lámina nuclear posee una estructura de red. Es un sitio unión para la cromatina. MICROFILS DE ACTINA C/ fil es un polímero de actina globulares, formando una cadena retorcida. Tienen polaridad, en el extremo + la vel de crecimiento es > a la del extremo -. El fil de actina se forma cuando un monómero de actina libre, unido a una moléc de ATP se une a otra actina globular unida a otro ATP. El ATP se hidrolizada a ADP y reduce la fuerza de unión de los monómeros de actina y se reduce la estabilidad del polímero que se empieza a desensamblar. Los microfils de actina son estabilizados / regulados por prots relacionadas con actina. Algunas ayudan a que crezcan o a nuclear los fils, otras secuestran los monómeros para impedir que se formen los polímeros, otras cortan a los fils de actina, otras los entrecruzan para estabilizarlos, otros estabilizan haces de fils paralelos de actina muy juntos, otras les ponen un capuchón para estabilizarlo e impedir que se degraden y otras actúan como prots motoras. Ej, 2 estructuras formadas por haces // de actina: en las céls musculares, los fils de actina están más separados en forma y están estabilizados por la ἀ actinina. Tiene una función contráctil, la separación entre los fils permite que las prots motoras, miosinas, puedan entrar e interactuar con los fils de actina para la contracción. Las microvellosidades, abundantes en las céls epiteliales, están estabilizados por la prot fimbrina, los haces de actina están mucho más próximos entre sí y no puede entrar la miosina para la contracción de los fils → no se mueven. La filamina es una prot asociada a la actina que estabiliza uniones cruzadas permitiendo formar una red de fils de actina en la corteza celular. Funciones: 1) Determinar la forma celular: o Corteza celular: red de fils de actina debajo de la memb plasm. 2) Contribuyen a la fijación espacial de prots de memb: uniones adherentes. o Formadas por fils de actina que se unen a varias caderinas que se unen a prots transmemb “caderinas”. o La parte extracel de las caderias de una cél se une a la parte extracel de las caderinas de la cél vecina. 3) Participan de uniones cél- cél (cinturón adhesivo) y cél –matriz (contacto focal): contacto focal. o Los fils de actina pueden formar uniones entre cél- matriz. o Un fil, estabilizado por la prot “capuchón”, se une a varias prots que interactúan con la integrina, que se une a la fibronectina en la matriz extracel. 4) Brinda estructura a prolongaciones de memb: microvellosidades o Da estructura de especialización de memb. El epitelio del intestino delgado tiene microvellosidades que aumentan su superficie de absorción. Poseen microfils de actina, muy juntos, estabilizados por prots fimbrina y vilinas. 5) Interviene en las diversas formas de desplazamiento celular: o los microfils se pueden ensamblar para permitir el desplazamiento de la cél. La cél forma filopodios que son prolongaciones delgadas y rígidas con fils de actina ordenados en forma //. Forman lamelipodios, que son extensiones delgadas con microfils más desordenados. La cél usa estás prolongaciones para desplazarse. En el lamelipodio se polimerizan los fils de actina en el extremo + y extiende al lamelipodio hacia adelante, que luego forma un contacto focal con la matriz extracel y la actina, dentro de la cél, con ayuda de la miosina II, se contrae para mover la cél y desplazarla hacia adelante. 6) Es esencial para la organogénesis, contracción muscular y citocinesis. 7 7) Sostiene mecanismo de transporte citoplasmaticos de vesículas. Prots motoras: miosinas Para contraerse, los fils de actina necesitan prots motoras. Hay ≠ clases de miosinas: Miosina I: puede desplazar un microfils con respecto a otro, transporta vesículas por los microfils. Miosina II: se asocia con otra miosina II e induce el desplazamiento de los fils de actina, uno sobre otro La miosina II puede formar dímeros, estos se unen entre sí para formar un fil grueso. Estos fils gruesos se intercalan con fils finos de actina para formar un sarcómero. Este es una estructura muy ordenada en las céls musculares y el mov de los fils de actina que son acercados por los fils de miosina es lo que produce la contracción muscular. En la citocinesis, división del citoplasma, se forma en el ecuador de la cél un anillo de actina que, ayudado por la miosina, se contrae hasta estrangular la cél y divide el citoplasma en 2 partes. MICROTUBULOS Son tubos proteicos de 25 nanómetros, largos y relativamente rígidos. Están formados por dímeros de ἀ y ẞ tubulina, que se apilan formando protofils. 13 protofils forman el microtúbulo. Tiene polaridad, extremo + y -. La unión de los dímeros entre sí está controlada por el GTP. Los dímeros, unidos a GTP, se unen más firmemente a otro dímero. Los microtúbulos que tienen dímeros tubulina unidos a GTP tienden a seguir creciendo → tiene un casquete de GTP que promueve que se unan otros dímeros tubulina GTP. Si el crecimiento de microtúbulos es lento, el GTP unido al dímero de tubulina se hidroliza y se pierde el casquete de GTP; los dímeros de tubulina tienden a desensamblarse del microtúbulos y el microtúbulo está en retracción. Función: Transporte intercitoplasmático de vesículas y Organelas Movs ciliar y flagelar. Formación del huso en la división celular. Crecimiento axónico. PROTS ASOCIADAS A LOS MICROTÚBULOS: 1) estabilizadoras de la estructura: MAPs, Tau y nexinas o se unen a los microtúbulos estabilizándolos para que no se desensamblen. 2) reguladoras de la polimerización: ỿ-tubulina. o la prot que inicia la polimerización de los microtúbulos es la ỿ -tubulina: forma una estructura de anillo desde donde se nuclean los dímeros de ἀ y ẞ tubulina para formar los microtúbulos, los anillos de ỿ-tubulina (sitios de nucleación) está en el centrosoma: estructura cerca del núcleo que contiene a los centriolos y la matriz centrosomal. Inmersos en la matriz están los anillos de ỿ tubulina y desde allí nacen los microtúbulos. 3) Motoras: dineinas y quinesinas o La dineina transporta vesículas desde la memb plasm hacia el centrosoma (extremo - del microtúbulo); o La quinesina transporta vesículas en sentido contrario. Centrosoma → memb plasm (extremo + del microtúbulo) o Estas prots tienen un dominio de unión al microtúbulo en un extremo y en el otro extremo se unen a prots que ayudan a transportar las vesículas. Un microtúbulo transporta varias vesículas a la vez. ASOCIACIÓN DE MICROTÚBULOS Dobletes y tripletes. En los dobletes no hay 2 microtúbulos enteros de 13 protofils c/u, se superponen o comparten algunos protofils entre las dos estructuras. Lo mismo en los tripletes. 8 CENTROS ORGANIZADORES DE MICROTÚBULOS: Estructuras con 9 tripletes c/u. Los centriolos son centros organizadores de microtúbulos (COMTS) que están de a pares y en forma perpendicular, uno del otro, en el centrosoma. Otro tipo COMTS es el cuerpo basal, 9 tripletes, están en la base de cilios y flagelos. ESTRUCTURA CILIAR Y/O FLAGELAR (9+2) 9 dobletes + 2 microtúbulos enteros (par central). Tiene prots estabilizadoras, nexina, y prots motoras, dineina, que ayudan con el mov. Dineina ciliar o del axonema ciliar → movs. MICROTÚBULOS Y HUSO MITÓTICO. Husos mitóticos: microtúbulos como los citoplasmáticos, pero que se forman en la división celular para ayudar a repartir el material genético entre las céls hijas. Hay 3 tipos de microtúbulos: astrales (en el polo de la cél), cinetocóricos (enganchan a los cromos para separarlos) y polares (se solapan entre sí para ayudar a separar las cromátides hermanas). BC 3 SISTEMA DE ENDOMEMBS O SISTEMA VACUOLAR CITOPLASMÁTICO (SVC) Complejo sist membranoso formado por: Con interconexión funcional o Cisternas (sacos aplanados) Determinante de 2 compartimientos o Túbulos. o Intermembranoso o vesículas o Citosólico. COMPONENTES • Envoltura nuclear o carioteca • RE o RER y REL • Aparato de Golgi • • • • Endosomas Lisosomas Vesículas secretorias Sist vesicular de tránsito y endocitosis Envoltura nuclear Formada por 2 membs externa e interna, que delimitan un espacio perinuclear. Las membs se continúan con las membs del RE, el espacio perinuclear se continúa con la luz del RE. Está interrumpida por los poros nucleares, que son las puertas por las que entran o salen del núcleo todas las molécs. C/complejo del poro está formado por un gran número de subunidades proteicas ≠, ej: 8 columnas proteicas y fibrillas que protruyen por ambos lados del complejo. Sobre el lado nuclear se forma una estructura como canasta. El complejo del poro está anclado al espacio perinuclear por prots de anclaje. TRANSPORTE A TRAVES DE LA ENVOLTURA NUCLEAR Tiene prots radiales llenan el centro del canal y permite el transporte selectivo por la E.N, así las molécs hidrosolubles pequeñas pueden pasar libremente y de manera no selectiva entre el núcleo y el citosol. Las molécs más grandes (prots, ARN y complejos macromoleculares) deben tener una señal de distribución para pasar por el poro nuclear por transporte activo. Transporte de prots del citosol al núcleo. 1) La prot con señal de localización nuclear o NSL dentro de su secuencia primaria es reconocida por un 2) 3) 4) 5) receptor para transporte nuclear o importina, el cual se une a dicha prot en el citosol La importina transporta la prot hacia el núcleo a través del poro nuclear En el núcleo, una moléc de Ran-GTP se une a la importina y libera la prot en el núcleo La importaba vacía unida a Ran-GTP regresa al citosol a través del poro nuclear Se produce la hidrólisis de GTP a GDP, originándose una moléc de Ran-GDP la cual se disocia de la importina y la libera para generar un nuevo ciclo de transporte de prots del citosol al núcleo. Transporte de prots del núcleo al citosol (exportación nuclear), transporte de prots y ARNm. 9 1) Un receptor de exportación nuclear o exportina se une a la prot y a Ran-GTP en el núcleo. La prot tiene 2) 3) 4) 5) una señal de exportación nuclear o NES en su secuencia primaria. La exportina transporta la prot hacia el citosol a través del poro nuclear Una vez allí, se produce la hidrólisis de GTP a GDP La exportina, la carga y la Ran-GDP se disocian Por último, se produce el regreso de la exportina vacía y de la Ran-GDP al núcleo a través del poro nuclear. El GTP es hidrolizado por una GTPasa: RAN Cuando la Ran-GDP reingresa al núcleo, la moléc de GDP es intercambiada por una moléc de GTP por la Ran-GEF, formando una moléc de Ran-GTP la cual cuando sale al citosol es hidrolizada a GDP por la RanGAP, generándose nuevamente una Ran-GDP. RER Forma una red que se extiende por todo el citoplasma FUNCIONES • Síntesis de prots para: • Modificación química de las prots: o la glicosilación proteica en asparagina o o secreción hacia el espacio extracelular N-glicosilacion o incorporar el sist de endomembs o formación de fuentes disulfuro. ▪ prots luminales, integradas a membs o lisosomales La síntesis de todas las prots celulares comienza en el citosol y según su señal de distribución específica dentro de la secuencia primaria de las mismas, van a continuar su síntesis y culminarla en ribosomas libres en el citosol: citosol, mitocondrias, cloroplastos, peroxisomas. Si la prot tiene una secuencia señal de RE va a continuar su síntesis dentro de la luz de RE por ribosomas unidos al mismo. Son distribuidas a su compartimento final dentro del sist de endomembs: Golgi, memb plasm, vesículas secretorias o lisosomas. SINTESIS DE PROTEINAS CON SECUENCIA SEÑAL DEL RE La síntesis de prots comienza en los ribosomas libres en el citosol. Estas prots tienen una secuencia señal sobre la cadena polipeptídica en crecimiento en el extremo amino terminal, el cual es rápidamente reconocido por una partícula de reconocimiento de señal (PRS); la cual, al unirse a la secuencia señal, detiene la síntesis proteica y trasloca al complejo ribosoma-prot en crecimiento hacia la memb del RE y se une a un receptor de PRS. Facilita que un traslocon se abra y que la prot continúe la síntesis dentro de la luz del RE. Partícula de reconocimiento de la señal o PRS: complejo ribonucleoproteico formado por 6 prots ≠ y una moléc de ARNpc. Tiene un dominio de pausa traduccional, un sitio de U para el receptor de la PRS en la memb del RE y un sitio de U para la secuencia señal en la cadena proteica en crecimiento. Ejemplos de síntesis de prots con secuencia señal del RE: 1) Síntesis de prots solubles: La secuencia señal se une a un canal translocación proteico y transfiere activamente el resto de la prot en crecimiento por la memb del RE un bucle. Una peptidasa divide la péptida señal de la prot en crecimiento, el canal de translocación se abre y eyecta esta secuencia señal dividida dentro de la bicapa donde se degrada. Se libera el péptido translocado como una prot soluble dentro de la luz del RE. Liberada la prot, se cierra el poro del canal translocación. 2) Síntesis de prots transmemb monopaso: una secuencia señal del comienzo de transferencia (N terminal) inicia la transferencia. La prot tiene una 2da secuencia hidrofóbica: una secuencia STOP. Cuando ésta ingresa en el canal de translocación, éste descarga la prot por los lats de la bicapa lipídica. La secuencia señal N- terminal se divide y deja la prot transmemb anclada en la memb. La síntesis proteica sobre el lado citosólico continúa hasta completarse. 3) Síntesis de prots transmemb multipaso: una secuencia señal interna del RE actúa como señal inicio de transferencia y la inicia. Cuando en el canal de translocación ingresa una secuencia stop, el canal descarga ambas secuencias dentro del plano de la bicapa lipídica. No se divide la secuencia de comienzo ni la de detención y la cadena polipeptídica entera queda anclada en la memb como una prot transmemb 10 de paso doble. Las prots que atraviesan más veces la memb contienen un > nro de pares de secuencia stop y comienzo por lo que se repite el mismo proceso en cada par. MODIFICACIONES QUIMICAS DE LAS PROTEINAS DEL RE Una de las modificaciones químicas que sufren las prots en el RE es la N-glicosilacion proteica en los residuos de asparagina. Casi tan pronto como la cadena política ingresa en la luz del RE, se glucosila por el agregado de cadenas lats de oligosacáridos a determinadas asparaginas del polipéptido en crecimiento. C/cadena de oligosacáridos se transfiere a la asparagina como una unidad intacta a partir de un lípido de memb del RE, dolicolfosfato, esta reacción es catalizada por la por la enzima oligosacárido-proteintransferasa. Si estas prots glicosiladas van a ser parte de la memb plasm celular, va a ser transportada por una vesícula para fusionarse con la memb plasm. La porción glucídica siempre va a quedar del lado extracelular de la memb. Luego de ser sintetizadas en RER, las prots del sist de endomembs pasan a Golgi para ser redistribuidas a los ≠ compartimentos celulares. APARATO DE GOLGI Cerca del núcleo. Formado por sacos aplanados delimitados por membs, cisternas, que están dispuestas como pilas de platos. C/pila tiene dos caras ≠: una de entrada o cis y una de salida o trans. La cis está adyacente al RE, la trans apunta hacia la memb plasm. La cisterna más externa de c/cara se conecta con una red de tubos y vesículas membranosas interconectadas. Las prots solubles y de memb entran en la red cis del Golgi por vesículas de transporte derivadas desde el RE, las prots viajan por las cisternas en sucesión por vesículas de transporte que brotan de una cisterna y se fusionan con la sig. Las prots salen desde la red trans del Golgi en vesículas de transporte destinadas a la superficie celular u otro compartimiento. FUNCIONES • O-glicosilacion proteica en el residuo serina o treonina; • Remoción y transferencia de monosacáridos de las glucoprots; • Fosforilación de glúcidos; • • • Agregado de grupos sulfato; Biosíntesis de glucolípidos; Papel en la estructura y función: lisosomas, endosomas y granulos o vesículas secretorias. Modificaciones de la glicosilación de las prots de RER en Golgi Red cis Golgi: fosforilación de oligosacáridos en prots lisosomales Cisterna cis: remoción de manosa. Cisterna media: remoción de manosa y adición de NACGLC. Cisterna trans: adición de GAL y ácido siálico. Red trans Golgi: adición de sulfatos en tirosina y carbohidratos. REL FUNCIONES • Biogénesis de membs celulares; • Biosíntesis de lípidos: fosfolípidos triglicéridos; • Almacenamiento y liberación de Ca; • y En algunas céls especializadas hay biosíntesis de esteroides, detoxificación y movilización de glucosa. SINTESIS DE LIPIDOS En el REL tiene lugar la biogénesis de membs celulares mediante la biosíntesis de lípidos como los fosfolípidos, los esfingolípidos y ceramidas en la capa citosólica del REL. Luego, mediante una flipasa (enzima), estos fosfolípidos originados en la monocapa citosólica de la bicapa se transfieren a la otra capa de la para un crecimiento simétrico. También, en el REL, se reciclan las membs de las céls. 11 ALMACENAMIENTO Y LIBERACION DE CA++ Ingresa desde el citosol por bombas Ca++ en la memb. El Ca puede ser liberado hacia el citosol. MOVILIZACION DE GLUCOSA En los hepatocitos (céls del hígado), REL moviliza la glucosa. Se almacena dentro de estas céls como glucógeno por reacciones: pasa glucosa-6-fosfato, la cual por la glucosa-6-fosfatasa (enzima en la memb del REL) se transforma en glucosa que puede pasar a la sangre cuando el organismo así lo requiera. TRANSPOTE VESÍCULAR Para funcionar correctamente, c/vesícula que brota desde un compartimento debe tomar de este sólo las prots apropiadas para su destino y fusionarse sólo con la memb de destino adecuada. Se necesitan prots específicas que se asocian a la memb de las vesículas y que forman una cubierta alrededor de ellas. Clatrina, COP I y COP II. La cubierta proteica cumple 2 funciones: • Dar forma al brote de la vesícula; • Ayudar a capturar molécs para su transporte. VESICULAS RECUPERADAS PARA EL RE En las prots residentes en el RE, tienen una secuencia señal en su extremo carboxilo terminal, KDEL. En la memb del RE hay receptores KDEL, que formarán parte de vesícula de transporte que se fusionan con Golgi. En el caso de que prots residentes en el RE alcancen Golgi por vesículas, estas serán reconocidas y captadas por los receptores de KDEL, los cuales se asocian a vesículas recubiertas de COP II que serán transportadas al RE para su recuperación. VESICULAS RECUBIERTAS CON CLATRINA Emergen de Golgi hacia el exterior y desde la memb plasm en su camino endocitico hacia el interior. La cubierta de clatrina está formada de muchas unidades proteicas, trisqueliones, el cual está integrado por 3 cadenas polipeptídicas pesadas y 3 livianas. Los trisqueliones se colocan sobre un área de la cara citosólica de la memb y se ensamblan entre sí hasta formar un poliedro en forma de canasta. En la captura de las molécs a ser transportadas intervienen receptores de carga, adaptinas y clatrina: En la memb plasm, los trisqueliones se unen al dominio citosólico de los receptores de las susts a ser transportadas por la prot adaptina. La unión de los trisqueliones a la memb le da la fuerza mecánica que provoca su curvatura, al inicio forman una fosita que al desprenderse de la memb (con la ayuda la prot dinamina) se vuelve vesícula que se libera en el citosol. Apenas la cubierta de clatrina se desconecta de la memb vesicular, los trisqueliones y las adaptinas quedan libres en el citosol para que puedan volverse a usar. VESICULAS RECUBIERTAS CON COP Se forma por la asociación de múltiples subunidades proteicas, COP I y COP II. Suelen ser poliedros irregulares o tubulares. Las prots adaptadoras son las SAR1 para las COP I y la SAR 2 para los COP II. El acoplamiento vesicular depende de las prots de reconocimiento inicial y de las SNARE: desprendida la vesícula de su cubierta proteica, debe viajar por el citosol y fusionarse con la memb receptora. Esto depende de 2 tipos de prots receptoras complementarias, una de la memb del compartimiento donante, la v-SNARE y la otra de la memb del compartimiento receptor, t-SNARE. C/ pareja de compartimientos donante y receptora, tiene una pareja particular de prots v-SNARE y t-SNARE complementarias, durante el traslado de una vesícula transportadora su v-SNARE deba tantear múltiples tSNARE antes de encontrar a su complementaria. CAVEOLAS Son invaginaciones muy pequeñas, abundantes en las céls endoteliales musculares lisas y adipocitos. Se forman desde balsas lipídicas (ricas en colesterol y esfingofosfolípidos). La F mecánica que invagina estas áreas es generada por prots, caveolinas, que se están entre los fosfolípidos de la propia memb. 12 Debido a que en sus luces se concentran susts inductoras y en sus membs se instalan los receptores de estas susts, las caveolas posibilitan la inducción de céls con mínimas demoras. TRANSPORTE VESICULAR: ENDOCITOSIS Ingreso de macromolécs y partículas hacia el interior de la cél. Según el tamaño y propiedades físicas del material a endocitar, el mecanismo es pinocitosis o fagocitosis. Pinocitosis: ingreso de líquidos con las macromolécs y los sts disueltos en ellos. Según la calidad de la st a incorporar a la cél, la pinocitosis puede ser: • Inespecífica: las sts ingresan automáticamente. • Regulada: las sts interactúan con receptores específicos en la memb plasm y desencadena la formación de las vesículas pinociticas. Fagocitosis: pasa en pocos tipos celulares, particularmente en los macrófagos y en los leucocitos neutrófilos. Incorporación de partículas relativamente grandes y estructuradas ENDOCITOSIS MEDIADA POR RECEPTOR Ej: colesterol. Es insoluble y transportado en la sangre unida a prots como lipoprots de baja densidad o LDL. La LDL se une a los receptores sobre la superficie celular e ingresan en vesículas recubiertas con clatrina. Las vesículas pierden sus cubiertas y se fusionan con los endosomas. En el ambiente ácido del endosoma, la LDL se disocia de sus receptores, que vuelven a la memb plasm con las vesículas de transporte para ser usados de nuevo. Otro camino que pueden tomar los receptores endocitados es la degradación, los sectores que no fueron recuperados siguen desde el compartimiento endosómico hacia los lisosomas, donde se degradan. Pueden ser recuperados al ser enviados a un dominio celular ≠ al origen por transcitosis. TRANSCITOSIS En algunos epitelios, los materiales ingresados por endocitosis por una cara de la cél atraviesan el citoplasma y salen por exocitosis por la cara opuesta. El cruce por el citoplasma lo hacen dentro de la vesícula, en algunos casos emplean un endosoma como estación de relevo. FAGOCITOSIS Según la circunstancia, es un medio de defensa capaz de eliminar partículas extrañas del organismo. Una vez que de material se fija sobre la superficie externa de la cél, la memb plasm emite prolongaciones que los rodean hasta dejarlo englobado en el interior del citoplasma, forma una vesícula de > tamaño la pinociticas, la fagosoma. Para fagocitar, el material debe adquirir señales que son reconocidas por receptores en la memb plasm de las céls fagocitarias. LISOSOMAS Organelas que completan la digestión de los materiales incorporados por endocitosis. Tienen variedad de tamaño, forma y composición de sus enzimas hidrolíticas, ya que si se activan a pH bajo son hidrolasas ácidas. La llegada de las hidrolasas ácidas al lisosoma se da al tener una señal de manosa-6-fosfato. La cara luminal de la memb lisosomal está protegida por de glicoprots. Los lisosomas se generan a partir de los endosomas, que reciben los materiales a digerir, los que ingresaron por endocitosis y las enzimas hidrolíticas encargadas la digestión (de Golgi). En los endosomas, se activa una bomba P+ que hace descender el pH a 6, conforme la bomba P+ sigue actuando el pH desciende a 5 y el endosoma secundario → lisosoma, donde se completa la digestión del material endocitado. Las enzimas lisosomales tienen una señal específica de manosa-6-fosfato, que es incorporada a la enzima lisosomal en su paso por el RE. Manosa-6-fosfato es la señal que conduce a las enzimas lisosomales hasta la salida de Golgi y las colocan en sectores destinados para su envío hacia los endosomas por vesículas. Allí, se une un receptor específico de manosa-6-fosfato y se genera una vesícula recubierta por clatrina que 13 se va al endosoma. En el endosoma, y por el efecto del pH, se disocia la enzima hidrolítica de su receptor y se elimina el grupo fosfato → enzima lisosomal madura Los materiales destinados a la degradación, siguen vías ≠ hacia los lisosomas. C/ vía conduce a la digestión intracelular de los materiales derivados de una fuente ≠, los compartimentos resultantes de las tres vías se pueden distinguir a veces por su morfología. Estos lisosomas difieren sólo por los diferentes materiales que digieran. ENFERMEDADES POR ALTERACIONES LISOSOMICAS ≠ Enfermedades congénitas se producen por mutaciones de los genes que codifican a las enzimas lisosómicas. Se caracterizan por la acumulación intracelular de las sts que esas enzimas degradan. Algunos ejemplos: EXOCITOSIS Salida de componentes al exterior de la cél. Hay 2 tipos: constitutiva (en todas las céls) y regulada. La cél secreta continuamente muchas prots solubles por su vía secretaria constitutiva. Esta vía aporta en lípidos y prots recién sintetizados a la memb plasm. Las céls secretoras especializadas tienen una vía de exocitosis regulada por la cual se deriva en prots seleccionadas de la red trans del Golgi hacia las vesículas secretoras donde se [] y almacenan hasta que una señal extracelular estimule su secreción. PEROXISOMAS NO forman parte del sist de endomembs. Organelas con una sola memb, en todas las céls (más numerosos en hígado y riñón), forma ovoide. Se dividen por fisión binaria, tomando prots que son sintetizadas en los ribosomas libres en el citosol y lípidos del REL. Tienen vida media corta siendo eliminados por autofagosomas y contienen enzimas, oxidasas y catalasa. FUNCIONES • Oxidación de ≠ sustratos del metabolismo celular (ácidos grasos, AA y purinas) • Detoxificación de fenoles, ácido fórmico, formaldehído y alcoholes; • Beta-oxidación de los ácidos grasos liberando grupos acetilo, que irán a la mitocondria para formar ATP; • Síntesis de plasmalógenos que son los fosfolípidos más abundantes en la mielina BC 4 MITOCONDRIAS Organelas en casi todas las céls eucariontes. Se cree que provienen de bacterias aeróbicas que fueron fagocitadas por una cél eucariota ancestral anaeróbica creándose una relación simbiótica en la cual ambas céls se ayudaron mutuamente para sobrevivir y reproducirse. ORGANIZACIÓN ESTRUCTURAL • Vista estructural: formada por 2 membs: una externa (muy permeable al H2O por su gran cantidad de porinas y a molécs de hasta 5000 Da); una interna (plegada en crestas y es impermeable a iones y molécs pequeñas, están embebidos los complejos proteicos de la cadena de transporte de e- y la ATP sintasa). • Entre ambas membs está el espacio intermemb, contiene enzimas que usan el ATP para fosforilar otros nucleótidos y su pH es 7. • Dentro de la memb mitocondrial interna: matriz mitocondrial que contiene ∆ enzimas de oxidación de piruvato y ácidos grasos, y del ciclo de ácido cítrico. Contiene ADN mitocondrial y la maquinaria de síntesis de prots mitocondriales. Su pH es 7.5. LAS MITOCONDRIAS PERMANECEN FIJAS EN REGIONES DE LA CÉL QUE DEMANDAN MUCHA E. 14 Son organelas con gran movilidad, que cambian constantemente de forma y posición dentro de la cél. En algunas céls permanecen fijas impulsando el ATP hacia un sitio de alto consumo. EL ADN MITOCONDRIAL ES DIFERENTE DEL ADN NUCLEAR El ADN mitocondrial es circular; hay varias copias del mismo; está desnudo, no está asociado a histonas; tiene un solo origen de replicación y los codones son diferentes del ADN nuclear; poseen muy pocas y muy cortas secuencias no génicas, es decir poco ADN no codificante; se transcriben ambas cadenas y su ADN codifica para 13 prots las cuales son subunidades de enzimas de la propia mitocondria, 22 ARNt y 2 tipos de ARNr: el 16 S y el de 12 S. BIOGENESIS MITOCONDRIAL En rta a señales específicas y dependiendo del requerimiento celular, las mitocondrias pueden sufrir los procesos de fisión (una mitocondria se divide en 2, dando 2 hijas pequeñas) o de fusión (inverso a la fisión). Así pueden llegar a formarse estas redes que ocupan todo el citoplasma. PROTEINAS MITOCONDRIALES Tienen 2 orígenes. La > parte de las prots mitocondriales, está codificada en el núcleo, en el ADN genómico, el cual puede ser transcripto y traducido en el citosol para generar prots precursoras que ingresarán a la mitocondria: Las prots mitocondriales son sintetizadas en el citosol, tienen una secuencia señal en su extremo N- terminal que es reconocido por el receptor del complejo TOM en la memb extrema de la mito. Este complejo, unido a la prot, difunde lat en la memb hacia un sitio de contacto entre la memb externa e interna y la prot es translocada por ambas membs, por los complejos translocadores TOM en la memb externa y TIM en la interna. En el interior de la organela, una peptidasa señal cliva la secuencia señal generándose así una prot mitocondrial madura. FUNCIONES • • • Remoción del Ca citosólico; Síntesis de esteroides Participan en la apoptosis; • • • Participan en la descarboxilación oxidativa; ẞ-oxidación de ácidos grasos; Producción de ATP por fosforilación oxidativa. REMOCION DEL CA++ CITOSOLICO Las céls eucariontes mantienen una [Ca], en el citosol, muy baja ya que puede unirse a muchas molécs las céls y alterar su actividad. Estos niveles tan bajos se logran por la remoción del mismo por el REL y por las molécs de unión del Ca en el citoplasma (ej la prot calmodulina). Cuando la [Ca] aumenta en el citosol a niveles peligrosos, la cél activa una CA++-ATPasa en la memb interna de la mitocondria que bombea Ca a la matriz mitocondrial, retirándolo del citosol. SINTESIS DE HORMONAS ESTEROIDEAS Síntesis de hormonas esteroideas junto con el REL: corteza suprarrenal, los ovarios o los testículos APOPTOSIS: VIA INTRINSECA Las mitocondrias están involucradas en la vía intrínseca de la apoptosis. Ante un estímulo apoptico ej: falta de nutrientes o daño reparable en el ADN), se libera el citocromo C, prot de la memb mitocondrial interna hacia el citosol. Prot citocromo C + prots adaptadoras activadas + procaspasa 9 = complejo proteico apoptosoma, el cual activa caspasas (proteasas efectoras) y llevan a la muerte por apoptosis de las céls. FUNCIONES CELULARES QUE REQUIEREN ENERGIA Las mitocondrias toman la E de las uniones covalentes de las molécs de alimento y, con el O2 ambiental, la transfieren a la ADP → ATP, que es usado en ∆ procesos celulares. Ej: mitosis, meiosis, motilidad y 15 contracción, biosíntesis de materiales celulares, transporte activo, transmisión de señales, endocitosis y exocitosis. La energía del ATP es liberada en c/u de los procesos por hidrólisis de esta moléc generando el ADP, el cual volverá a ser transformado en ATP en la mitocondria. LA OXIDACION GRADUAL CONTROLADA DEL HdC CONSERVA LA ENERGIA UTIL Cuando una moléc de HdC se degrada (se oxida a CO2 y H2O), se libera E. la degradación/ oxidación de HdC se lleva a cabo por pasos enzimáticos, liberándose energía E en pequeños paquetes de un tamaño adecuado. Esta E sí puede ser transferida a molécs transportadoras, ATP o NADH, y queda disponible para realizar trabajo útil en la cél. El NADH y el FADH2 o NAD y FAD reducidos, son molécs transportadoras activadas que participan en reacciones de óxido-reducción celular y son transportadores de e- y p+ de alta energía. Cuando una moléc de alimentos se oxida, transfiere e- y p+ de alta energía al NAD o FAD, los cuales se reducen a NAD o FADH2. La e- y el p+ serán cedidos a otra moléc en una reacción post de óxido-reducción, es decir, el NADH y el FADH2 se comportan como transportadores de energía celular. ETAPAS DEL METABOLISMO CELULAR PARA OBTENCION DE ENERGIA DE LOS ALIMENTOS Las prots polisacáridos y grasas que forman la mayoría de los alimentos, deben degradarse en molécs más pequeñas antes de que nuestras céls puedan usarse. Este proceso de degradación que usa enzimas para degradar molécs complejas en otras más simples → catabolismo celular e involucra tres etapas: 1. Ocurre por fuera de las céls e involucra el desdoblamiento de macromolécs grandes en subunidades simples por enzimas digestivas. Luego de la digestión, los AA, azúcares simples, ácidos grasos y glicerol ingresan al citosol donde comienzan su oxidación gradual. 2. Una serie de reacciones, glucólisis, convierte c/moléc de glucosa en 2 molécs más pequeñas de piruvato, el cual se transporta desde el citosol hacia la matriz mitocondrial y se oxida a acetil-CoA, produciéndose una pequeña cantidad de ATP y NADH. En la degradación gradual de ácidos grasos se producen grandes cantidades de acetil-CoA. 3. Dentro de las mitocondrias e involucra la oxidación completa de acetil-CoA y producción de ATP y NADH. GLUCOLISIS →CITOSOL Glucólisis: proceso de 10 pasos que ocurre en el citosol. En los pasos 1 a 3, desde una moléc de glucosa y con gasto de E (2 ATP), se genera una moléc de fructosa 1,6-bifosfato. En 4 y 5 se desdobla esta moléc de 6 C en 2 molécs de 3 C c/u (gliceraldehido 3-fosfato). De 6 a 10, estas molécs se vuelven 2 molécs de piruvato y se generan 4 ATP y 2 NADH. Resumen: desde una moléc de glucosa obtenemos 2 NADH, 2 ATP y 2 DECARBOXILACION OXIDATIVA MATRIZ MITOCONDRIAL → Ocurre dentro de la matriz mitocondrial, el piruvato, se oxida y obtenemos 1 NADH + 1 acetil-coa. Teniendo en cuenta que, por c/ moléc de glucosa obteníamos 2 piruvato, desde una moléc de glucosa, nos da 2 NADH y 2 acetil-CoA. 16 CICLO DE KREBS O DEL ACIDO CITRICO → MATRIZ MITOCONDRIAL El acetil-CoA va ingresa a un ciclo de 8 pasos enzimáticos dentro. Por c/moléc de acetil-coa, se obtiene 3 NADH, 1 FADH2, 1 ATP y 2 CO2. Si tomamos en cuenta que por c/moléc de glucosa obteníamos 2 acetilcoa, el resultado final de krebs (por moléc de glucosa) son 6 NADH, 2 FADH2, 2 ATP y 4 CO2. FOSFORILACION OXIDATIVA → MEMB MITOCONDRIAL INTERNA La E que se acumuló en los transportadores de E NADH y FADH2, es transferida unas prots en la memb mitocondrial interna que forman la cadena de transporte de e-. El NADH dona sus e- al complejo I o NADH deshidrogenasa y se oxida a NAD, los e- de FADH2 entran a la cadena de transporte de e- por el complejo II o succinato deshidrogenasa; estos e- van a ir pasando de un complejo al sig por reacciones de óxido-reducción y van a ir perdiendo E en c/ paso. En el complejo IV o citocromo oxidasa, estos e- se van a combinar con 1 O2 para generar H2O. FOSFORILACION OXIDATIVA: FUERZA PROTON-MOTRIZ Los e- van a ir perdiendo E en su paso por los complejos I, III y IV, que es usada para bombear p+ por la memb mitocondrial interna hacia el espacio intermemb, donde se van a acumular. Este bombeo activo de p+ genera, por un lado, un gradiente de voltaje, un potencial de memb por la memb mitocondrial interna en donde el interior (del lado de la matriz) es negativo y del lado externo (en el espacio intermemb) positivo. También se genera un gradiente de [p+], un gradiente de pH en el que el pH es casi 0.5 más alto en la matriz que al espacio intermemb. El gradiente electroquímico total, consiste en una gran F que responde al potencial de memb o ΔV y una F más pequeña del gradiente de [p+], ΔpH, ambas F se combinan en la fuerza protón-motriz. FOSFORILACION OXIDATIVA: SINTESIS DE ATP Esta fuerza protón-motriz, conduce al p+ de vuelta hacia la matriz mitocondrial a favor de su gradiente electroquímico e impulsa la síntesis de ATP. Se da por la enzima ATPsintasa, en la memb mitocondrial interna, que acopla el pasaje de p+ a favor de su gradiente electroquímico con la síntesis de ATP desde el ADP y el fósforo inorgánico. ATP SINTASA Es una prot de formada por varias subunidades. Una porción enzimática grande o f1 se proyecta hacia la matriz mitocondrial y se adhiere a un transportador de p+ transmemb o porción f0 a través de una subunidad delgada con forma de tallo. El pasaje de p+ por el transportador, hace que el tallo gire por dentro de la porción f1 induciéndola a formar ATP, es capaz de generar más de 100 ATP/ seg y es necesario que pasen aprox 3 p+ por la sintasa para sintetizar c/ ATP. La ATP sintasa es un mecanismo con un acoplamiento reversible, puede aprovechar el flujo de p+ a favor de su gradiente electroquímico y generar ATP (función normal) y puede hidrolizar ATP para bombear p+ por la memb (la ATP sintasa es bomba de p+). Todo depende de la magnitud del gradiente electroquímico de p+ a través de la memb en la que se encuentra. EL GRADIENTE ELECTROQUIMICO DE H+ TAMBIEN SE UTILIZA PARA EL TRANSPORTE ACOPLADO Los transportadores de molécs (piruvato, ADP y fosfato inorgánico) pueden acoplar su transporte con el flujo energéticamente favorable del p+ hacia el interior de la matriz mitocondrial. Ej: el piruvato y el fosfato 17 inorgánico son co-transportados hacia el interior de la matriz al mismo tiempo que lo hacen los p+ a favor de su gradiente de [], una prot anti porter aprovecha el gradiente de voltaje para expulsar ATP hacia el citosol e importar ADP hacia la matriz mitocondrial. La cantidad de ATP final que c/ moléc transportadora produce depende de varios factores (incluso del sitio de la cadena respiratoria en el que ingresan sus e-). Las molécs de NADH que se producen dentro de la mitocondria (matriz mitocondrial) ceden sus e- al complejo I y dan E para la formación neta de aprox de 2.5 ATP por moléc de NADH, los e- de FADH2 ingresan a la cadena de transporte de e- por el complejo II, c/FADH2 genera aprox de 1.5 ATP. El NADH citosólico rinde menos molécs de ATP que el producido en la matriz mitocondrial ya que tiene que ser transportado hacia la matriz con gasto de E. Por c/ moléc de glucosa, se generan aprox de 30 ATP. LAS GRASAS TAMBIEN SE OXIDAN A ACETIL COA: B-OXIDACION DE ACIDOS GRASOS Los ácidos grasos de las grasas son un combustible alternativo de los azúcares para la generación de E. Los ácidos grasos → acetilCoA dentro de la matriz mitocondrial por la ẞ-oxidación. Es catalizado por 4 enzimas en la matriz mitocondrial, que acortan la cadena del ácido graso en 2C c/vez, generando 1 acetil-coa, 1 NADH y 1 FADH2 en c/ ciclo. Ya que los ácidos grasos tienen cadenas de C largas, las grasas dan + E que los HdC por la cantidad de NADH y FADH2 suplementarias que se generan en la ẞ- oxidación. Son > que las producidas por la glucosa en la glucólisis y la descarboxilación oxidativa. LA GLUCOLISIS Y EL CICLO DE KREBS PROVEEN PRECURSORES PARA LA SINTESIS DE MUCHAS BIOMOLECULAS Las reacciones catabólicas (glucólisis y krebs) producen E y unidades estructurales de las cuales elaboran muchas otras molécs. Muchos de los intermediarios formados en las reacciones se desvían a vías biosintéticas o anabólicas, donde reacciones enzimáticas los convierten en AA, nucleótidos, lípidos y otras molécs orgánicas. OXIDACION PARCIAL DEL ALIMENTO: FERMENTACION LACTICA En ausencia de O2, algunos microorganismos aerobios (levaduras o M estriado esquelético) pueden obtener E por la oxidación parcial del alimento. M estriado esquelético: el piruvato de la glucólisis se mantiene en el citosol y es transformado en lactato, se regenera el NAD que se consumió en el 6to paso de la glucólisis dando 2 ATP. Rinde mucho - E total que la oxidación completa. FERMENTACION ALCOHOLICA En el caso de microorganismos aerobios, el piruvato de la glucólisis se convierte, por el acetaldehído, en CO2 y etanol. Se regenera NAD desde NADH para permitir que la glucólisis continúe, se generan 2 ATP. Ambas vías de fermentación parcial del alimento, rinden mucho - E total que la oxidación completa. MITOCONDRIOPATIAS Afectan a tejs de alto requerimiento energético como por ejemplo el músculo estriado y el tejido nervioso. BC 5 NÚCLEO INTERFASICO. CROMATINA Y CROMOSOMAS. Núcleo: organela membranosa en el centro de las céls eucariontes. Contiene la > parte del material genético, que está organizado en varias molécs de ADN muy largas y lineales, unido a prots. Formando los cromos. Función: mantener la integridad de los genes contenidos en el ADN y controlar actividades celulares regulando la expresión génica. 18 ESTRUCTURA DEL NUCLEO EN INTERFASE En MO, el núcleo de una cél en interfase veremos sus componentes más característicos; la envoltura nuclear que los rodea y por dentro la cromatina, ADN + prots, y el nucléolo. ENVOLTURA NUCLEAR O CARIOTECA Son 2 membs concéntricas, memb nuclear interna y memb nuclear externa, entre ambas está el espacio perinuclear. La memb nuclear externa se continúa con la memb del RE, por lo cual hay una comunicación directa entre el espacio perinuclear y el lumen del RE. La memb nuclear externa es funcionalmente similar a la del RE y tiene ribosomas adheridos en su superficie citoplasmática. La memb nuclear interna tiene prots únicas y específicas del núcleo que se encargan de unirse a la matriz nuclear y a las prots de la lámina nuclear. FILS INTERMEDIOS NUCLEARES: LAMINA NUCLEAR La lámina nuclear está por dentro de la memb nuclear interna. Es una red fibrosa que da soporte estructural al núcleo. Formada por prots, láminas, que pertenecen a la flia de los fils intermedios. Las prots láminas son el único tipo de fil intermedio hay dentro del núcleo. Las céls de los mamíferos tienen 3 genes que codifican para las prots láminas, A, B y C, estas prots reciben los mismos nombres. Las láminas interactúan con receptores de la memb nuclear interna, como la emerina y el receptor de lámina B, que interaccionan con la cromatina por unión a las histonas y tienen capacidad de unirse directamente al ADN. POROS NUCLEARES (PN) La memb nuclear está perforada por los poros nucleares. Son compuertas por donde entran o salen del núcleo todas las molécs. C/PN está formado por unas 100 prots ≠ y tiene un canal lleno de H2O por los cuales pasan de manera libre y no selectiva las sts hidrosolubles de pequeño tamaño. Las molécs más grandes, ej las prots deben ingresar al núcleo o las subunidades ribosomales que deben ir al citosol deben tener una señal de distribución apropiada para pasar por el PN. Las secuencias señal que dirigen a las prots para ingresar al núcleo se llaman señales de localización nuclear y son una o dos secuencias cortas que contienen AA con carga positiva. NUCLÉOLO Sitio donde se sintetiza el ARNr y se ensambla a las subunidades ribosomales. ESTRUCTURA Y FUNCION En él, están las versiones de los cromos que tienen las múltiples copias del gen para el ARNr 45S. Funcionalmente se pueden distinguir dos zonas principales: • Zona fibrilar: está el ADN y los ARN transcrito primario, contiene 200 copias del gen del ARN 45S, molécs de ARN 45S, los factores de transcripción, la ARN polimerasa I. • Zona granular: sitio donde se ensamblan las subunidades ribosomales Al ME se ven 3 regiones diferenciadas: el centro fibrilar (ADN de los genes nucleares), componente fibrilar denso (copias de ARN de 45S que se transcriben desde dichos genes) y componente granular (subunidades ribosomales en formación). La modificación de algunos ARN especiales, cómo ser el ARN de la partícula de reconocimiento de la señal, también se produce en el nucléolo. ARN RIBOSOMALES QUE SE SINTETIZAN EN EL NUCLEOLO De los 4 ARN en las subunidades ribosomales, 3 se sintetizan en el nucléolo pero surgen por el corte de un ARN transcrito primario común que es el pre ARNr de 45S. TRANSCRITO PRIMARIO COMÚN: ARNr 45S 19 El pre ARN transcripto primario de 45S contiene a los ARN de 18S, 5.8S y 28S, además de regiones espaciadoras transcriptas en gris. Estas regiones espaciadoras son eliminadas por ribonucleoprots pequeñas nucleolares. Éstas ribonucleoprots se unen al pre ARNr para formar un complejo de procesamiento de manera similar a como se forman los espliceosoma en el pre ARNm. CROMATINA Sts que forman los cromos y son la asociación del ADN + prots histónicas y no histónicas. Las histonas más abundantes son la H1, H2A, H2B, H3 y H4. Las prots no histónicas son prots que forman parte de la matriz nuclear, están relacionadas con actividades que se llevan a cabo en el núcleo como ser la transcripción, la replicación, entre otras. ADN C/ ADN consiste en 2 cadenas de nucleótidos complementarias, c/u formada por 4 tipos de subunidades (nucleótidos) y ambas están unidas por enlaces de H entre las bases de los nucleótidos. Los nucleótidos están formados por una pentosa (desoxirribosa), a que se une un grupo fosfato y una base nitrogenada (adenina, citosina, timina o guanina). Los nucleotidos están unidos entre sí, formando una cadena por las pentosas y los fosfatos establecen un esqueleto de azúcar-fosfato alternante. La forma en que están unidos entre sí los nucleótidos, le da a la cadena de ADN una polaridad química, ésta se indica denominando el extremo 3´a uno de los extremos y 5´ al otro. ESTRUCTURA Los nucleótidos en la doble del ADN están unidos por enlaces H entre las bases de cadenas ≠. ADENINA → TIMINA; CITOCINA →GUANINA. En c/ caso, una purina se aparea con una pirimidina; c/ par purina-pirimidina: par de bases. Las 2 cadenas de la hélice corren anti paralelas una de la otra, orientadas con polaridades opuestas. Las 2 cadenas del ADN se enrollan una alrededor de la otra, formando una hélice dextrógira con 10 bases/ vuelta. Tiene 2 surcos: surco más ancho -> surco > y el más estrecho surco menor. C/ cél humana contiene 2 metros de ADN, pero un núcleo celular mide solamente entre 5- 8 micras de diámetro. Comprimir o compactar el ADN dentro del núcleo requiere prots que pliegan y enrollan el ADN. Las prots que se unen al ADN formando los cromos se dividen en dos clases generales, las histonas y las no histonas. Las histonas son las responsables del 1er nivel de compactación de la fibra cromatínica, que es el nucleosoma. La estructura de la partícula central del nucleosoma se determinó por la digestión de la cromatina con nucleasas que degradan el ADN por de cortes entre los nucleótidos. Post de una digestión breve, solamente se degrada el ADN entre las partículas centrales de los nucleosomas. Este ADN se denomina ADN ligador o espaciador. C/ partícula central está formada por 8 histonas con 2 molécs de las histonas H2A, H2B, H3 Y H4 + el ADN bicatenario con longitud de 147 pares de nucleótidos (que se enrolla alrededor del octamero de histonas). La longitud del ADN espaciador varía desde unos pocos nucleótidos hasta aprox 80. Nucleosoma: partícula central + uno de sus ADN espaciadores contiguos; muchas veces se usa el término para la partícula central. La formación de los nucleosomas convierte una cadena de ADN en una hebra de cromatina que tiene alrededor de un tercio de su longitud inicial y provee el primer nivel de condensación del ADN. A las partículas centrales de nucleosomas se les une una 5ª histona, H1, formando la cromotosoma, formada por 166 pares de bases enrollados alrededor del centro de histonas y sujetos por 20 la h1. El empaquetamiento del ADN con histonas produce una fibra de cromatina que tiene aprox 10 nanómetros de diámetro y está formado por cromatosomas separados por ADN ligador. La sucesión de cromatosomas produce la imagen de collar. La cromatina se condensa aún más formando fibras de 30 nanómetros. Ésta se forma ya que los cromatosomas se enrollan sobre sí mismos adoptando la disposición solenoide. Condensación de la cromatina: en mitosis, los cromos se condensan para ser distribuidos en las céls hijas. Los lazos de cromatina de 30 nm se pliegan sobre sí mismos para formar los cromos compactos de la metafase (ADN condensado alrededor de diez mil veces). El ADN de los cromos en metafase se organiza en grandes lazos unidos a un andamio de prots no histónicas. En la interfase, la > parte de la cromatina está menos condensado formando la eucromatina. La > parte de la eucromatina está en forma de la fibra de 30 nm y los genes de ella se transcriben activamente. Aprox el 10% de la cromatina en interfase forma la heterocromatina que está muy condensado, transcripcionalmente inactiva y contiene secuencias de ADN altamente repetitivos. Un tipo especial de heterocromatina es la facultativa. Está formada por uno de los 2 cromos X inactivados en las céls somáticas de la mujer. Este X inactivo forma el cuerpo de Barr o cromatina sexual y se llama heterocromatina facultativa porque se transcribe en algunos tipos celulares como ser las ovogonias o en ciertos momentos del desarrollo. REGULACION DEL ENROLLAMIENTO DE LA CROMATINA Hay ≠ mecanismos para ajustar la estructura de la cromatina a nivel local, para que esté + o - condensada. Uno ellos es el uso de complejos de remodelación de la cromatina que usan la E de hidrólisis de la ATP para cambiar la posición del ADN enrollado en los nucleosomas. Estos complejos producen sitios repetidos de hidrólisis de ATP y permiten que se afloje el ADN nucleosómico, al empujarlo a lo largo del centro de histonas→ desplazamiento del nucleosoma y expone el ADN a otras prots que se unen al mismo. Una forma de alternativa de alterar la estructura de la cromatina es la modificación química reversible de las histonas. Los extremos amino y carboxilo de las 4 histonas centrales, colas de las histonas, sobresalen de la partícula central y son accesibles para recibir modificaciones covalentes de las enzimas residentes en el núcleo. A estas colas de histonas, se les añaden o quitan grupos químicos que afectan la conformación de la cromatina, haciendo que el ADN sea + o - accesible a factores de transcripción o de replicación. Afectan la estabilidad de la fibra cromatínica de 30 nm, aumentando o disminuyendo su enrollamiento. CROMOSOMAS Una cél se reproduce por la duplicación y división en céls hijas, ciclo celular. La fase de división se denomina fase M y ahí cuando se pueden ver los cromos como entidades individuales. Para producir un cromo eucariótico que pueda duplicarse y luego dividirse en 3 céls hijas en la mitosis, se necesitan tres elementos: Los orígenes de replicación, El centromero y Los telómeros. C/ cromo tiene múltiples sitios de inicio de la replicación del ADN. En un ciclo celular, el ADN se duplica en interfase comenzando en los orígenes de 21 replicación y avanza bidireccionalmente a lo largo de todo el cromo. En la fase M, el centromero une los cromos duplicados al huso mitótico para que se distribuya una copia a c/cél hija; el centromero ayuda a mantener juntos los cromos duplicados hasta que estén listos para separarse. Los telómeros garantizan que los extremos de los cromos se dupliquen e impiden que estos extremos se confundan con ADN dañado que necesita reparación. LOS CROMOSOMAS INTERFASICOS ESTAN ORDENADOS DENTRO DEL NUCLEO En un núcleo en interfase se puede ver que los cromos ocupan territorios ≠ dentro del núcleo. CROMOSOMAS METAFASICOS Como consecuencia de la duplicación cromosómica en interfase, c/ cromos tiene 2 molécs de ADN hijas idénticas. C/u de estas molécs de ADN con sus prots asociadas se denomina cromátide y están unidas en forma estrecha a todo lo largo del cromosoma. La constricción en la zona medial en el cromo es el centromero y las porciones que están por arriba y por debajo se denominan brazos cromosómicos. El centromero divide al cromo en 2 brazos que puedan tener longitudes ∆. Los cromos humanos en metafase tienen 3 formas básicas y se pueden clasificar según la longitud relativa de los brazos cortos y largos. • • • Metacéntricos: ambos brazos de = longitud, centromero central; Submetacéntricos: brazos de longitudes ≠, centromero más próximo a uno de los extremos; Sacrocéntricos: centromero mucho más cerca de un extremo, brazo corto muy pequeño. Tienen constricciones secundarias en los brazos cortos que conectan trozos muy pequeños de c/ cromátide, tallo y satélite, con el centrómero. Los tallos tienen los organizadores nucleolares que corresponden a los genes que codifican el ARNr 45S. CARIOTIPO El ordenamiento de los cromos de una cél según su tamaño y morfología forman un cariotipo. En el cariotipo humano, los 23 pares de cromos se clasifican en 7 grupos, A-> G, según su tamaño y posición del centrómero. BC 6 CICLO CELULAR Tiempo de vida de una cél = celular. En este T, la cél crece, aumenta de tamaño y se divide. Función básica: duplicar en forma exacta el ADN y distribuir las copias en las céls hijas. Fase M: periodo de la división celular, se divide tanto el núcleo como el citoplasma. El periodo entre la fase M y la sig se denomina interfase. La interfase es un periodo muy activo que se divide en 3: • G1: la cél crece de tamaño, sintetizan prots, organelas, etc. Si todo va bien, la cél entra en fase S • S: duplica su ADN • G2: se prepara para la división celular. En casos especiales la cél puede salir del ciclo quedando en un estado de reposo donde no se divide, G0. 22 REPLICACIÓN DEL ADN En c/ división celular, el genoma debe ser copiado con mucha precisión. Proceso por el cual la cél copia su ADN: replicación o duplicación. Desde una molé de ADN se copia la info sintetizando otra moléc de ADN igual. En la interfase en G1, las 2 cadenas de ADN son anti paralelas y complementarias. En S, las cadenas se abren para ser copiadas y éstas quedan unidas. En M, las copias se separan en 2 céls hijas que reciben una moléc de ADN c/u, siendo genéticamente iguales entre si e iguales a la cél madre. C/cadena de ADN es complementaria a la otra cadena, c/ cadena puede servir como molde para sintetizar la cadena complementaria Ej: una moléc de ADN formada por 2 cadenas, S y S´, paralelas y complementarias. Si se toma S de molde, se copia por complementariedad de base, se estará sintetizando una cadena nueva idéntica a la cadena de S´. Si tomamos S´ de molde, se sintetiza una cadena nueva idéntica a S. El ADN actúa como molde para su replicación. Permite que la info genética del ADN pueda ser copiada en forma muy precisa. C/ cél hija hereda una doble hélice formada por una cadena molde y una nueva. Semiconservativa. Las 2 hebras del ADN se separan por la enzima HELICASA, que rompe los enlaces puente de H (mantiene unida a las bases complementarias de las 2 hebras). Las prots estabilizadoras mantienen separadas a las 2 hebras en toda la duplicación. La doble hélice se separa formando una estructura bifurcada, horquilla de replicación: inicia la replicación. (Ambas cadenas son anti paralelas). Cadena continua: 5´´→3´. La ADN polimerasa sintetiza los nucleótidos y forma la nueva cadena, pero sólo puede empezar a trabajar a partir de un cebado (ARN primasa). Los cebadores de ARN son el punto de inicio de la síntesis de la nueva cadena. La ADN polimerasa comienza a sintetizar y posicionar los nucleótidos complementarios, desplazándose por toda la cadena molde. Cadena discontinua: 3´´→5´. La ADN polimerasa sólo puede sintetizar cadenas en sentido 5´→´3´. Para sintetizar la nueva cadena discontinua, la ARN primasa añade un cebador de ARN para que la ADN polimerasa pueda sintetizar una porción de la nueva cadena. La ARN primasa agrega otro cebador más adelante, para que la ADN polimerasa pueda sintetizar otro fragmento. La nueva cadena queda formada por fragmentos discontinuos, fragmentos de Okazaki. En la replicación, la ADN polimerasa se autocorrige. Chequea que el nucleótido que agrego sea correcto, cuando no lo es, la misma enzima corta la unión que hizo y elimina el nucleótido usando su actividad 3´-5´ exonucleasa. Une otro nucleótido, y si es correcto, lo deja y la síntesis continúa. Hay muchas prots que colaboran con el ADN polimerasa en la replicación: • ADN helicasa: abre la doble hélice de ADN con gasto de ATP. rompe los puentes de H para dejar una cadena simple de ADN. • Las prots de unión al ADN de cadena simple se unen a la cadena simple generada por la helicasa evitando formen uniones con la otra cadena. Se unen de forma cooperativa, y mantienen estirada la cadena de ADN para que actúe como molde en la replicación. • La ADN polimerasa se mantiene unida al ADN por la prot abrazadera deslizante, de otra forma se desplegaría antes de terminar la síntesis de ADN. Es un anillo que se coloca alrededor del ADN y sujeta al ADN polimerasa mientras sintetiza el nuevo ADN. • Para ensamblar la abrazadera, se requiere la actividad de la prot cargador de la abrazadera que usa ATP c/ vez que asegura una abrazadera al ADN. Una vez que cargó la abrazadera, el cargador se es liberado y se une la ADN polimerasa. Esta carga se produce una vez por replicación. Sobre la cadena retrasada, la abrazadera se disocia y se vuelve a cargar c/ vez que se sintetiza un fragmento de Okazaki. 23 En eucariotas hay ≠s tipos de ADN polimerasa: Otras enzimas que colaboran en la duplicación del ADN son las topoisomerasas. Alinean el superenrollamiento ocasionado por la helicasa cuando separan las cadenas de ADN. • • Topoisomerasa I: produce un corte en una sola cadena de ADN, permite que rote libremente para aliviar el superenrollamiento. Esta enzima queda unida al ADN. Al hacerlo se guarda, en la unión, la E para volver a formar enlace fosfodiéster que se rompió, la reacción es reversible. El enlace fosfodiéster se vuelve a formar y regenera al ADN y a la enzima. Topoisomerasa II: forma un enlace covalente en las 2 cadenas de la doble hélice, provocando una ruptura transitoria de la doble cadena, en sitios donde las 2 cadenas se enrollan sobre sí mismas. La enzima hidroliza ATP para romper una de las dobles hélices, hace pasar la otra por la abertura y luego sella la ruptura. También desenrolla el ADN. Los telómeros (extremos de los cromos), lineales tienen un problema de replicación en su extremo: en el final de la cadena retrasada no hay lugar para hacer un cebador de ARN que se necesita para sintetizar el fragmento de Okazaki. En eucariotas, hay secuencias especiales de ADN telomérico que atraen a la enzima telomerasa. Agrega nucleótidos usando un molde interno de ARN en la cadena parental que actúa como molde para que el ADN polimerasa complete la replicación de los telómeros. MUTACIONES EN EL ADN Son alteraciones en la secuencia del ADN. Pueden tener consecuencias drásticas, nulas o beneficiosas. La fidelidad en la replicación del ADN es muy importante, por eso existe un conjunto de mecanismos que reducen la cantidad de mutaciones. Este sist repara el 99% de los errores. En la replicación, el ADN polimerasa produce un error c/10 millones de nucleótidos copiados. Con la ayuda del sist de reparación, se produce un error c/1000 millones de nucleótidos copiados. Un error en la duplicación del ADN deja un nucleótido mal apareado, si no se corrige habrá una mutación en el prox ciclo de replicación. Esto es arreglado por un complejo de prots de reparación deben corregir sólo la cadena recién sintetizada, y así dejar sin cambios el ADN. El ADN puede sufrir daño espontaneo, si no se arregla puede generar mutaciones. Los cambios espontáneos en las secuencias de base de ADN son: • • • Despurinizacion: se pierden las bases purinas A y G. Se hidroliza o rompe la unión glucosídica que une el azúcar a la base purina. Produce la perdida de la base nitrogenada en ese nucleótido, sitio apurinico. Desaminación: perdida espontanea del grupo amino de cualquiera de las bases. La base nitrogenada pierde un grupo amino y cambia a uracilo. Todas las bases menos las timinas. Deja bases anormales, como la hipoxantina, la xantina y el uracilo. Dímeros de pirimidinas: se unen 2 bases pirimidinas entre sí. Generalmente 2 timinas. Los sistemas de reparación del ADN son varios: • Lectura de prueba del ADN polimerasa • Reparación de la miss-match (MMR): se elimina 1 o unas pocas bases mal apareadas post la replicación. • Reparación por escisión de base (BER): repara bases mal apareadas. Una base desaminada, ej: una citosina → uracilo, es reconocida por la uraciladn-glicosilasa que corta la base nitrogenada generando un 24 • • sitio apurinico. Luego, la endonucleasa AP, remueve al nucleótido que no tenía base y la ADN polimerasa une el nucleótido correcto y la ADN ligasa une la citosina desaminada queda devuelta a citosina. Reparación por escisión de nucleótidos (NER): soluciona los dímeros de timina. Detecta y elimina las alteraciones que deforman la doble hélice. Repara los dímeros de pirimidina. Una endonucleasa detecta el dímero de pirimidina y corta un segmento en la cadena de ADN a los lados de este dímero. Luego la ADN polimerasa copia los nucleótidos faltantes, la ADN ligasa sella el Nick y el dímero queda reparado. Reparación por recombinación: cuando hay rupturas en la doble cadena. Se usa como molde otra moléc de ADN hermana o homologo para solucionar este daño. Participan las prots BRCA 1 Y BRCA 2. Un daño grave del ADN se produce cuando ambas cadenas se rompen y no queda la cadena molde intacta que guíe la reparación. Si esta lesión no se repara, puede causar fragmentación de los cromos sin pérdida de genes. Comúnmente, se soluciona el mecanismo “unión de extremos no homólogos”: los 2 extremos rotos son acercados por un grupo de enzimas y vueltos a unir. Se repara la ruptura, aunque se suelen perder nucleótidos. Recombinación homóloga: se intercambia info genética entre las cadenas de ADN homologas. Si hay ruptura del ADN doble cadena, se usa el cromo homologo para copiar y unir las cadenas dañada. Se da en el crossing over. En este caso, las secuencias de nucleótidos no son alteradas, no se gana ni se pierden nucleótidos. BC 7 ESTRUCTURA DE LOS GENES. TRANSCRIPCIÓN DEL ADN. FLUJO DE INFORMACION GENETICA La info genética está guardada en el ADN, se duplica al copiarse y se copia a otro tipo de ácido nucleico → el ARN por la transcripción. La info que está en los ARN pasa a prots por la traducción o síntesis proteica, entonces la info genética fluye del ADN a las prots. TASA DE EXPRESION GENETICA Es la vel con que se transcribe un gen. Ej: el gen A tiene una alta tasa de transcripción lo que produce más prots; el gen B tiene una transcripción menor y genera menos prots. La cél puede producir gran cantidad de algunas prots y cantidades mínimas de otras. ARN ≠ ADN Transcripción, ADN → ARN, se sintetiza una nueva moléc de ARN. El ARN es un polímero de ribonucleótidos, su azúcar es la ribosa, tiene el uracilo, es monocatenario y hay de varios tipos. TRANSCRIPCION = SINTESIS DE ADN La transcripción comienza con la apertura de la doble hélice de ADN. La cadena molde es leída para copiar la cadena complementaria, antimolde o codificante. En la transcripción, el ARN es desplazado y se vuelve a formar la doble hélice de ADN. ARN POLIMERASA Enzimas de la transcripción: ARN pol. Catalizan la unión fosfodiéster entre 2 ribonucleótidos. No usa primers o cebadores → no corrige. La ARN pol lee la cadena molde en sentido 3´→ 5´ para sintetizar 5´→ 3´. Los sustratos de la reacción son los ribonucleótidos trifosfatados que entran al sitio activo de la ARN pol por un canal y cuyos enlaces de alta E, dan la E para hacer el enlace. El ARN sintetizado sale por un canal. TIPOS DE ARN Hay ≠ tipos de ARN producidos en las céls: • ARNm (mensajeros): codifican prots 25 • • • • ARNr (ribosomales): forman el ribosoma y catalizan la síntesis de prots miARN (micro): regulan la expresión génica ARNt (de transferencia): adaptadores entre el ARNm y los AA en la síntesis de prots Otros ARN pequeños: usados el corte y empalme, mantenimiento de telómeros, formación del ribosoma en el nucléolo Hay tres tipos de ARN polimerasa: • ARN polimerasa I: transcribe ARNr 45S • ARN polimerasa II: transcribe ARNm, miARN, ARN pequeños • ARN polimerasa III: transcribe ARNt, ARNr 5S, ARN pequeños ESTRUCTURA DE LOS GENES Un gen eucariota tiene varias estructuras. Promotor: secuencia de nucleótidos de ADN que regula el inicio de transcripción. Se les unen los factores basales de la transcripción (factores de la transcripción). Gen X: formado de intrones (secuencias de ADN que no son parte de la prot X) y exones (secuencias de ADN que codifican para la prot X). Secuencias regulatorias: aumentan o inhiben la transcripción. El paso crucial en la expresión de los genes es el inicio de la transcripción → la ARN polimerasa se posiciona en la secuencia promotora, con la ayuda de los factores basales de la transcripción. FACTORES DE TRANSCRIPCION BASALES O GENERALES Ayudan a posicionar a la ARN pol II en el promotor, ayudan a separar las cadenas de ADN y a que la ARN pol empiece a transcribir en su modo de elongación. El TFIID (factor de transcripción 2D) reconoce y se une a la TATA box en el promotor. La TATA box es una secuencia de ADN que está en el promotor. Cuando TFIID se une a ella, se induce la unión del factor TFIIB. TFIIB reconoce otras secuencias en promotores y ayuda a posicionar la ARN pol. TFII estabiliza la unión de la ARN pol con los factores basales de la transcripción y atrae al TFIIE y el TFIIH. TFIIH h abre el ADN en el inicio de la transcripción y fosforila la cola carboxiterminal de la ARN pol. Esto libera a la ARN pol que empieza a transcribir, y libera los factores basales que no son necesarios. La ARN pol, con la ayuda de factores de elongación, la ayudan a mantenerse unida al ADN sintetiza entonces el ARN FACTORES DE TRANSCRIPCION ESPECIFICOS Son necesarias prots regulatorias (activadores), factores específicos o reguladores de la transcripción que se unen a regiones regulatorias que pueden ser intensificadoras o inhibitorias. Los activadores transcripcionales necesitan del mediador que permite que el activador se comunique con la ARN pol y los factores de inicio de la transcripción. Cuando este complejo está listo comienza la transcripción. Para empezar a transcribir, la cromatina debe estar descondensada → se reclutan complejos enzimáticos que la modifiquen, como un complejo remodelador de la cromatina o histonas acetiladas. En los lugares donde los genes se expresan mucho la cromatina está más laxa → eucromatina. La transcripción se vería algo así: El gen X va a ser transcripto, ya que un activador + factores específicos activan a la ARN pol (que está junto con los factores basales en el promotor). Esta se da por un mediador y el resultado es el transcripto de ADN. 26 Los ARNm son procesados antes de salir del núcleo, para ser traducidos en el citosol. El ARNm transcripto primario sufre una maduración de 3 procesos: encapuchamiento, corte y empalme y poliadenilacion. (Encapuchamiento y poliadenilacion son exclusivos de los ARNm). Según el tipo de ARN que se está usando, los transcriptos son procesados antes de abandonar el núcleo. Las enzimas que hacen el procesamiento de ARN están en la cola carboxiterminal de la ARN pol y, a medida que va saliendo, el ARN transcripto primario van actuando sobre él: encapuchamiento → corte y empalme→ poliadenilacion. 1. Encapuchamiento o capping: agregado, al extremo 5´, de un nucleótido modificado, la 7-metil guanosina. Ocurre una vez que la ARN pol sintetizó aprox 25 nucleótidos. Aumenta la estabilidad del ARNm y lo ayuda para su exportación desde el núcleo al citoplasma. 2. El corte y empalme o splicing: se remueven los intrones (secuencias no codificantes) y se empalman los exones (secuencia codificante). Splicing: Unos ARNpn, unidos a prots, forman ribonucleoprots → empalmosoma o spliceosoma. El complejo reconoce la secuencia de principio y final de los intrones, las corta y empalma los exones. Para hacer el corte y empalme, unos ARNpn reconocen los intrones. U1 reconoce el inicio del intrón y U2 reconoce el final. Se cree que las ribonucleoprots heterogéneas se asocian a los intrones y ayudan a distinguirlos de los exones a las prots de empalme. Existe (para algunos genes), un splicing alternativo que permite producir prots ≠ desde el mismo gen. 3. Poliadenilacion: agregado, en el final del ARN transcripto primario, de una cola de poliadenina (cola poli- A). La ARN pol pasa por la señal de corte y poliadenilacion. El extremo 3´ es cortado por factores enzimáticos en una secuencia particular. La poli-A polimerasa agrega a los nucleótidos de adenina. Hay prots de unión a la cola de poli-A que se unen y la estabilizan. Aumenta la estabilidad del ARNm y ayuda a identificarlo como tal para salir del núcleo. ¿Cómo sale el ARN maduro del núcleo? Se exporta de manera selectiva. El ARN maduro no debe contener prots que reconozcan intrones y si deben tener muchas prots que ayudan a distinguirlas. El ARNm tiene: una prot unida al capuchón, las prots que se unen a la cola de poli-A, y ribonucleoprots heterogéneas. Tiene, para su salida al núcleo, una exportina. Tiene unidas otras prots nucleares que se liberan antes que el ARNm salga. Una vez que pasa por el CPN, la exportina se libera en el citosol y es reciclada. En el citosol, el capuchón pierde su prot y se reemplaza por factores de inicio de la traducción, lo que deja al ARNm listo para ser traducido en el citosol. GEN DE ARN 45S TRANSCRIPTO POR ARN POLIMERASA I El ARNr forma el 80% del ARN total de una cél. Sólo el 5% de la ARN es el mensajero y el resto es ARNt. El ARNr es sintetizado por la ARN pol I, que es muy similar a la ARN pol II pero no tiene la cola carboxiterminal. Hay 4 ARNr, la ARN pol I sintetiza desde las 200 copias del gen del ARN 45 s en el nucléolo. Éste es un precursor que, post modificaciones químicas y clivaje, genera los ARN 18S, 5.8S y 28S. 27 La ARN pol III sintetiza el ARN 5S fuera del nucléolo y no requiere modificaciones. SINTESIS Y ENSAMBLADO DE LOS RIBOSOMAS En el nucléolo se reúnen los genes que sintetizan el ARN 45S. 1. La ARN pol 1 los transcribe en ese lugar 2. Las prots ribosomales que fueron sintetizadas en el citosol ingresan por el poro nuclear 3. El ARN 5S, sintetizado por la ARN polimerasa 3, entra al nucléolo 4. Los ARNpn empiezan a procesar prots y ARN para formar las subunidades ribosomales 5. Las subunidades ribosomales sufren una maduración 6. Salen al citosol donde finalmente se ensamblan para realizar la síntesis de prots Los ARNt son ARN pequeños de alrededor de 80 nucleótidos sintetizados por la ARN pol III. El ARNt forma una estructura terciaria, que es estabilizada por un puente H entre sus propias bases nitrogenadas. Posee una región, anticodón, que es un triplete de nucleótidos consecutivos que van a aparearse con el codón, otro triplete de nucleótidos, complementarios que están en el ARNm. A los extremos 3´ de los ARNt se les agrega un triplete CCA para todos. Éste se va a unir covalentemente el AA que le corresponde. El ARNt es un traductor del idioma del ARNm al idioma de las prots y va a cumplir su función en la síntesis proteica. BC 8 SÍNTESIS, FUNCIONALIDAD Y RENOVACIÓN DE PROTS PROTS Las prots están formadas por AA: grupo heterogéneo de molécs con una propiedad característica: tienen un grupo acido carboxilo y uno amino, ambos unidos al C. Se diferencian químicamente entre sí por su cadena lat, que también está unida al C. AMINOACIDOS Las prots están formadas por 20 AA ≠. La característica química de c/AA va a estar dado por la cadena lat que tienen, existen AA polares/ hidrofílicos y AA no polares/ hidrofóbicos. Dentro de los polares, hay algunos AA con carga negativa, otros positivos y otros son polares sin carga. Los AA se unen entre sí por enlaces peptídicos. Se forma un enlace peptídico covalente cuando el átomo de C del grupo carboxilo de un AA ataca químicamente al grupo amino de un 2do AA. En la reacción de condensación se formó una moléc de H2O y se gasta una moléc de ATP. Una prot está formada por AA unidos entre sí en una cadena polipeptídica. Los AA unidos por una unión peptídica forman un esqueleto polipeptídico de estructura repetitiva, del que se proyectan las cadenas lats de los AA. Extremos de c/cadena polipeptídica: el extremo que lleva el grupo amino libre → amino o Nterminal y el extremo que lleva el grupo carboxilo libre → carboxilo o C-terminal. Las posiciones de las ≠ cadenas lats químicamente ≠. Ej: polares y no polares, dan a c/prot sus propiedades individuales. La secuencia de AA de una prot está siempre en la dirección amino → carboxilo y se lee de izq a der. TIPOS DE ENLACES NO COVALENTES QUE CONTRIBUYEN AL PLEGAMIENTO DE LAS PROTEINAS 28 Las cadenas polipeptídicas largas son muy flexibles. Muchos de los enlaces covalentes que unen átomos de C de una cadena extensa permiten la rotación libre de los átomos que vinculan→ las prots se pueden plegar en una enorme cantidad de formas. C/ cadena plegada está restringida por numerosos grupos ≠ de enlaces no covalentes débiles que se forman dentro de las prots. En estos enlaces, participan los átomos del esqueleto polipeptídico, así como los átomos de las cadenas laterales de los AA. Enlaces no covalentes: enlaces de H, atracciones electrostáticas y atracciones de Van Der Waals. Se necesitan muchos enlaces no covalentes para mantener unidas 2 regiones de una cadena polipeptídica. La estabilidad de c/forma plegada estará afectada por las F combinadas de gran nro de enlaces no covalentes. 4ta fuerza débil: interacción hidrófoba. Las cadenas lats no polares o hidrófobas tienden a agruparse en el interior de una prot plegada para evitar el contacto con el citosol acuoso que las rodea. Las cadenas lats polares tienden a estar cerca de la parte externa de la prot plegada donde pueden formar enlaces H con el H2O y con otras molécs polares. ESTRUCTURAS DE LAS PROTEINAS C/ tipo de prot tiene una estructura tridimensional particular que se determina por el orden de los AA de su cadena (estructura primaria). Las cadenas polipeptídicas se pliegan en 1 o 2 patrones de plegamiento regular formando una estructura secundaria. El plegamiento global de la cadena polipeptídica completa, que da lugar a una forma tridimensional específica, estructura terciaria. La estructura cuaternaria es la estructura que adoptan las prots que tienen más de una cadena polipeptídicas → varias cadenas polipeptídicas con estructura terciaria se unen entre sí. ESTRUCTURA SECUNDARIA DE PROTEINAS: HELICE ALFA Y BETA Hélice alfa. En este patrón, el H del grupo amino de c/ enlace peptídico está unido por puente de H al O2 del grupo carboxilo de un enlace peptídico vecino, el cual está a 4 AA de distancia de la misma cadena. Las regiones cortas de la hélice alfa abundan en las prots de las membs celulares (prots de transporte y receptores). Hoja plegada beta: se forman enlaces de H entre segmentos adyacentes de las cadenas polipeptídicas. Cuando una estructura consiste en cadenas polipeptídicas vecinas que corren en la misma orientación. Ej: del N-terminal al C-terminal es una hoja beta paralela. Cuando se forma desde una cadena polipeptídica que se pliega una y otra vez sobre sí misma, c/sección de la cadena corre en dirección opuesta a las de sus vecinas, la estructura es una hoja beta antiparalela. Ambos tipos producen una estructura plegada muy rígida y forman el centro de muchas prots. SINTESIS PROTEICA O TRADUCCIÓN Cómo se convierte/traduce la info en una moléc de ADNm a una secuencia lineal de AA. CODIGO GENETICO Como hay sólo 4 nucleótidos ≠ en el ARNm, pero 20 tipos ≠ de AA en una prot, esta traducción no se puede explicar de manera directa entre un nucleótido de ARN y un AA de la prot. Las reglas por las cuales la secuencia de nucleótidos de un gen, por el ARNm, es traducida a la secuencia AA de una prot: código genético. La secuencia de nucleótidos de la moléc de ARNm se lee consecutivamente en grupos de 3. C/triplete de nucleótidos→ codón. Como el ARN es un polímero lineal formado por 4 nucleótidos ≠, hay 64 combinaciones posibles de 3 nucleótidos o sea 64 codones que codifican cada uno para un AA. • Casi todos los organismos usan este código genético, es decir, es universal, aunque existen algunas diferencias menores como por ejemplo en las mitocondrias. 29 • • • El código genético no es ambiguo, c/codón codifica para un solo AA. Es redundante, existen más de un codón para c/AA, algunos AA son especificados por más de un triplete. Es generado, codones para el mismo AA difieren frecuentemente en el tercer nucleótido del triplete. MARCOS DE LECTURA POSIBLES NO SUPERPUESTOS En el proceso de traducción de una secuencia de nucleótidos → secuencia AA, la secuencia de nucleótidos de una moléc de ARNm es leída de 5´→ 3´ en grupos secuenciales de 3 nucleótidos. La misma secuencia de ARN puede especificar 3 secuencias de AA ≠ según el marco de lectura, pero sólo uno de estos codifica el msj real. ¿Cómo se establece el marco de lectura correcto? Codón de iniciación. La traducción de un ARNm comienza con el codón AUG y se requiere ARNt especial para iniciar la traducción. El ARNt iniciador transporta el AA metionina → todas las prots recién sintetizadas tienen metionina como primer AA en su extremo N-terminal. Esta metionina es eliminada más tarde por una proteasa específica. ARN DE TRANSFERENCIA Son molécs captadoras que pueden reconocer y unirse, por un lado, al codón en el ARNm y, por el otro, a un AA en otro sitio de la moléc. Los ARNt están plegados en una estructura tridimensional formando pares de bases entre ≠ regiones de la moléc, formando una estructura como una hoja de trébol. La hoja de trébol se pliega y forma una como L, que es mantenida por otros ptes de H entre ≠ regiones de la moléc. 2 regiones de nucleótidos no apareados en c/extremo de la moléc en forma de L son cruciales para la función del ARNt en la síntesis proteica. Una de estas regiones forma el anticodón, grupo de 3 nucleótidos que se une al codón complementario de la moléc de ARNm; la otra es una región monocatenaria corta en el extremo 3´ de la moléc, que es el sitio del AA que se corresponde con el codón, se une al ARNt. ACTIVACION DE LOS AMINOACIDOS El ARNt tiene que unirse o cargarse a su respectivo AA. El reconocimiento y la unión del AA correcto dependen de enzimas aminoacil-ARNt-sintetasa, que se acoplan a c/AA con su grupo de ARNt. Existen 20 tipos ≠ de esta enzima, c/u reconoce un AA y todos los ARNt análogos. La reacción catalizada por la sintetasa (une el AA al extremo 3´ del ARNt) usa ATP y produce un enlace de alta E entre el ARNt cargado y el AA. La E que se usa en una etapa post de la síntesis proteica para unir el AA a la cadena polipeptídica en crecimiento. RIBOSOMAS La traducción rápida y precisa de ARNm a prots requiere de maquinaria molecular que se desplaza a lo largo del ARNm, captura molécs de ARNt complementarias, las mantiene en posición y une los AA que transportan para formar una cadena proteica. Es el ribosoma, complejo formado por más de 50 prots ≠, prots ribosomales, y varias molécs de ARNr. La unión práctica está catalizada por una de estas molécs de ARNr. Los ribosomas están formados por una subunidad grande y otra pequeña, que se encajan y forman un ribosoma completo. La subunidad pequeña hace coincidir los ARNt con los codones del ARNm, la subunidad grande cataliza la formación de enlaces peptídicos que unen a los AA entre sí y forman una cadena polipeptídica. C/ ribosoma tiene un sitio de unión para una moléc de ARNm y 3 sitios para las molécs de ARNt → sitio A, sitio P y sitio E. Para añadir un AA a una cadena polipeptídica en crecimiento, el ARNt cargado ingresa en el sitio A por apareamiento de bases con el codón complementario en la moléc de ARNm. Su AA es unido a la cadena polipeptídica sostenido por el ARNt en el sitio P 30 vecino. El ribosoma se desplaza y el ARNt usado es movido al sitio E antes de ser eyectado. Este ciclo de reacciones se repite c/ vez que se agrega un AA a la cadena polipeptídica, que crece de su extremo amino al carboxilo hasta el codón de terminación. TRADUCCIÓN Puede dividirse en tres etapas: • Iniciación: el ribosoma se une a la moléc de ARNm y comienza la traducción desde el codón de iniciación • Elongación: la cadena polipeptídica se elonga por el agregado sucesivo de AA • Terminación: al encontrar un codón stop, el polipéptido se libera y el ribosoma se disocia INICIACIÓN: El ARNt iniciador, acoplado a metionina, es cargado en la subunidad ribosomal menor con el factor de iniciación 2 (con gasto GTP). Luego, el factor de iniciación 4 se une al capuchón 5´ del ARNm (gasto de ATP). Por último, el factor de iniciación 3 y 4 colocan al extremo 5´del ARNm, sobre la cara de la subunidad menor del ribosoma que contiene los sitios E, P y A. Se desplaza la subunidad ribosómica menor a lo largo del ARNm buscando el codón de iniciación AUG. AUG se coloca en el sitio P y el ARNt cargado se une al codón AUG por su anticodón. Se disocian los factores de iniciación → se ensambla la subunidad ribosómica grande, por el factor de iniciación 5. Como el ARNt iniciador está unido al sitio P, la síntesis de la prot está lista para comenzar con la adición al sitio A del siguiente ARNt cargado. ELONGACION Se une un ARNt cargado adecuado al sitio A por el factor de elongación 1 con gasto de E. Luego, se forma del 1er enlace peptídico catalizado por una ARNr de la subunidad mayor. Ésta se desplaza con respecto a la subunidad menor → mueve a los 2 1ros ARNt hacia los sitios E y P de la subunidad grande, participa el factor de elongación 2 con gasto de E. La subunidad menor se mueve 3 nucleótidos por la moléc de ARNm, lo que restablece su posición original respecto de la subunidad mayor, participa el factor de elongación 2 y se gasta GTP. Sitio A vacío. Finalmente, se expulsa el ARNt que cedió su AA que estaba en el sitio E. Se une un nuevo ARNt cargado al sitio A por el factor de elongación 1 con gasto de E → nuevo ciclo de elongación. TERMINACION La presencia de uno o varios cordones stop, codones de terminación, señala el final del msj de codificación de una prot. Indican al ribosoma que termine la traducción. Las prots, factores de liberación, se unen a cualquier codón de terminación que alcance el sitio A del ribosoma. La unión de un factor de liberación cataliza el agregado de una moléc de H2O en lugar de un AA apeptidilARNt, induciendo que el polipéptido en el sitio P se desligue del último ARNt y se independice del ARNm del ribosoma. Se da por el factor de liberación 3 con gasto de E. El ribosoma libera el ARNm y se disocia en sus 2 subunidades que después pueden ensamblarse con otra moléc de ARNm y comenzar una nueva ronda de síntesis proteica. POLIRRIBOSOMAS Si el ARNm es traducido bien, un nuevo ribosoma alcanza el extremo 5´ de la moléc de ARNm casi tan pronto como el ribosoma precedente ha traducido lo suficiente de la secuencia de nucleótidos para apartarse del camino. Las molécs de ARNm que están siendo traducidas suelen estar como polirribosomas o polisomas, los cuales son grandes ensamblajes citoplasmáticos formados por varios ribosomas separados por 80 nucleótidos a lo largo de una única moléc de ARNm. Se pueden producir muchas más molécs de prot en un tiempo determinado de lo que sería posible si c/u tuviera que ser completada antes que pudiera comenzar la siguiente. INHIBICION DE LA TRADUCCION 31 Muchos de los antibióticos son compuestos que actúan por la inhibición de la síntesis proteica bacteriana. Algunos aprovechan las pequeñas ≠ estructurales y funcionales entre los ribosomas bacterianos eucariontes para interferir con la síntesis proteica bacteriana, pueden ser administrados en altas dosis sin que sean para los seres humanos. Con frecuencia inhiben ≠ pasos de la síntesis proteica. Algunos antibióticos son usados tanto para inhibir la síntesis de procariotas y eucariontes y algunos inhiben únicamente la síntesis de eucariontes los cuales no pueden ser utilizados como antibióticos en los seres humanos. LA SINTESIS DE PROTEINAS COMIENZA EN EL CITOSOL En los ribosomas libres del citosol. Estas prots van a contener, en su secuencia primaria, señales de destino o localización que pueden hacer que sean completamente traducidas en los ribosomas libres en el citosol, si son a prots que van a terminar en el citosol, núcleo, mitocondrias, peroxisomas; o pueden tener secuencias señales de localización en el RE, continuar y finalizar su traducción en la luz del RE. Son las que van a terminar en el mismo RE o van a ser distribuidas en todo el sist de endomembs (Golgi), la memb plasm, las vesículas secretarias o los lisosomas. Que una prot termine su proceso de traducción, no necesariamente le otorga funcionalidad a la misma. Las prots primero necesitan ser plegadas y muchas veces van a sufrir modificaciones para darle una funcionalidad adecuada. Ej: se le pueden unir cofactores, por interacciones covalentes o de otro tipo; pueden sufrir modificaciones covalentes por glicosilación, fosforilación, acetilación, entre otras o aún deben unirse a otras subunidades proteicas para formar estructuras cuaternarias. MODIFICACIONES QUIMICAS DE LAS PROTEINAS: N-GLICOSILACION PROTEICA EN ASPARAGINA Muchas prots son glucosiladas en el RE. Casi tan pronto como la cadena polipeptídica ingresa en la luz del RE, se glucosilla por el agregado de cadenas lats de oligosacáridos a asparaginas del polipéptido. C/ cadena de oligosacáridos se transfiere a la asparagina como una unidad intacta desde el lípido dolicol. Esta reacción es catalizada por la enzima oligosacárido-protein-transferasa. Su agregado forma sólo el primer paso de una serie de modificaciones posts antes de que emerja la glucoprot madura en el otro extremo de la ruta hacia el exterior. Este procesamiento del oligosacárido comienza en el RE y continúa en Golgi. MODIFICACIONES POSTRADUCCIONALES: O-GLICOSILACION PROTEICA EN SERINA O TREONINA En Golgi ocurre la O-glicosilación de las prots (agregado de un oligosacárido a un residuo serina o treonina del polipéptido). Clivaje: irreversible. Ej: un polipéptido grande (POMC) es clivado en las céls de la pituitaria para dar lugar a 2 polipéptidos más pequeños, la alfa-lipotropina y la pro-ACTH, que es nuevamente clivada para dar lugar a la hormona adenocorticotrofina o ACTH. En el hipotálamo, la piel y los milanotropos del lóbulo intermedio de la pituitaria continúan los clivajes para generar otras hormonas. Otro ej son las caspasas, están en forma de procaspasas inactivas en el citosol. Ante un estímulo proapoptotico son activadas por clivajes conformando una caspasa activa. Otro ej es la hormona insulina, es sintetizada por el páncreas endocrino. En las céls de los islotes para el páncreas, se sintetiza una prohormona precursora de la insulina, preproinsulina. En el RE de estas céls, se quita el extremo amino terminal, (péptido señal). Preproinsulina → proinsulina, a lo largo del sist de endomembs la proinsulina sufre un plegamiento específico estabilizado por ptes disulfuro y la eliminación del péptido de unión, quedando una moléc de insulina 32 completa de 2 cadenas, que será empaquetada en vesículas secretorias para su post secreción. Otra modificación es la fosforilación y la desfosforilación. Ambos son reversibles. Las fosforilaciones están a cargo de una quinasa, las desfosforilaciones de una fosfatasa. Pueden ser procesos para activar o desactivar prots. PLEGAMIENTO PROTEICO Las prots no siempre se pliegan bien. Para que sean correctos, se necesita que se produzcan en el lugar adecuado y en el momento oportuno. Esto se logra por la intervención de las chaperonas que acompañan a las prots y previenen sus plegamientos prematuros para que sean correctos. Hsp70, hsp60 y hsp90. Con respecto a las prots destinadas a las mitocondrias, desde que salen del ribosoma hacia el citosol, son asistidas por chaperonas hsp70 citosólicas que están desplegadas hasta que llegan a su paradero. Dentro de la matriz mitocondrial, se pliegan correctamente. En el REG, existe una hsp70 especial llamada BIP que produce el plegamiento correcto de las prots que se sintetizan en esta organela. CHAPERONAS Hsp70. Son monoméricas y tienen un surco en el que cabe sólo una parte de la prot asistida → se necesitan varias hsp70 para c/ prot. A medida que emana del ribosoma, c/prot citosólica se asocia con sucesivas chaperonas hsp70 (prevenir el plegamiento prematuro y evitar que la prot se combine con molécs inapropiadas). Al terminar de sintetizarse y el plegamiento, la prot se desprende del ribosoma y de las chaperonas hsp70, y fija residencia en el citosol. Si algunas de sus partes no se plegaron o lo hicieron mal, ingresa temporalmente en una chaperona hsp60 dentro de la cual termina de plegarse. Las chaperonas hsp60 son poliméricas. Formadas por 14 o 18 polipéptidos chaperoninas que componen una estructura cilíndrica en torno a un espacio central, donde ingresa la prot que va a ser asistida. Cuando la prot está defectuosa, ingresa temporalmente a una chaperona hsp60 dentro de la cual, termina se arregla y se pliega de nuevo tratando de hacerlo sin errores. DEGRADACION DE PROTEINAS: VIA UBIQUITINA-PROTEASIMA En el citosol hay estructuras que destruyen o degradan prots. Cuando una prot debe desaparecer, es degradada por un complejo enzimático proteasoma. La proteasoma es cilíndrica y se forma de varias proteasas en torno a una cavidad central, donde ingresa la prot. Su estructura es más compleja ya que junto a cada extremo del cilindro se halla un casquete proteico integrado por alrededor de 20 polipéptidos reguladores. Cuando una prot está destinada a ser degradada, se activa una señal de degradación en la misma. Puede ocurrir por ▲ procesos. Activada la señal, las prots tienen que ser marcadas para su destrucción por las proteasomas, participan unos pequeños polipéptidos citosólicos, ubiquitinas, y 3 enzimas que los activan y transfieren a la prot a ser etiquetada. - E3 ligasa de ubiquitina (hay cientos) E2 conjugadora de ubiquitina (hay 30) 33 - E1 activadora de ubiquitina La 1ra ubiquitina es activada por la enzima E1 que la transfiere a la enzima E2, con la ayuda de la ligasa E3. El complejo ubiquitina E2 se une a la prot que debe degradarse. Esto se repite varias veces, y la prot queda conectada a una corta cadena de ubiquitinas. Esta prot marcada, es reconocida por los polipéptidos reguladores de uno de los casquetes de la proteasoma los cuales separan a las ubiquitinas, deshacen el plegamiento de la prot e introducen en la cavidad de la proteasoma donde es degradada por las proteasas. Se originan oligopéptidos cortos que salen de la proteasoma y se vuelcan en el citosol. Usa E que es cedida por molécs de ATP cuya hidrólisis se encargan 6 ATPasas en los casquetes de la proteasoma. Cuando termina la degradación, la proteasoma y las ubiquitinas quedan disponibles para su reutilización. BC 9 CONTROL DE LA EXPRESIÓN GÉNICA Diferenciación celular: las céls expresan ≠ ARN y prots, hay regulación de la expresión génica que se específica para c/tipo celular. DIFERENCIACIÓN CELULAR ¿Cómo se conoce que todas las céls tienen la capacidad de expresar ≠ genes sin modificar su ADN? Experimento: se inyectó en el núcleo de la cél de la piel de una rana, en un óvulo de rana al que se le eliminó el núcleo al irradiarlo con luz UV. El cigoto se desarrolló normalmente → el núcleo de la cél de la piel tiene toda la info para formar una rana. CLONACIÓN Experimento: se toman céls epiteliales de una vaca y se introducen dentro del óvulo de otra vaca. Genera un cigoto, que es implantado en una madre sustituta → el ternero es genéticamente igual que la vaca, son clones. Todas las céls del organismo tienen el mismo ADN y difieren porque expresan ≠ genes. REGULACIÓN DE LA EXPRESIÓN GÉNICA ¿Cómo se puede controlar la expresión génica? ¿A qué nivel se puede dar? Existen muchos pasos desde el ADN a la prot y todos ellos pueden ser regulados. 1- REGULACION DE LA TRANSCRIPCION Se da por prots reguladoras de la transcripción o factores específicos de la transcripción, actuan uniéndose a secuencias reguladoras lejos del promotor. Tienen dominio de unión al ADN, partes de la prot con una con formación especial que se unen con afinidad al surco > del ADN. Los represores y activadores interactúan con un mediador, una prot que interactúa con la ARN pol y los factores de inicio de la transcripción, en el promotor. La expresión del gen dependerá de la suma de señales activadoras e inhibitorias, el balance entre estas determina que se de la trancripción. Hay señales que usan activadores para inducir la transcripción de X gen, en presencia del activador se transcriben. Cuando llega la señal, ej, una prot que se pega a su receptor de 34 memb, la señal se transduce dentro de la cél hasta que el activador es estimulado, se trasloca al núcleo e induce la síntesis del gen. Los reguladores transcripcionales atraen prots que remodelan la cromatina y afectan el acceso al promotor de los factores de la transcripción. Hay un complejo que abre la cromatina y hay enzimas que modifican las colas de las histonas que forman los nucleosomas. Las modificaciones a las historias son: acetilación, metilación y fosforilación. El ADN puede metilarse e inhibir su expresión; el complejo remodelador de la cromatina puedes descondensar el ADN para que sea más fácil acceder al gen, cuanto más accesible sea un gen más se transcribe CONTROL DE PROCESAMIENTO DEL ARN Se da principalmente en los genes que tienen corte y empalme alternativo, esto genera ≠ isoformas de la prot. En c/ tipo celular se expresa una isoforma ≠, se da porque se está regulando el corte y empalme. CONTROL DE TRANSPORTE DEL ARN: Se controla a los ARN que abandonan el núcleo y su ubicación en el citoplasma Se estima que sólo 1/20 ARNm sintetizados salen del núcleo. Normalmente se degradan en el núcleo, ARNm dañados que no hicieron bien el corte y empalme o sin cola de poli-A. También se puede usar, la salida o entrada del núcleo, para regular la expresión génica. Los ARNm que salen del núcleo pueden tener ≠ localizaciones en el citosol, pueden ir al RE o traducirse cerca de donde van a actuar. Estas directivas están codificadas en los extremos 5´ y 3´ interés del ARNm que no se traduce. CONTROL DE LA TRADUCCION Los extremos 5´ del ARNm que no se traducen, tienen secuencias que pueden unir prots que estabilizan al ARN para que no sea degradado o que pueden unir prots que mantienen frenada la traducción del ARN. Ej: la ferritina, prot que une el Fe en el citosol de la cél. Cuando no hay Fe en las céls, la aconitasa se une al extremo 5´ del ARNm de la ferritina y bloquea su traducción. Si no hay Fe para almacenar en el citosol, la prot ferritina no se sintetiza. La aconitasa se une al extremo 3´ del ARNm del receptor de transferrina (prot extracelular que une el Fe y lo ingresa a la cél), para estabilizae el ARNm ya que tapa un sitio para una endonucleasa y el ARNm es traducido. Si no hay Fe, se produce el receptor para que el hierro ingrese a la cél. Cuando hay exceso de Fe en la cél, la aconicasa se une al Fe, se despega del extremo 5´ del ARNm de la ferritina y es traducido. La aconitasa se despega del extremo 3´ del ARNm del receptor de la transferrina, dejando libre el sitio para la endonucleasa que lo degrada. Cuando hay exceso de Fe en el citosol, se sintetiza ferritina y no se sintetiza el receptor para transferrina. El Fe puede regular la expresión de estos 2 ARNm por ≠ mecanismos de regulación de la traducción. CONTROL DE LA DEGRADACION DEL ARNm La zona 3´ del mensajero que no se traduce, tiene secuencias que controlan la vida media del ARNm. Pueden tener sitios de unión a prots que aumenten o disminuyan el acortamiento de la cola de poli-A y que saquen el capuchón o degraden el ARNm. Existen enzimas que degradan la cola de poli-A (principal mecanismo de control de la mayoría de los ARNm. Existen mecanismos especializados que degradan los ARNm usando ARN de interferencia. Son ARN no codificantes pequeños; 3 tipos: los pequeños (siARN), los microARN (miARN) y los… • miARN: controlan la expresión génica de X ARNm que reconoce por apareamiento de bases y controla su estabilidad. El transcrito de miARN se sintetiza en el núcleo y sufre maduración para ser exportado al citosol. Se ensambla con prots especializadas y forman el complejo RISC. Los RISC patrullan el citoplasma buscando ARNm complementarios al miARN. Cuando encuentra un ARNm con > grado de complementariedad, una nucleasa del RISC degrada el ARNm y se libera para seguir actuando. Si el ° de complementariedad es <, se reduce la traducción y se secuestra ese ARNm que será degradado. 35 • siARN: actúan como defensa contra ARN extraños de doble cadena. El ARN doble cadena suele ser de virus o elementos génicos transponibles. Los siARN lo detectan y degradan. La presencia del ARN doble cadena en la cél, activa la nucleasa DICER que los cliva en fragmentos cortos →ARN interferencia pequeños. Éstos son incorporados a RISC → simple cadena. El complejo RISC busca los ARN extraños y los degrada. CONTROL DE LA ACTIVIDAD PROTEICA Prot mal plegada→ no cumple su función→ degradación. La degradación de las prots la hace el proteasoma, complejo proteico que tiene un cilindro central y un capuchón. Las prots que entran al proteasoma están ubiquitinizadas, fueron marcadas por el agregado de varias ubiquitinas a su estructura. Luego de que la prot pasa por el proteasoma (actúan las proteasas), la prot queda completamente degradada a AA. La fosforilación es una modificación reversible, el agregado de un fosfato lo hace una prot kinasa y lo puede romper una prot fosfatasa. La cél puede activar prots de forma muy rápida (fosforilando o defosforilando). Una modificación irreversible es el clivaje: ruptura del enlace peptídico de una prot para producir fragmentos. Ej: activación de las capasas. Son prots que intervienen en la apoptosis. Normalmente están en la cél como prots inactivas, procaspasas. La activación ocurre porque el clivaje de las procaspasas en 2 subunidades y se liberan los prodominios, 2 caspasas se unen para formar la caspasa activa que posee 2 subunidades pequeñas y 2 grandes. BC 10 CICLO CELULAR Función básica del ciclo celular: duplicar la gran cantidad de ADN cromosómico y distribuirlo en 2 céls hijas. Los 2 acontecimientos más notables son la división nuclear o mitosis y la división de la cél 2 (citocinesis). Ambos forman la fase M del ciclo celular. El periodo entre una fase M y la siguiente, es la interfase y comprende las otras 3 fases del ciclo celular. En la fase S, la cél replica su ADN nuclear. Antes y después de la fase S, hay 2 fases en las cuales la cél continúa su crecimiento: G1 y G2. G1: entre la fase M y el comienzo de la fase S. G2: entre el final de la fase S y el comienzo de la fase M. En c/fase, la cél controla del ambiente intracelular y las condiciones extra celulares asegurándose que sean adecuadas y que se hayan completado todos los preparativos antes de iniciar la fase S y la mitosis. PUNTOS DE CONTROL DEL CICLO CELULAR En la replicación del ADN y la división celular, participa una compleja red de prots reguladoras, sist de control del ciclo celular. Garantiza que los acontecimientos del ciclo celular tengan lugar en una secuencia establecida y que c/ proceso se complete antes de que comience el sig. Se logra por frenos moleculares que pueden detener el ciclo en diversos puntos de control. Los puntos de control más destacados son: G1, que determina si la cél avanza a la fase S; G2, determina si la cél continúa hacia la mitosis; fase M, controla si la cél está preparada para separar a los cromos duplicados y dividirlos en 2 céls hijas. Los sists de control del ciclo celular actúan por la activación y desactivación de prots y complejos proteicos que regulan la replicación del ADN, la mitosis y la citocinesis. Usa la fosforilación y desfosforilación para estimular o inhibir la actividad de esas prots. Las reacciones de fosforilación son hechas por las enzimas quinasas, la desfosforilación depende de protein-fosfatasas. Quinasas = quinasas dependientes de ciclinas (Cdk). Las ciclinas son otro grupo de prots de control que no tienen actividad enzimática, se unen a la Cdk para que tomen actividad enzimática. Cdk debe ser fosforilada en un sitio de la moléc y desfosforilada en otro. La formación de complejos ciclina-Cdk impulsa a ≠ procesos, como el de ingreso en la fase S o en la fase M. Aunque la actividad enzimática del complejo ciclina Cdk aumenta y disminuye en el ciclo celular, la [Cdk] no tiene esta variación cíclica. 36 PRINCIPALES CICLINAS Y CDK EN LOS VERTEBRADOS Hay ∆ tipos de ciclinas y Cdk en el control del ciclo celular. C/u desencadena un paso de transición ≠ del ciclo celular. Ej: el complejo Cdk de fase M fosforila las prots clave que promueven la condensación de los cromos, la ruptura de la EN y la reorganización de los microtúbulos del citoesqueleto para formar el huso mitótico. INTERFASE Antes de que inicie la fase M, el ADN tiene que replicarse y se debe duplicar el centrosoma. El centrosoma es el principal centro organizador de microtúbulos en las céls animales. En su duplicación ayuda a la formación de los 2 polos del huso mitótico y a que c/ cél hija pueda recibir su propio centrosoma. DUPLICACION DEL CENTROSOMA Centrosoma: 2 dos centriolos apareados, inmersos en un conjunto de agregados proteicos que forman la matriz pericentriolar. La duplicación de los centros pasa en la fase S. Al principio, los centrosomas están juntos, en G2 la cél tiene 2 centrosomas, c/u formado por 2 centriolos. Se separan en las 1ras etapas de la mitosis y se disponen en los polos opuestos de la cél. FASE M Se divide en 6 etapas, las 5 1ras forman la mitosis, la 6ta es la citocinesis. Las etapas de la mitosis ocurren en un estricto orden secuencial, la citocinesis comienza en el anafase y termina en la telofase. PROFASE Se condensan los cromos replicados y c/u está formado por 2 cromátides hermanas asociadas. Fuera del núcleo, se ensambla el huso mitótico entre los 2 centrosomas que comienzan a separarse. El huso mitótico bipolar se forma por la estabilización de microtúbulos interactuantes. En la profase se forman nuevos microtúbulos en direcciones aleatorias desde los 2 centrosomas. Los 2 extremos de un microtúbulos: extremos + y -. El extremo - está anclado al centrosoma y los + son libres, dinámicamente inestables y alternan entre crecimiento y retraimiento. Cuando 2 microtúbulos de centrosomas opuestos interactúan en una zona de superposición, las prots motoras y otras asociadas, los unen estabilizando sus extremos, reduce su despolimerización. PROMETAFASE En la prometafase se rompe la EN, los cromos se unen a los microtúbulos del huso por los cinetocoros y tiene un mov muy activo. La desorganización de la EN comienza por la fosforilación y desensamblaje de las prots del polo nuclear y las prots de los fils intermedios que forman la lámina nuclear (red de prots fibrosos subyacente a la memb nuclear interna). En la telofase, la desfosforilación de las prots del PN y de las láminas, ayuda a revertir este proceso y dar la reformación de la EN. CINETOCOROS En la prometafase, los microtúbulos del huso se unen a los cromos por complejos proteicos especializados (cinetocoros). C/cromo replicado está formado por 2 cromátides hermanas unidas longitudinalmente y c/u tiene un estrechamiento en una región con una secuencia de ADN especializada (centrómero). Antes de la profase, las prots del cinetocoro forman un complejo de gran tamaño en c/ centrómero, c/cromo duplicado tiene 2 cinetocoros, 1 en c/cromátide hermana, orientados en direcciones opuestas. La formación del cinetocoro depende de la presencia de la secuencia del ADN del centrómero. En ausencia, no se forman los cinetocoros y fracasa la segregación adecuada de los cromosomas durante la mitosis. 37 METAFASE Los cromos se alinean en el ecuador del huso, a mitad del camino entre los polos. Los microtúbulos de los cinetocoros de c/cromo se unen a los polos opuestos del huso. El huso mitótico toma su forma definitiva, los extremos - de los microtúbulos se concentran en c/polo, y los extremos + contactan con los cinetocoros o con otros microtúbulos que polimerizan desde el lado opuesto. Los microtúbulos del aster parten desde los centrosomas y cuyos extremos + se dirigen hacia la memb plasm. ANAFASE Las cromátides hermanas se separan sincrónicamente y son arrastradas hacia polos opuestos del huso. Los microtúbulos del cinetocoro se acortan y los polos del huso se separan, lo que forma la segregación de los cromos SEPARACION DE LAS CROMATIDES HERMANAS EN ANAFASE La anafase comienza con la liberación de la unión de cohesinas que mantienen juntas a las cromátides hermanas. Pasa por la proteasa separasa que, hasta el comienzo del anafase, se mantiene inactiva ya que está unida a una prot inhibitoria (securina). A comienzo del anafase, la securina es marcada para la destrucción por el complejo proteico promotor del anafase. Con la securina eliminada, la separasa rompe las uniones de cohesina. El complejo promotor de la anafase marca la ciclina M que se destruye desactivando el complejo Cdk-M, esta rápida desactivación de Cdk-M ayuda a iniciar la salida de la mitosis. Separadas las cromátides hermanas, son arrastradas hacia el polo del huso del que estaban orientadas. Pasa por 2 procesos mediados por partes ≠ del huso mitótico: anafase A y B. Anafase A: los microtúbulos del cinetocoro se acortan por despolimerización y las cromátides se mueven en dirección al polo. La F que lo impulsa es aportada por prots motoras asociadas a los microtúbulos del cinetocoro. Estas eliminan subunidades de tubulina usando E de la hidrólisis de ATP y acortando los microtúbulos. Anafase B: los polos del huso se separan uno del otro. Las F que lo impulsa dependen de 2 grupos de prots, la flia de las quinesinas y las dineinas. Éstas crean una F deslizante entre los microtúbulos interpolares separando los polos. El otro grupo de prots actúa sobre los microtúbulos del áster. Están por debajo de la memb plasm y traccionan los polos hacia la zona cortical de la cél contribuyendo a la separación de los polos. TELOFASE Los 2 grupos de cromos llegan a los polos del huso, se forma una nueva EN alrededor de c/grupo cromosómico, completando la formación de 2 núcleos y marcando el final de la mitosis. La división del citoplasma comienza con la formación del anillo contráctil. CITOCINESIS El citoplasma se divide en 2 por un anillo contráctil de fils de actina y miosina, se forman 2 céls hijas, c/u con un núcleo. 38 MEIOSIS Tiene lugar en las céls germinales y genera céls sexuales o gametos. Se producen 2 divisiones celulares sucesivas. Consecuencia: las céls hijas son haploides (n), tienen la mitad del nro cromosómico diploide. En la 1ra división, c/juego de cromos homólogos, (padre + madre), segregan al azar. Crossing over. Ambas divisiones comprenden profase, metafase, anafase y telofase. La profase de la 1ra división es muy larga y compleja, se subdivide en 5 etapas/estadios que son leptotene, cigotene, paquitene, diplotene y diacinesis. MEIOSIS I PROFASE I La 1ra etapa de la profase es el leptotene: los cromos individuales comienzan a condensarse en fils largos dentro del núcleo. C/cromo tiene un elemento axial, armazón de prots que lo recorre a lo largo y está entre las 2 cromátides hnas. Cigotene: los cromos homólogos se acercan hasta quedar yuxtapuestos por sinapsis y se completa en el paquitene. Se inicia el crossing over. Paquitene: los pares de cromos homólogos sinapsados y el conjunto de c/par de homólogos → bivalente o tétrada. Se forma el complejo sinaptonemico. Se resuelve el crossing over. Diplotene: se pueden ver los quiasmas, son los sitios donde se dio el crossing over. En este punto 2 cromátides (1 de c/ homólogo), parecen cruzarse una sobre la otra. La meiosis puede sufrir una pausa. En los ovocitos el proceso de la meiosis se detiene en meiosis I y sólo continúa años después al comienzo de la pubertad Diacinesis: los cromos están más condensados. El final de la diacinesis (por lo tanto de la profase I), está marcado por la rotura de la EN. Sinapsis y desinapsis de los cromosomas homólogos durante los diferentes estadios de la profase I. En el leptotene se unen las cromátides hermanas con los lazos de cromatina extendidos desde un solo elemento axial de prots. El complejo sinaptonémico comienza a ensamblarse en el cigotene temprano, se completa en paquitene y desintegra en diplotene. El complejo sinaptonémico es una estructura exclusiva de los cromosomas meioticos y tiene una estructura evolutivamente muy conservada. COMPLEJO SINAPTONEMICO C/par de cromos homólogos tiene un complejo sinaptonémico formado por 2 elementos lats. En la región central hay elementos fibrilares que unen los elementos lats con un central que está formado por prots. Los fils transversales tienen una estructura de prots arrolladas en espiral y pueden interactuar entre sí como las prots de los fils intermedios. El elemento oval es un nódulo de recombinación, son la expresión de la recombinación recíproca en el paquitene, como los quiasmas que son la recombinación en etapas posts de la meiosis. RECOMBINACION HOMOLOGA EN LA MEIOSIS 39 A nivel molecular, la recombinación meiótica inicia con el alineamiento de molécs homólogas de ADN. Antes de la sinapsis. Se producen fracturas de cadena doble en unas de las molécs de ADN. Las fracturas son producidas por un complejo enzimático en el que interviene la prot Spo11. A partir de ellas, se generan extremos 3´ colgantes en la moléc activa por una exonucleasa con actividad 5´-3´. Los extremos colgantes se asocian a prots que unen el ADN de cadena simple. Los extremos 3´ invasores producen el desplazamiento de una cadena de ADN formando un lazo D, que es usado por la moléc activa que lo acopla sobre el otro extremo 3´. Las cadenas intactas se usan como molde para hacer una síntesis reparativa del ADN en los extremos 3´ de las cadenas rotas. Quedan formadas 2 uniones de holliday. Esta estructura de 4 cadenas puede resolverse de 2 maneras: con intercambio de cadenas (con recombinación recíproca) o sin recombinación recíproca. METAFASE I – ANAFASE I Los cromos homólogos sinapsados en la meiosis, forman un bivalente que se mantiene en toda la profase. En la prometafase se rompe la EN y, cuando los bivalentes se ordenan en la placa ecuatorial del huso, comienza la metafase I. Metafase I: los quiasmas (de la recombinación recíproca) mantienen unidos a los homólogos maternos y paternos, los cinetocoros de c/homologo se orientan hacia el mismo polo. Las cromátides hnas están unidas por cohesinas específicas de la meiosis. Anafase I: las cohesinas se degradan a nivel de los brazos cromosómicos pero quedan a nivel del centromero →las cromátides hnas no se separan. Los cinetocoros de c/homólogo son traccionados a polos opuestos y se separan entre sí. Telofase I: c/conjunto de cromos llega a sus respectivos polos y se reconstituyen las membs nucleares. MEIOSIS II La2da división meiótica es más breve que la primera y sus etapas son similares a la mitosis. PROFASE II Reconstrucción del huso y se desintegre la EN antes de la entrada en metafase. METAFASE II Los cromos están en la placa ecuatorial y los cinetocoros de las cromátides hnas se orientan a polos opuestos. ANAFASE II Terminan de degradarse las cohesinas del centromero → separación de las cromátides hermanas. TELOFASE II C/ polo recibe un juego haploide de cromátides y se forma la EN. MEIOSIS VS MITOSIS Muchos de los fenómenos que ocurren en la mitosis suceden también en la meiosis, por ejemplo, la secuencia de los cambios en 40 el núcleo y en citoplasma, la formación del huso mitótico, la condensación de los cromosomas, entre otros. Sin embargo, existen diferencias fundamentales. MITOSIS MEIOSIS En céls somáticas C/ replicación del ADN es seguida por una división celular → las céls hijas tienen la misma cantidad de ADN que la cél madre y un número diploide de cromos. ESPERMATOGENESIS OVOGENESIS En céls germinales. C/replicación del ADN es seguida por 2 divisiones celulares: meiosis I y meiosis II. Resultan 4 céls haploides con la mitad del ADN. Y Varón: el resultado de la 1ra división meiótica son dos céls hijas iguales, espermatocitos II. La meiosis comienza desde la pubertad, la profase I aprox 14 días y la meiosis completa aprox 24 días. Las espermatogonias siguen entrando en meiosis en toda la vida adulta. Mujer: el reparto de citoplasma es desigual y el resultado de la 1ra división meiótica son 2 céls de tamaño ≠: ovocito II y el cuerpo polar. Las ovogonias inician la meiosis entre el 3er y 7mo mes de desarrollo prenatal. Los ovocitos I detienen la meiosis hacia el final de la profase I y entran en dictiotene. Desde la pubertad, en c/ciclo menstrual varios ovocitos I retoman la meiosis, pero sólo 1 la completa. Cuando el ovocito II se libera del ovario hacia el oviducto, ya ha iniciado la 2da división meiótica. Prosigue si se produce la fecundación. En la recién nacida, el nro de ovocitos I es de aprox de un millón; a la edad de 12 años se reducen a 300.000, cerca de 400 alcanzaron la madurez total; en la menopausia, la meiosis puede durar alrededor de 50 años. BC 11 REGULACIÓN DEL CICLO CELULAR Y CELULA TUMORAL La función básica del ciclo celular es duplicar ADN cromosómico y distribuirlas en céls hijas genéticamente =. Existen puntos de control que garantizan que estos procesos claves tengan lugar en la secuencia apropiada, ej: • • • Al finalizar G1, y cuando la cél va a entrar en la fase S, se pregunta si el ambiente es favorable para la duplicación del ADN, este es el punto de control de g1; Al finalizar G2, al entrar en la mitosis, tenemos el punto de control en G2 en la cual las céls se preguntan si está replicado todo el ADN y si esta reparado todo el daño; En mitosis, justo antes la separación de los cromos duplicados, está el punto de control en el cual las céls se preguntan si están todos los cromos bien unidos al huso mitótico antes de ser segregados en 2 céls hijas. CONTROL CICLINAS DEL CICLO CELULAR: CDKS Y 41 El sist de control del ciclo celular regula el ciclo celular por la activación o desactivación cíclica de prots y complejos proteicos claves que inician/ regulan la replicación del ADN, la mitosis y la citocinesis. Las quinasas son la parte central de este sist, están en todo el ciclo celular en las céls en proliferación. Sólo son activadas en momentos oportunos y vuelven a ser desactivadas. Su activación y desactivación dependen del grupo de las prots ciclinas, que deben unirse a las quinasas para que tomen actividad enzimática. Las ciclinas tienen [] que varían en el ciclo celular, contribuyen a la formación y activación cíclica de complejos quinasa dependientes de ciclinas (Cdk) Esta figura muestra los cambios de [ciclina] y actividad de Cdk para el ingreso a la fase M. Se ve el aumento de la [ciclina], ayuda a formar el complejo ciclina-Cdk activo que impulsa el ingreso en la fase M. La actividad enzimática del complejo ciclina-Cdk aumenta y disminuyen en el ciclo celular, la [] de Cdk no lo hace. Para que el complejo Cdk-ciclina sea activo necesita ser fosforilado y desfosforilado en diferentes sectores. Una vez que complejo ciclina-Cdk cumple su función, en un punto de control específico la ciclina es ubiquitinizada para ser degradada por el proteasoma tornando a este complejo Cdk-ciclina inactivo. Hay varios tipos de ciclinas y en la mayoría de las céls eucariontes varios tipos de Cdk implicados en el control del ciclo celular. ≠ complejos ciclinas-Cdk desencadenan ≠ pasos del ciclo celular, por ejemplo: - Ciclina G1-Cdk: pasa un punto de control en G1 tardío permitiendo a la cél que ingrese en la fase S; Ciclina G1/S-Cdk: pasa un punto de control en el final de la G1 comprometiendo la replicación del ADN; - Ciclina S-Cdk: se activa en la fase S produciendo la iniciación de la replicación; - Ciclina M-Cdk: se activa el final de G2 promoviendo la mitosis. PUNTOS DE CONTROL DEL CICLO CELULAR Una cél se duplica si el ambiente extracelular es favorable (presencia de mitogenos). Se activa el complejo G1-Cdk que inicia las síntesis de ciclina G1/S para formar el complejo G1/S-Cdk. Estos complejos promueven la síntesis de ciclina S para seguir al sig estadio del ciclo. Imagen: los complejos G1-Cdk y G1/S-Cdk inducen a la cél a entrar en la fase S. Ante un mitogeno, se activa una cascada de señalización intracelular, en la cél que va a proliferar, y va a activar a los complejos que G1-Cdk y G1/S-Cdk. Estos van a fosforilar e inactivar a la prot retinoblastoma (activa: inhibe a la actividad de un regulador de la transcripción). Cuando los complejos G1-Cdk y G1/S-Cdk fosforilan al retinoblastoma, éste libera regulador de la transcripción que va a activar la transcripción y traducción, induciendo la proliferación celular. Los complejos G1-Cdk y G1/S-Cdk estimulan la síntesis de ciclina S para formar el complejo S-Cdk que promueve la síntesis de ADN. 42 La S-Cdk abre los orígenes de replicación y activan las molécs de la síntesis de ADN para desencadenar la replicación del ADN y garantizar que se inicie sólo una vez por ciclo celular. La replicación del ADN inicia en los orígenes de replicación, que son secuencias de nucleótidos dispersas a lo largo de c/cromo. Las secuencias reclutan prots específicas que controlan la replicación del ADN. El complejo de reconocimiento de origen (ORC) está unido a los orígenes de replicación en todo el ciclo celular. A principio de G1, la prot reguladora Cdc6 se asocia con este ORC, ayudadas por la Cdc6, otras prots se unen al ADN adyacente lo que determina la formación de un complejo de pre-replicación que incluyen las prots y el ADN al que estaba unido. S-Cdk desencadena la descarga del origen al inducir el ensamblaje de los complejos proteicos que inician la síntesis de ADN. S-Cdk ayuda a bloquear una nueva replicación ya que fosforila a Cdc6 y lo degrada. Ésta y otras prots se disocian de ORC después de que un origen sea activado. El desensamblaje impide que la replicación se produzca de nuevo en el mismo origen. El sist de control del ciclo celular tiene varios mecanismos ≠ que detienen el ciclo si el ADN está dañado. Los puntos de control de daño del ADN de la fase G1 y S, impiden que la cél comience /complete la fase S y replique el ADN dañado. G1 se conoce especialmente bien, involucra la prot p53. PUNTO DE CONTROL EN G1: P53 Cuando el ADN está dañado, protein-quinasas específicas activan la prot p53 e interrumpen su degradación normal. Esta prot se acumula y se une al ADN. Estimula la transcripción del gen que codifica a la prot inhibidora de Cdk: p21. P21 se une a G1/S-Cdk y S-Cdk y las desactiva → ciclo celular se detiene en G1. Cuando la cél supera los puntos de control → replica con éxito su ADN en la fase S → G2 → fase M: divide su núcleo por mitosis y su citoplasma por citocinesis. El complejo M-Cdk impulsa a la cél a la entrada en mitosis y va a inhibir la re-replicación del ADN. El complejo M-Cdk, va a su ver ser inhibidor si el ADN no fue completamente replicado o si hay daño. La MCdk promueve a la activación del complejo APC, que promueve la segregación de las cromátides hnas y va a ser inhibido si los cromos no están unidos perfectamente al huso mitótico M-Cdk: desintegración de la red de fils de actina, formación del huso mitótico, disgregación de la EN y ↑ del ° de enrollamiento de la cromatina: mitosis. Las cromátides hnas están asociadas entre sí por los anillos de cohesinas. Activa la formación del huso mitótico y al complejo APC. El complejo APC activo libera a la prot separasa por la ubiquitinacion y degrada su inhibidor, securina. La separasa activa actúa en la metafase para clivar estos anillos, disociando las cromátides hnas para que puedan ser segregadas en el anafase. REGULACION DE LA SUPERVIVENCIA, CRECIMIENTO Y DIVISION CELULAR Una cél individual sobrevive sólo cuando es necesaria y se divide solo cuando se requiere de otra cél, lo que permite el crecimiento tisular o el reemplazo de céls perdidas. En el crecimiento de los tejs o reposición, las céls deben crecer antes de dividirse. La mayoría de las moléc de señalización extracelular que influyen en la supervivencia, son prots solubles secretadas por otras céls o unidas a la superficie de otras céls o a la matriz extracelular. La mayoría de ellas actúan positivamente estimulando 1 o + de los procesos celulares, algunas ejercen acción negativa (inhibiendo un proceso). Las prots de señalización con acción positiva, se pueden dividir según su función en 3 clases principales: - Factores de supervivencia: promueven la supervivencia celular por supresión de apoptosis; Mitogenos: estimulan la división celular al contrarrestar los mecanismos intracelulares de freno que tienden a bloquear la progresión a lo largo del ciclo celular; 43 - Factor de crecimiento: estimulan el crecimiento celular, aumento del tamaño y masa celular por la promoción de la síntesis e inhibición de la degradación de prots y otras macromolécs. APOPTOSIS Las céls de un organismo pluricelular son miembros de una comunidad muy organizada. La cantidad de céls está estrictamente regulada, por control de la vel de división y por el control de la muerte celular. Las céls que ya no son necesarias pueden suicidarse por la activación de apoptosis. NECROSIS VS APOPTOSIS Las céls que mueren por una lesión aguda, suelen tener tumefacción y estallidos con derrame de su contenido en las céls vecinas: necrosis celular. Desencadena una respuesta inflamatoria lesiva. Una cél con apoptosis, muere sin dañar las céls adyacentes. CASPASAS Las prots de la apoptosis = caspasas. Se activan por clivaje proteolítico de sus propias molécs y amplifican la señal apoptótica por cascadas de caspasas. Una caspasa se organiza en 2 molécs de procaspasas inactivas que se clivan y se ensamblan, formando una moléc de caspasa iniciadora activa. Esta moléc de caspasa iniciadora activa varias molécs de caspasas efectoras, que produce el clivaje. Las molécs de caspasas efectoras activas activan más molécs de caspasas efectoras las que producen el clivaje de las prots citosólicas. La señal de apoptosis es desencadenada por una caspasa iniciadora y amplificada por cascadas de caspasas efectoras. VIA EXTRINSECA Hay 2 tipos de señales que las céls reciben para iniciar la apoptosis. Uno se inicia en el medio extracelular iniciando, la vía extrínseca de la apoptosis. El otro se inicia desde el interior de la cél, involucra la vía intrínseca de la apoptosis. Se une un ligando de muerte a un receptor de muerte en la superficie celular. Esta inicia la activación de caspasas iniciadoras, que desencadena la activación de caspasas efectoras y la muerte por apoptosis. VIA INTRINSECA Se da por un estímulo apoptotico en el interior de la cél. Ej: daño al ADN o deprivacion de nutrientes. Se produce la salida del citocromo C desde la mitocondria hacia el citosol. Éste se asocia a prots adaptadoras activadas que reclutan a la procaspasa 9, formando el apoptosoma que activa a la caspasa 9 (caspasa iniciadora) y desencadena la activación de caspasas efectoras y la muerte por apoptosis de las céls. CÁNCER Los mecanismos que controlan la renovación y reparación tisular, pueden fallar y conducir alteraciones catastróficas en la estructura corporal. Se origina en perturbaciones de las reglas básicas del comportamiento social de las céls. Para mantener el orden, las céls individuales deben adaptar su comportamiento a las necesidades del organismo. El cáncer se origina cuando una cél no puede controlar estos procesos, proliferan en contra de las limitaciones normales e invaden y colonizan territorios. El cáncer que es una enfermedad multifactorial. En una cél cancerígena se dan una sucesión de varias mutaciones. Siempre se da en céls con capacidad de proliferar. Es monoclonal y se da céls somáticas. 44 El cáncer se da cuando las céls proliferan en contra de las limitaciones normales, si estas céls sólo proliferan en forma excesiva agrupadas en una masa, → tumor benigna. Un tumor es canceroso si sus céls tienen invaden otros tejs circundantes→ tumor maligno. Las céls pueden separarse del tumor primario, ingresar en el torrente sanguíneo, a los vasos linfáticos y formar tumores secundarios o metástasis en otros sitios, cuanto más se disemine más difícil es erradicarlo. Las céls cancerosas producen angiogénesis: generan la aparición de nuevos vasos sanguíneos que alimenta a estas céls en proliferación y se producen modificaciones fenotípicas de la cél. En el 50% de los tumores malignos hay mutación en p53 (prot encargada de la reparación del ADN). - Existe una clasificación según el origen de las céls cancerosas: Origen epitelial: carcinoma -Origen en céls hematopoyéticas: leucemia Si tiene origina en el tej conectivo: sarcoma - Origen en el sist nervioso: glioma. El cáncer se desarrolla por acumulación de mutaciones. Estas pueden llevar a una prot alterada, ausente o exceso. Lleva a un descontrol del ciclo celular y/o a la apoptosis→ proliferación anormal y una cél cancerosa. Se necesita + de una mutación para que una cél normal→ cancerosa. La mayoría de las céls cancerosas humanas tienen muchas mutaciones y son genéticamente inestables. GENES QUE PUEDEN MUTAR En gral, son genes supresores de tumores y oncogenes. La función de su copia normal regula el crecimiento y proliferación celular, ej prots p53 y retinoblastoma. La mutación en los genes supresores de tumores tiene que darse en ambos alelos, tiene que tener una mutación recesiva para producir el efecto. Oncogenes la función es promover el crecimiento y proliferación celular, ej prot bcl-2 y ras. La mutación a nivel celular es dominante, necesito una única copia alterada en un único alelo para producir el efecto y es una ganancia de función de esta prot. 45