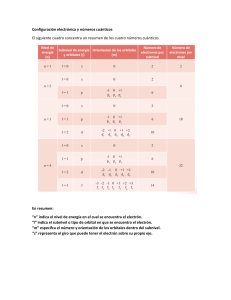
Los números cuánticos y la distribución electrónica Química General Logro de aprendizaje Al finalizar la sesión de aprendizaje el estudiante reconoce el significado de los números cuánticos, aplicando los principios de la distribución electrónica. Recordemos y repasemos… Relaciona las imágenes mostradas Relaciona con el tema trabajado en la clase anterior. Datos/Observaciones Si ya recordaste conceptos… Resuelve el siguiente ejercicio: ¿Cuántos neutrones tiene el átomo 65A que es isobaro de otro átomo 50B y éste último a su vez, es isótono con otro átomo que tiene 33 neutrones y 28 protones? Datos/Observaciones Si ya recordaste conceptos… Datos: isobaro 50B Igual número de masa. 50B isótono 28X33 Igual cantidad de neutrones. 65A Por tanto: Para B: Al ser 50B isótono 28X33 Cantidad de neutrones en ambos = 33 El número másico es la suma de: protones (50) + Neutrones (33) = 83 Por tanto para A: Al ser A isobaro con B, tendría 83 de número másico también. Para hallar neutrones de A: El total de su masa (83) – La cantidad de protones (65) = 18 (neutrones) Datos/Observaciones Contenido Introducción. Orbitales atómicos. Números Cuánticos. Número principal (n). Número secundario (l). Número magnético (m). Número del spin (s). Configuración Electrónica Principios que regulan la Configuración Electrónica. Configuración abreviada. Anomalías en la configuración: d4 y d9 Datos/Observaciones Teoría atómica moderna https://loff.it/society/efemerides/niels-bohr-el-cientifico-que-descubrio-la-naturaleza-dual-delelectron-255830/ https://www.areaciencias.com/quimica/modelos-atomicos.html Datos/Observaciones Orbital Atómico Región espacial alrededor del núcleo atómico donde hay mayor probabilidad de encontrar un electrón. Cada orbital está definido por números cuánticos, que determinan: Tamaño, forma y orientación del orbital. Los números cuánticos se utilizan para describir orbítales atómicos y para identificar los electrones que se ubican en ellos. Formas de Orbitales (s y p) Datos/Observaciones Formas de Orbitales (d y f) Datos/Observaciones Observa la animación… En la imagen aparece un átomo de helio donde se representan los protones, neutrones y electrones. Los electrones se encuentran en el orbital 1s representado por el área sombreada. Datos/Observaciones Entonces, ¿cómo ubicamos al electrón? Analicemos algunas analogías Analogía del número cuántico “n” Analogía del número cuántico “l” Analogía del número cuántico “ml” Usando números vamos a identificar: El tamaño de tu casa (n), la forma de tu casa (l) y la orientación de tu casa (ml) Datos/Observaciones http://www.cienciaonline.com/2012/12/11/analogias-cotidianas-para-los-numeros-cuanticos/ Por Tanto… Para determinar la posición probable de un electrón en un átomo dependemos de una función de onda u orbital. Números cuánticos Representa un nivel de energía. n l Indica la forma de los orbitales. Datos/Observaciones m s Indica la orientación espacial de los orbitales. Indica el sentido de rotación del electrón. Número cuántico principal (n): • • Describe el nivel de energía principal ocupado por el electrón. Puede ser un entero positivo (n = 1, 2, 3,…) • A medida que n aumenta: Mayor es el tamaño del orbital Mayor tiempo el electrón estará distante del núcleo. Mayor es la energía del electrón. Menor es la atracción del electrón hacia el núcleo. n = 1 ; 2 ; 3 ; 4 ; 5 ……… ∞ Mayor distancia ‹—› mayor energía ‹—›menor estabilidad Número cuántico Secundario (l): El número cuántico del momento angular (l), relacionado con la forma del orbital, puede tomar valores enteros de 0 hasta n - 1. Para un orbital con n = 3, el número cuántico del momento angular (l) puede ser 0, 1, o 2.. l = 0 designa un subnivel s Cada subnivel se designa con una letra: l = 1 designa un subnivel p l = 2 designa un subnivel d l = 3 designa un subnivel f Número cuántico Magnético (m): El número cuántico magnético (ml) indica la orientación espacial del orbital y puede tomar valores enteros desde -l hasta +l (incluyendo el cero) determinados por el número cuántico del momento angular. Cuando l = 0, ml = 0 Cuando l = 1, ml = -1, 0, +1 Cuando l = 2, ml = -2, -1, 0, +1, +2 La siguiente figura presenta la jerarquía de los números cuánticos para los orbitales atómicos. Datos/Observaciones Número cuántico del Spin (S): +½ Datos/Observaciones –½ Ejercicio: Indique cuál(es) de los siguientes conjuntos de números cuánticos están permitidos: n = 1; l = 1, ml = 0; ms = +½ n = 3; l = 1, ml = -2; ms = -½ n = 2; l = 0, ml = 0; ms = 1 n = 2; l = 1, ml = 0; ms = +½ Ejercicio: Indique cuál(es) de los siguientes conjuntos de números cuánticos están permitidos: n = 1; l = 1, ml = 0; ms = +½ No permitido; l solo puede ser cero (0) cuando n = 1 n = 3; l = 1, ml = -2; ms = -½ No permitido; ml solo puede ser -1, 0, +1 cuando l = 1 n = 2; l = 0, ml = 0; ms = 1 No permitido; ms solo puede ser -½ ó +½ n = 2; l = 1, ml = 0; ms = +½ Permitido Lo ponemos en práctica… Calcula los cuatro números cuánticos del último electrón en: 4d6 Datos/Observaciones Calcula los cuatro números cuánticos del último electrón en: 4d6 Continuación… Calcula los cuatro números cuánticos del último electrón en: 4d6 Continuación… Calcula los cuatro números cuánticos del último electrón en: 4d6 Continuación… CONFIGURACIÓN ELECTRÓNICA: Es la distribución ordenada de electrones en cada nivel y subnivel energético. O bien, la distribución de electrones en los orbitales de un átomo. Indica la cantidad de electrones existentes en un tipo de orbital Indica el número cuántico principal (n) 1 3p Los números cuánticos para el último electrón en este ejemplo serían: n=3 l = 1 m = -1 s = +1/2 Indica el número cuántico secundario (l) Distribución Electrónica Diagrama de Moeller o Regla del Serrucho Principios que la regulan la configuración electrónica 1. Principio de Construcción Principio de establece que los electrones irán ocupando los niveles de más baja energía. https://www.youtube.com/watch?v=STo7ZIWsMbA Datos/Observaciones Principios que la regulan la configuración electrónica Primer electrón n= 1 l= 0 m= 0 Segundo electrón n= 1 l= 0 m= 0 Datos/Observaciones 2. Principio de exclusión de Pauli. s= +1/2 s= -1/2 Establece que no pueden haber 2 electrones de un mismo átomo con los cuatro números cuánticos iguales. Principios que la regulan la configuración electrónica 3. Principio de máxima multiplicidad: Regla de Hund Para orbitales de igual energía, la distribución más estable de los electrones, es la que tenga mayor número de espines paralelos, es decir, electrones desapareados. Los electrones se ubican uno en uno (con el mismo espin) en cada orbital y luego se completan con el segundo electrón con espin opuesto. Datos/Observaciones Ejemplo de representación 11Na Configuración electrónica (C.E): 1s2 2s2 2p6 3s1 Números cuánticos del último electrón de la C.E. n=3 Datos/Observaciones =0 m=0 Configuración Abreviada Es más compacta que la anterior. Se remplaza parte de la configuración electrónica, por el símbolo del gas noble de Z inmediatamente anterior al elemento. Gases nobles: 2He; 10Ne; 18Ar; 36Kr; 54Xe; 86Rn. 1s2 2s2 2p6 3 s (10Ne) 3s1 Datos/Observaciones 1 Átomos que presenta anomalías en la configuración electrónica Con el cromo (Cr Z = 24) Configuración incorrecta [Ar] 3d4 4s2 Configuración correcta [Ar] 3d5 4s1 Con el cobre (Cu Z = 29) Configuración incorrecta [Ar] 3d9 4s2 Configuración correcta [Ar] 3d10 4s1 https://www.youtube.com/watch?v=81tfT0H3PHI Datos/Observaciones Ejercicio de cierre 1 Si el último penúltimo electrón de la configuración electrónica de un elemento tiene los números cuánticos 3, 2, 0, +1/2 respectivamente (n, l, m, s) Calcule el número atómico del elemento, detallando el método usado y halle el número másico si tiene un total de 25 neutrones. Datos/Observaciones Ejercicio de cierre 2 El anión trivalente de un elemento presenta los siguientes números cuánticos para el último electrón de su configuración electrónica: n=3, l=1, m=-1 y s=1/2. Plantee dicha configuración. Datos/Observaciones Tabla Periódica Moderna Es el ordenamiento de los elementos químicos de forma creciente según su número atómico (Z), es decir según la cantidad de protones del núcleo de un átomo. Clasifica, organiza y distribuye los distintos elementos químicos conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos. Lo que se viene en la siguiente sesión!!! Lo que hemos aprendido hoy… 1. Los orbitales son regiones alrededor del núcleo de un átomo donde está la mayor probabilidad de encontrar a los electrones. 2. Todo elemento químico tiene cuatro números cuánticos que lo caracteriza (n, l, m, s) y se utilizan para describir orbitales atómicos e identificar a los electrones que se ubican en ellos, permitiendo determinar su posición probable. 3. La distribución de los electrones de un átomo en los niveles y subniveles de energía (orbitales) se da a través de la configuración electrónica. 4. El diagrama de Moeller o Regla del Serrucho se utiliza para recordar el orden de llenado de los orbitales atómicos. Es, simplemente, una regla nemotécnica. 5. Para el llenado de electrones se debe tener en cuenta los principios que lo regulan, como el Principio de Construcción, Principio de exclusión de Pauli y el principio de máxima multiplicidad. GRACIAS