1.- Un átomo X, en estado excitado, presenta la siguiente
Anuncio

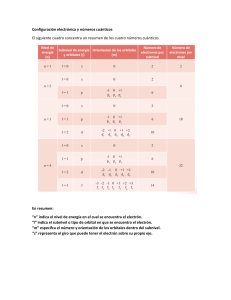
LA RIOJA / JUNIO 00. LOGSE / QUÍMICA / ESTRUCTURA DE LA MATERIA / OPCION A / CUESTIÓN 1 1.- Un átomo X, en estado excitado, presenta la siguiente configuración electrónica: 1s 2 2s2 2p2 3s1 . a) ¿De qué elemento se trata? b) Indique los cuatro números cuánticos de cada uno de los electrones desapareados de X, en su estado normal. Solución: a) El elemento tiene un electrón en un orbital s del nivel de energía 3, pero en el nivel anterior (el 2) sólo hay 2 electrones en orbitales p; luego en estado fundamental el átomo tendría los 3 electrones en los orbitales 2p, siendo su configuración: 1s2 2s2 2p3 El elemento, por su configuración externa, pertenece al grupo de los nitrogenoideos, y por ser del periodo 2, será el nitrógeno (N). b) Los electrones desapareados de la configuración fundamental se encuentran en orbitales 2p, y sabemos que en un mismo átomo no puede haber 2 electrones con los 4 números cuánticos iguales (Principio de exclusión de Pauli). Los números cuánticos principal (n), y secundario (l), serán los mismos para los 3 e- : n (nivel energía) = 2 l (forma orbital) = 1 (pues los orbitales son tipo p). Los números m, y s, serán en este caso: m = +1, 0 ,-1 s = +1/2 Así, escribimos ya los 4 nº cuánticos de cada electrón: n l m s Electrón 1 2 1 +1 +1/2 Electrón 2 2 1 0 +1/2 Electrón 3 2 1 -1 +1/2 Se trata de tres electrones situados en orbitales degenerados (de igual energía ). www.profes.net es un servicio gratuito de Ediciones SM