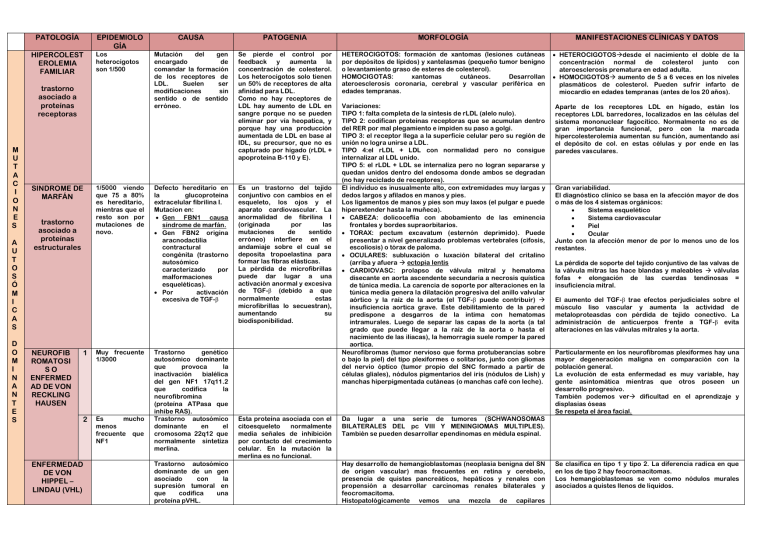
PATOLOGÍA EPIDEMIOLO GÍA HIPERCOLEST EROLEMIA FAMILIAR Los heterocigotos son 1/500 trastorno asociado a proteínas receptoras M U T A C I O N E S A U T O S Ó M I C A S D O M I N A N T E S SINDROME DE MARFÁN trastorno asociado a proteínas estructurales NEUROFIB ROMATOSI SO ENFERMED AD DE VON RECKLING HAUSEN 1/5000 viendo que 75 a 80% es hereditario, mientras que el resto son por mutaciones de novo. 1 Muy frecuente 1/3000 2 Es mucho menos frecuente que NF1 ENFERMEDAD DE VON HIPPEL – LINDAU (VHL) CAUSA PATOGENIA MORFOLOGÍA MANIFESTACIONES CLÍNICAS Y DATOS Mutación del gen encargado de comandar la formación de los receptores de LDL. Suelen ser modificaciones sin sentido o de sentido erróneo. Se pierde el control por feedback y aumenta la concentración de colesterol. Los heterocigotos solo tienen un 50% de receptores de alta afinidad para LDL. Como no hay receptores de LDL hay aumento de LDL en sangre porque no se pueden eliminar por vía heopatica, y porque hay una producción aumentada de LDL en base al IDL, su precursor, que no es capturado por hígado (rLDL + apoproteína B-110 y E). HETEROCIGOTOS: formación de xantomas (lesiones cutáneas por depósitos de lípidos) y xantelasmas (pequeño tumor benigno o levantamiento graso de esteres de colesterol). HOMOCIGOTAS: xantomas cutáneos. Desarrollan ateroesclerosis coronaria, cerebral y vascular periférica en edades tempranas. HETEROCIGOTOSdesde el nacimiento el doble de la concentración normal de colesterol junto con ateroesclerosis prematura en edad adulta. HOMOCIGOTOS aumento de 5 a 6 veces en los niveles plasmáticos de colesterol. Pueden sufrir infarto de miocardio en edades tempranas (antes de los 20 años). Aparte de los receptores LDL en hígado, están los receptores LDL barredores, localizados en las células del sistema mononuclear fagocítico. Normalmente no es de gran importancia funcional, pero con la marcada hipercolesterolemia aumentan su función, aumentando así el depósito de col. en estas células y por ende en las paredes vasculares. Defecto hereditario en la glucoproteina extracelular fibrilina I. Mutacion en: Gen FBN1 causa síndrome de marfán. Gen FBN2 origina aracnodactilia contractural congénita (trastorno autosómico caracterizado por malformaciones esqueléticas). Por activación excesiva de TGF-β Es un trastorno del tejido conjuntivo con cambios en el esqueleto, los ojos y el aparato cardiovascular. La anormalidad de fibrilina I (originada por las mutaciones de sentido erróneo) interfiere en el andamiaje sobre el cual se deposita tropoelastina para formar las fibras elásticas. La pérdida de microfibrillas puede dar lugar a una activación anormal y excesiva de TGF-β (debido a que normalmente estas microfibrillas lo secuestran), aumentando su biodisponibilidad. Variaciones: TIPO 1: falta completa de la síntesis de rLDL (alelo nulo). TIPO 2: codifican proteínas receptoras que se acumulan dentro del RER por mal plegamiento e impiden su paso a golgi. TIPO 3: el receptor llega a la superficie celular pero su región de unión no logra unirse a LDL. TIPO 4:el rLDL + LDL con normalidad pero no consigue internalizar al LDL unido. TIPO 5: el rLDL + LDL se internaliza pero no logran separarse y quedan unidos dentro del endosoma donde ambos se degradan (no hay reciclado de receptores). El individuo es inusualmente alto, con extremidades muy largas y dedos largos y afilados en manos y pies. Los ligamentos de manos y pies son muy laxos (el pulgar e puede hiperextender hasta la muñeca). CABEZA: dolicoceflia con abobamiento de las eminencia frontales y bordes supraorbitarios. TORAX: pectum excavatum (esternón deprimido). Puede presentar a nivel generalizado problemas vertebrales (cifosis, escoliosis) o tórax de paloma. OCULARES: subluxación o luxación bilateral del critalino (arriba y afuera ectopia lentis CARDIOVASC: prolapso de válvula mitral y hematoma disecante en aorta ascendente secundaria a necrosis quística de túnica media. La carencia de soporte por alteraciones en la túnica media genera la dilatación progresiva del anillo valvular aórtico y la raíz de la aorta (el TGF-β puede contribuir) insuficiencia aortica grave. Este debilitamiento de la pared predispone a desgarros de la intima con hematomas intramurales. Luego de separar las capas de la aorta (a tal grado que puede llegar a la raíz de la aorta o hasta el nacimiento de las ilíacas), la hemorragia suele romper la pared aortica. Neurofibromas (tumor nervioso que forma protuberancias sobre o bajo la piel) del tipo plexiformes o solitarios, junto con gliomas del nervio óptico (tumor propio del SNC formado a partir de células gliales), nódulos pigmentarios del iris (nódulos de Lish) y manchas hiperpigmentada cutáneas (o manchas café con leche). Trastorno genético autosómico dominante que provoca la inactivación bialélica del gen NF1 17q11.2 que codifica la neurofibromina (proteína ATPasa que inhibe RAS). Trastorno autosómico dominante en el cromosoma 22q12 que normalmente sintetiza merlina. Trastorno autosómico dominante de un gen asociado con la supresión tumoral en que codifica una proteína pVHL. Esta proteína asociada con el citoesqueleto normalmente media señales de inhibición por contacto del crecimiento celular. En la mutación la merlina es no funcional. Gran variabilidad. El diagnóstico clínico se basa en la afección mayor de dos o más de los 4 sistemas orgánicos: Sistema esquelético Sistema cardiovascular Piel Ocular Junto con la afección menor de por lo menos uno de los restantes. La pérdida de soporte del tejido conjuntivo de las valvas de la válvula mitras las hace blandas y maleables válvulas fofas + elongación de las cuerdas tendinosas = insuficiencia mitral. El aumento del TGF-β trae efectos perjudiciales sobre el músculo liso vascular y aumenta la actividad de metaloproteasdas con pérdida de tejido conectivo. La administración de anticuerpos frente a TGF-β evita alteraciones en las válvulas mitrales y la aorta. Particularmente en los neurofibromas plexiformes hay una mayor degeneración maligna en comparación con la población general. La evolución de esta enfermedad es muy variable, hay gente asintomática mientras que otros poseen un desarrollo progresivo. También podemos ver dificultad en el aprendizaje y displasias óseas Se respeta el área facial. Da lugar a una serie de tumores (SCHWANOSOMAS BILATERALES DEL pc VIII Y MENINGIOMAS MULTIPLES). También se pueden desarrollar ependinomas en médula espinal. Hay desarrollo de hemangioblastomas (neoplasia benigna del SN de origen vascular) mas frecuentes en retina y cerebelo, presencia de quistes pancreáticos, hepáticos y renales con propensión a desarrollar carcinomas renales bilaterales y feocromacitoma. Histopatológicamente vemos una mezcla de capilares Se clasifica en tipo 1 y tipo 2. La diferencia radica en que en los de tipo 2 hay feocromacitomas. Los hemangioblastomas se ven como nódulos murales asociados a quistes llenos de liquidos. sanguíneos y células estromales intermedias de histogénesis incierta con citoplasma vacuolado PAS+, rico en lípidos. Dichas células son el elemento neoplásico del hemangioblastoma. Enfermedad de herencia dominante Enfermedad degenerativa de los núcleos de la base del encéfalo Función anormal de una proteína de los canales de cloro epiteliales que codifica por el gen del regulador de la conductancia transmembrana de la fibrosis quística (CFTR) del cromosoma 7q31.2 Trastorno del transporte de iones cloro en las células epiteliales. ALBINISMO Ausencia de tirosinasa ALCAPTONURI A Trastorno autosómico recesivo que determina la ausencia de la enzima homogentisato oxidasa Defecto enzimático que genera un bloqueo metabólico con reducción del producto final deficiencia de melanina Se acumula ácido homogentitísico en el cuerpo por la imposibilidad de transformarlo en ácido metilacetoácido en la vpia de degradación de la tirosina. ENFERMEDAD O COREA DE HUNTINGTON M U T A C I O N E S A U T O S Ó M I C A S R E C E S I V A S FIBROSIS QUISTICA O MUCOVISCIDO SIS ENFERMEDAD DE TAY-SACHS E N F E Usualmente afecta a personas entre 35 y 50 años 1/2500 nacidos vivos Alta prevalencia en europa (este) 1/30. En esta gangliosidosis GM2 (enfermedad de depósitos lisosómicos) ocasionada por mutaciones en el locus de la subunidad alfa en el cromosoma 15, hay una deficiencia de hexosaminidasa. La deficiencia de esta enzima trae aparejada la imposibilidad de catabolizar los gangliósidos GM2. Debido al fallo genético hay mal plegamiento de las proteínas que genera una respuesta a la “proteína no plegada” lo cual lleva a la aopotosis de las células ((Hay otro tipo de gangliosidosis GM2, ENFERMEDAD DE SANDORF que se asocia con la deficiencia de la subunidad beta)). Avanza rápidamente hacia la demencia y muerte 5 a 20 años después de los primeros síntomas. Alteraciones pancreáticas (85 a 90% de los casos). En los casos graves hay taponamiento de los conductos de forma completa atrofia del componente exócrino glandular con fibrosis progresiva. Hay tapones de moco denso en el intestino delgado formando el íleo meconial. Los canalículos biliares estas taponados por material mucoso en conjunto con proliferación de conductillos e inflamación portal. 1/3 de los ptes desarrolla cirrosis biliar. Hay dilatación progresiva de los conductos excretres de las glándulas salivales , junto con metaplasia escamosa y atrofia glandular seguida de fibrosis. Secreción mucosa viscosa de las glándulas submucosas del árbol respitatorio que determinan obstrucción y infección de las vías aéreas, la cuales pueden ocasionar bronquitis graves con bronquiectasias (dilatación prominente de uno o más bronquios). Hay azoospermia e infertilidad en 95% de los varones que llegan a edad adulta. También puede haber ausencia bilateral de los conductos deferentes. Las alteraciones pueden aparecer desde el nacimiento hasta muchos años espues, siendo muy variable. Afecta a la secreción de líquido en las glándulas exócrinas y el revestimiento epitelial de los aparatos genital, digestivo y respiratorio. Hay secreciones anormamente viscosas que obstruyen las vías del órgano. Los cuadros clínicos asociados son: Neumopatía crónica secundaria a infecciones repetidas. Insuficiencia cardíaca Esteatorrea Malnutrición Cirrosis hepática Obstrucción intestinal o íleo meconial Infertilidad masculina Pólipos nasales recurrentes Insuficiencia pancreática Enfermedad pulmonar El diagnóstico se lleva a cabo ante: concentraciones elevadas de electrolitos persistentememnte en sudor (test del sudor) trastornos característicos realización de screening genético en RN El ácido homogentísico se acumula en el colágeno de los tejidos conjuntivos, tendones y cartílago coloración negro-azulada (ocronosis) en orejas, nariz y mejillas mayormente. Debido a que este se excreta por orina, adquiere un color negro. Se evidencia artropatías a edades tempranas. Hay acumulación de gangliósidos GM2 en todos los tejidos, especialmente corazón, hígado y bazo, pero se destaca el SNC Y SNAutónomo. Al estudio histológico hay neuronas balonizadas con vacuolas intracitoplasmáticas (que se corresponde con lisosomas distendidos llenos de gangliosidos). Con el tiempo hay una destrucción progresiva de neuronas, proliferación de microglia y acumulación de lípidos complejos en el tejido cerebral. Las células ganglionares de la retina también aparecen tumefactas por la mismas razonas, mayormente alrededor de la mácula aparición de mancha rojo cereza en la mácula por acentuación del color normal de la coroides que se contrasta con la palidez provocada por las células tumefactas del resto de la retina. Los RN aparentan ser normales, pero a los 6 meses manifiestan signos y síntomas: deterioro mental progresivo - incoordinación motora - retraso mental - flacidez muscular - ceguera - demencia en 1-2 años los ptes terminan en estado vegetativo completo y fallecen a los 2-3 años. Afecta al cerebro, cerebelo, ganglios basales, médula espinal y ganglios de la raíz posterior + SNA y neuronas de la retina. Se debe establecer los portadores y realizar estudio prenatal. R M E D A D E S ENFERMEDAD DE NIEMANNPICK Tipo A y B Frecuentes en judíos (norte de europa). P O R A C U M U L A C I Ó N L I S O S O M A L Mutaciones en los genes NPC1 (95% de los casos) y NPC2. ENFERMEDAD DE NIEMANNPICK Tipo C ENFERMEDAD DE GAUCHER (EG) Aunque normalmente es una enfermedad autosómica recesiva, los heterocigotas que heredan el alelo mutante de la madre pueden desarrollar la enfermedad. El gen de la esfingomielinasa se localiza en el cromosoma 11p15.4. es una mutación en sentido erróneo. Es la forma más frecuente en la que se presentan los trastornos lisosómicos. Tipo 1: judíoseuropeos Tipo 2: no muetsra predilección por judios Conjunto de trastornos autosómicos recesivos secundarios a genes que codifican la enzima glucocerebrosidasa. Acumulación de lisosomas con esfingomielina (la cual normalmente es un componente de las membranas plasmáticas celulares y de los orgánulos) por la deficiencia de esfingomielinasa. La acumulación es más marcada en las células del sistema nuclear fagocítico. Se debe a un defecto primario en el transporte de los lípidos no enzimáticos. NPC1 está unida a membrana, NPC2 es soluble y ambas participan en el transporte de colesterol desde los lisosomas al citoplasma. No se puede separar el residuo glucosa de la ceramida de los glucocerebrósidos, por lo que se acumulan principalmente en las células fagocíticas (y en algunos subtipos en el SNC). Los glucocerebrósidos se forman constantemente del metabolismo de glucolípidos a partir de membranas celulares de leucocitos y eritrocitos envejecidos. Hay activación de los macrófagos con secreción de citocinas (IL 1, 6 y TNF-α). Tipo A: forma grave en lactantes con gran afección neurológica + acumulaciones viscerales de esfingomielina y atrofia progresiva, lo que lleva a una muerte precoz (aproximadamente 3 años). Tipo B: hay organomegalia sin afección del SNC. Los enfermos llegan a la adultez. Las células afectadas llegan hasta los 90 um de diámetro por la presencia de lisosomas secundarios distendidos por esfingomielina y colesterol numerosas vacuolas pequeñas que le dan una morfología espumosa a las células (cuerpos de “cebra”). En 1/3 de los pacientes se reconoce la mancha color rojo cereza en la retina, al igual que en la enfermedad de Tay-Sachs. Las células espumosas se distribuyen por varios órganos, en especial bazo, hígado, ganglios linfáticos, médula ósea, amígdalas, aparato digestivo y los pulmones esplenomegalia masiva (alcanza hasta 10 veces su tamaño) junto con una hepatomegalia leve y un aumento moderado del tamaño de los ganglios de forma generalizada. En el SNC circunvoluciones encefálicas hundidas y ensanchadas con afección neuronal difusa en todas las regiones de SN. Hay vacuolización con balonizacion de neuronas = muerte de neuronas con pérdida de sustancia cerebral. Hay hidropesía fetal o muerte neonatal en su forma aguda, o puede adoptar una forma crónica con lesiones neurológicas progresivas (ataxia, parálisi de la mirada vertical supranuclear, disartia y regresión psicomotora). Hay 3 subtipos clínicos: 1) TIPO 1 O FORMA CRONICA NO NEUROPÁTICA: la acumulación de glucocerebrósidos se limita a los fagocitos mononucleares en todo el cuerpo (no hay en encéfalo). Hay afección esplénica y esquelética. Hay muy poca actividad enzimática. La longevidad se acorta, pero no demasiado. -El bazo está aumentado de tamaño (llega hasta 10kg), hay adenopatías generalizadas moderadas y en un 70 a 100% de los enfermos tipo 1 se ve acumulación de células de gaucher en médula ósea provocan erosión osea que en ocasiones son pequeñas o pueden llegas a provocar fracturas patológicas. Esto último se debe a la secreción de citocinas de macrófagos activados. 2) 3) ENFERMEDAD DE SANDHOFF Tipo A: pueden aparecer desde el nacimiento sus manifestaciones, pero siempre son evidentes a partir de los 6 meses. Los lactantes poseen un abdomen protuberante por la marcada hepatoesplenomegalia. Otras manifestaciones son retraso del crecimiento progresivo, fibre, vómitos, adenopatías y deterioro progresivo de la función psicomotora. TIPO 2 O EG AGUDA NEUROPÁTICA: forma cerebral aguda en el lactante. No hay actividad de glucocerebrosidasa. Hay hepatoesplenomegalia con afección progresiva del SNC muerte a temprana edad. TIPO 3: hay una afección sistémica propia del tipo 1 con una afección del sistema nervioso que comienza en la adolescencia o en los primeros años de la vida adulta. -En los pacientes con alteración cerebral se reconocen las células de gaucher en los espacios de Virchow-Robin (espacios perivasculares de líquido intersticial que rodea los vasos cerebrales desde el espacio subaracnoideo a través del parénquima encefálico) y las arteriolas se rodean de células de la adventicia edematosas. No hay almacenamiento de lípidos en las neuronas, pero estas resultan lesionadas por las citocinas liberadas por los macrófagos que rodean los vasos. Tesaurismosis grave vinculada con la enfermedad de tay-sachs. Abarca también a los gangliosidos GM2 con actividad de la hexosaminidasa A disminuida o ausente. Pero en esta enfermedad se suma aparte una falla en la subunidad B por mutación del gen HEXB. Los glucocerebrósidos se acumulan en gran cantidad en las células fagocíticas de todo el cuerpo en las tres formas de la enfermedad, estas células pasan a llamarse células de gaucher (en hígado, bazo, médula ósea, ganglios linfáticos, amígdalas, timo y placas de Peyer. A veces las podemos encontrar con menor tamaño en tabiques alveolares y espacios aéreos pulmonares). Las células de gaucher llegan a medir hasta 100 um con uno o más nucleos excéntricos, no suelen estar vacuoladas porque tienen un citoplasma fibrilar que se debe a los lisosomas distendidos elongados en pilas de bicapas (“papel de seda arrugado”). Son PAS+ TIPO 1: los signos y síntomas aparecen en la edad adulta y se relacionan con esplenomegalia o afecciones óseas. Podemos evidenciar pancitopenia o trombocitopenia por el hiperesplenismo. Hay dolor óseo y fracturas patológicas cuando se expande el espacio medular de forma masiva. TIPO 2 Y 3: predomina la disfunción del SNC, convulsiones y un deterioro mental progresivo junto con afecciones en ganglios, bazo e hígado. Forma infantil muerte antes de los 3 años. SÍNDROME DE DOWN T R A S T O R N O S C R O M O S Ó M I C O S SÍNDROME DE KLINEFELTER SÍNDROME DE TURNER Alteración cromosómica más frecuente y una de las principales causas de retraso mental. 1/700 en EEUU – 1/1550 en madres menores de 20 años y 1/25 en madres mayores de 45 años. Es una de las enfermedades más frecuentes que afectan a los cromosomas sexuales. Es una de las causas más frecuente de hipogonadismo masculino. 1/660 hombres vivos 1/2500 RN vivos femeninos. La causa más frecuente es la no disyunción cromosómica en la meiosis Un 95% de los individuos presenta trisomía (recuento de cromosomas en 47). La mayoría de los demás casos tiene recuento de cromosomas normal pero con mayor cantidad de material genético. En un 4% de los casos puede verse una translocación robertsoniana (translocación entre dos cromosomas acrocéntricos cerca de sus centrómeros) entre el cromosoma 21 y otro acrocentrico (22 o 14 xej). Un 1% son mosaicos con mezclas de cromosomas 46 y 47 por falta de separación del cromosoma 21 (son más leves). Existencia de 2 o + cromosomas X y un cromosoma Y (o +). Monosomía completa o parcial del cromosoma X. -57% muestran ausencia de todo el - Retraso mental Abundante piel en el cuello Pliegues epicánticos y perfil aplanado de la cara Pliegue simiesico (pliegue único en la mano) Hernia umbilical Hipotonía Estenosis intestinal Malformaciones congénitas cardíacas Tipo trisomía 21 47, XX, +21 Tipo translocación 46, XX, der(14;21)(q10;q10), +21 Tipo mosaico 46, XX o 47,XX, +21 - - Hipogonadismo masculino (único rasgo persistente entre todos los enfermos). Se debe a un aumento de las gonadotropinas (especialmente de la FSH) constantemente, en conjunto con estradiol y una marcada disminución de la testosterona. El 90% posee un cariotipo 47, XXY por falta de separación en la primera meiosis de los padres. Todos los cromosomas X se inactivan en los pacientes, pero no lo hacen por completo, sino que hay una sobreexpresión que provoca hipogonadismo, sumada a una inactivación preferencial en el cromosoma X del gen encargado de coordinar la síntesis del receptor de andrógenos (lo cual explica las bajas concentraciones de testosterona pene pequeño). Se caracteriza por hipogonadismo en pacientes femeninos. 5 a 10% presenta secuencias Importante retraso mental con un CI de 25 a 50. Actitud afable y dócil. Conformismo. Los mosaicos pueden llegar a tener un intelecto normal o casi normal Un 40% sufre malformaciones congénitas cardiacas, sobre todo defectos del cojinete cardíaco ostium primum, comunicación interauricular, malformaciones de válvulas AV y comunicación interventricular. Pueden verse atresias esofágicas o intestinales. Los niños con trisomía 21 poseen 10 a 20 veces mayores posibilidades de padecer leucemia linfoblástica aguda o mieloide aguda. Todos los pacientes con trisomía 21 sufren cambios neuropáticos característicos de la enfermedad de Alzheimer. Hay respuestas inmunitarias anormales infecciones (mayormente pulmonares) + procesos autoinmuitarios tiroideos. Suele detectarse en la pubertad. La mayoría de los ptes presenta una constitución corporal característica: Aumento de la longitud entre las pantas y el hueso púbico = aspecto elongado del cuerpo Aspecto enucoide: Piernas largas Testículos pequeños atrofiados con pene pequeño Ausencia de características sexuales secundarias (voz ronca, barba o distribución masculina del vello púbico) Ginecomastasia Hay riesgo de cáncer de mama aumentado (20 veces mayor que un hombre normal), tumores de células germinales extragonadales y enfermedades autoinmunes (LES). - Posee un CI levemente inferior a lo normal, y el retraso mental es infrecuente. - Hay mayor predisposición a diabetes tipo 2 y síndrome metabólico, en conjunto con aumento de la resistencia a la insulina. - Se evidencia prolapso de la válvula mitral, y por el desequilibrio hormonal vemos osteoporosis y fracturas. - Causa reducción de la espermatogenia e infertilidad masculina. Se evidencia con atrofia completa de los túbulos seminíferos (que se sustituyen con sombras colágenas hialinas rosadas), túbulos normales mezclados con atróficos o tubulos primitivos de aspecto embrionario constituidos de cordones (no maduraron para generar la luz del órgano). Las células de Leydig son muy prominentes por la atrofia y el apilamiento de los túbulos. -Los pacientes en las formas más graves suelen consultar durante la lactancia con edema en el dorso de las manos y pies, secundario a estasis venosa + edema en la nuca por la existencia de linfáticos distendidos higroma quístico. -Conforme estos lactantes se desarrollan, el edema desaparece -La situación mental de los pacientes suele ser normal , aunque hay presencia de defectos sutiles de procesamiento de información no verbal visual y temporal. -Hay presencia de malformaciones cardíacas congénitas en un 25 a 50% de los casos coartación preductal de la cromosoma X (genotipo X0) -1/3 (14%) presenta alteraciones estructurales del cromosoma X -2/3 (29%) son mosaicos muestran una población de células 45, X con uno o más tipos de células de cariotipo normal. de segmentos del cromosoma Y translocado predisposición a tumor gonadal (gonadoblastoma). SINDROME DE EDWARDS pero presentan el “cuello alado” (es bilateral con laxitud en piel de la nuca). -No hay desarrollo de caracteres sexuales secundarios, con presencia de genitales externos infantiles, poco desarrollo mamario y poco vello púbico. -Hay talla baja (no más de 1,50) y amenorrea primaria (siendo responsable de 1/3 del total de las amenorreas). -“la menopausia se desarrolla antes que la menarca” se debe a que los ovocitos de ovarios que se desarrollan en el período prenatal se involucionan convirtiéndose en hebras fibrosas atróficas sin óvulos ni folículos (cintillas ováricas). -Presencia de cúbito valgo, línea posterior de implantación del pelo baja, tórax amplio con pezones muy separados, nevos pigmentados y linfedema periférico desde el nacimiento. aorta y válvula bicúspide. -Desarrollo de anticuerpos frente a tiroides en un 50% de los casos, y la mitad de estos desarrollan hipotiroidismo. -Hay intolerancia a la glucosa, obesidad y resistencia a la insulina (en la minoría de los pacientes).









