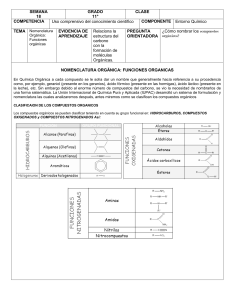
1.1. Esquema formulación INORGÁNICA
Anuncio

Nomenclatura de composición estequiométrica Usando prefijos multiplicadores (di, tri, tetra…) Expresando el número de oxidación con números romanos entre paréntesis sin espacio delante (sólo si tiene más de uno) Con número de carga en números arábigos entre paréntesis sin espacio delante. Nomenclatura tradicional: uso de prefijos y sufijos para nombrar el compuesto: Manganeso: en vez de seguir la regla de aquellos que tienen únicamente tres valencias cambia: Con la valencia menor se usa la terminación – oso. Con la intermedia se usa la terminación – ico. Con la más alta se usa el prefijo per- y el sufijo – ico. Cromo: solo hay dos fórmulas y nombres posibles: Ácido crómico: CrO3 + H2O H2CrO4 Ácido dicrómico: 2CrO3 + H2O H2Cr2O7 Nomenclatura de sustitución: Nombre del hidruro progenitor. NOMBRE SUSTANCIAS SIMPLES CATIONES MONOATÓMICOS SUSTANCIAS DE UN SOLO ELEMENTO NOMENCLATURA Nomenclatura de composición (con prefijos multiplicadores): [Pref-][ elemento] IONES Nomenclatura de composición: - Nº de oxidación: catión [elemento](nºox.en nºromanos) - Nº de carga: ion [elemento](nºcarga) TIPO Xn En+ EJMPLOS H2 Dihidrógeno Cr3+ Catión cromo(III) Ion cromo(3+) CATIONES HOMOPOLIATÓMICOS CATIONES HETEROPOLIATÓMICOS ANIONES MONOÁTOMICOS Nomenclatura de composición: - Nº de carga: ion [pref.][elemento](nºcarga) + + Cambiando terminación “-o” por “-io”: 𝑵𝑯+ 𝟒 ion amonio, 𝑯𝟑 𝑶 ion oxonio, 𝑷𝑯𝟒 ion fosfonio Nomenclatura de composición: Nº de carga: ion [𝐫𝐚í𝐳 𝐧𝐨𝐦𝐛𝐫𝐞 𝐞𝐥𝐞𝐦𝐞𝐧𝐭𝐨]–𝐮𝐫𝐨 –𝐢𝐝𝐨 (𝐧º𝐜𝐚𝐫𝐠𝐚) 2− - Excepción: 𝑂 óxido ANIONES Nomenclatura de composición: HOMOPOLIATÓMICOS - Nº de carga: 𝐢𝐨𝐧 [𝐩𝐫𝐞𝐟. ][𝐫𝐚í𝐳 𝐧𝐨𝐦𝐛𝐫𝐞 𝐞𝐥𝐞𝐦𝐞𝐧𝐭𝐨]–𝐮𝐫𝐨 –𝐢𝐝𝐨 (𝐧º𝐜𝐚𝐫𝐠𝐚) - Excepciones: 𝑂2− 𝑖𝑜𝑛 𝑑𝑖ó𝑥𝑖𝑑𝑜(1 −) 𝑜 𝑖𝑜𝑛 𝑠𝑢𝑝𝑒𝑟ó𝑥𝑖𝑑𝑜, 𝑂22− 𝑖𝑜𝑛 𝑑𝑖ó𝑥𝑖𝑑𝑜(2 −) 𝑜 𝑖𝑜𝑛 𝑝𝑒𝑟ó𝑥𝑖𝑑𝑜, 𝑂3− 𝑖𝑜𝑛 𝑡𝑟𝑖ó𝑥𝑖𝑑𝑜(1 −) 𝑜 𝑖𝑜𝑛 𝑜𝑧ó𝑛𝑖𝑑𝑜 ANIONES Nomenclatura de composición: HETEROPOLIATÓMICOS - Unos pocos tienen nombres con terminación estas terminaciones: 𝑂𝐻 − ion hidróxido, 𝐶𝑁 − ion cianuro. Oxianiones (los que contienen oxigeno): Nomenclatura común: - Nombres que terminan en –ato o –ito y con prefijos per- e hipo- (según nº oxidac.) Nomenclatura de composición: - [𝐩𝐫𝐞𝐟][𝐨𝐱𝐢𝐝𝐨][𝐫𝐚í𝐳 á𝐭𝐨𝐦𝐨 𝐜𝐞𝐧𝐭𝐫𝐚𝐥][−𝐚𝐭𝐨](𝐧º𝐜𝐚𝐫𝐠𝐚) - Prefijo tio- = un átomo de O ha sido sustituido por uno de S. - Los aniones que se obtienen añadiendo H+ a un oxianión: hidrogeno- o dihidrógenoNomenclatura de hidrógeno: - [pref][hidrógeno]([pref][oxido][raíz átomo central][-ato])(nºcarga) Nomenclatura de adición: - [𝐩𝐫𝐞𝐟][𝐡𝐢𝐝𝐫ó𝐱𝐢𝐝𝐨][𝐩𝐫𝐞𝐟][𝐨𝐱𝐢𝐝𝐨][𝐫𝐚í𝐳 á𝐭𝐨𝐦𝐨 𝐜𝐞𝐧𝐭𝐫𝐚𝐥][−𝐚𝐭𝐨](𝐧º𝐜𝐚𝐫𝐠𝐚) ÓXIDOS DE METALES ÓXIDOS DE NO METALES COMPUESTOS METAL – NO METAL SUSTANCIAS DE DOS ELEMENTOS: COMPUESTOS BINARIOS Nomenclatura de composición: (oxígeno nº oxidación -2) [Pref][óxido] de [pref][metal] Óxido de metal(Nºoxidación) Nota: en los peróxidos el oxígeno actúa con nºox. -1 y el subíndice no se simplifica Nomenclatura de composición (oxigeno nº oxidación -2) [Pref][óxido] de [pref][no metal] Nota: el prefijo mono sólo antes de óxido y cuando los coef.esteq. sean 1:1 Óxido de [no metal](Nºoxidación) Nomenclatura de composición (COMPUESTOS IONICOS) [nombre del anión] de [nombre del catión](nºoxidación) O+ 2 Ion dioxígeno(1+) E n- 𝐵3− Ion boruro(3-) 𝐼3− Ion triyoduro(1-) 𝐶𝑙𝑂4− 𝑖𝑜𝑛 𝑝𝑒𝑟𝑐𝑙𝑜𝑟𝑎𝑡𝑜 𝐶𝑙𝑂3− 𝑖𝑜𝑛 𝑐𝑙𝑜𝑟𝑎𝑡𝑜 𝐶𝑙𝑂2− 𝑖𝑜𝑛 𝑐𝑙𝑜𝑟𝑖𝑡𝑜 𝐶𝑙𝑂− 𝑖𝑜𝑛 ℎ𝑖𝑝𝑜𝑐𝑙𝑜𝑟𝑖𝑡𝑜 −𝑧 𝑋𝑛 𝑂𝑚 𝑆2 𝑂72− ℎ𝑒𝑝𝑡𝑎𝑜𝑥𝑖𝑑𝑜𝑠𝑢𝑙𝑓𝑎𝑡𝑜(2−) Ion tiosulfato (𝑆2 𝑂32−) 𝐻𝑆𝑂4− ion hidrogenosulfato 𝐻2 𝑃𝑂4− dihidrogeno(tetraoxidosulfato)(1−) 𝐻𝑆𝑂4− [SO3(OH)]hidroxidotrioxidosulfato(1-) MO Om X O Ox Mx X m MnO2 Dióxido de manganeso Óxido de manganeso(IV) 𝐻2 𝑂2 peróxido de hidrógeno N2 O4 Tetraóxido de dinitrógeno Óxido de nitrógeno(IV) FeCl3 Cloruro de hierro(III) COMPUESTOS NO METAL-NO METAL HIDRUROS METÁLICOS Metal + H ÁCIDO BINARIO HIDRÁCIDOS (en disolución acuosa) HIDRÓGENO + NO METAL HIDRÓXIDOS Metal + grupos OH- OXOÁCIDOS H + O + No metal (también metal de transición con nºox alto) [nombre del anión] de [nombre del catión](nºcarga) Nota: si solo hay un número de oxidación posible no se nombra entre paréntesis (se omite) Nomenclatura de composición: [Pref][No metal]-uro de [pref][no metal] Nota: a la derecha siempre en la fórmula el más electronegativo. Nomenclatura de composición (H tiene número de oxidación -1) Hidruro de METAL(Nºoxidacion) H + calcógeno (G16) o halógeno (G17). El H actúa con número de oxidación +1 Nomenclatura de composición [No metal]-uro de [pref.][hidrógeno] [No metal]-uro de hidrógeno En disolución acuosa: ácido [no metal]-hídrico Nomenclatura de sustitución: [hidruros progenitores con la raíz del elemento que acompaña al hidrógeno]-ano, -eno, -ino. Si cambia el número de oxidación: prefijo 𝜆𝑛 −. Si tenemos 2 o más átomos metálicos unidos entre sí: prefijo multiplicador. Nomenclatura de composición [pref.][hidruro] de [pref][boro] Nomenclatura de sustitución: [hidruros progenitores con la raíz del elemento que acompaña al hidrógeno]-ano, -eno, -ino. Si cambia el número de oxidación: prefijo 𝜆𝑛 −. Si tenemos 2 o más átomos metálicos unidos entre sí: prefijo multiplicador. SUSTANCIAS DE TRES ELEMENTOS: COMPUESTOS TERNARIOS Nomenclatura de composición: números de oxidación. Hidróxido de metal(Nºoxidación) Nomenclatura tradicional aceptada: Prefijos y sufijos según número de oxidación: Más alto per-[elemento central]-ico Alto [elemento central]-ico Bajo [elemento central]-oso Más bajo hipo-[elemento central]-oso Si solo hay 3 N.Ox.: -ico, -oso, hipo—oso; si hay 2: -ico, -oso. Mismo número de oxidación distinto número de H y O: meta (1H2O), piro (2H2O) (ya en desuso) y orto (3H2O). Nomenclatura de adición: los O unidos a los H ácidos se nombran como hidróxido y los O unidos únicamente al elemento central como óxido. [prefijo]-[hidroxido]-[prefijo]-[oxido]-[elemento central] Nomenclatura de hidrógeno: X y Yx As2 Se3 Triseleniuro de diarsénico MH Hm CaH2 Hidruro de calcio CuH Hidruro de cobre(I) Hx X H H2S Sulfuro de hidrógeno o sulfuro de dihidrógeno HF(aq) ácido flurohídrico Sulfano X H Hx B2H6 Hexahidruro de diboro H3B-BH3 diborano HN=NH diazeno M(OH)m Ba(OH)2 Hidróxido de bario Fe(OH)3 Hidróxido de hierro(III) Ha X b Oc N.Ox. (+1): HClO ácido hipocloroso N.Ox. (+3): HClO2 ácido cloroso N.Ox. (+5): HClO3 ácido clórico N.Ox. (+7): HClO4 ácido perclórico H2SO4 SO2 (OH)2 dihidroxidodioxidoazufre OXISALES NEUTRAS Derivan de sustituir todos los H por cationes metálicos. OXISALES ÁCIDAS Derivan de sustituir parte de los H por cationes metálicos. prefijo-hidrogeno(prefijo-oxido-elemento central-ato) Oxoácidos con doble número del átomo central (uso del prefijo di-) Nomenclatura tradicional aceptada: Mismas reglas que para los oxiácidos cambiando las terminaciones –oso por –ito e –ico por –ato y manteniendo los prefijos. Si el metal puede tener diversos N.Ox. debemos indicarlo entre paréntesis. Nomenclatura de adición: [prefijo][nombre anión por adición] de [nombre catión](carga) Nomenclatura de composición: [prefijo alternativo si necesario]([prefijo][oxianión]) de [pref][catión] Nomenclatura tradicional aceptada: igual que las sales neutras añadiendo los prefijos hidrógeno- o dihidrógeno- delante del nombre de la sal neutra correspondiente. Nomenclatura de adición: [prefijo][nombre anión por adición] de [nombre catión](carga) Nomenclatura de composición: [prefijo alternativo si necesario]([prefijo][oxianión]) de [pref][catión] Ma X b Oc Dihidrógeno(tetraoxidosulfato) H2S2O7 ácidos disulfúrico Na2SO4 Sulfato de sodio Fe(NO3)3 Nitrato de hierro(III) Fe(ClO3)2 trioxidoclorato(1-) de hierro(2+) bis(trioxidoclorato) de hierro Rb2MnO4 Teraoxidomanganato de dirubidio Cu(HSO4 )2 Hidrogenosulfato de cobre(II) Hidroxidotrioxidosulfato(1-) de cobre(2+) Bis[hidrogeno(tetraoxidosulfato)] de cobre