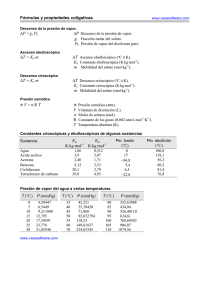
VARIABLES DE COMPOSICIÓN A representa la masa atómica. m (g) = número de g-at A(at-1) m (Kg) = número de Kg-at A(at-1) m (Tn) = número de Tn-at A (at-1) m (Lb) = número Lb-at A (at-1) M representa la masa molecular: m (g) = número de g-mol M(mol-1) m (Kg) = número de Kg-mol M (mol-1) m (Tn) = número de Tn-mol M (mol-1) m (Lb) = Lb-mol M (mol-1) COMPOSICIÓN DE MEZCLAS Considerando un sistema formado por n componentes. Designando por la letra i a un componente especifico de la mezcla y además consideramos: m = peso o masa (g, Kg, Tn,Lb) V= volumen (Lt, m3, pies3, gal) M = masa molecular de la una sustancia (mol-1) A = masa atómica de un elemento (at-1) a) Porcentaje en peso: % en peso de i = mi x100 ∑mi b) Porcentaje en volumen: % en volumen i = Vi x 100 ∑Vi c) Fracción Atómica: Fracción atómica de i = (mi/Ai) = N ∑(mi/Ai) d) Fracción de masa: Fracción de masa de i = mi = W i ∑mi e) Fracción Molar: Fracción Molar de i = (mi/Mi) = X ∑(mi/Mi) ∑Xi = 1 f) Porcentaje atómico: % atómico de i = Ni x 100 g) Porcentaje en peso o masa: % en peso de i = W i x 100 h) Porcentaje Molar: % Molar de i = Xi x 100 MASA MOLECULAR MEDIA M = ∑MiXi EJERCICIOS DE APLICACIÓN 1) En el condensador de una turbina de vapor se mantiene la presión absoluta de 3.92 Kpa. Qué marcarán los vacuómetros graduados en mm Hg, si en un caso indica el barómetro 735 mm Hg y en otro caso 764 mm Hg? PAbs = 3.92 Kpa(760 mm Hg/101,3Kpa) = 29.4 mm Hg PAtm = 735 mm Hg PAtm = 764 mm Hg Pvac = Patm – PAbs Pvac = (735 – 29.4) mm Hg = 705.6 mm Hg Pvac = (764 – 29.4) mm Hg = 734.6 mm Hg 2) Se bombea agua hacia un tanque cuyo diámetro es 10 pies a velocidad estable. El nivel del tanque se incrementa en 16 pulgadas por hora. a) ¿Cuántos galones por minuto son bombeados? b) Si se utiliza una tubería de 6 pulgadas de diámetro para llenar el tanque, ¿Cuál es la velocidad del agua en la tubería en pies/mi? 3) Se mezcla 12 galones de un liquido A cuya densidad relativa es 0.77 con 25 galones de otro liquido B cuya densidad relativa es 0.86. Calcular el porcentaje en peso de la mezcla y la densidad relativa de la mezcla si los volúmenes son aditivos. VA = 12 Galx(3.785 Lt/1 Gal)(1000 mL/ 1 Lt) = 45420 mL GA = 0.77 VB = 25 Gal(3.785 Lt/1 Gal)(1000 mL/1 Lt) = 94625 ml GB = 0.86 mB = 94625 mL x 0.86 g/mL = 81377.5 g mA = VADA = 45420 mL x 0.77 g/mL = 34973.4 g GA = DA DA = GADRef = 0.77 x 1 g/mL = 0.77 g/mL DRef mB= VBDB = =81377.5 g masa total = 34973.4 g + 81377.5 g = 116350.9 g % peso de A = (34973.4/116350.9) x 100 = 30.06 % % peso de B = (81377.5 g/116350.9 g) x 100 = 69.94 D = m/V VT = 45420 mL + 94625 mL = 140045 mL Dm = 116350.9 g/140045 mL = 0.83 g/mL Gm = 0.83 g/mL = 0.83 1 g/mL 4) Un gas combustible tiene la siguiente composición molar: O2 5% N2 80% CO 15% 12+16= 28 Calcular: a) La masa molecular media b) La composición en peso. TAREA Si 4500 barriles de un combustible pesado de 30°API se mezclan con 15000 barriles de aceite de 15°API ¿Cuál es la densidad en la escala API de la mezcla? Solución Ejercicio 4: B.C 100 g-mol de gas combustible a) M = ∑MiXi = 32x0.05 + 28x0.8 + 28x0.15 = 28.1 mol-1 b) O2 5 g-mol x 32 mol-1 = 160 g N2 80g-mol x 28 mol-1 = 2240 g CO 15 g-mol x 28 mol-1 = 420 g Total 2820 g Composición: 160 g = 0.05 x 100 = 5 % O2 2820 g 2240 g = 0.79 x 100 = 79% N2 2820 g 420 g = 0.14 x 100 = 14% CO 2820