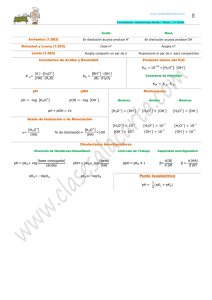
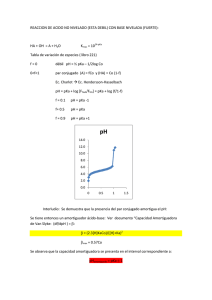
SEMANA 13 SOLUCIONES BUFFER BUFFER También llamado Solución Reguladora, Tampón o Amortiguadora. Es un sistema que tiende a mantener el pH casi constante cuando se agregan pequeñas cantidades de ácidos (H+) ó bases (OH-). Cambio de pH tras añadir acido/base al buffer Cambio de pH tras añadir ácido/base al agua Cambio de pH tras añadir ácido/base a una disolución amortiguadora Una solución amortiguadora reduce el impacto de los cambios drásticos de H+ y OH- . Está formada por un ÁCIDO DÉBIL y una SAL del mismo ÁCIDO o por una BASE DÉBIL y una SAL de la misma BASE. La solución amortiguadora contiene especies que van a reaccionar con los iones H+ y OHagregados. Componentes: Buffer ácido: Formado por un ácido débil y su sal. Ejemplo: CH3COOH/CH3COONa Buffer básico: Formado por una base débil y su sal. Ejemplo: NH3/NH4Cl Capacidad amortiguadora de un Buffer Ácido Al agregar un ACIDO FUERTE: Los iones H+ adicionados reaccionan con la SAL del ÁCIDO DÉBIL en solución y producen el ÁCIDO DÉBIL. Buffer Ácido HCOOH/HCOO- Na+ HCOO- + H+ ↔ HCOOH Al agregar una BASE FUERTE: los iones H+ presentes en solución neutralizan a los iones OH- produciendo H2O . Buffer Ácido: HCOOH/HCOO- Na+ HCOOH + OH- ↔ HCOO- + H2O Forma en que actúan EJERCICIO: Capacidad amortiguadora de un buffer básico. NH3/NH4Cl Capacidad amortiguadora de un buffer básico Al agregar un ACIDO FUERTE: Los iones H+ adicionados reaccionan con la Base en solución y producen Sal y agua. NH3/NH4Cl (NH4OH / NH4 Cl ) NH4OH + H+ ↔ NH4+ + H2O Al agregar una BASE FUERTE: Los iones OH- adicionados reaccionan con la sal para formar nuevamente la base débil. NH4+ + OH- ↔ NH4OH Función e Importancia Biológica: En los organismos vivos, las células deben mantener un pH casi constante para la acción enzimática y metabólica. Los fluidos intracelulares y extracelulares contienen pares conjugados ácido-base que actúan como buffer. Buffer Intracelular más importante: H2PO4- / HPO4-2 Buffer Sanguíneo más importante: H2CO3 / HCO3Como producto final del metabolismos de produce CO2 en las células; una parte de éste se lleva a los pulmones para eliminarlo y lo demás se disuelve en el plasma y saliva para formar ácido carbónico. CO2 + H2O ↔ H2CO3 Los riñones aportan HCO3- produciendose asi el buffer. CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3- Otros sistemas que ayudan a mantener el pH sanguíneo son: •Proteínas •Ácidos Nucleicos •Coenzimas •Metabolitos intermediarios Algunos poseen grupos funcionales que son ácidos o bases débiles, por consiguiente, ejercen influencia en el pH intracelular y éste afecta la estructura y el comportamiento de las moléculas. pH sanguíneo 7.35 -7.45 Los cambios de pH por debajo de 6.8 y por encima de 8 no permiten el funcionamiento adecuado de las células y a éstos niveles sobreviene la muerte. Valores Normales en Sangre Arterial Componentes Valor normal PCO2 H2CO3 HCO3 - 40 mmHg 2.4 mmoles/ L de plasma 2.4 mmoles / L de plasma pH 7.35 – 7.45 pH sanguíneo Acidosis pH debajo de 7.35 7.35 -7.45 Alcalosis pH arriba de 7.45 Tipos de Acidosis: Respiratoria y Metabólica Acidosis respiratoria: Al aumentar la concentración de CO2 se produce mas H2CO3; produciéndose mas H+ y por lo tanto el pH disminuye por lo que hay acidosis, puede darse por respiración dificultosa, enfisema o neumonía. Al aumentar CO2 el O2 disminuye. Resumiendo el proceso se daría así: La dificultad de respirar o un ambiente pobre en oxígeno, permite que se eleve la concentración de [CO2] favoreciendo la formación de ácido carbónico, el cual se disocia en H+ y HCO3- de acuerdo a la siguiente reacción: CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3- Tipos de Alcalosis: Respiratoria y Metabólica Alcalosis respiratoria: Al aumentar la concentración O2 disminuye la concentración de CO2 y el pH aumenta por lo que hay alcalosis, puede ser por hiperventilación o respiración rápida. La hiperventilación, genera: Alcalosis porque el incremento de la [O2] hace bajar la [CO2] produciéndose menos H2CO3 y por consiguiente el pH sube. Al bajar la presión parcial de CO2 el equilibrio lleva a la formación de CO2 Y H2O. CO2 + H2O ↔ H2CO3 Esto disminuye la [ H+ ] y por lo tanto eleva el pH. pKa y pKb De la misma forma que para el pH, hay expresiones similares para pKa y pKb, basadas en las constantes de ionización. pKa = - log Ka pKb = - log Kb Por lo tanto: cuanto mas grande es pka más débil es el ácido cuanto mas grande es pKb mas débil es la base Ejercicio: Encuentre el pKa del ácido acético, si posee un valor de Ka = 1.8 x 10-5. Para un par conjugado ácido base el producto de Ka y Kb es igual a Kw. (Ka) (Kb) = Kw Por lo tanto cuando se conoce una de ellas se puede obtener el valor de la otra. Para un par conjugado ácido base : pKa + pKb = 14 (a 25 grados centígrados) CÁLCULO DE PH EN UN BUFFER Ecuación de Henderson Hasselbach pH= pKa + Log [Sal] [Ácido] pOH= pKb + Log [Sal] pOH= pKb + Log [Sal] [Base] [Base] Otro procedimiento para calcular pH en soluciones Buffer: [H+] = Ka [ácido] [sal] pH = -log [H+] [OH-] = Kb [base] [sal] [H+] = 1 X 10-14 [OH] 1.Calcule el pH de una solución Buffer formada por 0.5 moles de CH3COOH (ácido acético) y 0.8 moles de CH3COONa (acetato de sodio) disueltos en 1000 ml de solución. Ka = 1.8 x 10-5 [H+]= Ka [ácido] [sal] [H+]= 1.8 x 10-5 [0.5M] = 1.125 x 10 [0.8M] pH = -log 1.125 X 10-5 = 4.94 -5 Resolución con la ecuación de HendersonHasselbach pH = pKa + log [sal] [ácido] pKa=-log Ka pKa = -log ( 1.8 x 10-5) = pKa =4.74 pH= 4.74 + log (0.8M) (0.5M) pH= 4.74+0.20= 4.94 2.Cuál será el pH del buffer anterior si se le AGREGAN NaOH 0.06 M ?. CH3COOH + OH- ↔ CH3COO- + H2O 0.5 M 0.06M 0.8M 0.5M-0.06M =0.44M de CH3COOH 0.8M+0.06M=0.86M de CH3COO- NUEVO pH pH = pKa + log [sal] [ácido] pKa=-log Ka pKa = -log ( 1.8 x 10-5) = pKa =4.74 pH= 4.74 + log (0.86M) (0.44M) pH= 4.74 + 0.29= 5.03 3.¿Cuál será el pH del buffer inicial si añadimos HCl 0.04 M ? CH3COONa + H+ ↔ CH3COOH + Na+ 0.8 M 0.04M 0.5M 0.8M-0.04M =0.76M de CH3COO0.5M+0.04M=0.54M de CH3COOH NUEVO pH pH = pKa + log [sal] [ácido] pKa=-log Ka pKa = -log ( 1.8 x 10-5) = pKa =4.74 pH= 4.74 + log (0.76M) (0.54M) pH= 4.74 + 0.14= 4.88 4. ¿Cuál será el pH de un buffer preparado asi: 0.2 moles de CH3NH2 0.3 moles de CH3NH2Cl en 1 Lt de solución? Kb= 4.4 x 10-4 [OH-]= Kb [base] [sal] [OH-]= 4.4 x 10-4 [0.2M] = 2.93 x 10 -4 [0.3M] pOH = -log 2.93 X 10-4 = 3.53 pH+ pOH= 14 pH= 14 - 3.53= 10.47 Resolución: (con la ecuación de HendersonHasselbach): pOH = pKb + log [sal] [base] pKb=-log Kb pKb = -log ( 4.4 x 10-4) = pKb =3.36 pOH= 3.36 + log (0.3M) (0.2M) pOH= 3.36 + 0.176= 3.53 pH = 14 – 3.53 = 10.47