Tema 7
Anuncio

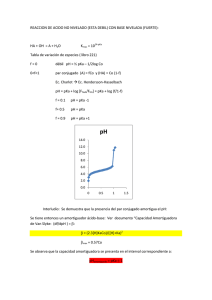
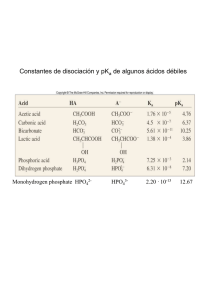
Tema 7 Equilibrio químico 1. Ley de acción de masas. Es una relación que establece que los valores de la expresión de la Ke (constante de equilibrio) son constantes para una reacción en particular a una temperatura dada, siempre que se haya sustituido las concentraciones en equilibrio. 2. Constante de velocidad. (Ejemplos de Equilibrio Químico) a) COCl2 dicloruro de carbonilo 2a) CO (g) + Cl2 (g) = COCl2 (g) COCl2 Ke = CO 2b) yoduro de hidrógeno H2 (g) + I2 (g) = 2 HI (g) Cl2 Constante de equilibrio C (s) + CO2 (g) ⇔ 2CO (g) 2 HgO (s) ⇔ 2Hg (l) + O2 (g) 2 ZnS (s) + 3 O2 (g) = 2 ZnO (s) + 2 SO2 (g) PCl3 (g) + Cl2 (g) = PCl5 (g) 3d) 2 CO2 (g) = 2 CO (g) + O2 (g) Disociación del agua y constante del equilibrio del agua (Kw). Ecuaciones de disolución del H2O y la expresión para el producto iónico del agua, Kw H2O (l) ↔ H+ (ac) + OH- (ac) Ke [H2O] = Kw = [H+][OH-] Kw = [H+][OH-] = 1.0 x 10-14 Kw = (1.0 x 10-7) (1.0 x 10-7) = 1.0 x 10-14 Expresión para el producto iónico del agua, Kw cuando el agua se ioniza pH El pH es una medida de la concentración de los iones hidrógeno en una solución. Los ácidos fuertes tal como el ácido clorhídrico al tipo de concentraciones que normalmente se usa tiene un pH de alrededor 0 a 1. El pH mide la concentración de iones hidrógeno desde la más baja hasta la más alta en una solución. significado de pH signo negativo pH = - log10 H+ logaritmo en base 10 concentración en moles / litro Tabla para una disolución Rangos de valores para Carácter de la solución pH pOH [H+] > [OH-] Ácida <7 >7 [H+] < [OH-] Básica >7 <7 [H+] = [OH-] Neutra =7 =7 Indicadores ácido - base Papel indicador Potenciómetro Constantes de acidez (Ka) y Basicidad (Kb) Ácido K1 K2 HClO4 muy grande HBr muy grande H2SO4 muy grande HNO3 muy grande H3O+ 55,4 HIO3 1,9x10-1 H2C2O4 5,36x10-2 5,42x10-5 H2SO3 1,7x10-2 5,0x10-6 H3PO4 7,11x10-3 6,34x10-8 H3PO3 7x10-3 2x10-7 Fe(H2O)63+ 6,3x10-3 HF 7,24x10-4 HCOOH 2,1x10-4 H2Se 1,7x10-4 Cr(H2O)63+ 1x10-4 HCH3COO 1,76x10-5 Al(H2O)63+ 1,3x10-5 H2CO3 4,45x10-7 4,69x10-10 H2S 8,9x10-8 1,2x10-15 HClO 4x10-8 H2O 1,82x10-16 K3 1,04x10-2 4,79x10-13 Concepto de pKa y pKb La descripción del grado de acidez en términos de pH tiene la enorme ventaja de evitar operaciones con potencias decimales de exponentes negativos. Dado que las constantes de equilibrio vienen dadas, por lo general, como potencias de diez, es posible extender la idea recogida en la definición de pH al caso de los valores de K. Así, se define el pK, para una reacción en equilibrio, en la forma: pK = -log K Bases Ácidos 1 2 ácido monoprótico ácido ácético Ka = 1.74 X 10-5 M 3 4 5 6 7 CH3COO- + H+ CH3COOH pKa = 4.76 8 9 10 11 12 13 14 pH amomiaco Ka = 5.62 X 10-10 M NH4+ NH3 + H+ pKa = 9.25 ácido diprótico ácido triprótico H3PO4 ácido fósforico Ka1 = 7.25 X 10-3 M Ka2 = 1.38 X 10-7 M Ka 3 = 3.98 X10-13 M 1 HCO3- CO3-2 + H+ pKa = 10.2 pKa = 3.77 ácido carbónico Ka = 1.7 X 10-4 M pH HCO3- + H+ H2CO3 2 bicarbonato Ka = 6.31 X 10-11 M H2PO4- + H+ pka1 = 2.14 HPO4HPO4- + H+ H2PO4- PO4-3 + H+ pKa3 = 12.4 pKa2 = 6,86 3 4 5 6 7 8 9 10 11 12 13 14 Conversión de Ka a pKa y de pKa a Ka Conversión de Ka a pKa pKa = - log Ka si la Ka = 1.77 X 10-5 pKa = - ( -log 1.77 X 10-5) pKa = - ( - 4.75) = 4.75 Conversión de pKa a Ka pKa = 4.75 log Ka = - pKa pKa = - log Ka log Ka = - (4.75) log Ka = (- 5.0 + 0.25) Ka = antilog (.5.0) + antilog (0.25) Ka = 10-5 X 1.77 = 1.77 X 10-5 ejemplo si el pKa = 10 por lo que Ka = 1 X 1010 entonces Ka = antilog (10) Ecuación de Henderson – Hasselbalch La ecuación de Henderson fue modificada por Karl Albert Hasselbalch (1874 a 1962), dando lugar a lo que se llama ecuación de Henderson-Hasselbalch Esta ecuación relaciona el pH de la disolución y el pKa de un ácido débil (AH) Cuando la concentración de la sal es igual a la concentración del ácido, el pH = pK; ya que el log de 1 es igual a cero