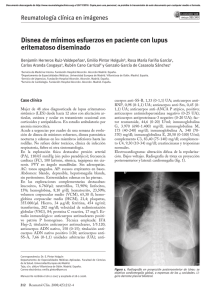
ACTUALIZACIÓN Lupus eritematoso sistémico (I). Etiopatogenia. Manifestaciones clínicas. Historia natural. Pruebas diagnósticas. Diagnóstico diferencial M. Galindo*, R.A. Molina y J.L. Pablos Álvarez Servicio de Reumatología. Hospital 12 de Octubre. Madrid. España. Palabras Clave: Resumen - Autoinmunidad Concepto y epidemiología. El lupus eritematoso sistémico (LES) es una enfermedad autoinmune, multisistémica, de etiología desconocida, que afecta preferentemente a mujeres entre la segunda y la quinta década de la vida. - Lupus cutáneo - Nefritis - Autoanticuerpos - Complemento Etiopatogenia. En su etiología intervienen tanto factores genéticos como hormonales y ambientales entre los que cabe destacar algunas infecciones, particularmente víricas, y la exposición a la luz ultravioleta o determinados fármacos. Manifestaciones clínicas. El espectro de afectación clínica es muy amplio, siendo las manifestaciones cutaneomucosas, hematológicas, articulares y la nefritis lúpica las más frecuentes. Comorbilidades. El riesgo de presentar comorbilidades como infecciones, arteriosclerosis, osteoporosis y ciertas neoplasias está aumentado como consecuencia de la propia enfermedad y de los tratamientos utilizados para su control. Diagnóstico. El diagnóstico de LES se hace reuniendo datos clínicos y pruebas de laboratorio, después de descartar los posibles diagnósticos diferenciales de la enfermedad. Keywords: Abstract - Autoimmunity Systemic lupus erythematosus (I). Etiopathogenesis. Clinical manifestations. Natural history. Diagnostic tests. Differential diagnosis - Cutaneous lupus - Nephritis - Autoantibodies - Complement Concept and epidemiology. Systemic lupus erythematosus (SLE) is a multisystem autoimmune disorder of unknown unknown aetiology affecting predominantly women between their second and fifth decades of life. Etiopathogenesis. Its aetiology involves genetic as well as hormonal and environmental factors, notable amongst those are some infections, particularly viral ones, and the exposure to ultraviolet light or certain drugs. Clinical manifestations. The clinical spectrum is very broad, with skin and mucous, hematological and joint manifestations as well as lupus nephritis being the most common. Comorbidities. The risk of developing comorbidities like infections, arteriosclerosis, osteoporosis and certain neoplasms is increased as a consequence of the disease itself and of the treatments used for controlling it. Diagnosis. Diagnosis of SLE is conducted by gathering clinical data and lab tests, after ruling out possible differential diagnoses of the disease. *Correspondencia Correo electrónico: [email protected] Medicine. 2017;12(25):1429-39 1429 ENFERMEDADES DEL SISTEMA INMUNE Y REUMATOLÓGICAS (II) Concepto y epidemiología El lupus eritematoso sistémico (LES) es una enfermedad multisistémica crónica autoinmune, de causa desconocida que se caracteriza por una amplia variedad de manifestaciones clínicas y producción de autoanticuerpos. Puede aparecer a cualquier edad, pero en la mayoría de los pacientes comienza entre los 15 y 55 años, con predominio en las mujeres, con una proporción de 9:1 respecto a los hombres. En general, los hombres con LES tienen menos fotosensibilidad, pero más serositis, una edad de inicio más tardío y una tasa más alta de mortalidad1-3. Los niños menores de 15 años padecen formas más graves de la enfermedad, principalmente nefropatía, afectación neurológica y trombopenia4 . Por el contrario, los pacientes mayores de 50-55 años desarrollan menos afectación cutánea malar, fotosensibilidad, alopecia, fenómeno de Raynaud, afectación renal o neurológica pero tienen mayor prevalencia de serositis, afectación pulmonar, síndrome de Sjögren secundario y artritis5. La incidencia y la prevalencia están influenciadas por la edad, etnia y sexo de la población estudiada. Se estima una incidencia en Norteamérica, Sudamérica y Europa de 1 a 23 por cada 100.000 habitantes año6. La prevalencia real varía sustancialmente según las comunidades étnicas que se consideren. Así, en Europa se estima de 20 a 50 por cada 100.000 habitantes año. El estudio EPISER evidenció una prevalencia en España de 9 casos por 100.000 habitantes7. El aumento de frecuencia en los últimos años se debe a una mayor supervivencia de los pacientes afectados, al mejor conocimiento de la enfermedad y a las técnicas de laboratorio que permiten diagnosticar casos más leves y de forma precoz. El LES es más frecuente en afroamericanos, hispanos y asiáticos, siendo además más grave en estos grupos étnicos, debido probablemente a factores genéticos, económicos y culturales6. Etiopatogenia La etiología del LES es hoy en día desconocida. Además de la producción variable de autoanticuerpos, se suman factores genéticos y ambientales que pueden estar implicados en su patogenia. Es probable que diferentes agentes patogénicos y etiológicos estén implicados, de ahí la heterogeneidad clínica y de laboratorio que presentan los pacientes con LES. Los diferentes agentes patogénicos potencialmente implicados son los que se repasan a continuación. Factores genéticos y epigenéticos La concordancia del LES en gemelos homocigotos es 10 veces superior a lo esperado8. Además, existe una mayor prevalencia de la enfermedad en familiares de pacientes que en la población sana, y una mayor incidencia de alelos comunes que en un grupo control. Estudios realizados en los últimos años sobre secuencias amplias del genoma (GWAS –genome wide association studies–) han confirmado la importancia de determinados genes implicados en el procesamiento de la respuesta inmune, relacionados tanto con una mayor suscep1430 Medicine. 2017;12(25):1429-39 tibilidad para desarrollar la enfermedad como con su gravedad9,10. Se ha descrito una asociación de la enfermedad con genes HLA de clase II como el DRB1 0301 (DR3) DRB1 1503, DRB1 1501 (DR2) en caucásicos, DRB1 1501 en orientales o DRB1 08 en hispanos. Los factores ambientales podrían ser el desencadenante de la enfermedad en individuos susceptibles genéticamente. El riesgo de desarrollar la enfermedad también puede estar influenciado por factores epigenéticos como la metilación del ADN y cambios postraslacionales de las histonas, inducidos bien genéticamente o bien por exposición a agentes ambientales10. Factores ambientales La participación de agentes externos como agentes inductores puede ser importante, en particular en individuos susceptibles genéticamente. Así, la luz ultravioleta puede alterar la estructura del DNA y aumentar su antigenicidad, e inducir apoptosis de los queratinocitos liberando gran cantidad de antígenos. Los virus, sobre todo los retrovirus, pueden contribuir al proceso autoinmune. Aproximadamente, un tercio de los pacientes con LES tiene anticuerpos reactivos frente a proteínas retrovirales. Por último, se ha descrito la inducción de LES por determinados fármacos que inhiben la metilación del DNA, induciendo la formación de anticuerpos como hidralacina, procainamida, isoniacida, metildopa, clorpromacina, minociclina11,12. En general, los cuadros clínicos que provocan son más leves y rara vez producen lesión orgánica severa como afectación renal o neurológica. Factores hormonales La influencia hormonal se apoya en la mayor prevalencia de la enfermedad en mujeres y en individuos con síndrome de Klinefelter, en la menor frecuencia de aparición de la enfermedad antes de la menarquia o después de la menopausia y en las agudizaciones durante el puerperio o asociadas al uso de anticonceptivos orales1,3,13. En modelos animales, la enfermedad varía en presencia de estímulos estrogénicos y la administración de estrógenos exógenos en modelos murinos desencadena nefritis. En la patogenia de la enfermedad participan multitud de células y moléculas implicadas en procesos como la apoptosis y la respuesta inmune innata y adaptativa. La respuesta inmune frente a antígenos nucleares es característica de la enfermedad. Los autoantígenos liberados por las células apoptóticas son presentados por las células dendríticas a los linfocitos T activándolos. Estos linfocitos T activados estimulan la producción de anticuerpos por parte de los linfocitos B mediante la secreción de determinadas citoquinas y moléculas de coestimulación. Existen además otros mecanismos de activación de los linfocitos B, independientes de los linfocitos T, que actúan a través de la señalización combinada de receptores de antígenos de linfocitos B (BCR) y toll like receptors (TLR). Los neutrófilos a su vez están implicados a través de los NET (neutrophil extracellular traps) que son unas LUPUS ERITEMATOSO SISTÉMICO (I). ETIOPATOGENIA. MANIFESTACIONES CLÍNICAS. HISTORIA NATURAL. PRUEBAS DIAGNÓSTICAS. DIAGNÓSTICO DIFERENCIAL redes extracelulares de fibras compuestas sobre todo por ADN liberado por estas células y con capacidad para anclar antígenos14,15. De esta forma, se ha descrito su implicación perpetuando la inflamación autoinmune, exacerbando la actividad de la enfermedad y el desarrollo de aterosclerosis. la que falta el dominio trasmembrana15,19. Su inyección en ratones sanos bloqueó la apoptosis provocando signos de enfermedad autoinmune. Autoanticuerpos Síntomas constitucionales La producción de autoanticuerpos es un rasgo característico de los pacientes con LES. Estos anticuerpos pueden ser bien una pieza clave en la patogenia, una consecuencia del daño tisular o la huella de un agente etiológico desconocido14. Su producción puede ser por activación policlonal de las células B o por estimulación inmune dirigida por autoantígenos. Los autoanticuerpos pueden provocar lesión tisular por depósito de inmunocomplejos y una reacción inflamatoria secundaria o por interferir directamente con la función celular (por ejemplo, las citopenias). Estos dos sistemas no son excluyentes y pueden complementarse. Un ejemplo de ello son los anticuerpos anti-DNA bicatenario que pueden depositarse en el riñón como inmunocomplejos, y pueden penetrar en las células renales produciendo lesión glomerular16. Sin embargo, no todos los anticuerpos son patogénicos. Los que tienen capacidad para producir lesión tisular son del tipo IgG y con alta afinidad por el DNA bicatenario, siendo este proceso además dependiente de la interacción entre las células B y células T helper CD4+. Células B y T y células dendríticas La activación de las células B no es propiamente policlonal sino que es selectiva y dirigida contra un número de antígenos determinados. Las células T son importantes activando las células B y la posterior producción de autoanticuerpos. En los pacientes con LES se ha descrito la presencia de células T específicas para un autoantígeno, con capacidad para inducir la producción de autoanticuerpos. Las células dendríticas plasmocitoides son células mononucleares circulantes que se caracterizan por la alta producción de interferón alfa, que tienen un efecto activador sobre la respuesta inmunitaria que incluye el aumento en la expresión de HLA de clase I, quimioquinas, activación y aumento de la supervivencia de los linfocitos T, inhibición del desarrollo de las células T reguladoras o la inducción del cambio de isotipo y formación de células plasmáticas en células B y favorece el desarrollo de aterosclerosis. Estas células se activan por los TLR-7 y 9, estimulados por el material nucleico (ARN y ADN) exógeno o endógeno procedente de células apoptóticas17,18. Manifestaciones clínicas Los síntomas constitucionales como la astenia, la pérdida de peso y la anorexia son frecuentes en el cuadro clínico inicial del LES, apareciendo en el 60-80% de los pacientes. La presencia de estos síntomas sugiere actividad de la enfermedad, aunque no están incluidos en ninguno de los índices de actividad. La fiebre puede presentarse tanto al inicio como en el transcurso de la enfermedad. Puede indicar actividad, aunque debe descartarse la sospecha de infección, puesto que tanto la enfermedad como los tratamientos empleados aumentan el riesgo de esta última. La presencia de escalofríos y leucocitosis y la ausencia de otros síntomas que sugieran actividad lúpica apoyarán la sospecha de infección. Manifestaciones cutaneomucosas Las lesiones cutáneas aparecen en un 80% de los pacientes con LES. Forman parte de los criterios de clasificación de la enfermedad. Concretamente, fotosensibilidad, aftas bucales, exantema malar y lesiones discoides son cuatro de los criterios clasificatorios. Las lesiones cutáneas pueden ser específicas e inespecíficas20,21. Las lesiones específicas se dividen en 3 grupos que enumeramos a continuación. Lupus eritematoso cutáneo agudo En esta forma, el edema y el eritema se localizan en el área malar, respetando surcos nasolabiales (exantema en “vespertilio” o en “alas de mariposa”), suele ser agudo, doloroso o pruriginoso, precipitado por la exposición solar, se distribuye por las regiones fotoexpuestas y no deja cicatriz (fig. 1). Ge- Apoptosis La expresión anormal de genes que regulan la apoptosis se ha asociado al desarrollo de enfermedades parecidas al LES en modelos animales, por ejemplo, mayor expresión de bcl-2 o defectos en el gen Fas. Además, en pacientes con LES, se ha descrito una forma soluble de la proteína Fas alterada en Fig. 1. Lupus eritematoso cutáneo agudo. Imagen característica de erupción en alas de mariposa que afecta al puente nasal. Galería de imágenes de la SER. Cortesía del Dr. Miguel A. Belmonte. Medicine. 2017;12(25):1429-39 1431 ENFERMEDADES DEL SISTEMA INMUNE Y REUMATOLÓGICAS (II) Fig. 2. Lupus eritematoso subagudo. Lesiones de lupus cutáneo subagudo circinadas en forma de eritema anular en un paciente con anti-Ro positivos y fotosensibilidad. Galería de imágenes de la SER. Cortesía del Dr. Miguel A. Belmonte. neralmente indica actividad de la enfermedad. Se debe diferenciar de otro eritema como la dermatitis de contacto, la rosácea o la atrofia por corticoides. Lupus eritematoso subagudo Aparece en aproximadamente el 10% de los pacientes con LES. Puede ocurrir tanto en zonas fotoexpuestas como en las fotoprotegidas. Puede presentarse como forma anular con lesiones redondeadas, de borde activo y centro claro, con tendencia al crecimiento periférico y curación central y como forma psoriasiforme o papuloescamosa, de crecimiento uniforme sin aclaramiento central y que, cuando remiten, pueden dejar un área hipopigmentada (fig. 2). Estos pacientes presentan con frecuencia lesiones en mucosas como placas blanquecinas o ulceraciones, alopecia difusa transitoria, telangiectasias periungueales, fenómeno de Raynaud y livedo reticularis. La mitad de los pacientes con esta afectación cutánea cumplen criterios de clasificación de LES, aunque la afectación del riñón y del sistema nervioso central (SNC) son más raras. Lupus eritematoso crónico Se subdivide en las lesiones discoides, el LES hipertrófico y la paniculitis lúpica. El lupus discoide es la forma más frecuente (25% de los pacientes con LES) y consiste en pápulas o placas eritematosas y descamativas o hiperqueratósicas, de tamaño variable, bien delimitadas, con tendencia a la cronicidad y crecimiento periférico, que dejan cicatrices atróficas, con pérdida de los anejos y alteraciones de la pigmentación (fig. 3). De todos los tipos de afectación lúpica cutánea, el LES crónico es el que menos se relaciona con la afectación orgánica o serológica. Entre las manifestaciones inespecíficas destaca la fotosensibilidad, generalmente asociada a la presencia de anticuerpos anti-Ro. Las aftas bucales, los nódulos subcutáneos y la alopecia no cicatricial son otras manifestaciones frecuentes. Otras posibles lesiones son la vasculitis leucocitoclástica, el liquen plano, la livedo reticularis, la hemorragia en “astilla” y los infartos periungueales. 1432 Medicine. 2017;12(25):1429-39 Fig. 3. Lupus eritematoso crónico. Áreas de alopecia y lesiones de lupus discoide en cara y zona retroauricular. Galería de imágenes de la SER. Cortesía de Juan R. Corts y Juan A. Castellanos. Manifestaciones osteomusculares El 90% de los pacientes con LES presenta afectación del aparato locomotor a lo largo del transcurso de la enfermedad. Las artralgias suelen ser bien definidas, migratorias o simétricas, intermitentes o diarias. Puede ser la única manifestación articular y cursar con rigidez matutina. En general, el patrón de afectación articular consiste en artralgias más o menos persistentes con artritis intermitente superpuesta. La artritis suele ser migratoria y episódica, aunque en ocasiones llega a comportarse como una artritis reumatoide. Suele afectar a grandes y pequeñas articulaciones22. Muy rara vez ocasiona erosiones radiológicas. El líquido sinovial suele ser claro, viscoso, con menos de 5.000 células y de predominio linfocítico. La artropatía de Jaccoud consiste en una afectación articular muy deformante, con desviación cubital de las metacarpofalángicas e hiperextensión de las interfalángicas proximales (dedos en “cuello de cisne” y pulgar “en z”), pero con poco dolor y escasa repercusión funcional (figs. 4 y 5). Característicamente, estas deformidades son reductibles. A lo largo de la enfermedad pueden producirse roturas tendinosas y afectan, por orden de frecuencia, a los tendones rotuliano, aquíleo y extensores de la mano23. La laxitud ligamentosa es frecuente en los pacientes con LES. Los nódulos subcutáneos pueden aparecer en la evolución y son indistinguibles macro y microscópicamente de los reumatoides. Algunos pacientes refieren síntomas de fibromialgia, se desconoce cuáles son los mecanismos subyacentes y no guarda relación con la enfermedad. La necrosis ósea aséptica es relativamente frecuente en el LES y, en particular, se localiza en cabeza femoral (bilateral en el 90% de los casos) o humeral, y cóndilos femorales, aunque puede presentarse en cualquier hueso. Puede ser única o múltiple, y los glucocorticoides (GC) desempeñan un papel indudable en su patogenia. Además de los GC, también se ha descrito la implicación de los anticuerpos antifosfolípido (aPL), aunque con resultados controvertidos. La sospecha clínica es fundamental para un diagnóstico precoz, y tanto la gammagrafía ósea como la resonancia magnética (RM) son muy útiles para confirmarlo. Las mialgias son frecuentes en el curso del LES. Además, LUPUS ERITEMATOSO SISTÉMICO (I). ETIOPATOGENIA. MANIFESTACIONES CLÍNICAS. HISTORIA NATURAL. PRUEBAS DIAGNÓSTICAS. DIAGNÓSTICO DIFERENCIAL TABLA 1 Clasificación de la nefritis lúpica de la International Society of Nephrology/Renal Pathology Society (ISN/RPS 2003) Clase I Mesangial mínima Clase II Mesangial proliferativa Clase III Focal (< de 50% de glomérulos) IIIA: lesiones activas IIIA/C: lesiones activas y crónicas IIIC: lesiones crónicas Clase IV Difusa (> 50% de los glomérulos) IVA: lesiones activas IVA/C: lesiones activas y crónicas Fig. 4. Artropatía de Jaccoud. Mano con artropatía de Jaccoud. Deformidades en “cuello de cisne”. Galería de imágenes de la SER. Cortesía del Dr. Miguel A. Belmonte. Fig. 5. Artropatía de Jaccoud. Radiografía de mano. Desviación cubital de dedos, deformidad en cuello de cisne, en ausencia de lesiones destructivas. Galería de imágenes de la SER. Servicio de Reumatología. Autor anónimo. puede presentarse una miopatía inflamatoria con debilidad proximal, elevación de creatinquinasa, electromiograma típico y biopsia muscular con infiltrado inflamatorio endomisial. Por último, debe destacarse que tanto los GC como los antipalúdicos pueden producir una miopatía. La osteoporosis y sus consecuencias suponen un problema adicional en los pacientes con LES. La patogenia es variable y la etiología multifactorial: tratamiento crónico con GC, falta de radiación solar, insuficiencia renal, menopausia precoz inducida por ciclofosfamida y otros factores relacionados con la propia enfermedad. Clase V Membranosa Clase VI Esclerosante avanzada (> 90% de glomérulos esclerosados globalmente, sin actividad residual) la proteinuria, la microhematuria, los cilindros renales, la insuficiencia renal y la hipertensión arterial (HTA). Al inicio de la enfermedad lúpica, el riñón puede afectarse de forma muy leve y pasar inadvertido. El desarrollo de nefritis lúpica habitualmente se acompaña de positivización de los anticuerpos anti-DNA y de descenso en los niveles de las fracciones del complemento. La nefritis lúpica suele desarrollarse en los primeros 5 años de enfermedad y, en general, se asocia a otros datos de actividad lúpica. La biopsia renal es necesaria, aparte de para definir exactamente el tipo de lesión, para plantear la estrategia terapéutica más adecuada. La nefritis lúpica se debería clasificar según clases histológicas definidas en el año 2003 por la International Society of Nephrology y la Renal Pathology Society, a lo que deben sumarse los índices de actividad y cronicidad25 (tabla 1). El estudio histológico requiere técnicas de microscopio óptico e inmunofluorescencia, y se recomienda la microscopía electrónica (fig. 6). En un 10-45% de los casos se observa una transformación de un tipo histológico a otro y, en general, es de una forma leve a otra más grave. Se recomienda realizar una biopsia renal cuando la microhematuria y la proteinuria son significativas, si la función renal empeora, ante la sospecha de una microangiopatía trombótica renal y, por último, ante una sospecha de transformación histológica. Manifestaciones renales Según las series, entre un 30 y un 50% de los pacientes con LES desarrollan afectación renal, y supone una de las primeras manifestaciones en el 10% de los casos. Constituye una de las causas principales de morbimortalidad en los pacientes con LES24. Las manifestaciones clínicas más frecuentes son Fig. 6. Glomerulonefritis membranosa. Glomerulonefritis membranosa. Fibrosis intersticial. Engrosamiento capsular y perivascular. Galería de imágenes de la SER. Cortesía del Dr. R. Moleres. Medicine. 2017;12(25):1429-39 1433 ENFERMEDADES DEL SISTEMA INMUNE Y REUMATOLÓGICAS (II) La glomerulonefritis (GN) de cambios mínimos (2-25%) cursa con proteinuria leve y no suele acompañarse de alteraciones en el sedimento, la mesangial (10-20%) con proteinuria y discreta microhematuria. Se caracteriza por la presencia de hipercelularidad mesangial (3 o más células mesangiales en una sección de 3 μm) en asociación con depósitos inmunes en el mesangio. La GN focal y segmentaria cursa con microhematuria y proteinuria y, en un 20% de los casos, evoluciona a la forma difusa. El grado de afectación se subdivide en: IIIA, con lesiones activas; IIIA/C, con lesiones activas y crónicas y III C, con lesiones crónicas. Las diferencias histológicas entre estas dos formas son cuantitativas y se ha establecido el límite del 50%. La GN proliferativa es una de las más frecuentes y con peor pronóstico. Cursa con proteinuria moderada o intensa (100%), síndrome nefrótico (60-90%), microhematuria (70%), HTA (40%) e insuficiencia renal crónica (50%). Se caracteriza por un engrosamiento de la pared capilar por la presencia de depósitos subendoteliales, necrosis focal con cuerpos hematoxilínicos, semilunas y trombos hialinos en los capilares del glomérulo. Se subdivide en: IV-S o difusa y IV-G o global. El grado de afectación se define igualmente por la presencia de lesiones activas, crónicas o ambas. La GN membranosa se manifiesta con proteinuria de amplio rango, puede coexistir con lesiones proliferativas y habitualmente tiene buen pronóstico. La nefritis lúpica puede ser silente y la mayoría de las veces corresponde a GN mesangiales. La glomeruloesclerosis o GN esclerosante con más del 90% de los glomérulos esclerosados globalmente es la fase terminal del riñón lúpico. Además de la lesión glomerular, se pueden afectar otras estructuras como vasos, túbulos e intersticio renal. El pronóstico a corto plazo va a ser peor en el caso de que haya creatinina elevada desde el inicio, edad avanzada, proteinuria elevada, hipoalbuminemia y HTA. A largo plazo, se mantiene como factor de mal pronóstico la presencia de creatinina elevada, de criterios histológicos de actividad grave y cambios de cronicidad, así como la demora en iniciar el tratamiento. En el caso de requerir un trasplante renal, el pronóstico es igual al de los pacientes sin LES. Otras formas de afectación renal son la amiloidosis secundaria, excepcional en el LES, y la trombosis de la vena renal. Coombs positivo. No obstante, no todos los pacientes con test de Coombs positivo desarrollarán anemia hemolítica. La anemia hemolítica puede presentarse con fiebre, astenia y dolor abdominal, asociado a una elevación en los niveles de bilirrubina no conjugada, aumento de reticulocitos y una haptoglobina disminuida o indetectable. Otras formas de anemia descritas en el LES son la anemia pura para la serie roja, la aplasia inducida por fármacos, la anemia por insuficiencia renal, la anemia microangiopática y, por último, también la anemia ferropénica por el uso de determinados fármacos o por patologías subyacentes28. La trombopenia puede estar mediada por la presencia de anticuerpos antiplaquetarios. La presencia de estos anticuerpos no siempre conlleva trombopenia. En el 25-50% de los pacientes se trata de una trombopenia moderada (100.000-150.000/mm3) y en el 10% es una trombopenia grave menor de 50.000/mm3. Puede producirse por destrucción periférica, hipoproliferación o secuestro esplénico. Cuando se presenta puede hacerlo asociada a otras manifestaciones de la enfermedad o de forma aislada. Puede presentarse de forma aguda y grave y suele responder a corticoides. Otra forma de presentarse es crónica con pobre respuesta a GC. La asociación de anemia hemolítica y trombopenia recibe el nombre de síndrome de Evans. El alargamiento del tiempo de tromboplastina parcial activada suele ser secundario a la presencia de aPL, lo que debe confirmarse mediante la detección de anticuerpos anticardiolipina, anticoagulante lúpico y serología reagínica. Hasta un 40% de los pacientes pueden presentar adenopatías, en general coincidiendo con el comienzo de la enfermedad o con los brotes de actividad. Habitualmente son adenopatías blandas, no dolorosas y de pequeño tamaño, localizadas en la región cervical, axilar e inguinal. La presencia de adenopatías obliga a descartar procesos infecciosos o linfoproliferativos intercurrentes, sobre todo cuando no se acompañan de otros datos de actividad lúpica. También se puede encontrar esplenomegalia coincidiendo con episodios de actividad, no necesariamente acompañada de citopenias. A su vez, los pacientes con LES tienen cierto grado de asplenia funcional que predispone a complicaciones infecciosas graves. Manifestaciones pulmonares Manifestaciones hematológicas Son frecuentes, correlacionan actividad de la enfermedad y afectan las 3 series, así como el sistema de coagulación y fibrinolítico. La leucopenia está presente en el LES, se relaciona generalmente con actividad de la enfermedad y suele ir asociada a linfopenia26. No obstante, se debe tener en cuenta que parte de los fármacos habituales en el tratamiento del LES pueden ocasionar citopenias. La leucocitosis puede aparecer asociada al tratamiento con GC o a la presencia de infección. La anemia es muy frecuente en el transcurso de la enfermedad. La anemia asociada a trastornos crónicos es la forma más característica, es normocítica y normocrómica y con niveles aumentados de ferritina27. La anemia hemolítica se presenta en el 10% de los pacientes con LES. Está mediada por anticuerpos calientes tipo IgG que dan un test de 1434 Medicine. 2017;12(25):1429-39 La manifestación más frecuente del LES es la pleuritis29,30. Se presenta en el 45-60% de los pacientes y puede ocurrir con o sin derrame pleural, la toracocentesis y el análisis del líquido pleural permite realizar el diagnóstico diferencial, entre otras patologías. El “pulmón encogido” es una manifestación rara que puede ser asintomática, aunque lo más frecuente es que el paciente refiera disnea, dolor pleurítico, pérdida de volumen pulmonar que produce un patrón restrictivo en ausencia de lesión parenquimatosa por una afectación de la musculatura diafragmática. En la radiografía de tórax se observan unos campos pulmonares disminuidos con atelectasias laminares y elevación de ambos diafragmas. El diagnóstico se confirma mediante pruebas de función respiratoria con el cálculo de las presiones inspiratorias máximas y mínimas. Su evolución es variable (fig. 7). La neumonitis lúpica suele aparecer al inicio de la enfermedad y su patogenia también es LUPUS ERITEMATOSO SISTÉMICO (I). ETIOPATOGENIA. MANIFESTACIONES CLÍNICAS. HISTORIA NATURAL. PRUEBAS DIAGNÓSTICAS. DIAGNÓSTICO DIFERENCIAL Fig. 7. Pulmón encogido. Pulmón encogido (shrinking lung) antes y después del tratamiento con betamiméticos. Galería de imágenes de la SER. Cortesía del Dr. Manuel Ramos. El diagnóstico se confirma mediante ecocardiografía y suele responder bien al tratamiento con GC. La miocarditis es una manifestación rara y aparece en individuos con actividad de la enfermedad en forma de trastornos de la conducción, cardiomegalia e insuficiencia cardíaca. La forma clásica de Libman Sacks de la endocarditis produce verrugas fibroinflamatorias. Las válvulas más afectadas son la mitral y la aórtica, con predominio de insuficiencia valvular sobre estenosis31. El ecocardiograma transesofágico es la prueba más sensible para su detección. La enfermedad coronaria y el infarto agudo de miocardio son frecuentes en los pacientes con LES y su patogenia es multifactorial: aterosclerosis, uso crónico de GC, insuficiencia renal crónica, vasculitis y trombosis. Manifestaciones neuropsiquiátricas desconocida. Se asocia a afectación de otros órganos como el riñón. La disnea es el síntoma más frecuente y puede asociarse a tos, hemoptisis y fiebre. En la radiografía se observan infiltrados uni o bilaterales en bases, generalmente acompañados de derrame pleural. En la gasometría se observa hipoxemia y el hemograma suele ser normal. Debe realizarse diagnóstico diferencial con procesos infecciosos. La hemorragia pulmonar es rara y cursa también con disnea, tos y fiebre. Ocurre en pacientes con altos títulos de anti-DNA y afectación extrapulmonar. Está indicada la broncoscopia con lavado broncoalveolar y la biopsia transbronquial. En la radiografía de tórax se observan infiltrados alveolares parahiliares. Debe tratarse de forma muy precoz pues su pronóstico es ominoso. El síndrome de hipoxemia aguda reversible se presenta en pacientes muy afectados y consiste en una insuficiencia respiratoria aguda pero con radiografía de tórax normal. Aunque la patogenia es desconocida, se ha sugerido que los productos de degradación del complemento son los responsables. La hipertensión pulmonar acontece en menos del 1% de los pacientes con LES y se caracteriza por disnea progresiva, tos seca y radiografía de tórax sin afectación del parénquima pulmonar. El fenómeno de Raynaud suele estar presente en el 60% de los casos y también son frecuentes los anticuerpos anti-RNP. El diagnóstico se confirma mediante ecocardiografía y cateterismo. Su patogenia se desconoce y el pronóstico es malo. Por último, la fibrosis pulmonar es una complicación rara que suele coincidir con el antecedente de una neumonitis lúpica. Se caracteriza por aparecer de forma insidiosa con disnea y tos seca y con patrón radiológico intersticial en bases. En las pruebas de función respiratoria se detecta un patrón restrictivo. Lo más importante es detectar el grado de actividad mediante tomografía computadorizada (TC) torácica, y broncoscopia con lavado y biopsia trasbronquial, para así determinar si es o no reversible. Manifestaciones cardíacas La pericarditis es la afectación más frecuente, apareciendo en el 25-40% de los pacientes con LES. Se presenta como dolor precordial, con o sin roce pericárdico y, en ocasiones, puede complicarse con derrame masivo y/o taponamiento cardíaco. Aparecen en el 17-75% de los pacientes y suelen acontecer en el curso del primer año de la enfermedad o como primer síntoma. Pueden estar mediadas inmunológicamente o ser secundarias a la afectación de otros órganos o al tratamiento. Las manifestaciones neuropsiquiátricas en el LES suelen presentarse coincidiendo con fases de actividad de la enfermedad, aunque pueden ser también la forma de presentación inicial, particularmente en pacientes jóvenes. Las manifestaciones más frecuentes son las que exponemos a continuación. Trastornos psiquiátricos, deficiencias cognitivas y estados confusionales Se definen como un déficit de memoria con dificultad de comprensión y de la capacidad de abstracción, afasia, apraxia y cambios de personalidad. La psicosis lúpica es menos frecuente32. El estado confusional agudo (síndrome orgánico cerebral) es un trastorno de nivel de conciencia que abarca desde un leve trastorno de la conciencia hasta el coma. Síndromes neurológicos focales La cefalea y las migrañas son muy frecuentes (10-40%); las crisis comiciales suelen ser tempranas (15-20%). Otros cuadros como los accidentes cerebrales vasculares, la mielitis transversa, el síndrome de Guillain Barré, y el corea se asocian generalmente con la presencia de aPL. Síndromes neurológicos del sistema nervioso periférico Los más frecuentes son la polineuritis sensitivomotora, la multineuritis y la afectación de los pares craneales. No existen pruebas de diagnóstico específicas para el neurolupus y siempre deben descartarse otras causas asociadas. El análisis del líquido cefalorraquídeo está alterado en un 30% de los casos. Con frecuencia, se observa pleocitosis y proteinorraquia, aunque su mayor utilidad es la de descartar la infección. Los anticuerpos antineuronales están presentes en el 75% de los pacientes con neurolupus. Asimismo, los pacientes con psicosis y depresión pueden presentar anticuerpos anti-P-ribosomales, aunque su detección no es exclusiva de pacientes con afectación neurológica33. Ambos anticuerpos están presentes en pacientes con afectación difusa del SNC, lo que sugiere una patogenia autoinmune, mientras que los aPL se asocian con los accidentes vasculares ceMedicine. 2017;12(25):1429-39 1435 ENFERMEDADES DEL SISTEMA INMUNE Y REUMATOLÓGICAS (II) rebrales, sugiriendo una patogenia trombótica. La TC es útil para descartar hemorragia o isquemia. La RM puede ser normal. La TC por emisión de fotón único (SPECT) no se correlaciona bien con los síntomas. Incluye afectación del SNC, sistema nervioso periférico o síntomas psiquiátricos. Es de los aspectos que más condicionan el pronóstico de los pacientes con LES junto con las manifestaciones renales. Manifestaciones digestivas En general, son raras y atribuibles al tratamiento. Náuseas, vómitos y diarrea pueden aparecer coincidiendo con fases de actividad de la enfermedad y mejoran con GC. La presencia de dolor abdominal en el LES puede deberse a diferentes motivos: vasculitis, pancreatitis o peritonitis espontánea34. La manifestación hepática más frecuente es una hipertransaminasemia durante las fases de actividad de la enfermedad, que se normaliza con el tratamiento. En ocasiones excepcionales, se desarrolla una hepatitis crónica activa. Otras manifestaciones poco frecuentes son: enteropatía pierde-proteínas, cirrosis biliar primaria, colangitis autoinmune, hiperplasia nodular regenerativa y vasculopatía oclusiva trombótica con síndrome de Budd-Chiari. Manifestaciones oftalmológicas La presencia de exudados algodonosos en la exploración de la retina acontece hasta en un 8% de los pacientes, pero no son patognomónicos del LES y pueden aparecer tanto como secuela de una inflamación de la arteria retiniana por actividad de la enfermedad como por una trombosis de la misma por aPL. Se puede encontrar igualmente afectación corneal y de la conjuntiva en pacientes con síndrome de Sjögren asociado. Otras manifestaciones más raras son la uveítis, la escleritis y la neuritis óptica35. Historia natural Es una enfermedad crónica que cursa con exacerbaciones y que provoca una importante morbilidad. Comienza con una fase preclínica que se caracteriza por presentar autoanticuerpos (común a otras enfermedades autoinmunes) y progresa haciéndose más evidente clínicamente con afectación de órganos específicos. El daño acumulado al inicio de la enfermedad está relacionado con el índice de actividad. Durante el curso y en los últimos estadios el daño en relación con la enfermedad y el tratamiento incrementa la alopecia, enfermedad valvular, aterosclerótica, necrosis avascular, rotura tendinosa, artropatía de Jaccoud, osteoporosis y el riesgo de neoplasias. Existen ciertos factores de riesgo que aumentan el riesgo de reactivación de la enfermedad como la exposición solar, las infecciones, las intervenciones quirúrgicas, el embarazo y la toma de anticonceptivos orales. La supervivencia del LES a los 10 años es del 75-85%, según las series. El pronóstico es mucho mejor debido a que el diagnóstico es cada vez más precoz, existen formas de lu1436 Medicine. 2017;12(25):1429-39 pus menos graves y además se han desarrollado medidas terapéuticas más eficaces. Las causas de muerte más frecuentes son las infecciones, los eventos cardiovasculares, la nefropatía y las lesiones neurológicas36; aunque el tratamiento actual del lupus ha mejorado drásticamente la supervivencia. La remisión prolongada y completa, definida como 5 años sin evidencia clínica y de laboratorio de enfermedad activa sin tratamiento, ha sido difícil de alcanzar para la mayoría de los pacientes. La incidencia de las recaídas se estima en un 0,30-0,50 por paciente al año. Por otra parte, un número significativo de pacientes (10-20% en centros de tercer nivel) no responden adecuadamente a las terapias inmunosupresoras. Comorbilidades En los pacientes con LES, el riesgo de presentar comorbilidades está aumentado, y es consecuencia de la propia enfermedad y de los tratamientos utilizados para su control. Infecciones Son la causa de muerte en un 20-55% de los pacientes con LES. El riesgo de infección aumenta por la propia alteración del sistema inmune característica de esta enfermedad, así como por el efecto del tratamiento como las dosis elevadas de GC e inmunosupresores. La sospecha de infección debe tenerse en caso de escalofríos, leucocitosis y/o neutrofilia (particularmente en ausencia de tratamiento con GC), presencia de metamielocitos en la extensión de sangre periférica y el uso concomitante de inmunosupresores. En espera de los resultados microbiológicos, se recomienda instaurar un tratamiento antibiótico de amplio espectro36. Arteriosclerosis El riesgo de enfermedad coronaria está aumentado en pacientes con LES, comparado con la población general. Se recomienda un control estricto de la dislipidemia para mantener el colesterol LDL por debajo de 100 mg/dl y los triglicéridos inferiores a 150 mg/dl, sobre todo en pacientes con LES moderado o grave, con otros factores de riesgo y con engrosamiento carotídeo por ecografía. Osteoporosis Varios factores influyen en el riesgo de tener una densidad mineral ósea reducida, como la propia actividad de la enfermedad, la menopausia precoz, el déficit de vitamina D al evitar la exposición solar y el uso crónico de GC37. Malignidad Determinadas neoplasias como las hematológicas, el linfoma no Hodgkin y el Hodgkin o la displasia cervical son más fre- LUPUS ERITEMATOSO SISTÉMICO (I). ETIOPATOGENIA. MANIFESTACIONES CLÍNICAS. HISTORIA NATURAL. PRUEBAS DIAGNÓSTICAS. DIAGNÓSTICO DIFERENCIAL cuentes en los pacientes con LES y esto es debido tanto a factores intrínsecos de la enfermedad como al tratamiento inmunosupresor. Las neoplasias se ven incrementadas probablemente por mecanismos intrínsecos del LES y la terapia inmunosupresora. Las neoplasias hematológicas aumentan tras la exposición a fármacos inmunosupresores, particularmente 5 años después del cese de su uso. La displasia cervical también aumenta sobre todo en pacientes tratadas con ciclofosfamida al interferir con el aclaramiento del virus del papiloma humano, recomendándose actualmente la vacunación. Por último, en pacientes que hayan recibido tratamiento con ciclofosfamida oral debe vigilarse la aparición de neoplasia vesical, particularmente si han desarrollado previamente cistitis hemorrágica. TABLA 2 Criterios del American College of Rheumatology (ACR) para la clasificación del lupus eritematoso sistémico de 1982 Exantema malar Eritema fijo, plano o elevado, sobre las eminencias malares, que tiende a respetar los pliegues nasolabiales Exantema discoide Manchas eritematosas elevadas con descamación queratósica adherente y tapones foliculares; en las lesiones más antiguas se puede producir cicatrización atrófica Fotosensibilidad Exantema cutáneo resultado de una reacción inusual a la luz solar, según la historia del paciente o la observación del médico Úlceras orales Úlceras orales o nasofaríngeas, usualmente indoloras, observadas por un médico Artritis Artritis no erosiva con afectación de dos o más articulaciones periféricas, caracterizada por hipersensibilidad, tumefacción o derrame Serositis Pleuritis: antecedentes de dolor pleurítico o auscultación de un roce por un médico o signos de derrame pleural Pericarditis: documentada mediante ECG, roce o signos de derrame pericárdico Pruebas diagnósticas El diagnóstico de LES se hace reuniendo datos clínicos y ciertas pruebas de laboratorio, después de descartar los posibles diagnósticos diferenciales de la enfermedad. Los criterios de clasificación del LES se establecieron en 1982, y se revisaron en 1997, de acuerdo con la Sociedad Americana de Reumatología (tabla 2). La especificidad y sensibilidad alcanzan el 96%. A pesar de ser clasificatorios, estos criterios también se utilizan para el diagnóstico, siendo necesaria la presencia de al menos 4 criterios. Estos criterios fueron validados para pacientes con enfermedad de larga evolución, lo que excluye a pacientes en fases iniciales o con enfermedad limitada. Por lo que el grupo de trabajo Colaboradores Clínicos Internacionales de Lupus Eritematoso Sistémico en el 2012 hicieron una revisión, proponiendo nuevos criterios de clasificación, con la intención de mejorar la capacidad de identificación precoz de los pacientes (tabla 3). Estos tienen una mejor sensibilidad que los del American College of Rheumatology (94% frente a 86%) y una especificidad similar (92% frente 93%). Exigen la presencia de 4 criterios, debiendo ser al menos uno de ellos clínico y otro un criterio inmunológico, o presentar una nefritis lúpica por biopsia con anticuerpos antinucleares (ANA) positivos38. Pruebas serológicas Anticuerpos antinucleares Es la prueba de cribado más representativa para las enfermedades del tejido conectivo. Tiene una sensibilidad del 90% y su negatividad prácticamente descarta el diagnóstico de LES. Tienen una especificidad baja, ya que pueden encontrarse en muchas otras enfermedades e incluso en población sana, generalmente con títulos menores de 1:160. Una persona con títulos menores de 1:80 tiene menos del 3-5% de probabilidad de tener LES. Por el contrario, en caso de síntomas muy sugerentes de LES, un resultado negativo de ANA no excluye el diagnóstico, sobre todo si su determinación se realiza por inmunoensayos enzimáticos39. Anticuerpos frente a extractos antigénicos nucleares Los anticuerpos frente al ADN de doble cadena se encuentran en el 70% de los pacientes con LES y tienen un 95% de Trastorno renal Proteinuria persistente superior a 0,5 g por día o superior a 3+ si no se realiza cuantificación Cilindros celulares que pueden ser hematíes, hemoglobina, granulares, tubulares o mixtos Trastorno neurológico Convulsiones: en ausencia de fármacos causales o anomalías metabólicas conocidas (por ejemplo, uremia, cetoacidosis o desequilibrio electrolítico) Psicosis: en ausencia de fármacos causales o trastornos metabólicos conocidos (por ejemplo, uremia, cetoacidosis o desequilibrio electrolítico) Trastorno hematológico Anemia hemolítica con reticulocitosis Leucopenia: menos de 4.000/mm3 total en dos o más ocasiones Linfopenia: menos de 1.500/mm3 en dos o más ocasiones Trombocitopenia: menos de 100.000/mm3 en ausencia de fármacos causales Trastorno inmunológico Anti-DNA: anticuerpos anti-DNA nativo a títulos anormales Anti-Sm: presencia de anticuerpos contra el antígeno nuclear Sm Positividad falsa de una prueba serológica para sífilis, con positividad persistente durante al menos 6 meses y confirmada mediante inmovilización de Treponema pallidum o prueba de absorción de anticuerpos fluorescentes contra los treponemas Anticuerpos antinucleares Título anormal de anticuerpos antinucleares mediante inmunofluorescencia o técnica equivalente, en cualquier momento y en ausencia de fármacos relacionados con el síndrome de “lupus inducido por fármacos” Para la clasificación de LES se requiere la presencia de 4 de 11 criterios en serie o simultáneamente durante cualquiera de los periodos de observación. ECG: electrocardiograma. especificidad. Desde el punto de vista patogénico, se asocian con la presencia de nefritis y sus títulos se correlacionan con la actividad de la enfermedad y la progresión a un estadio final de la enfermedad renal. Los anti-Sm (Smith) se detectan en el 10-30% de los pacientes y son patognomónicos de LES. Los anti-RNP suelen ir asociados a los anti-Sm pero no son específicos de la enfermedad. Los anti-Ro (SSA) y anti-La (SSB) se asocian a lupus cutáneo subagudo, lupus neonatal y bloqueo cardíaco congénito en hijos de madres seropositivas. Los aPL se asocian con manifestaciones propias del síndrome antifosfolípido (SAF) como trombosis venosas y/o arteriales, trombopenia, enfermedad cerebrovascular, patología obstétrica, afectación renal grave, aumento del daño acumulado y muerte. Diagnóstico diferencial El diagnóstico diferencial inicial debe incluir artritis reumatoide, enfermedad de Still, síndrome de Sjögren, SAF, fibromialgia con ANA positivos, púrpura trombocitopénica idioMedicine. 2017;12(25):1429-39 1437 ENFERMEDADES DEL SISTEMA INMUNE Y REUMATOLÓGICAS (II) TABLA 3 Criterios de clasificación del Systemic Lupus International Collaborating Clinics Group (SLICC) 2012 Criterios clínicos Lupus cutáneo agudo Lupus cutáneo crónico Exantema malar lúpico, lupus bulloso, necrosis epidérmica tóxica, exantema maculopapular, fotosensibilidad) en ausencia de dermatomiositis o lupus cutáneo subagudo Exantema discoide, lupus hipertrófico o verrugoso, paniculitis lúpica o lupus profundus, lupus mucoso, lupus tumidus, perniosis lúpica, superposición lupus discoide/ liquen plano Úlceras orales Paladar o mucosa nasal en ausencia de otras causas Alopecia no cicatricial En ausencia de otras causas Sinovitis De 2 o más articulaciones con presencia de tumefacción o derrame o dolor en 2 o más articulaciones con una rigidez matutina de más de 30 minutos Serositis Pleuritis o pericarditis de más de un día Renal Cociente proteínas orina/creatinina o proteinuria de 24 horas > 500 mg/día o cilindros celulares hemáticos en orina Neurológico Convulsiones, psicosis, mononeuritis múltiple, mielitis, neuropatía central o periférica, síndrome confusional agudo en ausencia de otras causas Anemia hemolítica Leucopenia Menos de 4.000/mcl en una ocasión en ausencia de otras causas Linfopenia Menos de 1.000/ mcl en una ocasión en ausencia de otras causas Trombocitopenia Menos de 100.000/mcl en una ocasión en ausencia de otras causas ANA Por encima del valor de referencia de laboratorio Anticuerpos anti-DNA Por encima del valor de referencia de laboratorio o 2 veces por encima del valor de referencia si es determinado por ELISA Anti-Sm Presencia de anticuerpos anti-Sm Positividad anticuerpos antifosfolípido Anticoagulante lúpico Criterios inmunológicos RPR falso positivo Anti-B2 glicoproteína I (IgG o IgM) positivo a título medio o alto Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Responsabilidades éticas Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales. Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes. Bibliografía r Importante rr Muy importante ✔ Metaanálisis ✔ Artículo de revisión Ensayo clínico controlado ✔ ✔ Guía de práctica clínica Epidemiología ✔ 1. Lockshin MD. Sex differences in autoimmune disease. Lupus. 2006;15: ✔ 753-6. 2. Lu LJ, Wallace DJ, Ishimori ML, Scofield RH, Weisman MH. Review: ✔ Male systemic lupus erythematosus: a review of sex disparities in this disease. Lupus. 2010; 19:119-29. 3. Lahita RG. The role of sex hormones in systemic lupus erythematosus. ✔ Curr Opin Rheumatol. 1999;11:352-6. 4. Tarr T, Dérfalvi B, Györi N, Szántó A, Siminszky Z, Malik A, et al. Simi✔ larities and differences between pediatric and adult patients with systemic lupus erythematosus. Lupus. 2015; 24:796-803. Anticuerpos anticardiolipina (IgG o IgM) positivo a título medio o alto 5. r Ballou SP, Khan MA, Kushner. Clinical features of systemic lupus ✔ erythematosus: differences related to race and age of onset. Arthri- Complemento bajo C3, C4, CH50 Test de Coombs directo positivo En ausencia de anemia hemolítica 6. r Pons-Estel GJ, Alarcón GS, Scofield L, Reinlib L, Cooper GS. ✔ Understanding the epidemiology and progression of systemic lupus Los criterios son acumulativos y no necesitan estar presentes al mismo tiempo. Se clasifica al paciente de LES si presenta al menos 4 de los criterios clínicos o inmunológicos, debiendo al menos estar presente un criterio clínico y otro inmunológico. También se clasifica de LES al paciente con biopsia renal compatible con nefritis lúpica que asocia unos ANA o anti-DNA positivos. RPR: reagina plasmática rápida. pática, lupus inducido por fármacos y enfermedad tiroidea autoinmune. En los pacientes que desarrollan fiebre y esplenomegalia o adenopatías, es obligado descartar un proceso infeccioso o linfoproliferativo. En los pacientes que comienzan con síntomas neurológicos se debe tener en cuenta en el diagnóstico diferencial infecciones, accidentes cerebrovasculares o enfermedades neurológicas inmunomediadas como la esclerosis múltiple o el síndrome de Guillain-Barré. En pacientes que comienzan con sintomatología pulmonar y renal se debe descartar que no se trate de una vasculitis asociada a ANCA o un síndrome de Goodpasture. Por último, el diagnóstico diferencial de la afectación renal debe incluir las GN postinfecciosas, otras GN membranoproliferativas y vasculitis renal. 1438 Medicine. 2017;12(25):1429-39 tis Rheum. 1982; 25:55-60. erythematosus. Semin Arthritis Rheum. 2010; 39:257-68. 7. Laffon A, Carmona L, Ballina FJ, Gabriel R. Prevalencia de enfermedades ✔ reumáticas en la población española. EPISER. 2016. 8. Deapen D, Escalante A, Weinrib L, Horwitz D, Bachman B, Roy-Burman ✔ P, et al. A revised estimate of twin concordance in systemic lupus erythematosus. Arthritis Rheum. 1992;35:311-8. 9. Kariuki SN, Ghodke-Puranik Y, Dorschner JM, Chrabot BS, Kelly JA, Tsao BP, et al. Genetic analysis of the pathogenic molecular sub-phenotype interferon-alpha identifies multiple novel loci involved in systemic lupus erythematosus. Genes Immun. 2015; 16:15-23. 10. Patel DR, Richardson BC. Dissecting complex epigenetic alterations in human lupus. Arthritis Res Ther. 2013;29:15:201. 11. Yung R, Richardson B. Drug-induced rheumatic syndromes. Bull Rheum Dis. 2002;51:1. 12. Margolis DJ, Hoffstad O, Bilker W. Association or lack of association between tetracycline class antibiotics used for acne vulgaris and lupus erythematosus. Br J Dermatol. 2007;157:540-6. 13. Costenbader KH, Feskanich D, Stampfer MJ, Karlson EW. Reproductive and menopausal factors and risk of systemic lupus erythematosus in women. Arthritis Rheum. 2007;56:1251-62. 14. Hahn BH, Ebling F, Singh RR, Singh RP, Karpouzas G, La Cava A. Cellular and molecular mechanisms of regulation of autoantibody production in lupus. Ann N Y Acad Sci. 2005;1051:433-41. 15. Mountz JD, Wu J, Cheng J, Zhou T. Autoimmune disease. A problem of defective apoptosis. Arthritis Rheum. 1994;37:1415-20. 16. D’Andrea DM, Coupaye-Gerard B, Kleyman TR, Foster MH, Madaio MP. Lupus autoantibodies interact directly with distinct glomerular and vascular cell surface antigens. Kidney Int. 1996;49:1214-21. 17. Tsokos GC. Systemic lupus erythematosus. N Engl J Med. 2011;365:211021. 18. Rönnblom L, Eloranta ML, Alm GV. The type I interferon system in systemic lupus erythematosus. Arthritis Rheum. 2006; 54:408-20. ✔ ✔ ✔ ✔ ✔ ✔ ✔ ✔ LUPUS ERITEMATOSO SISTÉMICO (I). ETIOPATOGENIA. MANIFESTACIONES CLÍNICAS. HISTORIA NATURAL. PRUEBAS DIAGNÓSTICAS. DIAGNÓSTICO DIFERENCIAL 19. Gatto M, Zen M, Ghirardello A, Bettio S, Bassi N, Iaccarino L, et al. ✔ Emerging and critical issues in the pathogenesis of lupus. Autoimmun Rev. 2013;12:523-36. 20. Walling HW, Sontheimer RD. Cutaneous lupus erythematosus: issues in ✔ diagnosis and treatment. Am J Clin Dermatol. 2009;10:365-81. 21. Patel P, Werth V. Cutaneous lupus erythematosus: a review. Dermatol ✔ Clin. 2002;20:373-85. 22. Grossman JM. Lupus arthritis. Best Pract Res Clin Rheumatol. 2009;23: ✔ 495-506. 23. Santiago MB, Galvão V. Jaccoud arthropathy in systemic lupus erythema✔ tosus: analysis of clinical characteristics and review of the literature. Medicine (Baltimore). 2008;87:37-44. 24. Danila MI, Pons-Estel GJ, Zhang J, Vilá LM, Reveille JD, Alarcón GS. ✔ Renal damage is the most important predictor of mortality within the ✔ 25. ✔ 26. 27. ✔ ✔ 28. damage index: data from LUMINA LXIV, a multiethnic US cohort. Rheumatology (Oxford). 2009;48:542-5. Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, Alpers CE, Appel GB, et al. International Society of Nephrology Working Group on the Classification of Lupus Nephritis, Renal Pathology Society Working Group on the Classification of Lupus Nephritis. The classification of glomerulonephritis in systemic lupus erythematosus revisited. Kidney Int. 2004;65:521. Newman K, Owlia MB, El-Hemaidi I, Akhtari M. Management of immune cytopenias in patients with systemic lupus erythematosus - Old and new. Autoimmun Rev. 2013;12:784-91. Giannouli S, Voulgarelis M, Ziakas PD, Tzioufas AG. Anaemia in systemic lupus erythematosus: from pathophysiology to clinical assessment. Ann Rheum Dis. 2006;65:144-8. Keeling DM, Isenberg DA. Haematological manifestations of systemic lupus erythematosus. Blood Rev 1993;7:199-207. 29. Keane MP, Lynch JP 3rd. Pleuropulmonary manifestations of systemic ✔ lupus erythematosus. Thorax. 2000;55:159-66. 30. Vincze K, Odler B, Müller V. Pulmonary manifestations in systemic lupus erythematosus. Orv Hetil. 2016;157:1154-60. 31. Miner JJ, Kim AH. Cardiac manifestations of systemic lupus erythematosus. Rheum Dis Clin North Am. 2014; 40:51-60. 32. Wong KL, Woo EK, Yu YL, Wong RW. Neurological manifestations of systemic lupus erythematosus: a prospective study. Q J Med. 1991;81:857-70. 33. Colasanti T, Delunardo F, Margutti P, Vacirca D, Piro E, Siracusano A. Autoantibodies involved in neuropsychiatric manifestations associated with systemic lupus erythematosus. J Neuroimmunol. 2009;25:212:213. 34. Tian XP, Zhang X. Gastrointestinal involvement in systemic lupus erythematosus: insight into pathogenesis, diagnosis and treatment. World J Gastroenterol. 2010;16:2971-7. 35. Silpa-archa S, Lee JJ, Foster CS. Ocular manifestations in systemic lupus erythematosus. Br J Ophthalmol. 2016;100:135-41. 36. Cervera R, Khamashta MA, Font J, Sebastiani GD, Gil A, Lavilla P, et al. Morbidity and mortality in systemic lupus erythematosus during a 10year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore). 2003; 82:299-308. 37. Panopalis P, Yazdany J. Bone health in systemic lupus erythematosus. Curr Rheumatol Rep. 2009;11:177. Petri M, Orbai AM, Alarcón GS, Gordon C, Merrill JT, Fortin PR, 38. et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum. 2012;64:2677-86. 39. Agmon-Levin N, Damoiseaux J, Kallenberg C, Sack U, Witte T, Herold M, et al. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 2014;73:17-23. ✔ ✔ ✔ ✔ ✔ ✔ ✔ r ✔ Medicine. 2017;12(25):1429-39 1439