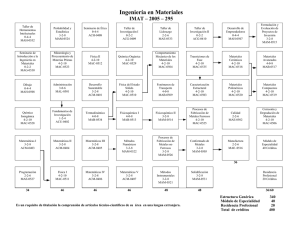
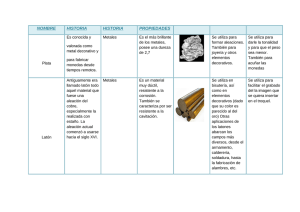
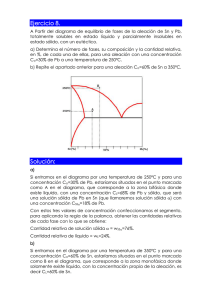
Instituto tecnológico José Mario Molina Pasquel y Henríquez INGENIERÍA ELECTROMECÁNICA TECNOLOGIA DE LOS MATERIALES Articulo científico – Materiales metálicos no ferrosos Nombre: Ulises Montelongo Tejeda Fecha: Junio 2018 Profesor: Jiménez López Luis Fernando 1 Instituto tecnológico José Mario Molina Pasquel y Henríquez Articulo científico – Materiales metálicos no ferrosos Ulises Montelongo Tejeda Ing. Electromecánica Instituto Tecnológico José Mario Molina Pasquel y Henríquez Cocula, Jalisco México. Resumen—“Introducción metálicos no ferrosos”. a los materiales Palabras Claves 1. Metal: Se denominan metales a los elementos químicos caracterizados por ser buenos conductores del calor y la electricidad. I. OBJETIVO C onocer los diferentes materiales metálicos no ferrosos, conocer diagramas de fase y sus características y estructuras de aleaciones diferentes. amplia gama de metales que se pueden alear. El elemento aleante puede ser no metálico, como: P (fósforo), C (carbono), Si (silicio), S (azufre), As (arsénico). Mayormente las aleaciones son consideradas mezclas, al no producirse enlaces estables entre los átomos de los elementos involucrados. Excepcionalmente, algunas aleaciones generan compuestos químicos. Las aleaciones más comunes utilizadas en la industria son: • II. ESTRUCTURAS DE LAS ALEACIONES • Las sustancias puras (metales, compuestos de tipo NaCl,...) cristalizan siempre según el mismo tipo de estructura cristalina. Esta estructura cristalina puede cambiar con la temperatura o con la presión; por ejemplo, el hierro puro si se enfría desde una temperatura superior a1536ºC (punto de fusión del hierro) y este enfriamiento se hace muy lentamente a 1536ºC el líquido (hierro fundido) se trasforma en cristales de hierro puro con estructura cúbica centrada en el interior; si se continúa el enfriamiento, a 1398ºC los cristales BCC se transforman en FCC y si se continua enfriando, a 911ºC el FCC se transforma en BCC nuevamente. Este fenómeno según el cual por variación de temperatura puede cambiar la estructura de la sustancia se conoce como alotropía y cada uno de los estados o estructuras cristalinas se conocen como estados alotrópicos de dicha sustancia. Este fenómeno se conoce también como polimorfa. Las aleaciones están constituidas por elementos metálicos como Fe (hierro), Al (aluminio), Cu (cobre), Pb (plomo), ejemplos concretos de una 2 Instituto tecnológico José Mario Molina Pasquel y Henríquez • • • • • • • Acero: Es aleación de hierro con una cantidad de carbono variable entre el 0,008 y el 1,7 % en peso de su composición, sobrepasando el 1.7 % (hasta 6.67 %) pasa a ser una fundición. Acero inoxidable: El acero inoxidable se define como una aleación de acero con un mínimo del 10 % al 12 % de cromo contenido en masa Alnico: Formada principalmente de cobalto (5.24 %), aluminio (8-12 %) y níquel (15-26 %), aunque también puede contener cobre (6 %), en ocasiones titanio (1 %) y el resto de hierro. Alpaca: Es una aleación ternaria compuesta por zinc (8-45 %), cobre (4570 %) y níquel (8-20 %) Bronce: Es toda aleación metálica de cobre y estaño en la que el primero constituye su base y el segundo aparece en una proporción del 3 al 20 %. Nicrom: Es una aleación compuesta de un 80 % de níquel y un 20 % de cromo. Nitinol: Titanio y níquel. Oro blanco (electro): Es una aleación de oro y algún otro metal blanco, como la plata, paladio, o níquel. Peltre: Es una aleación compuesta por estaño, cobre, antimonio y plomo. III. DIAGRAMA DE FASE TIPO 1. DOS METALES COMPLETAMENTE SOLUBLES EN ESTADO SÓLIDO Y LÍQUIDO la presión el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida. En termodinámica y ciencia de materiales se denomina diagrama de fase a la representación gráfica de las fronteras entre diferentes estados de la materia de un sistema, en función de variables elegidas para facilitar el estudio del mismo. Cuando en una de estas representaciones todas las fases corresponden a estados de agregación diferentes se suele denominar diagrama de cambio de estado. A. Sustancia pura Los diagramas de fase más sencillos son los de presión - temperatura de una sustancia pura, como puede ser el del agua. En el eje de ordenadas se coloca la presión y en el de abscisas la temperatura. Generalmente, para una presión y temperatura dadas, el cuerpo presenta una única fase excepto en las siguientes zonas: • • • • • • Punto triple: En este punto del diagrama coexisten los estados sólidos, líquido y gaseoso. Estos puntos tienen cierto interés, ya que representan un invariante y por lo tanto se pueden utilizar para calibrar termómetros. Los pares (presión, temperatura) que corresponden a una transición de fase entre: Dos fases sólidas: Cambio alotrópico; entre una fase sólida y una fase líquida: fusión - solidificación; entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa); entre una fase líquida y una fase vapor: vaporización condensación (o licuefacción); Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico. Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado. Es preciso anotar que, en el diagrama PV del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando 3 B. Diagramas de fase con fases intermedias Muchos diagramas de equilibrio son complejos y, a menudo muestran fases o compuestos intermedios. Es conveniente distinguir entre dos tipos de soluciones sólidas: fases terminales y fases intermedias. Las fases en solución sólida terminales se presentan al final de los diagramas de fases, en los límites de los componentes puros. Las soluciones en fases intermedias se presentan en un rango de composiciones dentro del diagrama de fases y están separadas de otras fases en un diagrama binario por regiones de dos fases. En este sistema, α y η, y β, γ,δ y ε son fases intermedias. El diagrama de fases Cu-Zn cuenta con cinco puntos peritécticos invariantes y con un punto eutectoide invariante en el punto más debajo de la región intermedia δ. Las fases intermedias no están restringidas a diagramas de fases metálicos. IV. DIAGRAMAS DE FASE DE TIPO EUTÉCTICO. DOS METALES COMPLETAMENTE INSOLUBLES EN ESTADO SOLIDO Los primeros investigadores en aplicar estas técnicas fueron Sekiguchi y Obi quienes obtuvieron mezclas eutécticas y soluciones sólidas por fusión de fármacos de baja solubilidad con substancias fisiológicamente inertes, rápidamente solubles en agua, como la urea y el ácido succínico. El fármaco y el vector soluble se mezclan y se calientan hasta fusión; el líquido homogéneo se enfría y, una vez al estado sólido, la masa se reduce a polvo y se tamiza a través de un tamiz de malla apropiada. Cuando este tipo de sistema se introduce Instituto tecnológico José Mario Molina Pasquel y Henríquez en agua, la substancia soluble se disuelve rápidamente y el medicamento poco soluble se libera en un estado de división muy fino lo que contribuye a aumentar su solubilidad y su velocidad de disolución. Considerando los aspectos teóricos del procedimiento, los podemos resumir diciendo que cuando dos substancias se funden conjuntamente, los líquidos resultantes pueden ser: • • • no miscibles parcialmente miscibles completamente miscibles Los diagramas de fases de los sistemas pueden damos información útil acerca de estos fenómenos. En el caso de substancias no miscibles, el diagrama de fases es muy simple, siempre que no se formen compuestos intermedios. En el caso de la figura 1.3, que representa el caso de una mezcla de A y B en diferentes proporciones, el componente B se separa cuando la mezcla tiene una composición de 0% a 40% de A. Inversamente, si la mezcla está constituida por 0% a 60% de B, se observará solamente la separación del producto A. El punto de intersección, E, de las dos curvas que separan la zona líquida y la zona donde el líquido se encuentra en equilibrio con el sólido, se llama "punto eutéctico" (del griego: "fusión fácil") y es la temperatura más baja a la cual puede existir la fase líquida. A este punto corresponde una temperatura y una composición determinada que, para la mezcla del diagrama de la figura 1.3, corresponde a 40% de A y 60% de B. Un líquido de esta composición, al enfriamiento forma dos fases sólidas separadas, A y B puras. Cuando una mezcla fundida posee un diagrama de fases como 4 éste, la última gota de líquido contiene siempre la composición eutéctica y es solamente en el punto eutéctico que los dos sólidos se separan. El enfriamiento de las mezclas para cualquier otra composición no dará lugar a la separación de una sola fase sólida. V. DIAGRAMA DE FASE DE TIPO EUTÉCTICO, DOS METALES COMPLETAMENTE SOLUBLES EN ESTADO LÍQUIDO Y PARCIALMENTE SOLUBLE EN ESTADO SOLIDO En este caso las soluciones sólidas de un componente en otro que se forman tienen un límite de saturación. Los puntos de solidificación de los dos componentes puros vienen representados por TA y TB respectivamente. La línea de líquidas será TAETB y la de sólidas TAFEGTB. Como puede verse en éste tipo de diagramas de equilibrio en los puntos de fusión de los metales puros, que a su vez es punto de encuentro de la línea de líquido y de sólido, el diagrama adquiere forma la forma de huso característica de los sistemas que presentan solubilidad total en estado líquido, lo cual es lógico, ya que los componentes son parcialmente solubles en estado sólido y por tanto forman soluciones sólidas. Al solidificar las aleaciones pertenecientes a este diagrama, nunca se forman cristales puros de A o de B sino que se forman soluciones sólidas o una mezcla de ellas. Las soluciones sólidas se designan por letras griegas, siendo en ésta caso a y ß las regiones correspondientes a las soluciones sólidas monofásicas, las cuales al formarse en las regiones contiguas a los ejes se denominan soluciones Instituto tecnológico José Mario Molina Pasquel y Henríquez sólidas terminales o finales. En él puede verse que al descender la temperatura y alcanzar la temperatura eutéctica, la solución sólida a disuelve un máximo de B, cuya cantidad disminuye si lo hace la temperatura hasta un mínimo. Y lo mismo ocurre en el caso de ß. Este cambio de solubilidad lo indican las líneas FH y GJ, las cuales se denominan líneas de transformación o cambio de solubilidad, e indican la solubilidad máxima de B en A o de A en B en función de la temperatura. Si consideramos el enfriamiento de distintas disoluciones, se observa que en caso de tomar una aleación cuya composición sea la eutéctica lo que tenemos es en primer lugar una solución líquida homogénea que al descender la temperatura hasta la eutéctica se transforma a temperatura constante en una mezcla eutéctica igual que pasara en el caso anterior estudiado, con la única diferencia que ésta mezcla eutéctica en lugar de estar constituida por dos componentes puros, la formarán dos soluciones sólidas. Ahora bien hay que tener en cuenta que como la solubilidad de B en A y de A en B varía de acuerdo con las líneas de transformación, las cantidades relativas de alfa y beta que componen el eutéctico a temperatura ambiente difieren ligeramente de las obtenidas después de la transformación eutéctica. VI. FASE INTERMEDIA DE FUSIÓN CONGRUENTE Cuando una fase cambia en otra isotérmicamente y sin ninguna modificación en composición química, se dice que es un cambio de fase congruente o una transformación congruente. Las fases intermedias son congruentes porque son únicas y se presentan entre las fases terminales en un diagrama de fase. Si la fase intermedia tiene un reducido intervalo de composición, como sucede en los compuestos Inter metálicos y los compuestos intersticiales, entonces se representa en el diarama con una línea vertical y se indica con la formula del compuesto intermetálico. 5 VII. ALEACIONES COMERCIALES DE MATERIALES NO FERROSOS Cada uno de estos procesos adopta diferentes formas tecnológicas según las características distintivas de cada metal y en algunos casos no se aplica la totalidad de las etapas mencionadas. Por ejemplo, el mercurio no requiere fusión porque ya es líquido a temperatura ambiente y los metales nobles muchas veces se emplean en estado puro, no aleado. A continuación, se describen en forma breve los procesos de la metalurgia de los metales no ferrosos. A. Extracción. Los metales no ferrosos provienen de minerales que se pueden encontrar en la superficie de la tierra o bien en yacimientos subterráneos. En ambos casos se han desarrollado técnicas de explotación eficientes y rentables. B. Concentración. Los metales no ferrosos raramente se encuentran en estado puro y en cantidades comerciales en los minerales de los que se obtienen. Por esta razón, se aplican procedimientos físicos y mecánicos para separar el mineral de interés de la ganga. Entr e los procesos de preparación más utilizados se menciona la pulverización o molienda del mineral para luego mezclarlo con agua y un aceite. Esta mezcla o suspensión se somete a algún tipo de agitación enérgica para promover el formado de Instituto tecnológico José Mario Molina Pasquel y Henríquez una espuma en la que los minerales metálicos quedan suspendidos mientras que otros materiales no deseables, como arena, roca, etc., sedimentan. C. Fusión. Los hornos utilizados para la fusión de los minerales de metales no ferrosos incluyen un tipo de alto horno de menores dimensiones que los de arrabio y los hornos de reverbero, es decir aquellos en los que se aplica una llama directa sobre la carga. De todas maneras, se reitera que no todos los metales no ferrosos necesitan ser fundidos para ser procesados. En los hornos para la producción de metales no ferrosos usualmente existen sistemas para el control de las emisiones de polvo. Esto se debe tanto a una medida de control de la contaminación ambiental como al aprovechamiento de metal adicional que esté contenido en los polvos cuando el mineral se pulverizado a un nivel muy fino. D. Afinación. Para lograr las características de calidad y pureza necesarias en los metales no ferrosos se pueden utilizar diferentes procesos. En la manufactura de cobre de alta pureza, por ejemplo, se usan cubas electrolíticas en las cuales el material adquiere niveles de calidad muy altos. VIII. CONCLUSIONES Con estos datos se ha podido concluir que con la mezcla de diferentes materiales podemos crear materiales mas resistentes, con mejores propiedades según sea nuestra necesidad. También aprendemos al mismo tiempo en que temperatura o con que porcentaje de cada material empiezan a mezclarse. Aleaciones. Las fases en cada aleación y sus diferentes estados. Como también los diferentes procesos que existen para que estos se fusionen en uno solo. IX. BIBLIOGRAFÍA [1] AVALLONE, EUGENE A. MANUAL DEL INGENIERO MECÁNICO, TERCERA EDICIÓN, MCGRAW-HILL [2] Best, M. 1982. Igneous and Metamorphic Petrology. 630 pp. W.H.Freeman & Co. [3] Swamy, V., y Saxena, S.K. 1994. A thermodynamic assessment of silica phase diagram. J. Geophys. Res. 99: 11787- 11794. [4] Bowen, N.L. 1951. The crystallization of haplodioritic, and related magmas. Amer. Jour. Sci. 40: 161-185. E. Aleación. Para cumplir adecuadamente con los diferentes requerimientos del servicio, es usual ajustar la composición mediante el mezclado de diferentes metales puros de manera de lograr una solución sólida o aleación con las características buscadas. 6 Instituto tecnológico José Mario Molina Pasquel y Henríquez