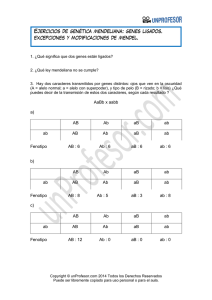
Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 1 GENÉTICA Y MEJORAMIENTO VEGETAL Y ANIMAL UNIDAD TEMÁTICA 2 GENÉTICA MENDELIANA Introducción. Genética: es la rama de la biología que se ocupa de la herencia. Las unidades hereditarias que se transmiten de una generación a la siguiente y determinan una característica biológica se denominan genes, estos son segmentos de filamentos de ADN (ácido desoxirribonucléico), que en combinación con una matriz proteica forman nucleoproteínas, las cuales constituyen los cromosomas ubicados en el núcleo de la célula. Cada gen ocupa una posición determinada en el cromosoma denominada locus génico (loci en plural). En la mayoría de los organismos superiores cada individuo es portador de dos genes correspondientes a cada carácter (individuo diploide), ubicados en cada uno de los cromosomas homólogos. Las alternativas distintas, en cuanto a genes, para un mismo carácter se denominan alelos. Algunos genes se reconocen porque producen un efecto biológico determinado, por ejemplo la forma de la semilla está regulada por un par de alelos (genes) que simbolizaremos con L: gen para semilla lisa, l: gen para semilla rugosa. Si el individuo diploide lleva dos alelos idénticos ya sea para semilla lisa o para semilla rugosa (simbólicamente LL ó ll respectivamente), se dice que el individuo es homocigota para dicho carácter. Si en cambio el individuo lleva un gen para semilla lisa y otro para semilla rugosa (simbólicamente Ll), se dice que es heterocigota, y presentará el carácter semilla lisa, pues este gen es dominante sobre su otro alelo que produce semilla rugosa. Es decir que los caracteres recesivos únicamente se manifiestan o aparecen cuando el individuo es homocigota. Los individuos homocigotas dominantes y heterocigotas (LL y Ll), serán fenotípicamente iguales pues manifestarán el mismo carácter (semilla lisa), pero genotípicamente diferirán ya que uno tendrá dos alelos iguales y el otro uno de cada clase. Se debe distinguir claramente entre lo que es efecto del gen (generalmente una proteína enzimática), y el propio gen (segmento de ADN). Simbolizamos con la letra “ele “ mayúscula al locus para forma de semilla, y a los genes correspondientes a dicho locus: L = alelo dominante para semilla lisa l = alelo recesivo para semilla rugosa. Del mismo modo se hace con otros pares de alelos y así se abrevia la designación del gen responsable del carácter o efecto. Para distinguir entre la apariencia de un individuo y los factores genéticos que la producen, se utilizan los términos: genotipo= es la constitución genética nuclear de un individuo, es decir el material genético que un individuo posee, y que ha heredado de sus progenitores y puede estar referido a uno solo, a varios o a todos los caracteres diferenciales del individuo. fenotipo= es la manifestación externa o aparente del genotipo; se refiere a múltiples apariencias biológicas, entre las que se incluyen características químicas, estructurales y de comportamiento que pueden ser observadas ya sea a simple vista o por otros métodos más complejos. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 2 Así para el ejemplo de la semilla lisa o rugosa tenemos tres genotipos posibles, a saber: LL Ll homocigota dominante heterocigota ll homocigota recesivo En este caso el genotipo se refiere a un sólo carácter. Como el gen L es dominante tendremos: LL y Ll: estos genotipos se manifiestan fenotípicamentede la misma manera, es decir que ambos tendrán semilla lisa. Se simbolizan como L-. ll : este genotipo tendrá semillas rugosas. Cabe hacer la aclaración de que un individuo homocigota para un par de genes, no tiene que serlo necesariamente, para otro par. Por ejemplo LL Aa: este individuo es homocigota para el carácter forma de semilla, y heterocigota para el carácter color de cotiledón. Genotipo y ambiente El ambiente en que se desarrollan los organismos vivos no es siempre el mismo, y la acción génica no produce siempre el mismo fenotipo bajo cualquier circunstancia, sino que el fenotipo resulta de la interacción con un determinado ambiente. Distinguimos así: Norma de reacción: se denomina norma de reacción de un genotipo a los distintos fenotipos que puede desarrollar en distintos ambientes, es decir, que es la amplitud de variación fenotípica potencial de un genotipo en distintos ambientes. Un ejemplo es la experiencia realizada con ovejas. Durante cierto período de años se criaron muestras de cuatro razas en tres ambientes diferentes (A, C y D) con patrones estacionales y pluviométricos distintos. Como se ve en el cuadro siguiente, la cantidad de lana producida dependía tanto del ambiente particular en el que se criaba la raza, como de la misma raza. El ambiente A, por ejemplo, producía una cantidad comparativamente superior de vellón en la raza F, que en cualquiera de las otras, pero esta relación se invertía en el ambiente D. La raza B se comportaba relativamente bien en el ambiente C, pero bastante mal en el ambiente A. Unicamente la raza A parecía producir una cantidad relativamente uniforme de vellón en cualquiera de los ambientes. Por lo tanto, si quisiéramos seleccionar un genotipo que diera su máximo en el ambiente A, elegiríamos indudablemente el genotipo F. Sin embargo, para un buen comportamiento en todos los ambientes deberíamos elegir los genotipos A ó B. Cuadro de la experiencia realizada con ovejas: los datos se refieren a la cantidad de lana producida por cada raza en los diferentes ambientes, tomados como desviación del peso medio del vellón de cada raza en los tres ambientes diferentes. (Strickberger, M.W. "Genética".1982). Ambientes A B C Raza F Raza S +0,51 -0,10 -0,10 -0,30 -0,42 +0,39 Raza B -0,19 +0,18 -0,03 Raza A -0,08 +0,06 +0,02 Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 3 Fenocopia: se denominan fenocopias a las modificaciones fenotípicas no hereditarias producidas por condiciones ambientales especiales que dan un fenotipo atribuible a un determinado genotipo, que no está presente en el individuo. A estos individuos se los denomina fenocopias, es decir que es una alternativa ambiental de la manifestación de un genotipo que copia el fenotipo de otro genotipo. Ejemplos: Los diabéticos que dependen de la insulina son fenocopias de los individuos normales, en el sentido de que el ambiente químico evita el efecto de la enfermedad. Si sus descendientes heredan la diabetes, tendría que administrarse nuevamente el tratamiento fenocópico con insulina para conseguir el fenotipo normal.. Por lo tanto, el tratamiento con insulina no cambia en nada el genotipo diabético. Otro ejemplo es el caso de la presencia de granos en la panoja de maíz que se manifiestan en condiciones climáticas determinadas, y que son una fenocopia del fenotipo producido por el gen Ts (tassel seed). Principios mendelianos Gregor Mendel nació en el año 1822 , en 1847 se ordenó como sacerdote en el monasterio Agustino de Brün; alli llevó a cabo las experiencias que le permitieron enunciar sus principios. La especie con que trabajó fue Pisum sativum, una planta anual, autógama, en la cual estudió diversos caracteres, entre ellos: forma de la cubierta seminal (lisa, rugosa), altura de plantas (altas, enanas), color de los cotiledones (amarillos, verdes), color de la cubierta sminal (gris, blanca), color de flor ( violeta, blanca), tipo de vainas (llenas, constreñida), color de vainas (verdes, amarillas), vainas y flores axiales a lo largo del tallo o vainas y flores terminales. Mendel al cruzar plantas de una variedad de semillas lisas con plantas de otra variedad de semillas rugosas, encontró que todas las plantas obtenidas en la descendencia tenían semillas lisas. La generación en la cual se cruzan los padres se llama generación paterna o P1, y su descendencia es la primera generación filial o F1, las generaciones sucesivas obtenidas por autofecundación, se denominan F2; F3; etc.. En todos los caracteres utilizados por Mendel para sus experiencias observó que la F1 era de un solo tipo e igual a uno de los padres. Si se dejaba autofecundar la F1, en F2 aparecían individuos de los dos fenotipos paternos. Es decir que si tomamos el caracter forma de semilla, las semillas lisas de la F1 al ser sembradas y autofecundarse daban plantas de semillas lisas y rugosas, las cantidades fueron 5474 plantas de semillas lisas y 1850 plantas de semillas rugosas, esto se aproxima a la proporción 3:1; que puede expresarse como 3/4 : 1/4; ó 0,75 : 0,25 ; ó 75% : 25%. El factor que determina uno de los caracteres (ej.semilla rugosa) debería estar escondido en F1 pero no destruído ya que reaparece en F2. Este fenómero por el que un factor se manifiesta y otro no, estando presentes ambos se llama dominancia. De acuerdo a los resultados obtenidos el factor para semilla lisa (L), estaba presente en la F1 (híbrido) ya que todas las plantas tenían semillas lisas, pero también debían contener el factor para semilla rugosa (l) pues en F2 aparecían plantas de semillas rugosas. Para determinar cuantos factores (L y l) estaban contenidos en cada planta, Mendel sembró plantas de F2 y observó su descendencia. De las semillas rugosas sembradas obtuvo siempre plantas con semillas rugosas ( o sea que no contenían el factor L). Al sembrar semillas lisas observó que de algunas solo se obtenían plantas de semillas lisas ( no contenían l) y otras Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 4 producían plantas de semillas lisas y rugosas en una proporción aproximada a 3:1, es decir que estaban contenidos los dos factores. Esto puede explicarse considerando dos factores presentes en cada planta para el carácter. Las plantas que solo producían semillas rugosas tenían dos factores l, las que producían solo semillas lisas tenían dos factores L, en estos dos casos los gametos producidos por cada individuo serán de un solo tipo y por autofecundación darán siempre una descendencia igual a la planta madre, a estos individuos, se los denomina líneas, líneas puras, razas puras o cepas. Las plantas que daban en su descendencia individuos con los dos tipos de semillas, tenían un factor de cada clase (L y l) y producían gametos portadores de L unos, y de l otros en igual proporción, por autofecundación darán una descendencia que responderá a la relación 3 individuos de semillas lisas por cada individuo de semillas rugosas. En otros experimentos, Mendel cruzó individuos que diferían en dos y en tres caracteres. Así al cruzar plantas que tenían semillas lisas y cotiledón amarillo por plantas de semillas rugosas y cotiledón verde, obtuvo los siguientes resultados: P F1 F2 AA BB x aa bb lisa, amarilla rugosa, verde Aa Bb lisa, amarilla 315 101 108 32 autofecundación lisa, amarilla rugosa, amarilla lisa, verde rugosa, verde En F2 aparecieron todas las combinaciones posibles, lo mismo ocurrió cuando trabajó teniendo en cuenta tres caracteres. A partir de las experiencias descriptas anteriormente, y de acuerdo a las conclusiones establecidas por Mendel, se llega a las siguientes leyes o principios: Primera ley de Mendel o principio de la uniformidad en F1. Cuando se cruzan dos líneas o razas puras (homocigotas) que difieren en un determinado carácter, todos los individuos de la primera generación filial F1, presentan el mismo fenotipo independientemente de la dirección del cruzamiento (cruzamiento recíproco) y este fenotipo coincide con el que manifiesta uno de los padres. Al carácter que se manifiesta, se lo denomina dominante, y recesivo al que queda enmascarado. Esquemáticamente, simbolizando a los genes respondables del carácter con "A" al gen dominante y "a" al gen recesivo es: P G F1 AA x aa amarillo verde A a Aa amarillo ó aa x verde a AA amarillo A Aa amarillo Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 5 Segunda ley de Mendel o principio de la segregación.. Los caracteres recesivos enmascarados en la F1 heterocigota de un cruzamiento entre dos líneas puras (homocigotas) reaparecen en la F2 con una proporción específica de 1:3 debido a que los miembros de una pareja alélica se separan (segregan) uno de otro, sin sufrir modificación alguna cuando un híbrido heterocigota forma las células germinales o gametas. Esquemáticamente sería: P AA x amarillo aa verde F1 Aa amarillo G A a autofecundación F2 (A + a) (A + a) = AA + 2 Aa + aa amarillo amarillo verde 3/4 1/4 3 amarillos : 1 verde Tercera ley de Mendel o principio de combinación independiente. Los miembros de parejas alélicas diferentes se distribuyen o combinan independientemente unos de otros, cuando se forman las gametas de un individuo híbrido para los caracteres correspondientes. Esquemáticamente sería: P G AA BB x aa bb AB F1 G ab Aa Bb AB Ab aB ab Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 6 F2 Gametos F1 Gametas F1 AB Ab aB ab AB Ab aB ab AABB AABb AaBB AaBb AABb AAbb AaBb Aabb AaBB AaBb aaBB aaBb AaBb Aabb aaBb aabb Segregaciones mendelianas en distintos cruzamientos Si consideramos una sola pareja alélica, la F1 proveniente del cruzamiento de dos líneas puras es un MONOHIBRIDO. Al autofecundarse la F1, dará una F2 segregante en la cual encontraremos las siguientes proporciones fenotípicas y genotípicas: P AA G A x a F1 (monohíbrido) G aa A Probabilidad de cada gameta ½ Aa autofecundación a ½ Para obtener las proporciones fenotípicas y genotípicas en F2 hay dos métodos: - Cuadrado de Punnett o tablero de ajedrez. F2 ½A ½a ½A ½a ¼ AA ¼ Aa ¼ Aa ¼ aa Proporción genotípica= ¼ AA : ½ Aa : ¼ aa Proporción fenotípica= 3/4 A- : 1/4 aa Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 7 - Método dicotómico. ½ A ¼ AA ½A ½ a ¼ Aa ½ A ¼ Aa ½a ½ a ¼ aa Proporción genotípica= 1/4 AA : 1/2 Aa : 1/4 aa Proporción fenotípica= 3/4 A- : 1/4 aa El cruzamiento de la F1 por uno de sus padres se denomina retrocruza. La retrocruza puede hacerse por el padre homocigota dominante, y la descendencia será: P G Aa x A F1 AA a A AA Aa Proporción genotípica= 1/2 AA : 1/2 Aa Proporción fenotípica= 100% A- Todos los individuos son fenotípicamente iguales. Si la retrocruza es por el progenitor recesivo, tenemos: P G A F1 Aa x aa a Aa a aa Proporción genotípica = 1/2 Aa : 1/2 aa Proporción fenotípica = 1/2 A- : 1/2 aa A este cruzamiento (por el progenitor recesivo) se lo denomina cruzamiento prueba, y se lo utiliza para conocer la naturaleza genética del individuo, a través del análisis de su descendencia. Si consideramos dos parejas alélicas ubicadas en cromosomas diferentes, la F1 proveniente del cruzamiento de dos líneas puras dará un dihíbrido. Tomando como ejemplo los caracteres color de cotiledón ubicado en el par cromosómico tres (que simbolizaremos con A) y la altura de planta ubicado en el par cromosómico cinco (que Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 8 simbolizamos con B); para obtener la F1 del cruzamiento AA BB x aa bb, debemos saber que tipos de gametos producen los padres. Para el caso del homocigota dominante las gametas producidas serán AB y para el caso del homocigota recesivo las gametas producidas serán ab. Ambos homocigotas dan un solo tipo de gametas con un representante de cada par cromosómico. Entonces del cruzamiento inicial la F1 será: P G AA BB x aa bb AB F1 (dihíbrido) ab AaBb Vemos que se obtienen cuatro tipos distintos de gametas, AB, Ab, aB, ab. O sea que los cromosomas se han combinado al azar en la meiosis, lo que implica que segregan independientemente. Los gametos pueden obtenerse por el método dicotómico, de la siguiente manera: ½ B ¼ AB ½A ½ b ¼ Ab ½ B ¼ aB ½a ½ b ¼ ab Al autofecundarse la F1 dihíbrida Aa Bb, tendremos la descendencia o F2, cuyas proporciones pueden obtenerse a través de: * Cuadrado de Punnett ó tablero de ajedrez: F2 Gametos F1 Gametas F1 1/16 AA BB 2/16 AA Bb 1/16 AA bb ¼ AB ¼ Ab ¼ aB ¼ ab ¼ AB ¼ Ab ¼ aB ¼ ab 1/16 AABB 1/16 AABb 1/16 AaBB 1/16 AaBb 1/16 AABb 1/16 AAbb 1/16 AaBb 1/16 Aabb 1/16 AaBB 1/16 AaBb 1/16 aaBB 1/16 aaBb 1/16 AaBb 1/16 Aabb 1/16 aaBb 1/16 aabb 2/16 Aa bb 1/16 aa BB 4/16 Aa Bb 2/16 aa Bb 2/16 Aa BB 1/16 aa bb Proporción genotípica de F2: 1: 2: 1: 2: 4: 2: 1: 2: 1 Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 9 9/16 A- B- amarillos altos 3/16 A- bb amarillos bajos 3/16 aa B- verdes altos 1/16 aa bb verdes bajos Proporción fenotípicas de F2: 9: 3: 3: 1 * Método dicotómico: - Para Genotipos 1 AA 1 BB 1 AA BB 2 Bb 2 AA Bb 1 bb 1 AA bb 2 Aa 1 BB 2 Aa BB 2 Bb 4 Aa Bb 1 bb 2 Aa bb 1 aa 1 BB 1 aa BB 2 Bb 2 aa Bb 1 bb 1 aa bb Proporción genotípica: 1: 2: 1: 2: 4: 2: 1: 2: 1 - Para fenotipos. 3 B- 9 A- B3 A1 bb 3 A- bb 3 B- 3 aa B1 aa 1 bb 1 aa bb Proporción fenotípica: 9: 3: 3: 1 Si consideramos más de dos parejas alélicas el razonamiento es el mismo, siempre que las parejas se hallen en cromosomas diferentes. Si el individuo tiene tres pares de genes al estado heterocigota se denomina trihíbrido, si posee cuatro tetrahíbrido y así sucesivamente. A medida que aumenta el número de caracteres en análisis, mayor será la cantidad de individuos diferentes que aparecerán en la F2. El próximo cuadro nos permite obtener los datos de la F2 en forma rápida, según el número de pares heterocigotas tenidos en cuenta. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana Nºde pares heterocigotas Nºde gam. diferentes 1 2 3 n 2 4 8 2n Nºde indiv. en F2 Nºde genot. 4 16 64 4n 3 9 27 3n 10 Nºde fenot. 2 4 8 2n Análisis estadístico aplicado al mendelismo. La constitución genética de un individuo es un suceso aleatorio que depende de la combinación al azar de los gametos paterno y materno, y cada gameto se origina con una determinada probabilidad. Por esto una segregación, por ejemplo en F2, deberá ajustarse más o menos a un modelo teórico, pero es muy difícil que los resultados obtenidos en las experiencias coincidan exactamente con los esperados. Se utiliza entonces una técnica estadística conocida como método de Ji-cuadrado para determinar si los resultados obtenidos se ajustan o no al modelo teórico. Si los resultados numéricos obtenidos experimentalmente son O1; O2;...On ( Oi=N) y los resultados esperados según el modelo teórico eran E1; E2; ...En, el valor de Ji-cuadrado viene dado por: X² = (Oi-Ei)² = di ² Ei Ei Es decir, que Ji-cuadrado es la suma de los cuadrados de las desviaciones entre los valores observados y esperados. Valores Observados Esperados Desviación O1 O2 Oi On E1 E2 Ei En d1 d2 di dn X²= d1² + d2² +....+ di² = dn² E1 E2 . Ei En Este valor Ji-cuadrado, que mide desviaciones se convierte en un valor de probabilidad P (de que estas desviaciones se produzcan por azar) mediante tablas. La probabilidad P, significa que si se volviera a repetir el experimento otras veces, se verían un (100 x P)% de casos en los que los datos observados se apartarían de lo esperado igual que la primera vez. Si el valor de Ji-cuadrado obtenido corresponde a un valor P> 0,05 se acepta, desde el punto de vista estadístico, que las desviaciones entre los resultados observados y los esperados se deben al azar, es decir, no difieren significativamente. Si P < 0,05 quiere decir que la observación realizada difiere significativamente de la esperada. Para calcular P en las tablas, hay que tener en cuenta los grados de libertad, que son tantos como clases estamos considerando menos uno. Así en una F2, trabajando con un solo par de alelos (A, a) con dominancia completa, el número de clases es dos (fenotipos A- y a), y los grados de libertad, uno. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 11 Como ejemplo para aplicar esta técnica tomemos uno de los experimentos realizados por Mendel, quien en un cruzamiento prueba obtuvo los siguientes resultados: aa bb x Aa Bb 24 A-B-: 25 A-bb : 22 aa B- : 26 aa bb Fenotipos A- BA- bb aa Baa bb Total Observados O 24 25 22 26 97 Esperados E 97 x ¼ = 24,25 97 x ¼ = 24,25 97 x ¼ = 24,25 97 x ¼ = 24,25 Desviación (O – E)2 (O – E)2 O-E E - 0.25 0.0625 0.002 0.75 0.5625 0.023 - 2.25 5.0625 0.207 1.75 3.0625 0.125 0.36 Para el valor X²=0,36 con tres grados de libertad (GL) corresponde un P = 0,95, es decir que no hay diferencias significativas, y las desviaciones se debieron al azar. También se puede observar en tabla para P= 0,05 (límite) y los GL correspondientes, cual es el valor de X² tabulado (X²t) si el X² calculado (X²c) es menor que el de tabla aceptamos que la diferencia es no significativa. Gráficamente: Zona de aceptación X²c= 0,36 Zona de rechazo X²t= 7,82 Para poder utilizar el método de X² se debe trabajar con frecuencias absolutas, no con frecuencias relativas (probabilidades o porcentajes), en este último caso primero hay que transformarlas a frecuencias absolutas. Cuando la frecuencia esperada de alguna clase es menor a 5 el test no se puede aplicar correctamente, y si están comprendidas entre 5 y 10 se debe aplicar la corrección de Yates, por tratarse de una muestra pequeña. X²= (di - o,5 )² Ei El método de X² puede utilizarse para realizar pruebas de heterogeneidad. Cuando un determinado experimento se realiza varias veces (en distintos laboratorios, con materiales de distinta procedencia, con distintos materiales, etc.) se obtienen varios resultados y se determina estadísticamente si las diversas repeticiones han dado un resultado homogéneo como respuesta al mismo fenómeno genético. En este caso la suma de los X² de cada experimento es otro X² con un número de GL igual a la suma de los GL correspondientes a cada experimento. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 12 Tomemos como ejemplo un cruzamiento entre heterocigotas para un carácter monogénico, que fue repetido tres veces en Petunia con los siguientes resultados: Fenotipos Aaa 374 122 96 29 122 31 Caso 1 2 3 X² X²de la suma 592 X² heterogeneidad 182 X2 GL 0.0431 0.216 1.832 2.0911 0.9112 1.1799 1 1 1 3 1 2 P = 0.70 En tabla X2 de tabla para 2 GL y 5% de probabilidad es 5,99. X2 calculado es menor que el de tablas. Se deduce que los experimentos son homogéneos. Interacciones génicas. Interacciones génicas intralélicas. Variaciones de la dominancia. En sus experiencias Mendel postuló que la F1 del cruzamiento de dos líneas puras manifestaba uno u otro de los caracteres parentales, el carácter dominante. Sin embargo experiencias posteriores señalaron la posibilidad de que el híbrido muestre un fenotipo diferente al de los padres. Un ejemplo se da en Antirrhinum mayus, cuando al cruzar una planta homocigota de flores rojas por otra planta homocigota de flores blancas, la F1 da plantas de flores rosadas, y en la F2 aparecen individuos de flores blancas, rosadas y rojas en una proporción 1: 2: 1: . A este caso se lo denomina dominancia incompleta. Esquemáticamente: P AA fl.rojas F1 F2 x aa fl.blancas Aa fl.rosadas AA 1 Fl.rojas Aa Aa 2 fl.rosadas aa 1 fl.blancas Cuando al realizar un cruzamiento entre dos líneas puras, se obtiene en F1 un híbrido cuyo fenotipo es una combinación del de ambos padres se dice que existe codominancia. En este caso ambos alelos se manifiestan fenotípicamente. Un ejemplo se dá en los pollos de raza Andalucian cuando al cruzar individuos blancos por individuos negros, se obtienen los llamados pollos azules, que en realidad presentan un fino mosaico de áreas blancas y negras que le dan el aspecto de color azul. Esquemáticamente: Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana P BB x pollos negros F1 F2 13 bb pollos blancos Bb pollos azules BB Bb Bb bb 1 2 1 pollos negros pollos azules pollos blancos Podemos notar que para ambos casos, dominancia incompleta y codominancia, la proporción fenotípica expresada en F2 es 1:2:1 , diferente a la postulada por Mendel. Alelismo múltiple. Hasta ahora hemos considerado para cada locus un par de alelos (por ejemplo semilla lisa y semilla rugosa, L ó l) ubicado uno en cada uno de los cromosomas homólogos. Pero aunque el individuo sea diploide y lleve dos alelos por vez, es posible que existan para ese locus más de dos alelos posibles, en este caso el locus presenta el fenómeno de alelismo múltiple y el conjunto de alelos que pertenecen a dicho locus se denomina serie alélica. Los alelos múltiples responden a las reglas de transmisión establecidas por Mendel, y se pueden representar de diferentes maneras: - Con letra mayúscula sin subíndice el alelo dominante, respecto a todos los demás de la serie, y con letra minúscula sin subíndice al recesivo de toda la serie. Los demás alelos se representan con mayúscula y subíndice o supraíndice. El menor subíndice o supraíndice indica una mayor relación de dominancia sobre un índice mayor. Por ejemplo para una serie de cinco alelos sería: A > A1 > A2 > A3 > A4 > a. - Con una letra común y un exponente o subíndice que corresponde a la abreviatura del fenotipo que dicho alelo determina. El primer alelo de la serie lleva el exponente + y el último no lleva ninguno. Por ejemplo la serie alélica para color de ojos en Drosophila melanogaster es: W+ > Wco > Wbl > We > Wch > Wa > Wh > Wbf > Wt > Wp > Wi > W - Con una letra mayúscula, sin exponente para el primer alelo, con un exponente que es la abreviatura del fenotipo para los otros alelos , y con una letra minúscula el recesivo de la serie. Por ejemplo para el color de pelaje en conejos sería: C > Cch > Cm > Ch > c Genotipos C C; C ; C Cm ; C Ch ; C c Cch Cch ; Cch Cm ; Cch Ch ; Cch c Cm Cm; Cm Ch ; Cm c Ch Ch; Ch c cc Cch Fenotipos silvestre chinchilla marta himalaya albino Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 14 Para el caso de series alélicas con relación de dominancia entre todos los alelos, el número de fenotipos posibles resulta igual al número de alelos de la serie; y el número de genotipos posibles puede obtenerse a través de la fórmula n(n+1)/2 siendo n el número de alelos de la serie. En vegetales tenemos como ejemplos de series alélicas: * la distribución del color rojo vinoso en la semilla de poroto (Phaseolus vulgaris), cuya serie alélica es: circundatus striatus uniforme Rm > Rcir > Rres > Rst > Rrho > R > r marmoratus respersus rhomboideus blanco * la variegación blanca en las hojas de trébol (Trifolium repens), producida por una serie de siete alelos. * en el hombre se da en la determinación de los grupos sanguíneos por el sistema ABO; la serie está constituida por tres alelos, dos de ellos codominantes: IA = IB > i genotipos fenotipos IA IA; IA i................................A IB IB; IB i................................B IA IB........................................AB ii...............................................O Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 15 Penetrancia y expresividad El fenotipo de un individuo es la expresión de su constitución genética o sea de su genotipo. En esta manifestación el ambiente juega un papel más o menos importante según las circunstancias. Se define penetración o penetrancia como la frecuencia o porcentaje con que un gen dominante o un gen recesivo se manifiesta en el fenotipo de los individuos que lo portan (en homocigosis para el caso de los alelos recesivos), como consecuencia de la interacción entre el fenotipo y el ambiente. Expresividad es la fuerza con que se manifiesta un determinado gen penetrante. Puede ser ligera, intermedia o fuerte. Un ejemplo es el caso de ojos Lobe en Drosophila melanogaster, que es una mutación dominante. En heterocigosis el carácter se presenta tan solo en el 75% de los individuos, aunque todos llevan el gen Lobe, o sea que dicho gen tiene una penetración del 75%. En cuanto a la expresividad de este gen su efecto puede variar desde la ausencia total de ojos hasta casi el tamaño normal. Factores letales y deletéreos Los genes letales dan proporciones genotípicas y fenotípicas distintas a las esperadas. Se llama factor letal o letal a un gen cuya presencia en el genotipo (en dosis activas), dificulta el desarrollo normal del individuo que lo posee, produciéndole la muerte antes de la madurez sexual. Cuando el gen no produce la muerte del individuo, pero disminuye su valor adaptativo o capacidad para sobrevivir y reproducirse, se llama deletéreo. Los letales pueden clasificarse según: El grado de penetración: - letales propiamente dichos: producen la muerte de todos los individuos (o por lo menos del 90%) que llevan el factor letal en dosis activas en sus genotipos. - semiletales: producen la muerte de más del 50% de los individuos que los llevan en dosis activas (y menos del 90%). - subvitales o detrimentales: la proporción de portadores muertos es del 10 al 50 %. - cuasinormales: muere menos del 10% de los individuos. Fase de actividad: - gaméticos: producen la muerte o no funcionalidad de los gametos que lo portan. - cigóticos: la muerte se produce después de formado el cigoto, a lo largo de su desarrollo, pero antes de que el individuo alcance su madurez sexual. Influencias ambientales externas e internas: - no condicionales: su penetrancia y expresividad no pueden ser influídas experimentalmente. - condicionales: su acción puede ser modificada por condiciones ambientales o bien por el propio desarrollo. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 16 Según su localización: - letales autosómicos: tienen sus loci en cromosomas no sexuales (autosomas). - letales ligados al sexo: tiene sus loci en cromosomas sexuales. Según su dominancia y recesividad: - letales dominantes: producen el efecto letal tanto en homocigosis como en heterocigosis. No pueden ser letales propiamente dichos a menos que sean condicionales, pues sino el mutante desaparecería con el individuo en que apareciera por primera vez. - letales recesivos: producen el efecto letal en homocigosis o en hemicigosis (en una sola dosis pero sin el alelo dominante). Los letales recesivos son los más comunes en las poblaciones naturales. - gen dominante con efecto letal recesivo: son letales en homocigosis, y el heterocigota tiene un fenotipo diferente del homocigoto recesivo normal. Ejemplo, el gen creeper (Cp) en gallinas. Cp Cp= produce acortamiento de los huesos largos de las extremidades. Mueren al cuarto día de incubación. Cp cp= fenotipo con patas y alas cortas. cp cp= normal. Interacciones génicas interalélicas. Epístasis. Se denomina así a la interacción entre genes alélicos o no alélicos del mismo genotipo en la producción de un fenotipo determinado. El caso más simple es el de una sola pareja alélica, que ya hemos visto bajo la forma de dominancia y sus variaciones. Nos referiremos ahora a la interacción génica que se produce cuando dos parejas alélicas influyen sobre un mismo carácter. Como consecuencia de la interación puede haber modificaciones en la segregación fenotípica de la F2 de un cruzamiento entre dos individuos homocigotas que difieren en dos pares de genes: 1)-Interacción sin modificación de la proporción 9 : 3 : 3 : 1. En estos casos la modificación de la F2 mendeliana consiste en la aparición de nuevos fenotipos, pero la segregación sigue siendo 9 : 3 : 3 : 1. Un ejemplo se presenta en Brassica oleracea (col) para el carácter color de planta. P F1 F2 AA bb x amarillas aa BB rojas Aa Bb púrpura A- BA- bb aa Bpúrpuras amarillas rojas 9 : 3 : 3 : aa bb verdes 1 El color verde puede deberse a la falta de un pigmento que enmascare al pigmento clorofílico. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 17 2)-Interacción con modificación de la proporción 9 : 3 : 3 : 1. Esto ocurre cuando un gen (epistático) suprime la acción de otro gen (hipostático) no alélico con él. A esta interacción génica no recíproca se la llama epistasia o epístasis. Existen varios casos de epístasis, a saber: 1) Dominante Epístasis simple 2) Recesiva 1) Dominante Epístasis doble 2) Recesiva 3) Dominante y recesiva Antes de explicar cada caso debemos tener en cuenta la hipótesis de un gen-una enzima (Beadle y Tatum. 1941). Cada gen (ADN) tiene como función producir una enzima en el proceso de biosíntesis, dicha enzima actuará en una determinada etapa de una vía metabólica. Vamos a suponer que las parejas alélicas consideradas afectan a pasos distintos de la misma vía metabólica, en la cual partiendo de un producto precursor o producto inicial (P) se obtiene, por medio de la actividad enzimática de la pareja alélica (A, a) un producto intermedio (I) que sirve de sustrato a la actividad enzimática determinada por la otra pareja alélica (B, b), y se transforma en el producto final (PF). Gráficamente: gen A gen B enz. P enz. I PF enz. enz. gen a gen b I.-Epístasis simple. 1) Dominante: se da cuando el alelo dominante de una pareja alélica, suprime la acción de la otra pareja alélica. La segregación 9 : 3 : 3 : 1 se convierte en 12 : 3 : 1. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 18 Un ejemplo hipotético, puede ser el color de las glumas, en el cual el gen A impide la transformación del producto inicial en producto intermedio, o sea que se corta la vía metabólica, por lo tanto no permite la manifestación de cualquiera de los miembros de la otra pareja alélica. Si en cambio se encuentra presente el alelo recesivo a, permite la manifestación de la otra pareja alélica. De esta última el gen B produce una enzima que transforma el producto intermedio en pigmento amarillo, y el gen b da como producto final un pigmento negro. Es decir que: A= impide la formación del producto intermedio, por lo que las glumas serán incoloras. Es el gen epistático. a= permite la formación de producto intermedio. B= da color amarillo. Gen hipostático. b= da color negro. Gen hipostático. Si representamos la vía metabólica: gen A gen B enz. enz. P PF incoloro PF amarillo PF negro I enz. enz. gen a gen b El cruzamiento sería: P F1 AA bb x aa BB incoloro amarillo Aa Bb incoloro Proporción fenotípica F2 9 A- B12 incoloros 3 A- bb 3 aa B- 3 amarillos 1 aa bb 1 negro Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 19 2) Recesiva: en este caso el alelo recesivo de una pareja alélica suprime o inhibe la acción de la otra pareja. La proporción fenotípica es 9 : 3 : 4 . Un ejemplo sería el albinismo en animales. A= permite la síntesis de melanina. a= bloquea la síntesis de melanina. Epistático. B= da color gris. b= da color amarillo. La vía metabólica es: gen A gen B enz. enz. P PF gris PF amarillo PF blanco I enz. enz. gen a gen b El cruzamiento es: P F1 F2 AA bb x aa BB gris blanco Aa Bb gris x Aa Bb Proporción fenotípica 9 A- B9 grises 3 A- bb 3 amarillos 3 aa B4 blancos 1 aa bb Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 20 II.- Epístasis doble. 1) Dominante (genes duplicados): cualquiera de los miembros dominantes es suficiente para originar el mismo producto final. La proporción fenotípica es 15 : 1 . Es decir que ambos alélos dominantes actúan como epistáticos. gen A gen B enz. enz. P PF gris PF amarillo PF blanco I enz. enz. gen a gen b Un ejemplo puede darse en el caso de que los alelos dominantes de las dos parejas alélicas determinen la producción de clorofila, entonces al cruzar: P AA bb x aa BB verde verde F1 Aa Bb verde Proporción fenotípica F2 9 A- B3 A- bb 3 aa B1 aa bb 15 verdes 1 blanco 2) Recesiva (genes complementarios): en este caso para que se manifieste un determinado carácter es necesaria la presencia simultánea de los miembros dominantes de ambas parejas. Es decir que los dos alelos recesivos son epistáticos. La proporción fenotípica resultante es 9 : 7 . Un ejemplo se da para el carácter color de flor del guisante dulce, en donde: A= permite la formación del producto intermedio. a= no permite la formación del producto intermedio. B= permite la formación del producto final. b= no permite la formación del producto final. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 21 Esquemáticamente: gen A gen B enz. enz. P PF gris PF amarillo PF blanco I enz. enz. gen a gen b Representando el cruzamiento: P AA bb x aa BB blanca blanca F1 Aa Bb púrpura Proporción fenotípica 9 A- B9 púrpura 3 A- bb 3 aa B7 blancas 1 aa bb F2 3) Dominante y recesiva: los genes epistáticos son el miembro dominante de una pareja alélica y el recesivo de la otra. La proporción fenotípica que se obtiene es 13 : 3 . Esquemáticamente: gen A gen B enz. P enz. PF gris PF amarillo PF blanco I enz. enz. gen a gen b Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 22 Un ejemplo se presenta en gallinas con las parejas alélicas (C,c) e (I,i), en donde: C= produce pigmentación c= no produce pigmento I= inhibe la producción de pigmento i= produce pigmentación Representando un cruzamiento: P CC II x Leghorn blanca F1 cc ii Wyandotte blanca Cc Ii x Cc Ii Proporción fenotípica F2 9 C- I3 cc I1 cc ii 3 C- ii 13 blancas 3 pigmentadas Resumiendo Genotipos Tipo de interacción A- B- A- bb aa B- aa bb Sin epístasis 9 3 3 1 3 1 Simple dominante Epístasis Simple recesiva 4 9 Doble dominante Doble recesiva Doble dominante recesiva 3 4 15 1 9 7 3 13 Pleiotropía En el punto anterior vimos como varios genes no alélicos afectaban al mismo carácter produciendo fenómenos de interacción y epístasis. La pleiotropía puede considerarse como el caso contrario, es decir, que un gen produce a nivel fenotípico efectos múltiples (polifenia), aparentemente no relacionados entre sí. Se sabe que la acción génica primaria es única (un gen-una enzima), lo que lleva a pensar que los efectos pleiotrópicos de los genes son una consecuencia de la complejidad del metabolismo celular y del desarrollo. Es decir que un gen produce una enzima determinada, pero esta enzima actúa en más de una vía metabólica por lo que el gen queda involucrado en la expresión de más de un carácter. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 23 Ligamiento y recombinación. El enunciado de la tercera ley de Mendel o principio de la combinación independiente, dice que los miembros de parejas alélicas diferentes (A,a y B,b) se distribuyen o combinan independientemente unos de otros cuando se forman los gametos. Por esto un individuo dihíbrido (Aa Bb), en el cual los genes A y B tienen sus loci en distintos cromosomas producirá los siguientes gametos en igual proporción: ¼ AB; ¼ Ab; ¼ aB; ¼ ab. Pero en el caso de que las parejas alélicas consideradas tengan sus loci en el mismo cromosoma se dice que existe ligamiento, y dichos pares de genes y por ende los caracteres que ellos determinan, están ligados. Como consecuencia de esto ambos genes tienden a presentarse juntos en las gametas en la mayoría de los casos. Solo aparecerán las combinaciones cuando en la meiosis se produzca un entrecruzamiento entre los loci de ambas parejas. Se denomina grupo de ligamiento al conjunto de genes que tienen sus loci en el mismo cromosoma. Así es que cada especie tendrá tantos grupos de ligamiento como número haploide de cromosomas. Si los genes que consideramos están en el mismo cromosoma, se esquematizan de la siguiente manera: A B a b ó A a B b En el caso de un individuo dihíbrido, cuyo genotipo es Aa Bb, pueden presentarse dos situaciones genéticas diferentes: * Fase de acoplamiento: cuando los genes dominantes se presentan sobre el mismo cromosoma y por lo tanto los recesivos se ubican en el cromosoma homólogo. A B a b ó A a B b * Fase de repulsión: en un cromosoma están el gen dominante de una pareja y el recesivo de la otra, y en el cromosoma homólogo se presentan el recesivo del primero y el dominante del segundo. A b a B ó A a b B El ligamiento entre dos pares de genes ubicados en el mismo cromosoma puede ser: Completo: cuando están tan próximos en el cromosoma que difícilmente se produzca un entrecruzamiento entre ellos. Los caracteres producidos por estos pares de genes aparecerán siempre juntos. El ligamiento completo es raro en especies de reproducción sexual. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 24 Incompleto o con entrecruzamiento: si bien las dos parejas alélicas están en el mismo cromosoma, se puede producir entre ellos entrecruzamiento (aunque no necesariamente en todas las meiosis), es decir que los genes se transmiten con independencia unos de otros, al menos parcialmente. Aunque siempre aparecerá en la descendencia una mayor proporción, con respecto a lo esperado, de individuos de tipo parental. No ligados: los loci genéticos están demasiado apartados en el cromosoma de manera que la probabilidad de que se dé un entrecruzamiento entre éstos es del 100%, entonces el 50% de los gametos será de tipo parental y 50% de tipo recombinante. Cuando tales individuos dihíbridos se someten a un cruzamiento prueba, se espera que produzcan una descendencia en una proporción 1: 1: 1: 1: como podría esperarse de genes localizados en diferentes cromosomas. Graficando la meiosis veremos qué tipos de gametas se producen en cada caso: Fase de acoplamiento: I) No se da entrecruzamiento: A B A B A B a b a a b b Duplicación ADN Anafase I A B A B a b a b Anafase II A B A B a b a b Se producen dos tipos de gametas: AB y ab que se denominan parentales ya que presentan la misma combinación alélica que el dihíbrido del cual provienen. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 25 II) Sí se da entrecruzamiento: A B a b Duplicación del ADN A B A B a b a b A B A b a B b b Entrecruzamiento Anafase I A B A b a B b b Anafase II A B A b a B a b Se producen cuatro tipos de gametas, las parentales (AB y ab) y las recombinantes (Ab y aB) que aparecerán por lo general con una frecuencia menor que las de tipo parental. La menor frecuencia de las gametas recombinantes está relacionada con el total de meiosis consideradas ya que no en todas se dará entrecruzamiento entre A y B, sino que ocurrirá con una frecuencia que será función de la distancia a que se encuentran ambos genes en el cromosoma. La distancia entre los genes se mide en Unidades Morgan (UM) o centimorgan y es proporcional a la cantidad de individuos recombinantes que aparecen en la descendencia. Fase de repulsión: I) No se da entrecruzamiento: A b a B A b a a B B Duplicación del ADN A b Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 26 Anafase I A b A b a a B B Anafase II A b A b a B a B Se producen dos tipos de gametas Ab y aB que se denominan parentales. II) Sí se da entrecruzamiento: A b a B Duplicación del ADN A b A b a a B B A b A B a b a B Anafase I A b A B a B a b Anafase II A b A B a b a B Se producen cuatro tipos de gametas, dos parentales Ab y aB y dos recombinantes AB y ab. Análisis del ligamiento En la resolución de problemas referentes al ligamiento y recombinación, se nos pueden presentar dos planteos que se han denominado directo e inverso según los datos con que contemos: * Directo: es el caso en que conocemos previamente la existencia de ligamiento y el valor, porcentaje o fracción de recombinación, y con estos datos debemos calcular las frecuencias fenotípicas esperadas. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 27 * Inverso: en este caso partimos de una segregación fenotípica obtenida a través de una experiencia y debemos determinar la existencia o no de ligamiento y el valor de recombinación. Para ambos planteos vamos a utilizar dos tipos de experiencias, el cruzamiento prueba y los datos de F2. Planteo directo. Supongamos un ejemplo en el cual en el 80% de las meiosis se dá entrecruzamiento entre los loci A,a y B,b. Calcular las frecuencias fenotípicas que se obtendrán en la descendencia de un cruzamiento prueba y en una F2 partiendo de individuos diheterocigotas en fase de repulsión. Frecuencia de entrecruzamiento = 2p = 0,80. El valor p representa la frecuencia total de gametos recombinantes y se llama fracción de recombinación. Si p es la frecuencia total de gametos recombinantes, la frecuencia de cada gameto será ½p y para el caso de las gametas parentales será ½(1-p). El máximo valor de p es 0,5 y corresponde a 2p=1, es decir al caso en que en todas las meiosis se dá entrecruzamiento entre ambos loci y las frecuencias gaméticas serán iguales a las esperadas en el caso de que las parejas alélicas se transmitieran independientemente. Si p=0 significa que nunca se dá entrecruzamiento entre ambos loci, entonces solo se producirán gametas de tipo parental. Para nuestro ejemplo sería: 2p = 0,80 => p = 0,40 Gametos Ab ½ (1-p) = ½ (1-0,40) = 0,30 P aB ½ (1-p) = ½ (1-0,40) = 0,30 AB ½ p = ½ 0,40 = 0,20 ab ½ p = ½ 0,40 = 0,20 1,00 R a) Cruzamiento prueba: como el padre homocigota recesivo produce un solo tipo de gametas (ab), las frecuencias fenotípicas de la descendencia coinciden con las clases gaméticas del padre heterocigota, es decir: Ab x ab aB ab Gametos Fenotípos Frecuencia Ab A- bb ½ (1-p) = 0,30 aB aa B- ½ (1-p) = 0,30 AB A- B- ½ p ab aa bb ½ p P = 0,20 R = 0,20 1,00 Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 28 Si nos referimos a un total de por ejemplo 300 individuos, deberían aparecer: 90 A- bb 90 aa B60 A- B60 aa bb 300 b) F2: en este caso las frecuencias fenotípicas (suponiendo dominancia completa en ambas parejas alélicas) es: *Fase de acoplamiento para ambos progenitores Fenotipo A- B- Frecuencia ¼ [2+(1-p)²] = ¼ (2+x) aa bb ¼ (1-p)² =¼x aa B- ¼ [1-(1-p)²] = ¼ (1-x) A- bb ¼ [1-(1-p)²] = ¼ (1-x) Siendo x = (1-p)² *Fase de repulsión para ambos progenitores Fenotipo Frecuencia A- bb ¼ (1-p²) = ¼ (1-x) aa B- ¼ (1-p²) = ¼ (1-x) A- B- ¼ (2+p²) aa bb ¼ p² = ¼ (2+x) = ¼x En nuestro ejemplo sería: Fenotipos Frecuencia A- bb ¼ (1-0,4²) = 0,21 aa B- ¼ (1-0,4²) = 0,21 A- B- ¼ (2+0,4²) = 0,54 aa bb ¼ 0,4² = 0,04 Siendo x = p² Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 29 Si referimos estas frecuencias relativas a 500 individuos, obtendremos las siguientes frecuencias absolutas: A- bb = 500 . 0,21 = 105 aa B- = 500 . 0,21 = 105 A- B- = 500 . 0,54 = 270 aa bb = 500 . 0,04 = 20 * Progenitores en fases diferentes: se deben hacer las combinaciones de gametas posibles utilizando por ejemplo el cuadrado de Punnet y considerando las frecuencias correspondientes a cada gameta. Planteo inverso. En estos casos se trata de averiguar si existe ligamiento entre las parejas alélicas (A,a) y (B,b) y en caso de que así sea se estima el valor de la fracción de recombinación entre los loci. Para determinar si existe ligamiento se recurre a la prueba de Ji-cuadrado (X²) y vemos si los resultados obtenidos difieren significativamente de lo esperado. Si es así se debe probar si cada par de alelos (A,a) y (B,b) ha segregado de acuerdo a lo esperado y esto se hace también a través del X². Luego se obtiene el X² de ligamiento por diferencia entre el primero y los otros dos, si éste X² es mayor que el de tabla significa que existe ligamiento. a) Cruzamiento prueba: supongamos un ejemplo en el cual AaBb x aabb 38 A-B-; 63 A-bb ; 58 aaB- ; 41 aabb Al realizar los tests de X² obtendremos: X²c GL X²t Interpretación Segregación total 9.16 3 7.815 Difiere significativamente de 1:1:1:1 Segregación (A,a) 0.05 1 3.841 No difiere significativamente de 1:1 Segregación (B,b) 0.32 1 3.841 No difiere significativamente de 1:1 Ligamiento 8.79 1 3.841 Existe ligamiento Ahora debemos determinar el valor de la fracción de recombinación que nos da la medida del ligamiento entre los loci A y B ó también denominada distancia entre A y B, y en este caso se expresa en Unidades Morgan (UM) y es proporcional a la cantidad de individuos recombinantes que aparecen en la descendencia. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 30 Siguiendo con el ejemplo anterior: A a b B Gametas Parentales x a a b b Ab ab aB AB Recombinantes ab Descendencia A- bb aa BA- Baa bb Total Nº de individuos 63 58 38 41 200 Al ser uno de los padres homocigota recesivo (y producir un solo tipo de gameta que no se manifiesta en el fenotipo), los tipos y frecuencias de gametas producidas por el heterocigota se pueden determinar directamente observando los fenotipos de la descendencia, en este ejemplo la cantidad y tipo de gametas producidas por el heterocigota fueron: 63 Ab 58 aB 38 AB 41 ab 200 El porcentaje de recombinantes se obtiene: % de recombinantes = Nº de recombinantes . 100 Nº total de individuos Para el ejemplo es: p = % de recombinantes = 38 + 41 . 100 = 39,5 % 200 La distancia entre los loci A y B es de 39,5 UM, esto implica que en el (2 x 39,5) % de las meiosis se da entrecruzamiento y habrá ½.39,5 gametas AB y ½.39,5 ab. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 31 b) F2: Cuando no puede contarse con los datos de un cruzamiento prueba, el valor de ligamiento puede obtenerse de la F2. Primeramente debe realizarse el X² para determinar si existe ligamiento. En caso de ser afirmativo se determina la distancia entre los loci. P M M L L F1 x m m l l M m L l F2 Descendencia M- LM- l l mm Lmm l l Total Nº de individuos observados 4831 390 393 1338 6952 Proporción 0.6949 0.0561 0.0565 0.1925 1 Con estos datos podemos seguir dos métodos: -Método del producto-proporción: para éste método se han construido tablas en las que figura la proporción teórica en que aparecen los cuatro fenotipos de F2 para genes separados por uno, dos, tres y hasta cincuenta UM. Esta tabla se llama de IMMER y entramos en ella a partir del valor obtenido de: Producto proporción de recombinantes Producto proporción de parentales En nuestro ejemplo es: 0,0561 x 0,0565 = 0,02369 0,024 0,6949 x 0,1925 Con el valor 0,024 para fase de acoplamiento se obtiene la distancia que es de 12 UM. También se puede calcular el error probable (EP) EP = Factor de la tabla II para la distancia calculada total de datos EP = 35 = 35,0 = 0,42 6952 83,37 EP = 0,42 Es decir que la distancia es de 12 ± 0,42 UM. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 32 -Método de la raíz cuadrada: de los individuos obtenidos en F2, los únicos en los que el genotipo coincide con el fenotipo son los homocigotas recesivos, que se forman de la unión de dos gametas iguales. En el ejemplo es: m m l l proporción 0,1925 Esta proporción surge del producto de la proporción de cada gameta por separado, es decir que si quiero calcular la proporción de una sola gameta es : proporción de gametas ml = 0,1925 = 0,439 La proporción de tipos paternos será 2 x 0,439 La proporción de tipos recombinantes se obtiene: 1 – (tipos paternos) 1 - (2 x 0,439) = 1 - 0,878 = 0,122 O sea que la distancia es de 12,2 UM. En caso de que la gameta doble recesiva sea de tipo recombinante: % de recombinación = distancia en UM = 2 .prop. doble recesivo Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 33 Mapas Genéticos La localización de genes consiste en situar lo mas exactamente posible el locus de un gen, y no va mas allá del conocimiento del cromosoma portador, cuando además se logra ubicarlo sobre el cromosoma, tomando como referencia el centrómero u otro locus previamente determinado, hablamos de construcción de mapas. Se puede definir un mapa genético como la representación de las distancias genéticas relativas que separan los loci de genes no alélicos en una estructura de ligamiento o cromosoma. La construcción de estos mapas, utilizando la recombinación meiótica, se basa en la proporcionalidad existente entre la distancia física entre dos loci en un cromosoma y la probabilidad que se de entrecruzamiento entre ambos en la meiosis. Esto, bajo el supuesto que el entrecruzamiento ocurre al azar en cualquier punto de los cromosomas homólogos. De esta manera podemos establecer la distancia entre los genes en un cromosoma. Cuando la distancia entre 2 loci excede ciertos valores (10 a 20 UM), aumenta la posibilidad que entre ellos se produzcan entrecruzamientos dobles sin poder ser detectados luego en la descendencia. A B A B A B A B a b a b a b a b Como la distancia está basada en la proporción de entrecruzamientos reales, si no tenemos en cuenta los entrecruzamientos dobles que se pueden producir, los valores calculados como distancia entre A y B serán menores a los reales. Obtendremos las distancias en relación a los entrecruzamientos simples que se observan sin tener en cuenta los dobles. Para estos casos debemos contar con un tercer gen, que se ubica en la zona central, y que nos permita detectar el entrecruzamiento doble. Ahora nos queda por determinar cual es el ordenamiento correcto, y cuales son las distancias entre los loci extremos y el central. Este problema se resuelve mediante el método denominado cruzamiento prueba de tres puntos. Cruzamiento prueba de 3 puntos Planteo inverso: consiste en la retrocruza de un trihíbrido por un homocigota recesivo (cruzamiento prueba), en donde los genes considerados se encuentran a una distancia relativamente corta. El tercer gen considerado para determinar los entrecruzamientos dobles se denomina gen marcador. Supongamos que tenemos 3 loci, A,a; B,b; C,c; y que disponemos de un individuo triheterocigota. Si realizamos un cruzamiento prueba con este individuo, las frecuencias fenotípicas observables en la descendencia serán el reflejo de las constituciones cromatídicas de los gametos producidos por el triheterocigota. La única clase de gameta producida por el parental homocigota recesivo para los 3 loci será abc, y por lo tanto no enmascara la constitución genética de los gametos del parental triheterocigota. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 34 Representación gráfica Gametos ABC abc ABC Abc AbC aBC Abc aBc abC abc abc abc Descendencia Genotipo Fenotipo ABC ABC Abc ABc Abc Abc AbC AbC Abc aBC aBC abc Abc Abc Abc aBc aBc abc abC abC abc abc abc abc abc Del análisis fenotípico de la descendencia, podemos deducir los fenómenos de entrecruzamiento ocurridos en la meiosis del parental triheterocigota. Para determinar que locus ocupa la posición central, debemos observar los fenotipos que corresponden a un entrecruzamiento simultáneo en las regiones I (entre A y B) y II (entre B y C). Como la probabilidad del entrecruzamiento doble (4 P1 x P2) es menor que la de uno simple (2 P1 ó 2 P2), no hay dificultad en identificar las combinaciones genéticas originadas por el doble entrecruzamiento. Para el caso anterior son AbC y aBc, donde se ve que el locus central tiene la propiedad única de que un cambio en los alelos que porta restituye las combinaciones parentales, es decir, que al cambiar B por b llegamos a las combinaciones de los padres ABC y abc. Ejemplo En maíz se conocen 3 genes ligados en los que han aparecido alelos mutantes recesivos que producen plantas brillantes (b), virescentes (v), y pacialmente fértiles (f), en homocigosis. Al realizar un cruzamiento prueba de un individuo heterocigota en fase de acoplamiento se obtuvo la siguiente descendencia: N° Gametas del individuos triheterocigota Normal 300 +++ Brillante, parcialmente fértil 64 B+f Parcialmente fértil 128 ++f Parcialmente fértil, virescente 18 +vf Brillante, parcialmente fértil, virescente 270 bvf Brillante 22 b++ Brillante, virescente 122 bv+ Virescente 76 +v+ Total 1000 Descendencia Secuencia correcta +++ +bf ++f v+f vbf +b+ vb+ v++ Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 35 Se deduce que: los gametos producto del doble entrecruzamiento son +vf y b++, pues son los que aparecen en menor proporción que la esperada (1/8 *1000). La secuencia correcta es por lo tanto v+f y +b+ por ser el par alélico +, b el central. los gametos parentales son +++ y vbf pues son los individuos que aparecen en mayor proporción. Las fracciones de recombinación son: Zona I: entre v y b Recombinantes zona I Dobles cruzamientos v++ = 76 +b+ = 64 v+f = 18 +b+ = 22 76 + 64 + 18 + 22 = 180 = 0,18 = 18 UM Distancia Zona I 1000 1000 Zona II: entre b y f Recombinantes zona II Dobles cruzamientos ++f = 128 vb+ = 122 v+f = 18 +b+ = 22 128 + 122 + 18 + 22 = 290 = 0,29 = 29 UM Distancia Zona II 1000 1000 Distancia entre v y f = 18 + 29 = 47 UM Coeficiente de coincidencia: En la mayor parte de los organismos superiores suele ocurrir que la formación de un quiasma reduce la posibilidad que se forme otro en una zona adyacente inmediata en el cromosoma. A este fenómeno se lo denomina interferencia de quiasma y trae como consecuencia que se observen menos recombinantes dobles que lo calculado de acuerdo a las distancias en el mapa. La influencia de la interferencia es variable en segmentos diferentes de un cromosoma y se expresa mediante el coeficiente de coincidencia, que es la relación entre los recombinantes dobles observados y los calculados: Coef. de coincidencia = Frecuencia observada de dobles recombinantes Frecuencia esperada de dobles recombinantes La interferencia es complementaria a la coincidencia, o sea que coincidencia mas interferencia es igual a 1. De allí que cuando la interferencia es total, o sea que no se presenta ningún recombinante doble, la coincidencia es cero; si no existe interferencia, y se presenta el mismo número de dobles recombinantes observados y calculados, la coincidencia es 1. En el ejemplo anterior, hemos visto que la distancia en la zona I es de 18 UM, y en la zona II es de 29 UM. Como la zona I es adyacente a la zona II, y si partimos de la base que son eventos independientes y al azar, podemos calcular la proporción de recombinantes dobles esperadas de la siguiente manera: Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 36 Recombinantes dobles esperados = 0,18*0,29 = 0,052 5,2% Recombinantes dobles observadas = (18 + 22)/1000 = 0,04 4% Coeficiente de coincidencia = C.C. = 0,04 / 0,052 = 0,76 ó 76% Esto significa que hemos observado sólo el 76% de los recombinantes dobles que podrían esperarse en base a las distancias dadas en el mapa. La interferencia en este caso es: C.I. = 1 – C.C. C.I. = 1 – 0,76 C.I. = 0,24 ó 24% Planteo directo: la problemática de 3 loci ligados, también puede plantearse de modo directo, así, conociendo los valores de P1, P2, e interferencia, calculamos las frecuencias gaméticas del trihíbrido. Ejemplo: *valor de interferencia = C.I. = 30% *recombinantes zona I = 10% *recombinantes zona II = 5% hacemos: Cruzamientos dobles C.C. = 1 – C.I. = 1 – 0,30 = 0,70 C.C. = Dobles recombinantes observados = Dobles recombinantes esperados entonces despejando: Dobles recombinantes observados = X = (0,10 * 0,05) * 0,70 = 0,0035 = 0,35% Cruzamientos simples Zona I = Recombinantes simples zona I + dobles recombinantes Recombinantes simples zona I = ZI – dobles recombinantes = 0,10 – 0,0035 = 0,0965 = 9,65% Zona II = Recombinantes simples zona II + dobles recombinantes Recombinantes simples zona II = ZII – dobles recombinantes = 0,05 – 0,0035 = 0,0465 = 4,65% Recombinantes totales Recombinantes = 0,0035 + 0,0965 + 0,0465 = 0,1465 = 14,65% Parentales = 1 – recombinantes = 1 –0,1465 = 0,8545 = 85,45% Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana Figura 1. Mapa genético de la región 15q112-q13 del cromosoma 15 de humanos. 37 Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana TABLA DE IMMER Tabla I de Immer % 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 22 24 26 28 30 35 50 Q Acoplamiento Repulsión 0,000136 0,000200 0,000552 0,000800 0,001 0,002 0,002 0,003 0,004 0,005 0,005 0,007 0,007 0,010 0,010 0,013 0,013 0,017 0,016 0,021 0,020 0,025 0,024 0,030 0,028 0,035 0,033 0,041 0,039 0,048 0,045 0,055 0,052 0,062 0,060 0,070 0,068 0,079 0,077 0,089 0,097 0,109 0,120 0,133 0,147 0,161 0,178 0,192 0,213 0,227 0,326 0,338 1,300 1,000 Tabla II de Immer % 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 22 24 26 28 30 35 50 E.P. Acoplamiento Repulsión 10,0 100,0 14,2 100,0 17,4 99,9 20,1 99,8 22,5 99,7 24,6 99,6 26,6 99,4 28,5 99,2 30,2 99,0 31,9 98,8 33,5 98,5 35,0 98,2 36,5 97,9 38,9 97,6 39,3 97,3 40,6 96,9 41,9 96,5 43,2 96,1 44,4 95,7 -----95,2 -----94,3 -----93,2 52,4 92,1 54,6 91,6 56,6 ----------86,5 75,0 75,0 38 Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 39 Determinismo genético del sexo. Determinismo genético en animales Los sistemas de determinismo genético del sexo más comunes son: Sistemas XX – XO: se observó primeramente en organismos del género Protenor (Orden Heteroptera), en donde se vio un cromosoma accesorio que se denominó cromosoma “X”, que se presentaba en la mitad de los espermatozoides y en la otra mitad estaba ausente. Es decir que los machos tenían un solo cromosoma X, mientras que las hembras tenían dos X, y por lo tanto todos los óvulos llevaban este cromosoma. Los machos de las especies que poseen esta forma de determinismo sexual llevan un cromosoma menos que las hembras. Se denominó a las hembras el sexo homogamético pues producen un solo tipo de gametas, y a los machos el sexo heterogamético pues producen gametas de dos tipos, con X y sin X (o también representado como “O”). Esto daría en la descendencia ½ de machos y ½ de hembras como se espera. XX Gametas x X XO X ½ XX O ½ XO Este tipo de determinismo también se da en Ortópteros (langostas, cucarachas). Sistemas XX – XY: en algunas especies se encontró que durante la meiosis el cromosoma X se apareaba con otro cromosoma al que denominaron cromosoma “Y”, y que generalmente es diferenciable morfológicamente del X. En este caso los machos y las hembras tienen el mismo número de cromosomas. Las hembras son el sexo homogamético, producen gametas con “X”, es decir: A+X (representando con A al conjunto de autosomas o cromosomas no sexuales). Los machos o sexo heterogamético, producen dos tipos de gametas: A+X A+Y y De la fecundación puede resultar: ½ A+Xx x A+X = 2 A + XX ½ A+Xx x A+Y = 2 A + XY Este sistema se da en nemátodes, moluscos, equinodermos, la mayoría de los artrópodos y en mamíferos incluyendo al hombre, en el hombre la sola presencia del cromosoma “Y” da la masculinidad. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 40 En otros casos como por ejemplo la mosca Drosophila, la simple presencia de “Y” no determina el sexo, sino que el sexo es el resultado del equilibrio entre los autosomas y los cromosomas “X”. Así dos juegos completos de autosomas (AA) y un cromosoma X originan un macho, mientras que dos juegos de autosomas y dos X dan lugar a hembras. Es decir: X/AA = ½ = 0.5 macho XX/AA = 2/2 = 1 hembra Otras relaciones originarán: 0.5 < X/A < 1 intersexos X/A > 1 superhembras X/A < 0.5 supermachos En algunos grupos de animales se presenta el sistema X-Y, pero el sexo heterogamético es el femenino y el masculino es el homogamético así ocurre en Lepidópteros (mariposas), reptiles, aves y algunos anfibios. Algunos autores representan con ZZ a los machos y con ZW a las hembras, para diferenciar este caso en que el sexo heterogamético es el femenino. En los vegetales el único caso que se conoce es en Fragaria. Sistemas compuestos: Xn Xn – Xn Y; XX – X Yn; Xn Xn – Xn Yn; Xn Xn – Xn O. En todos los casos se presentan simultáneamente o no, varios cromosomas X y/o Y. Un ejemplo se da en el nemátode Ascaris incurva, en donde todos los machos tienen ocho X, un cromosoma Y y trece pares de autosomas, las hembras poseen solo ocho X y trece pares de autosomas. Los machos darán dos tipos de gametas: y 8X +A Y+A Las hembras producen gametas de un solo tipo: 8X +A De la fecundación se obtienen: (8 X + A) x (8 X + A) = 16 X + 2 A = 16 X + 26 = 42 crom. (8 X + A) x (Y + A) = 8 X + Y + 2 A = 8 X + Y + 26 = 35 crom. En vegetales se da en algunas especies de Rumex. Determinación por haplo-diploidía: en este caso el determinismo genético del sexo no depende de cromosomas sexuales, sino que los machos son haploides (producidos partenogenéticamente) y las hembras son diploides. Hay cuatro órdenes de insectos dentro de los cuales se presentan en algunos o en todas las especies este tipo de determinismo sexual, Himenópteros, Homópteros, Tisanópteros y Coleópteros. Este sistema se da en abejas (Apis melífera) y se creía que en avispas era igual, pero trabajando con la avispa Bracon hebetor, al cruzar una hembra homocigota de ojos naranja (recesivo) con machos de ojos negros (dominante) se obtuvo la siguiente descendencia: Machos de ojos naranja Machos de ojos negros (estériles, no esperados) Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana Hembras de ojos negros Lo esperado es: nn hembra ojos naranja n machos ojos naranja x 41 + macho ojos negros +n hembras ojos negros De la descendencia obtenida en el experimento, donde aparecen machos de ojos negros, deducimos que el progenitor masculino era diploide. Se determinó entonces que en esta avispa la herencia del sexo se basaba en una serie alélica, con nueve alelos (X1, X2, X3 ... X9). La combinación de dos alelos diferentes (heterocigosis) daba una hembra, pero un solo alelo (haploide) o dos alelos en homocigosis originaban un macho. Como en esta avispa la mayoría de los cruzamientos se da entre individuos no emparentados, los diploides generalmente son heterocigotas y por lo tanto hembras, pero para el caso de la experiencia antes mencionada los individuos utilizados en el cruzamiento deben haber estado emparentados, es decir: X1 X2 n n x X1 N X1 X1 N n macho estéril ojos negros X1 X2 N n hembra ojos negros X1 n macho fértil ojos naranjas X2 n macho fértil ojos naranjas Existen formas determinantes del sexo cuyos mecanismos genéticos no están dilucidados. Se observan diversos factores que influyen en la evolución hacia un sexo u otro. Algunos ejemplos en animales son: Bonellia viridis: es un gusano marino, los huevos fecundados eclosionan y se transforman en larvas natatorias que si caen al fondo del mar se convierten en hembras con un cuerpo pequeño y redondeado y una trompa ciliada y larga bifurcada en el extremo. Las larvas que en su caída se encuentran con la trompa de una hembra, se depositan en ella y se transforman en machos que son diminutos con sus órganos internos degenerados, a excepción del aparato reproductor, y parasitan en las hembras. Dinophilus: es otro gusano marino, en este caso el tamaño de los huevos incide en el sexo, los huevos de mayor tamaño producen hembras y los más pequeños machos. También se dan algunos ejemplos en vegetales: Equisetum (Pteridófito): cuando crece en condiciones favorables (abundancia de nutrientes) presenta características femeninas y sino masculinas. Cucunmis sativus (pepino) y Cucumis melo (melón): la aparición de flores femeninas está relacionada con la producción de etileno, que a su vez depende de las condiciones ambientales. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 42 Aunque la mayoría de las especies sexuadas poseen cromosomas sexuales determinados, dichos cromosomas no son los únicos que intervienen en el desarrollo sexual, sino que influyen también gran cantidad de genes autosómicos. La función de los cromosomas sexuales sería la de desencadenar y dirigir el desarrollo del organismo hacia uno de los dos caminos posibles a seguir (machos o hembras). En Drosophila se da el caso de un gen que se denominó transformer (tra) y que es recesivo. Dicho gen en heterocigosis no tiene ningún efecto pero en homocigosis hace que los individuos hembras (XX) se transformen fenotípicamente en machos que son infértiles. En el hombre también existe un gen autosómico que produce la denominada feminización testicular, estos individuos genéticamente son XY, presentan características femeninas, los testículos se atrofian y son estériles. En maíz el gen bs suprime la formación de órganos femeninos, y el gen ts transforma los órganos masculinos en femeninos. Herencia ligada al sexo El comportamiento mendeliano de los caracteres hereditarios puede estar modificado si dichos caracteres están controlados por genes cuyos loci están en los cromosomas sexuales. Así cuando un carácter tiene su locus situado en el segmento diferencial o zona heteróloga de los cromosomas sexuales (ya sea X o Y), se dice que existe ligamiento total con el sexo, cuando el carácter tiene su locus en el segmento apareante u homólogo de los cromosomas X e Y se dice que existe ligamiento parcial y las segregaciones obtenidas dependerán de la distancia entre los loci considerados y el punto de separación entre el segmento apareante y diferencial de cada cromosoma. Se les denomina Caracteres o genes ligados al sexo a aquellos que tienen sus loci sobre el segmento diferencial del cromosoma “X”. Caracteres o genes holándricos a los que tienen sus loci en el “segmento diferencial o heterólogo del cromosoma Y”. El primer caso de ligamiento al sexo, descripto por Morgan, fue el del mutante White que produce ojos blancos en Drosophila. Este carácter presenta ligamiento total con el cromosoma “X”. Morgan cruzó: XX x XY BB b ojos rojos ojos blancos G1 G2 XX y XY Bb b ojos rojos ojos rojos XX XX ; XY XY Bb BB B b ojos rojos ojos blancos Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 43 Cuando cruzó hembras de la G1 con machos de ojos blancos obtuvo: P XX Bb G XX Bb Rojos x XY b XX XY bb B Blancos Rojos XY b Blancos Para explicar estos resultados concluyó en que las hembras de G1 eran heterocigotas, que el carácter ojos blancos era recesivo y que las hembras de ojos blancos solo se daban cuando estaba el recesivo en homocigosis. Los machos en cambio tenían la misma probabilidad de tener ojos blancos o rojos si la madre era heterocigota sin importar la característica del padre, esto se debe a que si bien el gen para ojos blancos es recesivo, al encontrarse en el segmento diferencial del cromosoma X y no tener homólogo, se manifestaba en hemicigosis. Es decir que el gen para color de ojos está localizado en el cromosoma X. Vemos entonces que en los machos todos los genes ligados al sexo (dominantes o recesivos) aparecen en el fenotipo, mientras que en la hembras se cumple la relación normal de dominancia y recesividad. Los machos solo heredan el cromosoma “X” de la madre, mientras que las hembras reciben uno de la madre y otro del padre. En el hombre se conocen por lo menos ochenta caracteres cuyos genes determinantes están ubicados en el cromosoma X, algunos no tienen influencia sobre la viabilidad de los individuos, pero otros disminuyen la posibilidad de vida, por ejemplo la hemofilia y el síndrome de Lesch-Nyhan (enfermedad convulsiva). La hemofilia producida por un gen recesivo (afecta la producción de tromboplastina, que es el sustrato necesario para la coagulación de la sangre) las mujeres son portadoras, la enfermedad se manifiesta en la descendencia masculina. Las mujeres pueden ser hemofílicas (doble dosis) pero la frecuencia es muy baja. Protrombina Tromboplastina Trombina Fibrinógeno Fibrina Existen tres tipos de hemofilia A, B y C (80%, 19% y 1%) con formas más o menos severas, debido posiblemente a alelos con mayor o menor efecto o a la presencia de modificadores de los genes o a ambos. Otras enfermedades ligadas al sexo en el hombre son la ceguera a los colores (deuteranopía), albinismo ocular, distrofia muscular, etc. Se puede evitar la aparición de individuos con estas enfermedades, algunas de ellas letales, identificando a las mujeres portadoras (heterocigotas). Las portadoras de hemofilia pueden identificarse en el 85% de los casos por pruebas bioquímicas (disminución del factor coagulante), también se pueden identificar los portadores de Lesch-Nyhan y distrofia muscular. Algunos caracteres ligados al sexo en el hombre también se encuentran en otros animales. Por ejemplo las hemofilias A y B se encuentran ligadas al sexo en el perro. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 44 La producción de glucosa 6-fosfato deshidrogenasa (enzima que elimina un átomo de hidrógeno de los azúcares de la glucosa fosforilada) es una característica ligada al sexo en el hombre, en el caballo, el asno, la liebre europea y el ratón, esto da idea de que algunos mamíferos han compartido por lo menos parte de sus cromosomas X durante su evolución. Relación entre sexos La relación esperada 1 : 1 entre los dos sexos se explica debido a la producción de gametas diferentes por parte del sexo heterogamético. Pero se conocen muchos casos en que la relación machos : hembras no es uno a uno, sino que predominan unos sobre otros. Esto ocurre por ejemplo en una Cepa de Drosophila en la cual algunos cromosomas X poseen un gen letal recesivo. Los machos que heredan este “X” mueren al emerger como adultos. Las hembras heterocigotas dan en su descendencia una proporción de dos hembras y un macho. Bb B XX x XY BB Bb B b XX XX XY XY Muere Determinismo genético en plantas No está tan ampliamente estudiado como en animales, pero en algunos casos se han identificado cromosomas sexuales. Los vegetales cuyas flores son hermafroditas no pueden presentar cromosomas sexuales, ya que el mismo genotipo genera la parte femenina y la masculina de una flor. En especies dioicas, como el maíz, no se presentan cromosomas sexuales pero se han identificado genes autosómicos que modifican la expresión sexual, así el gen bs (recesivo) suprime la formación de órganos femeninos, y el gen ts (recesivo) transforma los órganos masculinos en femeninos. Una planta de genotipo bs bs TsTs será solo masculina; el genotipo Bs Bs ts ts dará una planta femenina. Así en el maíz podrían existir plantas con flores de un solo sexo, femeninas, y plantas con flores un solo sexo, masculinas. En especies diclinas se han encontrado cromosomas sexuales, por ejemplo en algunas especies de Rumex se ha detectado un sistema compuesto de determinismo sexual. También en especies de Fragaria se ha comprobado la existencia de determinismo sexual a través del sistema ZZ – ZW o de un sistema compuesto. Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 45 Comportamiento meiótico de los cromosomas sexuales Durante la meiosis los cromosomas sexuales X e Y se comportan como una pareja cromosómica. Aunque morfológicamente son diferentes, cada cromosoma presenta un segmento de apareamiento mutuo que varía desde una porción muy pequeña hasta casi toda la longitud de ambos. Se cree que esta zona de apareamiento es la zona o segmento homólogo y que en ella se puede producir entrecruzamiento (si es lo suficientemente larga) durante la meiosis. La zona no apareada se denomina segmento diferencial. Machos: Meiosis 1° fase || || || || || || || || -----> + Meiosis 2° fase | | | | | -----> | | + + | + || || || || | | | | XX YY XX YY X X Y Y Espermatocito primario Espermatocitos secundarios Espermatozoides En el caso del sistema XO, el cromosoma X no tiene homólogo y durante la primer división meiótica se dirige a uno de los polos. En la segunda división, al separarse las cromátidas, quedan dos espermatozoides con X y dos con O (X nulo). Hembras: || || Meiosis 1° fase || || || || Meiosis || || | | | | 2° fase -----> + | -----> | | + + | + || || || || | | | | XX XX XX XX X X X X Oocito primario Oocito secundario Óvulo degeneran Genética y Mejoramiento Vegetal y Animal – Facultad de Ciencias Agropecuarias – UNER – Genética Mendeliana 46 No disyunción de los cromosomas Se denomina así al caso en que los cromosomas homólogos no se separan en gametas individuales durante la meiosis. Esto, se cree que es debido a un apareamiento no adecuado durante la metafase que hace que los cromosomas homólogos no se separen al azar pudiendo ir uno a cada polo o los dos al mismo polo. Como consecuencia de la no disyunción se obtienen gametas con dos cromosomas sexuales y otras sin ninguno. La no disyunción puede producirse en la primera o en la segunda división meiótica y así tendremos: En machos: -No disyunción en la primera división que dará dos espermatozoides XY y dos espermatozoides O. La no disyunción en la segunda división produce espermatozoides XX, YY y O. En hembras: -No disyunción en la primera división da óvulos XX ó O y la no disyunción en la segunda división da óvulos XX ó O. Genes o caracteres limitados por el sexo Las características fenotípicas de un sexo y otro surgen de la diferencia de genes presentes en uno y otro. Pero muchas diferencias fenotípicas se deben a genes que se presentan en ambos sexos, pero en uno se manifiestan y en el otro no. Un ejemplo se dá en algunas razas ovinas, en las cuales solamente los machos presentan cuernos, siendo que los genes que determinan este caracter se hallan presentes en ambos sexos. Otro caso se dá en vacunos para los genes determinantes del fenotipo productor lechero, dichos genes son portados por ambos sexos y se manifiestan en el femenino. Por esto para seleccionar a un toro reproductor lechero se lo evalúa a través de su descendencia femenina mediante los llamados test de progenies. Como la expresión de estos genes se halla limitada a un solo sexo, se denominan genes o caracteres limitados por el sexo. Genes o caracteres influidos por el sexo Se denominan así a los caracteres que se dan con mayor frecuencia en un sexo que en el otro (debido a que en el hombre algunos genes recesivos se manifiestan en hemicigosis). Ejemplos de esto son: la calvicie, el labio leporino y la gota que son más frecuentes en el hombre que en la mujer.