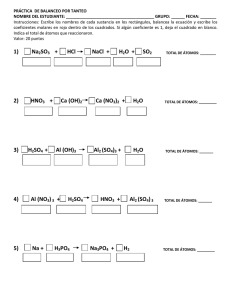
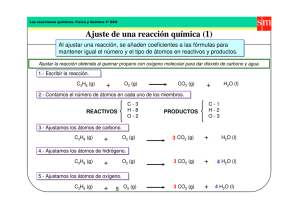
20-09-2019 REACCIÓN QUÍMICA Prof. María Teresa Villanueva CAMBIO FÍSICO Y CAMBIO QUÍMICO. • CAMBIO FÍSICO: es aquél que tiene lugar sin transformación de materia. Cuando se conserva la sustancia original. – Ejemplos: cualquiera de los cambios de estado y también patear una pelota, romper una hoja de papel. En todos los casos, encontraremos que hasta podría cambiar la forma, como cuando rompemos el papel, pero la sustancia se conserva, seguimos teniendo papel. • CAMBIO QUÍMICO: es aquél que tiene lugar con transformación de materia. Cuando no se conserva la sustancia original. – Ejemplos: cuando quemamos un papel, cuando respiramos, y en cualquier reacción química. En todos los casos, encontraremos que las sustancias originales han cambiado, puesto que en estos fenómenos es imposible conservarlas. EJEMPLOS: Aquí se identifican fenómenos físicos y químicos, para un fenómeno natural y para un hecho de la vida diaria: Durante el proceso de FOTOSÍNTESIS: • a- La hoja TOMA CO2 del aire,(también llega el H2O tomada del suelo por la raíz ). FÍSICO • b- El AGUA se transforma en HIDRÓGENO y OXÍGENO. QUÍMICO • c- El OXÍGENO se desprende de la planta y vuelve a la atmósfera .FÍSICO • d- El HIDRÓGENO reacciona con el DIÓXIDO DE CARBONO para formar ALMIDÓN .QUÍMICO 1 20-09-2019 Representación de cambios químicos: REACCIÓN QUÍMICA. • Según la teoría cinético-molecular una reacción química consiste en las roturas de las moléculas de las sustancias iniciales, reordenándose los átomos de forma diferente . • En la reacción química se produce siempre una transformación energética. EXPLICACIÓN CINÉTICO MOLECULAR DE LA REACCIÓN QUÍMICA. • Para que se produzca la reacción química se tienen que producir dos hechos fundamentales : • I 2 + H2 1.-Los átomos tienen que chocar con suficiente energía. 2.-La orientación del choque de los átomos ha de ser efectiva. Es decir la orientación del choque ha de ser la adecuada. 2HI choque efectivo choque no efectivo. PRINCIPIO DE CONSERVACIÓN DELA MASA. • Debido a los estudios de Lavoisier. Que estableció dicho principio en el año 1877. • “En un sistema aislado ,en el que no entra ni sale materia ,la masa de las sustancias iniciales es idéntica a la masa de las sustancias finales,aunque dichas sustancias sean diferentes”. mreactivos = mproductos. 2 20-09-2019 PRINCIPIO DE CONSERVACIÓN DELA MASA. IK + Pb(NO3)2 PbI2 + KNO3 PRINCIPIO DE CONSERVACIÓN DELA MASA. • Ahora bien, el número de átomos de cada elemento en los reactivos debe ser igual al que existe en los productos • Esto nos obliga a realizar un ajuste de la ecuación química para que el número de átomos de cada elemento en los reactivos sea igual al que existe en los productos. Ejemplo:Combustión de la gasolina. • ¿En qué se transforma la gasolina una vez es consumida?. • ¿Cuáles son los reactivos y los productos de dicha combustión?. • ¿La masa de dichos productos?,¿Es igual a la masa de los reactivos?. 3 20-09-2019 Ajuste de reacciones. Formación del agua. H2 + O2 H2O • Vemos que en los reactivos hay dos átomos de oxígeno mientras que en los productos sólo hay uno. • ¿Qué tal si multiplicamos por dos la molécula de agua? H2 + O2 • 2 H2O • Ahora tenemos igualdad en los átomos de oxígeno, pero no en los de hidrógeno. De estos hay cuatro en los productos y sólo dos en los reactivos. • ¿Por qué no multiplicamos por dos el hidrógeno en los reactivos? 2 H2 + O2 • 2 H2O Ajuste de reacciones. Formación del agua. • • A los números que hemos añadido para ajustar la ecuación se les llama coeficientes estequiométricos. 2 H2 + O2 2 H2O nº de átomos en la molécula. coeficiente estequiométrico(nº de moléculas) • “ las ecuaciones químicas son las representaciones simbólicas de las reacciones reales. En ellas, el número de átomos de cada elemento es el mismo en las sustancias iniciales y en las finales.” REPRESENTACIÓN GRÁFICA DE REACCIONES QUÍMICAS. • Las reacciones químicas pueden ser representadas mediante los modelos moleculares. • Dibujando los átomos como si fueran esferas y construyendo así las moléculas de las sustancias que intervienen en una reacción. • Utilizando los modelos moleculares podemos entender mejor la conservación de la materia en las reacciones químicas, puesto que el número de esferas de cada clase debe ser el mismo en las sustancias iniciales y en las finales, es decir, en los reactivos y en los productos. 4 20-09-2019 REPRESENTACIÓN GRÁFICA DE REACCIONES QUÍMICAS. H2 + O2 H2O La representación anterior no cumple el principio de conservación de la masa.!!! REPRESENTACIÓN GRÁFICA DE REACCIONES QUÍMICAS. 2 H2 + O2 2 H2O La representación anterior si cumple el principio de conservación de la masa.!!! Representación de reacciones. • Zn + HCl ZnCl2 + H2 • Procedemos a ajustar: • Zn +2 HCl ZnCl2 + H2 5 20-09-2019 Representación de reacciones. • CaCO3 CaO + CO2 Ca C O Reacción de COMBUSTIÓN • En reacción de combustión, el combustible y el oxígeno desaparecen apareciendo otras sustancias nuevas como las que forman la cenizas (si quedan),humos y gases invisibles . Combustible(C,H,O) +O2 CO2 +H2O Reacción de COMBUSTIÓN. Etanol Carbón Butano Propano + O2 CO2 +H2O Gasolina Madera Plásticos ………… 6 20-09-2019 ¿Como ajustar una reacción de combustión? C2H6 + O2 CO2 + H2O 1º.-Ajustamos los átomos de hidrógeno. Ponemos el coeficiente estequiométrico a la molécula de agua, para ajustar estos. C2H6 + O2 CO2 +3 H2O ¿Como ajustar una reacción de combustión? 2º.-Ajustamos los átomos de carbono. Ponemos el coeficiente estequiométrico a la molécula de dióxido de carbono, para ajustar estos. C2H6 + O2 2CO2 +3 H2O ¿Como ajustar una reacción de combustión? 3º.-Ajustamos los átomos de oxigeno. Ponemos el coeficiente estequiométrico a la molécula de oxígeno, para ajustar estos. C2H6 + 7/2 O2 • 2CO2 +3 H2O !!ojo!!.Frecuentemente aparecen coeficientes fraccionarios. 7 20-09-2019 Ajuste y representación de la reacción C2H6 + 7/2 O2 2CO2 +3 H2O Para poder representarla ,eliminamos el coeficiente fraccionario, multiplicando por dos la ecuación: 2 C2H6 + 7 O2 4CO2 +6H2O + + Reacción de oxidación de metales. • El metal incorpora átomos de oxigeno ,formando óxidos. • En muchos casos la reacción ocurre a temperatura ambiente. • M + O2 MO • M + O2 MO2 • 2Fe +O2 Ejemplo: 2FeO Reacción de oxidación de metales. En las reacciones de oxidación se ajusta primero el oxígeno.Después el metal. Na + O2 Na2O 1º Na + O2 2º 4Na + O2 2 Na2O 2 Na2O + 8 20-09-2019 Energía de las reacciones • Durante el curso de una reacción siempre se produce ,en mayor o menor medida ,un desprendimiento o una absorción de energía. • Así clasificamos las reacciones en: 1.-EXOTÉRMICAS: Aquellas en las que se desprende calor. Aunque en un principio haya que suministrar una mínima cantidad de calor. 2.-ENDOTÉRMICAS: Son aquellas en las que se absorbe calor. 9