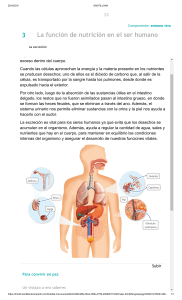
INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES 1. IDENTIFICACIÓN DEL PLAN Área/asignatura: CIENCIAS NATURALES / BIOLOGIA Y QUIMICA Grado/grupos: 7° 4 Período académico: SEGUNDO PERIODO ACADEMICO Docente: ALVARO LUIS PICO BAEZ 2. OBJETIVO DEL PLAN Desarrollar las actividades de recuperación, potencializando conocimientos en ciencias naturales en las dos asignaturas. En base a los conocimientos del periodo, uso de apuntes, guías, tabla periódica, diccionario; Realizar las actividades corroborando textos, llevando consigo análisis de gráficas, textos y representando los ejercicios de química con criterios claros y coherentes. 3. COMPETENCIAS-ACTIVIDADES 4. PRODUCTOS ESPERADOS. 5. Aplicación de conocimientos científicos. Explicación de fenómenos. Indagación. Comprensión de las cadenas y redes tróficas que existen flujos de materia y energía, y las relaciones con procesos de nutrición, fotosíntesis y respiración celular. Análisis, de la configuración electrónica y números cuánticos de los elementos periódicos. Desarrollo de competencia exploratoria, analítica e interpretativa de los fenómenos físico químicos de la materia. Capacidad en el desarrollo de ejercicios configuración electrónica, empleando los números cuánticos. Comprensión de gráficas, preguntas tipo icfes VALORACION DE EL PRODUCTO. En la escala de valoración en recuperación al finalizar el periodo académico para aprobación del área de ciencias naturales, el estudiantes se esforzara en el desarrollo de las actividades planteadas el cual de una manera clara , coherente y gestionada con aprendizaje en casa obtendrá el porcentaje de calificación de 40% , posteriormente se llevara a cabo la sustentación ya sea escrita o expositora generando argumentos que demuestren su esfuerzo en el desarrollo y motivación por la superación de la competencia en el área , cuyo porcentaje será 60%. NOTA: Aclaro que el educando; que solo presente el taller y no sustente será reprobado(a) la recuperación, debido al proceso que será incompleto, recomiendo tener dominio de las actividades y lo mencionado en el proceso de recuperación. 1 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES QUIMICA- BIOLOGIA EJERCICIOS 1. Determine las configuración electrónica , teniendo presente los números cuánticos, los ejercicios completos colocando pines, distribuciones debidas a los elementos que hacen parte de los siguientes grupos IA,IIA,IIIA,IVA,VIIA,IIB. 2. El 17 de febrero de 1860 Mendeleiev al organizar los elementos según el orden creciente de sus pesos atómicos, observó la existencia de una repetición periódica de sus propiedades. La tabla periódica es el resultado de organizar en filas los elementos químicos, de acuerdo con el orden creciente de sus números atómicos (z). Completar las siguientes frases: a) A las filas horizontales de la tabla periódica se les denominan: verticales de la tabla periódica se les denominan: 3. b). A las filas Moseley determinó el número atómico (Z) de todos los elementos químicos. a). Qué indica el número atómico en un átomo? Este científico también determinó el número de elementos presentes en cada período. Periodo: 1 o K – 2L – 3M – 4N – 5O - 6P – 7Q b) ¿En qué periodo se encuentra el elemento plata? c) ¿Un elemento de Z = 12 en qué periodo se encuentra? d) ¿Un elemento de Z = 44 en qué periodo se encuentra? e) ¿Un elemento de Z = 53 en qué periodo se encuentra? f) ¿Un elemento de Z = 60 en qué periodo se encuentra? g) Los elementos del 58 al 71 conforman la serie de los h) Los elementos del 90 al 110 conforman la serie de los 3 a).Qué nombre reciben los elementos del grupo A? ------------------------b) ¿Qué nombre reciben los elementos del grupo B?---------------------------------------c) Dar los símbolos de los elementos del grupo de los alcalinos.------------------------d) Dar los símbolos de los elementos del grupo de los halógenos.------------------------e) Dar los símbolos de los elementos del grupo de los gases nobles.---------------------f) ¿Un elemento con Z = 8 en qué grupo y periodo se encuentra?------------------------g) ¿Un elemento con Z = 20 en qué grupo y periodo se encuentra?-----------------------h) ¿Un elemento con Z = 24 en qué grupo y periodo se encuentra?-----------------------i) ¿Un elemento con Z = 40 en qué grupo y periodo se encuentra?-----------------------j) ¿Un elemento con Z = 50 en qué grupo y periodo se encuentra?-----------------------4 En la tabla periódica encontramos los metales y los no metales separados por una línea quebrada. a) ¿En qué parte de la tabla periódica se encuentran los metales?, ----------------------- ¿Y los no metales?-------------------------------- b) También existen los metaloides. ¿Cuáles son?--------------------------------------------------------------------- c) ¿Cuál es Z, periodo, grupo, Nº de electrones en la última orbita de la plata?-------------------------------------------------------------------------- d) ¿Qué grupo constituye los llamados “Metales de acuñar”?------------------------------ e) Elabora una lista de los grupos de elementos metálicos----------------------------------------------------------------------------------------------------------------------------------------- y una lista de los grupos de elementos no metálicos.------------------------------------------------------------------------------------------------------------------------------------------------ f) En el grupo IA, hay un elemento no metálico. Identifícalo.---------------------------- g) Los lantánidos y los actínidos. ¿Son metales o no metales, explica?--------------------------------------------------------------------------------------------------------------------- 2 ¿Por qué se les denomina así?------- INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES h) Los elementos en transición, ¿son metales?-------- Explica su respuesta.------------------------------------------------------------------------------- i) Enumere 5 propiedades de los metales.----------------------------------------------------------------------------------------------------------------------Enumere 5 propiedades de los no metales.---------------------------------------------------------------------------------------------------------------- j) k) Los metales poseen una gran tendencia a (perder o ganar) electrones: negativo) de un ejemplo.------------------------ l) Los no metales poseen una gran tendencia a (perder o ganar) electrones iones (positivos o negativos) de un ejemplo.----------------------------------------------------------------- formando así iones (positivo o , formando así 5 Llene la siguiente tabla Con base en la tabla, escriba el símbolo del elemento que satisfaga las siguientes afirmaciones: a) Corresponde a un gas noble. b) Es el más electronegativo. c) Es un metal alcalino. d) Es el de mayor radio atómico. e) Es diamagnético. 6 Para los elementos de la familia V A, conteste: a) ¿Cuál de ellos posee la mayor energía de ionización (primera)? b) ¿Cuál de ellos posee la mayor afinidad electrónica? c) Acomódelos en orden creciente de electronegatividad. d) Acomódelos en orden creciente de radio atómico. Argumente sus respuestas 7 A continuación se presentan los valores de los números cuánticos para el último electrón (según el orden que se sigue en el principio de construcción) de los siguientes elementos: Escriba los símbolos de los elementos que cumplen con las características siguientes: a) No metálicos. b) Paramagnéticos. c) Son del sexto periodo. d) Es gas noble. e) Es el más electronegativo. 8 Considere al elemento con 119 protones y con base en su configuración electrónica, indique: a) Los números cuánticos para su electrón diferencial. b) La forma de su óxido. c) Su ubicación en la tabla periódica (mencione grupo o familia). d) Su carácter magnético. 3 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES e) Su electronegatividad con respecto a los elementos de su familia. 9 Escriba el símbolo o los símbolos de los elementos del segundo periodo, que cumplen con el enunciado de cada inciso. a) Son diamagnéticos. b) Tiene la energía de primera ionización más grande. c) Los números cuánticos de su electrón diferencial son: n= 2, l= 1, m= 0 y giro= -1/2. d) Los números cuánticos de su electrón diferencial son: n= 2, l= 1, m= -1 y giro= +1/2. e) Tiene el radio atómico más grande. 10 A continuación se presentan los valores de los números cuánticos para el último electrón (según el orden que se sigue en el principio de construcción) de los siguientes elementos: Escriba el símbolo del elemento que: a) Es el menos electronegativo. b) Tiene la afinidad electrónica mayor. c) Tiene un radio atómico menor. d) Es gaseoso y diamagnético. e) Pertenece al sexto periodo. 4 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES 1. PARA REPRESENTAR LOS SUBNIVELES DE ENERGÍA SIGUIENTES SÍMBOLOS: A. B. C. D. 2. 3. UN ÁTOMO EN SU NÚCLEO SE Numero de Avogadro. Numero cuántico. Numero atómico. Numero de masa EL NÚMERO DE ELECTRONES EN EL TERCER NIVEL PRINCIPAL DE ENERGÍA DE UN ÁTOMO CON ESTRUCTURA ELECTRÓNICA 1S2 2S2 2P6 3S2 3P2, ES: A. B. C. D. 4. IA, IIA, IIIA, VA, VIA, VIIA. K, L, M, N, O, P, Q. A, b, c, d, e, f s, p, d, f. LA CANTIDAD DE PROTONES QUE PRESENTA DENOMINA: A. B. C. D. SE UTILIZAN LOS 2 4 6 8 Teniendo en cuenta que el punto de ebullición es una propiedad intensiva, al graficar el punto de ebullición (Tb) de diferentes masas de un mismo líquido, la gráfica que se obtiene es: 5. De la fórmula del etano (C2 H6) es válido afirmar que por cada molécula de etano hay A. B. C. D. 2 moléculas de C 1 mol de H 2 átomos de C 2 moles de C . 5 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES 6. Un recipiente tiene la siguiente etiqueta PENTANO 1 LITRO Densidad = 0,63 g/ml p. ebullición = 36ºC p. fusión = -130ºC soluble en disolventes orgánicos. Los datos que sirven para determinar la masa del líquido en ese recipiente son: A. B. C. D. la solubilidad y punto de fusión el volumen y el punto de ebullición la densidad y el volumen el volumen y la solubilidad RESPONDA LAS PREGUNTAS 7 Y 8 DE ACUERDO CON LA SIGUIENTE FIGURA 7. A. B. C. D. De acuerdo con la información inicial el número atómico del cadmio es 48 47 50 49 8. Con base en la información inicial es válido afirmar que el elemento Te tiene: A. B. C. D. 9. Mayor tamaño atómico que el elemento S y que el elemento Fr Mayor electronegatividad que el elemento Fr y que el elemento S Mayor electronegatividad que el elemento Po y que el elemento Fr Menor tamaño atómico que el elemento H y que el elemento Po Un ión es una especie química que ha ganado o perdido electrones y por lo tanto tiene carga. La configuración electrónica para un átomo neutro "P" con Z = 19 es 1s2 2s2 2p6 3s2 3p6 4s1. De acuerdo con esto, la configuración electrónica más probable para el ión P2+ es: A. 1s2 2s2 2p6 3s2 3p6 4s2 B. 1s2 2s2 2p6 3s2 3p6 C. 1s2 2s2 2p6 3s2 3p5 D. 1s2 2s2 2p6 3s2 3p6 4s2 3d1 10. El siguiente esquema representa parte de la información que contiene la tabla periódica 6 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES Si se tiene en cuenta que los elementos que quedan ubicados en un mismo grupo presentan propiedades químicas semejantes, es válido afirmar que forman parte de un grupo los siguientes elementos A. B, C y N B. N, S y Br C. Be, Mg y Ca D. Li, Na y Be LA EXCRECIÓN Proceso de eliminación de sustancias no útiles para el organismo, manteniendo constante la composición del medio celular. Los gases salen de la célula por difusión a través de la membrana. Los líquidos y sólidos se eliminan por osmosis, difusión y transporte activo . 1. Excreción celular: Las células excretan sustancias líquidas y gaseosas a través de la membrana por osmosis, difusión y diálisis o paso de líquidos a gases a través de la membrana, causado por la diferencia de concentraciones.Orgánulos de excreción: Las vacuolas pulsátiles y contráctiles son estructuradas a manera de cavidades que toman del citoplasma agua y sustancias no útiles disueltas en ella, por medio de contracciones vierten su contenido. 2. Excreción en protistas: Excretan agua y bióxido de carbono por las vacuolas pulsátiles, cavidades que extraen agua y otras sustancias contrayéndose para expulsarlas por el citopigio. Líquidos y gases se eliminan por difusión a través de todo su cuerpo. 3. Excreción en bacteria: Cada célula a través de la membrana realiza su excreción, debido a que no posee tejidos conductores. Tienen metabolismo variado y excretan gran cantidad de sustancias de Azufre o de minerales de hierro, o toxinas, al descomponer sustancias orgánicas como bacterias saprofitas, que se alimentan de sustancias orgánicas en descomposición. 4. Excreción en algas: Elaboran sustancias de reserva o pigmentos. Las algas pardas producen alginatos que son aprovechados en la industria de los tejidos; las rojas elaboran mucílagos debido a la constitución de la membrana celular, producen el agaragar utilizado como medio de cultivo en bacteriología. 5. Excreción en hongos: Son heterótrofos, excretan a través de las hifas una serie de sustancias tóxicas para el hombre. Otros hongos producen sustancias que dañan al huésped como la roya del trigo, café, etc. 6. Excreción exterior. en plantas: Presentan Carecen diferentes de procesos sistema de excretor, eliminación. sus Gas productos carbónico no y salen oxígeno al se eliminan por difusión a través de los es tomas. Los tejidos de excreción están en toda la planta. Además de agua, gas carbónico, amoniaco, oxígeno, eliminan compuestos orgánicos como mucílagos, resinas, alcaloides, aceites y taninos. 7. Excreción en animales: Es la expulsión de los productos finales del metabolismo, sustancias no asimilables ni útiles para el organismo, manteniendo constante la organización interna del ser vivo. Se excreta bióxido de carbono, eliminado a través del aparato respiratorio, como v apor; y productos nitrogenados, provenientes del metabolismo de proteínas. A. Excreción en invertebrados: Los celentéreos no poseen aparato, excretan a través de la pared celular por difusión. Las esponjas, hidras, medusas excretan por medio de células emigra ntes, eliminando las sustancias catabólicas del agua. B. Excreción en invertebrados superiores: La lombriz de tierra posee órganos especializados, las células clorágenas, los nefridios y los tubos de Malpighi. excretores Los nefridios son tubos originados en el interior del cuerpo que desemboca en el exterior por los poros de la cara ventral inferior y lateral de cada anillo, excretando aguas y sustancias nitrogenadas. 7 INSTITUCIÓN EDUCATIVA ALCALDÍA DE MEDELLÍN PLAN DE APOYO Y ESTRATEGIAS PARA LA SUPERACIÓN DE DEBILIDADES Los tubos de Malpighi son órganos excretores de estómago e intestino. Tubos cerrados ramificados, los insectos y arácnidos, situados en sus células se acumulan uratos en y residuos insolubles que son vaciados en el intestino. C. Excreción en vertebrados: Presentan aparato, por medio del cual expulsan los productos finales del metabolismo no utilizados por el organismo: gas carbónico, eliminado en la respiración; sustancias nitrogenadas provenientes de la descomposición de los prótidos, eliminados a través de las células. Riñones: Órganos provenientes de los metanefridios, tienen como función s eparar de la sangre los compuestos de desecho para eliminarlos en forma d orina. Están formados por unidades llamadas nefronas; constan de dos partes: la cápsula de Bowman y el tubo urinario. a. b. C á p s u l a d e B o w m a n : Esfera hueca donde se realiza la absorción y filtrado de sustancias, está rodeado por un ovillo de capilares sanguíneos llamado glomérulo. T u b o u r i n a r i o : Situado a continuación de la cápsula, rodeado de capilares, terminan en un poro excretor por el cual pasa la orina al uréter, éste la lleva luego a la vejiga en donde se almacena para ser expulsada por la uretra al exterior. Formación de la orina: Por el fenómeno de transporte activo mediante filtración y reabsorción, así: la sangre pierde agua y sales durante la filtración que forma la orina primaria en la cápsula de Bowman, de la anterior se reabsorben sustancias que pueden ser utilizadas en los tubos urinarios. En estos mecanismos intervienen hormonas reguladoras de la absorción del agua, pérdida o recuperación de sales y control del pH. TALLER 6 1. ¿Qué es la excreción? 2. ¿Cómo salen los gases y los líquidos no útiles de la célula? 3. ¿Cómo las células excretan las sustancias? 4. ¿Cuáles son los orgánulos encargados de la excreción? ¿Cómo son? ¿Qué hacen? 5. ¿Qué tipo de sustancias excretan las bacterias? 6. ¿Qué sustancias excretan las algas? 7. ¿Cómo utiliza el hombre las excretas de las algas? 8. ¿A través de que estructuras los hongos excretan sustancias? 9. ¿Qué tipo de sustancias excretan los hongos? Riñones 10. Explique cómo se lleva a cabo la excreción en las plantas Uréter 11. ¿Qué tipo de compuestos orgánicos excretan las plantas? Vejiga 12. ¿Cómo se define la excreción en animales? 13. ¿Qué sustancias excretan los animales? Uretra 14. ¿Cómo es la excreción en animales invertebrados? 15. ¿Cómo es la excreción en invertebrados superiores? 16. ¿Qué son los nefridios? 17. ¿Qué son los tubos de Malpighi? Sistema urinario de un animal vertebrado 18. ¿Cómo es la excreción en vertebrados? 19. ¿Qué función cumplen los riñones? 20. ¿Cómo están formados los riñones? 21. ¿Qué es la cápsula de Bowman? 22. ¿Qué es el tubo urinario? 23. Haga un resumen acerca de cómo se forma la orina. 24. Copie el dibujo con el título y el nombre se las estructuras representadas BIBLIOGRAFÍA http://personal.iddeo.es/romeroa/latabla/index.htm http://www.google.com/Top/World/Espa%C3%B1ol/Ciencia_y_tecnolog%C3%ADa/Qu%C3%ADmica/Tabl a_Peri%C3%B3dica/ http://www.fisicanet.com.ar/quimica/q1tp02/tpq1_06a_Tabla_Periodica.php http://www.fisicanet.com.ar/quimica/qu_1_tabla_p.php http://www.juntadeandalucia.es/averroes/~jpccec/tablap/tests/test1.html http://w3.cnice.mec.es/eos/MaterialesEducativos/mem2002/quimica/index.html http://chemicalelements.com/ 8