Escalas y Solucionario
Anuncio

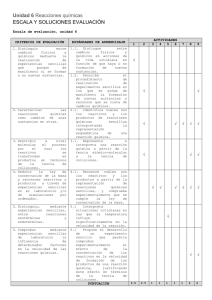
Unidad 6 Reacciones químicas 1. APELLIDOS: …………………………………………………… NOMBRE: ……………………… FECHA: ……………………… GRUPO: ………………………… CURSO: ………………. a) Al calentar alcohol en un vaso, se produce la evaporación del mismo. ¿Es un cambio físico o químico? ¿Por qué? b) Al encender con una cerilla un poco de alcohol, se producen nuevas sustancias en estado gaseoso. ¿Es un cambio físico o químico? Razona la respuesta. 2. En el siguiente esquema, qué enlaces se rompen y cuáles se forman nuevos. Escribe la ecuación química ajustada que representa dicho proceso. 3. Completa los datos de la siguiente ecuación química: 2 Cl2 (g) Mol 4. 2 + __ Volumen __ + 3 Masa + 96 __ → 2 Cl2O3 (g) + 3 O2 (g) → __ → __ __ Realiza el ajuste estequiométrico de las siguientes ecuaciones químicas: a) H2S (g) + O2 (g) → SO2 (g) + H2O (g) b) Fe2O3 (s) + CO (g) → CO2 (g) + Fe (s) 5. Se calientan 10 g de azufre y 10 g de hierro en un recipiente cerrado. La ecuación química es: S (s) + Fe (s) → FeS (s) a) ¿Hay algún reactivo en exceso? b) ¿Qué cantidad de FeS se produce? 6. El agua oxigenada se descompone según la siguiente reacción: H2O2 (l) → H2O (l) + O2 (g) Ajusta la ecuación química y calcula los gramos de oxígeno que se obtienen a partir de 85 g de agua oxigenada. Unidad 6 Reacciones químicas 1 Secundaria Unidad 6 Reacciones químicas APELLIDOS: …………………………………………………… NOMBRE: ……………………… FECHA: ……………………… GRUPO: ………………………… 7. CURSO: ………………. Lee el siguiente texto y responde a las preguntas: El ozono protector El ozono de la estratosfera actúa como un filtro de la luz ultravioleta de alta energía. Se produce mediante la siguiente reacción: O2 + radiación solar → O + O O + O2 → O3 + energía Las actividades humanas han reducido la capa de ozono al introducir en dicha capa de la atmósfera sustancias químicas que trasforman el ciclo natural de formación y descomposición de ozono. a) Consulta el dibujo y escribe las ecuaciones químicas de la destrucción del ozono a partir del CFCl3 [triclorofluorometano]. b) ¿Cuáles son los reactivos y los productos en la reacción de descomposición del CFCl3? c) ¿Cuántos litros de Ozono se destruirán con 10 L de CFCl3? d) ¿Por qué es tan importante que se conserve la capa de ozono en la atmósfera terrestre? ¿Cómo influye la intervención humana? 8. Lee el siguiente texto y responde: La lluvia ácida El agua pluvial es ácida por naturaleza, debido a que el CO2 reacciona con el agua y forma ácido carbónico, H2CO3, que le confiere en general un pH de 5,6. La lluvia ácida tiene un pH de 4. El pH de casi todas las aguas naturales que contienen organismos vivos está entre 6,5 y 8,5 La lluvia ácida se produce principalmente por la emisión de óxidos de azufre y de nitrógeno a la atmósfera, donde pueden transformarse, entre otros compuestos, en los ácidos sulfúrico y nítrico. a) Analiza la imagen y describe el proceso de formación de la lluvia ácida, indicando el origen de dicha contaminación. b) Consulta las masas atómicas en la tabla periódica para calcular la masa molecular y la composición centesimal del compuesto ácido de azufre. c) Teniendo en cuenta la ley de conservación de la masa, completa los datos de las reacciones que producen la lluvia ácida: SO3 + H2O → H2SO4 4 NO2 __ __ 18 g 98g Unidad 6 Reacciones químicas + 2 H2O 36 g 2 __ + O2 → 4 HNO3 __ Secundaria Escala de evaluación, unidad 6 CRITERIOS DE EVALUACIÓN ESTÁNDARES DE APRENDIZAJE 1. Distinguir entre cambios físicos y químicos mediante la realización de experiencias sencillas que pongan de manifiesto si se forman o no nuevas sustancias. 1.1. Distingue entre cambios físicos y químicos en acciones de la vida cotidiana en función de que haya o no formación de nuevas sustancias. 1.2. Describe el procedimiento de realización de experimentos sencillos en los que se ponga de manifiesto la formación de nuevas sustancias y reconoce que se trata de cambios químicos. 2.1. Identifica cuáles son los reactivos y los productos de reacciones químicas sencillas interpretando la representación esquemática de una reacción química. 3.1. Representa e interpreta una reacción química a partir de la teoría atómico-molecular y la teoría de colisiones. 2. Caracterizar las reacciones químicas como cambios de unas sustancias en otras. 3. Describir a nivel molecular el proceso por el cual los reactivos se transforman en productos en términos de la teoría de colisiones. 4. Deducir la ley de conservación de la masa y reconocer reactivos y productos a través de experiencias sencillas en el laboratorio y/o de simulaciones por ordenador. 5. Distinguir, mediante experiencias sencillas, entre reacciones exotérmicas y endotérmicas. 6. Comprobar mediante experiencias sencillas de laboratorio la influencia de determinados factores en la velocidad de las reacciones químicas. 1 2 7 8 9 √ √ √ √ √ √ √ 4.1. Reconoce cuáles son los reactivos y los productos a partir de la representación de reacciones químicas sencillas, y comprueba experimentalmente que se cumple la ley de conservación de la masa. 5.1 Interpreta situaciones cotidianas en las que la temperatura influye significativamente en la velocidad de la reacción. 6.1 Propone el desarrollo de un experimento sencillo que permita comprobar experimentalmente el efecto de la concentración de los reactivos en la velocidad de formación de los productos de una reacción química, justificando este efecto en términos de la teoría de colisiones. PUNTUACIÓN ACTIVIDADES 3 4 5 6 √ √ √ √ √ √ √ √ √ √ √ √ √ 0,5 0.5 1 1 1 1 1 2 2