(OH)2
Anuncio

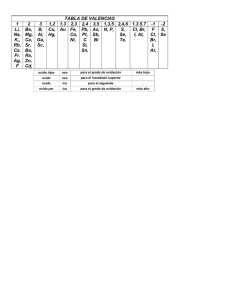
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : ASIGNATURA: DOCENTE: TIPO DE GUIA: PERIODO 2 CIENCIAS NATURALES Y EDUCACION AMBIENTAL QUIMICA OSCAR GIRALDO HERNANDEZ CONCEPTUAL - EJERCITACION GRADO N0 FECHA DURACION 10 3 8 ABRIL 2013 ___ UNIDADES INDICADORES DE DESEMPEÑO 1. 2. 3. 4. 5. Reconoce por su nombre o fórmula química los óxidos, peróxidos e hidruros. Reconoce por su nombre o fórmula química los hidróxidos, los hidrácidos y los oxácidos. Reconoce por su nombre o fórmula química las sales. Reconoce experimentalmente diferentes tipos de reacciones de los óxidos, ácidos y sales. Valora la influencia que tiene la química en la vida diaria y en la industria. LA NOMENCLATURA QUIMICA DE LOS COMPUESTOS INORGANICOS Así como cada persona tiene un nombre propio que la diferencia de las demás, con los compuestos químicos ocurre lo mismo; cada uno tiene un nombre que lo diferencia de los demás. A medida que se fueron descubriendo los compuestos químicos, se les asignaron nombres comunes; por ejemplo, el ácido fórmico recibió ese nombre debido a que se extraía de las hormigas; el ácido butírico porque se encontraba en la mantequilla; a otros se les dieron sus nombres por sus características, como su color o también por sus aplicaciones; un ejemplo muy claro es el H2O, el cual todos llamamos agua (iniciador de vida). A nadie se le ocurriría llamar el agua oxido de dihidrogeno, que es su nombre químico. Esta variedad de nombres resultaba muy compleja y no permitía identificar los compuestos; además, se prestaba para confusiones. Por esta razón, en 1921, se formó una organización llamada Unión Internacional de Química Pura y Aplicada (IUPAC), la cual se encargó de crear reglas para nombrar los compuestos químicos y, así, establecer un lenguaje universal. De esta manera, para los químicos, el nombre de una sustancia no solo la identifica sino que revela su fórmula y su composición. Para obtener la fórmula de un compuesto, o sea, su expresión abreviada, sólo se escriben los símbolos de los elementos presentes en el compuesto y la cantidad de átomos de cada elemento, expresados por los subíndices. Siempre se coloca en primer término el catión, o parte positiva, y luego el anión, o parte negativa. La suma de las cargas positivas debe ser igual a la suma de las cargas negativas, es decir, el compuesto debe ser neutro. La nomenclatura química es la expresión oral de las sustancias químicas. La expresión escrita de tales sustancias se llama notación química. Se denomina función química al conjunto de propiedades comunes que caracterizan a una serie de sustancias, y por las cuales se diferencian de las demás. Las principales funciones de la química inorgánica son: los óxidos, las bases, los ácidos y las sales. El grupo funcional es el átomo o agrupación de átomos cuya presencia en la molécula determina las propiedades características de la función. Por ejemplo, las bases o hidróxidos llevan en su estructura el grupo funcional –OH. El nombre que se le da a una sustancia química, la debe distinguir con claridad y sin ambigüedad de todas las otras sustancias que se conocen. La existencia de más de un millón de compuestos 1 químicos inorgánicos hace muy difícil la tarea de nombrarlos. Para nombrar los compuestos inorgánicos se emplean tres tipos de nomenclatura: La nomenclatura clásica o tradicional. La nomenclatura Stock: en honor del químico alemán Alfred Stock La nomenclatura sistemática: establecida por la IUPAC NOMENCLATURA CLASICA O TRADICIONAL Utiliza los prefijos hipo, per y los sufijos oso, ico, hídrico, ito, ato, uro acompañados de la raíz del nombre latino del elemento. OXIDO HIPOCLOROSO SULFITO DE CALCIO OXIDO CLOROSO SULFATO DE CALCIO OXIDO CLORICO ACIDO CLORHIDRICO OXIDO PERCLORICO CLORURO DE SODIO NOMENCLATURA STOCK En este sistema, se escriben los nombres de los compuestos así: el nombre de la función, seguido de la preposición de y el nombre del elemento. Adicionalmente, entre paréntesis, se escribe en números romanos el estado de oxidación del elemento unido a la función. OXIDO DE CARBONO (II) OXIDO DE CARBONO (IV) HIDROXIDO DE HIERRO (II) HIDROXIDO DE HIERRO (III) NOMENCLATURA SISTEMATICA Con este sistema, se utilizan los prefijos mono, di, tri, tetra, penta, hexa, hepta, octa, nona, deca, etc., que respectivamente corresponden a los números 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, etc., unidos al nombre de la función y al nombre del elemento; indican la cantidad de cada uno de ellos en el compuesto. MONOXIDO DE CARBONO DIOXIDO DE CARBONO TRIOXIDO DE DINITROGENO HEPTOXIDO DE BROMO 1. LOS OXIDOS En general, los óxidos son compuestos formados por la combinación del oxígeno con otro elemento. El oxígeno se combina con la mayoría de los elementos, excepto con el helio, el neón, el argón, el oro, el paladio y el platino. Los óxidos ácidos están constituidos por el oxígeno y un elemento no metálico. Los óxidos básicos son combinaciones del oxígeno con un elemento metálico. Los óxidos tienen como fórmula general. E = símbolo del elemento respectivo x = número de oxidación del oxígeno x y O = símbolo del oxígeno y = número de oxidación de E EO Para nombrar los óxidos se presentan los siguientes casos: CUANDO EL ELEMENTO POSEE UN ESTADO DE OXIDACION UNICO Nomenclatura clásica: Nombre genérico óxido, preposición de y el nombre del elemento diferente al oxígeno. Nomenclatura Stock: Nombre genérico óxido, preposición de y el nombre del elemento. Entre paréntesis en números romanos el estado de oxidación del elemento diferente al oxígeno. 2 Nomenclatura sistemática: Prefijo que indica cantidad de oxígenos, palabra óxido, preposición de, prefijo que indica cantidad del elemento diferente al oxígeno y el nombre del elemento. B2O3 (NC): óxido de boro (NS): óxido de boro (III) (NM): trióxido de diboro Ag2O (NC): óxido de plata (NS): óxido de plata (I) (NM): dióxido de plata CUANDO EL ELEMENTO FORMA OXIDOS CON DOS ESTADOS DE OXIDACION DIFERENTES Nomenclatura clásica: el de menor estado de oxidación se nombra con el sufijo oso y el de mayor estado de oxidación con el sufijo ico. Nomenclatura Stock: como en el primer caso. Nomenclatura sistemática: como en el primer caso. FeO NC) Oxido ferroso (NS) Óxido de hierro (II) (NM) Monóxido de hierro Fe2O3 (CN) Oxido férrico (NS) Oxido de hierro (III) (NM) trióxido de dihierro SI EL ELEMENTO FORMA OXIDOS CON CUATRO ESTADOS DE OXIDACION DIFERENTES. Nomenclatura clásica: el de menor número de oxidación se nombra con el prefijo hipo y el sufijo oso; El segundo con el sufijo oso; el tercero con el sufijo ico y el de mayor número de oxidación con el prefijo per y el sufijo ico. Nomenclatura Stock: como el primer y segundo caso. Nomenclatura sistemática: Como en el primer y segundo caso. Br2O (NC) Oxido hipobromoso (NS) Oxido de bromo (I) (NM) Monóxido de dibromo Br2O3 Br2O5 (NC) Oxido bromoso (NS) Oxido de bromo (III) (NM) Trióxido de dibromo (NC) Oxido brómico (NS) Oxido de bromo (V) (NM) Pentóxido de dibromo Br2O7 (NC) Oxido perbromico (NS) Oxido de bromo (VII) (NM) Heptóxido de dibromo 2. LOS PEROXIDOS Son compuestos que poseen el enlace - O – O - y su característica es que poseen un oxígeno más que el óxido metálico que forma con los grupos IA y IIA. Se nombran con la palabra peróxido, la preposición de, seguida del nombre del elemento unido al oxígeno. El peróxido más conocido es el peróxido de hidrógeno o agua oxigenada que se utiliza en solución como antiséptico. H2O2 Li2O2 CaO2 Peróxido de hidrogeno Peróxido de litio Peróxido de calcio 3. LOS HIDRUROS Son compuestos binarios del hidrógeno con cualquier otro elemento. Se clasifican en hidruros metálicos e hidruros no metálicos. 3 Los hidruros metálicos que forman con los elementos de los grupos IA y IIA. Tiene como característica que el hidrógeno posee número de oxidación -1. Los hidruros metálicos se nombran con la palabra hidruro, la preposición de, seguida del nombre del elemento unido al hidrógeno. Los hidruros no metálicos el hidrogeno posee número de oxidación +1 y se conocen con nombres especiales. CsH NaH CaH2 Hidruro de cesio Hidruro de sodio Hidruro de calcio NH3 PH3 BH3 Amoniaco Hidruro de nitrogeno Fosfina Hidruro de fosforo Borano Hidruro de boro 4. LAS BASES O HIDROXIDOS Una base es un compuesto que, al disociarse en el agua, produce iones -OH, los cuales son llamados hidroxilos. Muchas bases presentan sabor amargo y tienen sensación resbalosa. No es conveniente, sin embargo, tratar de reconocerlos por este procedimiento. Algunas bases son venenosas y corrosivas. El papel tornasol (indicador base - ácido) nos puede ayudar. Las bases cambian a color azul el papel de tornasol rosado; colorean de rojo la fenolftaleína, neutralizan los ácidos y forman la sal respectiva y agua. Los hidróxidos provienen de la reacción de un óxido básico con el agua, lo cual determina que una base está constituida por un metal y el grupo -OH. Tienen como fórmula general: M(OH)x M = símbolo del metal OH = grupo hidroxilo X = número de oxidación de M NOMENCLATURA DE LAS BASES SI EL METAL POSEE UN ESTADO DE OXIDACIÓN UNICO .Nomenclatura clásica: nombre genérico hidróxido, preposición de y el nombre del metal. .Nomenclatura Stock: Nombre genérico Hidróxido, preposición de y nombre del metal Entre paréntesis en números romanos el estado de oxidación del metal. .Nomenclatura Sistemática: Se utilizan los prefijos di, tri, tetra, etc., según que la fórmula presente dos, tres o más grupos —OH, seguido de la palabra genérica hidróxido, la preposición de y el nombre del elemento metálico. Be (OH)2 (NC) Hidróxido de berilio (MS) Hidróxido de berilio (II) (NM) Dihidróxido de berilio Ca (OH)2 (NC) Hidróxido de calcio (MS) Hidróxido de calcio (II) (NM) Dihidróxido de calcio SI EL METAL FORMA HIDROXIDOS CON DOS NUNEROS DE OXIDACIÓN DIFERENTES: .Nomenclatura clásica: nombre genérico hidróxido, luego la terminación oso o ico para el de menor número de oxidación y mayor número de oxidación respectivamente. 4 .Nomenclatura Stock: como en el caso anterior. .Nomenclatura Sistemática: como en el caso anterior. CuOH (NC) Hidróxido cuproso (NS) Hidróxido de cobre (I) (NM) Monohidróxido de cobre Cu (OH)2 (MC) Hidróxido cúprico (NS) Hidróxido de cobre (II) (NM) Dihidróxido de cobre 5. CATIONES Son átomos o grupos de átomos cargados positivamente. Resultan de la disociación de las bases o hidróxidos. Los cationes con sus respectivos nombres de uso más frecuente son: CATION Li+ + K +2 Be +2 Zn Ag+ Cu+ Cu+2 Ni+2 Ni+3 Pt+2 Pt+4 NOMBRE Litio Potasio Berilio Cinc Plata Cuproso o cobre (I) Cúprico o cobre (II) Niquiloso o níquel (II) Niquílico o níquel (III) Platinoso o platino (II) Platínico o platino (IV) CATION Na+ +2 Ca +2 Mg +3 Al Au+ Au+3 Fe+2 Fe+3 Sn+2 Sn+4 + (NH4) NOMBRE Sodio Calcio Magnesio Aluminio Auroso u oro (I) Aúrico u oro (III) Ferroso o hierro (II) Férrico o hierro (III) Estañoso o estaño (II) Estanico o estaño (IV) amonio 6. LOS ACIDOS Según Arrhenius, se consideran ácidos aquellas sustancias que, al disolverse en agua, producen iones positivos de hidrógeno, (H+). Los ácidos enrojecen el papel de tornasol azul, decoloran la fenolftaleína que ha sido enrojecida por las bases, reaccionan con los hidróxidos para formar sales y agua. Existen dos clases de ácidos: los hidrácidos y los oxácidos. ACIDOS HIDRACIDOS Estos ácidos son combinaciones binarias del hidrógeno con los halógenos y algunos elementos del grupo VIA. Estos compuestos se nombran anteponiendo la palabra ácido; luego, el nombre específico del nometal y cambiando la terminación respectiva por el sufijo hídrico. HIDRACIDOS FORMULA NOMBRE HF HCl HBr HI H2S H2Se H2Te Ácido fluorhídrico – fluoruro de hidrogeno Ácido clorhídrico – cloruro de hidrogeno Ácido bromhídrico – bromuro de hidrogeno Ácido yodhídrico – yoduro de hidrogeno Ácido sulfhídrico – sulfuro de hidrogeno Ácido selenhídrico – seleniuro de hidrogeno Ácido telurhídrico – teleniuro de hidrogeno EXCEPCIONES DE LOS HIDRACIDOS FORMULA NOMBRE NH3 PH3 SbH3 AsH3 SiH4 BH3 B2H6 CH4 Amoníaco Fosfina Estibamina Arsenamina Silano Borano Diborano Metano 5 Otra forma de nombrarlos consiste en agregar la terminación uro la raíz del nombre del elemento diferente al hidrogeno seguido por la expresión hidrogeno. Existen algunos compuestos binarios entre el hidrógeno y algunos no metales que no son hidrácidos y se les conocen con nombre de hidruros no metálicos y se nombran con nombres específicos: ACIDOS OXACIDOS Estos ácidos son compuestos formados a partir de la combinación de los óxidos ácidos con el agua. Los oxácidos están formados por tres clases de átomos: el hidrógeno, un no-metal y el oxígeno. El hidrógeno, en estos compuestos, tiene número de oxidación +1, el oxígeno -2 y el elemento no metálico varía su estado de oxidación, lo cual hace que el nombre del ácido correspondiente también varíe. Para nombrar los oxácidos se pueden utilizar los tres sistemas de nomenclatura: Nomenclatura tradicional: se comienza con la palabra ácido y hace uso de los sufijos oso o ico y de los prefijos hipo o per, si existen más de dos ácidos oxácidos de ese elemento. La nomenclatura Stock: adiciona, a la palabra ácido, el prefijo respectivo según la cantidad de oxígenos, seguido de la palabra oxo y la raíz del nombre correspondiente del elemento no metálico diferente del hidrógeno y del oxígeno, con la terminación ico y su número de oxidación en números romanos. La nomenclatura Sistemática: similar a la Stock, cambiando la terminación ico por ato del nombre del ion; luego la palabra de hidrógeno. HNO2 (NC) ácido nitroso (NS) Dioxonítrico III (NM) Dioxonitrato III de Hidrógeno HNO3 (NC) ácido nítrico (NS) Trioxonítrico V (NM) trioxonitrato V de hidrógeno 7. ANIONES Los aniones son iones negativos: estos provienen tanto de los ácidos hidrácidos como de los oxácidos. Para formarlos basta sustraer los hidrógenos del ácido respectivo y la carga del anión es igual al número de hidrógenos desplazados. Para nombrarlos se debe tener en cuenta lo siguiente: Si proviene de los ácidos hidrácidos, la terminación hídrico se cambia por uro. Si proviene de los oxácidos la terminación OSO se cambia por ITO y la terminación ICO por ATO ANION FCl Br IS= CO3 = HCO3 PO3 –3 PO4 -3 NOMBRE Fluoruro Cloruro Bromuro Yoduro Sulfuro Carbonato Bicarbonato Fosfito Fosfato ANION NOMBRE ANION NOMBRE IO IO2 IO3 IO4 NO2 NO3 SO3 = SO4 = Hipoyodito Yodito yodato Peryodato Nitrito Nitrato Sulfito Sulfato ClO ClO2 ClO3 ClO4 MnO MnO4 = CrO4 = Cr2O7 = Hipoclorito Clorito Clorato Perclorato Permanganato Manganato Cromato Dicromato 6 8. LAS SALES Las sales se forman teóricamente por sustitución de los átomos de hidrogeno de los ácidos por los átomos metálicos de las bases y prácticamente se forman por la reacción de los ácidos con las bases dando sales más agua; esta reacción se llama reacción de neutralización. Tanto para su nomenclatura como para su formulación, las sales se dividen en sales neutras, sales ácidas, sales básicas y sales dobles. SALES NEUTRAS Estas sales no contienen hidrógenos, todos han sido reemplazados por elementos metálicos. La nomenclatura de las sales neutras es bastante parecida a la de los ácidos. El éxito para dar los nombres correctos a las sales radica en el dominio que se tenga de la información sobre los iones positivos o cationes y los iones negativos o aniones. En el sistema tradicional se utiliza para los aniones los sufijos uro, ito y ato y los prefijos hipo y per. Para los cationes los sufijos oso e ico. Las sales formadas por un metal y un no-metal se llaman sales haloideas y los aniones terminan en uro. La nomenclatura Stock y la sistemática se combinan para nombrar las sales. Se nombran primero los aniones y luego los cationes. Para los aniones, se hace uso de los prefijos di, tri, tetra, ... para indicar el número de oxígenos. Luego, a la raíz del nombre del elemento no metálico, diferente al oxígeno, se le agrega la terminación ato, y en número romanos, el estado de oxidación de dicho elemento. Para los cationes, se nombra el metal seguido del número romano que corresponda al número de oxidación. Si el catión sólo tiene un número de oxidación, se da únicamente el nombre de dicho elemento. CuNO2 KF Nitrito cuproso Nitrito de cobre (I) Trioxonitrato III de Cobre I Fluoruro de potasio SALES ACIDAS Son sales que contienen uno o varios hidrógenos en la molécula. Para nombrar las sales ácidas se tienen en cuenta los criterios dados para las sales neutras y se recuerda que, ahora, se tienen uno o dos hidrógenos en la fórmula. Fe2(HPO4)3 Hidrogeno fosfato férrico Hidrógeno fosfato de hierro (III) Fosfato ácido férrico Fosfato ácido de hierro (III) Tetrafosfato V de hidrógeno y de hierro III LiHCO3 Bicarbonato de litio Carbonato ácido de litio Tricarbonato IV de hidrógeno y litio 7 SALES BASICAS Las sales básicas resultan de sustituir en una base, parcialmente, los grupos -OH. También se obtiene una sal básica cuando en una sal neutra se han sustituido parcialmente los átomos metálicos por grupos —OH. Se nombran igual que las sales neutras, colocando la palabra básico o dibásico, según tengan uno o dos grupos –OH CuOHNO3 Nitrato básico cúprico Nitrato básico de cobre (II) MgOHCl Al (OH)2ClO Cloruro básico de magnesio Hipoclorito dibásico de aluminio SALES DOBLES Son aquellas que se forman cuando el ácido reacciona con dos bases de diferentes metales; se nombran igual que las sales neutras, sólo que en seguida del nombre del anión van los nombres de los dos cationes. NaLiNO3 CuFePO4 Nitrato de litio y sodio Fosfato cuproso ferroso PRUEBA DE QUÍMICA PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA - (TIPO I) Estas preguntas se desarrollan en torno a una idea o problema al cual se refieren las opciones o posibilidades de respuesta. Constan de un enunciado en el que se expone el problema y cuatro posibilidades de respuestas. Las cuales son expresiones que completan el enunciado inicial; entre estas opciones debe escogerse una, la que usted considere correcta. 1. Los nombres de los compuestos FeO (Fe: 2,3) y SO 2 (S: 2,4,6) son respectivamente, óxidos A. hipoferroso y sulfuroso B. de hierro (III) y sulfúrico C. Ferroso y trióxido de azufre D. de hierro (II) y azufre (IV) 2. ¿Cuál de las siguientes estructuras corresponde al ácido perclórico? A. HClO7 B. H2ClO7 C. H3ClO7 D. HClO4 3. ¿cuál de las siguientes formulas corresponde a un hidruro no metálico? A. FrH B. BeH2 C. B2H6 D. CaH2 4. Es considerada una sal ácida: A. (NH4)2SO3 B. CaCO3 C. KHSO4 D. KCl “EL QUE TODO LO JUZGA FÁCIL, ENCONTRARÁ DIFICULTADES” 8