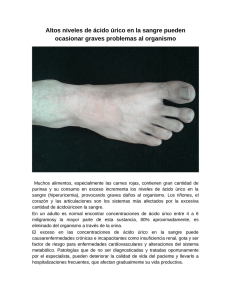
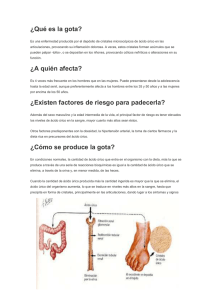
HIPERURICEMIA Y GOTA
Anuncio

01_Portada.pdf 1 30/04/13 13:13 C M Y HIPERURICEMIA Y GOTA CM MY CY Riesgo renal y cardiovascular CMY K ADU-304 MAY’13 Coordinador: José Luño Avalado por: Sociedad Española de Nefrología 3,6 CRÉDITOS Nº expediente 09/07757-MD Título original: Hiperuricemia y gota. Riesgo renal y cardiovascular Coordinador: José Luño Jefe del Servicio de Nefrología. Hospital General Universitario Gregorio Marañón. Madrid Avda. dels Vents, 9-13, esc. B, 2.º 1.ª 08917 Badalona [email protected] www.euromedice.net Depósito legal: B-11195-2013 isbn: 978-84-15134-86-2 Edición patrocinada por Menarini © Copyright 2013. EUROMEDICE, Ediciones Médicas, S.L. Reservados todos los derechos de la edición. Prohibida la reproducción total o parcial de este material, fotografías y tablas de los contenidos, ya sea mecánicamente, por fotocopia o cualquier otro sistema de reproducción, sin autorización expresa del propietario del copyright. El editor no acepta ninguna responsabilidad u obligación legal derivada de los errores u omisiones que puedan producirse con respecto a la exactitud de la información contenida en esta obra. Asimismo, se supone que el lector posee los conocimientos necesarios para interpretar la información aportada en este texto. HIPERURICEMIA Y GOTA Riesgo renal y cardiovascular Coordinador: José Luño Índice Metabolismo del ácido úrico ...................................................................................................... 5 Alberto Ortiz, María Dolores Sánchez-Niño Hiperuricemia y gota ................................................................................................................. 13 Eugenio Chamizo Carmona, Adela Galllego Flores Diagnóstico de gota .................................................................................................................. 21 Eliseo Pascual Gómez Actualización del tratamiento de la gota .................................................................................. 27 Fernando Pérez-Ruiz, Ane Altuna, Joana Atxotegi Ácido úrico. Obesidad y síndrome metabólico ........................................................................ 35 Luis M. Beltrán Romero, Rosa Torres Jiménez, Juan García Puig Hiperuricemia e hipertensión arterial ....................................................................................... 43 Úrsula Verdalles, José Luño Hiperuricemia y enfermedad renal ........................................................................................... 47 Marian Goicoechea El ácido úrico y el riesgo cardiovascular .................................................................................. 55 Francisco Fernández Vega, Alfonso Pobes Martínez de Salinas Hiperuricemia en pacientes con enfermedad renal crónica avanzada y en diálisis .............. 65 Patricia de Sequera Ortiz, Marta Albalate Ramón, Rafael Pérez García Hiperuricemia en pacientes trasplantados renales ................................................................. 73 Enrique Morales, Jose María Campistol Manejo de la hiperuricemia y la gota en el paciente con enfermedad renal crónica ............ 83 Pedro Aranda Lara Hiperuricemia y litiasis renal ..................................................................................................... 91 Félix Grases, Antonia Costa-Bauza Sobreproducción de ácido úrico. Enfermedad de Lesch-Nyhan, trastornos mielo- y linfoproliferativos ....................................................................................... 97 Rosa Torres Jiménez, Juan García Puig 3 Metabolismo del ácido úrico Alberto Ortiz Jefe de Servicio de Nefrología, Instituto de Investigación Sanitaria Fundación Jiménez Díaz, Madrid. Profesor Titular de Medicina, Universidad Autónoma de Madrid María Dolores Sánchez-Niño Investigadora posdoctoral Sara Borrell. IDIPAZ. Madrid Puntos clave 1.La principal fuente de ácido úrico es el metabolismo endógeno de las purinas. 2.Dieta: diversos alimentos, incluidos los ricos en purinas, modifican la uricemia. 3.Excreción renal e intestinal: los factores genéticos de los transportadores explican el 60 % de la variabilidad poblacional de la uricemia. 4.Existen hiperuricemias por excreción renal de ácido úrico insuficiente y por sobrecarga del mecanismo de excreción renal debido a producción excesiva o a excreción intestinal de ácido úrico insuficiente. 5.Diversos fármacos suben o bajan la uricemia. Los principales fármacos que la disminuyen terapéuticamente son los inhibidores de la xantina oxidasa (alopurinol, febuxostat), la uricasa y los uricosúricos. Introducción En el ser humano el ácido úrico es el producto final del metabolismo de las purinas. El ácido úrico es un ácido débil con un pKa de 5,75. Al pH fisiológico del compartimiento extracelular (7,40), el 98 % del ácido úrico está ionizado como urato, fundamentalmente urato monosódico. La orina se acidifica a lo largo del túbulo renal y, al bajar el pH, el urato urinario se convierte en ácido úrico de baja solubilidad. La uricemia depende del balance entre producción y excreción de urato (figura 1). El urato se produce principalmente en el hígado y en menor grado en el intestino delgado. La producción de urato depende del equilibrio entre la ingestión de purinas, la síntesis de novo de purinas en las células, el reciclado de purinas y su degradación por la xantina oxidasa (figura 2). Dos tercios del urato provienen de la degradación de purinas endógenas y el resto de las purinas de la dieta. A diferencia de otros mamíferos, el hombre y otros primates no tienen uricasa, que convierte el ácido úrico (relativamente insoluble) en alantoína (muy soluble). La mayoría (70 %) del ácido úrico producido diariamente se excreta por vía renal. El resto se elimina en el tracto gastrointestinal y es posteriormente convertido a alantoína por la uricasa de las bacterias del colon. La uricemia varía mucho entre individuos y está influida por el sexo, la función renal y factores genéticos y ambientales (fundamentalmente dieta, fármacos y determinadas enfermedades adquiridas). Los factores genéticos explican alrededor del 60 % de la variabilidad de la uricemia y dependen sobre todo de polimorfismos de transportadores renales e intestinales de ácido úrico (tabla 1). La concentración sérica de urato es más alta en los varones (se considera hiperuricemia > 7 mg/dl) que en las mujeres (hiperuricemia: > 6 mg/dl), debido al efecto uricosúrico de los estrógenos. El 90 % de las hiperuricemias son consecuencia de una menor excreción renal de ácido úrico (tabla 2). Aquellos que sobreproducen ácido úrico representan menos del 10 % de los pacientes con gota. 5 Hiperuricemia y gota Riesgo renal y cardiovascular Figura 1. Metabolismo del ácido úrico y oportunidades para la intervención terapéutica (en verde). La uricasa no está presente en el ser humano, pero se puede administrar terapéuticamente. En rojo, algunos factores que contribuyen a la hiperuricemia. Las dos grandes causas de hiperuricemia (hipoexcreción o sobrecarga renal) están indicadas, así como las dos variedades de sobrecarga renal (aumento de producción o disminución de la eliminación extrarrenal) Producción Hiperuricemia por hiperproducción Purinas endógenas Purinas exógenas Destrucción tisular Fructosa, etanol Inhibidores de xantina oxidasa Restricción dieta Inhibidor CNT2? 30 % 70 % Alantoína Urato 70 % 30 % Uricasa Excreción Riñón Filtrado glomerular Reabsorción tubular Excreción extrarrenal: • Bilis: 2 % • Intestino 28 % Secreción tubular Uricosúricos Insuficiencia renal Excreción renal Hiperuricemia hipoexcretora extrarrenal (ABCG2/BCRP) Hiperuricemia hipoexcretora renal Hiperuricemia por sobrecarga renal ABCG2/BCRP: ATP-binding cassette sub-family G member 2//breast cancer resistance protein; CNT2: concentrative nucleoside transporter 2. Se considera hipouricemia los niveles plasmáticos de ácido úrico < 2,0 mg/dl. Está presente en el 0,8 % de los pacientes hospitalizados y en un 0,2 % de la población general. Puede deberse a defectos en la producción de ácido úrico (excreción fraccional de 6 ácido úrico reducida) o a defectos en el transporte tubular proximal de ácido úrico, incluido el síndrome de Fanconi (tubulopatía proximal generalizada), con excreción fraccional de ácido úrico aumentada (> 10 %). Metabolismo del ácido úrico Figura 2. Catabolismo de las purinas y oportunidades para la intervención terapéutica (en negrita y encuadrado). En azul, la vía de reciclaje de purinas AMP IMP Adenosina Inosina HGPRT Hipoxantina Xantina oxidasa XMP GMP Xantosina Guanosina Xantina Guanina HGPRT Xantina oxidasa Febuxostat, alopurinol Ácido úrico O H N O H N O N N H H Uricasa Alantoína AMP: monofosfato de adenosina; GMP: monofosfato de guanosina; HGPRT: hipoxantina-guanina fosforibosiltransferasa; IMP: monofosfato de inosina; XMP: monofosfato de xantosina. Tabla 1. Transportadores de urato cuyas variantes genéticas o mutaciones se asocian con hiper- o hipouricemia. Todos son transportadores de túbulos proximales, excepto ABCG2, que se expresa en célula tubular proximal e intestino y cuya disfunción origina hiperuricemia de causa intestinal Gen Transportador Nombre SLC22A12 URAT1 Urate transporter 1 SLC2A9 GLUT9/URATv1 Glucose transporter 9 SLC22A11 OAT4 Organic anion transporter 4 SLC17A1 Npt1 (NaPi-1) Na phosphate transporter-1 SLC17A3 Npt4 (NaPi-4) Na phosphate transporter-4 ABCG2 ABCG2/BCRP ATP-binding cassette sub-family G member 2/breast cancer resistance protein ABCG2: ATP-binding cassette sub-family G member 2. 7 Hiperuricemia y gota Riesgo renal y cardiovascular Tabla 2. Clasificación de la hiperuricemia Tipo EUU (mg h−1/1,73 m2) FEUA (%) Tipaje ABCG2 Hipoexcreción renal de urato Normal < 5,5 Normal Por sobreproducción > 25 (> 600 mg/día) Normal Normal Por hipoexcreción extrarrenal Normal Normal Anormal > 25 < 5,5 Anormal Sobrecarga renal de urato Combinada 1 EUU: excreción urinaria de úrico; FEUA: excreción fraccional de urato. 1 Combinación de dos o más de estas características. Origen del ácido úrico Las purinas son moléculas heterocíclicas aromáticas que forman parte de los ácidos nucleicos. Además, la purina nucleótido trifosfato de adenosina (ATP) es el principal dador de energía de las reacciones intracelulares. Otros metabolitos de esta vía son el difosfato de adenosina (ADP), el monofosfato de adenosina (AMP) y la adenosina (figura 2). La dieta humana contiene poco ácido úrico y es más relevante el aporte dietético de sus precursores las purinas. Históricamente, la hiperuricemia y la gota se han asociado a un estilo de vida con excesos de carne en la dieta y de alcohol. La prevalencia de gota en los varones aumenta con un consumo alto de carne, mariscos, fructosa, cerveza (rica en purinas) y licores. En contra de la sabiduría popular, existe más riesgo al comer en exceso carne roja que marisco. Los refrescos endulzados contienen grandes cantidades de fructosa. No está claro si solo modula la uricemia la fructosa derivada del maíz, usada en Estados Unidos, o si también lo hace la sacarosa (disacárido de glucosa y fructosa), usada en Europa. Por el contrario, las verduras ricas en purinas y el consumo moderado de vino no modifican la uricemia. Las dietas con contenido alto de productos lácteos bajos en grasa, la vitamina C y el café, incluido el descafeinado, se asociaron con un riesgo menor. La reciente descripción de inhibidores del trasportador de purinas que media su absorción intestinal (Cnt-2) puede suponer una nueva diana terapéutica. Las enfermedades caracterizadas por alto turnover de ácidos nucleicos pueden producir hiperuricemia, incluidos trastornos mieloproliferativos y linfoproliferativos, psoriasis y anemia hemolítica. 8 Otra causa de sobreproducción de ácido úrico es la aceleración de la degradación de ATP a AMP, un precursor del ácido úrico. Tanto el exceso de alcohol como el exceso de fructosa favorecen la transformación de ATP a AMP. El metabolismo del etanol a acetil CoA conduce a la degradación de nucleótidos de adenina, generando AMP. Además, el etanol aumenta el nivel de ácido láctico en la sangre, que, a su vez, inhibe la excreción de ácido úrico, y la fructosa interactúa con el transportador GLUT9. La deficiencia de hipoxantina-guanina fosforibosiltransferasa (HGPRT) impide el reciclaje de purinas y causa un raro síndrome ligado a X que, entre otras manifestaciones, tiene hiperuricemia y gota (síndrome de Lesch-Nyhan). Aclaramiento del ácido úrico El ácido úrico se excreta fundamentalmente por la orina y en menor medida por el sistema gastrointestinal (figura 1). El manejo renal del urato es complejo. Consiste en filtración glomerular y reabsorción, y secreción tubular, que en el ser humano tiene lugar en el túbulo proximal. Alrededor del 90 % de la carga diaria de urato filtrado por los riñones es reabsorbido y el 10 % restante excretado en orina. Un 99-100 % del urato filtrado sería inicialmente reabsorbido. Una fase ulterior de secreción tubular devolvería a la luz tubular un 50 % del urato inicialmente filtrado. La mayor parte sería reabsorbida de nuevo en el túbulo proximal (reabsorción postsecretora). Todavía se están describiendo transportadores de urato de las células tubulares renales que contribuyen a la reabsorción y secreción tubular (figura 3). Los Metabolismo del ácido úrico Figura 3. Transportadores de ácido úrico del túbulo proximal humano. Un complejo sistema de transportadores, todavía no completamente caracterizados, promueven tanto la reabsorción como la secreción de urato Reabsorción Secreción Urato Urato Luz tubular NPT1/ NPT4 MRP4/A BCG2 Na+ UTAT1 Urato OAT10 Pirazinoato Nicotinato Lactato Urato OAT4 Dicarboxilatos Célula tubular proximal OAT1 Intersticio OAT1 Urato Dicarboxilatos Urato Glut9a Urato GLUT9/ URATv1: Glucose transporter 9; Npt1 (NaPi-1): Na phosphate transporter-1; Npt4 (NaPi-4): Na phosphate transporter-4; OAT4: organic anion transporter 4; URAT1: Urate transporter 1. principales transportadores implicados en la reabsorción tubular proximal de ácido úrico son URAT1 (membrana apical) y GLUT9 (membrana basolateral). Los agentes uricosúricos benzobromarona, probenecid, losartán y sulfinpirazona inhiben URAT1. GLUT9 es un transportador de eflujo de urato que también transporta hexosas como glucosa y fructosa. En los seres humanos, la reabsorción tubular proximal de urato implica también a las proteínas intercambiadoras apicales OAT4 y OAT10 (figura 3). Monocarboxilatos intracelulares, como lactato, pirazinoato y nicotinato (URAT1 y OAT10), o dicarboxilatos (OAT4) aceleran la captación de urato. Varios transportadores apicales (MCT9, SMCT1 y -2) transportan monocarboxilatos y pueden favorecer la reabsorción de urato. El transporte de urato también está regulado por citoesqueleto de actina modulado por la proteína CARMIL y por la interacción de los dominios PDZ presentes en URAT1, NPT1, OAT4 y SMCT1 con PDZK1 y NHERF1. En la secreción tubular participan los intercambiadores basolaterales de urato/dicarboxilato OAT1 y OAT3, y los apicales MRP4 y ABCG2, así como los cotransportadores de sodio/fosfato NPT1 y NPT4. En el riñón murino el transporte de ácido úrico involucra a los túbulos proximales y a los distales y, a diferencia del ser humano, Glut9 es una proteína del túbulo distal. La uromodulina tiene un papel mal caracterizado en el transporte de urato y sus mutaciones pueden causar nefropatías hiperuricémicas. Recientemente se ha descrito su interacción con OIT3, cuya deficiencia causa uricosuria. La glucosuria tiene efectos uricosúricos y se ha descrito hipouricemia hiperexcretora en diabéticos tipo 1 y tipo 2 con función renal normal. 9 Hiperuricemia y gota Riesgo renal y cardiovascular Estudios genéticos recientes han ilustrado la importancia de la excreción extrarrenal de ácido úrico, que se produce sobre todo a nivel intestinal, y no por vía biliar como se pensaba. La disfunción de ABCG2/ BCRP a nivel intestinal (y no renal) sería la responsable de la hiperuricemia asociada a polimorfismos de este gen. algunos casos, el efecto hipouricemiante es la principal característica del fármaco, la base de sus indicaciones terapéuticas. La uricasa parenteral se usa en el síndrome de lisis tumoral espontáneo o inducido por quimioterapia. Los inhibidores orales de la xantina oxidasa alopurinol y febuxostat se usan en la hiperuricemia crónica. Fármacos y uricemia Herencia de la uricemia Diversos fármacos modifican la uricemia, la mayor parte de ellos al modular la excreción renal, aunque existen otros mecanismos de acción (tabla 3). Muchos de estos fármacos ocasionan hipo- o hiperuricemia como un efecto adverso o como un efecto beneficioso pleiotrópico. La hiperuricemia farmacológica más frecuente es la asociada a diuréticos. Los diuréticos interactúan con Npt4, OAT4 y MRP4. Los antagonistas de los receptores de angiotensina y sobre todo losartán interactúan con OAT3, MRP4, URAT1 y GLUT 9. El suplemento de 500 mg/día de vitamina C durante dos meses redujo la uricemia en 0,5 mg/dl. Fármacos de interés en nefrología como los ligadores de fosfato hipocolesterolemiantes sevelamer y colestilan también bajan la uricemia. En El estudio de los factores hereditarios que regulan la uricemia ha identificado nuevos genes importantes en el metabolismo y la disposición del ácido úrico que eventualmente pueden originar nuevas aproximaciones terapéuticas para la hiperuricemia e incluso para la hipouricemia. Tabla 3. Fármacos que modifican la uricemia Elevan la uricemia • • • • • • • • • Diuréticos Tacrolimus, ciclosporina Etambutol, pirazinamida Quimioterapia citotóxica (causada por lisis celular) Etanol Salicilatos (dosis baja, < 1 g/día) Levodopa Ribavirina e interferón Teriparatida Reducen la uricemia • Inhibidores de la xantina oxidasa: alopurinol y febuxostat • Uricasa • Ácido ascórbico (vitamina C) • Benzobromarona y probenecid • Calcitonina • Citrato • Estrógenos • Fenofibrato • Losartán • Salicilatos (dosis alta, > 3 g/día) • Sulfinpirazona • Por acción intestinal: sevelamer y resinas como colestilan 10 Son raras las enfermedades de herencia monogénicas con hiperuricemia por sobreproducción de ácido úrico (mutación de HGPRT) o defecto de excreción renal, como el observado en la nefropatía hiperuricémica juvenil consecuencia de mutaciones de la uromodulina (proteína de Tamm-Horsfall). Sin embargo, estudios de asociación genómica han identificado al menos diez genes cuyos polimorfismos comunes se asocian con hiperuricemia y gota, que incluyen genes que codifican ocho transportadores renales e intestinales. Los principales son SLC2A9, ABCG2, SLC17A3 y SLC22A12, y justifican la alta herencia (60 %) de la uricemia (tabla 1). Otros genes polimórficos asociados a la uricemia son PKD2 (poliquistina 2), SLC17A4 (Na/PO4 cotransporter), SLC16A9 (MCT 9; monocarboxylate transporter 9), PDZK1, glucokinase regulator protein (GCKR) y LRRC16A. Ácido úrico, estrés oxidativo e inflamación La gota es una enfermedad por depósito de cristales de urato monosódico en las articulaciones y los tejidos blandos. Para que se formen cristales se requiere que el producto iónico de sodio y ácido úrico esté en o por encima del nivel de saturación (6,8 mg/dl a pH 7,40). Una vez alcanzada esta concentración, otros factores, como el balance tisular de factores inhibidores o promotores de la formación de cristales, determinan si se forman cristales. Los cristales de urato monosódico son estímulos proinflamatorios que activan monocitos y macrófagos a través de receptores tipo Toll (TLR) y de la vía Metabolismo del ácido úrico del inflamasoma Nlrp3 que activa la caspasa-1 y libera interleucina-1-beta. Además, el ácido úrico tiene actividades antioxidantes y prooxidantes, que varían en función del microambiente químico y podrían contribuir a otras enfermedades metabólicas, vasculares y renales. Desde el punto de vista antioxidante, el ácido úrico inactiva directamente varios radicales de oxígeno, incluido el peroxinitrito (ONOO-), un radical libre formado por la reacción de óxido nítrico (NO) con superóxido (O2-). El ácido úrico también puede prevenir la oxidación de las lipoproteínas de baja densidad inducida por metales como el Cu2 +. Sin embargo, el ácido úrico puede disminuir los niveles de NO, una molécula con propiedades vasodilatadoras, tanto disminuyendo su producción al aumentar la actividad arginasa, lo que desvía la Larginina desde la producción de NO a la producción de urea, como reaccionando directamente con el NO para generar ácido úrico nitrosado. El ácido úrico, sobre todo el intracelular, puede ser también prooxidante, lo que le confiere propiedades proinflamatorias. En adipocitos activa la nicotinamida adenina dinucleótido fosfato oxidasa y aumenta la producción de radicales libres de oxígeno. En células musculares lisas vasculares activa el factor de transcripción proinflamatorio NF‑kB y la señalización por quinasas activadas por mitógenos. La hiperuricosuria o la hipouricemia tubular aislada pueden asociarse con nefrolitiasis y con fracaso renal agudo (FRA) por precipitación intratubular de cristales de ácido úrico. En la hipouricemia de portadores de mutaciones de los genes SLC22A12 (URAT1) o SLC2A9 (GLUT9) es característico el FRA inducido por el ejercicio físico, que se presenta aproximadamente a las dos semanas de realizado este. El ejercicio físico puede aumentar la producción de ácido úrico, pero las causas del FRA todavía se debaten. Puede tener un papel la nefropatía aguda por precipitación intratubular de ácido úrico o isquemia renal secundaria a vasoconstricción local debida al exceso de radicales libres de oxígeno durante el ejercicio, ante la ausencia del efecto antioxidante del ácido úrico. En este sentido, tanto la hipouricemia de causa genética como la hiperuricemia son factores de riesgo para la enfermedad renal crónica. bibliografía recomendada • Richette P, Bardin T. Gout. Lancet 2010;375:31828. • Neogi T. Clinical practice. Gout. N Engl J Med 2011;364:443-52. • Sanchez-Niño MD, Sanz AB, Ortiz A. Uromodulin, inflammasomes, and pyroptosis. J Am Soc Nephrol 2012;23:1761-3. • Ichida K, Matsuo H, Takada T, Nakayama A, Murakami K, Shimizu T, et al. Decreased extrarenal urate excretion is a common cause of hyperuricemia. Nat Commun 2012;3:764. • Esparza Martín N, García Nieto V. Hypouricemia and tubular transport of uric acid. Nefrologia 2011;31:44-50. • So A, Thorens B. Uric acid transport and disease. J Clin Invest 2010;120:1791-9. • Evenepoel P, Selgas R, Caputo F, Foggensteiner L, Heaf JG, Ortiz A, et al. Efficacy and safety of • • • • sevelamer hydrochloride and calcium acetate in patients on peritoneal dialysis. Nephrol Dial Transplant 2009;24:278-85. Hiratochi M, Tatani K, Shimizu K, Kuramochi Y, Kikuchi N, Kamada N, et al. Hypouricemic effects of novel concentrative nucleoside transporter 2 inhibitors through suppressing intestinal absorption of purine nucleosides. Eur J Pharmacol 2012;690:183-91. Lee YH, Song GG. Pathway analysis of genome-wide association studies on uric acid concentrations. Hum Immunol 2012;73:805-10. Anzai N, Endou H. Urate transporters: an evolving field. Semin Nephrol 2011;31:400. Lanaspa MA, Tapia E, Soto V, Sautin Y, Sánchez-Lozada LG. Uric acid and fructose: potential biological mechanisms. Semin Nephrol 2011;31:426-32. 11 Hiperuricemia y gota Eugenio Chamizo Carmona, Adela Gallego Flores Servicio de Reumatología. Hospital de Mérida Introducción La gota es un síndrome clínico causado por una respuesta inflamatoria al depósito de cristales de urato monosódico en los tejidos articulares y periarticulares en humanos con concentraciones séricas de urato elevadas. Las primeras referencias a la gota datan de 2600 a. C., cuando los egipcios describieron la podagra. A Hipócrates (400 a. C.) se le atribuye la primera buena descripción de la gota, a Séneca (siglo I a. C.) el reconocimiento de la naturaleza familiar de la gota y a Galeno (siglo II d. C.) la primera descripción de un tofo. El término gota (del latín gutta) fue introducido en el siglo XIII d. C. y apunta a la creencia de que la enfermedad se debía a un veneno que caía gota a gota en las articulaciones. En el siglo XVII, von Leeuwenhoek identificó cristales en el microscopio en un tofo y Sydenham, físico, escritor y gotoso, describió los síntomas clásicos de la gota aguda; en el siglo XVIII, Scheele descubrió el ácido úrico y Wollaston lo identificó en los tofos; en el siglo XIX, Garrod describió por primera vez la asociación entre la hiperuricemia y la gota. McCarthy y Hollander describieron en 1961 la presencia consistente de cristales de urato monosódico en el líquido sinovial de la artritis gotosa. Fisiología del ácido úrico El ácido úrico es el producto final del metabolismo de las purinas en los humanos y la mayoría de los primates. Diversas mutaciones silenciaron el gen que codifica para la enzima urato oxida- sa (uricasa), lo que se tradujo en un aumento de la concentración sérica de urato con respecto al resto de los mamíferos. El ácido úrico es el antioxidante natural más abundante en el organismo y además puede desempeñar un papel importante en la vigilancia inmune, como señal de peligro ante la lesión o muerte celular y como adyuvante endógeno para facilitar las respuestas inflamatoria e inmune. El ácido úrico posee una constante de disociación (pKa) de 5,75 en la sangre y 5,35 en la orina, y se encuentra mayoritariamente en su forma disociada (urato) en los fluidos extracelulares (pH 7,4), y en su forma no disociada (ácido úrico) en la orina (pH entre 5 y 6). Por convención se denomina urato en el suero y el líquido sinovial, y ácido úrico en la orina. Balance de urato El ácido úrico se produce en el hígado a partir de la degradación de compuestos de purina exógenos (dieta) y endógenos. La dieta apenas aporta ácido úrico, aunque sí cantidades significativas de precursores de urato. No obstante, la mayor parte de urato usualmente proviene de la síntesis endógena. En condiciones normales, existe un equilibrio entre la producción y la eliminación de urato. Un tercio de la eliminación total se produce por secreción pasiva por el intestino, donde es degradado por las bacterias (uricolisis intestinal). La excreción renal es responsable de la eliminación diaria de los dos tercios restantes. Solo el 4 % del 13 Hiperuricemia y gota Riesgo renal y cardiovascular urato sérico se encuentra unido a proteínas plasmáticas, por lo que es casi totalmente filtrado en el glomérulo. Tras la filtración glomerular se produce reabsorción presecretoria (90 % del urato filtrado), secreción y reabsorción postsecretoria, en el túbulo proximal. Estudios recientes han identificado múltiples transportadores de urato en el túbulo contorneado proximal, cuyo funcionamiento puede verse alterado por polimorfismos genéticos y por agentes farmacológicos, que pueden alterar el equilibrio entre la producción y la eliminación de ácido úrico. La cantidad corporal total de urato, habitualmente en forma soluble, varía en los adultos normales entre 800 y 1.500 mg en el varón y entre 500 y 1.000 mg en la mujer. Cada día se renueva el 60-70 % del volumen total de urato. Los valores de urato sérico son menores en los niños que en los adultos. Los varones alcanzan los niveles del adulto en la pubertad, pero las mujeres en edad fértil mantienen valores inferiores, porque los estrógenos aumentan el aclaramiento renal de ácido úrico, probablemente por inhibición de los transportadores de la reabsorción tubular. Después de la menopausia, si no se instaura terapia hormonal sustitutoria, los valores de ácido úrico se igualan en ambos sexos. Hiperuricemia La definición fisiológica de la hiperuricemia es una concentración sérica de urato superior a 6,8 mg/ dl, que es el punto de saturación de la sal de urato sódico en los líquidos biológicos con pH y temperatura fisiológicos. La definición estadística basada en la media de la población que emplean los laboratorios clínicos (6 mg/dl en la mujer y 7 mg/dl en el varón) carece de valor práctico, porque no tiene relación con los aspectos patogénicos de la gota y porque la mayoría de las poblaciones no tienen una distribución normal de las concentraciones séricas de urato. Epidemiología La prevalencia de la hiperuricemia varía de un país a otro; sin embargo, en todo el mundo el porcentaje de adultos con hiperuricemia ha aumentado en las últimas cuatro décadas. En Estados Unidos, la prevalencia de hiperuricemia en los adultos (urato sérico > 7,0 mg/dl) ha aumentado progresivamente del 14 4,8 % a principios de 1970 hasta el 9,3 % a mediados de 1980, según el estudio Framingham, y hasta el 19 % actual, según los estudios más recientes. Cifras similares se han encontrado en países como Tailandia, Turquía, Gran Bretaña o Alemania. En otras poblaciones (como las islas Seychelles y una comunidad costera de China), la prevalencia de la hiperuricemia puede ser mucho mayor (> 30 % en los varones). La gota es el tipo de artritis más común en los varones y las mujeres mayores, con una prevalencia estimada del 1 % en Estados Unidos y del 1,5 % en Europa, que puede pasar del 7 % en los mayores de 75 años. Los varones maoríes de Nueva Zelanda y los taiwaneses pueden alcanzar cifras de prevalencia del 10 y el 15 %, respectivamente. La relación de género oscila entre 3 y 4 varones por cada mujer. Numerosos factores pueden contribuir, de forma diferente en cada población, al aumento de la prevalencia de la hiperuricemia. Probablemente el más decisivo sea la edad. El aumento de la proporción de mayores de 65 años en la población se acompaña de un aumento paralelo de la hiperuricemia y la gota. Este efecto de la longevidad sobre la hiperuricemia es más marcado en las mujeres. Los cambios de estilo de vida, especialmente dietéticos, las enfermedades concomitantes y los tratamientos farmacológicos son los otros tres pilares en los que se sustenta el aumento de la hiperuricemia. La obesidad, una epidemia de los países occidentales, incrementa la producción y disminuye la eliminación renal de ácido úrico, lo que la convierte en un factor de riesgo importante para el aumento de la prevalencia de la hiperuricemia y la gota. La asociación de factores dietéticos con la hiperuricemia es compleja y difícil de interpretar; no obstante, es evidente que los cambios dietéticos introducidos en los países occidentales (aumento del consumo de carne, marisco y cerveza y disminución del consumo de lácteos) favorecen el aumento de las concentraciones de ácido úrico. Está comprobado que la ingesta excesiva de carnes rojas y mariscos (pero no de vegetales ricos en purinas) favorece la hiperuricemia, de la misma forma que la cerveza y los licores son factores de riesgo para la hiperuricemia, mientras que el vino en pequeñas cantidades puede ser protector. Curiosamente, el contenido en purinas de la cerveza y los licores es menor que el de muchas comidas, por lo que deben estar implicados otros mecanismos en la hiperuricemia, como la acidemia láctica y la reducción de la excreción urinaria de ácido úrico, Hiperuricemia y gota Clasificación la aceleración de la degradación de trifosfato de adenosina y, en el caso de la cerveza, su contenido elevado en guanosina. Las bebidas ricas en fructosa son también factores de riesgo, en tanto que los productos lácteos y la vitamina C son considerados factores protectores para la hiperuricemia. La hiperuricemia persistente es una anomalía bioquímica común, que en última instancia se produce por la disminución de la excreción renal (lo más común), por el aumento de la producción de ácido úrico o por la combinación de ambos mecanismos. No se conocen deficiencias en la eliminación de urato intestinal y en la uricolisis cuando el intestino está intacto. Cuando se encuentra la causa responsable (enfermedades, productos dietéticos, tóxicos o medicamentos), se denomina hiperuricemia secundaria. Las principales causas relacionadas con la sobreproducción de urato son enfermedades asociadas con la proliferación y la destrucción celular, tales como leucemias agudas y linfomas, síndromes de lisis tumoral, estados hemolíticos y psoriasis. Por lo general, la hiperuricemia desaparece al quitar la causa. Cuando no se encuentra ninguna causa se denomina hiperuricemia primaria o idiopática, que dura indefinidamente. La hiperuricemia (primaria o secundaria) en la mayoría de las personas afectadas resulta del deterioro de la excreción renal del ácido úrico, en lugar de por la sobreproducción de urato (tabla 1). Numerosos medicamentos de uso muy común, como los diuréticos tiazídicos (hipertensión) y las dosis bajas de aspirina (riesgo cardiovascular), disminuyen la eliminación renal de ácido úrico y aumentan la prevalencia de hiperuricemia. El aumento de los trasplantes de órganos y los inhibidores de la calcineurina (ciclosporina y tacrolimus) empleados en los trasplantados, y la supervivencia de los pacientes con insuficiencia renal crónica, aunque no se sometan a trasplantes, tienen efectos importantes sobre el aumento en la prevalencia de la hiperuricemia. Existe una clara relación entre hiperuricemia e hipertensión arterial en los adultos e incluso en los niños. Hasta el 50 % de las personas hipertensas no tratadas tienen hiperuricemia, que a menudo precede a la hipertensión. Tabla 1. Principales causas de hiperuricemia secundaria Aumento de la producción Disminución de la eliminación renal Defectos enzimáticos hereditarios Enfermedades Hipoxantina-g PRTransf. Insuficiencia renal Enfermedad depósito de glucógeno Depleción de volumen efectivo PRP sintetasa Acidosis láctica Enfermedades Cetoacidosis diabética Trastornos mieloproliferativos Obesidad Trastornos linfoproliferativos Hipotiroidismo Neoplasias sólidas Hiperparatiroidismo Obesidad Otras enfermedades renales Psoriasis Preeclampsia Hipoxia tisular Dieta, fármacos y tóxicos Hemólisis Ciclosporina, tacrolimus Déficit de vitamina B12 Etambutol, pirazinamida Fármacos y tóxicos Levodopa Etanol Laxantes Ácido nicotínico L-Dopa Fructosa Etanol Fármacos citotóxicos Restricción de sal Exceso de purinas en la dieta Diuréticos PRP: fosforibosilpirofosfato sintetasa; PRTransf: fosforibosil transferesa. 15 Hiperuricemia y gota Riesgo renal y cardiovascular Estadios clínicos de la gota El término gota se utiliza para describir un grupo heterogéneo de enfermedades exclusivas de los humanos que incluyen hiperuricemia, artritis gotosa aguda, artropatía gotosa crónica, nefropatía por urato y urolitiasis úrica. En este capítulo nos vamos a limitar a las manifestaciones musculoesqueléticas de la gota. En la actualidad, la gota típica se entiende como un síndrome que progresa desde un período inicial prolongado generalmente asintomático en el que se acumulan cristales de urato monosódico en las articulaciones y alrededores (hiperuricemia asintomática), a una fase en la que se producen episodios agudos muy dolorosos y autolimitados de monoartritis u oligoartritis (gota aguda intermitente), y finalmente a una fase crónica de poliartritis dolorosa, deformante y debilitante asociada generalmente con la presencia de depósitos cristalinos (tofos) en los tejido blandos (artritis gotosa avanzada). La duración de cada período es muy variable y depende de numerosos factores, entre los que el grado de hiperuricemia es el más determinante. Hiperuricemia asintomática La hiperuricemia asintomática es el período en que los niveles séricos de urato se encuentran persistentemente elevados, pero no se producen manifestaciones clínicas relacionadas con el depósito de cristales de urato (gota). Se estima una prevalencia en los varones adultos caucasianos en torno al 8 %. Parece que la hiperuricemia asintomática no es el período quiescente y benigno previo a la gota clínica que se creía. Por un lado, se ha demostrado que los niveles séricos de ácido úrico predicen de forma independiente el desarrollo de hipertensión, enfermedad cardiovascular, insuficiencia cardíaca, accidente cerebrovascular y enfermedad renal. Por otro lado, los cambios requeridos en las articulaciones y los tejidos blandos de los pacientes hiperuricémicos para que finalmente puedan producirse las manifestaciones clínicas de la gota ocurren durante este período de hiperuricemia asintomática. La hiper­uricemia persistente conlleva la sobresaturación del líquido sinovial por urato y la formación de cristales de urato monosódico que se van depositando gradualmente en la superficie del cartílago y la membrana sinovial hasta formar microtofos, años antes del primer ataque clínico de la gota. La presencia de estos microtofos 16 puede observarse directamente por artroscopia e indirectamente por ecografía y resonancia magnética en personas con hiperuricemia asintomática. Por lo tanto, aunque la mayoría de las personas con hiperuricemia asintomática no tienen manifestaciones clínicas, esta fase inicial de la gota es un período importante en la alteración de la anatomía estructural y el desarrollo de las comorbilidades médicas asociadas con la gota. El período de la hiperuricemia asintomática suele durar varias décadas, pero puede ser considerablemente más corto en pacientes con concentraciones séricas muy elevadas de urato, especialmente en aquellos con errores metabólicos congénitos o en tratamiento con ciclosporina. Pocos estudios epidemiológicos han buscado relacionar los niveles previos de urato con la aparición de gota. En un estudio de 2.046 participantes sanos seguidos durante 14,9 años, encontraron una incidencia anual de gota del 4,9 % para urato > 9 mg/dl, del 0,1 % para urato < 7,0 mg/dl y del 0,5 % para niveles intermedios. La incidencia acumulada de gota durante seis años para niveles de urato > 9 mg/dl fue del 22 %. En el estudio Framingham, encontraron una incidencia acumulativa del 12 % durante 14 años para pacientes con urato sérico entre 7 y 7,9 mg/dl. Por lo tanto, los niveles séricos de urato mayores de 9 mg/dl tuvieron un valor predictivo mucho mayor para el desarrollo de gota, pero este grado de hiperuricemia fue poco frecuente en ambas series (< 20 % de los hiperuricémicos). Esta etapa inicial necesaria de la gota termina con el desarrollo de los episodios agudos y graves de artritis o con el desarrollo de nefrolitiasis de ácido úrico. Gota aguda intermitente El ataque inicial generalmente ocurre entre las décadas cuarta y sexta de la vida en los varones y dos décadas después en las mujeres, aunque depende de varios factores, como la edad de la menopausia. El típico ataque de gota por lo general es anunciado por el desarrollo rápido de dolor intenso, hinchazón, calor, enrojecimiento e incapacidad en la articulación afectada. Puede aparecer en cualquier momento del día, pero es más frecuente durante el sueño nocturno. El dolor alcanza su máxima intensidad en un corto período de horas. Clásicamente, los pacientes se quejan de no poder soportar el más ligero roce o el peso de la sábana sobre la articulación afectada y de quedar incapacitados para caminar cuando Hiperuricemia y gota está afectada la extremidad inferior. Los primeros ataques casi siempre se resuelven completamente en días o semanas, incluso sin tratamiento. El ataque inicial por lo general es monoarticular (80 %) y se localiza en la extremidad inferior. La articulación implicada suele ser la primera metatarsofalángica o podagra (50 % inicial y 90 % en total) y, en menor medida, la rodilla. Otras articulaciones que pueden verse afectadas en la fase inicial son el tarso, el tobillo y el talón, aunque es más probable que ocurra en episodios recurrentes. Los dedos de las manos, las muñecas y los codos suelen afectarse también en episodios ulteriores. La afectación de otras bursas, los hombros, las caderas, esternoclavicular, la columna vertebral y las sacroilíacas obliga a descartar otras causas. Los signos inflamatorios pueden sobrepasar los límites de la articulación involucrada y dar la impresión de artritis en varias articulaciones contiguas o de tenosinovitis, dactilitis (dedo en salchicha) o incluso celulitis. En general, las características clínicas de una artritis gotosa aguda típica pueden ser suficientes para ayudar a distinguirla de otras formas de monoartritis aguda. Pero la gota también puede acompañarse de síntomas sistémicos, como fiebre, escalofríos o malestar general, y dar lugar a cierta confusión con una artritis séptica. Los hallazgos analíticos habituales en los ataques de gota aguda (leucocitosis neutrofílica y elevación de velocidad de sedimentación globular o proteína C reactiva) poseen escaso valor diagnóstico. Cualquier factor que altere el microambiente usualmente estable que rodea al microtofo en el espacio articular puede conducir al desprendimiento de cristales en el líquido sinovial y desencadenar un brote agudo de gota. Los factores físicos más comúnmente alterados son el pH y la concentración de urato del fluido sinovial. El pH intraarticular puede ser modificado por traumatismos articulares, con o sin hemorragia intraarticular, y por la acidosis sistémica asociada con la cirugía. La concentración de urato en suero y en líquido sinovial puede variar bruscamente con las transgresiones dietéticas con carne roja, mariscos y alcohol (especialmente cerveza) o con fármacos, lo que desestabiliza el microtofo y da lugar a ataques agudos. Es lo que ocurre cuando se inician fármacos reductores de urato sin profilaxis antiinflamatoria. De hecho, los factores que causan disminución repentina de los niveles de urato en suero son más propensos a desencadenar ataques que los que elevan los niveles de urato. Una de las señas de identidad de los ataques de gota aguda es su naturaleza autolimitada. Los períodos completamente asintomáticos entre dos o más episodios repetidos de artritis aguda orientan hacia un diagnóstico clínico de gota. Los ataques iniciales suelen tener una duración de entre cinco y diez días. El período intercrítico que separa los primeros ataques puede durar meses o años, con una duración media de 11 meses. En ausencia de tratamiento, los ataques agudos tienden a ser más frecuentes, más duraderos, más graves y más extensos (oligo- o poliarticular) y los períodos intercríticos progresivamente más cortos y menos asintomáticos. Pero, incluso durante los períodos intercríticos asintomáticos, pueden observarse en el líquido sinovial cristales de urato monosódico y un grado bajo de inflamación (1.000-2.000 leucocitos/μl). En este sentido, se puede afirmar que la etapa de la gota aguda intermitente consiste en una inflamación persistente de grado bajo con períodos relativamente cortos de inflamación aguda grave. La duración de esta fase es muy variable, dependiendo de la causa e intensidad de la hiperuricemia, con una media de diez años antes de progresar a la fase crónica sintomática de la gota avanzada. Artritis gotosa avanzada La artritis gotosa avanzada comienza cuando desaparecen los períodos asintomáticos o intercríticos entre los ataques. En esta etapa, las articulaciones afectadas permanecen constantemente doloridas e hinchadas, aunque la intensidad de los síntomas es mucho menor que durante los ataques agudos, que pueden seguir ocurriendo. En ausencia de tratamiento eficaz, el dolor de fondo tiende a ser progresivo y los ataques agudos se repiten con frecuencia. La afectación poliarticular es común. Cuando implica de forma simétrica a las articulaciones pequeñas de manos y pies, puede confundirse con la artritis reumatoide (AR). Y como esta, la artritis gotosa avanzada puede llegar a producir lesiones articulares y óseas muy graves e incapacitantes. Esta etapa antes recibía el nombre de gota tofácea crónica porque los tofos subcutáneos son la lesión más característica de la gota avanzada; pero los tofos a veces aparecen durante la artritis aguda intermitente y otras veces no están presentes en la artritis gotosa avanzada. Durante las primeras fases de la gota avanzada es posible no encontrar en el examen físico tofos clínicamente evidentes, pero casi siempre se detectan tofos 17 Hiperuricemia y gota Riesgo renal y cardiovascular óseos o periarticulares mediante ecografía o resonancia magnética. Los tofos subcutáneos son tan patognomónicos como la artritis destructiva de la gota avanzada (figura 1). Consisten en una colección organizada de cristales de urato monosódico y pueden ser dolorosos e incapacitantes. Son más frecuentes en las gotas más graves y crónicas y con niveles séricos de urato más elevados, aunque su incidencia ha disminuido mucho con los tratamientos hipouricemiantes. Pueden aparecer en cualquier lugar del cuerpo, pero son más comunes en los dedos, las muñecas, las orejas, las rodillas, las bursas del olécranon y los puntos de presión, como la cara cubital del antebrazo y el tendón de Aquiles. Pueden ser confundidos con los de la AR y reticulohistiocitosis multicéntrica. Pueden formarse sobre los nódulos de Heberden en la artrosis o más raramente en el tejido conectivo de otros sitios, como las pirámides renales, las válvulas cardíacas y las escleróticas. Figura 1. Artritis gotosa avanzada con lesiones osteoarticulares y tofos Presentaciones atípicas de la gota El caso típico de gota se produce en un varón de mediana edad, obeso y con una o más comorbilidades asociadas, como hipertensión, enfermedad cardiovascular, insuficiencia renal o dislipemia. Pero a veces se presenta antes de los 25 años (5 %), en ausencia de comorbilidades asociadas. Esta gota de inicio temprano tiene un curso clínico más acelerado y una asociación familiar más fuerte (80 %) que la gota clásica (30 %). Se desarrollará en otro capítulo. En el caso de las mujeres posmenopáusicas, la gota se presenta a una edad más tardía (siete años), con formas clínicas más avanzadas (tofos, afectación poliarticular y de extremidades superiores) y acompañada de mayor comorbilidad (hipertensión e insuficiencia renal) y mayor uso de diuréticos que en el varón. Suelen tener artrosis en las manos y pueden desarrollar tofos en nódulos preexistentes de Heberden o de Bouchard. Antes representaban el 5 % de las gotas, pero su incidencia se va aproximando a la del varón de la misma edad. La gota de la mujer premenopáusica suele ser secundaria a hipertensión y uso de diuréticos, con o sin insuficiencia renal, o debe ser considerada como gota de inicio temprano. También se han descrito variantes mucho más suaves de gota con episodios triviales de dolor que duran solo de unos minutos a horas y a veces se repiten durante varios años antes del primer ataque agudo de gota o son la única manifestación de gota, pero no están muy bien estudiados. Finalmente, la hiperuricemia y la gota son complicaciones bien reconocidas de la intoxicación crónica por plomo (saturnismo), aunque en la actualidad es rara. Las escasas diferencias clínicas de la gota saturnina respecto a la primaria son una afectación poliarticular y de rodillas mayor e incidencia de tofos menor. 18 Hiperuricemia y gota Bibliografía RECOMENDADA • Becker MA, Jolly M. Hyperuricemia and associated diseases. Rheum Dis Clin North Am 2006;32:275. • Becker MA. Uric acid balance. En: Romain PL, ed. UpToDate. Waltham, MA; 2013. • Brian FM. Clinical manifestations of hiperuricemia and gout. Cleve Clin J Med 2008;75:S5-8. • Edwards NL. Clinical gout. En: Hochberg MC, et al., eds. Rheumatology. 5th ed. Philadelphia: 2011. • Crittenden DB, Pillinger MH. The year in gout: 20102011. Bull NYU Hosp Jt Dis 2011;69(3): 257-63. • Dalbeth N, Haskard DO. Pathophysiology of crystal-induced arthritis. En: Wortmann RL, eds. Crystal-induced arthropathies. New York: Taylor & Francis; 2006. p. 239-51. • Doherty M. New insights into the epidemiology of gout. Rheumatology 2009;48:ii2-ii8. • McLean L, Becker MA. Etiology and pathogenesis of gout. En: Hochberg MC, eds. Rheumatology: 5th ed. Philadelphia: 2011. • Roddy E, Zhang W, Doherty M. The changing epidemiology of gout. Nat Clin Pract Rheumatol 2007;3:443. • Saag KS, Choi HK. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther 2006;8(Suppl 1):S2. • So A. Developments in the scientific and clinical understanding of gout. Arthritis Res Ther 2008;10:221. • Thiele RG, Schlesinger N. Diagnosis of gout by ultrasound. Rheumatology (Oxford) 2007;46: 1116. • Weaver AL. Epidemiology of gout. Cleve Clin J Med 2008;75:S9-12. • Wortmann RL. Gout and hyperuricemia. En: Firestein GS, et al., eds. Kelley’s textbook of Rheumatology. 8th ed. Philadelphia: Saunders; 2009. • Yamanaka H. Gout and hiperuricemia in young people. Curr Opin Rheumatol 2011;23:15660. • Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008. Arthritis Rheum 2011;63:3136. 19 Diagnóstico de gota Eliseo Pascual Gómez Catedrático de Medicina, Universidad Miguel Hernández de Elche. Jefe de Sección de Reumatología, Hospital General Universitario de Alicante La gota es una enfermedad debida al depósito de cristales de urato monosódico, consecuencia de la hiperuricemia. Los cristales de urato son disueltos por el formol y desaparecen durante el proceso de fijación de tejidos habitual en estudios histológicos1. Esta parece la causa de que hayamos tenido muy poca información sobre la extensión de los depósitos de urato en pacientes incluso con gota avanzada y que el depósito de cristales se haya subestimado. Los estudios ecográficos con sondas de alta definición muestran los depósitos de cristales y permiten apreciar su magnitud, lo que ocurre en la superficie del cartílago articular (lo cubre de una capa blanca visible mediante artroscopia) y en el interior de los ligamentos y tendones. Además, los tofos habitualmente extraarticulares son también claramente visibles por este medio. Los depósitos se definen bien por tomografía axial computarizada (TAC), aunque no permite definir su composición; un nuevo instrumento (TAC de doble energía) sí hace posible la identificación de los depósitos como de urato2. Estos medios están permitiendo definir los sitios de depósito de cristales y también su extensión. Resulta de particular interés que en dos estudios se haya apreciado presencia de depósitos de urato en un 35 % y un 25 % de los pacientes con hiperuricemia asintomática3,4, lo que sugiere que este depósito en pacientes con hiperuricemia de cierto nivel puede tener relevancia clínica. En todo caso, tras iniciarse el depósito de los cristales, y en ausencia de medidas que normalicen la uricemia, los depósitos están presentes de manera constante, aumentan su magnitud a mayor o menor ritmo y afectan a nuevas articulaciones y nuevos sitios extraarticulares. El depósito de cristales de urato en los tejidos requiere hiperuricemia, pero también condiciones locales que no están bien definidas. El depósito preferente en el interior de los tendones, los ligamentos y la superficie del cartílago mostrada por estudios ecográficos y también por TAC de doble fuente de energía sugiere que el colágeno local puede facilitar la nucleación de los cristales. En el líquido sinovial de pacientes con gota pueden encontrarse fragmentos formados por bandas de fibras paralelas con cristales depositados a lo largo de las fibras individuales en forma de bandas transversales. Esta forma de depósito sugiere una formación apitaxial de los cristales, habitual en los procesos de biomineralización, que es el proceso por el cual diferentes seres vivos forman cristales sobre soportes proteicos (el colágeno para el hueso y los dientes de los vertebrados y la quitina para las conchas de los moluscos), con el objeto de dar solidez y resistencia a estructuras cuya función les es esencial. Este mecanismo sugeriría que en las fibras de colágeno derivadas del cartílago sobre las que parecen formarse los cristales existen estructuras complementarias a los cristales que facilitan su formación5,6. La artrosis favorece la presencia de gota7 (y, por ende, el depósito previo de cristales de urato monosódico [UMS]) y parece razonable que el daño al cartílago articular característico de la artrosis exponga fibras colágenas y facilite la formación sobre ellas de los cristales. Los tofos están 21 Hiperuricemia y gota Riesgo renal y cardiovascular compuestos de acúmulos de cristales radiando en abanico6. Durante las fases intercríticas los cristales de UMS producen inflamación en el interior de las articulaciones que los contienen8,9 y también alrededor de los tofos10. Es de especial interés que en pacientes con gota avanzada se haya descrito el depósito de cristales en la médula renal11, donde con probabilidad también deben producir cambios inflamatorios locales; la relación entre estos y la insuficiencia renal que puede acompañar a la gota no está estudiada, pero es llamativo que el tratamiento hipouricemiante (cuyo objetivo es disolver los cristales de UMS) resulta en mejoría de la función renal en algunos de estos pacientes12. El depósito de cristales de urato precede al primer ataque de gota y puede ser ya importante y afectar varias articulaciones cuando este ocurre (como indica un primer ataque poliarticular o el diagnóstico que se hace a raíz de la aparición de tofos). Si la hiperuricemia persiste, el depósito de cristales no deja de crecer y extenderse a nuevas localizaciones y puede llegar a ser masivo e incluir localizaciones inesperadas. verse los cristales en formol1 es necesario advertir a los patólogos para que hagan los cortes por congelación en la muestra sin fijar o, de hacerlo, que lo hagan por otros medios. El tamaño y las características de los cristales de UMS permiten una detección e identificación inmediata mediante un microscopio provisto de filtros polarizados y un compensador rojo17,18, que es una técnica diagnóstica habitual en reumatología. De hallarse el microscopio en las propias consultas o salas, permite un diagnóstico etiológico inmediato y evita estudios diagnósticos costosos e innecesarios. Los cristales de UMS se detectan fácilmente por su brillante birrefringencia mediante un microscopio provisto de filtros polarizados (figura 1) y la adición a este sistema de un compensador rojo de primer orden permite una mejor diferenciación de los cristales de pirofosfato cálcico, otros posibles cristales y artefactos (figura 2). El estudio se realiza en una muestra fresca de líquido sinovial, requiere poco tiempo y proporciona un diagnóstico inequívoco de la enfermedad. Los cristales de UMS no se han hallado en ningún otro contexto (aunque su presencia en articulaciones y en el líquido sinovial precede a los ataques3). Diagnóstico La ecografía en el diagnóstico de la gota Si se tiene en cuenta que los cristales de urato se depositan (entre otros sitios) en la superficie del cartílago articular, no es de extrañar que su presencia en el líquido sinovial obtenido durante un ataque de gota sea constante13,14. Igualmente, los cristales se encuentran con regularidad en las muestras de líquido sinovial obtenidas de articulaciones asintomáticas pero previamente inflamadas de pacientes que no han recibido tratamiento hipouricemiente8,15. Al normalizar la uricemia, este tratamiento induce a la disolución de los cristales, que acaban por desaparecer4,16 (este es el objetivo principal del tratamiento de la gota); por ello, en pacientes que ya llevan cierto tiempo de tratamiento hipouricemiante pueden no hallarse cristales de UMS, sencillamente porque el tratamiento fue eficaz o en una articulación determinada ya han desaparecido. La punción de tofos también permite identificar los cristales de forma muy clara. Los cristales se han encontrado en articulaciones que no han estado inflamadas de pacientes gotosos3 y se han detectado mediante ecografía de alta sensibilidad en articulaciones de pacientes con hiper­ uricemia asintomática3,4. Si se envían muestras de tejidos para análisis anatomopatológico, al disol22 El estudio ecográfico mediante ecografía de alta sensibilidad puede mostrar cambios característicos en la gota, ya que los depósitos de cristales se visualizan con claridad. En el cartílago articular, los cristales de UMS se detectan en la superficie19. Los depósitos son también aparentes en el tejido sinovial y pueden serlo en los tendones y los ligamentos. Los tofos subcutáneos o periarticulares son también claramente visibles20. Finalmente, cuando existe un derrame articular, los cristales suspendidos en el líquido pueden reflejar una imagen ecográfica punteada que se ha comparado a una tormenta de nieve. Estos hallazgos han hecho que los ecografistas sugieran que la ecografía podría ser un método diagnóstico no invasivo adecuado para el diagnóstico de la gota. En general, los estudios que han utilizado ecografía se han realizado en pacientes con enfermedad evidente y extensa; queda por determinar la fiabilidad del método en la enfermedad limitada con depósitos todavía pequeños, y en todo caso habrá que determinar cómo se comporta la ecografía en relación con el diagnóstico basado en la identificación de cristales antes de utilizarlo en clínica. Diagnóstico de gota Figura 1. Cristales de urato monosódico vistos con microscopía polarizada simple (400X). Los cristales se detectan por su clara birrefringencia, que los hace brillar en el campo oscuro del microscopio Figura 2. La misma preparación de la figura 1, vista con microscopio polarizado provisto de compensador rojo de primer orden Las limitaciones del diagnóstico clínico Algunas de las presentaciones de la gota resultan tan características que ya egipcios y griegos la identificaban como una enfermedad independiente; esta práctica se mantuvo a través de los siglos y la gota ha seguido siendo una enfermedad que los médicos tienen como fácil de reconocer. Quizás esta aparente simplicidad, junto con cierta displicencia actual de los médicos hacia la gota21, ha contribuido a que el enfoque diagnóstico basado en el reconocimiento de las manifestaciones clínicas (apoyadas por la presencia de hiperuricemia) siga siendo aún hoy una práctica extendida, habitual y ampliamente aceptada22. Además, contribuye a esta actitud que cuando la gota se presenta en su expresión más «típica» (supongamos un varón obeso de mediana edad que viene con ataques de artritis aguda e intensa en la primera metatarsofalángica de uno u otro pie y cuya uricemia es consistentemente elevada) sea poco realista plantearse un diagnóstico alternativo. Con independencia de que la podagra (término que se refiere al dolor en el pie, pero que hoy se suele interpretar de forma más restringida) puede deberse a otras causas23, ha de tenerse en cuenta que la interpretación de las presentaciones más características, cuando se hace por médicos menos experimentados en el diagnóstico de las enfermedades músculo-esqueléticas, tiene un mayor margen de error. Por otro lado, el diagnóstico basado en manifestaciones clínicas tenidas como suficientemente únicas se hace imposible cuando la gota se presenta con cuadros clínicos que también son compatibles con otras artropatías que carecen de una prueba diagnóstica etiológica e indudable y cuyo diagnóstico suele depender de la exclusión de las posibles alternativas. En algo más de la mitad de las ocasiones la gota se inicia en localizaciones menos características, ya sea como artritis de tarso, tobillo, rodilla o muñeca, como bursitis olecraniana o preaquílea, o en diferentes articulaciones de las manos, entre otras. No es raro que una artritis aguda en estas localizaciones (que puede cursar con gran inflamación local y leucocitosis, sobre todo si se trata de una articulación grande) plantee problemas diagnósticos iniciales a reumatólogos, y muchos más a médicos generales, de servicios de urgencias o de otras áreas, que pueden ser menos conscientes de que esos cuadros pueden deberse a gota. Formas poliarticulares, aditivas, febriles (condicionadas por la intensidad y extensión de la inflamación) o de presentación menos aguda y más persistente no son raras, así como tampoco lo es la presencia de tofos como primera manifestación de la enfermedad. La afectación de cualquier articulación es posible y se ha descrito en la mayoría de las articulaciones, incluida la columna. En ausencia de una historia consistente de gota, esta posibilidad solo se considerará y, en su caso, se confirmará si se analiza rutinariamente el líquido sinovial de todas las artritis no filiadas. La hiperuricemia es de poca ayuda y puede confundir. Se asocia (igual que la gota) al síndrome metabólico y habitualmente es asintomática. Es importante no confundir la hiperuricemia asintomática con 23 Hiperuricemia y gota Riesgo renal y cardiovascular la gota: solamente 0,9 personas por 1.000 al año presentarán gota si su nivel sérico de ácido úrico está entre 7 y 7,9 mg/dl; la proporción sube a 4,1 por 1.000/año con uricemias entre 8 y 8,9 mg/dl y a 49 por 1.000/año si la concentración sérica de ácido úrico es superior a 9 mg/dl24. En estas personas con hiperuricemia cualquier síntoma articular puede fácilmente ser tomado como gota. Durante los ataques de gota los niveles séricos de ácido úrico pueden descender e incluso llegar a valores normales25 debido a un aumento del aclaramiento renal del ácido úrico26; los ataques de gota también son habituales tras iniciar un tratamiento con fármacos hipouricemiantes o pueden ocurrir en cualquier momento durante el tratamiento antes de que los cristales intraarticulares de UMS se hayan disuelto, sobre todo si no se administra tratamiento profiláctico con colchicina. En todas estas circunstancias, la coincidencia de un episodio de artritis con una uricemia normal puede desorientar al clínico que busca la elevación de la uricemia como ayuda a un diagnóstico clínico de gota. REFERENCIAS BibliogrÁfICAS 1. Simkin PA, Bassett JE, Lee QP. Not water, but formalin, dissolves urate crystals in tophaceous tissue samples. Rheumatol 1994;21:2320-1. 2. Dalbeth N, Kalluru R, Aati O, Horne A, Doyle AJ, McQueen FM. Tendon involvement in the feet of patients with gout: a dual-energy CT study. Ann Rheum Dis 2013 Jan 19. [Epub ahead of print] 3. De Miguel E, Puig JG, Castillo C, Peiteado D, Torres RJ, Martín-Mola E. Diagnosis of gout in patients with asymptomatic hyperuricaemia: a pilot ultrasound study. Ann Rheum Dis 2012;71:157-8. 4. Pineda C, Amezcua-Guerra LM, Solano C, Rodríguez-Henríquez P, Hernández-Díaz C, Vargas A, et al. Joint and tendon subclinical involvement suggestive of gouty arthritis in asymptomatic hyperuricemia: an ultrasound controlled study. Arthritis Res Ther 2011;13(1):R4. 5. Pascual E, Ordóñez S. Orderly arrayed deposit of urate crystals in gout suggest epitaxial formation. Ann Rheum Dis 1998;57:255. 6. Pascual E, Martínez A, Ordóñez S. Gout: The mechanism of urate crystal nucleation and growth. A hypothesis based in facts. Joint Bone Spine 2012:80(1):1-4. 7. Roddy E, Zhang W, Doherty M. Are joints affected by gout also affected by osteoarthritis? Ann Rheum Dis 2007;6:1374-7. 8. Pascual E. Persistence of monosodium urate crystals, and low grade inflammation, in the synovial fluid of untreated gout. Arthritis Rheum 1991;34:141-5. 9. Pascual E, Castellano JA. Treatment with colchicine decreases the white cell counts in the synovial fluid of asymptomatic knees which contain monosodium urate crystals. J Rheumatol 1992;19:600-3. 24 10.Dalbeth N, Pool B, Gamble GD, Smith T, Callon KE, McQueen FM, et al. Cellular characterization of the gouty tophus: a quantitative analysis. Arthritis Rheum 2010;62:1549-56. 11.Linnane JW, Burry AF, Emmerson BT. Urate deposits in the renal medulla. Nephron 1981;29: 216-22. 12.Gibson T, Rodgers V, Potter C, Simmonds HA. Allopurinol treatment and its effect on renal function in gout: a controlled study. Ann Rheum Dis 1982;41:59-65. 13.McCarty DJ, Hollander JL. Identification of urate crystals in gouty synovial fluid. Ann Intern Med 1961;54:452-60. 14.Phelps P, Steele AD, McCarty DJ Jr. Compensated polarized light microscopy. Identification of crystals in synovial fluids from gout and pseudogout. JAMA 1968;203(7):508-12. 15.Pascual E, Batlle-Gualda E, Martínez A, Rosas J, Vela P. Synovial fluid analysis for diagnosis of intercritical gout. Ann Intern Med 1999;131:756-9. 16.Pascual E, Sivera F. The time required for disappearance of urate crystals from synovial fluid after successful hypouricemic treatment relates to the duration of gout. Ann Rheum Dis 2007;97:273-5. 17.Pascual E, Sivera F, Andrés M. Synovial fluid analysis for crystals. Curr Opin Rheumatol 2011;23:161-9. 18.Pascual E, Sivera F. Synovial fluid crystal analysis. En: Terkeltaub R (ed.). Gout and other crystal arthropathies. Philadelphia: Elsevier-Saunders; 2012. 19.Grassi W, Meenagh G, Pascual E, Filippucci E. «Crystal clear»-sonographic assessment of gout and calcium pyrophosphate deposition disease. Semin Arthritis Rheum 2006;36:197-202. Diagnóstico de gota 20.Wright SA, Filippucci E, McVeigh C, Grey A, McCarron M, Grassi W, et al. High-resolution ultrasonography of the first metatarsal phalangeal joint in gout: a controlled study. Ann Rheum Dis 2007;66:859-64. 21. Pascual E, Sivera F. Why should be gout so poorly managed? Ann Rheum Dis 2007;66:1269-70. 22. Pérez-Ruiz F, Pascual E, Carmona L, GonzálezGay MA, de Miguel E, Ureña I, et al. Diagnosis of gout in the rheumatology, hospital-based setting lies far from that recommended: results from the GEMA (Gout Evaluation of Management) Study. Arthritis Rheum 2007;56:S639. 23.Bolamaski IS, Schumacher HR. Podagra is more than gout. Bull Rheum Dis 1984;34:1-8. 24. Campion EW, Glyn RJ, De Labry LO. Asymptomatic hyperuricemia. Am J Med 1987;82:421-6. 25. Park YB, Park YS, Lee SC, Yoon SJ, Lee SK. Clinical analysis of gouty patients with normouricaemia at diagnosis. Ann Rheum Dis 2003;62:90-2. 26. Urano W, Yamanaka H, Tsutani H, Nakajima H, Matsuda Y, Taniguchi A, et al. The inflammatory process in the mechanism of decreased serum uric acid concentrations during acute gouty arthritis. J Rheumatol 2002;29:1950-3. 25 Actualización del tratamiento de la gota Fernando Pérez-Ruiz, Ane Altuna, Joana Atxotegi Servicio de Reumatología, Hospital Universitario Cruces. Instituto de Investigación Biomédica BioCruces, Universidad del País Vasco Puntos clave 1.El tratamiento de la gota está encaminado a una reducción de la uricemia suficiente, dianas de uricemia dependientes de la gravedad, para disolver los cristales de urato monosódico. 2.Recientemente se ha optimizado el tratamiento de medicamentos veteranos y se han introducido nuevos medicamentos aprobados, como el febuxostat, la pegloticasa y el canakinumab. 3.Otros puntos que se han de considerar son la educación del paciente y la prevención y el tratamiento de los episodios agudos de inflamación. 4.El tratamiento de la gota deberá siempre individualizarse, con especial consideración de las comorbilidades e interacciones con otros medicamentos. Introducción En los últimos años se ha generado un crecimiento exponencial de la producción científica sobre la gota1. Un aspecto fundamental ha sido la toma de conciencia de que la gota es una enfermedad por depósito y que los síntomas son solo una manifestación clínica que alerta de la presencia de un depósito preformado de cristales de urato monosódico (UMS). Como analogía, no entendemos la arteriosclerosis, la diabetes o la hipertensión como entidades nosológicas solo presentes si inducen manifestaciones clínicas. Entender la gota como una enfermedad crónica desde el primer síntoma podrá evitar el desarrollo de formas graves e incapacitantes (conocidas como gota tofácea crónica) inducidas por el depósito progresivo de urato, lo que ocurrirá en la mitad de los pacientes no tratados adecuadamente en un lapso de un década2. Aún más, el desarrollo de gota con depósitos subcutáneos (gota tofácea) se ha asociado a un aumento del riesgo de mortalidad en los pacientes con gota3. Nuevos conceptos Depósitos y clínica La gota se ha definido como la enfermedad cuyas manifestaciones clínica se derivan del depósito de cristales de UMS en las estructuras articulares y, dependiendo de sus manifestaciones clínicas, se clasifica en gota aguda, gota crónica, gota tofácea, gota tofácea crónica, etc. Así, se ha inferido que un paciente con manifestaciones inicialmente agudas e intermitentes no padece una enfermedad crónica. No nos imaginamos definir diabetes como «diabetes asintomática», «diabetes aguda», «diabetes crónica», «diabetes con afección de órganos y sistemas», etc. El «eslabón perdido» de la evolución del depósito de urato se encuentra entre la «hiperuricemia asintomática» y la «gota clínica». Dos trabajos de De Miguel et al. mediante ecografía de alta resolución han 27 Hiperuricemia y gota Riesgo renal y cardiovascular mostrado que el 42 % de los pacientes con hiper­ uricemia mantenida (al menos dos años, media de seis años) y sin síntomas de gota mostraba signos ecográficos de depósito. Se obtuvieron cristales de urato en el líquido sinovial mediante punción articular guiada por ecografía en el 80 % de ellos4 y se apreció la presencia de tofos en 12/35 (34 %) de los pacientes y señal Power-Doppler en 8/12 (67 %)5. Todo ello indica que previamente a la aparición del primer síntoma de gota existe depósito de urato e inflamación no apreciables clínicamente. Gota, fracaso del tratamiento y gota refractaria El fracaso con el tratamiento (treatment failure gout) es frecuente en la práctica clínica, por una inadecuada prescripción (en dosis y duración) de los medicamentos reductores de la uricemia (MRU), un incorrecto cumplimiento (se abandona el tratamiento al desaparecer los síntomas) o una diana de uricemia insuficiente (los niveles de uricemia mayores de 6 mg/dl no aseguran una adecuada disolución de los cristales de UMS)7. El fracaso terapéutico verdadero o gota refractaria (refractory gout) es la situación en que persisten los síntomas por un control inadecuado de la uricemia tras implementar los tratamientos disponibles, en las dosis máximas aprobadas o toleradas, intolerancia o contraindicación8. La presencia de gota refractaria es la indicación aprobada para el tratamiento con pegloticasa (polietilenglicol [PEG]uricasa) por la Food and Drug Administration9. Utilidad de las técnicas de imagen El patrón de oro diagnóstico de la gota es la observación de cristales de UMS10 en muestras biológicas (líquido sinovial o nódulos sospechosos de ser tofos), pero requiere la habilidad técnica para la realización de artrocentesis, la disponibilidad de un microscopio y la pericia para la detección e identificación de cristales, por lo que no es un hábito frecuente ni siquiera en la práctica especializada11. La ecografía permite detectar depósitos de urato de forma precoz y con una sensiblidad mucho mayor que la radiografía simple, así como evaluar la extensión del depósito y la presencia de inflamación12. La tomografía computadorizada de doble haz muestra, asimismo, una alta especificidad para apreciar depósitos de urato, si bien la disponibilidad del aparataje y la emisión de radiaciones ionizantes limitan su empleo en la práctica habitual. 28 Asimismo, las técnicas de imagen pueden aportar datos para el seguimiento de los depósitos, especialmente en los depósitos articulares o periarticulares no aparentes en la exploración física. La ecografía es la única técnica de imagen validada en la actualidad para el seguimiento de los depósitos articulares13. Tratamiento Inversión del discurso académico y terminología De una forma académicamente clásica, el tratamiento de la gota se ha subdividido en el tratamiento de los «ataques» agudos, su «profilaxis» y el tratamiento «hipouricemiante». Se entendería que lo primero es lo más importante, y que lo último quedaría como secundario, especialmente cuando se ha entendido erróneamente la gota no como enfermedad inflamatoria crónica desde el inicio del depósito de cristales de UMS, sino como una enfermedad con crisis intermitentes de síntomas agudas que afortunadamente remiten de forma espontánea14. Una aproximación innovadora del esquema terapéutico15 invertiría este discurso: el objetivo principal es el tratamiento reductor de la uricemia (TRU) como factor fundamental para conseguir la disolución de los cristales de UMS y posteriormente prevenir su formación, la prevención apropiada y durante un tiempo suficiente de los episodios de inflamación aguda (EIA) que pueden aumentar su frecuencia al inicio del TRU y, finalmente, el tratamiento de los EIA. La información y educación de los pacientes y de los profesionales implicados en el tratamiento de la gota ha demostrado que mejora hasta niveles muy altos la efectividad de este16, por lo que nunca debe olvidarse. Dianas de uricemia terapéutica y preventiva El objetivo final del tratamiento es «curar» la gota17, es decir, conseguir la completa y definitiva disolución de los cristales de UMS y, por ende, la resolución definitiva de la sintomatología. Siempre tendremos en cuenta que la gota es «curable», pero sus secuelas, las lesiones articulares establecidas, no lo son. Se ha definido que el nivel terapéutico mínimo se sitúa al menos por debajo de 6 mg/dl, tanto en las Actualización del tratamiento de la gota recomendaciones europeas18 como en las más recientes americanas19. En estas últimas ya se establece de forma explícita que debe ser inferior a 5 mg/dl en el paciente con enfermedad grave. La evidencia muestra que el grado de reducción de la uricemia por debajo del punto de saturación es inversamente proporcional a la velocidad de resolución de los depósitos subcutáneos20 y articulares13, por lo que el TRU debe adaptarse a conseguir distintas dianas terapéuticas, al menos inicialmente, dependiendo de la gravedad de la gota21. La suspensión del TRU se asocia a la recidiva de la gota, dependiente del tiempo desde la suspensión y de la uricemia22. Las dianas de uricemia pueden variar durante el seguimiento evolutivo: la diana terapéutica es aquella necesaria para conseguir una rápida y completa disolución de los depósitos tisulares de UMS, cuanto más baja, mejor. Posteriormente, puede plantearse una diana de prevención para el tratamiento de mantenimiento a largo plazo que impida la formación de nuevos cristales, por debajo del punto de saturación del urato23. En resumen, la estrategia para «curar» la gota es reducir la uricemia hasta niveles adecuados, de forma persistente y a largo plazo24. Tratamiento reductor de la uricemia El TRU incluye todas aquellas medidas encaminadas a conseguir una diana terapéutica de uricemia, tanto farmacológicas como no farmacológicas. Medidas generales y estilo de vida Aunque diversos aspectos dietéticos muestran una asociación con la incidencia acumulada de hiperuricemia y gota25, su impacto en la uricemia es, cuando menos, de escasa significación clínica. No obstante, la valoración de forma individualizada de los factores asociados y de las comorbilidades asociadas puede tener un impacto apreciable tanto en la uricemia como, y sobre todo, en la salud global del paciente. De tal forma, la dieta más recomendable, salvo que se consideren otras opciones más aconsejables por la presencia de otras comorbilidades, sería una de tipo mediterráneo (libre para legumbres, verduras, frutas y ovolácteos), que evite una ingesta proteica de origen animal elevada, favorezca el consumo de grasas de origen vegetal y limite los productos con azúcares refinados y las bebidas alcohólicas. La reducción progresiva de peso puede favorecer la reducción de la uricemia, al disminuir la resistencia periférica a la insulina. En pacientes con gota e hipertensión puede considerarse, si es factible, sustituir los diuréticos tiazídicos o prescribir losartán; la combinación de la suspensión de la tiazida y del efecto uricosúrico del losartán puede evitar tener que prescribir otros medicamentos reductores de la uricemia. Nuevos aspectos sobre medicamentos veteranos La eficacia de alopurinol se estima, con datos procedentes de ensayos, en una reducción de 3,3 mg/ dl (33 % de reducción respecto a una basal media de 9 mg/dl) de media con dosis de 300 mg/día y de 4,5 mg/dl (49 %) con dosis de 600 mg/día en pacientes con función renal normal14. La corrección de dosis de alopurinol en pacientes con disminución del filtrado glomerular (FG) ha sido un aspecto muy controvertido. Hande et al.26 sugerían empíricamente no sobrepasar una dosis máxima de 3 mg/día por cada ml de FG. La toxicidad del alopurinol parece relacionarse con factores de predisposición genética, como la presencia del haplotipo B5801 en la mitad de los pacientes caucásicos con SCAR (severe cutaneous adverse reactions), pero no son suficientes para explicar todos los casos. Datos más recientes sugieren que deben corregirse tanto la dosis de inicio como la dosis máxima por el FG, con una escalada lentamente progresiva en pacientes con enfermedad renal crónica (ERC) desde dosis iniciales inferiores a 1,5 mg/día por ml de FG27 hasta dosis máximas no superiores a 6 mg/día por ml de FG28. En 2004 la benzobromarona quedó restringida a uso hospitalario, prescripción limitada a especialistas en nefrología y en reumatología y para el tratamiento de la hiperuricemia en pacientes con gota grave (poliarticular o tofácea), insuficiencia renal con FG > 20 ml/min y trasplante renal29. La Agencia Española de Medicamentos y Productos Sanitarios recomienda controles de análisis bisemanales o según protocolo por riesgo de toxicidad hepática grave. El riesgo de litiasis durante el tratamiento con benzobromarona30 se asocia al mayor aclaramiento de urato antes del tratamiento y a mayores concentraciones de ácido no disociado (AUND) en la orina du29 Hiperuricemia y gota Riesgo renal y cardiovascular rante el seguimiento evolutivo. Las concentraciones de AUND menores de 20 mg/dl no se asociaron a mayor riesgo de litiasis. Nuevos medicamentos aprobados: febuxostat y pegloticasa El febuxostat es un inhibidor selectivo de la xantinaoxidorreductasa que inhibe ambas isoformas e induce una reducción intensa, lineal y dependiente de la dosis de la uricemia31. Su biodisponibilidad es elevada y sin interacciones farmacocinéticas significativas en pacientes tratados con tiazidas, colchicina, antiinflamatorios no esteroideos (AINE) o anticoagulantes. Se elimina por vía renal y hepática, por lo que no requiere ajuste de dosis en pacientes con ERC, si bien no se recomienda en estadios CKD 4-5, incluido el trasplante, por falta de datos procedentes de los ensayos de registro6. La eficacia de febuxostat se estima en una reducción de 4,5 mg/dl (46 % de una basal de 9,8 mg/dl)14. La efectividad de febuxostat 80 mg/día, dosis de inicio registrada en Europa, en el último control en ensayos clínicos en fase 3 (porcentaje de pacientes con control de la uricemia por debajo de la diana terapéutica de 6 mg/dl) fue superior a alopurinol 300 mg/día: 74 % frente a 36 %32, 67 % frente a 42 %33. En los ensayos de extensión abierta, más de la mitad de los pacientes asignados a alopurinol debieron ser reasignados a febuxostat por un control insuficiente de la uricemia, frente a solo el 22 % de los pacientes asignados a febuxostat 80 mg/día. La dosis de febuxostat 120 mg, dosis máxima registrada en Europa, puede prescribirse a pacientes que tras al menos dos semanas de tratamiento con 80 mg/día no consigan una reducción suficiente de la uricemia. La seguridad de febuxostat no difirió en ensayos en fase 3 o de extensión de la de alopurinol en dosis mayoritariamente de 300 mg/día, si bien no se recomienda en pacientes con cardiopatía isquémica o insuficiencia cardíaca, hasta disponer de los datos de ensayos en curso, ni las dosis más altas aprobadas en pacientes con enfermedad hepática (solo Child A). La pegloticasa (PEG-uricasa) es una uricasa recombinante tetramérica asociada a cadenas de PEG con el fin de favorecer su biodisponibilidad, prolon30 gar su actividad enzimática (la rasburicasa muestra una vida media inferior a 12 horas) y disminuir la inmunogenicidad (las uricasas no se expresan en antropoides superiores, incluidos los seres humanos, por lo que son inmunogénicas)34. La pegloticasa ha sido aprobada recientemente por la Agencia Europea de Medicamentos (EMA) para el tratamiento de la hiperuricemia en pacientes con gota refractaria, grave y tofácea35. Se recomienda que el tratamiento con pegloticasa se indique y realice por facultativos con experiencia en el tratamiento de gota refractaria crónica. La pegloticasa se administra por la vía endovenosa en dosis de 8 mg cada dos semanas. En pacientes con gota refractaria, un 42 % mostró respuesta, con una media de uricemia inferior a 2 mg/dl. Las reacciones infusionales no son infrecuentes y se asocian al desarrollo de autoanticuerpos y a la pérdida de eficacia o ausencia de respuesta (mayoritariamente en los primeros tres meses de tratamiento) en un 90 % de los casos36. Se recomienda medir los niveles de urato antes de las infusiones y no asociar otros fármacos reductores de la uricemia; si la uricemia es superior a 6, se recomienda suspender el tratamiento de forma definitiva. Prevención y tratamiento de los episodios de inflamación aguda La prevención de los EIA debe prolongarse, a ser posible, al menos seis meses desde el inicio del TRU37. Datos de un estudio de extensión abierta con febuxostat mostraron que tras la suspensión de la profilaxis, a los 12 meses de TRU con buen control de la uricemia, menos del 5 % de los pacientes sin tofos sufrieron un EAI, frente a más del 30 % de los pacientes con tofos38. La colchicina se ha empleado de forma empírica hasta recientemente39,40. En la reciente ficha técnica41 queda contraindicada en pacientes con CKD 4-5, enfermedad hepática grave y en los 14 días posteriores a tratamiento con medicamentos inhibidores potentes de CYP3A4 o glicoproteína P. La dosis debe ser reducida a la mitad en pacientes con ERC CKD 3, enfermedad hepática y en tratamiento con inhibidores moderados de CY3A4 o glicoproteína P. Los fármacos hipolipemiantes, incluidos estatinas y fibratos, pueden potenciar la miotoxicidad de la colchicina. La dosis para los EAI no superará los 2 mg al día ni la dosis acumulada de 6 mg en cuatro Actualización del tratamiento de la gota días. Requiere un período de lavado de al menos tres días para ser reinstaurado. La dosis para la prevención de los EIA es de 1 mg/día41. Los análogos de la hormona adrecocorticotropa, como la tetracosáctida, tienen un efecto antiinflamatorio mediado por la inhibición del receptor 3 de melanotonina en los neutrófilos, y no por la liberación de cortisol endógeno. Se emplea empíricamente desde hace 60 años, pero solo disponemos de estudios retrospectivos42. Los agentes bloqueantes de la interleucina 1, incluidos anakinra, rilonacept y canakinumab, son eficaces en el tratamiento de la gota en pacientes con contraindicación para la prescripción de otras alternativas43. LA EMA ha emitido un dictamen favorable a la autorización del empleo de canakinumab en pacientes con EIA recurrentes (al menos tres al año) con intolerancia o contraindicación a AINE y colchicina y en los que los cursos reiterados de corticosteroides no sean aceptables 44. REFERENCIAS BibliogrÁfICAS 1. Dalbeth N, Pérez-Ruiz F, Edwards LN, Schlesinger N. In defense of research into the crystal induced arthropathies. J Rheumatol 2008;35:2278-9. 2. Gutman AB. The past four decades of progress in the knowledge of gout, with an assessment of the present status. Arthritis Rheum 1973;16:431-45. 3. Pérez-Ruiz F, Martinez-Indart L, Carmona L, Herrero-Beites AM, Pijoan JI, Krishnan E. Tophaceous gout and high level of hyperuricaemia are both associated with increased risk of mortality in patients with gout. Ann Rheum Dis 2013 Jan 12. [Epub ahead of print]. 4. De Miguel E, Puig JG, Castillo C, Peiteado D, Torres RJ, Martin-Mola E. Diagnosis of gout in patients with asymptomatic hyperuricaemia: a pilot ultrasound study. Ann Rheum Dis 2012;71(1):157-8. 5. Puig JG, de Miguel E, Castillo MC, Rocha AL, Martínez MA, Torres RJ. Asymptomatic hyperuricemia: impact of ultrasonography. Nucleosides Nucleotides Nucleic Acids 2008;27: 592-5. 6. AEMPS. Ficha Técnica Febuxostat. Disponible en: http://www.ema.europa.eu/ema/index.jsp? curl=pages/medicines/human/medicines/ 000777/human_med_000627.jsp&mid= WC0b01ac058001d124 . 2012. 7. Sundy JS, Hershfield MS. Uricase and other novel agents for the management of patients with treatment-failure gout. Curr Rheum Rep 2007;9:258-64. 8. Edwards LN. Treatment-failure gout: a moving target. Arthritis Rheum 2008;58:2587-90. 9. FDA. Full prescribing information for Krystexxa. Disponible en: http://www.accessdata.fda.gov/ drugsatfda_docs/label/2010/125293s0000lbl. pdf . 2010. 10.Zhang W, Doherty M, Pascual E, Bardin T, Barskova V, Conagham P, et al. EULAR evidence based recommendations for gout. Part I. Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65:1301-11. 11.Pérez-Ruiz F, Carmona L, Yebenes MJ, Pascual E, de ME, Urena I, et al. An audit of the variability of diagnosis and management of gout in the rheumatology setting: the gout evaluation and management study. J Clin Rheumatol 2011;17:349-55. 12.Pérez-Ruiz F, Schlesinger N, Dalbeth N, Urresola A, De Miguel E. Imaging of gout: findings and utility. Arthritis Res Ther 2009;11(3):232. 13.Pérez-Ruiz F, Martin I, Canteli B. Ultrasonographic measurement of tophi as an outcome measure for chronic gout. J Rheumatol 2007;34:1888-93. 14.Pérez Ruiz F, Herrero-Beites AM. Evaluation and treatment of gout as a chronic disease. Adv Ther 2012;29:935-46. 15.Pérez Ruiz F, Pascual Gómez. Tratamiento de la gota. Reumatol Clin 2010;10:23-7. 16.Rees F, Jenkins W, Doherty M. Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study. Ann Rheum Dis 2012 Jun 7. [Epub ahead of print]. 17.Doherty M, Jansen TL, Nuki G, Pascual E, Pérez-Ruiz F, Punzi L, et al. Gout: why is this curable disease so seldom cured? Ann Rheum Dis 2012;71:1765-70. 18.Zhang W, Doherty M, Pascual E, Bardin T, Barskova V, Conagham P, et al. EULAR evidence based recommendations for gout. Part II. Management. Report of a task force of the EULAR Standing Committee for International 31 Hiperuricemia y gota Riesgo renal y cardiovascular Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65:1312-24. 19.Khanna D, Fitzgerald JD, Khanna PP, Bae S, Singh MK, Neogi T, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: Systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken) 2012;64:1431-46. 20.Pérez-Ruiz F, Calabozo M, Pijoan JI, HerreroBeites AM, Ruibal A. Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum 2002;47:356-60. 21.Pérez-Ruiz F, Lioté F. Lowering serum uric acid levels: what is the optimal target for improving clinical outcomes in gout? Arthritis Rheum 2007;57:1324-8. 22.Pérez-Ruiz F, Atxotegi J, Hernando I, Calabozo M, Nolla JM. Using serum urate levels to determine the period free of gouty symptoms after withdrawal of long-term urate-lowering therapy: a prospective study. Arthritis Rheum 2006;55:786-90. 23.Pérez-Ruiz F, Herrero-Beites AM, Carmona L. A two-stage approach to the treatment of hyperuricemia in gout: The «Dirty Dish» hypothesis. Arthritis Rheum 2011;63:4002-6. 24.Pérez-Ruiz F. Treatting to target: an strategy to cure gout. Rheumatology 2009;49:ii9-ii12. 25.Choi HK, Curhan G. Gout: epidemiology and lifestyle choices. Curr Opin Rheumatol 2005;17:341-5. 26.Hande KR, Noone RM, Stone WJ. Severe allopurinol toxicity. Description and guidelines for prevention in patients with renal insufficiency. Am J Med 1984;76:47-56. 27.Stamp LK, Taylor WJ, Jones PB, Dockerty JL, Drake J, Frampton C, et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: A proposed safe starting dose of allopurinol. Arthritis Rheum 2012;64(8):2529-36. 28.Pérez-Ruiz F, Hernando I, Villar I, Nolla JM. Correction of allopurinol dosing should be based on clearance of creatinine, but not plasma creatinine levels. Another insight to allopurinolrelated toxicity. J Clin Rheumatol 2005;11:129-33. 29.AEMPS. Ficha Técnica benzobromarona. Disponible en: http://www.aemps.gob.es/cima/ especialidad.do?metodo=verFichaWordPdf&co digo=49386&formato=pdf&formulario=FICHAS &file=ficha.pdf. 2007. 30.Pérez-Ruiz F, Hernández-Baldizon S, HerreroBeites AM, González-Gay MA. Risk factors 32 associated with renal lithiasis during uricosuric treatment of hyperuricemia in patients with gout. Arthritis Care Res (Hoboken) 2010;62:1299305. 31.Khosravan R, Grabowski BA, Wu JT, JosephRidge N, Vernillet L. Pharmacokinetics, pharmacodynamics and safety of febuxostat, a non-purine selective inhibitor of xanthine oxidase, in a dose escalation study in healthy subjects. Clin Pharmacokinet 2006;45:821-41. 32.Becker MA, Schumacher HR Jr, Wortmann RL, MacDonald PA, Eustace D, Palo WA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005;353:2450-61. 33.Becker MA, Schumacher HR, Espinoza LR, Wells AF, MacDonald P, Lloyd E, et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010;12:R63. 34.Sherman MR, Saifer MGP, Pérez-Ruiz F. PEGuricase in the management of treatmentresistant gout and hyperuricemia. Adv Drug Deliv Rev 2008;60:59-68. 35.Krystexxa EMA/CHMP/672303/2012. Committee for Medicinal Products for Human Use (CHMP). 2013. 36.Sundy JS, Baraf HSB, Yood RA, Edwards NL, Gutiérrez-Urena SR, Treadwell EL, et al. Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment. Two randomized controlled trials. JAMA 2011;306:711-20. 37.Wortmann RL, MacDonald PA, Hunt B, Jackson RL. Effect of prophylaxis on gout flares after the initiation of urate-lowering therapy: analysis of data from three phaseIII trials. Clin Ther 2011;32:2386-97. 38.Schumacher HR Jr, Becker MA, Lloyd E, MacDonald PA, Lademacher C. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology (Oxford) 2009;48:188-94. 39.Terkeltaub RA, Furst DE, Bennett K, Kook KA, Crockett RS, Davis MW. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study. Arthritis Rheum 2010;62:1060-8. 40.Terkeltaub RA, Furst DE, DiGiacinto JL, Kook KA, Davis MW. Novel evidence-based colchicine Actualización del tratamiento de la gota dose-reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P4503A4/P-glycoprotein inhibitors. Arthitis Rheum 2011;63:2226-37. 41.AEMPS. Ficha Técnica Colchicina Seid. Disponible en: http://www.aemps.gob.es/cima/ especialidad.do?metodo=verFichaWordPdf&co digo=33720&formato=pdf&formulario=FICHAS &file=ficha.pdf. 2011. 42.Daoussis D, Antonopoulus I, Yiannopoulos G, Andonopoulos AD. ACTH as first line treatment for acute gout in 181 hospitalized patients. Joint Bone Spine 2012 Nov 26. [Epub ahead of print]. 43.So A, Busso N. A magic bullet for gout? Ann Rheum Dis 2009;68:1517-9. 44.Ilaris EMA/CHMP/8612/2013. Committee for Medicinal Products for Human Use (CHMP). 2013. 33 Ácido úrico. Obesidad y síndrome metabólico Luis M. Beltrán Romero1, Rosa Torres Jiménez2, Juan García Puig1 Unidad Metabólico-Vascular. Servicio de Medicina Interna. Hospital Universitario La Paz. Fundación de Investigación IdiPaz 1 Unidad Metabólico-Vascular. Laboratorio de Bioquímica. Hospital Universitario La Paz. Fundación de Investigación IdiPaz 2 Síndrome metabólico y obesidad El síndrome metabólico (SM) describe un grupo de factores de riesgo modificables concurrentes en un mismo sujeto y asociado con un incremento del riego de desarrollar enfermedad cardiovascular (ECV) y diabetes mellitus tipo 2 (DM2). Las primeras comunicaciones de la tendencia a coexistir de diversos factores de riesgo metabólicos se remontan a comienzos de 19201. El aumento de las concentraciones de ácido úrico y la gota se reconocían ya entonces como características importantes en estos pacientes. El interés en la agregación de factores de riesgo modificables fue especialmente implementado por el profesor Gerald Reaven2, quien acuñó el término síndrome X para describir una entidad caracterizada por la presencia de resistencia a la insulina, intolerancia a la glucosa, elevación de los niveles triglicéridos y descenso del colesterol ligado a las lipoproteínas de alta densidad (c-HDL) e hipertensión arterial (HTA). El profesor Reaven postuló que la resistencia a la insulina era el sustrato fisiopatológico común sobre el que se asentaba el resto de las alteraciones metabólicas que eran probablemente secundarias a esta alteración inicial. Desde entonces, múltiples estudios han demostrado que la resistencia a la insulina es un factor clave en el agrupamiento de factores proaterogénicos como la dislipemia aterógena (triglicéridos elevados y c-HDL descendido), HTA y disglicemia3. Aunque el profesor Reaven inicialmente no incluyó la obesidad como característica del síndrome X, en los últimos años han aparecido evidencias robustas que relacionan la resistencia a la insulina con la presencia de obesidad, y concretamente obesidad abdominal con aumento de la grasa visceral4. En este sentido, la mayoría de las definiciones del síndrome recogen la obesidad abdominal reflejada en el perímetro abdominal o cociente cintura/cadera como criterio necesario o incluso imprescindible para el diagnóstico. La Organización Mundial de la Salud (OMS) definió por primera vez este síndrome en 19985 con el término síndrome metabólico. Los criterios requeridos para el diagnóstico, según la definición de la OMS, eran la presencia de DM2, glucosa basal alterada, intolerancia a la glucosa o resistencia a la insulina (evaluada por la técnica del clamp euglucémico), junto con dos factores de riesgo adicionales. En 1999, el Grupo Europeo para el Estudio de la Resistencia a la Insulina6 propuso el término síndrome de resistencia a la insulina y modificó los criterios. Se requería hiperinsulinemia en ayunas junto con otros dos factores con puntos de corte diferentes a los de la definición de la OMS. Uno de los criterios era la presencia de un perímetro de cintura elevado, como marcador de obesidad abdominal. En 2001, el National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP III)7 propuso una definición simple de SM que requiere tres de los siguientes cinco criterios: aumento del perímetro de cintura, niveles elevados de triglicéridos, descenso del c-HDL, presión arterial elevada y glucosa en ayunas alterada. Los criterios del NCEP ATP III fueron actualizados en 2005 con los nuevos estándares de la American Diabetes Association (ADA) para definir la glucemia normal en ayunas con 35 Hiperuricemia y gota Riesgo renal y cardiovascular una concentración menor de 100 mg/dl8. En 2005, la International Diabetes Federation (IDF)9 propuso una definición similar a la del NCEP ATP III con puntos de corte específicos de raza para el perímetro de cintura, ya que los asiáticos (perímetro de cintura normal en varones < 90 cm y en mujeres < 80 cm) tienen una mayor incidencia de resistencia a la insulina y DM2 con índice de masa corporal y circunferencia de cintura menores que los europeos (perímetro de cintura normal < 94 cm en varones y < 80 cm en mujeres) y estadounidenses (perímetro de cintura normal < 102 cm en varones y < 88 cm en mujeres). Para niños, entre 10 y 16 años, el SM puede diagnosticarse en presencia de obesidad abdominal (según los percentiles del perímetro de cintura) y dos o más de las otras características clínicas (triglicéridos elevados, c-HDL descendido, presión arterial elevada, glucosa plasmática aumentada)10. Aunque algunos de estos descriptores (así como el tamaño y las proporciones corporales) cambian con la edad y el crecimiento, en ausencia de datos definitivos, los criterios se ajustan a los valores referidos en la definición de SM en adultos de la IDF. La excepción es que se usa un único punto de corte para los niveles de c-HDL, en lugar de los dependientes del sexo. Para adolescentes mayores de 16 años, se pueden usar los criterios propuestos para adultos por la IDF. Relevancia clínica del síndrome metabólico La importancia clínica del SM estriba en dos hechos: primero, su capacidad para predecir el desarrollo de DM2, ECV y mortalidad por cualquier causa11; y segundo, por su elevada prevalencia. La frecuencia del SM depende de los criterios utilizados para el diagnóstico y la población estudiada. La Third National Health and Nutrition Examination Survey (NHANES III)12 estimó que aproximadamente un 24 % de la población adulta de Estados Unidos padecía SM según los criterios del NCEP ATP III. En un estudio llevado a cabo en varias cohortes europeas, la prevalencia de SM (criterios de la OMS) fue del 23 % en varones y del 12 % en mujeres13. La prevalencia en otros estudios europeos varía desde el 13 % al 33 % (criterios del NCEP ATP III)14,15. En un estudio reciente realizado en la población del área sanitaria de la provincia de Madrid (n = 1.344), la prevalencia de SM (criterios del NCEP ATP III) fue del 25 % (intervalo de confianza [IC] al 95 %, 21 % a 28 %)16. Esta prevalencia es similar a la encontrada en Estados Unidos. Conforme la población enveje36 ce, la prevalencia de SM aumenta y se aproxima al 50 % entre los sujetos mayores de 60 años. La trascendencia clínica del SM ha sido cuestionada17-19. Aunque el concepto de SM ayuda al médico a buscar factores metabólicos relacionados y enfermedades asociadas18, en un consenso de la ADA y la American Heart Association19 se puntualizaba que el SM era una entidad caracterizada como enfermedad cuyo valor como herramienta de predicción de riesgo de ECV era incierto. Específicamente, en este consenso se sugería que los pacientes con DM2 y ECV manifiesta deberían ser excluidos de la definición de SM, ya que en estos casos el diagnóstico de SM no aportaba información clínica adicional que supusiera un cambio en el manejo terapéutico, según las recomendaciones actuales. Además, cuestionaba el valor del SM en la predicción del riesgo de desarrollo de DM2 más allá del riesgo que supone la presencia de glucosa basal alterada por sí misma. Los datos del San Antonio Heart Study20 han arrojado algo de luz. En este estudio se siguieron 2.559 sujetos (rango de edad: 25-64 años) durante 7,4 años. El diagnóstico de SM se asoció con un riesgo significativamente elevado de ECV, particularmente en varones > 45 y mujeres > 55 años. Además, la presencia de SM predijo la incidencia futura de DM2 de forma independiente a la presencia de intolerancia a la glucosa. En los últimos años, varios estudios poblacionales han confirmado la capacidad del SM para predecir la incidencia de enfermedad coronaria y cerebrovascular21-23, incluso en pacientes con ECV arteriosclerótica preexistente24. Por tanto, en nuestra opinión el término SM es de gran valor clínico y contribuye a mantenernos alertas sobre la relación existente entre obesidad, resistencia a la insulina y DM2 con la ECV, de forma análoga a la que existe entre el tabaquismo y el cáncer de pulmón18. Urato sérico, síndrome metabólico y obesidad La presencia de niveles elevados de urato sérico (hiperuricemia) se ha descrito desde hace tiempo como característica asociada al SM1. Los individuos con este síndrome presentan concentraciones séricas de urato entre 0,5 y 1 mg/dl mayores que los sujetos sanos16,25,26. Además, el urato sérico aumenta con el número de componentes del SM16,26,27, incluso tras ajustar por factores de confusión como la edad, el género, el aclaramiento de creatinina, el consumo de alcohol y el uso de diuréticos. En un estudio po- Ácido úrico. Obesidad y síndrome metabólico blacional de nuestro grupo16, la concentración media de urato fue de 4,6 mg/dl en sujetos sin ningún componente de SM y se incrementó a 5,9 mg/dl en pacientes con tres componentes. Sin embargo, el urato sérico no se incrementó más en pacientes con más de tres componentes de SM (figura 1). También se ha comunicado recientemente que, en pacientes atendidos por HTA esencial en una unidad de riesgo vascular española, la presencia de SM se asociaba a niveles más altos de uricemia28. Aunque en la mayoría de los estudios todos los componentes del SM se relacionan con los niveles de urato sérico, la correlación más fuerte descrita ha sido con el perímetro de la cintura (figura 2)16. Figura 1. Niveles medios de urato sérico en función del número de componentes de síndrome metabólico en un estudio poblacional (n = 1.344)16. Las columnas grises indican uno o dos elementos patológicos de la definición de síndrome metabólico (criterios del NCEP ATP III7). Las columnas negras indican la presencia de síndrome metabólico (> 3 criterios, según la definición del NCEP ATP III7) Urato sérico (mg/dl) 6,0 5,0 5,9 5,7 5,8 5,9 4,8 4,6 4,0 3,0 0 1234 5 Número de componentes de síndrome metabólico Urato sérico (mg/dl) Figura 2. Correlación entre concentraciones séricas de urato y perímetro de cintura en un estudio poblacional (n = 1.344)16 14 r Pearson = 0,455 (p < 0,001) 12 10 8 6 4 2 0 25 45 65 85 105125 145 Perímetro de cintura (cm) La relación entre urato sérico y SM también se incrementa con el aumento de los niveles de urato. El estudio NHANES III29 mostró que la prevalencia de SM aumenta con el incremento de los niveles de urato sérico. Así, la prevalencia de componentes del SM (criterios NCEP ATP III) aumentó desde un 18,9 % (IC 95 %, 16,8 % a 21,0 %) para niveles de urato < 6 mg/dl hasta un 70,7 % (IC 95 %, 51,4 % a 89,9 %) para niveles > 10,0 mg/dl. La prevalencia del SM fue más de dos veces mayor en pacientes con gota (62,8 %; IC 95 %, 51,973,6 %) que en sujetos sin gota (25,4 %; IC 95 %, 23,5-27,3 %)30. En otro estudio, el incremento de una desviación estándar en la concentración de urato se asoció en ambos sexos con una probabilidad un 35 % superior de padecer SM, de forma independiente a varios factores relacionados con el SM31. ¿Por qué está aumentada la concentración sérica de uratos en pacientes con obesidad o SM? En humanos, el ácido úrico es el producto final del metabolismo de las purinas y deriva de la conversión de hipoxantina en xantina y de xantina en ácido úrico. Ambas reacciones son catalizadas por la enzima xantina-oxidorreductasa, la cual es inhibida por el alopurinol y el febuxostat (figura 3). La hiperuricemia puede deberse a un aumento de la síntesis de ácido úrico (sobreproductores), a un descenso en su excreción (infraexcretores) o a una combinación de ambos mecanismos. La participación de estos mecanismos puede medirse relacionando los niveles de uricemia con la excreción urinaria de ácido úrico en 24 horas según un nomograma publicado recientemente por nuestro grupo32. En pacientes con SM se ha descrito una reducción en la excreción de ácido úrico25 que parece deberse a una deficiente excreción renal de ácido úrico mediada por una reabsorción de sodio en el túbulo proximal potenciada por la hiperinsulinemia33,34. También se ha descrito este mecanismo en la obesidad y en la HTA35, las dos enfermedades más comúnmente asociadas con el SM. En una serie de 104 pacientes con gota atendidos en nuestra unidad (84,6 % de pacientes infraexcretores y 15,4 % de sobreproductores), la presencia de SM se asoció a una menor excreción de ácido úrico para iguales niveles de urato sérico. Mientras los pacientes con SM (37,5 %) presentaban una excreción de ácido úrico en 24 horas de 444 mg para una uricemia de 8,1 mg/dl (excreción fraccional de ácido úrico (EFUr) 5,01 %), los pacientes sin SM excretaron 546 mg de ácido úrico en 24 horas (98 mg/día más, IC 95 %, 37-168 mg/día), 37 Hiperuricemia y gota Riesgo renal y cardiovascular Figura 3. Síntesis y degradación de nucléotidos purínicos. La fructosa se fosforiliza en el hígado a fructosa-1fosfato con el concurso de ATP. El consumo de ATP en esta reacción genera AMP, que puede entrar en la vía degradativa de los nucleósidos purínicos. Esta vía degradativa culmina en la síntesis de ácido úrico. En presencia de oxígeno, el AMP se fosforiliza a ATP. En situaciones de hipoxia, la mayor parte del AMP entra en la vía degradativa de los nucleótidos purínicos R5P + ATP PRPPs PRPP ATP ADP GMP IMP AMP Guanosina Inosina Adenosina HPRT Guanina O2 APRT Hipoxantina Adenina XO Xantina XO Alopurinol Febuxostat Ácido úrico ADP: adenosina difosfato; AMP: adenosina monofosfato; APRT: adenina-fosforribosiltransferasa; ATP: adenosina trifosfato; GMP: guanosina monofosfato; HPRT: hipoxantina-fosforribosiltransferasa; IMP: inosina monofosfato; O2: oxígeno; PRPP: fosforribosil pirofosfato; PRPPs: fosforribosil-pirofosfato sintetasa; R5P: fibosa-5-fosfato; XO: xantina oxidasa. siendo la uricemia media igualmente de 8,1 mg/dl (EFUr 5,52 %); P = 0,002 (datos no publicados). Por otro lado, se ha sugerido que la hiperuricemia del SM se puede deber a un aumento en la ingesta de fructosa36. La fosforilación de la fructosa en el hígado consume adenosina trifosfato (ATP) con formación de adenosina monofosfato (AMP). Parte del AMP formado puede entrar en la vía degradativa de los nucleótidos purínicos con sobreproducción de ácido úrico (figura 3). La introducción de alimentos ricos en fructosa, como el sirope (sustancia más estable y barata que el azúcar) en Estados Unidos, se ha acompañado de un marcado incremento en la prevalencia del SM36. Un segundo mecanismo que podría aumentar la síntesis de ácido úrico es el daño 38 orgánico por isquemia local. La enzima xantinaoxidorreductasa es activa en dos formas distintas, xantina deshidrogenasa y xantina oxidasa, cada una de ellas con capacidad para sintetizar ácido úrico. La xantina deshidrogenasa, activa en condiciones fisiológicas, tiene una mayor afinidad por la nicotinamida adenina dinucleótido oxidasa (NAD+) comparada con el oxígeno como aceptor de electrones. En condiciones de isquemia, la degradación de ATP se incrementa, lo que conlleva un aumento de la síntesis de ácido úrico y, además, la xantina deshidrogenasa es convertida a xantina oxidasa. Esta forma de la enzima utiliza preferentemente oxígeno en lugar de NAD+ como aceptor de electrones, dando lugar a la formación del anión superóxido y peróxido de hidrógeno (radicales libres de oxígeno). Ácido úrico. Obesidad y síndrome metabólico En este contexto y en los últimos años está empezando a cambiar la visión de la hiperuricemia únicamente como marcador asociado al SM y comienzan a aparecer datos que orientan a que la propia hiper­ uricemia podría participar en el desarrollo del SM, al inducir disfunción endotelial, que con los cambios inflamatorios y oxidativos del tejido adiposo podría contribuir al desarrollo de la resistencia a la acción hipoglucemiante de la insulina37. Ácido úrico, síndrome metabólico y riesgo vascular Según la población analizada, la relación entre urato sérico y ECV difiere, tal y como se observa en dos revisiones sistemáticas. En población general y en pacientes con bajo riesgo, la concentración de urato sérico era en el mejor de los casos un predictor muy débil de morbimortalidad cardiovascular, una vez que se consideraban posibles fac­ tores de confusión. En contraste, en grupos se­ leccionados de pacientes con elevado riesgo cardiovascular (pacientes con DM2, ictus, insuficiencia cardíaca o enfermedad coronaria), todos los estudios examinados mostraron una asociación independiente entre los niveles de urato sérico y la ECV38,39. Se ha de remarcar que dos grandes estudios prospectivos mostraron una asociación independiente de gota con ECV y mortalidad40,41. No se puede inferir una relación de causalidad entre gota y ECV a partir de estos estudios. Sin embargo, la aparente discrepancia en los hallazgos en los sujetos de bajo y alto riesgo suscita la pregunta de si la hiperuricemia tiene un significado diferente dependiendo del sujeto en riesgo. Así, la elevación generalmente ligera de los niveles de urato en pacientes con obesidad no complicada, HTA, dislipemia o resistencia a la insulina podría reflejar un manejo renal anormal del sodio y del ácido úrico25,33. En contraste, la elevación de los niveles séricos de urato en pacientes con obesidad, HTA o DM2 y elevado riesgo vascular (especialmente aquellos con enfermedad vascular manifiesta) podría considerarse como un marcador de inflamación, isquemia y aumento de estrés oxidativo en el sistema cardiovacular42. Esta hipótesis, apoyada en los resultados de varios estudios epidemiológicos (como el Atherosclerosis Risk in Communities en sujetos de bajo riesgo43 y el Acute Stroke Study en pacientes de alto riesgo44) precisa ser testada en ensayos clínicos y experimentales. Conclusión La prevalencia del SM es muy elevada en pacientes con hiperuricemia. Varios estudios epidemiológicos apoyan la idea de que la hiperuricemia asintomática en pacientes de bajo riesgo cardiovascular es una condición benigna probablemente debida a una disminución del aclaramiento renal de ácido úrico. En contraste, la hiperuricemia en pacientes de alto riesgo cardiovascular podría causar o ser consecuencia de la aparición de efectos deletéreos sobre el corazón y los vasos sanguíneos, como la inflamación, la isquemia y el estrés oxidativo. Esta hipótesis precisa ser evaluada, especialmente en ensayos clínicos de intervención bien diseñados con fármacos que reduzcan la síntesis de ácido úrico. REFERENCIAS BibliogrÁFICAS 1. Sarafidis PA, Nilsson PM. The metabolic syndrome: a glance at its history. J Hypertens 2006;24:621-6. 2. Reaven GM. Banting Lecture 1988: role of insulin resistance in human disease. Diabetes 1988;37:1505-607. 3. Després JP. Is visceral obesity the cause of the metabolic syndrome? Ann Med 2006;38: 52-63 4. Després JP, Lemieux I, Bergeron J, Pibarot P, Mathieu P, Larose E, et al. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk. Arterioscler Thromb Vasc Biol 2008;28(6):1039-49. 5. Alberti KGMM, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications, part 1: diagnosis and classification of diabetes mellitus: provisional report of a WHO consultation. Diabet Med 1998;15:539-53. 6. Balkau B, Charles MA. European Group for the Study of Insulin Resistance (EGIR). Comment on the provisional report of the WHO consultation (letter). Diabet Med 1999;16:442-3. 7. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, 39 Hiperuricemia y gota Riesgo renal y cardiovascular and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001;285:2486-97. 8. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement (published corrections appear in Circulation 2005;112: e298). Circulation 2005;112:273552. 9. Alberti KGMM, Zimmet P, Shaw J. IDF Epidemiology Task Force Consensus Group. The metabolic syndrome – a new worldwide definition. Lancet 2005;366:1059-62. 10.Alberti KGMM, Zimmet PZ, Shaw JE. The metabolic syndrome in children and adolescents. Lancet 2007;369:2059-61. 11.Ford ES. Risk for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome: a summary of the evidence. Diabetes Care 2005;28:1769-78. 12.Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA 2002;287:356-9. 13.Balkau B, Charles MA, Drivsholm T, BorchJohnsen K, Wareham N, Yudkin JS, et al. European Group for the Study of Insulin Resistance (EGIR). Frequency of the WHO metabolic syndrome in European cohorts, and an alternative definition of an insulin resistance syndrome. Diabetes Metab 2002;28:364-76. 14.Balkau B, Vernay M, Mhamdi L, Novak M, Arondel D, Vol S, et al. DESIR Study Group. The incidence and persistence of the NCEP (National Cholesterol Education Program) metabolic syndrome. The French DESIR study. Diabetes Metab 2003;29:526-32. 15.Ozsahin AK, Gokcel A, Sezgin N, Akbaba M, Guvener N, Ozisik L, et al. Prevalence of the metabolic syndrome in a Turkish adult population. Diabetes Nutr Metab 2004;17:230-4. 16.Puig JG, Martínez MA, Mora M, Fraile JM, Montoya F, Torres RJ. Serum urate, metabolic syndrome and cardiovascular risk factors. A population-based study. Nucleosides Nucleotides Nucleic Acids 2008;27(6):620-3. 17.Kahn R, Buse J, Ferranini E, Stern M. The metabolic syndrome: time for a critical appraisal: joint statement from the American Diabetes Association for the study of Diabetes. Diabetes Care 2005;28:2289-304. 40 18.Johnson LW, Weinstock RS. The metabolic syndrome: Concepts and controversy. Mayo Clin Proc 2006;81:1615-20. 19.Eckel RH, Kahn R, Robertson RM, Rozza RA. Preventing cardiovascular disease and diabetes: a call to action from the American Diabetes Association and the American Heart Association. Diabetes Care 2006;29:1697-9. 20.Lorenzo C, Williams K, Hunt KJ, Haffner SM. The National Cholesterol Education Program Adult Treatment Panel III, International Diabetes Federation, and World Health Organization definitions of the metabolic syndrome as predictors of incident cardiovascular disease and diabetes. Diabetes Care 2007;30:8-13. 21.Kurl S, Laukkanen JA, Niskanen L, Laaksonen D, Sivenius J, Nyyssönen K, et al. Metabolic syndrome and the risk of stroke in middle-aged men. Stroke 2006;37:806-11. 22.Bataille V, Perret B, Dallongeville J, Arveiler D, Yarnell J, Ducimetière P, et al. Metabolic syndrome and coronary heart disease risk in a population-based study of middle-aged men from France and Northern Ireland. A nested case-control study from the PRIME cohort. Diabetes Metab 2006;32:475-9. 23.Chen HJ, Bai CH, Yeh WT, Chiu HC, Pan WH. Influence of metabolic syndrome and general obesity on the risk of ischemic stroke. Stroke 2006;37:1060-4. 24.Koren-Morag N, Goldbourt U, Tanne D. Relation between the metabolic syndrome and ischemic stroke or transient ischemic attack. A prospective cohort study in patients with atherosclerotic cardiovascular disease. Stroke 2005;36:1366-71. 25.López-Suárez A, Elvira-González J, BascuñanaQuirell A, Rosal-Obrador J, Michán-Doña A, Escribano-Serrano J, et al. Grupo para el Estudio del Riesgo Vascular Alcalá (GERVA). Concentraciones séricas de uratos y excreción urinaria de ácido úrico en individuos con síndrome metabólico. Med Clin (Barc) 2006;126: 321-4. 26.Hjortnaes J, Algra A, Olijhoek J, Huisman M, Jacobs J, van der Graaf Y, et al. Serum uric acid levels and risk for vascular diseases in patients with metabolic syndrome. J Rheumatol 2007;34:1882-7. 27.Ford ES, Cook S, Choi HK. Serum concentrations of uric acid and the metabolic syndrome among US children and adolescents. Circulation 2007;115:2526-32. Ácido úrico. Obesidad y síndrome metabólico 28.López-Jiménez M, Vigil-Medina L, CondésMoreno E, García-Carretero R, FernándezMejías C, Ruiz-Galiana J. Uricemia and metabolic syndrome in patients with arterial hypertension. Rev Clin Esp 2012;212(9):425-31. 29.Choi HK, Ford ES. Prevalence of the metabolic syndrome in individuals with hyperuricemia. Am J Med 2007;120:442-7. 30.Choi HK, Ford ES, Li C, Curhan G. Prevalence of the metabolic syndrome in patients with gout: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2007;57: 109-15. 31.Onat A, Uyarel H, Hergenç G, Karabulut A, Albayrak S, Sari I, et al. Serum uric acid is a determinant of metabolic syndrome in a population-based study. Am J Hypertens 2006;19:1055-62. 32.Puig JG, Torres RJ, de Miguel E, Sánchez A, Bailén R, Banegas JR. Uric acid excretion in healthy subjects: a nomogram to assess the mechanisms underlying purine metabolic disorders. Metabolism 2012;61(4):512-8. 33.Strazzullo P, Barbato A, Galletti F, Barba G, Siani A, Iacone R, et al. Abnormalities of renal sodium handling in the metabolic syndrome. Results of the Olivetti Heart Study. J Hypertens 2006;24:1633-9. 34.Puig JG, Ruilope LM. Uric acid as a cardiovascular risk factor in arterial hypertension. J Hypertens 1999;17:869-72. 35.Strazzullo P, Puig JG. Uric acid and oxidative stress: relative impact on cardiovascular risk. Nutr, Metab & Cardiovasc Dis 2007;17:409-14. 36.Nakagawa T, Tuttle K, Short RA, Johnson RJ. Hypothesis: fructose-induced hyperuricemia as a causal mechanism for the epidemic of the metabolic syndrome. Nat Clin Pract Nephrol 2005;1:80-6. 37.Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;359(17):1811-21. 38.Baker JF, Krishnan E, Chen L, Schumacher HR. Serum uric acid and cardiovascular disease; recent developments, where do they leave us? Am J Med 2005;118:816-26. 39.Wannamethee SG. Serum uric acid and risk of coronary heart disease. Curr Pharm Des 2005;11:4125-32. 40.Krishnan E, Baker JF, Furst DE, Schumacher HR. Gout and the risk of acute myocardial infarction. Arthritis Rheum 2006;54:2688-96. 41.Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation 2007;116:894-900. 42.Ferroni P, Basili S, Paoletti V, Davi G. Endothelial dysfunction and oxidative stress in arterial hypertension. Nutr Metab Cardiovasc Dis 2006;16:222-33. 43.Moriarity JT, Folsom AR, Iribarren C, Nieto FJ, Rosamond WD. Serum uric acid and risk of coronary heart disease: Atherosclerosis Risk in Communities (ARIC) Study. Ann Epidemiol 2000;10:136-43. 44.Weir CJ, Muir SW, Walters MR, Lees KR. Serum urate as an independent predictor of poor outcome and future vascular events after acute stroke. Stroke 2003;34:1951-6. 41 Hiperuricemia e hipertensión arterial Úrsula Verdalles Servicio de Nefrología. Hospital General Universitario Gregorio Marañón. Madrid José Luño Jefe del Servicio de Nefrología. Hospital General Universitario Gregorio Marañón. Madrid Introducción La asociación entre la hiperuricemia y la enfermedad cardiovascular se describió a finales del siglo XIX, aunque es a partir de la segunda mitad del siglo XX cuando diversos estudios epidemiológicos bien diseñados demostraron una relación entre los niveles de ácido úrico, la hipertensión arterial (HTA) y el riesgo cardiovascular1. Estudios más recientes clínicos, epidemiológicos y experimentales sugieren de forma más convincente un papel independiente de los niveles elevados de acido úrico en el desarrollo de la HTA2‑12. En el metaanálisis realizado por Grayson et al., en el que se incluyeron 18 estudios prospectivos con datos de 55.607 sujetos, la hiperuricemia se asoció con un incremento del riesgo relativo de desarrollar HTA de 1,41 (intervalo de confianza [IC] 95 % 1,23-1,58). Por cada 1 mg/dl que se incrementa el ácido úrico aumenta el riesgo relativo de desarrollar HTA en 1,13 (IC 95 % 1,06-1,20)3. Se ha observado que la hiperuricemia precede al desarrollo de la HTA, lo que es un dato a favor de que la hiperuricemia sea causa y no únicamente consecuencia de la propia HTA4. En el estudio de Alper et al., los niveles elevados de ácido úrico en la infancia fueron un factor de riesgo independiente para el desarrollo de HTA en la edad adulta5. Prevalencia de la hiperuricemia en la hipertensión arterial La hiperuricemia es muy frecuente en los pacientes con HTA. Tienen niveles elevados de ácido úrico entre el 25-40 % de los pacientes hipertensos no tratados, el 50 % de los que reciben tratamiento con diuréticos y más del 80 % de los pacientes con HTA maligna6. La relación entre los niveles elevados de ácido úrico y la elevación en las cifras de presión arterial (PA) se ha observado también en adolescentes. El 90 % de los adolescentes con HTA esencial tienen hiperuricemia7. En un estudio realizado en adolescentes estadounidenses, las cifras de ácido úrico mayores de 5,5 mg/dl se asociaron con un riesgo de desarrollar HTA 2,03 veces más elevado (IC 95 % 1,38-3,00)8. La fuerza de esta asociación disminuye al aumentar la edad y la duración de la HTA, lo que sugiere que el ácido úrico es un factor patogénico más importante en los hipertensos más jóvenes con HTA de comienzo reciente6. La hiperuricemia es también más frecuente en pacientes con HTA esencial que en aquellos con HTA secundaria. Se han atribuido distintos mecanismos para justificar la hiperuricemia en los pacientes hipertensos: 1.La reducción del flujo sanguíneo renal que ocurre en la HTA estimula la reabsorción de urato en el túbulo proximal6. 2.La enfermedad hipertensiva microvascular favorece la isquemia local y la liberación de lactato que bloquea la secreción de urato en el túbulo proximal y aumenta la síntesis de ácido úrico9. La isquemia tubular favorece la degradación de adenosin trifosfato (ATP) a adenosina y xantinaoxidasa. Ambas aumentan la xantina, que incrementa la generación de ácido úrico y la oxidación. 43 Hiperuricemia y gota Riesgo renal y cardiovascular 3.Otros factores adicionales que favorecen la hiper­ uricemia y que son frecuentes en estos pacientes son el consumo de alcohol, el tratamiento con diuréticos, etc. Mecanismos fisiopatológicos. Modelos animales Sin embargo, algunos estudios experimentales sugieren un papel patogénico de la hiperuricemia en el desarrollo de la HTA. Los mecanismos fisiopatológicos que explican por qué la elevación de ácido úrico favorece el desarrollo de HTA se basan en observaciones realizadas en modelos animales. El desarrollo de estos modelos animales hiperuricémicos ha permitido observar las primeras evidencias del efecto del ácido úrico sobre la PA. Las ratas que desarrollan hiperuricemia al ser tratadas con ácido oxónico, un inhibidor de la uricasa, desarrollan HTA en pocas semanas10. Inicialmente esta elevación de la PA se debe a una vasoconstricción sistémica y renal debida a la activación del sistema renina-angiotensina y a la reducción en los niveles de óxido nítrico endotelial. La hiperuricemia crónica y persistente produce un daño renal microvascular que genera una arteriopatía preglomerular y daño túbulo-intersticial renal11. Estos cambios en la microvasculatura se producen incluso cuando se controlan las cifras de PA en las ratas utilizando un diurético, lo que sugiere el efecto directo del ácido úrico sobre la lesión renal12. En este estadio, la HTA se vuelve sal-sensible y no se puede controlar con la restricción de cloruro sódico (figura 1). En este modelo animal, las cifras de PA se relacionan directamente con los niveles de ácido úrico y el tratamiento hipouricemiante con inhibidores de la xantinaoxidasa o fármacos uricosúricos es capaz de prevenir el desarrollo de HTA y el daño renal10,11. Figura 1. Mecanismos patogénicos que favorecen el desarrollo de hipertensión arterial en la hiperuricemia Incremento del ácido úrico Fases iniciales • ↑ Sistema renina-angiotensina • ↑ Óxido nítrico • Vasocontricción y ↑ resistencias renales • Vasoconstricción sistémica • ↑ Óxido nítrico Fases tardías • Proliferación de células • Musculares lisas • Arteriopatía preglomerular • Fibrosis intersticial HTA sal-sensible HTA: hipertensión arterial. 44 Hiperuricemia e hipertensión arterial Hiperuricemia e hipertensión arterial. Estudios en humanos gieren un papel patogénico en el desarrollo de la HTA de comienzo reciente en niños y adolescentes19. En humanos, la mayor parte de los estudios epidemiológicos observan una asociación independiente entre hiperuricemia e HTA. En el Framingham Heart Study, la hiperuricemia fue un factor de riesgo independiente para el desarrollo de HTA, con una odds ratio de 1,17 por cada incremento de ácido úrico de 1,3 mg/dl13. Resultados similares se observaron en el Multiple Risk Factor Intervention y en el Normative Aging Study14. En este estudio de Feig y Johnson realizado en 30 adolescentes con hiperuricemia e HTA, el tratamiento con alopurinol se asoció a una disminución de la PA, tanto de la PA medida en la consulta como ambulatoria, tras cuatro semanas de tratamiento. La PA sistólica disminuyó -6,9 ± 4,4 mmHg en el grupo tratado con alopurinol frente a -2,0 ± 0,4 en el grupo placebo, y la PA diastólica disminuyó -5,1 ± 2,4 mmHg frente a -2,4 ± 0,7 mmHg. Además, en el grupo de pacientes en los que el tratamiento con alopurinol redujo los niveles séricos de ácido úrico por debajo de 5 mg/dl, las cifras de PA se normalizaron en el 86 % de los adolescentes y las cifras tensionales se normalizaron únicamente en el 3 % de los pacientes que recibieron placebo19. En el estudio de Shankar et al., en el que se siguió durante diez años a 2.520 individuos no hipertensos, el incremento en los niveles de ácido úrico se asoció con un aumento en el riesgo relativo de desarrollar HTA, independientemente de otros factores clásicos como el tabaco, el alcohol o la función renal basal15. En otro estudio realizado en pacientes varones normotensos sin síndrome metabólico, la hiperuricemia (definida con ácido úrico > 7 mg/dl) se asoció con un incremento de un 80 % en el riesgo de desarrollar HTA, independientemente de las cifras de PA basal, los niveles de lípidos, la proteinuria o la función renal16. Existen evidencias sobre la asociación entre hiperuricemia, sobrepeso e HTA. Masuo et al. han observado que el incremento de peso, de la PA, del ácido úrico, de noradrenalina y de insulina basal fue mayor a los cinco años de seguimiento en los pacientes que desarrollaron HTA. En este estudio, la elevación en los niveles de ácido úrico y de noradrenalina sérica predijo de forma independiente el desarrollo de obesidad y de HTA17. Sin embargo, en otros estudios, la hiperuricemia no se asoció con un incremento en el riesgo de padecer HTA. En el estudio de Forman et al., realizado en sujetos mayores de 60 años, el incremento en la cifras de ácido úrico no aumentó el riesgo de desarrollar HTA18. Efecto del tratamiento de la hiperuricemia sobre la presión arterial Estudios clínicos preliminares de intervención para reducir los niveles de ácido úrico con alopurinol su- Kanbay et al. han observado en un estudio prospectivo aleatorizado que el tratamiento durante cuatro meses con 300 mg de alopurinol produce una reducción significativa de la PA sistólica y una mejoría de la función endotelial en 30 pacientes con hiperuricemia asintomática frente a 37 pacientes hiperuricémicos no tratados o 30 normouricémicos utilizados como controles20. Como conclusión: estudios recientes observacionales y epidemiológicos sugieren que el ácido úrico elevado es un factor de riesgo para el desarrollo de HTA, independientemente de los factores de riesgo clásicos. La hiperuricemia es muy prevalente en los pacientes hipertensos. El ácido úrico elevado es un factor de riesgo más relevante en pacientes jóvenes con síndrome metabólico y con diagnóstico reciente de HTA. En pacientes adolescentes con HTA de reciente comienzo, la reducción de los niveles de ácido úrico con inhibidores de la xantinaoxidasa es capaz de normalizar las cifras de PA. Sin embargo, en la actualidad no contamos con evidencias suficientes que permitan confirmar el papel patogénico de la hiperuricemia sobre el desarrollo de la HTA y sobre el riesgo cardiovascular asociado. Es preciso, por ello, el desarrollo de estudios multicéntricos controlados de intervención para reducir los niveles de ácido úrico que permitan confirmar estas observaciones en los pacientes con HTA esencial con suficiente grado de evidencia para recomendar el tratamiento de la hiperuricemia asintomática en los pacientes hipertensos. 45 Hiperuricemia y gota Riesgo renal y cardiovascular REFERENCIAS BibliogrÁfICAS 1. Cannon PJ, Stason WB, Demartini FE, Sommers SC, Laragh JH. Hyperuricemia in primary and renal hypertension. N Engl J Med 1966;275: 457-64. 2. Krishnan E, Kwoh CK, Schumacher HR, Kuller L. Hyperuricemia and incidence of hypertension among men without metabolic syndrome. Hypertension 2007;49:298-303. 3. Grayson PC, Kim SY, LaValley M, Choi HK. Hyperuricemia and incident hypertension: a systematic review and meta-analysis. Arthritis Care Res 2011;63:102-10. 4. Syamala S, Li J, Shankar A. Association between serum uric acid and prehypertension among US adults. J Hypertens 2007;25:1583-9. 5. Alper AB Jr, Chen W, Yau L, Srinivasan SR, Berenson GS, Hamm LL. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study. Hypertension 2005;45:34-8. 6. Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;23: 1811-21. 7. Feig DI, Johnson RJ. Hyperuricemia in childhood primary hypertension. Hypertension 2003;42:247-52. 8. Loeffler LF, Navas-Acien A, Brady TM, Miller ER 3rd, Fadrowski JJ. Uric acid level and elevated blood pressure in US adolescents: National Health and Nutrition Examination Survey, 19992006. Hypertension 2012;59:811-7. 9. Faller J, Fox IH. Ethanol-induced hyperuricemia: evidence for increased urate production by activation of adenine nucleotide turnover. N Engl J Med 1982;23;1598-602. 10.Mazzali M, Kanellis J, Han L, Feng L, Xia YY, Chen Q, et al. Hyperuricemia induces a primary renal arteriolopathy in rats by a blood pressureindependent mechanism. Am J Physiol Renal Physiol 2002;282:991-7. 11.Mazzali M, Hughes J, Kim YG, Jefferson JA, Kang DH, Gordon KL, et al. Elevated uric acid increases blood pressure in the rat by a novel 46 crystal-independent mechanism. Hypertension 2001;38:1101-6. 12.Kang DH, Park SK, Lee IK, Johnson RJ. Uric acid-induced C-reactive protein expression: implication on cell proliferation and nitric oxide production of human vascular cells. J Am Soc Nephrol 2005;16:3553-62. 13.Sundström J, Sullivan L, D’Agostino RB, Levy D, Kannel WB, Vasan RS. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension 2005;45:28-33. 14.Perlstein TS, Gumieniak O, Williams GH, Sparrow D, Vokonas PS, Gaziano M, et al. Uric acid and the development of hypertension: the normative aging study. Hypertension 2006;48:1031-6. 15.Shankar A, Klein R, Klein BE, Nieto FJ. The association between serum uric acid level and longterm incidence of hypertension: Population-based cohort study. J Hum Hypertens 2006;20:937-45. 16.Krishnan E, Kwoh CK, Schumacher HR, Kuller L. Hyperuricemia and incidence of hypertension among men without metabolic syndrome. Hypertension 2007;49:298-303. 17.Masuo K, Kawaguchi H, Mikami H, Ogihara T, Tuck ML. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 2003;42:474-80. 18.Forman JP, Choi H, Curhan GC. Plasma uric acid level and risk for incident hypertension among men. J Am Soc Nephrol 2007;18:287-92. 19.Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA 2008;300:924-32. 20.Kanbay M, Huddam B, Azak A, Solak Y, Kadioglu GK, Kirbas I, et al. Study of allopurinol on endothelial function and estimated glomular filtration rate in asymptomatic hyperuricemic subjects with normal renal function. Clin J Am Soc Nephrol 2011;6:1887-94. Hiperuricemia y enfermedad renal Marian Goicoechea Médico adjunto. Servicio de Nefrología. Hospital General Universitario Gregorio Marañón. Madrid Resumen La hiperuricemia puede producir daño renal por la precipitación intratubular e intersticial de los cristales de urato monosódico o por otros mecanismos que conducen a arteriolopatía aferente, glomeruloesclerosis e hipertensión preglomerular. La mayor parte de los pacientes con hiperuricemia y enfermedad renal crónica permanecen asintomáticos y solo un pequeño porcentaje de ellos tiene síntomas de gota. Estudios clínicos y experimentales avalan el tratamiento de la hiperuricemia asintomática para frenar la progresión de la enfermedad renal, de la nefropatía diabética y para mejorar el pronóstico global y cardiovascular de estos pacientes. Analizamos los estudios epidemiológicos y ensayos clínicos realizados que apoyan el tratamiento de la hiperuricemia asintomática como una de las medidas para frenar la progresión de la enfermedad renal. Introducción La asociación entre ácido úrico y enfermedad renal es muy estrecha, ya que el ácido úrico se elimina en sus dos terceras partes por el riñón, por lo que, cuando cae el filtrado glomerular (FG), los niveles de ácido úrico aumentan. Una tercera parte se elimina por las heces y, en presencia de estrés oxidativo, el ácido úrico se puede metabolizar a alantoína, parabanato y aloxano. La mayoría del ácido úrico plasmático es filtrado por el riñón y el 90 % sufre reabsorción tubular proximal a través del transportador aniónico URAT1, que es el lugar de acción de algunos fármacos uricosúricos, como probenecid, benzobromarona y losartán. Otra pequeña parte del ácido úrico filtrado sufre secreción tubular a través de una bomba transportadora MRP41. La hiperuricemia puede dar lugar a un espectro clínico variable: artritis gotosa aguda debida a la precipitación de cristales de urato monosódico en las articulaciones; la gota tofácea debida a la precipitación de los cristales en la piel y el tejido celular subcutáneo; la nefrolitiasis úrica; la nefropatía aguda por ácido úrico debida a la precipitación de cristales intratubulares (frecuente en los procesos linfoproliferativos tras tratamientos quimioterápicos, asociada al síndrome de lisis tumoral) y la nefropatía crónica por ácido úrico debida al depósito de cristales de urato en el intersticio medular, produciendo fibrosis intersticial. Además, existen alteraciones congénitas que afectan al gen de la uromodulina y que producen una nefropatía familiar juvenil hiperuricémica. Pero un gran porcentaje de pacientes con niveles elevados de ácido úrico permanecen asintomáticos. En los últimos años se ha demostrado en modelos experimentales que la hiperuricemia produce daño renal independientemente de la precipitación de cristales de urato, por lo que el tratamiento de esta, aun sin presencia de síntomas, sería beneficioso. 47 Hiperuricemia y gota Riesgo renal y cardiovascular Gota en la enfermedad renal crónica Desconocemos la prevalencia de gota en los pacientes con enfermedad renal crónica (ERC). Ifudu et al.2 mostraron que, entre pacientes con ERC avanzada, la prevalencia de artropatía gotosa era de un 6,5 % y que desaparecía casi por completo cuando los pacientes entraban en diálisis. Datos similares se publicaron en un estudio epidemiológico japonés3, con una prevalencia de un 14 % entre pacientes con ERC, que descendía hasta un 2,8 % en pacientes en diálisis. En nuestras consultas analizamos la prevalencia de gota en una cohorte de 400 pacientes (228 varones y 172 mujeres) con una edad media de 66,94 ± 16,4 años: 35 en estadio 1, 49 en estadio 2, 230 en estadio 3 y 86 en estadio 4 de ERC. Ciento trece pacientes recibían tratamiento con alopurinol y 287 no tomaban ningún fármaco hipouricemiante. De los 400 pacientes, un 14 % presentaron artropatía gotosa: 43 varones (19,5 %) y 13 mujeres (7,6 %). Según la etiología de la ERC, la nefropatía vascular y la no filiada (que incluía la patología obstructiva) fueron las que más se asociaron con la artropatía gotosa. Respecto a las comorbilidades, los pacientes hipertensos presentaron con más frecuencia gota (un 16 % frente a un 7 %, p = 0,023). No encontramos asociación entre gota, cardiopatía, diabetes y dislipemia4. Existía una correlación inversa entre los niveles de ácido úrico y el FG estimado (r = -0,338, p < 0,001), que mejoraba cuando excluíamos los 113 pacientes que estaban recibiendo alopurinol (r = -0,447, p < 0,001). Así, 52 de los pacientes con gota tenían ERC estadio 3 o 4, y solo 4 de los pacientes estadio 2. El 48,5 % de los varones en nuestra consulta con artropatía gotosa tenían hiperuricemia (úrico > 7 mg/dl), un 23 % a pesar de recibir tratamiento con alopurinol. Un 45 % de los varones y un 51 % de las mujeres presentaban hiperuricemia asintomática, 11 % y 9 %, respectivamente, a pesar de recibir tratamiento con alopurinol4. Por lo tanto, el agente hipouricemiante más utilizado en nefrología parece que no consigue reducir los niveles de ácido úrico por debajo del objetivo recomendado para evitar la precipitación de cristales de urato monosódico (< 6 mg/dl). Esto es debido fundamentalmente a que en pacientes con ERC la dosis de alopurinol debe ser ajustada, y con FG por debajo de 60 ml/min/1,73 m2, la dosis recomendada no puede superar los 200 mg/día. Recientemente se ha comercializado un nuevo inhibidor selectivo 48 de la xantina oxidasa, febuxostat, que no requiere ajuste de dosis en la ERC, aunque la experiencia en FG < 30 ml/min/1,73 m2 es escasa. Hiperuricemia e incidencia de enfermedad renal Basado en estudios experimentales, se ha demostrado que la hiperuricemia a largo plazo produce cambios hemodinámicos e histológicos renales que pueden conducir al desarrollo de ERC de novo no relacionada con el depósito de cristales de urato en el intersticio medular o a acelerar la progresión de una nefropatía existente. En un modelo murino en el que se generó hiperuricemia mediante la administración de ácido oxónico, un inhibidor de la uricasa, en ratas 5/6 nefrectomizadas se observó un aumento de la presión arterial con vasoconstricción de la arteriola aferente, vasoconstricción cortical con descenso de la tasa de filtración glomerular por nefrona e hipertensión intraglomerular con desarrollo posterior de glomeruloesclerosis y fibrosis túbulo-intersticial5. Por lo tanto, las principales lesiones que produce la hiperuricemia en el riñón son glomeruloesclerosis, arteriolopatía y fibrosis intersticial. El mecanismo de lesión se debe al desarrollo de una arteriolopatía glomerular que deteriora la respuesta de autorregulación renal y causa hipertensión glomerular. Dos grandes estudios prospectivos epidemiológicos realizados en Japón fueron los primeros en examinar la relación entre el ácido úrico y el desarrollo de enfermedad renal6,7. En el primero se evaluó el riesgo de insuficiencia renal en una cohorte prospectiva de 49.413 varones japoneses estatificados por cuartiles de ácido úrico, según los niveles de ERC y seguidos durante 5,4 años. Tener un ácido úrico por encima de 8,5 mg/dl aumentaba ocho veces el riesgo de desarrollar ERC frente a niveles de hiperuricemia moderada (5-6,4 mg/dl). En el segundo de los estudios, Iseki et al.7 evaluaron la incidencia acumulativa de ERC en una cohorte de 48.177 varones y mujeres japoneses seguidos durante siete años. La incidencia de ERC fue mayor en el grupo de varones con ácido úrico > 7 mg/dl y mujeres con > 6 mg/dl. Hsu et al.8 han publicado un gran estudio epidemiológico que incluyó 175.700 sujetos sanos, seguidos durante 25 años, y han encontrado que existe una asociación entre la hiperuricemia y el desarrollo de ERC. Estos datos se corroboran con otro gran estudio epidemiológi- Hiperuricemia y enfermedad renal co realizado en Los Apalaches, que ha incluido a 49.295 sujetos sanos9. Los datos combinados del estudio ARIC (Atheroscle­ rosis Risk in Communities) y CHS (Cardiovascular Health Study)10, que incluyen un total de 13.338 pacientes, muestran que cada aumento de 1 mg/dl en el ácido úrico incrementa el riesgo de desarrollo de ERC entre un 7-16 %. Estos resultados contrastan con los datos por separado del estudio CHS11, que no muestran asociación entre los niveles de ácido úrico y la incidencia de ERC, aunque los sujetos incluidos en los quintiles cuarto y quinto de ácido úrico sí tenían un mayor riesgo de presentar un descenso más rápido del FG (> 3 ml/min/1,73 m2). Una explicación a estos resultados contradictorios podría ser que el CHS solo incluyó pacientes mayores de 65 años. Tampoco se confirmó esta asociación en el estudio MDRD (Modification of Diet of Renal Disease), en el que la hiperuricemia no se asoció con mayor incidencia de ERC12. Sin embargo, recientemente Bellomo et al.13, en 900 adultos sanos seguidos durante cinco años, encontraron que el aumento de 50 mmol/l (1 mg/dl) de ácido úrico se asocia con el aumento de un 23 % en el riesgo de una caída del FG de más de 2 ml/ min/año. Un estudio reciente retrospectivo basado en 680 pacientes diagnosticados de poliquistosis renal muestra que el aumento de ácido úrico se asocia con hipertensión, mayor volumen renal y mayor progresión a ERC14. Estos resultados en población general (tabla 1) se han confirmado en población diabética y en trasplantados renales. En diabéticos tipo 115, el aumento del ácido úrico se asocia a un deterioro en la tasa de FG incluso en pacientes que no tienen albuminuria y, aún más importante16, la hiperuricemia en diabetes mellitus tipo 1 es un factor predictivo de desarrollo de albuminuria a los seis años en un estudio de 324 pacientes17. Recientemente se ha publicado un estudio en 1.449 pacientes diabéticos tipo 2 seguidos durante cinco años18. La hiperuricemia aumenta el riesgo de desarrollo de ERC, definida como una caída del FG por debajo de 60 ml/min/1,73 m2 o la aparición de macroalbuminuria, independientemente de la edad, el sexo, el índice de masa corporal, la hemoglobina glucosilada, la duración de la diabetes, la hipertensión y la albuminuria basal. Tabla 1. Epidemiología del ácido úrico y la enfermedad renal crónica Autor Año Participantes Principales hallazgos Tomita6 2000 49.413 hombres japoneses Úrico > 8,5 mg/dl, aumenta el riesgo de ERC en 8 veces Iseki7 2004 48.177, Okinawa General Health Úrico > 7 mg/dl aumenta 4,0 riesgo en varones y úrico > 6 aumenta 8,0 el riesgo en mujeres Chonchol11 2007 5.808, CHS Úrico asociado con ERC prevalente, pero débilmente asociado con ERC incidente Obermayr31 2008 21.457 Vienna Health Screening Project Úrico > 7 mg/dl aumenta 1,74 riesgo de ERC en varones y 3,12 en mujeres Chen32 2009 5.722, Taipei University Hospital Úrico asociado con prevalencia de ERC Weiner33 2008 13.338 ARIC más CHS Aumento de 1 mg/dl de úrico, aumenta 7-11 % riesgo de ERC See34 2009 28.745 Chang Gung University Úrico < 7,7 en varones y > 6,6 mg/dl en mujeres asociado con ER prevalente Madero12 2009 840, MDRD ERC estadio 3 y 4: el úrico se relaciona con mortalidad, pero no con disminución de FG Hsu8 2009 177.570, USRDS Mayores niveles de úrico, aumenta 2,14 riesgo de ERC a los 25 años Cain9 2010 49.295, Los Apalaches Úrico > 5,5 mujeres y > 7,1 varones aumenta el riesgo de ERC en 4,67 Bellomo13 2010 900 sujetos sanos Aumento de 1 mg/dl aumenta un 23 % riesgo caída de FG ARIC: Atherosclerosis Risk Communities; CHS: Cardiovascular Health Study; ER: enfermedad renal; ERC: enfermedad renal crónica; FG: filtrado glomerular; MDRD: Modification of Diet of Renal Disease; USRDS: United States Renal Data System. 49 Hiperuricemia y gota Riesgo renal y cardiovascular En trasplantados renales, la media de ácido úrico durante los seis primeros meses postrasplante predice de forma independiente la supervivencia del injerto, con independencia del grado de función renal durante esos primeros meses y de otros factores que influyen en la función del injerto19. En resumen, la mayoría de los estudios epidemiológicos realizados en población general, así como los realizados en diabéticos y trasplantados renales, demuestran una asociación entre la hiperuricemia y la caída del FG a largo plazo. Ácido úrico y pronóstico renal en pacientes con enfermedad renal crónica Los datos actuales sugieren que el ácido úrico puede ser un factor de riesgo o un biomarcador de pronóstico renal. Aunque la hiperuricemia es una condición muy frecuente que acompaña a los pacientes con ERC, la relación entre la hiperuricemia y la caída del FG o el riesgo cardiovascular está menos establecida que en la población general, con algunos resultados contradictorios, sobre todo en pacientes con ERC más avanzada o en diálisis (ver capítulo dedicado a este tema). En un estudio de 177 pacientes no diabéticos con ERC, no se encontró una relación entre la progresión de ERC y el ácido úrico tras ajustar para proteinuria y función renal basal. Unos resultados similares se encontraron en 223 pacientes con nefropatía IgA en que la hiperuricemia no se asociaba con mayor progresión de ERC cuando se ajustaba para otras variables. En ese trabajo, los niveles de ácido úrico se relacionaban con cambios histopatológicos crónicos túbulo-intersticiales. Por otro lado, los datos del estudio MDRD14, con un seguimiento largo, no muestran una asociación entre el aumento del ácido úrico y la progresión de la ERC. En un estudio prospectivo de 90 pacientes prevalentes trasplantados renales, un aumento del ácido úrico en una desviación estándar se asoció con un 22 % de disminución del FG; sin embargo, los niveles de ácido úrico basales no fueron predictivos de la caída del FG en el tiempo. En 2010, Hairian et al.19 mostraron que un aumento de 1 mg/dl del ácido úrico aumentaba en un 26 % el riesgo de pérdida del injerto, pero no el riesgo de muerte. 50 Disminución del ácido úrico y pronóstico renal Hasta el momento se han publicado muchos estudios de asociación entre hiperuricemia, riesgo cardiovascular y riesgo renal, pero son escasos y de tamaño muestral pequeño los trabajos de intervención que demuestren una relación causal. Kanbay et al.20 han demostrado en 59 sujetos sanos que el tratamiento con alopurinol en pacientes con hiperuricemia asintomática aumenta el FG. Talaat et al.21, en 52 pacientes con ERC estadio 3 y 4, han mostrado que la retirada de alopurinol empeora la hipertensión arterial y la función renal. Siu et al. han aleatorizado 54 pacientes con ERC estadio 3 y 4 a recibir alopurinol en dosis de 100 a 300 mg/día durante 12 meses o a seguir con su terapia habitual22. El tratamiento con alopurinol retrasó la progresión de la enfermedad renal. Kao et al.23 han tratado a 53 pacientes con ERC estadio 3 e hipertrofia ventricular izquierda con 300 mg/día de alopurinol, y la función endotelial y la hipertrofia ventricular izquierda mejoró�. Nosotros realizamos un estudio en 113 pacientes con ERC24 aleatorizados a continuar con su medicación habitual o a recibir tratamiento con 100 mg/día de alopurinol y los seguimos durante una media de dos años. Nuestros principales resultados fueron: 1) el alopurinol disminuía los marcadores inflamatorios y el riesgo de hospitalización; 2) el tratamiento con alopurinol redujo el riesgo de eventos cardiovasculares en un 71 %; 3) los pacientes tratados con alopurinol tuvieron un aumento del FG a los dos años de 1,2 ml/min/1,73 m2 respecto a una caída del FG de 3,39 ml/min/1,73 m2 en el grupo de tratamiento estándar (p = 0,018). El alopurinol redujo la progresión de ERC definida como una caída del FG mayor de 0,2 ml/min/1,73 m2/mes en un 47 %. Posteriormente, Kanbay et al.25 han realizado un estudio en 105 sujetos: 72 hiperuricémicos y 33 sujetos en el grupo control normouricémicos con función renal normal. Los 72 pacientes hiperuricémicos fueron aleatorizados a recibir 300 mg de alopurinol durante cuatro meses o nada. El tratamiento con alopurinol produjo un descenso del ácido úrico que se asoció con una mejoría de la función endotelial (p = 0,003), del FG estimado (p = 0,001) y de la presión arterial sistólica (p = 0,001). No tenemos datos suficientes para afirmar si el efecto beneficioso del alopurinol se debe a la reducción del ácido úrico o al efecto antioxidante que se produce al inhibir la enzima xantina oxidasa. Aunque los estudios experimentales sugieren que la mejoría en la función endotelial, la diabetes, la insuficiencia cardíaca y la Hiperuricemia y enfermedad renal insuficiencia renal ocurre cuando disminuye el ácido úrico con tratamiento con alopurinol y no con otras drogas hipouricemiantes26,27. Igual que con alopurinol, el febuxostat (inhibidor selectivo de la xantina oxidasa) también ofrece protección renal. Así, en un estudio experimental realizado en ratas 5/6 nefrectomizadas normo- e hiperuricémicas28, el febuxostat protegió del daño renal y previno la proteinuria, y conservó la morfología de los vasos glomerulares y la presión glomerular. Por lo tanto, previene la progresión de la ERC independientemente del efecto del ácido úrico. En el estudio de extensión FOCUS (Febuxostat Open-label Clinical trial of Urate-lowering efficacy and Safety)29, 116 pacientes tratados con febuxostat fueron seguidos durante cinco años. Los pacientes con una reducción de ácido úrico mayor de 6 mg/dl fueron los que sufrieron una caída menor del FG a lo largo del seguimiento. La reducción30 de 1 mg/dl de ácido úrico supuso una mejoría del FG en 1 ml/min/1,73 m2. En un análisis post hoc del estudio RENAAL (Reduction of End-points in NIDDM with the Angiotensin II Antagonist Losartan)31 en pacientes diabéticos tipo 2, que incluye 1.232 pacientes, se ha determinado la relación entre el cambio de los niveles de ácido úrico a los seis meses y la aparición de un evento renal, definido como la progresión a la diálisis o el aumento de creatinina en un 50 %. Los autores concluyen que: a) el tratamiento con losartán disminuye los niveles de ácido úrico; b) la reducción de 0,5 mg/dl de ácido úrico se asocia con una disminución del riesgo de evento renal en un 6 % durante los primeros seis meses; y c) esta disminución del ácido úrico explica aproximadamente 1/5 parte (20 %) del efecto renoprotector que ofrece el losartán. Por lo tanto, estos hallazgos corroboran que el ácido úrico puede ser un factor modificable en la progresión de la ERC. En resumen, los pacientes con ERC tienen con frecuencia hiperuricemia asociada a la caída del FG, que en la mayor parte de los casos es asintomática. La hiperuricemia produce enfermedad renal por mecanismos distintos a la precipitación de cristales de urato monosódico y además acelera la progresión de la enfermedad renal. Esto, asociado a que aumenta el riesgo de mortalidad global y cardiovascular en pacientes con ERC, son motivos suficientes para cambiar la actitud nefrológica y empezar a tratar la hiperuricemia asintomática, sobre todo en estadios más precoces de la ERC. Sin embargo, todavía quedan muchos interrogantes por resolver, como cuál es el target de ácido úrico, si la mayor reducción del ácido úrico aumenta el beneficio o si el beneficio demostrado por los inhibidores de la xantina oxidasa se debe a su efecto antioxidante o sobre la función endotelial o a la reducción del ácido úrico. Todos estos interrogantes solo serán resueltos con ensayos clínicos aleatorizados multicéntricos y a gran escala. Conceptos clave • La artropatía gotosa es mucho más frecuente entre los pacientes con ERC que en la población general; sin embargo, el porcentaje de pacientes con hiperuricemia y ERC que permanecen asintomáticos es mucho mayor. • A pesar del tratamiento con alopurinol, existe un porcentaje elevado de pacientes con ERC que no consiguen reducir los niveles de ácido úrico. • La hiperuricemia produce cambios hemodinámicos e histológicos renales que conducen a una glomeruloesclerosis y fibrosis túbulo-intersticial. • La hiperuricemia asintomática se asocia con una mayor incidencia de ERC en la población general. • El aumento del ácido úrico predice el desarrollo de nefropatía diabética en pacientes con diabetes tipo 1 y tipo 2. • En pacientes con ERC, el aumento del ácido úrico puede incrementar el riesgo cardiovascular y acelerar la progresión de la ERC. • El tratamiento con inhibidores de la xantina oxidasa puede disminuir la inflamación, la progresión de la enfermedad renal, la tasa de hospitalización y el riesgo cardiovascular en pacientes con ERC. • Existen evidencias para tratar la hiperuricemia asintomática en pacientes con ERC y mejorar su pronóstico renal. Ensayos clínicos aleatorizados, multicéntricos y a gran escala que permitan que las sociedades científicas avalen el tratamiento de la hiperuricemia asintomática. 51 Hiperuricemia y gota Riesgo renal y cardiovascular REFERENCIAS BibliogrÁFICAS 1. Hediger M, Johnson RJ, Miyazki H, Endou H. Molecular physiology of urate transport. Physiology 2005;20:125-33. 2. Ifudu O, Tan CC, Dulin AL, Delano BG, Friedman EA. Gouty arthritis in end-stage renal disease: Clinical course and rarity of new cases. Am J Kidney Dis 1994;23:347-51. 3. Ohno I, Ichida K, Okabe H, Hikita M, Uetake D, Kimura H, et al. Frequency of gouty arthritis in patients with end-stage renal disease in Japan. Intern Med 2005;44(7):706-9. 4. Goicoechea M, García de Vinuesa S, Arroyo D, Luño J. Hiperuricemia, gota y enfermedad renal. Nefrología 2012;Supl 3:8-15. 5. Sánchez-Losada LG, Tapia E, Santamaría J, Ávila-Casado C, Soto V, Nepomuceno T, et al. Hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats. Kidney Int 2005;67:237-47. 6. Tomita M, Mizuno S, Yamanaka H, Hosoda Y, Sakuma K, Matuoka Y, et al. Does hiperuricemia affect mortality? A prospective cohort study of Japanese male workers. J Epidemiol 2000;10:403-9. 7. Iseki K, Ikemiya Y, Inoue T, Iseki C, Kinjo K, Takishita S. Significance of hyperuricemia as a risk factor clustering in a screened cohort in Okinawa, Japan. Am J Kidney Dis 2004;44: 642-50. 8. Hsu CY, Iribarren C, McCulloch CE, Darbinian J, Go AS. Risk factors for end-stage renal disease: 25-year follow up. Arch Intern Med 2009;168:342-50. 9. Cain L, Shankar A, Ducatman AM, Steenland K. The relationship between serum uric acid and chronic kidney disease among Appalachian adults. Nephrol Dial Transplant 2010;25:3593-9. 10.Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DN, Levey AS, et al. Uric acid and incident kidney disease in the community. JASN 2008;19:1204-11. 11.Chonchol M, Shlipak MG, Katz R, Sarnak MJ, Newman AB, Siscovick DS, et al. Relationship of uric acid with progression of kidney disease. Am J Kidney Dis 2007;50:239-47. 12.Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, et al. Uric acid and long-term outcomes in CKD. Am J kidney Dis 2009;53: 796-803. 13.Bellomo G, Venanzi S, Verdura C, Saronio P, Esposito A, Timio M. Association of uric 52 acid with change in kidney function in healthy normotensive individuals. AJKD 2010;2:26472. 14.Helal I, McFann K, Reed B, Yan XD, Schrier RW, Fick-Brosnahan GM. Serum uric acid, kidney volume and progression in autosomaldominant polycystic kidney disease. Nephrol Dial Transplant 2013;28(2):380-5. 15.Rosolowsky ET, Ficociello LH, Maselli NJ, Niewczas MA, Binns AL, Roshan B, et al. Highnormal serum uric acid is associated with impaired glomerular filtration rate in nonproteinuric patients with type 1 diabetes. Clin J Am Soc Nephrol 2008;3:706-13. 16.Ficociello L, Rosolowsky ET, Niewczas M, Maselli NJ, Weinberg JM, Aschengrau A, et al. High-normal serum uric acid increases risk of early progressive renal function loss in type 1 diabetes. Diabetes Care 2010;33:1337-43. 17.Hovind P, Rossing P, Tarnow L, Johnson RJ, Parving HH. Serum uric acid as a predictor for development of diabetic nephropathy in type 1 diabetes: an inception cohort study. Diabetes 2009;58(7):1668-71. 18.Zoppini G, Targher G, Chonchol M, Ortalda V, Abaterusso C, Pichiri I, et al. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes Care 2012;35:99104. 19.Haririan A, Nogueira JM, Zandi-Nejad K, Aiyer R, Hurley H, Cooper M, et al. The independent association between serum uric acid and graft outcomes after kidney transplantation. Transplantation 2010;89(5):573-9. 20.Kanbay M, Ozkara A, Selcoki Y, Isik B, Turgut F, Bavbek N, et al. Effect of treatment of hiperuricemia with allopurinol on blood pressure, creatinine clearance, and proteinuria in patients with normal renal function. Int Urol Nephrol 2007;39:1227-33. 21.Talaat KM, el-Sheikh AR. The effect of mild hyperuricemia on urinary transforming growth factor beta and the progression of chronic kidney disease. Am J Nephrol 2007;27(5):435-40. 22.Siu YP, Leung KT, Tong MK, Kwan TH. Use of allopurinol in slowing the progression of renal disease through its ability to lower serum uric acid level. Am J Kidney Dis 2006;47:51-9. 23.Kao MP, Ang DS, Gandy SJ, Nadir MA, Houston JG, Lang CC, et al. Allopurinol benefits left Hiperuricemia y enfermedad renal ventricular mass and endothelial dysfunction in chronic kidney disease. J Am Soc Nephrol 2011;22:1382-9. 24.Goicoechea M, García-Vinuesa MS, Verdalles U, Ruiz-Caro C, Ampuero J, Rincón A, et al. Effect of allopurinol in chronic kidney disease (CKD) progression and cardiovascular risk. Clinical J Am Soc Nephrol 2010;5:1388-93. 25.Kanbay M, Huddam B, Azak A, Salak Y, Kadioglu GK, Kirbas I, et al. A randomized study of allopurinol on endothelial function and estimated glomerular filtration rate in asymptomatic hyperuricemic subjects with normal renal function. Clin J Am Soc 2011;6:1887-94. 26.George J, Carr E, Davies J, Belch JJ, Struthers A. High-dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid. Circulation 2006;114:2508-16. 27.Waring WS, McKnight JA, Webb DJ, Maxwell SR. Lowering serum urate does not improve endothelial function in patients with type 2 diabetes. Diabetologia 2007;50:2572-9. 28.Sánchez-Losada LG, Tapia E, Soto V. Effect of febuxostat on the progression of renal disease in 5/6 nephrectomy rats with and without hyperuricemia. Nephron Physiol 2008;108; 69-78. 29.Whelton A, MacDonald PA, Zhao L, Hunt B, Gunawardhara L. Renal function in gout. Long- term treatment effects of febuxostat. J Clin Rheumatol 2011;17:7-13. 30.Whelton A, Macdonald PA, Zhao L, Hunt B, Gunawardhana L. Renal function in gout: longterm treatment effects of febuxostat. J Clin Rheumatol 2011;17(1):7-13. 31.Miao Y, Ottenbros SA, Laverman GD, Brenner BM, Cooper ME, Parving HH, et al. Effect of a reduction in uric acid on renal outcomes during losartan treatment: a post hoc analysis of the reduction of endpoints in non-insulin dependent diabetes mellitus with the Angiontensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7. 32.Obermayr RP, Temmi C, Gutjahr G, Knechtelsdorfer M, Oberbauer R, Klauser-Braun R. Elevated uric acid increases the risk for kidney disease. J Am Soc Nephrol 2008;19:2407-13. 33.Chen YC, Su CT, Wang ST, Lee HD, Lin SY. A preliminary investigation of the association between serum uric acid and impaired renal function. Chang Gung Med J 2009;32:66-71. 34.Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DN, Levey AS. Uric acid and incident kidney disease in the community. J Am Soc Nephrol 2008;19:1204-11. 35.See LC, Kuo CF, Chuang FG, Li HY, Chen YM, Chen HW, et al. Serum uric acid is independently associated with metabolic syndrome in subjects with and without a low estimated glomerular filtration rate. J Rheumatol 2009;36:1691-8. 53 El ácido úrico y el riesgo cardiovascular Francisco Fernández Vega Servicio de Nefrología. Unidad de Hipertensión. Hospital Universitario Central de Asturias Alfonso Pobes Martínez de Salinas Servicio de Nefrología. Hospital Universitario Central de Asturias La hiperuricemia (HU) resulta inseparable de las diversas manifestaciones de la enfermedad cardiovascular1 y también la artritis gotosa presenta una fuerte asociación con la enfermedad coronaria (EC) aguda2 y el fallo cardíaco congestivo3. El ácido úrico (AU) desempeña un doble papel. Por un lado, refleja la actividad del sistema de la xantina oxidasa (XO), la mayor fuente de especies reactivas de oxígeno, y por otro, contrarresta en parte su actividad, además de contar con efectos directos tales como inducir el crecimiento del músculo liso vascular y activar el sistema renina-angiotensina4. La disfunción endotelial generada es causa de la resistencia a la insulina, lo que pone en relación la HU y el síndrome metabólico5. El ácido úrico como factor de riesgo cardiovascular La dificultad para definir el AU como un verdadero factor de riesgo cardiovascular (FRCV) estriba en que la HU aparece ligada al resto de los factores tradicionales, e influye en su desarrollo y favorece sus efectos deletéreos mediante acciones directas. Además, el efecto antioxidante de concentraciones de AU altas podría enmascarar en parte sus efectos deletéreos, lo que explicaría cierta «curva en J» que se observa, entre otras, en las cohortes de Progetto Ipertensione Umbria Monitoraggio Ambulatoriale (PIUMA), Syst-Eur y CArdiovascular STudy in the ELderly (CASTEL)6. Quizá haya que coincidir con Feig et al. en que no es necesario que causalidad e independencia sean autoexcluyentes para que un factor sea declarado «de riesgo»1. Un problema subsiste: no existe un punto de corte que defina la HU como factor de riesgo. En la actualidad se vienen usando aquellos propios de la gota, cercanos al punto de solubilidad del AU, que no tienen por qué coincidir con los de eventos cardiovasculares7. Los enfermos con riesgo cardiovascular alto presentan condiciones tales como la hiperinsulinemia, el estrés oxidativo, la isquemia tisular o la toma de diuréticos que incrementan de entrada los valores del AU. Por ello, es estadísticamente difícil establecer si el papel que desempeña el AU en las cohortes de los estudios clásicos es de factor independiente o mero marcador de riesgo. En general, estos ensayos muestran una progresiva pérdida del peso de la HU al ajustar los resultados por FRCV reconocidos o la presencia de gota úrica2. Sin embargo, resulta sintomático que en el Systolic Hypertension in the Elderly Program, ensayo sobre la hipertensión arterial (HTA) sistólica aislada, en el que los diuréticos conseguían reducir la mortalidad cardiovascular en mayores de 60 años, la protección que confería la bajada en las cifras tensionales iba aminorándose a medida que aumentaban los niveles de AU8. A la inversa, se ha reconocido que una parte del efecto beneficioso sobre los eventos cardiovasculares que se observa en los estudios Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan (RENAAL) y The Irbesartan type II diabetic nephropathy trial (IDNT) aparece ligado a los menores niveles de AU conseguidos por losartán, fármaco que ejerce un discreto efecto uricosúrico9. De manera 55 Hiperuricemia y gota Riesgo renal y cardiovascular retrospectiva, estos resultados se han corroborado por los estudios GREek Atorvastatin and Coronaryheart-disease Evaluation10 y Losartan Intervention for Endpoint reduction in hypertension (LIFE)11, con objetivos primarios centrados en la disminución de los eventos cardiovasculares, en los que buena parte del beneficio obtenido en los grupos de tratamiento más activo se relaciona con el descenso de los valores de uricemia. Hasta la fecha, la HU no se reconoce abiertamente como FRCV en las tablas que manejamos. De permanecer así, se trataría de una condición «benigna», a no ser que se asociara a gota o cálculos renales. De otro modo, podría ser un factor determinante del denominado «riesgo residual». Basándose en metaanálisis de aquellos estudios que realizaron ajuste por factores de riesgo tradicionales, son más los autores que establecen que el AU es un factor de riesgo independiente para la enfermedad cardiovascular, si bien marginal, sobre todo en hipertensos12 y en individuos de alto riesgo13,14. Una cohorte austríaca de amplia base poblacional (n: 83.683) estableció más tarde que el AU era un factor independiente para la mortalidad por insuficiencia cardíaca, EC e ictus en varones15, resultados corroborados más tarde por Holme16 en Suecia. En todo caso y hasta el momento, se ha considerado que el exceso de riesgo atribuible a la HU ha de ser pequeño, sobre todo en individuos con perfil de riesgo bajo. Así, en un estudio taiwanés que incluyó población con riesgo cardiovascular muy bajo (n = 403.935) y ajustó los resultados por 14 variables, el exceso de AU contribuyó solo en un 1,2 % a la mortalidad y en un 4,5 % a las muertes de causa cardiovascular17. Sin embargo, sobre los pacientes de riesgo alto-muy alto de la base de datos PreCIS (PREventive Cardiology Information System), y una vez ajustado, por cada 1 mg/dl de incremento en los niveles de AU, el incremento en el riesgo de mortalidad fue del 26 % (hazard ratio [HR]: 1,26 [intervalo de confianza {IC} al 95 % 1,28-1,50, p < 0,001]), independientemente del uso de diuréticos18. Entre los pacientes diabéticos, las comunicaciones han sido controvertidas en los últimos años, con ensayos que otorgan al AU categoría de predictor independiente, ya sea de mortalidad total o cardiovascular, y otros que se la niegan19. Contando con los datos de la National Health and Nutrition Examination Survey (NAHNES) III, representativos de la población general de Estados Unidos y tras excluir a aquellos individuos tratados con alopurinol o colchicina, tras el ajuste por todos los factores de confusión, los niveles de AU predicen la mortalidad por cualquier 56 causa tanto en los individuos diabéticos como en los no diabéticos, pero por el contrario no alcanzaban rango de independencia cuando se trataba de predecir la muerte cardiovascular20. En un último intento, Panero et al.21 vuelven sobre el tema en el CasaleMonferrato Study y obtienen resultados semejantes al estudio anterior. Concluyen además que la muerte de causa neoplásica, más acusada en los cuartiles superiores de AU, pudiera estar detrás de la significación obtenida sobre mortalidad total. Ácido úrico y factores de riesgo tradicionales En una reciente comunicación, y tomando como referencia un grupo de familias israelitas (n: 9.156), que cuentan con niveles muy bajos de AU de forma natural (< 3 mg/dl), aquellos sujetos con «niveles normales» (3,1-6,8 mg/dl) de AU tenían un riesgo aumentado (alrededor del 50 %) de presentar en el futuro HTA o diabetes22. La prevalencia de HU es alta entre los hipertensos1, por lo que el AU pudiera tener una relación causal con la HTA. En la edad pediátrica, los niveles progresivamente elevados de AU se relacionan con las cifras posteriores de presión arterial (PA)23 y ya entre los adultos parecen predecir la aparición posterior de HTA en algunos casos, si bien no resisten el ajuste por factores de confusión en otros24. Así, el aumento del AU resiste como factor asociado independiente tras el análisis multivariante entre los pacientes prehipertensos del estudio NAHNES25. La HU se ha considerado como candidata a entrar dentro de la definición del síndrome metabólico. La incidencia de este, definido por criterios del National Cholesterol Education Program/Adult Treatment Panel III en la cohorte NAHNES III, es del 18,9 % entre los individuos normouricémicos y se eleva hasta el 59,7 % y el 62 % para aquellos con niveles de AU entre 7-7,9 mg/dl y 8-8,9 mg/dl, respectivamente26. La relación entre AU y los componentes del síndrome metabólico resulta bidireccional, ya que el hiperinsulinismo provoca una menor eliminación renal de urato y los niveles altos de este interfieren con la recaptación muscular de glucosa y condicionan la adipogénesis1. Aunque se hayan comunicado resultados dispares2, en un estudio de intervención sobre hipertensos con hipertrofia ventricular izquierda (HVI) como LIFE27, tras observar los resultados por cuartiles de AU basal, mientras que el 3 % de los sujetos del primer cuartil desarrollaban diabetes de novo, la tasa subía al 11 % en el cuarto. El ácido úrico y el riesgo cardiovascular Ácido úrico y enfermedad renal La enfermedad renal crónica (ERC) y la HU se comportan como FRCV, por lo que no es extraño que cuando ambas están presentes se establezca una potenciación de sus efectos sobre los eventos cardiovasculares. Un estudio clásico como el Modification of Diet in Renal Disease28 permitió vislumbrar la relación de ambas sobre la morbimortalidad cardiovascular. Otros estudios han venido a corroborar esta primera observación. Así, en el The Japan Hypertension Evaluation with Angiotensin II Antagonist Losartan Therapy (J-HEALTH) study (J-HEALTH) (n: 7.629 pacientes japoneses), la HU determinaba un significativo aumento del riesgo cardiovascular en los pacientes con un filtrado glomerular estimado entre 45-59 ml/min29. En el trabajo de Liu WC et al., que recoge una cohorte taiwanesa de pacientes con ERC grados 3-5, el AU se comportó como un determinante independiente tanto de la mortalidad total como de los eventos cardiovasculares en todos los estadios en el análisis multivariante, sin que alcanzara esta condición en el riesgo de rápida progresión de la ERC o inicio de diálisis30. Clásicamente se ha dicho que en fases más avanzadas el AU perdía progresivamente su carácter de marcador de progresión. Una reciente publicación de Heras et al.31 pone en duda esta afirmación, ya que, sobre una cohorte de 80 pacientes con una edad media de 83 años y tras cinco años de seguimiento, aquellos con AU por encima de la media mostraban una mayor progresión en términos de filtrado glomerular y mayor riesgo de fallecer por cualquier causa. Ácido úrico y enfermedad cerebrovascular La enfermedad cerebrovascular no está libre de asociarse con el AU. Niveles altos se han relacionado con demencia en general32. En las etapas más tempranas del daño cerebrovascular, incluso entre sujetos con niveles normales de AU, aquellos pertenecientes al cuartil más alto de la normalidad presentan un mayor acúmulo de lesiones silentes de sustancia blanca cerebral, predisponente de cuadros ictales y que se relaciona a su vez con la demencia vascular33. Conocida su relevancia en la población hipertensa12, la asociación entre la HU y el ictus parece más marcada entre los no hipertensos, como cabía esperar una vez eliminado el más reconocido factor de riesgo cerebrovascular34. En pacientes diabéticos tipo 2, la tasa de recurrencia tras un ictus era mayor en aquellos con niveles altos de AU, con una correlación más intensa en estos pacientes que en los no diabéticos19. El más ambicioso metaanálisis llevado a cabo hasta la fecha que ha intentado dilucidar si el papel del AU resulta o no independiente tuvo solo en cuenta estudios prospectivos que incluyeran un grupo control, hasta un total de 16 (n = 238.449). Tras el análisis multivariado, basado solo en los estudios que ajustaron por todos los factores reconocidos de ictus, el riesgo relativo (RR) fue de 1,47 (IC 95 % 1,19-1,76) para la incidencia y de 1,26 (IC 95 % 1,12-1,39) para la mortalidad relacionada. En el caso de esta última, el RR en mujeres prácticamente triplicaba el de los varones (1,34 frente a 4,75) aun sin alcanzar la significación estadística (IC 95 % 0,53-8,98)35. Los autores de este análisis se hacen de nuevo eco del fenómeno de curva en J que parece observarse. De hecho, una vez que el paciente ha sufrido un ictus, la presencia de niveles elevados de AU parece resultar un factor protector. Así, sobre una base de 881 ictus atendidos en el Hospital Clinic de Barcelona, Chamorro et al.36 encuentran que por cada 1 mg/dl de aumento en el nivel de AU medido en las primeras horas de ingreso sus pacientes tienen un 12 % de incremento en las posibilidades de llegar a un buen resultado clínico, lo que pone de manifiesto la trascendencia del daño por estrés oxidativo que conlleva la isquemia cerebral. Intentando diferenciar entre ictus isquémico y hemorrágico, Holme et al.16 concluyen con base en los registros de los hospitales suecos (n = 417.737) que ambos se ven igualmente influidos por la HU, y que aparece una «curva en J» en el caso del ictus isquémico. Sin embargo, en la base de datos de Strasak et al., el riesgo de mortalidad por ictus solo se veía afectado por el AU en el quintil más alto y únicamente para el componente isquémico15. Ácido úrico y enfermedad coronaria Ha sido objeto de amplio estudio si la HU es o no un factor independiente en la incidencia de EC. En la cohorte de Framingham, los valores de AU fueron progresivamente mayores con la edad, en parte debido al mayor uso de diuréticos. Pudo establecerse una correlación entre la HU y el aumento de la PA, sobre todo sistólica, así como con la EC, sobre todo en la mujer. Sin embargo, en el análisis multivariable el AU no se mostró como un factor independiente37. En el Reino Unido, Wannamethee et al.38 siguieron a 7.688 varones durante 16 años y encontraron una estrecha relación del AU con prácticamente todos 57 Hiperuricemia y gota Riesgo renal y cardiovascular los factores de riesgo estudiados, así como correlación entre los niveles de AU y la incidencia de EC. Sin embargo, dicha correlación se hacía no significativa cuando se realizaba el ajuste por niveles de colesterol. Similar resultado arrojó el estudio Atherosclerosis Risk in Communities años más tarde para ambos sexos39. Otros, como el realizado por Krishnan et al.2, basado en la cohorte de Multiple Risk Factor Intervention Trial (MRFIT), otorgan a la HU un pequeño pero significativo efecto independiente (HR 1,11 [IC 95 % 1,08-1,15], P < 0,001). de 5.124 pacientes sometidos a angioplastia percutánea. La probabilidad de fallecer de los pacientes del tercer cuartil (de 6,3 a 7,5 mg/dl) fue del 5,6 %, frente al 17,4 % del último (HR 3,05 [IC 95 % 2,54-3,67], P < 0,001). Por cada 1 mg de aumento en los niveles de AU, la probabilidad de morir en el año que seguía a la intervención fue de nuevo del 12 %44. Los últimos metaanálisis realizados arrojan conclusiones un tanto diferentes. En el realizado en 2005 por Wheeler et al. sobre 16 ensayos relevantes que incluían 9.458 casos incidentes de EC y 155.084 controles, a pesar de la estrecha relación entre el AU y la EC, la posibilidad de que aquel se comporte como un factor de riesgo determinante parece disiparse cuando se tienen en cuenta los ocho estudios que contenían un ajuste más exhaustivo de los factores de confusión, HR 1,02 (IC, 0,91-1,14)40. El llevado a cabo por Kim et al.41 más recientemente incluyó solo ocho de los estudios del precedente. En este caso, solo se incluyeron cohortes prospectivas con grupos control (n = 26) y ajuste exhaustivo por los tradicionales FRCV. El resultado mostraba un efecto independiente de la HU, si bien de escasa cuantía (RR de 1,09 [IC 95 %: 1,03-1,16]) en cuanto a la incidencia de EC e igualmente sobre la mortalidad por EC (1,16 [IC 95 %: 1,01-1,30]), con efecto más marcado sobre el sexo femenino. Por cada 1 mg/dl de incremento en los valores de AU, la mortalidad, tras el análisis multivariado, aumenta un 12 %. La presencia de valores elevados de AU tras un evento coronario tiene también un significado pronóstico. Así, tras los 850 infartos agudos de miocardio recogidos en un centro coreano, los niveles de uricemia se mostraron como un factor independiente a la hora de predecir nuevos eventos cardiovasculares en los seis meses siguientes, con un valor incremental al sumarlo a los FRCV convencionales y el péptido natriurético (NT‑ProBNP)42. A efectos de estudiar la HU como factor pronóstico de mortalidad y del objetivo compuesto de mortalidad de causa cardíaca/infarto de miocardio, se enrolaron 936 pacientes pendientes de cirugía coronaria. Los niveles basales de AU no fueron capaces de predecir los eventos inmediatos (30 días poscirugía), pero la presencia de HU se relacionó con una HR de 1,4 (IC 95 % 1,1-1,7) y de 1,7 (IC 95 % 1,3-2,3), respectivamente, para ambos objetivos a más largo plazo43. Recientemente se han comunicado los resultados de mortalidad al año en un grupo Los pacientes con insuficiencia cardíaca crónica (ICC) suelen realizar dietas bajas en sal, cuentan con diversos grados de ERC y reciben diuréticos, mecanismos todos ellos que elevan los niveles de AU. La relación entre AU y mortalidad no ha de ser enteramente causal, sino que la HU puede ser solo una respuesta al aumento de actividad de la XO, y actuar de manera compensatoria (¿beneficiosa?) al estrés oxidativo45. Existe una correlación entre los niveles de AU y la incidencia de fallo cardíaco16 que puede comenzar ya con el desarrollo de HVI. Sobre una muestra tomada de población general, Yoshimura et al. publicaron recientemente un análisis (n: 1.943) que pone en relación el AU con la masa ventricular (P < 0,001), con una HR de ser diagnosticado de HVI que se duplica a partir de cifras por encima de 8 mg/dl, y es la primera prueba de esta correlación en la población general46. Más allá, en un estudio de intervención sobre pacientes con ERC moderada, la adición de alopurinol al tratamiento redujo la masa del ventrículo izquierdo47. En condiciones de enfermedad establecida, la HU está intimamente ligada con el grado funcional del paciente48 y presta valiosa información pronóstica49. Se ha conseguido demostrar la relación entre los niveles de AU y objetivos tales como la mortalidad por ICC15 y la mortalidad total, incluso de manera independiente de los conocidos factores neurohormonales50. Así y comparados con pacientes que contaban con una uricemia normal (< 6,7 mg/dl), los pacientes con cifras por encima de 10,1 mg/dl tuvieron una supervivencia seis veces menor (P < 0,0001) en un estudio cuyos 112 pacientes sufrían ICC moderada-grave, independientemente de la coexistencia de otros FRCV51. Una cifra de AU > 8,7 mg/dl ofreció superior información pronóstica (objetivo primario: muerte de causa cardíaca o readmisión) que el NT-proBNP en pacientes con ICC de naturaleza no isquémica52. 58 El ácido úrico y la insuficiencia cardíaca congestiva En cuanto a la insuficiencia cardíaca aguda, la serie más numerosa es la del Hospital Universitario El ácido úrico y el riesgo cardiovascular de Valencia, que recoge 560 ingresos consecutivos y concluye tras el análisis multivariante que un AU > 7,7 mg/dl se asocia con mayor riesgo de mortalidad (HR 1,45, IC 95 %: 1,03-2,44; P = 0,03)53. Más allá, Tamariz et al.54 realizan un metaanálisis que tiene en cuenta aquellos estudios sobre pacientes con fallo cardíaco tanto crónico como agudo que ofrecen datos sobre mortalidad (n: 1.456) y encuentran una asociación lineal de los niveles de uricemia con mortalidad por cualquier causa que comienza en los 7 mg/dl, lo que sugiere la adición del AU a las fórmulas predictivas del pronóstico de estos pacientes. El ácido úrico como factor protector La literatura hace referencia extensa a las consecuencias negativas de la HU, pero no por ello deja de reseñar situaciones en que se comporta de forma bien distinta. No puede ser en vano que evolutivamente nuestro riñón se haya adaptado para recuperar más del 90 % del AU filtrado55. Una situación donde la uricemia está elevada parece ofrecer neuroprotección. Los niveles bajos de AU se relacionan con la aparición de la enfermedad de Parkinson, la enfermedad de Alzheimer, la esclerosis lateral amiotrófica y la esclerosis múltiple, y con el empeoramiento de la sintomatología motora de la enfermedad de Huntington32. En el caso de los pacientes con ERC sometidos a hemodiálisis y al igual que sucede con otros factores de riesgo como la PA y el colesterol56, los niveles elevados de AU confieren un efecto protector sobre la mortalidad cardiovascular en lo que probablemente constituye un fenómeno de epidemiología inversa en una población tan particular. Tras recoger datos del estudio Dialysis Outcomes and Practice Patterns Study (DOPPS) (n: 4.637, media de AU 6,97 mg/dl) y realizando un exhaustivo ajuste, se observó un aumento en el riesgo de mortalidad por cualquier causa con cifras por debajo de 6,4 mg/dl. Los niveles altos de AU se asociaron con menor mortalidad cardiovascular (HR: 0,92, IC 95 %: 0,86-0,99 por cada incremento de 1 mg/dl). Es probable que, en estos pacientes, la HU sea un marcador subrogado de mejor estatus nutricional, pero lo cierto es que la asociación se mantuvo tras el ajuste por factores tales como el índice de masa corporal, el colesterol, el catabolismo proteico o la albúmina. En un plano diferente, algunos autores plantean la hipótesis de la posibilidad de que en pacientes hipertensos las leves elevaciones de AU provocadas por el uso de diuréticos o las dietas bajas en sal pu- dieran haber contribuido a los buenos resultados observados en el estudio The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT)57 entre los pacientes tratados con clortalidona, si bien incluso para los defensores de esta teoría resulta un salto arriesgado atribuir a la HU un rango de factor protector frente a los eventos cardiovasculares58. El ácido úrico como objetivo de tratamiento Sea por su efecto inhibidor de la XO o porque directamente alopurinol y su metabolito oxypurinol contrarrestan los radicales libres, van acumulándose pruebas de su potencial para mejorar la capacidad de ejercicio de los pacientes con angina estable y el aporte de energía en forma de Adenosina TriPhosphato (ATP) al corazón en situación de ICC, estabilizar la placa de ateroma, en la regresión de la HVI o en la progresión de la insuficiencia renal59,60. Sin embargo, el estudio prospectivo Oxypurinol Therapy for Congestive Heart Failure (OPT-CFH) sobre pacientes con ICC usando oxypurinol no mostró beneficio del tratamiento en cuanto a la mortalidad y la mejora del estatus funcional por ICC. En este estudio solo los pacientes con AU > 9,5 obtuvieron buenos resultados, pero desafortunadamente eran pocos para conseguir poder estadístico sobre el objetivo primario propuesto61. Quizá para que este acercamiento funcione la sobreexpresión de la XO ha de ser notable, reflejada en niveles de AU realmente elevados7, o la dosis utilizada (equivalentes a 85 mg de alopurinol) resultó escasa. De momento habremos de conformarnos con evidencias menos consistentes del efecto protector del inhibidor de la XO, basadas en estudios observacionales. En un pequeño estudio sobre 40 pacientes sometidos a angioplastia percutánea tras un infarto con elevación de ST, recibir alopurinol significó una menor elevación de la troponina y una menor aparición de eventos cardíacos en el seguimiento62. En una cohorte retrospectiva de 25.000 pacientes dados de alta tras un episodio de fallo cardíaco en Quebec, aquellos que sufrieron un ataque de gota o tenían historia de haberla sufrido y se encontraban bajo tratamiento con alopurinol tuvieron una reducción significativa en sus readmisiones por fallo cardíaco y en la mortalidad de cualquier causa3. Idéntico resultado publicaron Wei et al. en una cohorte retrospectiva de pacientes con ICC, donde la terapia con alopurinol era capaz 59 Hiperuricemia y gota Riesgo renal y cardiovascular de mejorar su pronóstico con base en la mortalidad de cualquier causa (HR 0,65 [IC 95 % 0,42-0,99])63. En el estudio español sobre pacientes con ERC, también la mortalidad cardiovascular se vio reducida en aquellos que recibieron el fármaco60. Sobre un registro de veteranos del noroeste de Estados Unidos, tomando una población de varones hiperuricémicos (> 7,0 mg/dl) mayores de 40 años y con riesgo global probablemente alto, se seleccionaron aquellos que habían iniciado el tratamiento con alopurinol entre 2001 y 2007 (n: 2.483) y un grupo control (n: 7.441) que no realizaba tratamiento. En el análisis final, con el mayor ajuste posible de factores confundentes, el grupo que había recibido alopurinol presentaba una significativa reducción del riesgo de muerte por cualquier causa (HR IC 95 % de 0,77 [0,65-0,91])64. Conclusiones • La HU es inherente a los pacientes de alto riesgo cardiovascular, está implicada en la • • • • aparición de los componentes del síndrome metabólico y a su vez es favorecida por la hiperinsulinemia. Su papel como FRCV es difícilmente separable de los factores tradicionales, pero su falta de independencia no tiene por qué excluir causalidad. La HU se ha relacionado con la enfermedad cardiovascular en todas sus formas. Su efecto resulta tanto más determinante cuanto mayor es el riesgo cardiovascular del sujeto. Su aumento puede tener en algunas ocasiones un efecto protector frente al ambiente oxidativo propiciado por un incremento de la actividad de la XO en situaciones de hipoperfusión tisular. Los inhibidores de la XO, desarrollados primariamente para el control de la HU en los pacientes con gota, pudieran tener un papel relevante en el futuro en la prevención primaria y secundaria de la enfermedad cardiovascular más allá de su capacidad para controlar el AU, de confirmarse las expectativas que despiertan los últimos estudios comentados. REFERENCIAS BIBLIOGRÁFICAS 1. Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med 2008;359: 1811-21. 2. Krishnan E, Svendsen K, Neaton JD, Grandits G, Kuller LH, MRFIT Research Group. Long-term cardiovascular mortality among middle-aged men with gout. Arch Intern Med 2008;168: 1104-10. 3. Thanassoulis G, Brophy JM, Richard H, Pilote L. Gout, allopurinol use, and heart failure outcomes. Arch Intern Med 2010;170:1358-64. 4. Feig DI, Mazzali M, Kang DH, Nakagawa T, Price K, Kannelis J, et al. Serum acid: a risk factor and a target for treatment? J Am Soc Nephrol 2006;17:S69-73. 5. Stellato D, Morrone LF, Di Giorgio C, Gesualdo L. Uric acid: a starring role in the intricate scenario of metabolic syndrome with cardio-renal damage? Intern Emerg Med 2012;7(1):5-8. 6. Johnson RJ, Kang DH, Feig D, Kivlighn S, Kanellis J, Watanabe S, et al. Is there a pathogenic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003;41:1183-90. 7. Doehner W, Landmesser U. Xanthine oxidase and uric acid in cardiovascular disease: clinical impact and therapeutic options. Semin Nephrol 2011;31:433-40. 60 8. Franse LV, Pahor M, Di Bari M, Shorr RI, Wan JY, Somes GW, et al. Serum uric acid, diuretic treatment and risk of cardiovascular events in the Systolic Hypertension in the Elderly Program. J Hypertens 2000;18:1149-54. 9. Smink PA, Bakker SJ, Laverman GD, Berl T, Cooper ME, de Zeeuw, et al. An initial reduction in serum uric acid during angiotensin blocker treatment is associated with cardiovascular protection: a post-hoc analysis of the RENAAL and IDNT trials. J Hypertens 2012;30(5): 1022-8. 10.Athyros VG, Elisaf M, Papageorgiou AA, Symeonidis AN, Pehlivanidis AN, Bouloukos VI, et al. Effect of statins versus untreated dyslipidemia on serum uric acid levels in patients with coronary heart disease: a subgroup analysis of the GREek Atorvastatin and Coronary-heartdisease Evaluation (GREACE) Study. Am J Kidney Dis 2004;43(4):589e99. 11.Hoieggen A, Alderman MH, Kjeldsen SE, Julius S, Devereux RB, De Faire U, et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int 2004;65:1041e9. 12.Kawai T, Ohishi M, Taketa Y, Onoshi M, Ito N, Yamamoto K, et al. Serum acid is an independent El ácido úrico y el riesgo cardiovascular risk factor for cardiovascular disease and mortality in hypertensive patients. Hypertens Res 2012;35:1087-92. 13.Baker JF, Krishnan E, Chen L, Schumacher HR. Serum uric acid and cardiovascular disease: recent developments, and where do they leave us? Am J Med 2005;118:816-26. 14.Niskanen LK, Laaksonen DE, Nyyssönen K, Alfthan G, Lakka HM, Lakka TA, et al. Uric acid level as a risk factor for cardiovascular and all-cause mortality in middle-aged men: a prospective cohort study. Arch Intern Med 2004;164:1546-51. 15.Strasak A, Ruttmann E, Brandt L, Kelleher C, Klenk J, Concin H, et al. Serum uric acid and risk of cardiovascular mortality: a prospective longterm study of 83 683 austrian men. Clin Chem 2008;54(2):273-84. 16.Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the Apolipoprotein MOrtality RISk study (AMORIS). J Intern Med 2009;266(6):558-70. 17.Wen CP, David Cheng TY, Chan HT, Tsai MK, Chung WS, Tsai SP, et al. Is high serum uric acid a risk marker or a target for treatment? Examination of its independent effect in a large cohort with low cardiovascular risk. Am J Kidney Dis 2010;56:273-88. 18.Ioachimescu AG, Brennan DM, Hoar BM, Hazen SL, Hoogwerf BJ. Serum uric acid is an independent predictor of all-cause mortality in patients at high risk of cardiovascular disease: a preventive cardiology information system (PreCIS) database cohort study. Arthritis Rheum 2008;58(2):623-30. 19.Zoppini G, Targher G, Bonora E. The role of serum uric acid in cardiovascular disease in tipe 2 diabetic and non diabetic subjects: a narrative review. J Endocrinol Invest 2011;34: 881-6. 20.Ford ES. Uric acid and mortality from all-causes and cardiovascular disease among adults with and without diagnosed diabetes: Findings from the National Health and Nutrition Examination Survey III Linked Mortality Study. Diabetes Res Clin Pract 2011;93(2):e84-6. 21.Panero F, Gruden G, Perotto M, Fornego P, Barutta F, Greco E, et al. Uric acid is not an independent predictor of cardiovascular mortality in type 2 diabetes: A population-based study. Atherosclerosis 2012;221(1):183-8. 22.Leiba A, Dinour D and Shani M. Healthy subjects with low uric acid levels followed up for 10 years, have a decreased incidence of diabetes and hypertension. J Hypertension 2012;30(e-Supplement A):e50. 23.Alper AB Jr, Chen W, Yau L, Srinivasan SR, Berenson GS, Hamm LL. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study. Hypertension 2005;45:34-8. 24.Jin M, Yang F, Yang I, Yin Y, Luo JJ, Wang H, et al. Uric acid, hyperuricemia and vascular diseases. Front Bios 2012;17:656. 25.Syamala S, Li J, Shankar A. Association between serum uric acid and prehypertension among US adults. J Hypertens 2007;25:1583-9. 26.Choi HK, Ford ES. Prevalence of the metabolic syndrome in individuals with hyperuricemia. Am J Med 2007;120:442-7. 27.Wiik BP, Larstorp A, Hoieggen A, Kjeldsen S, Olsen MH, Ibsen H, et al. Serum uric acid is associated with new-onset diabetes in hypertensive patients with left ventricular hypertrophy: the LIFE Study. Am J Hypertens 2010;23:845-51. 28.Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, et al. Uric acid and longterm outcomes in CKD. Am J Kidney Dis 2009;53:796-803. 29.Ito S, Naritomi H, Ogihara T, Shimada K, Shimamoto K, Tanaka H, et al. Impact of serum uric acid on renal function and cardiovascular events in hypertensive patients treated with losartan. Hypertens Res 2012;35(8):867-73. 30.Liu WC, Hung CC, Chen SC, Yeh SM, Lin MY, Chiu YW, et al. Association of hyperuricemia with renal outcomes, cardiovascular disease, and mortality. Clin J Am Soc Nephrol 2012;7:541-8. 31.Heras M, Fernández-Reyes MJ, Sánchez R, Molina A, Rodríguez A, Álvarez-Ude F. Serum uric acid as a marker of all-cause mortality in an elderly patient cohort. Nefrologia 2012;32(1): 67-72. 32.Álvarez-Lario B, Macarron-Vicente. Is there anything good in uric acid? Q J Med 2011;104: 1015-24. 33.Vannorsdall TD, Jinnah HA, Gordon B, Kraut M, Schretlen DJ. Cerebral ischemia mediates the effect of serum uric acid on cognitive function. Stroke 2008;39(12):3418-20. 34.Bos MJ, Koudstaal PJ, Hofman A, Witteman JC, Breteler MM. Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam Study. Stroke 2006;37:1503-7. 35.Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and risk of stroke: 61 Hiperuricemia y gota Riesgo renal y cardiovascular a systematic review and meta-analysis. Arthritis and rheumatism 2009;61:885-92. 36.Chamorro A, Obach V, Cervera A, Revilla M, Deulofeu R, Aponte JH. Prognostic significance of uric acid serum concentration in patients with acute ischemic stroke. Stroke 2002;33: 1048-52. 37.Brand FN, McGee DL, Kannel WB, Stokes J 3rd, Castelli WP. Hyperuricemia as a risk factor of coronary heart disease: The Framingham Study. Am J Epidemiol 1985;121(1):11-8. 38.Wannamethee SG, Shaper AG, Whincup PH. Serum urate and the risk of major coronary heart disease events. Heart 1997;78:147-53. 39.Moriarity JT, Folsom AR, Iribarren C, Nieto FJ, Rosamond WD. Serum uric acid and risk of coronary heart disease: Atherosclerosis Risk in Communities (ARIC) Study. Ann Epidemiol 2000;10:136-43. 40.Wheeler JG, Juzwishin KD, Eiriksdottir G, Gudnason V, Danesh J. Serum uric acid and coronary heart disease in 9,458 incident cases and 155,084 controls: prospective study and meta-analysis. PLoS Med 2005;2(3):e76. 41.Kim SY, Guevara JP, Kim KM, Choi HK, Heitjan DF, Albert DA. Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken) 2010;62:170-80. 42.Bae MH, Lee JH, Lee SH, Park SH, Yang DH, Park HS, et al. Serum acid as an independent and incremental prognostic marker in addition to N-terminal pro-B-type natriuretic peptide in patients with acute myocardial infarction. Circ J 2011;75(6):1440-7. 43.Dunkelgrun M, Welten GM, Goei D, Winkel TA, Schouten O, van Domburg RT, et al. Association between serum acid and perioperative and late cardiovascular outcome in patients with suspected or definite coronary artery disease undergoing elective vascular surgery. Am J Cardiol 2008;102(7):797-01. 44.Ndrepepa G, Braun S, Hans-Ullrich H, Schulz S, Ranftl S, Hadamitzky M, et al. Prognostic value of uric acid in patients with acute coronary syndromes. Am J Cardiol 2012;109:1260-5. 45.Reyes AJ. The increase in serum uric acid concentration caused by diuretics might be beneficial in heart failure. Eur J Heart Fail 2005;7(4):461. 46.Yoshimura A, Adachi H, Hirai Y. Serum uric acid is strongly associated with the left ventricular mass index in the general population. J Hypertension 2012;30(e-Supplement A):e239. 62 47.Kao MP, Ang DS, Gandy SJ, Nadir MA, Houston JG, Lang CC, et al. Allopurinol benefits left ventricular mass and endothelial dysfunction in chronic kidney disease. J Am Soc Nephrol 2011;22:1382-9. 48.Doehner W, Rauchhaus M, Florea VG, Sharma R, Bolger AP, Davos CH, et al. Uric acid in cachectic and non-cachectic CHF patients— relation to leg vascular resistance. Am Heart J 2001;141:792-9. 49.Harzand A, Tamariz L, Hare JM. Uric acid, heart failure survival, and the impact of xantine oxidade inhibition. Congest Heart Fail 2012;18(3):1 79-83. 50.Sakai H, Tsutamoto T, Tsutsui T, Tanaka T, Ishikawa C, Horie M. Serum level of uric acid, partly secreted from the failing heart, is a prognostic marker in patients with congestive heart failure. Circ J 2006;70:1006-11. 51.Anker SD, Doehner W, Rauchhaus M, Sharma R, Francis D, Knosalla C, et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation 2003;107:1991-7. 52.Kim H, Shin HW, Son J, Yoon HJ, Park HS, Cho YK, et al. Uric acid as prognostic marker in advanced nonischemic dilated cardiomyopathy: comparison with N-terminal pro B-type natriuretic peptide level. Congest Heart Fail 2010;16:153-8. 53.Alimonda AL, Nuñez J, Núñez E, Husser O, Sanchis J, Bodí V, et al. Hyperuricemia in acute heart failure. More than a simple spectator? Eur J Intern Med 2009;20(1):74-9. 54.Tamariz L, Harzand BS, Palacio A, Verma S, Jones J, Hare J. Uric acid as a predictor of allcause mortality in heart failure: a meta-analysis. Congest Heart Fail 2011;17:25-30. 55.Mount DB, Kwon CY, Zandi-Nejad K. Renal urate transport. Rheum Dis Clin North Am 2006;32:313-31. 56.Kalantar-Zadeh K, Kilpatrick R, McAllister C, Greenland S, Kopple JD. Reverse epidemiology of hypertension and cardiovascular death in the hemodialysis population: The 58th annual fall conference and scientific sessions. Hypertension 2005;45:811. 57.Reyes AJ, Leary WP. The ALLHAT and the cardioprotection conferred by diuretics in hypertensive patients: a connection with uric acid? Cardiovasc Drugs Ther 2002;16(6):485-7. 58.Reyes AJ, Leary WP. Hypertension, diuretics, and uric acid. Am J Hypertens 2006;19(10):1093-4. El ácido úrico y el riesgo cardiovascular 59.Struthers A, Shearer F. Allopurinol: novel indications in cardiovascular disease. Heart 2012;98(21):1543-5. 60.Goicoechea M, Vinuesa SG, Verdalles U, RuiaCaro C, Ampuero J, Rincón A, et al. Effect of allopurinol in chronic kidney disease progression and cardiovascular risk. Clin J Am Soc Nephrol 2010;5(8):1388-93. 61.Hare JM, Mangal B, Brown J, Fisher C Jr, Freudenberger R, Colucci WS, et al. OPT-CHF Investigators. Impact of oxypurinol in patients with symptomatic heart failure. Results of the OPTCHF study. J Am Coll Cardiol 2008;51:2301-9. 62.Rentoukas E, Tsarouhas K, Tsitsimpikou C, Lazaros G, Deftereos S, Vavetsi S. The prognostic impact of allopurinol in patients with acute myocardial infarction undergoing primary percutaneous coronary intervention. Int J Cardiol 2010;145:257-8. 63.Wei L, Fahey T, Struthers AD, MacDonald TM. Association between allopurinol and mortality in heart failure patients: a long-term follow-up study. Int J Clin Pract 2009;63:1327-33. 64.Luk A, Levin GP, Moore EE, Zhou XH, Kestenbaum BR, Choi HK. Allopurinol and mortality in hyperuricemic patients. Rheumatology 2009;48: 804-6. 63 Hiperuricemia en pacientes con enfermedad renal crónica avanzada y en diálisis Patricia de Sequera Ortiz, Marta Albalate Ramón, Rafael Pérez García Servicio de Nefrología. Hospital Universitario Infanta Leonor. Madrid Introducción Estudios clínicos recientes sugieren una estrecha relación entre la hiperuricemia y la enfermedad renal y cardiovascular, bien como marcador o como factor de riesgo para el desarrollo y progresión de estas. En el presente capítulo abordaremos qué papel desempeña la hiperuricemia en la morbimortalidad de los pacientes en los estadios avanzados de enfermedad renal crónica (ERC), definidos por un filtrado glomerular (FG) menor de 30 ml/min/1,73m2 (ERC estadios 4 y 5) y en tratamiento sustitutivo con diálisis. Esto tiene especial importancia en esta población, ya que tienen un riesgo cardiovascular (RCV) y una mortalidad muy elevados, con una probabilidad mayor de morir que de necesitar diálisis en el curso de su enfermedad1. En la ERC, la disminución de la excreción renal de ácido úrico (AU) es el principal mecanismo patogénico que conduce a la hiperuricemia. No obstante, pacientes con igual FG muestran niveles variables de AU, por lo que puede haber otros factores involucrados en el desarrollo de hiperuricemia distintos de la excreción urinaria de AU (probablemente relacionados con la generación de AU o su eliminación digestiva). La prevalencia de hiperuricemia en la ERC depende fundamentalmente de la definición de esta, que, aunque es arbitraria, la mayoría de los estudios sitúan en valores > 6 mg/dl (360 mmol/l) en las mujeres y > 7 mg/dl (387 mmol/l) en los varones. Con estos valores, la prevalencia de hiperuricemia en la enfermedad renal crónica avanzada (ERCA), según distintos autores, es superior al 20 %. Los resultados de los estudios epidemiológicos sobre hiperuricemia en los estadios avanzados de ERC son distintos a los realizados en poblaciones de RCV bajo, debido a que, por un lado, la disminución de la excreción renal de AU es inherente a la disminución del FG y la propia ERC es un factor de RCV y, por otro, a que los pacientes con ERCA y en diálisis tienen un RCV muy elevado. Para abordar el tema nos referiremos a los pacientes con ERCA y a los pacientes en diálisis por separado. Ácido úrico en la enfermedad renal crónica avanzada Hiperuricemia y progresión de la enfermedad renal crónica Establecer el papel que la hiperuricemia desempeña en la progresión de la ERCA es complicado, debido fundamentalmente a que la disminución del FG se acompaña invariablemente de la disminución de la excreción de AU. Aunque se ha descrito un aumento de la excreción de AU a través del tracto gastrointestinal2,3 a medida que la ERC progresa, siempre se produce una retención de este. Por ello, los niveles de AU elevados han sido considerados durante décadas el resultado de la disminución del FG y no un verdadero mediador de desarrollo y progresión de la ERC. De ahí el escaso número de estudios 65 Hiperuricemia y gota Riesgo renal y cardiovascular Hiperuricemia y mortalidad cardiovascular y la ausencia de recomendaciones en las guías de práctica clínica del tratamiento de la hiperuricemia en la ERCA. En relación con el RCV y la mortalidad, la mayoría de los estudios concluyen que los pacientes con hiperuricemia tienen un riesgo mayor. En el estudio de Liu4 la hiperuricemia aumentó el riesgo de muerte de cualquier causa y la aparición de eventos cardiovasculares. El riesgo relativo (RR) ajustado por cuartiles cuando se comparaban los cuartiles primero y cuarto (AU medio 5,7 y 10,5 mg/dl, respectivamente) fue de 1,85. Un dato interesante de este estudio es que la asociación entre hiperuricemia y mortalidad fue independiente del estadio de ERC. Como puede observarse en la tabla 1, son pocos los estudios realizados en la ERCA, y los resultados referentes a la asociación entre la hiperuricemia y la progresión de la ERC muestran que la hiperuricemia no es un factor de riesgo de progresión. En el estudio de Liu4, realizado en 3.303 pacientes con ERC estadios 3-5 (64,1 % ERC 4-5), la hiperuricemia no fue un factor de riesgo ni para la necesidad de tratamiento sustitutivo de la función renal (0,96 [0,79-1,16]) ni para la rápida progresión de la ERC, donde esta se consideraba como un descenso del FG > 6 ml/min/año (1,30 [0,98-1,73]). En el estudio de Madero5, la hiperuricemia tampoco resultó ser un factor de riesgo de progresión de la ERC, a pesar de un seguimiento de diez años. En el de Chang6, la correlación entre AU y FG fue muy significativa en los pacientes con ERC estadio 3 (b = -0,846; P < 0,0001); sin embargo, no hubo correlación en los estadios más avanzados, en ERC 4 y 5. Estos resultados difieren de los encontrados en estadios más precoces de la ERC, en los que la hiperuricemia se relaciona con la progresión de la ERC. Es posible que el AU tenga un papel patogénico en la inducción del daño renal, pero sea poco relevante en la ERC establecida. Kanbay7 et al. incluyeron en su estudio a 303 pacientes con ERC estadios 3-5 sin tratamiento renal sustitutivo (TRS), pero excluyeron a aquellos que tomaban fármacos que pudieran alterar la función endotelial (inhibidores de la enzima convertidora de angiotensina, antagonistas de los receptores de angiotensina II, alopurinol, estatinas o vitaminas C y E). En este estudio, la hiperuricemia también fue un factor de riesgo de eventos cardiovasculares (fatales y no fatales). El incremento de 1 mg/dl de los niveles de AU aumentó el RCV en un 32 %. Sin embargo, en este trabajo los pacientes con ERC estadio 5 sí presentaron mayor RCV que los que tenían ERC estadio 3 y 4. Tabla 1. Estudios en pacientes con enfermedad renal crónica estadios 4 y 5 y en diálisis para determinar la asociación de hiperuricemia y progresión de enfermedad renal crónica o mortalidad Autor Tipo de población n Seguimiento (años) Factor de riesgo independiente Madero5 ERC 3-4 (FG medio: 33 ml/min/1,73 m2) 840 10 Sí de mortalidad total y CV No de progresión ERC Liu4 ERC 3-5 (FG medio: 22,4 ml/min/1,73 m2) 3.303 2,8 Sí de mortalidad total y CV No de progresión ERC Kanbay7 ERC 3-5 (63,3 % ERC 4-5) 303 3,2 Sí de eventos CV Chang6 ERC 3-5 (pacientes > 40 años) 18.020 Estudio transversal Correlación AU y FG: No en ERC 4 y 5 Sí en ERC 3 Latif14 HD 4.637 2 Sí de mortalidad asociación inversa 16 Hsu HD 146 1 Sí de mortalidad asociación curva J 17 Lee HD 168 6 Sí de mortalidad asociación inversa 294 2,2 Sí de mortalidad asociación curva J 134 2 Sí pérdida de FRR Suliman15 ERC 5-HD (incidentes) FG medio: 6,4 ml/min/1,73 m2 Park24 DP AU: ácido úrico; CV: cardiovascular; DP: diálisis peritoneal; ERC: enfermedad renal crónica; FG: filtrado glomerular; FRR: función renal residual; HD: hemodiálisis. 66 Hiperuricemia en pacientes con enfermedad renal crónica avanzada y en diálisis En relación con la patogenia, hay que comentar un estudio observacional en 337 pacientes con ERC estadio 58 que no estaban en tratamiento con diálisis. La proteína C reactiva se asoció, entre otros factores, a la hiperuricemia, lo que ofrece un dato indirecto de afectación endotelial y una posible explicación a la relación existente entre la hiperuricemia y el RCV. Ácido úrico en diálisis Riesgo cardiovascular y mortalidad Los estudios que analizan la asociación entre hiperuricemia y mortalidad en los pacientes en diálisis son diversos y no muestran una relación directa entre ambos parámetros. Probablemente se deba a que los pacientes en diálisis presentan una mortalidad muy elevada, fundamentalmente de origen cardiovascular. En España, según los últimos informes del Grupo de Registros de Enfermos Renales (GRER)9, la mortalidad de los pacientes en diálisis fue en 2011 del 14,1 % en hemodiálisis (HD) y del 8,1 % en diálisis peritoneal (DP). En el informe del registro americano (US Renal Data System) en 2011, al comparar la mortalidad ajustada de los mayores de 45 años en diálisis con los de la misma edad en la población general, esta se multiplicaba por 710. Esta elevada mortalidad se atribuye en general a que a los factores de riesgo clásicos en la población en diálisis se suman otros relacionados con el estado urémico y con la terapia dialítica, como la malnutrición, la hipoalbuminemia, la anemia y las alteraciones del metabolismo óseo y mineral. Además, no hay que olvidar que algunos de los factores de RCV de la población general han mostrado una epidemiología inversa en el paciente en diálisis, es decir, que su presencia se asocia con un mejor pronóstico. En esta paradoja se incluyen, por ejemplo, la hipertensión arterial (HTA)11, la hipercolesterolemia12 y la obesidad13. Existen pocos estudios que analicen la asociación entre hiperuricemia y mortalidad; más aún, el AU no se analiza de forma rutinaria en todos los países. Mientras que en España o Japón se realiza esta determinación en más del 90 % de los pacientes en HD, en Estados Unidos este porcentaje es inferior al 10 %14. Como se muestra en la tabla 1, algunos estudios epidemiológicos muestran que la asociación de hiperuricemia y mortalidad tiene un comportamiento especial: tanto una curva de riesgo en J15,16 como la asociación inversa14,17. El estudio que recoge mayor número de pacientes en HD14 es el realizado por el DOPPS (Dialysis Outcomes and Practice Patterns Study), que incluye a 4.637 pacientes de seis países, incluida España. En él, los niveles elevados de AU no solo no se asociaron a una mayor mortalidad cardiovascular y total, sino que los niveles de AU mostraron una relación inversa con la mortalidad (RR: 0,95 y 0,92 para la mortalidad total y cardiovascular, respectivamente). Cuando se analizó el AU como una variable dicotómica, al comparar AU < 8,2 mg/dl con AU > 8,2 mg/dl, el RR fue de 1,24 y 1,54 para la mortalidad total y cardiovascular, respectivamente. Este estudio sugiere que la hiperuricemia podría ser cardioprotectora en los pacientes en diálisis y es un ejemplo más de epidemiología inversa en esta población. A su vez, fueron factores predictores de hiperuricemia: menor edad, mayor índice de masa corporal (IMC) y tasa de catabolismo proteico, función renal residual (FRR), uso de diuréticos, niveles más elevados de fósforo (P) y creatinina (Cr), y más bajos de calcio y potasio. Sin embargo, la diabetes y el tratamiento con alopurinol mostraron una asociación negativa con la hiperuricemia. Otros tres autores han estudiado la asociación entre AU y mortalidad15-17. Estos estudios están realizados con un menor número de pacientes (< 300) y dos de ellos cuentan solo con pacientes incidentes en diálisis. El estudio de Suliman15, que incluye 294 pacientes incidentes en HD, los divide en tres grupos en función de los niveles de AU (quintil más bajo, tres quintiles medios, quintil más alto). Los resultados de la asociación con la mortalidad muestran una curva en J, con unos RR de 1,96 y 1,42 para los quintiles más alto y más bajo, respectivamente. El de Hsu16, con 146 pacientes en HD crónica, obtiene resultados similares con una mayor mortalidad en los niveles de AU extremos (quintiles 1 y 5). En el estudio retrospectivo de Lee17 en pacientes incidentes en HD, al igual que en el DOPPS, en los pacientes con niveles más bajos de AU (AU < 5,2 mg/dl) el riesgo de morir se duplicaba en el primer año de tratamiento. No se sabe cuáles podrían ser los mecanismos implicados en la asociación entre menor mortalidad y niveles elevados de AU, pero los autores14,18 especulan sobre dos: 1) el AU podría ser un marcador subrogado de mejor estado nutricional, dada la asociación positiva con el IMC, la tasa de catabolismo proteico, los niveles de P y Cr; y 2) las propiedades antioxidantes del AU demostradas en estudios in 67 Hiperuricemia y gota Riesgo renal y cardiovascular vitro19 tendrían un papel protector. Varios estudios experimentales han mostrado que el urato, la forma soluble del AU, puede reaccionar y bloquear distintos oxidantes como el peróxido de hidrógeno, los radicales hidroxilo y los peroxinitritos18, neutralizando su efecto y evitando el daño mediado por estos poderosos oxidantes. La mayor mortalidad observada en los pacientes con niveles muy elevados de AU, en aquellos que mostraron una curva de mortalidad en J15,16, se atribuye entre otros factores a la disfunción endotelial producida por la hiperuricemia. Los efectos del AU parecen ser contradictorios; por un lado, tiene un efecto antioxidante, y por otro, favorece la disfunción endotelial. Un estudio reciente realizado en 50 pacientes con ERC estadio 5 en TRS con diálisis (52 % en HD y 48 % en DP) demuestra un riesgo mayor de presentar calcificaciones y eventos cardiovasculares en pacientes con niveles de AU por encima de 6 mg/dl20. El único estudio realizado en población pediátrica en diálisis (46 en HD y 17 en DP) que analiza el efecto del AU21 encuentra una asociación positiva entre la hiperuricemia y la HTA en HD, pero no en DP. Sin embargo, el estudio de Tang22 en población adulta en DP continua ambulatoria sí encontró una asociación directa entre AU y disfunción endotelial, independiente de los factores de riesgo tradicionales e inflamación, pudiendo contribuir al desarrollo de HTA y enfermedad cardiovascular. Al igual que ocurre en los estudios realizados en estadios más precoces de la ERC, en los realizados en pacientes en HD y con ERCA, los diuréticos se asocian con la aparición de hiperuricemia23. En el DOPPS14 los pacientes en tratamiento con diuréticos presentaron un 34 % más de riesgo de hiperuricemia (RR 1,34). dida de la FRR, lo que sugiere que el AU puede ser un factor de riesgo de disminución de la FRR en los pacientes en DP. Artritis gotosa y diálisis El paciente con artritis gotosa y ERC presenta una evolución más favorable de la gota cuando inicia el tratamiento dialítico25,26 (HD y DP), con una disminución importante del número de episodios de gota, a pesar de persistir cifras elevadas de AU. Ifudu et al.25 mostraron que la prevalencia de gota (del 6,5 % antes del TRS) desaparecía casi por completo en diálisis. Datos similares fueron publicados en el estudio epidemiológico japonés de Ohno26, que incluyó a 493 pacientes en TRS. La prevalencia de artritis gotosa al menos dos años antes de iniciar el TRS era del 4,1 % en las mujeres y del 15,4 % en los varones. Después de iniciar el TRS disminuía en los varones al 3,4 % en los primeros dos años y al 1,2 % en años sucesivos, sin que aparecieran nuevos casos de gota en las mujeres. Esta menor actividad de la enfermedad cuando el paciente es incluido en diálisis se atribuye a la eliminación mediante la diálisis de algún factor desconocido promotor de la artritis gotosa o a la propia eliminación del AU, que produciría una disminución del pool corporal de AU. Otro mecanismo propuesto es que la disminución de la secreción de citocinas proinflamatorias estimulada por el urato monosódico en la ERC podría prevenir las manifestaciones de la gota en estos pacientes27. Los resultados de estos dos estudios nos llevan a concluir que la indicación de tratamiento hipouricemiante para tratar la gota es bastante infrecuente en diálisis. No obstante, no resuelve la duda de si debemos tratar la hiperuricemia asintomática, en aras de disminuir el RCV tan elevado que presentan. Hiperuricemia y técnica de diálisis Hiperuricemia y pérdida de la función renal residual A pesar de la importancia que la FRR ha demostrado, tanto en la adecuación de la técnica como en la supervivencia de los pacientes en diálisis, solo un estudio realizado en 134 pacientes incidentes en DP analiza la relación entre la hiperuricemia y la FRR24. El 32,8 % de los pacientes presentaron un nivel de AU superior a 7 mg/dl al inicio del tratamiento con DP. En estos, los niveles elevados de AU se asociaron de forma independiente con la pér68 El AU es una molécula hidrosoluble y de bajo peso molecular (168,1 Da), por lo que es fácilmente dializable, con un porcentaje de extracción elevado (71 al 80 %). El porcentaje de extracción por hora disminuye durante la sesión de HD, pues es de en torno al 32 % en la primera hora y del 20 % en la cuarta. La eliminación media por sesión es de aproximadamente 1 g y puede ser mayor si se utilizan membranas de alto flujo28 o técnicas de hemodiafiltración posdilucional29 o mid-dilution30 (porcentaje de reduc- Hiperuricemia en pacientes con enfermedad renal crónica avanzada y en diálisis ción de AU de 75,4 % y 75,2 %). En cambio, la eliminación no es mayor con la hemodiafiltración predilucional cuando se compara con la HD convencional (porcentaje de reducción de AU de 71 %). La extracción de AU con diálisis atenúa la hiperuricemia. En un estudio que comparaba los niveles de AU entre pacientes en HD, en ERCA sin TRS y controles sanos, los niveles de AU estaban elevados en los dos primeros, pero los valores eran superiores en los pacientes que no recibían tratamiento con diálisis (6,8 frente a 5,9 mg/dl), respecto a los controles sanos (4,7 mg/dl)31. Tratamiento farmacológico y ácido úrico en enfermedad renal crónica y diálisis El tratamiento de la gota y la hiperuricemia en pacientes con ERC se aborda con detalle en otro capítulo de esta monografía y por ello solo se hará alguna referencia a las peculiaridades en los pacientes con ERCA y en tratamiento dialítico. Aunque en pacientes con ERC en estadios más precoces el tratamiento de la hiperuricemia con alopurinol ha mostrado enlentecer la progresión de la ERC y disminuir el RCV32,33, no existen estudios en la ERCA ni en diálisis que apoyen el tratamiento de la hiperuricemia asintomática en estos pacientes. El riesgo de efectos adversos graves con el alopurinol (rash, intolerancia gastrointestinal, leucopenia y reacciones graves de hipersensibilidad) es mayor en la ERC34 debido a que el oxipurinol se elimina por vía renal y, por ello, su uso se ha limitado en esta población. Así, la dosis de alopurinol debe ajustarse a la función renal35 y, aunque no se conoce la dosis óptima, se recomienda que con FG inferiores a 20 ml/min se inicie el tratamiento con una dosis máxima de 100 mg diarios, e ir ajustando. De existir las facilidades para medir las concentraciones plasmáticas del metabolito oxipurinol, debe ajustarse la dosis para mantener los niveles plasmáticos de oxipurinol por debajo de 100 micromol/l (15,2 mg/l). La diálisis elimina el alopurinol y sus metabolitos, por lo que se aconseja administrar el fármaco después de la sesión de diálisis. Solo un estudio realizado en un pequeño número de pacientes (n = 12) afectos de gota en HD36 utiliza dosis de 300 mg/día, y observa una reducción sig- nificativa de los niveles de AU (-3,5 mg/dl), así como de colesterol ligado a lipoproteínas de baja densidad y triglicéridos. La benzobromarona está restringida a la hiperuricemia asociada a ERC o a trasplante renal en pacientes que muestren ineficacia o intolerancia al alopurinol y está contraindicada si el FG < 20 ml/min, debido al riesgo, aunque infrecuente, de toxicidad hepática grave. El febuxostat, un nuevo inhibidor de la xantina oxidasa de gran potencia disponible en España desde 2011, tiene la ventaja de que su farmacocinética es independiente de la función renal y no requiere ajuste de dosis con FG > 30 ml/min. Sin embargo, no hay experiencia en pacientes con ERCA ni en diálisis37. No todos los estudios epidemiológicos que estudian la asociación entre hiperuricemia y mortalidad o progresión de la ERC analizan el tratamiento con hipouricemiantes. En el de Liu4, un 18,1 % al inicio del estudio estaban en tratamiento con hipouricemiantes, y en el DOPPS14, los pacientes en tratamiento con alopurinol presentaron menor riesgo de hiperuricemia (RR 0,28). El único estudio en DP que analiza el efecto de alopurinol lo hace sobre la FRR en pacientes en DP23 y, aunque en los pacientes con hiperuricemia la FRR disminuyó más rápidamente, el tratamiento con este fármaco no se relacionó con la preservación de la FRR. No obstante, la proporción de pacientes en tratamiento con alopurinol fue similar entre el grupo de pacientes con niveles elevados y el grupo con niveles normales de AU, lo que implica que el alopurinol no se utilizó de forma adecuada para disminuir los niveles de AU. Otro aspecto que se ha de destacar es la existencia de fármacos utilizados con frecuencia en pacientes con ERC con un discreto efecto hipouricemiante y que pueden ser de interés como tratamiento coadyuvante en pacientes en los que estén indicados por su comorbilidad asociada. Este es el caso del antihipertensivo losartán38, que reduce los niveles de ácido úrico por un mecanismo independiente del bloqueo de la angiotensina 2, en concreto por interferir con el transporte de urato en el túbulo proximal. Más aún, en el análisis post hoc del estudio Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan (REENAL)38, cuyos resultados, aunque 69 Hiperuricemia y gota Riesgo renal y cardiovascular no está realizado en ERCA, podrían extrapolarse, la reducción de 0,5 mg/dl de AU se asoció con una disminución del riesgo de evento renal y la disminución de AU explicó aproximadamente un 20 % del efecto renoprotector del losartán. Varios estudios han mostrado que el quelante del fósforo sevelamer tiene un efecto hipouricemiante en los pacientes en HD39,40. La reducción de los niveles de AU es proporcional a la gravedad de la hiperuricemia. El mecanismo posiblemente sea mediante la disminución de la absorción entérica del AU directamente por el sevelamer, de forma similar a como disminuye los niveles de fósforo. Puntos clave • Los estudios en pacientes con ERCA muestran que la hiperuricemia es un factor de riesgo de mortalidad y RCV. • En pacientes con ERCA, la hiperuricemia no ha mostrado ser un factor de progresión de la enfermedad renal. • En los pacientes en diálisis, la asociación entre mortalidad y AU muestra una relación inversa o curva en forma de J. • No existen estudios en la ERCA ni en diálisis que apoyen el tratamiento de la hiperuricemia asintomática en estos pacientes. referencias Bibliográficas 1. Keith DS, Nichols GA, Gullion CM, Brown JB, Smith DH. Longitudinal follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med 2004;164:659-63. 2. Hatch M, Vaziri ND. Enhanced enteric excretion of urate in rats with chronic renal failure. Clin Sci 1994;86:511-6. 3. Vaziri ND, Freel RW, Hatch M. Effect of chronic experimental renal insufficiency on urate metabolism. J Am Soc Nephrol 1995;6:1313-7. 4. Liu WC, Hung CC, Chen SC, Yeh S-M, Lin M-Y, Chiu Y-W, et al. Association of hyperuricemia with renal outcomes, cardiovascular disease, and mortality. Clin J Am Soc Nephrol 2012;7:541-8. 5. Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, et al. Uric acid and long-term outcomes in CKD. Am J Kidney Dis 2009;53:796-803. 6. Chang H-Y, Tung C-W, Lee P-H, Lei C-C, Hsu Y-C, Chang H-H, et al. Hyperuricemia as an independent risk factor of chronic kidney disease in middle-aged and elderly population. Am J Med Sci 2010;339:509-15. 7. Kanbay M, Yilmaz MI, Sonmez A, Solak Y, Saglam M, Cakir E, et al. Serum uric acid independently predicts cardiovascular events in advanced nephropathy. Am J Nephrol 2012;36:324-31. 8. Caravaca F, Martin MV, Barroso S, Cancho B, Arrobas M, Luna E, et al. Serum uric acid and C-reactive protein levels in patients with chronic kidney disease. Nefrologia 2005;25:645-54. 9. GRER. Informe de diálisis y trasplante 2011. Disponible en: http://www.senefro.org/modules/ webstructure/files/reercongsen2012.pdf. 70 10.US Renal Data System. USRDS 2011 Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States. Am J Kidney Dis 2012;59:e1-e420. 11.Chien CC, Yen CS, Wang JJ, Chen HA, Chou MT, Chu CC, et al. Reverse epidemiology of hypertension-mortality associations in hemodialysis patients: a long-term populationbased study. Am J Hypertens 2012;25:900-6. 12.Bowden RG, La Bounty P, Shelmadine B, Beaujean AA, Wilson RL, Hebert S. Reverse epidemiology of lipid-death associations in a cohort of end-stage renal disease patients. Nephron Clin Pract 2011;119:214-9. 13.Kalantar-Zadeh K, Abbott K, Salahudeen A, Kilpatrick RD, Horwich TB. Survival advantages of obesity in dialysis patients. Am J Clin Nutrition 2005;81:543-54. 14.Latif W, Karaboyas A, Tong L, Winchester JF, Arrington CJ, Pisoni RL, et al. Uric acid levels and all-cause and cardiovascular mortality in the hemodialysis population. Clin J Am Soc Nephrol 2011;6:2470-7. 15.Suliman ME, Johnson RJ, García-López E, Qureshi AR, Molinaei H, Carrero JJ, et al. J-shaped mortality relationship for uric acid in CKD. Am J Kidney Dis 2006;48:761-71. 16.Hsu SP, Pai ME, Peng YS, Chiang CK, Ho TI, Hung KY. Serum uric acid levels show a ‘J-shaped’ association with all cause mortality in haemodialysis patients. Nephrol Dial Transplant 2004;19: 457-62. 17.Lee SM, Lee AL, Winters TJ, Tam E, Jaleel M, Stenvinkel P, et al. Low serum uric acid level is Hiperuricemia en pacientes con enfermedad renal crónica avanzada y en diálisis a risk factor for death in incident hemodialysis patients. Am J Nephrol 2009;29:79-85. 18.Kuzkaya N, Weissmann N, Harrison DG, Dikalov S. Interactions of peroxynitrite with uric acid in the presence of ascorbate and thiols: Implications for uncoupling endothelial nitric oxide synthase. Biochem Pharmacol 2005;70:343-54. 19.Suzuki T, Nishigawara O. Nitrosation of uric acid induced by nitric oxide under aerobic conditions. Nitric Oxide 2007;16:266-73. 20 20 D’Marco L, García I, Vega C. Uric acid, atherosclerosis and vascular calcifications in chronic kidney disease. Invest Clin 2012;53:52-9. 21.Silverstein DM, Srivaths PR, Mattison P, Upadhyay K, Midgley L, Moudgil A, et al. Serum uric acid is associated with high blood pressure in pediatric hemodialysis patients. Pediatr Nephrol 2011;26:1123-8. 22.Tang Z, Cheng LT, Li HY, Wang TI. Serum uric acid and endothelial dysfunction in continuous ambulatory peritoneal dialysis patients. Am J Nephrol 2009;29:368-73. 23. Lin CH, Lee WL, Hung YJ, Lee DY, Chen KF, Chi WC, et al. Prevalence of hyperuricemia and its association with antihypertensive treatment in hypertensive patients in Taiwan. Int J Cardiol 2012;156:41-6. 24.Park JT, Kim DK, Chang TL, Kim HW, Chang JH, Park SY, et al. Uric acid is associated with the rate of residual renal function decline in peritoneal dialysis patients. Nephrol Dial Transplant 2009;24:3520-5. 25.Ifudu O, Tan CC, Dulin AL, Delano BG, Friedman EA. Gouty arthritis in end-stage renal disease: clinical course and rarity of new cases. Am J Kidney Dis 1994;23:347-51. 26.Ohno I, Ichida K, Okabe H, Hikita M, Uetake D, Kimura H, et al. Frequency of gouty arthritis in patients with end-stage renal disease in Japan. Intern Med 2005;44:706-9. 27.Schreiner O, Wandel E, Himmelsbach F, Galle PR, Marker-Hermann E. Reduced secretion of proinflammatory cytokines of monosodium urate crystal-stimulated monocytes in chronic renal failure: an explanation for infrequent gout episodes in chronic renal failure patients? Nephrol Dial Transplant 2000;15:644-9. 28.Sombolos K, Tsitamidou Z, Kyriazis G, Karagianni A, Kantaropoulou M, Progia E. Clinical evaluation of four different high-flux hemodialyzers under conventional conditions in vivo. Am J Nephrol 1997;17:406-12. 29.Meert N, Eloot S, Schepers E, Lemke H-D, Dhondt A, Glorieux G, et al. Comparison of removal capacity of two consecutive generations of high-flux dialysers during different treatment modalities. Nephrol Dial Transplant 2011;26:2624-30. 30.Eloot S, Dhondt A, Van Landschoot M, Waterloos MA, Vanholder R. Removal of water-soluble and protein-bound solutes with reversed mid-dilution versus post-dilution haemodiafiltration. Nephrol Dial Transplant 2012;27:3278-83. 31.Mircescu G, Capusa C, Stoian I, Vârgolici B, Barbulescu C, Ursea N. Global assessment of serum antioxidant status in hemodialysis patients. J Nephrol 2005;18:599-605. 32.Goicoechea M, de Vinuesa SG, Verdalles U, RuizCaro C, Ampuero J, Rincón A, et al. Effect of allopurinol in chronic kidney disease progression and cardiovascular risk. Clin J Am Soc Nephrol 2010;5:1388-93. 33.Jalal DI, Chonchol M, Chen M, Targher G. Uric acid as a target of therapy in CKD. Am J Kidney Dis 2013;61:134-46. 34.Arellano F, Sacristan JA. Allopurinol hypersensitivity syndrome: a review. Ann Pharmacother 1993;27:337-43. 35.Dalbeth N, Stamp L. Allopurinol dosing in renal impairment: walking the tightrope between adequate urate lowering and adverse events. Semin Dial 2007;20:391-5. 36.Shelmadine B, Bowden RG, Wilson RL, Beavers D, Hartman J. The effects of lowering uric acid levels using allopurinol on markers of metabolic syndrome in end-stage renal disease patients: a pilot study. Anadolu Kardiyol Derg 2009;9: 385-9. 37.Pérez-Ruiz F. Febuxostat: nuevo tratamiento para la gota. Nefrología Sup Ext 2012;3:16-22. 38.Milao Y, Ottenbros SA, Laverman GD, Brenner BM, Cooper ME, Parving HH, et al. Effect of a reduction in uric acid on renal outcomes during losartan treatment: a post hoc analysis of the reduction of endpoints in non-insulin dependent diabetes mellitus with the Angiontensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7. 39.Ohno I, Yamaguchi Y, Saikawa H, Uetake D, Hikita M, Okabe H, et al. Sevelamer decreases serum uric acid concentration through adsorption of uric acid in maintenance hemodialysis patients. Intern Med 2009;48:415-20. 40.Garg JP, Chasan-Taber S, Blair A, Plone M, Bommer J, Raggi P, et al. Effects of sevelamer and calcium-based phosphate binders on uric acid concentrations in patients undergoing hemodialysis. A randomized clinical trial. Arthritis Rheum 2005;52:290-5. 71 Hiperuricemia en pacientes trasplantados renales Enrique Morales Ruiz Servicio de Nefrología. Hospital 12 de Octubre. Madrid Jose María Campistol Plana Jefe de Servico de Nefrología del Hospital Clinic. Barcelona Introducción La hiperuricemia es una complicación muy frecuente en el paciente con trasplante renal, sobre todo en la era de la ciclosporina. Su incidencia oscila entre el 50-80 %, frente al 15-20 % observado en el enfermo con inmunosupresión con azatioprina y esteroides1-3. El resto de los inmunosupresores actuales tiene un mínimo efecto sobre el metabolismo del ácido úrico4. Los niveles de ácido úrico en pacientes trasplantados que reciben ciclosporina suelen encontrarse en rangos entre 8-14 mg/dl y los episodios de artritis gotosa son poco frecuentes, pues se sitúan alrededor del 5-25 % en la mayoría de las series5. La causa de la hiperuricemia es multifactorial; así, el descenso de la función renal, la afectación del manejo tubular del urato, la obesidad, una historia previa de hiperuricemia o gota y el uso de diuréticos son los factores más destacados3. Sin embargo, la influencia de la hiperuricemia sobre la supervivencia del injerto, así como la prevención y el tratamiento de esta complicación, continúan siendo temas confusos y con pobre evidencia en la literatura científica del mundo del trasplante. Etiopatogenia de la hiperuricemia en el paciente trasplantado. Papel de los inmunosupresores Durante la última década numerosos trabajos científicos han intentado identificar nuevos factores de riesgo que influyen en el pronóstico del injerto y del paciente trasplantado. La identificación de estos factores y su papel en el desarrollo de la nefropatía crónica del injerto es esencial para el empleo de diferentes armas terapéuticas que mejoren la supervivencia del injerto renal. En este sentido, existen estudios experimentales y clínicos que han demostrado que la hiperuricemia desempeña un papel fundamental en la progresión de la enfermedad cardiovascular y de la patología renal. El ácido úrico produce una serie de cambios en los siguientes ámbitos: • Induce disfunción endotelial y disminución en la producción de óxido nítrico6. • Estimula la proliferación de la célula del músculo liso vascular y la producción de citocinas proinflamatorias y profibróticas7. • Se ha asociado con la etiopatogenia de la hipertensión8. • Los niveles de ácido úrico se han relacionado con marcadores inflamatorios como la proteína C reactiva, la interleucina (IL)-6 y el factor de necrosis tumoral alfa9. • Incrementos de ácido úrico se han relacionado con la regulación del sistema renina-angiotensina10. • Los niveles de ácido úrico se han asociado a la calcificación de las arterias coronarias y al engrosamiento de la media de la arteria carótida11. • Un número importante de estudios epidemiológicos han relacionado el ácido úrico como factor independiente en la asociación con el infarto de miocardio, el accidente cerebrovascular y todas las causas de mortalidad cardiovascular12. 73 Hiperuricemia y gota Riesgo renal y cardiovascular • Los niveles elevados de ácido úrico se han relacionado como factor de riesgo para el desarrollo de insuficiencia renal, así como factor de progresión de esta13. • La reducción del ácido úrico con alopurinol se ha asociado con enlentecimiento de la progresión de la enfermedad renal y un mejor control de la presión arterial14. • En animales de experimentación, la hiperuricemia induce un incremento de la presión intraglomerular y progresión de la enfermedad renal en animales monorrenos15. En ratas tratadas con ciclosporina, la hiperuricemia causa empeoramiento de la hialinosis arteriolar, lesión túbulo-intersticial y acúmulo de macrófagos en el glomérulo y en el intersticio16. La hiperuricemia aparece fundamentalmente durante el primer año postrasplante, su incidencia es superior al 50 % y aumenta hasta el 70 % a los tres años; este aumento progresivo es paralelo al de la incidencia de la hipertensión arterial. Como factores predisponentes se han identificado: el descenso del filtrado glomerular (FG), la administración de diuréticos, un descenso en la excreción renal de ácido úrico y niveles elevados de los inhibidores de la calcineurina17. Los receptores de un trasplante renal a menudo desarrollan hipertensión y edemas, motivo por el cual se utilizan diuréticos tiazídicos y de asa. Es conocido que este tipo de fármacos puede causar hiperuricemia por interferir en el aclaramiento del ácido úrico y cierto grado de hipovolemia, los cuales contribuyen a incrementar la reabsorción de úrico en el túbulo5. Sin embargo, la causa más frecuente de hiperuricemia en el paciente trasplantado es la ciclosporina. Hay pocos estudios en la literatura sobre la hiperuricemia en la era preciclosporina. Los estudios del manejo del ácido úrico en ausencia de ciclosporina se basan en las anomalías en el manejo de la reabsorción o excreción del ácido úrico18. A continuación, comentaremos el papel de los diferentes inmunosupresores sobre el metabolismo del ácido úrico. La patogenia de la hiperuricemia en el enfermo trasplantado en tratamiento con ciclosporina no es bien conocida y se han postulado dos hipótesis: en la primera se atribuiría al descenso del FG secundario a la vasoconstricción de la arteriola aferente19 y en la segunda a alteraciones del manejo tubular del ácido úrico especialmente en presencia de depleción de volumen secundaria al uso de diuréticos20. Favorecería la primera la asociación entre niveles de creatinina sérica elevados y la hiperuricemia, pero esta relación no se ha observado sistemáticamente. Zucher et al.21, midiendo el FG con métodos más precisos como el aclaramiento de inulina, observan una correlación de este y los niveles sanguíneos de ácido úrico en tres grupos de individuos (enfermos con trasplante renal, enfermos con trasplante de médula ósea y donantes de riñón), así como la desaparición de la hiperuricemia cuando se suspende la administración de ciclosporina; por estos motivos concluyen que la hiperuricemia es debida a la disminución del FG y no a un trastorno tubular. Sin embargo, estos autores solamente miden la excreción fraccional de ácido úrico; no hacen otras pruebas de función tubular, y además y fundamentalmente no separan los enfermos con hiperuricemia respecto de los normouricémicos, por lo que diferencias en el manejo tubular de estos dos grupos de enfermos podrían pasar desapercibidas. A favor de la segunda hipótesis, existen muchos datos que apoyan que la ciclosporina disminuye el aclaramiento de ácido úrico por el riñón. Estudios realizados con pirazinamida encuentran que la hiperuricemia se relacionaba con un aclaramiento de creatinina descendido, pero que había también trastornos de la secreción y reabsorción tubular de úrico22. Ciclosporina En cuanto al papel de los diuréticos en la patogenia de la hiperuricemia, pensamos que tienen una importancia secundaria y que su efecto es sinérgico o aditivo al de la ciclosporina en su capacidad de retención de ácido úrico. Si bien es cierto que los diuréticos pueden ser causa desencadenante de la hiperuricemia, solamente explicaría su aparición en menos de la mitad de los casos, mientras que en la mayor parte habría que buscar otra causa, puesto que nunca habían sido tratados con ellos. Entre los efectos secundarios de la ciclosporina se incluye la nefrotoxicidad, la hipertensión arterial y la hiperuricemia. Aproximadamente el 50 % de los que toman ciclosporina presentan hiperuricemia y un 10 % desarrolla gota3. En los enfermos con hipertensión arterial esencial, la hiperuricemia se asoció con descenso del flujo plasmático renal y alteraciones en el manejo tubular de ácido úrico, similar a lo observado en los pacientes con trasplante renal, lo que se ha atribuido a la 74 Hiperuricemia en pacientes trasplantados renales afectación de los vasos renales. Podría ocurrir que el desarrollo de la hiperuricemia fuese debido a los efectos hemodinámicos renales mediados por la ciclosporina que determinaría un descenso del FG y una disminución de la excreción del ácido úrico que se asocia con una tendencia a retener agua y sodio. El papel del ácido úrico en la patogenia de la hipertensión en la población trasplantada ha sido pobremente estudiado. Estudios preliminares apuntan a que esta asociación es independiente de la función renal del injerto. En el estudio de Amstrong et al., se encuentran dos interesantes asociaciones: la primera, los sujetos con historia previa de hipertensión estaban asociados a niveles más elevados de ácido úrico, y la segunda, aquellos pacientes con niveles de úrico más elevados precisaban un número mayor de fármacos hipotensores23. Existe poca información sobre la influencia de otros inmunosupresores en el desarrollo de la hiperuricemia y está basada en casos clínicos o en pequeñas series de pacientes. Esteroides Los efectos metabólicos de los esteroides incluyen hiperlipidemia, retención de sal y de agua, pero no efectos sobre el metabolismo del ácido úrico. Sin embargo, este grupo de fármacos puede incrementar el apetito y agravar desórdenes metabólicos previos24. Azatioprina No son reconocidos efectos de la azatioprina sobre el ácido úrico. Sí que debemos conocer la interacción entre el alopurinol y la azatioprina, que incrementa su toxicidad medular y provoca una intensa leucopenia24. Tampoco se recomienda la administración concomitante de febuxostat con azatioprina25. Micofenolato mofetil y ácido micofenólico No son conocidos los efectos de este grupo de fármacos sobre el ácido úrico24. No es necesario ajustar estos fármacos cuando se administran conjuntamente con el alopurinol. Tacrolimus El tacrolimus es un inhibidor de la calcineurina y tiene unas propiedades y unos efectos secundarios simi- lares a los de la ciclosporina, que incluyen nefrotoxicidad e hipertensión. Puede causar hiperuricemia, pero no se han comunicado casos de gota en pacientes tratados con tacrolimus26. Algunos estudios han mostrado un efecto beneficioso del tacrolimus en la hiperuricemia y en la gota en comparación con la ciclosporina27. Sirolimus y everolimus Estudios preclínicos y clínicos con sirolimus no demuestran efectos adversos sobre la función renal; sin embargo, los efectos secundarios más frecuentes son la hiperlipidemia y los efectos mielotóxicos. La incidencia de hiperuricemia en pacientes tratados con sirolimus es incierta, porque la mayor parte de los regímenes inmunosupresores están basados en la combinación con ciclosporina. Sin embargo, estudios que comparan terapias inmunosupresoras con ciclosporina frente a terapias libres de inhibidores de la calcineurina (sirolimus o everolimus en combinación con azatioprina y esteroides) muestran niveles de ácido úrico y de creatinina sérica inferiores en el grupo de pacientes tratados con sirolimus frente al grupo de pacientes tratados con ciclosporina, lo que sugiere que el sirolimus tiene un efecto menor sobre el metabolismo del ácido úrico28. Efecto de la hiperuricemia en la evolución postrasplante La hipertensión, la diabetes y, más tardíamente, la hiperlipidemia son consideradas factores de riesgo para la supervivencia del injerto. Sin embargo, la mayoría de los estudios se refieren a la hiperuricemia como una complicación de la pérdida de la función del injerto o un efecto adverso de la ciclosporina, y no como un factor de riesgo. El impacto de la hiperuricemia sobre la evolución del postrasplante no ha sido claramente establecido29. Existe un número escaso de estudios que han evaluado el efecto de la hiperuricemia sobre la supervivencia del injerto y los resultados han sido poco concluyentes30,31. Es difícil establecer una conexión clara entre la hiperuricemia y el deterioro de la función renal. La hiperuricemia puede ser consecuencia del progresivo deterioro de la función renal en el trasplante renal o ser la que contribuya a las lesiones histológicas del injerto renal (hipertrofia glomerular o lesiones túbulo-intersticiales)10,32. 75 Hiperuricemia y gota Riesgo renal y cardiovascular Supervivencia del injerto Existen pocos estudios que evalúen la influencia de la hiperuricemia sobre la supervivencia del injerto renal y la mayoría son series cortas de pacientes y estudios retrospectivos. En un estudio prospectivo de 90 pacientes prevalentes trasplantados renales, un aumento del ácido úrico en una desviación estándar se asoció con un 22 % de disminución del FG; sin embargo, los niveles de ácido úrico basales no fueron predictivos de la caída del FG en el tiempo33. Gerhardt et al. analizaron la influencia de los niveles de ácido úrico en los trasplantados renales y vieron que presentan una peor supervivencia del injerto renal del 68,8 % a los cinco años, comparados con el 83,3 % de los pacientes normouricémicos31. Los investigadores concluyen que la hiperuricemia contribuye a una peor supervivencia del injerto renal. Este hallazgo puede ser explicado por la suma de dos mecanismos: la vasculopatía asociada al uso de la ciclosporina y el daño interstiticial del ácido úrico, como se presentan en los animales de experimentación34. Hay bastantes similitudes entre las lesiones producidas por la ciclosporina o por el ácido úrico. Ambas causan vasoconstricción, depleción del ácido nítrico e incremento de los niveles de angiotensina II, arteriolopatía preglomerular e hialinosis y enfermedad intersticial24. En un estudio coreano realizado sobre 281 pacientes trasplantados renales, se encontró que en aquellos sujetos que desarrollan hiperuricemia moderada-grave (úrico > 8 mg/dl) en el postrasplante precoz, durante el primer año, es un factor de riesgo para el desarrollo de la nefropatía crónica del injerto, cambios del FG o pérdidas del injerto renal35. Sin embargo, podemos encontrar otros estudios como el Symphony donde se pone de manifiesto que no existe asociación entre los niveles de ácido úrico y la supervivencia del injerto en los tres primeros años del trasplante36. Akgul et al., en un estudio retrospectivo realizado en 133 trasplantados renales, no encontraron diferencias en el desarrollo de nefropatía crónica del injerto durante el seguimiento de los pacientes hiper- o normouricémicos30. Un metaanálisis reciente, a pesar de sus limitaciones, nos describe diferentes estudios que analizan los efectos de la hiperuricemia sobre la función renal del injerto: 1) el FG renal es menor en el grupo de los pacientes hiperuricémicos; 2) la creatinina sérica es mayor en el grupo de los pa76 cientes con hiperuricemia; y 3) la nefropatía crónica del injerto y la pérdida del injerto renal era superior en el grupo de pacientes hiperuricémicos frente a los normouricémicos, lo que implica que la hiperuricemia puede ser considerada como un factor de riesgo independiente para la disfunción del injerto y su correspondiente pérdida37. Supervivencia del paciente En trasplantes renales, los trabajos que han evaluado el aumento de ácido úrico sobre la mortalidad ofrecen resultados diferentes. En 2010, Haririan et al. mostraron que un incremento de 1 mg/dl del ácido úrico aumentaba en un 26 % el riesgo de pérdida del injerto, pero no el riesgo de muerte. Los resultados de este estudio sugieren que los niveles de ácido úrico durante los primeros seis meses postrasplante son un factor de riesgo independiente para la supervivencia del injerto renal a corto y largo plazo38. En otro estudio realizado en trasplantados renales, un ácido úrico por encima de 7,1 mg/dl aumentaba el número de eventos cardiovasculares, aunque en un grupo de pacientes portadores de trasplante renal de donante vivo la hiperuricemia no se asoció con mayor mortalidad39. Gores et al.40, en un estudio prospectivo en 262 trasplantados con función renal normal e inmunosuprimidos con ciclosporina (niveles entre 100-200 ng/ml) o azatioprina y globulina antilinfocítica, no encontraron diferencias con respecto a la supervivencia del injerto o del paciente a pesar de una mayor incidencia (80 %) en el grupo tratado con ciclosporina. Hiperuricemias graves (ácido úrico > 14 mg/dl) se observaban en menos del 10 % de los pacientes. No hubo diferencias con respecto a los valores de creatinina sérica en los pacientes con niveles de ácido úrico entre 8 y 14 mg/dl, lo que sugiere que la hiperuricemia asintomática no debería ser tratada y no tiene un efecto deletéreo sobre la función renal. Crisis gotosa en el paciente trasplantado A pesar de la alta incidencia de la hiperuricemia, la artropatía gotosa es rara pero su frecuencia aumenta con el tiempo de evolución del injerto. Afecta, como a otros enfermos, a las articulaciones metatarsofalángicas, los codos, las rodillas y las muñecas. En cuanto a la gota, hay que señalar que, mientras en la población general solo uno de cada Hiperuricemia en pacientes trasplantados renales 30 sujetos hiperuricémicos la desarrolla, en los pacientes trasplantados lo hace en uno de cada seis hiperuricémicos tratados con ciclosporina. Los episodios de gota son menos frecuentes en los pacientes trasplantados renales (9,6 %) que en los trasplantados hepáticos (13 %) o cardíacos (17 %). Las diferencias entre la gota primaria de la producida por la ciclosporina incluyen el marcado acortamiento del período de la hiperuricemia asintomática y el menor intervalo de períodos libres de crisis, así como la mayor probabilidad de que el paciente trasplantado desarrolle tofos3. La artritis gotosa plantea en el paciente trasplantado una serie de cuestiones prácticas. Como consecuencia del tratamiento esteroideo crónico, la artritis gotosa suele debutar de forma más solapada. Asimismo, la existencia de hiperuricemia previa no es de mucha ayuda en el diagnóstico debido a la elevada prevalencia en el paciente trasplantado. Por otro lado, al tratarse de pacientes inmunosuprimidos, hemos de valorar siempre la posibilidad de que la artritis sea de causa infecciosa. En estos casos, la presentación clínica o la radiología resultan de escasa rentabilidad; por este motivo, en todo paciente trasplantado renal con una artritis aguda ha de intentarse una artrocentesis con o sin lavado articular41. El líquido sinovial obtenido debe ser analizado por personal con experiencia en un microscopio con luz polarizada con compensador rojo de primer orden. Tratamiento de la hiperuricemia (tabla 1) Las medidas preventivas y el tratamiento farmacológico de los pacientes trasplantados con hiperuricemia no están exentos de numerosas complicaciones. En la actualidad, sigue existiendo un debate con respecto al tratamiento de la hiperuricemia asintomática en el paciente trasplantado. Dentro de las diferentes estrategias para el controvertido tratamiento de la hiperuricemia nos encontramos las siguientes medidas: Tratamiento nutricional Uno de los mecanismos para el desarrollo de la hiperuricemia es la ingesta excesiva de alimentos ricos en purinas y de alcohol. El incremento de la hipertensión, la obesidad y la hiperlipidemia también afecta al mundo del trasplante renal. Después del trasplante renal, con la mejoría de la calidad de vida, el uso de esteroides y la recuperación del apetito, el paciente puede incrementar la incidencia de hiperuricemia por el tipo de dieta realizada24. Minimización del uso de la ciclosporina Durante la última década se han propuesto diferentes estrategias para minimizar el efecto de la nefrotoxicidad de la ciclosporina. Estas estrategias Tabla 1. Tratamiento de la hiperuricemia y la gota en el paciente trasplantado Crisis aguda de gota • Colchicina 0,6 mg/12 horas (según tolerancia) durante 2 días y posteriormente 0,6 mg/24 horas durante 10 días • Antiinflamatorios no esteroideos durante 4-5 días (control estricto de la función renal) • Corticoides 20-40 mg/24 horas durante 4-5 días y descenso paulatino a la dosis previa en 1-2 semanas • ACTH 40-80 U intramuscularmente (dosis única) •Experimentación: – Anakinra (antagonista del receptor de la IL-1) – Rinolacept (inhibidor de la IL-1) – Anticuerpo monoclonal (canakimumab) Tratamiento de la hiperuricemia • Medidas generales –Alimentación – Control de la presión arterial (losartán, calcioantagonistas) – Minimización de la ciclosporina • Inhibidores de la xantina oxidasa (alopurinol) – Evitar uso de alopurinol y azatioprina • Agentes uricosúricos (probenecid y sulfinpirazona) • Uricosúricos (benziodarona y benzobromarona) ACTH: hormona adrenocorticotropa; IL: interleucina. 77 Hiperuricemia y gota Riesgo renal y cardiovascular incluyen la retirada de la ciclosporina, la conversión a otros agentes no nefrotóxicos (sirolimus o micofenolato mofetil), el descenso de los niveles y la suspensión definitiva de la ciclosporina24. Control de la presión arterial La alta incidencia de hipertensión arterial en los pacientes trasplantados se asocia frecuentemente con niveles elevados de ácido úrico, por lo que se han realizado pequeños ensayos clínicos que comparan diferentes terapias que tengan efecto sobre la función renal y los niveles de ácido úrico. Los mecanismos pueden ser a través del efecto directo uricosúrico como el losartán o la mejoría del flujo sanguíneo renal y del FG como el amlodipino. Losartán tiene un efecto directo sobre el transporte del ácido úrico en el túbulo proximal, que incrementa la excreción fraccional de ácido úrico y disminuye los niveles de úrico en los pacientes trasplantados42. Este efecto beneficioso es mayor en los pacientes sin tratamiento diurético, pero es independiente de la función renal. Un dato interesante es que esta propiedad uricosúrica es particular del losartán y no de otros antagonistas del receptor de la angiotensina II43. Los calcioantagonistas son fármacos de elección en el tratamiento hipotensor del paciente trasplantado por su propiedad vasodilatadora preglomerular. Chanard et al. compararon el efecto de amlodipino frente a un betabloqueante en pacientes hipertensos y observaron que el amlodipino producía un descenso del ácido úrico después de 60 días de tratamiento sin cambios en la excreción del ácido úrico44. Tratamiento clásico de la hiperuricemia y la gota El tratamiento de la crisis inflamatoria El tratamiento de la crisis inflamatoria articular aguda tiene una serie de peculiaridades. Los antiinflamatorios no esteroideos (AINE) pueden interferir, al igual que la ciclosporina, con la formación renal de las prostanglandinas, y por tanto disminuir el flujo renal. Además, cuando se usan conjuntamente con la ciclosporina tienen un efecto aditivo, por lo que han de evitarse. Sin embargo, el uso de AINE durante pocos días en fases agudas 78 puede darse sin grandes efectos adversos y monitorizando la función renal del trasplantado. La colchicina, en dosis precisas para controlar la inflamación articular (0,6 mg cada 12 horas el primer y segundo día, y posteriormente 0,6 mg cada 24 horas durante 7-10 días), es una buena opción, aunque suele producir diarrea a veces importante, por lo que en ocasiones ello limita su uso en los pacientes trasplantados. En dosis de 0,6 mg/ día puede ser útil en la profilaxis de nuevos episodios. Sin embargo, no es excepcional que la colchicina induzca en pacientes que toman ciclosporina una miopatía tóxica, que siempre ha de tenerse en cuenta45. Esta miopatía suele ser indolora, aunque no siempre, cursar con aumento de enzimas musculares y mejorar de forma paulatina al suspender el fármaco. El uso de la colchicina puede ser problemático en pacientes en tratamiento con azatioprina que tengan un recuento leucocitario disminuido. Otro tratamiento habitual de las crisis inflamatorias es el uso de corticosteroides, que podrían ser menos eficaces, dado que la mayor parte de los pacientes están tomando de forma crónica estos fármacos. No obstante, una aproximación para el tratamiento sintomático puede ser un incremento transitorio hasta 40 mg/día (20-30 mg/día) durante 4-5 días y después un descenso paulatino a la dosis previa en 1-2 semanas. Sin embargo, debemos extremar la precaución en el descenso progresivo del corticoide por el riesgo de rebote de la crisis gotosa. Una alternativa segura y eficaz en casos recalcitrantes o con contraindicaciones para otras medidas, que tengan afectación monoarticular y sin datos de sospecha de infección, es la aspiración con inyección intraarticular de 10-40 mg de triamcinolona. El manejo de la hiperuricemia Inhibidores de la xantina oxidasa (alopurinol)46. Aunque en el estudio de Gerhardt los pacientes con hiperuricemia tratados con alopurinol no mostraban un efecto beneficioso sobre la supervivencia del paciente o del injerto31, estos fármacos son efectivos en el tratamiento de la hiperuricemia del paciente trasplantado, pero si este está en tratamiento con azatioprina puede producir leucopenia grave, lo que favorece la aparición de infecciones que ponen en riesgo la vida del paciente47. Esta situación se produce como consecuencia del acúmulo de la 6-mercaptopurina (metabolito activo de la azatioprina), no Hiperuricemia en pacientes trasplantados renales transformado al ácido 6-tioúrico, que precisa como catalizador la xantina oxidasa y que tiene un efecto mielosupresor muy potente cuando se administra con inhibidores de la xantina oxidasa. Entre las alternativas propuestas para el uso de los inhibidores de la xantina oxidasa en casos agudos, se recomienda la reducción de la dosis del 50 % de la azatioprina, monitorizar estrechamente el recuento leucocitario o sustituir la azatioprina por micofenolato mofetil cuando sea precisa la administración de alopurinol. El alopurinol puede ser utilizado en el mantenimiento de la hiperuricemia en pacientes gotosos que no reciben azatioprina y con una función renal aceptable. Se recomienda iniciar dosis de 50 mg/día, con incrementos de 50 mg cada 3-4 semanas según la función renal del injerto. El uso de febuxostat no está recomendado en pacientes trasplantados por falta de experiencia. Agentes uricosúricos (probenecid y sulfinpirazona) pueden ser usados en pacientes trasplantados con función renal normal y sin historia de litiasis renal. Debido a que la sulfinpirazona interfiere con los niveles de ciclosporina, debe ser monitorizado desde su empleo. Otra alternativa son los uricosúricos (benziodarona, benzobromarona). No se han encontrado efectos secundarios con ninguna de estas drogas, por lo que pensamos que la administración de uricosúricos es la terapia de elección de la hiperuricemia inducida por los anticalcineurínicos48. Pérez-Ruiz et al. analizaron el efecto del tratamiento con alopurinol o benzobromarona en una cohorte de pacientes trasplantados renales. Los pacientes seleccionados tenían una función renal estable (aclaramiento de creatinina > 20 ml/min) y hiperuricemia al menos durante los últimos 12 meses, y los investigadores compararon la eficacia de estos dos regímenes de tratamiento. Ambas drogas se mostraron eficaces y seguras en el manejo de la hiperuricemia; sin embargo, se observaron unos niveles inferiores y un mejor control con la benzobromarona. No hubo diferencias con respecto a la función renal, pero la incidencia de gota fue menor que en otras series49. La duración del tratamiento sería durante toda la vida por el riesgo de recurrencia de las crisis de gota y de formación de tofos. Fármacos en investigación: la IL-1 es una de las más potentes citocinas proinflamatorias resultado de los mecanismos inmunológicos, activada por la interacción de los cristales de urato y los leucocitos50. Por este motivo, puede desempeñar un papel primordial en los síntomas del ataque agudo de gota. Un estudio con un antagonista del receptor de la IL-1 (anakinra) en pacientes con gota no trasplantados renales encontró resultados muy favorables (reducción del dolor) y gran rapidez (24-48 horas)51. En otros estudios, el efecto de un inhibidor de la IL-1 (rinolacept) era superior a placebo en un estudio realizado en pacientes gotosos no trasplantados52 o el anticuerpo monoclonal (canakimumab) era superior a la inyección de triancinolona intramuscular53. Conceptos clave • La hiperuricemia es una complicación frecuente en el paciente trasplantado inmunosuprimido con ciclosporina. • La causa de la hiperuricemia en el paciente trasplantado es multifactorial: el descenso del filtrado glomerular, el manejo tubular del úrico, la historia previa de hiperuricemia, la obesidad y el uso de diuréticos son los factores más importantes. • La ciclosporina puede causar hiperuricemia por dos mecanismos: por un incremento en la reabsorción proximal de ácido úrico y por el descenso del filtrado glomerular secundario a la vasoconstricción de la arteriola aferente. • El impacto de la hiperuricemia sobre la supervivencia del injerto y del paciente no ha sido claramente establecido. • El losartán tiene un efecto directo sobre el transporte del ácido úrico en el túbulo proximal y disminuye los niveles de ácido úrico. • En la actualidad sigue existiendo un debate con respecto al tratamiento de la hiperuricemia asintomática en el paciente trasplantado. • El tratamiento de la artritis gotosa es complicado en el paciente trasplantado por las posibles inter­ acciones de los diferentes fármacos empleados (colchicina, antiinflamatorios no esteroideos, alopurinol) con los inmunosupresores utilizados (ciclosporina, azatioprina, diuréticos). • Los inhibidores de la xantina oxidasa (alopurinol y febuxostat) deben utilizarse con especial cuidado en pacientes que estén recibiendo tratamiento inmunosupresor con azatioprina por el riesgo de desarrollar leucopenia. • En trasplantes renales con función renal normal pueden emplearse agentes uricosúricos (benziodiarona o benzobromarona). 79 Hiperuricemia y gota Riesgo renal y cardiovascular referencias Bibliográficas 1. Lin HY, Rocher LL, McQuillan MA, Schmaltz S, Palella TD, Fox IH. Cyclosporine induced hyperuricemia and gout. N Engl J Med 1989;321: 287-92. 2. Perico N, Codreanu I, Caruso M, Remuzzi G. Hyperuricemia in kidney transplantation. Contrib Nephrol 2005;147:124-31. 3. Clive DM. Renal transplant–associated hyperuricemia and gout. J Am Soc Nephrol 2000;11:974-9. 4. Abbott KC, Kimmel PL, Dharnidharka V, Oglesby RJ, Agodoa LY, Caillard S. New-onset gout after kidney transplantation: incidence, risk factors and implications. Transplantation 2005;80:1383-91. 5. Noordzij TC, Leunissen KM, Van Hooff JP. Renal handling of urate and the incidence of gouty arthritis during cyclosporine and diuretic use. Transplantation 1991;52:64-7. 6. Gersch C, Palii SP, Kim KM, Angerhofer A, Johnson RJ, Henderson GN. Inactivation of nitric oxide by uric acid. Nucleosides Nucleotides Nucleic Acids 2008;27:967-78. 7. Kang DH, Han L, Ouyang X, Kahn AM, Kanellis J, Li P, et al. Uric acid causes vascular smooth muscle cell proliferation by entering cells via a functional urate transporter. Am J Nephrol 2005;25:425-33. 8. Feig DI, Kang DH, Nakagawa T, Mazzali M, Johnson RJ. Uric acid and hypertension. Curr Hypertens Rep 2006;8:111-5. 9. Kang DH, Park SK, Lee IK, Johnson RJ. Uric acid-induced C-reactive protein expression: Implication on cell proliferation and nitric oxide production of human vascular cells. J Am Soc Nephrol 2005;16:3553-62. 10.Mazzali M, Kanellis J, Han L, Feng L, Xia YY, Chen Q, et al. Hyperuricemia induces a primary renal arteriolopathy in rats by a blood pressureindependent mechanism. Am J Physiol Renal Physiol 2002;282:F991-7. 11.Santos RD, Nasir K, Orakzai R, Meneghelo RS, Carvalho JA, Blumenthal RS. Relation of uric acid levels to presence of coronary artery calcium detected by electron beam tomography in men free of symptomatic myocardial ischemia with versus without the metabolic syndrome. Am J Cardiol 2007;99:42-5. 12.Fang J, Alderman MH. Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study, 1971-1992. National Health and Nutrition Examination Survey. JAMA 2000;283:2404-10. 80 13.Iseki K, Ikemiya Y, Inoue T, Iseki C, Kinjo K, Takishita S. Significance of hyperuricemia as a risk factor for developing ESRD in a screened cohort. Am J Kidney Dis 2004;44:642-50. 14.Feig DI, Soletsky B, Johnson RJ. Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: A randomized trial. JAMA 2008;300:924-32. 15.Sánchez-Lozada LG, Tapia E, Santamaría J, Avila-Casado C, Soto V, Nepomuceno T, et al. Mild hiperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats. Kidney Int 2005;67:237-47. 16.Mazzali M, Kim YG, Suga S, Gordon KL, Kang DH, Jefferson JA, et al. Hyperuricemia exacerbates chronic cyclosporine nephropathy. Transplantation 2001;71:900-5. 17.Kalantar E, Khalili N, Hossienis MS, Rostami Z, Einollahi B. Hyperuricemia after renal transplantation. Transplantation Proc 2011;43: 584-5. 18.Better OS. Tubular dysfunction following kidney transplantation. Nephron 1980;25:209-13. 19.Hansen JM, Fogh-Andersen N, Leyssac PP, Strandgaard S. Glomerular and tubular function in renal transplant patients treated with and without cyclosporin A. Nephron 1998;80:450-7. 20.Marcén R, Gallego N, Orofino L, Gámez C, Estepa MR, Sabater J, et al. Impairment of tubular secretion of urate in renal transplant patients on cyclosporine. Nephron 1995;70:307-13. 21.Zürcher RM, Bock HA, Thiel G. Hyperuricemia in cyclosporin-treated patients: a GFR-related effect. Nephrol Dial Transplant 1996;11:153-8. 22.Cohen SL, Boner G, Rosenfield JB, Schmueli D, Sperling O, Yusim A, et al. The mechanism of hiperuricemia in cyclosporin-treated renal transplant patients. Transplant Proc 1987;19: 1829-30. 23.Armstrong KA, Johnson DW, Campbell SB, Isbel NM, Hawley CM. Does uric acid have a pathogenetic role in graft dysfunction and hypertension in renal transplant recipients? Transplantation 2005;80:1565-71. 24.Mazzali M. Uric acid and transplantation. Semin Nephrol 2005;25:50-5. 25.Becker MA. Hyperuricemia and gout in renal transplant recipients. UpToDate [homepage on the Internet]. 2009. Disponible en: http://www. uptodate.com/contents/hyperuricemiaandgout-in-renal-transplant-recipients. Hiperuricemia en pacientes trasplantados renales 26.Pilmore HL, Faire B, Dittmer I. Tacrolimus for treatment of gout in renal transplantation. Transplantation 2001;72:1703-5. 27.Kanbay M, Akcay A, Huddam B, Usluogullari CA, Arat Z, Ozdemir FN, et al. Influence of cyclosporine and tacrolimus on serum uric acid levels in stable kidney transplant recipients. Transplant Proc 2005;37:3119-20. 28.Budde K, Becker T, Arns W, Sommerer C, Reinke P, Eisenberger U, et al. Everolimusbased, calcineurin-inhibitor-free regimen in recipients of de-novo kidney transplants: an open-label, randomised, controlled trial. Lancet 2011;377:837-47. 29.Dimeny EM. Cardiovascular disease after renal transplantation. Kidney Int Suppl 2002;80:S78-84. 30.Akgul A, Bilgic A, Ibis A, Ozdemir FN, Arat Z, Haberal M. Is uric acid a predictive factor for graft dysfunction in renal transplant recipients? Transplant Proc 2007;39:1023-6. 31.Gerhardt U, Grosse Huttmann M, Hohage H. Influence of hyperglycemia and hyperuricemia on long-term transplant survival in kidney transplant recipients. Clin Transplant 1999;13:375-9. 32.Nakagawa T, Mazzali M, Kang DH, Kanellis J, Watanabe S, Sanchez-Lozada LG, et al. Hyperuricemia causes glomerular hypertrophy in the rat. Am J Nephrol 2003;23:2-7. 33.Goicoechea M, García de Vinuesa S, Arroyo D, Luño J. Hiperuricemia, gota y enfermedad renal crónica. Nefrología Sup Ext 2012;3(2):8-15. 34.Mazzali M, Kim YG, Suga S, Gordon KL, Kang DH, Jefferson JA. Hyperuricemia exacerbates chronic cyclosporine nephropathy. Transplantation 2001;71:900-5. 35.Min SI, Yun IJ, Kang JM, Park YJ, Min SK, Ahn C, et al. Moderate-to-severe early-onset hiperuricemia: a prognostic marker of long term kidney transplant outcome. Nephrol Dial Transplant 2009;24:2584-90. 36.Meier-Kriesche HU, Schold JD, Vanrenterghem Y, Halloran PF, Ekberg H. Uric acid levels have no significant effect on renal function in adult renal transplant recipients: evidence from the Symphony study. Clin J Am Soc Nephrol 2009;4:1655-60. 37.Huang Y, Li YL, Huang H, Wang L, Yuan WM, Li J. Effects of hyperuricemia on renal function of renal transplant recipients: a systematic review and meta-analysis of cohort studies. PLoS One 2012;7(6):e39457. 38.Haririan A, Noguiera JM, Zandi-Nejad K, Aiyer R, Hurley H, Cooper M, et al. The independent association between serum uric acid and graft outcomes after kidney transplantation. Transplantation 2010;89:573-9. 39.Akalin E, Ganeshan SV, Winston J, Muntner P. Hyperuricemia is associated with the development of the composite outcomes of new cardiovascular events and chronic allograft nephropathy. Transplantation 2008;86:652-8. 40.Gores PF, Fryd DS, Sutherland DE, Najarian JS, Simmons RL. Hyperuricemia after renal transplantation. Am J Surg 1988;156:397-400. 41.Sinnot JT, Holt DA. Cryptococcal pyarthrosis complicatin gouty artritis. South Med J 1989;82:1555-6. 42.Kamper AL, Nielsen AH. Uricosuric effect of losartan in patients with renal transplants. Transplantation 2001;72:671-4. 43.Enomoto A, Kimura H, Chairoungdua A, Shigeta Y, Jutabha P, Cha SH, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels. Nature 2002;417:447-52. 44.Chanard J, Toupance O, Lavaud S, Hurault de Ligny B, Bernaud C, Moulin B. Amlodipine reduces cyclosporine induced hyperuricemia in hypertensive renal transplant recipients. Nephrol Dial Transplant 2003;18:2147-53. 45.Simkin PA, Gardner GC. Colchicine use in cyclosporine treated transplant recipients: how little is too much? J Rheumatol 2000;27: 1334-7. 46.Becker MA, Schumacher HR Jr, Wortmann RL, MacDonald PA, Eustace D, Palo WA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005;353:2450-61. 47.Ragab AH, Gilkerson E, Myers M. The effect of 6-mercaptopurine and allopurinol on granulopoiesis. Cancer Res 1974;34:2246-9. 48.Zürcher RM, Bock HA, Thiel G. Excellent uricosuric efficacy of benzbromarone in cyclosporin-Atreated renal transplant patients: a prospective study. Nephrol Dial Transplant 1994;9:548-51. 49.Perez-Ruiz F, Gómez-Ullate P, Amenábar JJ, Zarraga S, Calabozo M, Herrero-Beites AM, et al. Long term efficacy of hyperuricemia treatment in renal transplant patients. Nephrol Dial Transplant 2003;18:603-6. 50.Pérez-Ruiz F, Calabozo M, Fernández-López MJ, Herrero-Beites A, Ruiz-Lucea E, GarcíaErauskin G, et al. Treatment of chronic gout in patients with renal function impairment: an open, randomized, actively controlled study. J Clin Rheumatol 1999;5:49-55. 81 Hiperuricemia y gota Riesgo renal y cardiovascular 51.So A, De Smedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther 2007;9:R28. 52.Terkeltaub R, Sundy JS, Schumacher HR, Murphy F, Bookbinder S, Biedermann S, et al. The interleukin 1 inhibitor rilonacept in treatment of chronic gouty arthritis: results of a placebocontrolled, monosequence crossover, non- 82 randomised, single-blind pilot study. Ann Rheum Dis 2009;68:1613-7. 53.So A, De Meulemeester M, Pikhlak A, Yücel AE, Richard D, Murphy V, et al. Canakinumab for the treatment of acute flares in difficult-totreat gouty arthritis: Results of a multicenter, phase II, dose-ranging study. Arthritis Rheum 2010;62:3064-76. Manejo de la hiperuricemia y la gota en el paciente con enfermedad renal crónica Pedro Aranda Lara Unidad de Hipertensión y Riesgo Vascular. Servicio de Nefrología. Hospital Regional Universitario Carlos Haya. Málaga Introducción Patogénica y clínicamente la hiperuricemia, además de la gota, se asocia con la hipertensión arterial (HTA) y la enfermedad cardiovascular y renal 1. Hace ya más de un siglo que empezaron a establecerse relaciones entre la patología renal, el ácido úrico (AU) y la gota 2, lo cual está ampliamente justificado por el papel relevante que el riñón desempeña en el ciclo metabólico del AU. Mientras la mayor parte del AU procede de su síntesis endógena en el hígado, el músculo y el intestino y en menor medida de la ingesta dietética (~ 20 %), siendo catabolizado por la enzima xantina oxidasa (XO), su eliminación es dual por las heces (1/3) y sobre todo por la vía renal (2/3) mediante un mecanismo múltiple y complejo que supone: filtración glomerular, reabsorción tubular proximal, secreción tubular y, por último, reabsorción tubular postsecretora, de modo que se elimina alrededor del 10 % del AU filtrado. Todos estos mecanismos son influenciables por un gran número de factores, tales como: cambios en el pH o en el volumen urinario, volumen de líquido extracelular, factores hormonales o deterioro de la función renal, los cuales van a facilitar la existencia de hiperuricemia, definida como valores de AU superiores a 7 mg/dl 3,4. Relevancia clínica de la hiperuricemia como agente contribuyente a la patología renal El hecho de ser el riñón la vía fundamental de la excreción del AU facilita que la hiperuricemia, además de ser el determinante de la manifestación clínica de la artritis gotosa aguda (y con mucha menor frecuencia tras la aparición del tratamiento hipouricemiante de la gota tofácea), también contribuya etiopatogénica y fisiopatológicamente al desarrollo y aparición de varios cuadros patológicos renales: litiasis renal úrica y nefropatía aguda y crónica por AU5,6. Someramente hay que comentar que, en general, la litiasis úrica supone entre 5-10 % de las formas de litiasis renal, que aparece tanto en el contexto de la hiperuricemia como de la hiperuricosuria aislada y que es, de manera especial, favorecida por la coexistencia con infección urinaria, la contracción de volumen plasmático o el pH urinario ácido 7. La nefropatía aguda por AU es una forma de fracaso renal agudo obstructivo, consecuencia casi en su totalidad de la precipitación intratubular de grandes cantidades filtradas de AU, con el consiguiente efecto tóxico y obstructivo, en el contexto de cuadros clínicos que cursan con marcada lisis celular y liberación de ácidos nucleicos y su transformación en AU7. Más raramente el fracaso renal agudo obstructi83 Hiperuricemia y gota Riesgo renal y cardiovascular vo es consecuencia de litiasis ureteral, promovida por la movilización de cálculos de AU, en pacientes monorrenos o con riñón único funcionante y cuyo tratamiento es la extracción quirúrgica del cálculo. La disfunción renal crónica puede aparecer en pacientes con gota articular crónica y se caracteriza por hallazgos anatomopatológicos que incluyen la presencia de cristales de urato monosódico (UMS) en el intersticio renal junto a lesiones de glomerulosclerosis y fibrosis túbulo-intersticial (la conocida como nefropatía crónica por AU)7,8. Este cuadro es cronopatológica y, en parte, fisiopatológicamente diferente al que presentan pacientes con insuficiencia renal crónica (IRC) e hiperuricemia y que pueden o no desarrollar secundariamente episodios de gota articular. Asimismo, aunque faltan estudios más amplios que permitan elucidar el papel del AU en el desarrollo y la progresión del daño renal crónico en los pacientes con hiperuricemia asintomática, no obstante, existen numerosas evidencias epidemiológicas, experimentales y terapéuticas que sustentan esta relación. Así, son múltiples los estudios epidemiológicos9-12 y experimentales13-18 que establecen nexos fisiopatológicos entre la uricemia, la HTA y el daño renal parenquimatoso, como asimismo estudios de intervención que relacionan el uso de agentes hipouricemiantes con el enlentecimiento en la progresión de la enfermedad renal crónica (ERC)19-22. El análisis de estos resultados inclina a recomendar el tratamiento de la hiperuricemia asintomática, sobre todo con niveles de AU por encima de 8 mg/ dl, en pacientes con ERC (grado de evidencia Ib, grado de recomendación B)5,6. Consideraciones sobre medidas generales para el control de la uricemia en el paciente con enfermedad renal crónica Antes de entrar en el manejo terapéutico con fármacos hipouricemiantes en el paciente con ERC y sus diversas manifestaciones clínicas, incidiremos en la importancia de las medidas higiénicodietéticas comunes a todos los estados hiperuricé­ micos, así como en aspectos particulares relacionados con el tratamiento en cada cuadro clínico (artritis gotosa, litiasis úrica y nefropatía aguda/ crónica por AU). 84 Manejo terapéutico de la artritis gotosa aguda en el paciente con enfermedad renal crónica La presencia de ERC, sobre todo a partir de un estadio 3, es uno de los factores involucrados en el aumento de la prevalencia de artritis aguda gotosa en estos pacientes (entre 5-14 % en pacientes con estadio 3-4, cuyos mecanismos no están bien definidos, y con tendencia a disminuir muy significativamente con la entrada en diálisis. De más rara observación en la actualidad en estos pacientes es la gota tofácea)23. En la aparición de las crisis intervienen tanto un aumento en la ingesta dietética o en la síntesis endógena de purinas como una disminución en la excreción urinaria de UMS o un aumento de su reabsorción tubular, por lo que la caída en el filtrado glomerular (FG) es un factor claramente favorecedor de hiperuricemia en la ERC. La determinación del aclaramiento de AU parece fiable para determinar si la causa de la hiperuricemia es un déficit de filtración glomerular (aclaramiento de AU bajo y excreción fraccionada alta) o si además el paciente sufre una disfunción tubular per se o inducida por fármacos (diuréticos y ciclosporina, los más usuales)3. El objetivo fundamental del tratamiento es disolver los cristales articulares de UMS o prevenir su formación, para lo cual es primordial «normalizar» la uricemia manteniéndola por debajo del punto de saturación (< 6 mg/dl) para el UMS3,4. Al mismo tiempo, se debe actuar terapéuticamente para el alivio rápido del dolor y la inflamación en la fase aguda, y cuando es necesario para la eliminación de los tofos. En cualquier circunstancia, siempre se debe considerar el estadio de la ERC para ajustar la dosis de los fármacos al grado de función residual, así como evitar aquellos que por su nefrotoxicidad lo requieran3,4. El reposo de la articulación y la administración de frío son, junto con el uso de antiinflamatorios y colchicina, medidas de aplicación inmediata. En casos adecuados, la aspiración de líquido articular ayuda a hacer remitir la sintomatología álgida. El control del exceso ponderal y las medidas dietéticas (ingesta abundante de agua, supresión del consumo de bebidas alcohólicas, incluida la cerveza, o edulcoradas con fructosa, así como una reducción del consumo proteico y de alimentos ricos en purinas), aunque no reducen la uricemia más del 20 %, son muy recomendables en la fase aguda y como profilaxis crónica3,4,24. Manejo de la hiperuricemia y la gota en el paciente con enfermedad renal crónica Otro aspecto terapéutico de gran importancia en el manejo general de la hiperuricemia, de especial relevancia en el paciente con ERC, es interrumpir (o reajustar la dosis) aquellos tratamientos hiperuricemiantes tomados por el paciente e igualmente corregir las situaciones clínicas (tales como ayuno, traumatismos, descontrol lipídico y estados hiper­ insulinémicos) que tienden a aumentar los niveles de AU. Durante las crisis son esenciales, con las debidas precauciones y ajustes de dosis, tanto la colchicina como los antiinflamatorios no esteroideos (AINE). La administración de colchicina debe reducirse a la mitad de la dosis habitual en caso de ERC estadio 3-4, y se ha de pautar 0,5 mg cada 8 horas al inicio, con reducción a 0,5 mg cada 24 horas a los 4-5 días. Debe evitarse su uso en pacientes con IRC muy avanzada o diálisis (no es dializable)3,4,25,26,27. Las mismas precauciones deben tomarse con pacientes trasplantados renales si presentan algún grado de disfunción renal o están tratados con ciclosporina o azatioprina, ya que ambas reducen el aclaramiento de colchicina25,26. Por las mismas razones no es aconsejable la profilaxis de la gota con colchicina. Solo en pacientes con FG entre 60-45 ml/min podrían emplearse dosis reducidas (0,25-0,50 mg/día) y por períodos lo más cortos posibles26. Aunque los AINE son altamente eficaces en estos pacientes, no podemos olvidar sus efectos negativos sobre la función renal, el descontrol de la HTA e incluso la posibilidad de provocar fracaso renal agudo, así como sus efectos adversos gastrointestinales26,27. En caso de ser prescritos, debe reducirse la dosis diaria y el tiempo de empleo al mínimo exigido para reducir la sintomatología del paciente25-27. La posibilidad de uso en estos pacientes de inhibidores selectivos de la ciclooxigenasa 2 podría ser una alternativa, si no hay otras contraindicaciones, ya que, en dosis bajas, parecen afectar con menos intensidad la función renal, al tiempo que presentan menor incidencia de sangrado digestivo y menor número de interferencias medicamentosas28. Una opción a las anteriores serían los corticosteroides, ya sean en inyección intraarticular o por vía oral o parenteral3,4,26. En cualquier caso, es evidente que el uso de estos agentes debe individualizarse y que ha de dominar la regla: «la dosis más baja, el tratamiento más corto». Una opción prometedora para el tratamiento de los pacientes con ERC y gota refractaria o contraindicación para el uso de colchicina, AINE y esteroides por su potente acción antiinflamatoria sería el uso de inhibidores de la interleucina 1 (IL-1), como anakinra (antagonista recombinante del receptor IL-1), rilonacet (inhibidor de IL-1 alfa y beta) o canakinumab (anticuerpo monoclonal humano anti-IL-1 beta)29. No obstante, en el momento presente, su elevado coste y la escasa evidencia disponible limitan en extremo su uso en estos pacientes. Consideraciones sobre el manejo de la litiasis renal hiperuricosúrica en el paciente con enfermedad renal crónica Además del uso de inhibidores de la XO, en dosis crecientes y ajustadas individualmente según el estadio de la ERC y el tipo de fármaco, en esta situación son de aplicación las medidas higiénico-dietéticas reseñadas en el apartado anterior, con especial hincapié en tres aspectos importantes: 1) mantener una diuresis elevada mediante una ingesta líquida abundante; 2) alcalinizar la orina; y 3) evitar agentes farmacológicos uricosúricos, como benzobromarona. Igualmente, dado que existen otras alternativas terapéuticas, fármacos con actividad uricosúrica, como losartán o fenofibrato3,30,31. Manejo terapéutico de la nefropatía aguda por ácido úrico en el paciente con enfermedad renal crónica Aparte de las consideraciones propias de la situación de ERC en cuanto al uso de hipouricemiantes y medidas de protección funcional renal, el manejo de las situaciones clínicas que cursan con una excesiva producción de AU y dan lugar a un cuadro de fracaso renal agudo, así como las medidas profilácticas en pacientes proclives a su desarrollo, serán tratados amplia y específicamente en otro capítulo. Consideraciones sobre la actuación terapéutica en el paciente con enfermedad renal crónica y nefropatía crónica por ácido úrico Como previamente comentamos, en la práctica clínica podemos encontrar dos formas de nefropatía crónica por AU. De una parte, el paciente con artritis gotosa crónica (tofácea o no) que desarrolla IRC; y, de otra parte, el paciente con IRC de distinta etiología y grado de gravedad (estadios 3-4 de ERC) y niveles elevados de AU, en los cuales existe un importante cuerpo de evidencia para considerar que la hiperuricemia pudiera contribuir a la progresión del 85 Hiperuricemia y gota Riesgo renal y cardiovascular daño renal. En ambas situaciones, el objetivo terapéutico fundamental sería reducir la uricemia en orden a conseguir una estabilización o enlentecimiento en la progresión hacia la IRC terminal. De forma general, todos estos pacientes serían tributarios de la aplicación de las medidas higiénicodietéticas dirigidas, de un lado, a reducir la uricemia y señaladas en el apartado Manejo terapéutico de la artritis gotosa aguda en el paciente con enfermedad renal crónica; y, de otro, de aquellas usualmente prescritas para retrasar la progresión del daño renal. Asimismo, deben evitarse o en todo caso reducirse los fármacos con efecto hiperuricemiante, sobre todo los diuréticos de asa, y controlar aquellas comorbilidades (obesidad, diabetes, HTA, insuficiencia cardíaca, etc.) que favorecen el aumento de los niveles de AU. Empleo de hipouricemiantes en el paciente con enfermedad renal crónica En estos pacientes, la finalidad del uso de agentes hipouricemiantes es, además de prevenir posibles episodios de gota y el riesgo de litiasis úrica, reducir la contribución de la hiperuricemia a la progresión del daño renal y, de acuerdo con muchas evidencias1,3,4,32, del daño cardiovascular. Aunque aún son necesarios más estudios para dilucidar de forma definitiva el papel del AU en el desarrollo y progresión de la ERC, no obstante, en la mayoría de estos pacientes el tratamiento de la hiperuricemia debería ser crónico tanto en presencia de gota como en aquellos sujetos con ERC en los que, luego de corregir tratamientos o situaciones clínicas favorecedoras, mantuvieran valores de AU superiores a 8 mg/dl (grado de evidencia 1b, grado de recomendación B)5,6. Por otro lado, su aplicación debe ser individualizada en la selección de los fármacos hipouricemiantes, en el ajuste de su dosis y en su inicio progresivo, a fin de evitar movilizaciones importantes de AU que pudieran precipitar una crisis gotosa4,5. Ante un episodio de gota en estos pacientes, los hipouricemiantes deben mantenerse en el caso de estar ya en tratamiento o, por el contrario, de nueva instauración iniciarse progresivamente dos o tres semanas después del episodio agudo. En la tabla 1 se listan los agentes hipouricemiantes y su dosificación en presencia de ERC. 86 Tabla 1. Hipouricemiantes: dosificación en presencia de enfermedad renal crónica •Hiperuricosúricos: –Benzobromarona: - Dosis media 100 mg/día (rango 50-200 mg/día, según FG) - Uso limitado a pacientes no respondedores o intolerantes a inhibidores XO • Inhibidores XO: – Alopurinol: ajuste progresivo según FG (ml/min): < 60: 200 mg/día; < 30: 100 mg/día. ERC estadio 4-5: 100 mg cada 48-72 horas – Febuxostat: 80 mg/día hasta FG 30 ml/min. - Posibilidad, con control, de aumentar a 120 mg/día. Oficialmente no recomendado con FG < 30 ml/min, diálisis o trasplante - Con ambos agentes: inicio gradual y profilaxis con dosis bajas de colchicina (0,5 mg/día) • Ureasa recombinante: – Pegloticasa: dosis promedio 8 mg intravenosos cada 2-4 semanas. No requiere ajuste de dosis. - Exige monitorización de la infusión intravenosa por sus graves y frecuentes efectos secundarios ERC: enfermedad renal crónica; FG: filtrado glomerular; XO: xantina oxidasa. Empleo de hiperuricosúricos en el paciente con enfermedad renal crónica Los fármacos que inhiben la reabsorción tubular proximal de AU incrementando su excreción renal son probenecid, sulfinpirazona y benzobromarona, de los cuales solo el último está aceptado para su uso clínico en España. La eficacia de la benzobromarona, aunque puede utilizarse en pacientes con IRC ligera-moderada, está muy reducida en pacientes con FG < 20 ml/min y su uso está limitado a pacientes en tratamiento concomitante con salicilatos en dosis bajas, no respondedores o intolerantes al tratamiento con alopurinol o febuxostat en gota grave3,4,33,34. Su dosis media en estos casos es de 100 mg/día, con rango entre 50 y 200 mg según el FG. Su administración debe acompañarse de un aporte de 2-3 litros de líquidos y alcalinización de la orina para prevenir el desarrollo de litiasis úrica4,34. La benzobromarona está contraindicada en pacientes con uricuria > 700 mg/día, disfunción hepática, porfiria hepática, uso concomitante con tuberculostáticos, trasplantados en tratamiento con azatioprina o alergia a ella33,34. Manejo de la hiperuricemia y la gota en el paciente con enfermedad renal crónica La Agencia Española del Medicamento (EMEA) suspendió hace años el uso de asociaciones en dosis fijas de benzobromarona y alopurinol por presentar un desfavorable balance riesgobeneficio. Debemos apuntar solo que en pacientes con ERC y comorbilidades asociadas, en los que estén indicados, pueden utilizarse por su acción uricosúrica agentes como losartán, fenofibrato o atorvastatina30,31,35. Hipouricemiantes inhibidores de la xantina oxidasa en el paciente con enfermedad renal crónica Alopurinol En la actualidad es el agente más utilizado en el manejo de la hiperuricemia36, pues la dosis de 300 mg/día consigue niveles de AU < 6 mg/dl en aproximadamente el 40 % de los pacientes con niveles superiores a 8 mg/dl7,36. Aunque es precisa una confirmación clínica más amplia, el uso de alopurinol en el tratamiento de los pacientes con ERC ha demostrado beneficios en cuanto a un mejor control de la presión arterial (PA) y en la progresión del daño renal tanto en pacientes con función renal normal20 como con alteración funcional renal18,19,22, y se han observado efectos contrarios con aumento de la PA y mayor ritmo de progresión de la ERC tras la supresión de alopurinol en pacientes que no recibían bloqueadores del sistema renina-angiotensina-aldosterona37. Incluso algún estudio ha puesto de manifiesto en estos pacientes beneficios en la regresión del daño cardiovascular en cuanto a reducir la masa ventricular izquierda y mejorar la disfunción endotelial y la rigidez de la pared arterial en pacientes con hipertrofia ventricular izquierda y ERC38. Estos estudios experimentales y su eficacia probada en la reducción de los niveles de AU3-6,34 hacen de alopurinol una excelente arma terapéutica en el paciente hiperuricémico con ERC. No obstante, en estos pacientes su administración requiere tener en cuenta sus características farmacocinéticas y farmacodinámicas según distintos grados o estadios de IRC39. Estas características hacen que la dosis usual de 300 mg/día deba ser ajustada al grado de disfunción renal y reducirse progresi- vamente a 200 mg para FG por debajo de 60 ml/ min, 100 mg/día si el FG es menor de 30 ml/min, y en caso de IRC más avanzada, la misma dosis de 100 mg cada 48-72 horas3,4,26,33,34,36. Además del ajuste de dosis, en los pacientes con antecedentes de episodios de artritis gotosa, el inicio del tratamiento debería acompañarse de una buena hidratación y del uso profiláctico de dosis bajas (0,5 mg diarios) de colchicina durante 2-4 semanas4,7,26,34,36. Entre 3-10 % de los pacientes que toman alopurinol suelen presentar efectos secundarios, porcentaje que se incrementa sustancialmente en aquellos con ERC, de manera especial si toman diuréticos4,26,33,34,36 o no se ajusta debidamente la dosis. Estos efectos secundarios requieren, en general, la supresión del tratamiento e incluyen trastornos gastrointestinales, reacciones cutáneas (incluidos síndrome de Stevens-Johnson y de Lyell), hepatitis granulomatosa, nefritis intersticial aguda4,7,26,34,36 o cuadros de depresión medular con agranulocitosis (sobre todo en pacientes que concomitantemente reciben fármacos con posibilidad de ocasionar esta reacción7). Febuxostat Aprobado por la EMEA en 2008, febuxostat es un potente inhibidor selectivo de ambas isoformas (oxidada y reducida) de la XO con gran efecto, dependiente de la dosis, reductor de la uricemia 40-42. Febuxostat se elimina por vía hepática y renal, lo que ofrece ventajas para su empleo en el paciente con ERC frente a alopurinol, cuyo metabolito activo alarga significativamente su vida media en este tipo de pacientes34. Por sus características, febuxostat no precisa ajuste de dosis en pacientes con FG > 30ml/min, si bien no se recomienda en pacientes con ERC 4-5, incluido el trasplante renal, por falta de datos de eficacia y seguridad procedentes de los estudios. Si se compara con alopurinol, su eficacia clínica en porcentajes de pacientes con objetivo de AU < 6 mg/dl fue, a corto y largo plazo, superior, incluidos los pacientes con ERC seguidos en los distintos estudios43-47. Aunque los estudios experimentales disponibles son escasos, existen datos prometedores acerca del posible papel de febuxos87 Hiperuricemia y gota Riesgo renal y cardiovascular tat en favorecer el enlentecimiento en la progresión de la ERC20. especialmente tufosa, o individuos con intolerabilidad a alopurinol y febuxostat. Las crisis gotosas al inicio del tratamiento son el efecto secundario más frecuente, por lo que, como se ha comentado en el caso de alopurinol, los pacientes deben ser tratados profilácticamente de forma preferencial mejor con dosis bajas de colchicina que con AINE, habida cuenta de sus efectos negativos sobre la función renal. Su administración es intravenosa en dosis medias de 8 mg cada 2-4 semanas, y experimenta una tendencia a incrementar su vida media con el tratamiento. La monitorización del tratamiento con febuxostat debe ser más estrecha en pacientes con ERC que concomitantemente presenten alteraciones de la función tiroidea (se ha observado aumento de la hormona tireotrofin estimulante) o alteraciones enzimáticas hepáticas34,41,42,46. Asimismo, no se recomienda su uso en pacientes con cardiopatía isquémica o insuficiencia cardíaca congestiva hasta disponer de datos de seguridad con mayor número de pacientes y tratamiento a más largo plazo. Pegloticasa Es una ureasa recombinante porcina conjugada con polietilenglicol, que permite la degradación de AU a alantoína, metabolito inerte de las purinas y 5-10 veces más soluble que AU4,48, aprobada en 2010 por la Food and Drug Adminstration y en fase de registro por la EMEA, e indicada en casos de gota refractaria, Aunque en los estudios disponibles su eficacia clínica es elevada en pacientes con gota refractaria (aproximadamente un 40 % de los pacientes consiguen niveles de AU < 6 mg/dl) 49 y no se requiere ajuste en caso de IRC48, no obstante la elevada incidencia de gota aguda (80 %), su deficiente perfil de tolerabilidad clínica (más del 60 % presentan reacciones de hipersensibilidad a la infusión intravenosa con reacciones urticariales pruriginosas) y su elevado precio limitan grandemente su uso48-50. En resumen, el tratamiento hipouricemiante en pacientes con ERC resulta altamente eficaz y seguro, pero requiere de ajustes a las características farmacocinéticas y farmacodinámicas de los distintos agentes hipouricemiantes y el grado de disfunción renal. Aunque los resultados disponibles son prometedores, son necesarios más estudios que definitivamente clarifiquen el papel renoprotector de los hipouricemiantes en el paciente con ERC. referencias Bibliográficas 1. Johnson R, Kang DH, Feig D. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003;41:1183-90. 2. Davis N. The cardiovascular and renal relations and manifestations of gout. JAMA 1897;29:261-2. 3. Zhang W, Doherty M, Bardin T, Pascual E, Barskova V, Conagham P, et al. EULAR evidence based recommendations for gout. Part II: Management report of a task force of the EULAR Standing Committee for Interventional Clinical Studies including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65:1321-4. 4. Hamburger M, Baraf HS, Adamson TC 3rd, Basile J, Bass L, Cole B, et al. European League against Rheumatism. 2011 recommendations for the diagnosis and management of gout and 88 5. 6. 7. 8. 9. hyperuricemia. Postgrad Med 2011;(Suppl 1): 3-36. Weiner DE, Tighionar TH, Elsayed E, Griffith JL, Salen DN, Levey AS. Uric acid and incident kidney disease. J Am Soc Nephrol 2008;19(6): 1203-11. Chonchol M, Shlipak MG, Kazt R, Sarnak MJ, Newman AB, Siscovick DS, et al. Relationship of uric acid with progression of kidney disease. Am J Kidney Dis 2007;50(2):239-47. Baker JF, Schumacher RH. Update on gout and hyperuricemia. Int J Clin Pract 2010;64(3): 371-7. Talbott JH, Terplan KL. The kidney in gout. Medicine (Baltimore) 1960;39:405-67. Feig DI. Uric acid-a novel mediator and marker of risk in chronic kidney disease? Curr Op Nephrol Hypertens 2009;18(6):526-30. Manejo de la hiperuricemia y la gota en el paciente con enfermedad renal crónica 10.Iseki K, Ikemiya Y, Inone T, Iseki C, Kinjo K, Takhesita S. Significance of hyperuricemia as a risk factor for developing ESRD in a screening cohort. Am J kidney Dis 2004;44:642-50. 11.Hsu CY, Iribarren C, McCullogh CE, Darbiman J, Co AS. Risk factors for end stage renal disease: 25-year follow up. Arch Int Med 2004;169:34250. 12.Bellomo G, Venanzi S, Verdura C. Association of uric acid with change in kidney function in healthy normotensive individuals. Am J Kidney Dis 2010;56(2):264-72. 13.Kang DH, Nakagawa T, Feng L. A role for uric acid in the progression of renal disease. J Am Soc Nephrol 2002;13(12):2888-97. 14.Sanchez-Lozada LE, Tapia E, Santamaria J, Avila-Casado C, Soto V, Nepomuceno T, et al. Mild hyperuricemia induces vasoconstriction and maintains glomerular hyperfiltration in normal and remnant kidney rats. Kidney Int 2005;67(1):237-47. 15.Sánchez-Lozada LG, Tapia E, Rodríguez-Iturbe B, Johnson RI, Herrera-Acosta J. Hemodynamics of hyperuricemia. Semin Nephrol 2005;25(1):1924. 16.Mené P, Punzo G. Uric acid: bystander or culprit in hypertension and progressive renal disease? J Hypertens 2008;26(11):2085-92. 17.Filiopoulos V, Hadjiyannakos D, Vlassopoulos D. New insigths into uric acid effects on the progression and prognosis of chronic kidney disease. Ren Fail 2012;34(4):510-20. 18.Goicoechea M, García de Vinuesa S, Arroyo D, Luño J. Hiperuricemia, gota y enfermedad renal crónica. Nefrología Supl Ext 2012;3(2):815. 19.Sin YP, Leung KT, Tong MK, Kwan TH. Use of allopurinol in slowing the progression of renal disease through its ability to lower serum uric acid level. Am J Kidney Dis 2006;47:51-9. 20.Kanbay M, Ozkara A, Selcoki Y, Isik B, Turquet F, Baybek N, et al. Effect of treatment of hyperuricemia with allopurinol on blood pressure, creatinine clearance and proteinuria in patients with normal renal function. Int Urol Nephrol 2007;39:1227-33. 21.Sánchez-Lozada LG, Tapia E, Soto V, Franco M, Wesale JL, Zhao L, et al. Effect of febuxostat on the progression of renal disease in 5/6 nephrectomy rats with and without hyperuricemia. Nephron Physiol 2008;108:69-78. 22.Goicoechea M, García de Vinuesa S, Verdalles V, Ruiz C, Ampuero J, Rincón A, et al. Effects of allopurinol in chronic disease progression and cardiovascular risk. Clin J Am Soc Nephrol 2010;5:1388-93. 23.Ohno I, Ichida K, Okabe M, Hikita M, Uetake D, Kumura H, et al. Frequency of gouty arthritis in patients with end-stage renal disease in Japan. Intern Med 2005;44(7):706-9. 24.Choi HK, Atkinson K, Karlson EW, Willett N, Curham G. Purine-rich foods, dairy and protein intake and the risk of gout in men. N Engl J Med 2004;350:1093-103. 25.Zoppini G, Targher G, Chonchol M, Ortalda V, Abaterusso C, Pichiri I, et al. Serum uric acid levels and incident chronic disease in patients with type 2 diabetes and preserved kidney function. Diabetes 2012;35:99-104. 26.Terkeltaub RA. Gout. N Engl J Med 2003;349: 1647-55. 27.López Jiménez M, García Puig J. Gota úrica. Med Clin 2004;123(4):138-42. 28.Fam AG. Treating acute gouty arthritis with selective COX-2 inhibitors. BMJ 2002;325: 980-2. 29.Luño J, Goicoechea M, García de Vinuesa S. Introducción: avances en el tratamiento de la gota. Nefrologia Sup Ext 2012;3(2):1-7. 30.García Puig J, Mateos F, Burn A, Ortega R, Rodríguez F, Dal-Ré R. Effect of eprosartan and losartan on uric acid metabolism in patients with essential hypertension. J Hypertens 1999;17: 1033-9. 31.Bastow MD, Durrington PN, Ishola M. Hypertriglyceridemia and hyperuricemia: effects of two fibric acid derivatives in a double-blind, placebo-controlled trial. Metabolism 1998;37: 217-20. 32.Viazzi F, Leoncini G, Ratto E, Pntremoli R. Serum uric acid as a risk factor for cardiovascular and renal disease: An old controversy revived. J Clin Hypertens 2006;8:510-8. 33.López Jiménez M. Tratamiento de la gota. Rev Clin Esp 1999;199:840-6. 34.Neogy T. Clinical practice: Gout. N Engl J Med 2011;364(5):443-52. 35.Pérez Ruiz F. New treatments for gout. Joint Bone Spine 2007;74(4):313-5. 36.Ridr TG, Jordan KM. The modern management of gout. Rheumatology 2010;49(1):5-14. 37.Ohno I. Relationship between hyperuricemia and chronic kidney disease. Nucleosides Nucleotides Nucleic Acids 2011;30(12):1039-44. 38.Kai MP, Ang DS, Gandy SJ. Allopurinol benefits on left ventricular mass and endothelial dysfunction 89 Hiperuricemia y gota Riesgo renal y cardiovascular in chronic kidney disease J Am Soc Nephrol 2011;22:1382-9. 39.Day Ro, Graham GG, Hicks M, Mclahlan AJ, Stocker SL, Williams KM. Clinical pharmacokinetics and pharmacodynamics of allopurinol and oxypurinol. Clin Pharmacokinet 2007;46:623-44. 40.Pérez Ruiz F, Schlesinger N. Febuxostat, a novel drug for the treatment of hyperuricemia of gout. Future Rheumatol 2008;5:421-7. 41.Edwards NL. Febuxostat: a new treatment for hyperuricemia in gout. Rheumatology 2009;48 (Suppl 2):ii15-9. 42.Love BL, Barrows R, Veverka A, Sniider KM. Urate-lowering therapy for gout: focus on febuxostat. Pharmacotherapy 2010;30(6):594608. 43.Becker MA, Schumacher HR, Espinoza LR, Wells AF, MacDonald P, Lloyd E, et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010;12(2):R63. 44.Schumacher HR, Becker MA, Wortmam RL, MacDonald PA, Hunt B, Streit J, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout:a 28-week, phase III, 90 randomised, double-blind parallel group trial. Arthritis Rheum 2008;15(11):1540-8. 45.Becker MA, Schumacher RL, Wortmam RL, MacDonald PA, Eustau D, Palo WA, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Eng J Med 2005;353(23):2450-61. 46.Schumacker HR, Becker MA, Lloyd E, MacDonald PA, Lademacher C. Febuxostat in the treatment of gout. Rheumatology 2009;48(2):188-94. 47.Becker MA, Schumacher RH, MacDonald PA, Lloyd E, Lademacher C. Clinical efficacy and safety of successful long-term urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol 2009;36(6):1273-82. 48.Lyseng-Williamson K. Pegloticase: In-treatment refractory chronic gout. Drugs 2011;71(16):217992. 49.Ganson NJ, Kelly SJ, Sacarlett E, Sundy JS, Kershfield MS. Control of hyperuricemia in subjects with refractory gout, and induction of pegloticase (PG) therapy: pooled results from GOUT 1 and GOUT 2PG phase III, randomised, double-blind, placebo-controlled trials. Arthritis Rheum 2008;58:S176. 50.Shannon JA, Cole SW. Pegloticase: a novel agent for the treatment of refractory gout. Ann Pharmacotherap 2012;46:368-76. Hiperuricemia y litiasis renal Félix Grases Director del Laboratorio de Investigación en Litiasis Renal. Director del Instituto Universitario de Investigación en Ciencias de la Salud (IUNICS). Catedrático de la Universidad de las Islas Baleares Antonia Costa-Bauza Subdirectora del Laboratorio de Investigación en Litiasis Renal. Profesora Titular de la Universidad de las Islas Baleares Introducción Los cálculos renales de ácido úrico se forman fundamentalmente en individuos con valores de pH urinario bajos (ácido), aunque en muchos casos con concentraciones urinarias de ácido úrico normales. Se sabe que los pacientes con gota, obesidad, diabetes o síndrome metabólico tienen un mayor riesgo de formación de cálculos de ácido úrico debido a la excreción de una orina anormalmente ácida1. La producción excesiva de urato asociada a lisis de tumores o a otras situaciones en las que se renuevan rápidamente ácidos nucleicos o se destruye un tejido está asociada normalmente con insuficiencia renal aguda, debido a un aumento de la precipitación intratubular de ácido úrico y a la obstrucción que ello genera2. Sin embargo, la producción excesiva de urato, juntamente con una hiperexcreción de ácido úrico, va comúnmente acompañada de piedras o gota, mientras que la hiperuricemia asintomática está relacionada con el deterioro cardiovascular y con la enfermedad vascular renal2. De hecho, hace algún tiempo se postuló el papel del ácido úrico en el daño vascular, aunque solo recientemente ha conseguido cierta aceptación3-5. Se considera que el ácido úrico es un importante antioxidante presente en la sangre, pero esa acción beneficiosa para el organismo se consigue solo en concentraciones inferiores a la concentración de saturación, ya que en esas condiciones el ácido úrico empieza a cristalizar. Hay evidencias epidemiológicas importantes que indican que niveles elevados de ácido úrico pueden dañar las células endoteliales, lo que pue- de conducir tanto a lesiones de la arteria coronaria como a hipertensión4. En este trabajo se han estudiado los distintos tipos de cálculos renales formados por un grupo de pacientes hiperuricémicos y se ha determinado la composición de su orina para establecer relaciones entre la hiperuricemia y la etiología de los cálculos renales desarrollados. Pacientes y métodos Pacientes En un grupo de 750 pacientes litiásicos se identificaron 95 pacientes hiperuricémicos que formaron 126 cálculos renales. Se analizó la orina de estos últimos pacientes y se estableció la composición, macroestructura y microestructura de los cálculos renales que desarrollaron. Estudio de los cálculos renales Se estudiaron 126 cálculos renales siguiendo el procedimiento detallado a continuación. Después de su expulsión, los cálculos renales se secaron, se almacenaron en recipientes estériles y se examinaron rápidamente. El estudio de los cálculos renales requiere una combinación de técnicas macroscópicas y microscópicas (microscopía estereoscópica) con métodos físicos tales como la espectrometría infrarroja (IR) y la microscopía elec91 Hiperuricemia y gota Riesgo renal y cardiovascular trónica de barrido (SEM) acoplada con microanálisis por rayos X6. El estudio del cálculo empieza con la observación directa de la apariencia externa mediante un microscopio estereoscópico. A continuación, si el cálculo se ha expulsado entero, se secciona en dos partes a lo largo de un plano lo más cercano posible al centro geométrico, para así poder establecer la estructura interna. Si el cálculo se estudia después de un tratamiento de fragmentación, los fragmentos se observan mediante microscopía estereoscópica para establecer la forma del cálculo original y la estructura interna. Este estudio inicial indicará qué otras técnicas se deben aplicar a continuación. Así, se puede obtener el espectro IR de uno o varios fragmentos del cálculo. Si los fragmentos de un mismo cálculo difieren en aspecto, es necesario obtener el espectro IR de los fragmentos más representativos. La técnica aplicada es el método de la pastilla de KBr (se requiere menos de 1 mg de muestra). El estudio detallado de la estructura interior del cálculo y la detección e identificación de microcomponentes requiere el uso de SEM (entre 30 y 20.000 aumentos) acoplada con microanálisis por rayos X. La combinación de ambas técnicas es de gran ayuda en la identificación de componentes particulares. Esta metodología permite, por ejemplo, distinguir entre un auténtico cálculo de oxalato cálcico monohidrato (COM), en el que el COM es la fase cristalina formada inicialmente, de cálculos de COM que provienen de la transformación cristalina de cálculos de oxalato cálcico dihidrato (COD), que fue la fase que se originó primero. Así, mediante SEM se puede observar que los cálculos que inicialmente se formaron como COD presentan una estructura no compacta desorganizada con «fantasmas» (moldes de los cristales de COD que se formaron en primer lugar) claramente identificables7. La metodología descrita anteriormente permite la asignación del cálculo renal a uno de los once tipos principales8: 1. Cálculos renales de oxalato cálcico monohidrato papilar (COMP). 2. Cálculos renales de oxalato cálcico monohidrato de cavidad (COMC). 3. Cálculos renales de COD. 4.Cálculos renales mixtos de COD/hidroxiapatita (COD/HAP). 92 5. Cálculos renales de HAP. 6. Cálculos renales de fosfato amónico magnésico (estruvita) (STR). 7. Cálculos renales de hidrógeno fosfato cálcico dihidrato (brushita) (BRU). 8. Cálculos renales de ácido úrico y sales de uratos (UA). 9. Cálculos renales mixtos de COM/UA. 10.Cálculos renales de cistina (CYS). 11. Cálculos renales poco frecuentes, que no se ajustan a ninguna de las categorías anteriores. Análisis de las muestras de orina En el momento de recogida de la orina, todos los sujetos seguían una dieta libre y ninguno de los litiásicos estaba bajo tratamiento farmacológico. Se realizó un análisis sanguíneo (creatinina, calcio, magnesio, fósforo y ácido úrico) para evaluar la función renal. Se excluyeron de este estudio los pacientes con insuficiencia renal y aquellos que presentaban infección urinaria. Las muestras de orina de 24 horas se recogieron en frascos estériles que contenían timol como conservante. De estas muestras se anotó el volumen y se conservaron a -20 ºC hasta el análisis. Las muestras de orina de 2 horas se recogieron en ayunas y se determinó su pH inmediatamente después de su recolección mediante el uso de un electrodo de vidrio y un pH-metro. El pH se midió únicamente en esta muestra de orina, ya que durante el período de recolección de la orina de 24 horas puede producirse la precipitación de sales cálcicas (que puede llevar asociado un cambio de pH). Además, la medida del pH de la orina de 2 horas representa mejor el pH urinario basal, ya que este valor se ve afectado mínimamente por factores dietéticos. Las muestras de orina se recogieron por duplicado entre uno y dos meses después de la expulsión del cálculo renal. Las concentraciones de calcio, magnesio y fósforo se determinaron mediante espectroscopía atómica de plasma acoplado inductivamente. Las concentraciones de ácido úrico y creatinina se evaluaron con un analizador Roche Modular Analytics con los reactivos N.º 11875426216 y 11875663216, respectivamente, mientras que el citrato y el oxalato se determinaron mediante análisis enzimáticos con los kits de RBiopharm N.º 10139076035 y 10755699035, respectivamente. Se estudiaron todos los parámetros bioquímicos urinarios en relación con su potencial como factores litógenos en condiciones particulares. En la tabla 1 se indican los valores límites de estos parámetros. Hiperuricemia y litiasis renal Tabla 1. Valores de referencia de riesgo metabólico y riesgo litógeno en pacientes litiásicos17 Parámetro urinario Riesgo metabólico (excreción) pH Riesgo litógeno (concentración) < 5,5 > 6,0 Ca > 6,2 mmol/24 h (mujeres) > 3,8 mmol/l > 7,5 mmol/24 h (varones) Mg < 3,0 mmol/24 h < 2 mmol/l P > 40,0 mmol/24 h > 30 mmol/l Oxalato > 0,5 mmol/24 h > 0,30 mmol/l Urato > 4,5 mmol/24 h (mujeres) > 2,5 mmol/l > 4,8 mmol/24 h (varones) Citrato < 1,5 mmol/24 h Resultados En el grupo de 750 litiásicos, el 12 % (n = 95) presentaba hiperuricemia ([ácido úrico]sangre > 7 mg/dl). En el grupo de pacientes hiperuricémicos, el 71 % presentaba a su vez hiperuricuria (hiperexcreción urinaria de ácido úrico), pero solo el 24 % presentaba riesgo litógeno asociado a ácido úrico ([ácido úrico orina > 600 mg/l o 2,5 mmol/l). Los cálculos renales formados por estos 95 pacientes hiperuricémicos presentan la distribución que aparece en la tabla 2. Se evaluaron las principales alteraciones urinarias observadas en cada uno de los pacientes hiperuricémicos en función del tipo de cálculo renal formado. Así, los cálculos de COD, el tipo más abundante (30 %), se asociaron principalmente a concentración urinaria de calcio elevada (71 % de los pacientes). El porcentaje de cálculos de COM fue similar, pero estos cálculos se subdividen en dos grupos correspondientes a cálculos papilares (12 %) y de cavidad (21 %), donde los de cavidad eran más prevalentes. Los cálculos de COMC se asociaron con un déficit urinario de inhibidores de la cristalización del oxalato cálcico, tales como citrato (el 48 % de los pacientes hiperuricémicos que han formado cálculos de COMC presentaba hipocitraturia) y un pH urinario alterado (pH > 6,0 o pH < 5,5 en el 91 % de los pacientes). Se observó una relación entre el desarrollo de cálculos de COMP y tanto la concentración urinaria elevada de oxalato (observada en el 54 % de los pacientes) como el déficit de inhibidores de la cristalización (el 54 % de pacientes presentaba hipocitraturia). Los cálculos mixtos de COD/HAP se < 1 mmol/l Tabla 2. Porcentaje de los tipos de los 126 cálculos renales formados por los 95 pacientes hiperuricémicos Tipo de cálculo Porcentaje (%) COMP (tipo I) 12 COMC (tipo II) 21 COD (tipo III) 30 COD/HAP (tipo IV) 11 HAP (tipo V) 6 STR (tipo VI) 4 BRU (tipo VII) 0 UA (tipo VIII) 15 COM/UA (tipo IX) 4 CYS (tipo X) 0 Poco frecuentes (tipo XI) 0 BRU: hidrógeno fosfato cálcico dihidrato (brushita); COD: oxalato cálcico dihidrato; COM: oxalato cálcico monohidrato; COMC: oxalato cálcico monohidrato de cavidad; COMP: oxalato cálcico monohidrato papilar; CYS: cistina; HAP: hidroxiapatita; STR: fosfato amónico magnésico (estruvita); UA: ácido úrico y sales de uratos. formaron principalmente en pacientes con concentración urinaria de calcio elevada (64 %) o pacientes con pH > 6 (82 %), mientras que los cálculos de HAP se relacionaron con valores de pH > 6 (75 % de los pacientes). El tipo o tipos de cálculos desarrollados por cada uno de los pacientes hiperuricémicos se muestran en la tabla 3. Es interesante observar que algunos pacientes hiperuricémicos que han formado cálculos 93 Hiperuricemia y gota Riesgo renal y cardiovascular Tabla 3. Tipos de cálculos desarrollados por cada paciente hiperuricémico Tipo de cálculo Número de pacientes % I 7 7,7 II 15 16,5 III 22 24,2 IV 8 8,8 V 5 5,5 VI 6 6,6 VIII 5 5,5 IX 2 2,2 I, III 4 4,4 II, VIII 1 1,1 III, IV 5 5,5 IV, V 1 1,1 V, VIII 1 1,1 VIII, II 1 1,1 VIII, IX 2 2,2 I, II, VIII 1 1,1 II, III, VIII 1 1,1 III, IV, V 1 1,1 I, II, III, IV 1 1,1 I, II, III, VIII 2 2,2 puros de ácido úrico también han generado otros tipos de cálculos y que solo el 5,5 % de los pacientes hiperuricémicos ha formado exclusivamente cálculos de ácido úrico, presentando en todos los casos valores de pH urinario inferior a 5,5. Discusión Los principales factores de riesgo implicados en la formación de cálculos renales de ácido úrico están relacionados con valores de pH urinario < 5,5, aumento de la excreción urinaria de ácido úrico, presencia de cavidades de baja eficacia urodinámica y déficit de inhibidores de la cristalización. A valores bajos de sobresaturación de ácido úrico se forma la fase termodinámicamente estable que corresponde al ácido úrico anhidro. En esas condiciones, el cálculo se forma principalmente mediante mecanismos de crecimiento cristalino generando agregados primarios, que dan lugar a estructuras muy compactas. En condiciones de sobresaturación 94 elevada de ácido úrico, se forma la fase cinéticamente favorecida que es el ácido úrico dihidrato. Al ser las condiciones más extremas, se generan muchos más cristales que se unen mediante agregación secundaria y dan lugar a estructuras frágiles y porosas9. Es conocido que ciertos factores pueden aumentar el riesgo de formación de cálculos renales de ácido úrico. Estos factores están relacionados principalmente con la hiperuricemia, pero también se deben considerar otros factores como los relacionados con la diabetes. La hiperuricemia implica concentraciones anormalmente elevadas de ácido úrico en sangre ([ácido úrico]sangre > 7 mg/dl). Muchos factores pueden contribuir a la hiperuricemia: la resistencia a la insulina, la hipertensión, la dieta, el uso de diuréticos, el consumo de alcohol (una de las más importantes) y la genética. El gen SLC2A9 codifica una proteína que ayuda a transportar el ácido úrico en el riñón10. Varios polimorfismos de un nucleótido de este gen presentan una correlación significativa con el ácido úrico elevado en sangre. Recientemente se ha descrito una nefropatía hiperuricémica familiar11,12. Es una rara enfermedad autosómica dominante. Las mutaciones genéticas de la uromodulina que codifican la proteína TammHorsfall son las responsables en aproximadamente la mitad de las familias. Al menos otros dos genes están implicados: el TCF2 y el gen que codifica la renina. El pH urinario inferior a 5,5 es sin duda el factor más importante relacionado con la litiasis renal de ácido úrico. Los vínculos entre la diabetes y el pH urinario bajo se han establecido claramente13. Así, la insulina es importante en la ammoniagénesis y los datos recientes indican que la resistencia a la insulina se asocia con ammoniagénesis deteriorada. En esta situación, hay menos amoníaco en la orina disponible para aceptar protones y el pH urinario es más bajo. La diabetes tipo 1 es principalmente de origen genético14 y la diabetes de tipo 2 tiene un importante componente genético15, lo que demuestra otra relación clara entre la genética y la litiasis renal de ácido úrico. La distribución de los tipos de cálculos formados por pacientes hiperuricémicos fue similar a la encontrada en un grupo general de litiásicos8. Hiperuricemia y litiasis renal Tal y como ya se ha descrito previamente8, la concentración urinaria de calcio elevada se asocia con la formación tanto de cálculos de COD como de cálculos mixtos de COD/HAP. Esta alteración se encontró en el 71 % de los pacientes hiperuricémicos que generaron dichos cálculos (solo el 19 % de la población sana exhibe concentración urinaria de calcio elevada en nuestra región8). Se han observado valores de pH urinario superiores a 6 en una elevada proporción de pacientes hiperuricémicos con cálculos mixtos de COD/HAP (82 % de los pacientes) y con cálculos de HAP (75 %) (estos valores de pH se encuentran en solo el 26 % de los individuos sanos8). Por último, la formación de cálculos de COMP se asoció con déficit en inhibidores de la cristalización (54 % de los pacientes hiperuricémicos con estos cálculos tenían hipocitraturia) y/o con concentraciones de oxalato urinario elevadas (54 % de los pacientes hiperuricémicos con estos cálculos tenían niveles urinarios de oxalato > 20 mg/l). Si se tiene en cuenta que la prevalencia de la hiperuricemia en una población normal es de aproximadamente el 7 %, es obvio que el alto porcentaje de individuos hiperuricémicos (13 %) en nuestro grupo general de pacientes litiásicos demuestra un alto riesgo de formación de cálculos renales para tales individuos. Este hecho debe atribuirse a las alteraciones de cuatro factores litogénicos importantes en el grupo de pacientes con hiperuricemia: valores alterados de pH urinario, concentración elevada de ácido úrico urinario, concentración urinaria de calcio elevada y déficit de citrato. El porcentaje de cada tipo de cálculo renal formado por pacientes hiperuricémicos fue similar al observado en un grupo general de litiásicos8. Esto se puede atribuir al bien conocido hecho de que la litiasis renal es una enfermedad multifactorial y el peso específico que ha de asignarse a un factor en particular depende de la naturaleza y la magnitud de otros factores alterados operativos cuando se genera un cálculo renal concreto. Así, la mayoría de estos pacientes hiperuricémicos mostraron diversos factores alterados, como son altas concentraciones de calcio urinario, valores de pH urinario alterados o déficit de inhibidores de la cristalización. Finalmente, es importante tener en cuenta que la cristalización del ácido úrico de la orina, aparte de implicar la formación de cálculos de ácido úrico, puede inducir el desarrollo de cristales de oxalato cálcico a través de mecanismos de nucleación heterogénea, formando los típicos cálculos mixtos de oxalato cálcico/ácido úrico, y también de cálculos de COMC aparentemente «puros», para los que solo métodos muy sensibles (como la cromatografía líquida de alta resolución) pueden detectar el ácido úrico en el «núcleo» cálculo16. Es importante destacar que la hiperuricemia también puede ser causa de la cristalización del urato sódico o potásico (en forma de agujas) en las puntas de las papilas. Como consecuencia de la lesión causada por estos cristales, puede inducirse el desarrollo de cálculos COMP. Este podría ser un mecanismo de formación de cálculos directamente vinculada a la hiperuricemia, aunque esta hipótesis todavía necesita una investigación más amplia. Como conclusiones principales se ha de señalar que: • El factor más importante relacionado con la litiasis renal exclusivamente de ácido úrico es el pH urinario inferior a 5,5. • La hiperuricemia está vinculada a la formación de cálculos de ácido úrico, pero también se relaciona con el desarrollo de cálculos renales cálcicos. • La hiperuricemia se correlaciona claramente con la hiperuricuria (71 %), pero no con el riesgo litógeno debido a concentraciones elevadas de ácido úrico urinario (24 %). • La relación entre hiperuricemia y los cálculos de COMP puede ser importante y debe ser investigada. Agradecimientos Se agradece al Ministerio de Ciencia e Innovación (Gobierno de España) (Proyecto CTQ2010-18271/ PPQ), a los fondos FEDER de la Unión Europea y a la Conselleria d’Educació, Cultura i Universitat (Gobierno de las Islas Baleares) (Ayuda 9/2011) la ayuda económica prestada. 95 Hiperuricemia y gota Riesgo renal y cardiovascular referencias Bibliográficas 1. Liebman SE, Taylor JG, Bushinsky DA. Uric acid nephrolithiasis. Curr Rheumatol Rep 2007;9: 251-7. 2. Steele TH. Hyperuricemic nephropathies. Nephron 1999;81 Suppl 1:45-9. 3. Edwards NL. The role of hyperuricemia and gout in kidney and cardiovascular disease. Cleve Clin J Med 2008;75 Suppl 5:S13-6. 4. Edwards NL. The role of hyperuricemia in vascular disorders. Curr Opin Rheumatol 2009;21:132-7. 5. Gaffo AL, Edwards NL, Saag Kg. Gout. Hyperuricemia and cardiovascular disease: how strong is the evidence for a causal link? Arthritis Res Ther 2009;11:240-6. 6. Grases F, García-Ferragut L, Costa-Bauzá A. Analytical study of renal calculi. A new insight. Recent Res Dev Pure Appl Anal Chem 1998;1:187-206. 7. Iwata H, Iio S, Nishio S, Takeuchi M. Architecture of mixed calcium oxalate dihydrate and monohydrate stones. Scanning Microsc 1992;6: 231-8. 8. Grases F, Costa-Bauzá A, Ramis M, Montesinos V, Conte A. Simple classification of renal calculi closely related to their micromorphology and etiology. Clin Chim Acta 2002;322:29-36. 9. Grases F, Villacampa AI, Costa-Bauzá A, Söhnel O. Uric acid calculi. Types, ethiology and mechanisms of formation. Clin Chim Acta 2000;302:89-104. 96 10.Döring A, Gieger C, Mehta D, Gohlke H, Prokisch H, Coassin S, et al. SLC2A9 influences uric acid concentrations with pronounced sex-specific effects. Nat Genet 2008;40:430-6. 11.Hummel A, Familial juvenile hyperuricemic nephropathy. Nephrol Ther 2012;8:117-25. 12.Gibson T. Hyperuricemia, gout and the kidney. Curr Opin Rheumatol 2012;24:127-31. 13.Maalouf NM, Cameron MA, Moe OW, AdamsHuet B, Sakhaee K. Low urine pH: a novel feature of the metabolic syndrome. Clin J Am Soc Nephrol 2007;2:883-8. 14.Hakonarson H, Grant SF, Bradfield JP, Marchand L, Kim CE, Glessner JT, et al. A genome-wide association study identifies KIAA0350 as a type 1 diabetes gene. Nature 2007;448:591-4. 15.InterAct Consortium, Langenberg C, Sharp S, Forouhi NG, Franks PW, Schulze MB, Kerrison N, et al. Design and cohort description of the InterAct Project: an examination of the interaction of genetic and lifestyle factors on the incidence of type 2 diabetes in the EPIC Study. Diabetologia 2011;54:2272-82. 16.Grases F, Sanchis P, Isern B, Perelló J, Costa-Bauzá A. Uric acid as inducer of calcium oxalate crystal development. Scand J Urol Nephrol 2007;41:26-31. 17.Jungers P. Medical treatment in urinary stone disease. En: Saladié JM, Blasco FJ. Progresos en Urología’99, Grup Serveis, Barcelona, 1999. pp. 79-98. Sobreproducción de ácido úrico. Enfermedad de Lesch-Nyhan, trastornos mielo- y linfoproliferativos Rosa Torres Jiménez1, Juan García Puig2 Unidad Metabólico-Vascular. Laboratorio de Bioquímica. Hospital Universitario La Paz. Fundación de Investigación IdiPaz 1 Unidad Metabólico-Vascular. Servicio de Medicina Interna. Hospital Universitario La Paz. Fundación de Investigación IdiPaz 2 Introducción El ácido úrico es el producto final del metabolismo de las purinas y la mayoría de él se produce a partir de la interconversión de las purinas endógenas (figura 1). Por contra, las purinas ingeridas contribuyen solo en un pequeño porcentaje al conjunto total de purinas. Aproximadamente dos tercios de los uratos son excretados por la vía renal. Las bacterias intestinales degradan el tercio restante. La eliminación intestinal o vía extrarrenal había sido hasta ahora ignorada como causa de la hiperuricemia. En la actualidad, algunos investigadores postulan que una disminución de la excreción extrarrenal de urato, ocasionada por ejemplo por la disfunción del trasportador intestinal de urato ABCG2, podría ser una causa común de hiperuricemia1. El aumento de la concentración sérica de uratos puede deberse a un incremento de la producción de ácido úrico o a una disminución de su excreción. Menos del 10 % de los sujetos con hiperuricemia evidencian, como trastorno fisiopatológico subyacente, un aumento de la producción de ácido úrico, asociada o no a una disminución de la excreción (tabla 1). Para diferenciar el tipo de hiperuricemia es necesario determinar la excreción de ácido úrico y creatinina en orina de 24 horas (a ser posible, tras dieta pobre en purinas). La hiperuricemia por sobreproducción se acompaña de un aumento de la excreción de ácido úrico en la orina de 24 horas (> 600 mg/24 horas) con una excreción fraccionada de ácido úri- co (EFAU) elevada. Por contra, en la hiperuricemia presente en el 90 % de los casos, y debida a infraexcreción renal de uratos, los sujetos presentan disminución tanto de la uricuria de 24 horas como de la EFAU. La hiper­uricemia combinada se presenta con un aumento de la uricuria de 24 horas con disminución de EFAU. Alteraciones congénitas del metabolismo de las purinas: sobreactividad de la fosforribosilpirofosfato sintetasa Es un raro trastorno congénito debido a un aumento de la actividad de la enzima fosforribosilpirofosfato sintetasa (PRPS), que se hereda ligada al cromosoma X2. Se conocen dos formas de presentación. La más leve o forma juvenil afecta solo a los varones hemicigotos, mientras que en la forma más grave o infantil también las mujeres heterocigotas pueden presentar sintomatología. Hasta el momento se conocen solo 30 familias con este defecto enzimático descrito en 19723. En la forma juvenil, las manifestaciones clínicas aparecen en la segunda o tercera década de la vida y se limitan a las consecuencias directas de la sobreproducción de ácido úrico: artritis gotosa grave, acompañada de tofos y de litiasis renal úrica3-4. Las mujeres heterocigotas no suelen presentar manifestaciones clínicas4. En el segundo fenotipo, o forma infantil, la gota debuta en la infancia y se acompaña de otros 97 Hiperuricemia y gota Riesgo renal y cardiovascular Figura 1. Metabolismo de las purinas Síntesis de novo de purinas Ribosa-5-P ATP PRPP sintetasa ADP PRPP ATP PRPP amidotransferasa Síntesis de pirimidinas ATPasa Reciclado de purinas Ácido orótico GMP Guanosina IMP HPRT AMP Adenosina Inosina PNP APRT PRPP PNP Guanina PRPP Hipoxantina PRPP Immucilinas OMP Adenina OMPDC Xantina oxidasa Xantina Xantina oxidasa UMP Alopurinol, febuxostat Ácido úrico Uricasa Rasburicasa Alantoína ADP: adenosín difosfato; AMP: adenosín monofosfato; APT: adenosín trifosfato; APRT: adenina fosforribosiltransferasa; GMP: guanosín monofosfato; HPRT: hipoxantina-guanina fosforribosiltransferasa; IMP: inosina monofosfato, OMP: orotato monofosfato, OMPDC: OMP decarboxilasa, PNP: purin nucleósido fosforilasa, PRPP: fosforribosilpirofosfato; UMP: Uridina monofosfato. Tabla 1. Causas de la producción excesiva de ácido úrico • Alteraciones congénitas del metabolismo de las purinas: sobreactividad de PRPS y deficiencia de HPRT • Deficiencia de glucosa-6-fosfato deshidrogenasa (enfermedad de Von Gierke) • Enfermedades hematológicas y neoplásicas con aumento del recambio celular • Psoriasis • Enfermedad de Paget • Sobreingestión de purinas • Aumento del catabolismo de ATP (alcoholismo, convusiones, ejercicio físico intenso, hipoxia tisular, glucogenosis) • Fármacos: citostáticos, síndrome de lisis tumoral ATP: adenosín trifosfato; HPRT: hipoxantina-guanina fosforribosiltransferasa; PRPS: fosforribosilpirofosfato sintetasa. 98 signos variables de alteraciones del desarrollo del sistema nervioso, el más frecuente de los cuales es la sordera neurosensorial5. Las mujeres portadoras pueden presentar gota y sordera en un grado menor6. La enzima PRPS cataliza la síntesis de fosforribosilpirofosfato (PRPP) (figura 1). El PRPP es sustrato de tres enzimas implicadas en el metabolismo de las purinas, tanto en la síntesis de novo: fosforribosilpirofosfato amidotransferasa (PRPP amidotransferasa), como en la vía de reutilización: hipoxantinaguanina fosforribosiltransferasa (HPRT) y adenina fosforribosiltransferasa (APRT). La mayor actividad de PRPS condiciona un aumento de los niveles intracelulares de PRPP y conlleva un incremento de la síntesis de purinas por ambas vías. Secundariamente, se produce un incremento de la degradación de nucleótidos que conduce, finalmente, a una síntesis exacerbada de ácido úrico. Sin embargo, la patoge- Sobreproducción de ácido úrico. Enfermedad de Lesch-Nyhan, trastornos mielo- y linfoproliferativos nia de las manifestaciones neurológicas, en aquellos casos en que aparecen, es desconocida. La anomalía que conduce al aumento de la actividad enzimática PRPS es diferente según el fenotipo4-7. Los defectos catalíticos, con aumento de la velocidad máxima de reacción de la enzima, son los más frecuentes y suelen asociarse al fenotipo menos grave. Los defectos de la regulación alostérica de la enzima suelen ser la causa de la forma grave infantil. La actividad enzimática PRPS puede determinarse en hemolisado o en cultivo de fibroblastos8, pero la variedad de los mecanismos causantes obliga a realizar estudios cinéticos para confirmar el defecto. Los defectos catalíticos se asocian a una actividad aumentada tanto en hemolisado como en fibroblasto. Sin embargo, en el caso de los defectos reguladores la actividad PRPS en hemolisado suele ser baja, por labilidad de la enzima mutante en eritrocito, pero la actividad enzimática residual (a veces < 3 % de lo normal) muestra las alteraciones de la regulación alostérica (figura 2), con una menor respuesta inhibidora frente a nucleótidos purínicos (adenosín mono, di y trifosfato y guanosín mono, di y trifosfato) acompañado por un afinidad aumentada al fosfato; en cultivo de fibroblastos la actividad enzimática está aumentada. En las mujeres heterocigotas que presentan dos poblaciones celulares, una normal y la segunda con la enzima mutante, el diagnóstico puede efectuarse determinando la actividad PRPS en cultivo de fibroblastos. Como sugieren las distintas variedades clínicas y enzimáticas, este trastorno presenta heterogeneidad genética. Se han descrito tres isoenzimas distintas, PRPS1, PRPS2 y PRPS3, codificadas por genes diferentes, si bien los genes de las dos primeras enzimas se localizan en el cromosoma X. Los defectos catalíticos asociados a las formas juveniles reflejan una sobreexpresión de la isoforma normal PRPS1, cuyo mecanismo molecular no está aún dilucidado9. Los defectos de tipo regulador se deben a mutaciones puntuales en la región codificante del gen PRPS1. Solo en estos casos, aproximadamente un 25 %, es posible realizar un diagnóstico molecular en otros miembros de la familia, así como un diagnóstico de portadoras y prenatal6. El tratamiento se realiza con inhibidores de la xantina oxidasa (alopurinol), con el fin de reducir la excesiva síntesis de ácido úrico. El tratamiento sintomático se dirige a aliviar las manifestaciones clínicas (artritis gotosa y litiasis renal) mediante antiinflamatorios y espasmolíticos. Deben asociarse medidas generales de profilaxis de la litiasis úrica, como el aumento de la ingestión de líquidos y la alcalinización de la orina. Hasta el momento, no hay tratamiento para las manifestaciones neurológicas. Deficiencia de hipoxantina-guanina fosforribosiltransferasa, enfermedad de Lesch Nyhan y sus variantes La deficiencia congénita de la actividad enzimática HPRT cursa con hiperuricemia e hiperuricosuria acompañadas de un espectro continuo de manifestaciones neurológicas, que dependen de la grave- Figura 2. Diagnóstico enzimático (A) y molecular (B) de la sobreactividad de la enzima fosforribosilpirofosfato sintetasa 60 A B % V max 50 Paciente 40 Control Paciente 30 20 10 0 Control 012345 Pi (mM) 99 Hiperuricemia y gota Riesgo renal y cardiovascular dad del defecto enzimático. Estas manifestaciones van desde la clásica enfermedad descrita por M. Lesch y W. Nyhan10 caracterizada por distonía de acción grave, coreatetosis y balismo, déficit cognitivo y de atención y automutilación11, hasta variantes parciales en las que la sintomatología neurológica puede estar ausente12. Todos los enfermos, independientemente del grado de déficit enzimático, muestran las manifestaciones propias de una sobreproducción de ácido úrico (litiasis, artritis gotosa y tofos) de comienzo muy temprano. En la enfermedad de Lesch-Nyhan es característico que los padres refieran la aparición de un sedimento anaranjado en los pañales del niño y en algunos casos la enfermedad debuta con insuficiencia renal obstructiva en el primer mes de vida. La artritis gotosa suele ser una manifestación tardía de la deficiencia de HPRT (segunda a cuarta década) y se caracteriza por su enorme agresividad y aparición de tofos en la edad juvenil. Esta forma de presentación es hoy en día más frecuente en los pacientes con deficiencia parcial, ya que el tratamiento suele evitar su aparición. La afectación del sistema nervioso central es variable y depende del grado de deficiencia enzimática, y es más grave en la deficiencia completa o enfermedad de Lesch Nyhan. Los niños con la enfermedad de Lesch-Nyhan suelen ser normales al nacer. Las manifestaciones neurológicas más precoces consisten en un retraso global del desarrollo psicomotor que se suele reconocer entre los primeros 3-9 meses de vida, en que el niño presenta hipotonía y no es capaz de sujetar la cabeza ni mantenerse sentado. Al final del primer año aparecen los signos extrapiramidales. La distonía es generalizada y afecta a los miembros superiores, de modo que impide que puedan alimentarse solos, y a los miembros inferiores, de manera que impide la deambulación. Entre los 6 y 8 meses aparecen movimientos involuntarios tipo coreatetosis y balismo, que son escasos en el reposo y suelen aparecer con el movimiento voluntario o el estrés. También son frecuentes los opistótonos y espasmos extensores del tronco. La disartria es un signo siempre presente en estos enfermos. En algunos pacientes es evidente la disfagia y también es frecuente la existencia de reflujo gastroesofágico. Aunque existe un amplio rango de habilidades cognitivas en los pacientes con la enfermedad de LeschNyhan, en general presentan un retraso mental entre moderado y grave. La manifestación neurológica más llamativa de la enfermedad de Lesch-Nyhan es 100 la tendencia compulsiva a la automutilación. Suele comenzar alrededor de los tres años y la forma más frecuente de presentación es la mordedura de labios y dedos. Evoluciona con períodos de mayor y menor intensidad, se agrava con las situaciones de estrés y mejora si el paciente está distraído por alguna actividad que le sea grata. La teoría más aceptada es que se trata de un comportamiento de tipo obsesivocompulsivo y el propio enfermo solicita las sujeciones que le impidan lesionarse y se siente aliviado cuando se le proporcionan. En las formas variantes o deficiencia parcial de HPRT, los pacientes presentan una afectación neurológica muy variada. Algunos enfermos pueden evidenciar un importante retraso psicomotor que en el primer año de vida hace muy difícil su diferenciación con la enfermedad de Lesch-Nyhan. En estos defectos más graves (grado 3), aparecen los signos motores con distonía generalizada y movimientos involuntarios que hacen necesaria la ayuda para la deambulación. Aunque el paciente es capaz de caminar durante un breve período con ayuda, generalmente emplean una silla de ruedas. Estos pacientes no muestran tendencia a la automutilación. En otros pacientes, las manifestaciones neurológicas son moderadas y se manifiestan en forma de marcha distónica, disartria, retraso mental leve, etc. (grado 2). En el extremo del espectro están los pacientes con hiperuricemia relacionada con la deficiencia de HPRT, los cuales son desde el punto de vista neurológico completamente normales (grado 1)13,14. La mayor parte de los pacientes con la enfermedad de Lesch-Nyhan presentan una anemia megaloblástica que no se relaciona con el deterioro de la función renal. En la mayoría los niveles de vitamina B12, ácido fólico y las pruebas de función tiroidea son normales. En la médula ósea suelen advertirse rasgos megaloblásticos, con o sin anemia. La disminución de la síntesis de inosín monofosfato (IMP) y guanosín monofosfato (GMP) libera el freno que en condiciones normales ejercen sobre la enzima amidofosforribosil PRT (figura 1). Además, la menor reutilización de hipoxantina y guanina determina una mayor disponibilidad de estas bases para su catabolismo del ácido úrico. Por último, la mayor disponibilidad de PRPP incrementa la síntesis de novo y también parece responsable del aumento de la actividad enzimática APRT, característica de la deficiencia de HPRT. La fisiopatología de los trastornos neurológicos no está aún dilucidada. Hasta Sobreproducción de ácido úrico. Enfermedad de Lesch-Nyhan, trastornos mielo- y linfoproliferativos el momento las mayores evidencias se encaminan hacia un defecto del desarrollo de los ganglios basales, pero no pueden descartarse otras teorías patogénicas. El gen que codifica la enzima HPRT se localiza en el brazo largo del cromosoma X y el trastorno se hereda de forma recesiva ligada al cromosoma X. Este hecho determina que los pacientes sean varones, aunque se han descrito varios casos de niñas documentados genéticamente. Hasta ahora se han descrito más de 500 mutaciones distintas en pacientes con deficiencia de HPRT. Dichas mutaciones son muy heterogéneas y se encuentran dispersas por todo el gen. Se han descrito algunos pacientes con región codificante normal en los que el defecto parece ser una disminución de la expresión del gen de causa aún desconocida15. El déficit de HPRT debe sospecharse ante toda hiperuricemia por sobreproducción de ácido úrico (con aumento de la excreción urinaria de urato), con o sin afectación neurológica. El diagnóstico se confirma por el hallazgo de una actividad HPRT descendida o ausente en hemolisado, acompañada de un incremento de la actividad APRT. Las mujeres portadoras de la deficiencia de HPRT suelen ser asintomáticas, aunque desde el punto de vista bioquímico se suele observar cierta sobreproducción de ácido úrico. Contrariamente a lo que cabría esperar, la actividad enzimática HPRT en hemolisado es normal, por lo que el diagnóstico de portadora debe realizarse determinando la actividad enzimática en cultivo de fibroblastos o de linfocitos, en las raíces del pelo o bien mediante métodos genéticos. El diagnóstico prenatal de la deficiencia de HPRT puede realizarse mediante la determinación enzimática o el diagnóstico genético en la vellosidad corial o en las células del líquido amniótico16. El tratamiento hipouricemiante se puede realizar con inhibidores de la xantina oxidasa (figura 1), alopurinol, y debe pretender reducir la eliminación de ácido úrico por debajo de 10 mg/kg de peso/día o un cociente de ácido úrico/creatinina inferior a 1 y que la concentración sérica de uratos sea inferior a 7,0 mg/dl. Para cumplir este objetivo se emplean dosis de alopurinol de 5-10 mg/kg/día17. También es útil alcalinizar la orina con bicarbonato o citrato sódico. La inhibición de la síntesis de ácido úrico con alopurinol se acompaña en estos enfermos de un gran aumento de los niveles de hipoxantina y xantina y este último compuesto, muy insoluble, puede preci- pitar ocasionando litiasis renal. Para intentar evitar su aparición, deben realizarse determinaciones periódicas de los niveles de xantina en orina. En la mayor parte de los mamíferos, aunque no en el humano, la enzima uricasa o urato oxidasa transforma el ácido úrico en un compuesto muy soluble, la alantoína (figura 1). La rasburicasa es una uricasa purificada del hongo Aspergillus flavus, que se administra de forma intravenosa y reduce drásticamente la concentración de ácido úrico. En los pacientes con deficiencia de HPRT, su uso permite hacer descender las concentraciones de ácido úrico sin incrementar las concentraciones de xantina. Sin embargo, la aparición de anticuerpos, su forma de administración y su corta vida media (18 horas) son un inconveniente para el tratamiento crónico. No obstante, el tratamiento con rasburicasa puede ser efectivo a corto plazo en pacientes con deficiencia de HPRT e insuficiencia renal obstructiva aguda18. Para su uso en tratamientos prolongados se ha desarrollado una uricasa de mamífero, conjugada con poli-etilen-glicol o pegloticasa, que presenta una vida media mayor, por lo que puede administrarse intravenosamente cada dos semanas y ser una opción en pacientes con deficiencia de HPRT. Sin embargo, los ensayos realizados hasta el momento en pacientes gotosos muestran la aparición de anticuerpos tras inyecciones repetidas con pérdida del efecto hipouricemiante y reacción a la inyección. Otro posible tratamiento en el futuro son las inmunocilinas (BCX 4208) o inhibidores de la enzima purin nucleósido fosforilasa (PNP). Estos compuestos en fase de desarrollo son capaces, en tratamiento combinado junto a alopurinol, de disminuir los niveles de ácido úrico y de hipoxantina y xantina en orina. Al no conocerse la causa precisa de las manifestaciones neurológicas, no existe un tratamiento de estas. La distonía y la espasticidad pueden manejarse con benzodiazepinas o inhibidores del ácido gamma amino butírico como el baclofen. El tratamiento rehabilitador es fundamental y debe incluir el manejo de la disartria y la disfagia. El comportamiento automutilante debe ser tratado con una combinación de restricciones físicas, tratamiento farmacológico y tratamiento conductual. Las benzodiazepinas y la carbamazepina pueden ser útiles para atenuar las manifestaciones autolesivas y la ansiedad. El estrés aumenta las conductas autolesivas, por lo que se debe evitar cualquier situación que aumente la ansiedad y no deben emplearse las terapias aversivas. En algunos casos han sido útiles los tratamientos conductuales de extinción. Sin embargo, el trata101 Hiperuricemia y gota Riesgo renal y cardiovascular miento principal de esta conducta son las restricciones físicas para proteger a los pacientes de sí mismos. Por ejemplo, las férulas que limitan la movilidad del codo impiden la posibilidad de morderse los dedos y las guardas dentales impiden la mordedura de labios y encías. Los pacientes piden las restricciones y se muestras inquietos y nerviosos si se las retiran. Hiperuricemia por aumento de la degradación de nucleótidos. Síndrome de lisis tumoral La presencia de concentraciones elevadas de ácido úrico en el suero es frecuente en algunas enfermedades hematológicas con elevado recambio celular tales como las anemias hemolíticas, la anemia megaloblástica, y los trastornos mielo- y linfoproliferativos. Esta hiperuricemia constituye una complicación seria en el síndrome de lisis tumoral (SLT) que aparece a consecuencia de la lisis celular masiva, inmediatamente después de la instauración del tratamiento con quimioterapia o radioterapia, y en casos de leucemia o linfoma maligno. Este síndrome puede aparecer también de forma espontánea cuando el tumor sufre una necrosis isquémica por aporte sanguíneo insuficiente. El SLT consiste en hiperuricemia, hiperkaliemia, hiperfosfatemia e hipocalcemia. Estas alteraciones metabólicas conducen a la precipitación de cristales, sobre todo de ácido úrico, aunque también pueden desarrollarse cristales de fosfato cálcico y de xantina. Estos cristales precipitan en el túbulo renal y pueden ser causantes de un fracaso renal agudo. Las alteraciones metabólicas pueden ocasionar además convulsiones, fallo cardíaco y muerte. Son factores de riesgo para la aparición del síndrome, tras la instauración del tratamiento: la sensibilidad del tumor al tratamiento, una gran carga tumoral, el recambio celular acelerado y la invasión del tejido renal por el tumor. Actualmente las opciones terapéuticas son la administración de alopurinol oral o intravenoso, con o sin alcalinización de la orina y diuréticos, o bien el empleo de rasburicasa intravenosa sin alcalinización urinaria19-21. En los adultos se ha propuesto además un régimen combinado de rasburicasa intravenosa durante los días 1 a 3, seguido de alopurinol oral que comienza administrarse el tercer día. Cualquiera 102 que sea el tratamiento, debe procurarse una hidratación intravenosa adecuada. El alopurinol no elimina el ácido úrico preexistente y tarda entre 24 y 72 horas en disminuir la síntesis de nuevo ácido úrico. Por contra, la rasburicasa elimina el ácido úrico y lo convierte en alantoína, y tiene efecto a las 4 horas de su administración. Aunque el ácido úrico es más soluble en orina alcalina, la alcalinización puede causar precipitación de fosfato cálcico y xantina. El fósforo se elimina mejor en orinas ácidas, por lo que la alcalinización disminuye la eliminación renal de fósforo. En pacientes con hipocalcemia sintomática, puede administrarse gluconato cálcico, que además es el tratamiento coadyuvante de las arritmias inducidas por hiperkalemia. Sin embargo, su uso debe evitarse, si no es necesario, porque puede favorecer la precipitación de fosfato cálcico, sobre todo en pacientes con orinas alcalinas. La dosis recomendada de rasburicasa es 0,20 mg/ kg/día durante 3-5 días, administrada de forma intravenosa en 50 ml de suero salino fisiológico en 30 minutos. La rasburicasa se tolera bastante bien y el efecto secundario más peligroso es la anemia hemolítica y la metahemoglobinemia que aparece en pacientes con deficiencia congénita de glucosa 6 fosfato deshidrogenasa. Se han observado reacciones de hipersensibilidad en aproximadamente un 5 % de los pacientes tratados entre 1-17 minutos después de su administración. Puntos clave • Menos del 10 % de los sujetos con hiperuricemia evidencian, como trastorno fisiopatológico subyacente, un aumento de la producción de ácido úrico. • La deficiencia congénita de la actividad enzimática hipoxantina-guanina fosforribosiltransferasa cursa con hiperuricemia e hiperuricosuria acompañadas de un espectro continuo de manifestaciones neurológicas, que dependen de la gravedad del defecto enzimático. • Actualmente, las opciones terapéuticas del síndrome de lisis tumoral son la administración de alopurinol oral o intravenoso, con o sin alcalinización de la orina y diuréticos, o bien el empleo de rasburicasa intravenosa sin alcalinización urinaria. Sobreproducción de ácido úrico. Enfermedad de Lesch-Nyhan, trastornos mielo- y linfoproliferativos referencias Bibliográficas 1. Ichida K, Matsuo H, Takada T, Nakayama A, Murakami K, Shimizu T, et al. Decreased extrarenal urate excretion is a common cause of hyperuricemia. Nat Commun 2012;3:764. 2. Zoref E, de Vries A, Sperling O. X-linked pattern of inheritance of gout due to mutant feedbackresistant phosphoribosylpyrophosphate synthetase. Adv Exp Med Biol 1977;76A:287-92. 3. Sperling O, Boer P, Persky-Brosh S, Kanarek E, De Vries A. Altered kinetic property of erythrocyte phosphoribosylpsyrophosphate synthetase in excessive purine production. Rev Eur Etud Clin Biol 1972;17:703-6. 4. Becker MA, Raivio KO, Bakay B, Adams WB, Nyhan WL. Variant human phosphoribosylpyrophosphate synthetase altered in regulatory and catalytic functions. J Clin Invest 1980;65:109-20. 5. Becker MA, Puig JG, Mateos FA, Jiménez ML, Kim M, Simmonds HA. Inherited superactivity of phosphoribosylpyrophosphate synthetase: association of uric acid overproduction and sensorineural deafness. Am J Med 1988;85:38390. 6. García-Pavía P, Torres RJ, Rivero M, Ahmed M, GarcíaPuig J, Becker MA. Phosphoribosylpyrophosphate synthetase overactivity as a cause of uric acid overproduction in a young woman. Arthritis Rheum 2003;48:2036-41. 7. Akaoka I, Fujimori S, Kamatani N, Takeuchi F, Yano E, Nishida Y, et al. A gouty family with increased phosphoribosylpyrophosphate synthetase activity: case reports, familial studies, and kinetic studies of the abnormal enzyme. J Rheumatol 1981;8: 563-74. 8. Torres RJ, Mateos FA, Puig JG, Becker MA. Determination of phosphoribosylpyrophosphate synthetase activity in human cells by a nonisotopic, one step method. Clin Chim Acta 1996;245:105-12. 9. Becker MA, Taylor W, Smith PR, Ahmed M. Overexpression of the normal phosphoribosylpyrophosphate synthetase 1 isoform underlies catalytic superactivity of human phosphoribosylpyrophosphate synthetase. J Biol Chem 1996;271:19894-9. 10.Lesch M, Nyhan WL. A familial disorder of uric acid metabolism and central nervous system function. Am J Med 1964;36:561-70. 11.Jinnah HA, Visser JE, Harris JC, Verdu A, Larovere L, Ceballos-Picot I, et al.; Lesch-Nyhan Disease International Study Group. Delineation of the motor disorder of Lesch-Nyhan disease. Brain 2006;129:1201-17. 12.Jinnah HA, Ceballos-Picot I, Torres RJ, Visser JE, Schretlen DJ, Verdu A, et al.; for the LeschNyhan Disease International Study Group. Attenuated variants of Lesch-Nyhan disease. Brain 2010;133:671-89. 13.Puig JG, Torres RJ, Mateos FA, Ramos TH, Arcas JM, Buno AS, et al. The spectrum of hypoxanthineguanine phosphoribosyltransferase (HPRT) deficiency. Clinical experience based on 22 patients from 18 Spanish families. Medicine (Baltimore) 2001;80:102-12. 14.Torres RJ, Puig JG. Hypoxanthine-guanine phosphoribosyltransferase (HPRT) deficiency: Lesch Nyhan Syndrome. Orphanet J Rare Dis 2007;2:48. 15.García MG, Torres RJ, Prior C, Puig JG. Normal HPRT coding region in complete and partial HPRT deficiency. Mol Genet Metab 2008;94:167-72. 16.Torres RJ, Puig JG, Ceballos-Picot I. Clinical utility gene card for: Lesch-Nyhan syndrome. Eur J Hum Genet 2011;19:118-20. 17.Torres RJ, Prior C, Puig JG. Efficacy and safety of allopurinol in patients with hypoxanthineguanine phosphoribosyltransferase deficiency. Metabolism 2007;56:1179-86. 18.Roche A, Pérez-Dueñas B, Camacho JA, Torres RJ, Puig JG, García-Cazorla A, et al. Efficacy of rasburicase in hyperuricemia secondary to Lesch-Nyhan syndrome. Am J Kidney Dis 2009;53:677-80. 19.Goldman SC, Holcenberg JS, Finklestein JZ, Hutchinson R, Kreissman S, Johnson FL, et al. A randomized comparison between rasburicase and allopurinol in children with lymphoma or leukemia at high risk for tumor lysis. Blood 2001;97:2998-3003. 20.Cairo MS, Coiffier B, Reiter A, Younes A; TLS Expert Panel. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: an expert TLS panel consensus. Br J Haematol 2010;149:578-86. 21.Cortes J, Moore JO, Maziarz RT, Wetzler M, Craig M, Matous J, et al. Control of plasma uric acid in adults at risk for tumor Lysis syndrome: efficacy and safety of rasburicase alone and rasburicase followed by allopurinol compared with allopurinol alone- Results of a multicenter phase III study. J Clin Oncol 2010;28:4207-13. 103 METODOLOGÍA de A C R E D I TA C I Ó N Hiperuricemia y gota Riesgo renal y cardiovascular Es un programa de Formación Continuada acreditado por la Comisión de Formación Continuada del Sistema Nacional de Salud con 3,6 créditos. El test de evaluación está disponible en www.menarini.es y para realizarlo debe registrarse en ella. Consta de 39 preguntas de respuesta múltiple. Es necesario contestar correctamente el 85 % del total de preguntas para obtener el certificado de acreditación. 104 01_Portada.pdf 1 30/04/13 13:13 C M Y HIPERURICEMIA Y GOTA CM MY CY Riesgo renal y cardiovascular CMY K ADU-304 MAY’13 Coordinador: José Luño Avalado por: Sociedad Española de Nefrología 3,6 CRÉDITOS Nº expediente 09/07757-MD