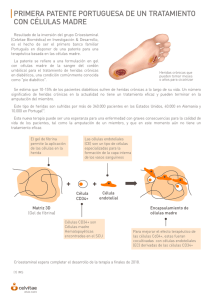
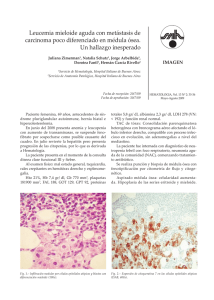
la actualidad, con FRCV (arritmia, DM tipo II en tratamiento con ADO
Anuncio

Pósteres la actualidad, con FRCV (arritmia, DM tipo II en tratamiento con ADO; exfumador). Desde hace años en tratamiento citorreductor con hidroxicarbamida y profilaxis antitrombótica con AAS 100; Acude a Dermatología en febrero 2012 por presentar múltiples lesiones queratósicas sobre base eritematosa localizadas en áreas fotoexpuestas que corresponden a queratosis actínicas sobre campo de cancerización, confirmadas histológicamente. Recibió múltiples tratamientos, como: Diclofenaco 3%, Ingenol mebutato, Imiquimod 5%, terapia fotodinámica con aminolevulinato de metilo hidrocloruro, con fracaso terapéutico de todos ellos. En enero de 2014 presenta un carcinoma espinocelular infiltrante en región malar tratado mediante extirpación. Tan solo al suspender el tratamiento con hidroxicarbamida (marzo de 2014) y cambio a Busulfan, fue posible el control de la enfermedad cutánea. Discusión: La displasia escamosa asociada a hidroxicarbamida incluye todo el espectro clínico comprendido entre queratosis actínicas refractarias a tratamiento y carcinomas espinocelulares de comportamiento particularmente agresivo. La hidroxicarbamida es transformada en radical libre nitróxido in vivo y entra en la célula mediante difusión pasiva parando el ciclo celular en fase S. Al suspender la replicación de ADN la hidroxiurea impide la reparación de mutaciones inducidas por la radiación ultravioleta que es más pronunciada en pacientes con fototipo I y II de Fitzpatrick, originando la aparición de lesiones. El periodo de latencia es de 2 a 13 años. La suspensión de la hidroxicarbamida suele inducir mejoría y/o regresión de las lesiones. La displasia escamosa a hidroxicarbamida es un efecto secundario cutáneo grave, del que existen pocas comunicaciones, y es indicación de suspensión de tratamiento. PO-113 CARACTERIZACIÓN MOLECULAR DE LOS PROGENITORES HEMATOPOYÉTICOS CD34+ EN PACIENTES CON NEOPLASIAS MIELOPROLIFERATIVAS EN TRATAMIENTO CON RUXOLITINIB Angona Figueras A., Álvarez-Larrán A., Bellosillo Paricio B., Longarón Rozalén R., Camacho Díaz L., Fernández Rodríguez M.C., Pairet García S., Martínez Avilés L., Ancochea Serra A., Senín Magán A., García Pallarols F., Torres Grande E., Besses Raebel C. Hospital del Mar. Barcelona Fundamentos y objetivos: El ruxolitinib es un inhibidor oral de JAK1 y JAK2, indicado en pacientes con mielofibrosis (MF). El ruxolitinib inhibe la vía de señalización celular activada por JAK2 independientemente de su estado mutacional. Su efecto en la carga mutacional JAK2V617F de los granulocitos es escaso. Se desconoce su acción sobre las células progenitoras CD34+. El objetivo del presente estudio fue analizar la evolución de la carga mutacional de JAK2V617F en las stem cells (CD34+/CD38-), en las células progenitoras (CD34+/CD38+) y en los granulocitos de los pacientes con neoplasias mieloproliferativas (NMP) en tratamiento con dicho fármaco. Pacientes y métodos: Se incluyeron 6 pacientes, 3 de ellos afectos de policitemia vera (PV) y 3 con MF (MF post PV n =2, MF post trombocitemia esencial n = 1), en tratamiento con ruxolitinib. Todos ellos habían recibido hidroxiurea previamente. Los granulocitos se aislaron de la sangre periférica mediante gradiente de densidad y las células CD34+ se purificaron a tra- vés de selección positiva inmunomagnética. Posteriormente las stem cells (CD34+/CD38-) y las células progenitoras (CD34+/ CD38+) se separaron mediante cell sorting. La carga alélica de JAK2V617F se monitorizó de forma prospectiva mediante PCR aleloespecífica en tiempo real en las 3 poblaciones, antes de iniciar el tratamiento con ruxolitinib, a los 6 y a los 12 meses. La dominancia clonal se definió como una diferencia absoluta = 10% de JAK2V617F entre los granulocitos y la población CD34+. La respuesta molecular se definió según los criterios de la European LeukemiaNet 2013 (ELN 2013). Resultados: Todos los pacientes que siguieron el tratamiento hasta los 12 meses presentaron una mejoría de la clínica constitucional y una disminución de la esplenomegalia. En la tabla 1 se muestran las carga alélicas de JAK2V617F en las 3 poblaciones a los 6 y 12 meses de tratamiento. En 3 pacientes demostramos dominancia clonal de JAK2V617F en las células progenitoras antes de iniciar el tratamiento y en dos de ellos se mantuvo durante el periodo del estudio. Asimismo, un paciente desarrolló dominancia clonal a los 12 meses del tratamiento. Los granulocitos fueron la población que presentó menor modificación de la carga mutacional de JAK2V617F durante el tratamiento con ruxolitinib sin que ningún paciente presentase respuesta molecular según los criterios ELN 2013. El compartimento de células progenitores CD34+/CD38+ fue en el que más se redujo la carga mutacional de JAK2V617F. Este hallazgo se observó en 4 de los 6 pacientes (66%) a los 6 meses de tratamiento. La carga mutacional de las stem cells (CD34+/CD38-) permaneció estable durante el tratamiento en todos los pacientes, incluidos aquellos que presentaban dominancia clonal de JAK2V617F previo al inicio de tratamiento. Conclusiones: El ruxolitinib tiene un escaso efecto sobre la carga mutacional de JAK2V617F de las stem cells, células progenitoras y granulocitos. Su efecto es más evidente a los 6 meses sobre las células progenitoras. Agradecimientos: 2014SGR/567, PI10/01807, PI13/00557, PI13/00393, RD12/0036/0010. Financiación: investigación auspiciada por la Fundación Española de Hematología y Hemoterapia. PO-114 CONCORDANCIA ENTRE LOS ÍNDICES PRONÓSTICOS CLÍNICOS (EUTOS, HASFORD, SOKAL) Y UTILIDAD PARA PREDECIR LA TRANSFORMACIÓN A CRISIS BLÁSTICA EN LMC: EXPERIENCIA EN NUESTRO CENTRO Redondo Velao S., Franco Villegas A.C., González Arias E., Pérez Sánchez I., Pérez Rus G., Escudero A., Osorio Prendes S., Díez-Martín J.L. Hospital General Universitario Gregorio Marañón. Madrid Fundamento y objetivo: En LMC disponemos de tres índices (scores) pronósticos que en ocasiones difieren entre ellos generando dificultades en la valoración de riesgo de los enfermos. Hemos analizado la correlación entre los tres y su utilidad para predecir la evolución a crisis blástica (CB). Pacientes y métodos: Hemos analizado retrospectivamente los pacientes adultos con LMC diagnosticados y tratados con inhibidores de tirosin-cinasa (ITK) en primera línea entre 20012014, con al menos 6 meses de seguimiento (N:61). I 453 I