UNIDAD II HIDROCARBUROS AROMÁTICOS
Anuncio

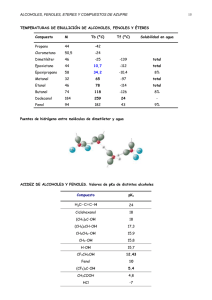
GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” UNIDAD II HIDROCARBUROS AROMÁTICOS COMPETENCIAS E INDICADORES DE DESEMPEÑO •Describe la estructura del benceno y de los hidrocarburos aromáticos en general. •Reconoce y describe comportamientos físicos y químicos de los aromáticos. •Utiliza las reglas de nomenclatura IUPAC para nombrar alcoholes, fenoles y éteres sencillos.Conoce algunas reacciones importantes de alcoholes, fenoles y éteres , analizando su comportamiento ante reactivos específicos para su reconocimiento. Química Unidad 2 ESTRUCTURA DEL BENCENO Undécimo 1 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” El benceno está formado por seis átomos de carbono y otros tantos de hidrógeno. La estructura correcta fue adelantada por el alemán Augusto Kekulé (1829-1896) y confirmada en época reciente por métodos de difracción de rayos X. Hidrocarburos Aromáticos y Policíclicos El concepto de aromaticidad - la gran estabilidad que presentan ciertos sistemas cíclicos altamente conjugados -puede extenderse más allá del benceno mismo o de bencenos sustituidos. Así pués, pueden presentar también aromaticidad moléculas que contienen dos o más anillos aromáticos fusionados y que se conocen como HIDROCARBUROS AROMÁTICOS POLICÍCLICOS (HAP). Los HAPs han estado presentes como contaminantes desde los inicios de la vida del hombre, ya que son compuestos naturales presentes en el medio ambiente. Sin embargo, el crecimiento industrial ha supuesto un aumento de gran número de contaminantes en el entorno natural, entre ellos los HAPs. La familia de los HAPs es un grupo de hidrocarburos que consisten en moléculas que contienen dos o más anillos aromáticos fusionados y como característica común presentan baja solubilidad en agua y elevada solubilidad en disolventes orgánicos. Su presencia en el medio ambiente puede deberse a diversas fuentes, tanto naturales como antropogénicas. Generalmente,los HAPs son producidos por combustión que puede ser natural (incendios forestales) o antropogénicos (combustión en automóviles).Algunos de los HAPs son de fabricación específica, como el naftaleno empleado como insecticida, pero su producción está en descenso al ser sustituido por compuestos clorados. Los HAPs pueden incorporarse al organismo por ingestión, inhalación o absorción dérmica .Como consecuencia de su baja solubilidad en agua y elevada en sustancias de naturaleza lipídica se acumulan en los organismos y en la materia orgánica y sedimentos, pudiendo permanecer así largos periodos de tiempo garantizando su biodisponibilidad .La lentitud con que son degradados estos compuestos provocan su acumulación en plantas, peces e invertebrados acuáticos y terrestres, incorporándose a la cadena alimentaria. Propiedades Físicas Como regla general ,la persistencia del compuesto aumenta al aumentar el tamaño de la molécula. Por ejemplo, la relativa baja persistencia del naftaleno y otros compuestos de bajo peso molecular indican su escasa capacidad de bioacumulación Mientras que los compuestos de mayor peso molecular, como el benzo[a]pireno, son altamente persistentes y por tanto bioacumulables. Así se ha observado que en sistemas acuáticos el benzo[a]pireno presenta una vida media superior a 300 semanas frente a las 5 semanas que presenta el naftaleno. Química Unidad 2 A temperatura ambiente los HAPs se encuentran normalmente en estado sólido. Las características comunes de estas sustancias son puntos de fusión y ebullición elevados, presión de vapor baja y solubilidad en agua muy baja ,la cual decrece al aumentar el peso molecular y tamaño de la molécula. Son solubles en disolventes orgánicos y por tanto, lipófilos. Así que son potencialmente bioacumulados y concentrados en sedimentos y suelos en función de su persistencia. Undécimo 2 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” Desde el punto de vista químico son bastante inertes. Las reacciones que pueden sufrir en un muestreo atmosférico e inducir así a pérdidas de HAPs son la fotodescomposición y las reacciones con óxidos de nitrógeno, óxidos de azufre, ácido nítrico ,ácido sulfúrico, ozono y radicales hidroxílo. La principal vía de degradación de estos compuestos incluye procesos químicos, fotolíticos o metabólicos asociados a microorganismos. En algunos casos se dan conjuntamente más de una, dependiendo de condicionantes como la temperatura, el oxígeno y microoganismos disponibles .Entre los procesos químicos se incluyen los tratamientos de cloración y ozonización del agua, entre los fotolíticos la acción conjunta de oxígeno y luz solar. La actividad de los microorganismos se desarrolla normalmente a través de un cometabolismo de los HAP`s con materia orgánica nutriente. Reacciones Químicas La reacción más importante de los compuestos aromáticos es la sustitución electrolífica aromática. Es decir la introducción de un electrófilo (E+), en el anillo bencénico. Seleccionando las condiciones y los reactivos apropiados, el anillo aromático se puede halogenar, nitrar, sulfonar, acilar y alquilar. Todas estas reacciones y muchas otras proceden a través de un mecanismo similar. La Halogenación Aromática El benceno es normalmente inerte en presencia de halógenos, debido a que los halógenos no son lo suficientemente electrófilos para destruir su aromaticidad. Sin embargo, los halógenos pueden activarse mediante ácidos de Lewis como los haluros de hierro, FeX3 o de aluminio, AlX3, para dar electrófilos más potentes. Mecanismo de la Bromación: 1) Activación del bromo por un ácido de Lewis (FeBr3) 3) El FeBr4- formado en la etapa anterior actúa ahora como base abstrayendo el protón del catión hexadienilo. Química Unidad 2 2) Ataque electrófilo sobre el benceno por bromo activado Undécimo 3 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” En resumen, la halogenación del benceno se hace más exotérmica al pasar del I2 (endotérmica) a F2 (explosiva). Las cloraciones y bromaciones se consiguen utilizando ácidos de Lewis como catalizadores que polarizan el enlace X-X y activan el halógeno aumentando su poder electrófilo. La Nitración Aromática Los anillos aromáticos se pueden nitrar por reacción con una mezcla de ácido nítrico y ácido sulfúrico concentrado. Se piensa que en ésta reacción el electrófilo es el ion nitronio, NO2+, que se genera a partir del ácido nítrico por protonación y pérdida de agua. La Sulfonación Aromática: El ácido sulfúrico concentrado no reacciona con el benceno a temperatura ambiente excepto por protonación. Sin embargo, una forma más reactiva, llamada “ácido sulfúrico fumante” da lugar a un ataque electrofílico por SO3. El ácido sulfúrico fumante comercial se prepara por adición de aproximadamente un 8% de trióxido de azufre (SO3), a ácido sulfúrico concentrado. El electrófilo reactivo es HSO3+ o SO3 neutro, dependiendo de las condiciones de reacción. Alquilación de Los Anillos Aromáticos: Reacción de Friedel-Crafts En 1877, Charles Friedel y James Crafts descubrieron que los haloalcanos reaccionan con benceno en presencia de cloruro de aluminio, para dar el producto de alquilación. La reacción de Friedel-Crafts es una sustitución electrofílica aromática en la cual el anillo aromático ataca a un carbocatión electrofílico. El carbocatión se genera cuando el catalizador AlCl3 ayuda al halogenuro de alquilo a ionizarse, de forma muy similar a como el FeBr3 cataliza las bromaciones aromáticas polarizando al bromo. ALCOHOLES, FENOLES Y ÉTERES Estructura Los fenoles son un grupo de compuestos orgánicos que presentan en su estructura un grupo funcional hidroxilo unido a un radical arilo. Por lo tanto, la fórmula general para un fenol se escribe como Ar – OH. Los fenoles se nombran, generalmente, como derivados del miembro más sencillo de la familia que es el fenol o hidroxibenceno. Para algunos fenoles, suelen emplearse nombres comunes como cresoles (metilfenoles), catecol (o-dihidroxibenceno), resorcinol (mdihidroxibenceno) e hidroquinona (p-dihidroxibenceno). Química Unidad 2 Los alcoholes son compuestos orgánicos oxigenados, que resultan de sustituir uno o más átomos de hidrógeno por grupos oxidrilo o hidroxilo (OH) en carbonos no aromáticos. Undécimo 4 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” El grupo funcional éter es – O – y la fórmula general es R – O – R’, donde R y R’ pueden ser radicales alquilos o arilos. Si estos son iguales, el éter es simétrico, cuando son distintos el éter es mixto. Nomenclatura Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH. Los fenoles tienen el mismo grupo funcional, pero unido a un anillo aromático Ar -OH. Los éteres tienen de formula general R - O - R', donde R y R' pueden ser grupos idénticos o diferentes y pueden ser grupos alquilo o arilo. Nomenclatura de Alcoholes. Los alcoholes, al igual que los halogenuros de alquilo, se clasifican o dividen en primarios, secundarios y terciarios, según el número de grupos hidrocarbonados unidos al átomo de carbono al que va enlazado el grupo hidroxilo. En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol. Ejemplos: CH3 – OH Alcohol Metílico CH3 - CH - OH CH3 Alcohol isopropílico El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas: 1. Se busca la cadena más larga que incluya el grupo hidroxilo. La terminación o del hidrocarburo se cambia por -ol. 2. La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc. 3. Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador. Nomenclatura de fenoles. Para nombrar los fenoles se utiliza, como en los alcoholes el sufijo -ol al nombre del hidrocarburo aromático. Los fenoles se nombran con mayor frecuencia como derivados del fenol. Los otros sustituyentes del anillo se localizan con un número o mediante los prefijos orto, meta, para. El grupo hidroxilo también se nombra como sustituyente cuando se encuentra presente en la misma molécula un ácido carboxílico, un aldehido o alguna cetona, ya que tienen prioridad en la nomenclatura. En el caso de éteres con estructuras más complejas, se nombra según la IUPAC considerando que uno de los radicales (el mayor si se trata de un éter asimétrico) es un hidrocarburo que lleva como sustituyente el grupo alquilo pequeño con el oxigeno, al que se denomina grupo alcoxi. Química Unidad 2 Nomenclatura de Eteres: Los éteres se denominan generalmente con el nombre de cada uno de los grupos alquilo o arilo, en orden alfabético, seguidos de la palabra eter. Undécimo 5 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” Propiedades Físicas y Químicas Los Alcoholes Son líquidos o sólidos neutros. El grupo hidroxilo confiere características polares al alcohol y según la proporción entre él y la cadena hidrocarbonada así será su solubilidad. Los alcoholes inferiores son muy solubles en agua, pero ésta solubilidad disminuye al aumentar el tamaño del grupo alquilo y aumenta en los solventes orgánicos. Las diferentes formas geométricas de los alcoholes isómeros influyen en las diferencias de solubilidad en agua. Las moléculas muy compactas del alcohol ter-butílico experimentan atracciones intermoleculares débiles y las moléculas de agua las rodean con más facilidad. Consecuentemente, el alcohol ter-butílico exhibe la mayor solubilidad en agua de todos sus isómeros. Reacción como bases El grupo hidroxilo de los alcoholes puede ser reemplazado por diversos aniones ácidos reaccionando, por lo tanto, como una base según la ecuación general siguiente, en la que se obtiene un haluro de alquilo como producto La reacción se inicia con la formación del ión oxonio mediante la protonación del alcohol con el ión hidrógeno liberado por el ácido. Propiedades Químicas Reacción como ácidos La reacción directa de un alcohol con los metales de los grupos IA y IIA de la tabla periódica, permite sustituir el hidrógeno del grupo hidroxilo, a pesar de su carácter neutro y su no disociación en solución acuosa, de la siguiente manera: R - OH + M R - O - M + 1/2 H 2 (g) Se obtienen bases muy fuertes llamadas alcóxidos como etóxido de sodio, CH3CH2 O – Na, o metóxido de magnesio, (CH3O)2Mg. El orden de basicidad de los alcóxidos es: R3CO _ > R2CHO _ > RCH2O _ > CH3O _ Por lo tanto, la reactividad de los alcoholes frente a los metales es: CH3OH > 1º > 2º > 3º Química Unidad 2 Esta diferencia en la velocidad de reacción permite diferenciar alcoholes primarios, secundarios y terciarios Undécimo 6 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” Fenoles Propiedades físicas de los fenoles Los fenoles sencillos son líquidos o sólidos, de olor característico, poco hidrosolubles y muy solubles en solventes orgánicos. Algunos se usan como desinfectantes, pero son tóxicos e irritantes. Propiedades químicas de los fenoles Los fenoles son más ácidos que el agua y los alcoholes, debido a la estabilidad por resonancia del ión fenóxido. El efecto de esta resonancia consiste en la distribución de la carga del anión sobre toda la molécula en lugar de estar concentrada sobre un átomo particular, como ocurre en el caso de los aniones alcóxido. Éteres Los éteres son inertes frente a la mayoría de los reactivos que atacan a los alcoholes, debido a que carecen del grupo hidroxilo responsable de la actividad química de éstos. Uso y Aplicaciones Usos de Alcoholes Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Aplicaciones Debido a sus debilidad como tensioactivos, no se emplean como tales si no es en presencia de otro surfactante de mejores propiedades. Por tanto, su principal uso es como estabilizantes de emulsiones, opacificantes, espesantes o espumantes, según la concentración. Usos y Aplicaciones de Los Fenoles La principal aplicación del fenol es la fabricación de resina fenol-formaldehídica. El segundo derivado en importancia es la caprolactama. También puede condensarse con acetona para obtener difenol, el cual reacciona con epiclorhidrina para dar policarbonatos y con diversas sulfonas complejas para dar resinas polisulfónicas. El fenol puede alquilarse con trímero de propileno (o con otras olefinas) par dar p-nonilfenol para conversión a detergentes, ya sea por sulfonación e etoxilación. Además, el nonilfenol constituye la base para oxidantes de hules y plásticos. Otros alquilfenoles se usan para la formación de resinas fenólicas. El fenol también se emplea como materia prima para obtener el herbicida ácido 2, 4-diclorofenoxiacético. Química Unidad 2 El fenol se utiliza para la preparación de resinas sintéticas, colorantes, medicamentos, plaguicidas, curtientes sintéticos, sustancias aromáticas, aceites lubricantes y solventes. Undécimo 7 GIMNASIO VIRTUAL SAN FRANCISCO JAVIER “Valores y Tecnología para la Formación Integral del Ser Humano” El fenol se usa también en la producción de resinas fenólicas. También se usa en la manufactura de nylon y otras fibras sintéticas. El fenol es muy utilizado en la industria química, farmacéutica y clínica como un potente fungicida, bactericida, antiséptico y desinfectante, también para producir agroquímicos, policarbonatos, en el proceso de fabricación de ácido acetilsalicílico o aspirina y en preparaciones médicas como enjuagadientes y pastillas para el dolor de garganta. Uso y Aplicaciones de Los Éteres Química Unidad 2 El éter es uno de los disolventes orgánicos más importantes y se usa con frecuencia en el laboratorio como disolvente de grasas, aceites, resinas y alcaloides, entre otros compuestos. La mezcla de vapor de éter y aire es muy explosiva; además, con el tiempo el éter puede oxidarse parcialmente formando un peróxido explosivo. Por lo tanto, el éter debe almacenarse y manejarse con mucho cuidado. Se usa principalmente como disolvente, como materia prima para fabricar productos químicos y como anestésico Undécimo 8