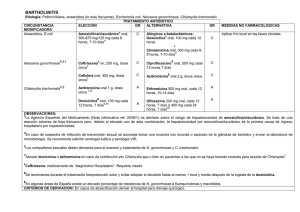
prevalencia de chlamydia trachomatis en mujeres que utilizan
Anuncio

PREVALENCIA DE CHLAMYDIA TRACHOMATIS EN MUJERES QUE UTILIZAN DISPOSITIVO INTRAUTERINO (DIU) EN EDAD FÉRTIL DE 15 A 49 AÑOS DE EDAD. CENTRO DE SALUD NORTE DE LA POLICIA NACIONAL DE QUITO, MAYO–AGOSTO 2013 Dra. Norma Jacqueline Vaca Acurio UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS MÉDICAS INSTITUTO SUPERIOR DE POSTGRADO POSTGRADO DE GINECOLOGIA Y OBSTETRICIA Quito, Julio 3, 2014 ii PREVALENCIA DE CHLAMYDIA TRACHOMATIS EN MUJERES QUE UTILIZAN DISPOSITIVO INTRAUTERINO (DIU) EN EDAD FÉRTIL DE 15 A 49 AÑOS DE EDAD. CENTRO DE SALUD NORTE DE LA POLICIA NACIONAL DE QUITO, MAYO-AGOSTO 2013 Dra. Norma Jacqueline Vaca Acurio Tesis de Grado presentado como requisito parcial para optar el Título de Especialista en Ginecología y Obstetricia Director de tesis: Dr. Andrés Gonzalo Calle Miñaca. MD. Msc. Asesor Metodológico: Dra. Silvia Jéssica Guarderas Muñoz Quito, Julio 3, 2014 iii FORMULARIO DE AUTORIZACIÓN REPOSITORIO INSTITUCIONAL DE PUBLICACIÓN EN EL iv APROBACIÓN DEL TUTOR v DEDICATORIA A Dios creador del universo Que con su infinito amor y bondad Permitió culminar Este trabajo de investigación A mis padres, esposo e hijos Que son el pilar fundamental De mi vida. Norma vi AGRADECIMIENTO Agradezco a Dios por el apoyo brindado en cada momento de mi vida y por guiar mi camino con amor y sabiduría. Al “Hospital Gíneco-Obstétrico Isidro Ayora”, Centro de Salud Norte de la Policía Nacional, Instituto Superior de Postgrado de la Facultad de Ciencias Médicas de la Universidad Central del Ecuador. Reconocimiento muy especial a mis Maestros, Coordinador del Postgrado, Director de Tesis, Asesora Metodológica, y a todos aquellos que me brindaron sus conocimientos y valiosa ayuda. Norma vii APROBACIÓN DEL TRABAJO “Prevalencia de chlamydia trachomatis en mujeres que utilizan dispositivo intrauterino (DIU) en edad fértil de 15 a 49 años de edad. Centro de Salud Norte de la Policía Nacional de Quito, Mayo-Agosto 2013” El Tribunal constituido por: Presidente del Tribunal: Dr. Walter Moya Delegado de Tribunal: Dr. Enrique Noboa Delegado de Tribunal: Dr. Armando Camino Luego de receptar la presentación del trabajo de grado previo a la obtención del Título de Ginecología y Obstetricia, presentado por la Dra. Norma Vaca Acurio, con el título: “Prevalencia de chlamydia trachomatis en mujeres que utilizan dispositivo intrauterino (DIU) en edad fértil de 15 a 49 años de edad. Centro de Salud Norte de la Policía Nacional de Quito, Mayo-Agosto 2013” Se ha emitido el siguiente veredicto: …………………………………… Quito, julio 3, 2014 Para constancia de lo actuado viii INDICE FORMULARIO DE AUTORIZACIÓN DE PUBLICACIÓN EN EL REPOSITORIO INSTITUCIONAL ................................................................................................ iii APROBACIÓN DEL TUTOR .............................................................................. iv DEDICATORIA ................................................................................................... v AGRADECIMIENTO ........................................................................................... vi APROBACIÓN DEL TRABAJO ......................................................................... vii RESUMEN......................................................................................................... xii ABSTRACT ...................................................................................................... xiii INTRODUCCIÓN ................................................................................................ 1 CAPITULO I........................................................................................................ 3 PLANTEAMIENTO DEL PROBLEMA ............................................................. 3 1.1 DESCRIPCION DEL PROBLEMA ............................................................. 3 1.2 ENUNCIADO DEL PROBLEMA ................................................................ 4 1.3 DELIMITACION DEL PROBLEMA ............................................................ 4 1.4 HIPÓTESIS ............................................................................................... 5 1.5. OBJETIVOS ............................................................................................. 5 GENERAL ....................................................................................................... 5 ESPECÍFICOS ................................................................................................ 5 1.6 JUSTIFICACIÓN ....................................................................................... 5 CAPITULO II ....................................................................................................... 8 2.1 ANTECEDENTES DE LA INVESTIGACIÓN ............................................. 8 2.2 MARCO TEÓRICO.................................................................................... 9 2.2.1 FUNDAMENTACION TEORICA O BASES TEORICAS ...................... 9 2.2.2 ANATOMOFISIOLOGIA DEL APARATO GENITAL FEMENINO ...... 10 a) ÓRGANOS GENITALES INTERNOS ............................................... 10 b) ORGANOS GENITALES EXTERNOS .............................................. 19 2.3 CHLAMYDIA TRACHOMATIS ................................................................ 22 2.4 EPIDEMIOLOGIA ................................................................................... 23 2.5 MECANISMO DE INFECCIÓN ............................................................... 26 2.6 PERÍODO DE INCUBACION .................................................................. 27 2.7 INMUNOGENICIDAD ............................................................................. 27 2.8 FACTORES PREDISPONENTES .......................................................... 29 2.8.1 DIU COMO FACTOR DE RIESGO .................................................. 29 2.9 MANIFESTACIONES CLINICAS. ........................................................... 32 2.10 INFECCIONES EN EL HOMBRE ......................................................... 34 ix 2.11 INFECCIONES EN LA MUJER ......................................................... 36 2.12 DIAGNOSTICO ..................................................................................... 40 2.13 ASPECTOS TERAPEUTICOS ............................................................. 45 2.14 PREVENCIÓN ...................................................................................... 47 2.15 VALIDACION Y ESTANDARIZACIÓN ................................................. 47 2.15.1 TÉCNICA DE VALORACIÓN DE LAS PRUEBAS SANGUÍNEAS . 48 2.15.2 LUGARES DE EXTRACCIÓN ....................................................... 48 CAPITULO III ................................................................................................... 54 METODOLOGÍA............................................................................................... 54 3.1 DISEÑO .............................................................................................. 54 3.3 OPERACIONALIZACIÓN DE LAS VARIABLES ................................... 55 3.4 POBLACIÓN Y MUESTRA ..................................................................... 56 3.5 CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN ....................................... 57 3.5.1 CRITERIOS DE INCLUSIÓN ......................................................... 57 3.5.2 CRITERIOS DE EXCLUSIÓN ........................................................ 57 3.6 INSTRUMENTOS ................................................................................ 57 3.6.1 IgA ANTI CHLAMYDIA TRACHOMATIS .......................................... 58 3.6.2 HOJA DE RECOLECCIÓN DE DATOS ......................................... 58 3.7 PROCEDIMIENTO.................................................................................. 58 3.8 ANÁLISIS DE LOS DATOS. .............................................................. 59 3.9 CONSIDERACIONES ÉTICAS ............................................................... 60 3.10 ............................................................................................................... 60 LIMITACIONES ............................................................................................ 60 CAPITULO IV ................................................................................................... 61 ANALISIS E INTERPRETACIÓN DE RESULTADOS .................................. 61 CAPITULO V .................................................................................................. 76 CONCLUSIONES Y RECOMENDACIONES ................................................... 76 CONCLUSIONES ......................................................................................... 76 RECOMENDACIONES ................................................................................. 78 BIBLIOGRAFÍA ................................................................................................ 80 ANEXOS .......................................................................................................... 87 ANEXO A HOJA FRONTAL DE RECOLECCIÓN DE DATOS ..................... 88 ANEXO B CONSENTIMIENTO INFORMADO .............................................. 89 CURRICULUM VITAE ...................................................................................... 91 Norma Jacqueline Vaca Acurio..................................................................... 91 x INDICE DE GRAFICOS Gráfico No. 1 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” por uso de DIU según la edad. CSN-PN. mayo-agosto del 2013 ......................................................................................................................... 61 Gráfico No. 2 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU según el número de compañeros sexuales. CSN-PN. mayo- agosto 2013 .......................................................................... 63 Gráfico No. 3 “Prevalencia de Chlamydia Trachomatis” por uso de DIU según determinaciones de Inmunoglobulina A. CSN-PN. mayo-agosto 2013 ........... 65 Gráfico No. 4 distribución de mujeres del estudio “prevalencia de chlamydia trachomatis” por uso de DIU según grupos por edad. CSN-PN. mayo-agosto 2013 ................................................................................................................. 66 Gráfico No. 5 Distribución de las mujeres del estudio “Prevalencia de Chlamydia Trachomatis” por uso de DIU según el número de compañeros sexuales. CSN-PN. mayo-agosto 2013 ............................................................ 68 xi INDICE DE TABLAS Tabla 1 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU por edad de inicio de vida sexual activa. CSNPN. mayo-agosto 2013 ..................................................................................... 62 Tabla 2 Distribución de mujeres del estudio “prevalencia de Chlamydia Trachomatis” que utilizan DIU según el tiempo de uso del dispositivo intrauterino. CSN-PN. mayo-agosto 2013 ....................................................... 64 Tabla 3 Distribución de las mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU por edad de inicio de vida sexual. CSN-PN. mayo-agosto 2013............................................................................................ 67 xii UNIVERSIDAD CENTRAL DEL ECUADOR INSTITUTO SUPERIOR DE POSTGRADO POSTGRADO DE GINECOLOGÍA Y OBSTETRICIA “Prevalencia de Chlamydia Trachomatis en mujeres que utilizan Dispositivo Intrauterino (DIU) en edad fértil de 15 a 49 años de edad. Centro de Salud Norte de la Policía Nacional de Quito, Mayo-Agosto 2013” Autora: Dra. Norma J. Vaca Acurio. Tutor: Dr. Andrés Calle M. MD. MSc. Julio 3,2014 RESUMEN La infección por Chlamydia Trachomatis es una infección de transmisión sexual (ITS) frecuente de origen bacteriano, causada por la bacteria Chlamydia Trachomatis que afecta a los órganos genitales de mujeres y varones. La prevalencia de Chlamydia trachomatis en diversos estudios varía del 3 al 5 por ciento en mujeres asintomáticas que asisten a clínicas de planificación familiar, aumentando a cifras mayores del 20 por ciento en las clínicas de ITS. Algunos Autores la encuentran en 20-35% de las infecciones agudas. Las maniobras intrauterinas pueden ser el punto de partida de las infecciones, consecutiva a la colocación del dispositivo intrauterino. En el Ecuador se desconoce estos datos, en nuestro medio su diagnóstico se basa fundamentalmente en las manifestaciones clínicas, estrategia que presenta muchas limitaciones en casos de una alta tasa de infecciones asintomáticas, por tal motivo se desconoce la verdadera prevalencia. Objetivo: Determinar la prevalencia de Chlamydia Trachomatis en pacientes que acuden a control de planificación familiar al Centro de Salud Norte de la Policía Nacional y establecer si el Dispositivo Intrauterino fue un factor desencadenante para la infección, abriendo nuevas hipótesis etiológicas y realizar más investigaciones básicas y epidemiológicas sobre las causas y la manera más adecuada para la prevención. Metodología: Previo consentimiento informado se realizó un estudio epidemiológico transversal en 210 mujeres, que acudieron al Centro de Salud Norte de la Policía Nacional a control de planificación familiar entre mayo y agosto del 2013, se realizaron determinaciones sanguíneas por micro ELISA de anticuerpo específico de Chlamydia Trachomatis IgA para conocer su presencia o ausencia. El análisis univariado descriptivo, seguido del análisis bivariado en el programa estadístico Epi Info VO.604 CD Atlanta, con un valor de “p” estadísticamente significativo si es ≤ 0,05. Resultados: En la población estudiada la prevalencia fue del 18.1%, constituyéndose el uso del Dispositivo Intrauterino en un factor desencadenante de las infecciones por Chlamydia Trachomatis en mujeres que realizan planificación familiar. Las determinaciones de IgA para Chlamydia Trachomatis, fueron comparables en relación a la edad, al tiempo de uso del DIU, inicio de vida sexual y número de compañeros sexuales. Palabras Claves: prevalencia, chlamydia trachomatis, dispositivo intrauterino, inmunoglobulina A. xiii ABSTRACT Chlamydia trachomatis is a common sexually transmitted disease (STD) frequently by bacteria, caused by the bacterium Chlamydia trachomatis which affects the genitals of women and men. Its importance lies in the magnitude of the spread of this disease, the peculiar characteristics of its clinical presentation and complications that may arise because of a lack of diagnosis or treatment, or both. The prevalence of Chlamydia trachomatis in different studies varies from 3 to 5 percent in asymptomatic women attending family planning clinics, increasing to higher figures of 20 percent in STD clinics. Some authors are in the 20-35 % of acute infections. Intrauterine maneuvers can be the starting point of the infections, consecutive placement of intrauterine devices. In Ecuador this data is unknown in our diagnosis is mainly based on clinical manifestations, that strategy has its limitations in cases of a high rate of asymptomatic infections, as such the true prevalence is unknown. Objective: To determine the prevalence of Chlamydia trachomatis in patients attending family planning Control Center Northern Health and the National Police to establish whether the IUD was a triggering factor for infection , opening new etiological hypotheses and conduct more basic research and epidemiological about the causes and the best way for prevention. Methodology: Prior informed consent a transverse epidemiological in 210 women who attended the Centre North of the National Police to control family planning between April and August 2013 Health was conducted by micro ELISA specific antibody blood tests were performed Chlamydia trachomatis IgA for their presence or absence. The descriptive univariate analysis, followed by bivariate in Epi Info VO. 604 CD Atlanta, with a significant value of "p" statistically ≤ 0.05 if analysis. Results: In the study population the prevalence was 18.1 %, being the use of the IUD in a trigger for Chlamydia trachomatis infections in women doing family planning factor. Determinations for Chlamydia trachomatis IgA were comparable in relation to time of IUD use, first intercourse and number of sexual partners. Key words: prevalence, immunoglobulin chlamydia trachomatis, intrauterine device, A. INTRODUCCIÓN Durante décadas, el principal método anticonceptivo en el Ecuador fue la píldora anticonceptiva y alrededor del mundo lo utilizaron unas 100 millones de mujeres, siendo el método preventivo más efectivo para evitar un embarazo (Rolla E. 2008) Hoy en día, las mujeres utilizan otros métodos, muchas veces llevadas por la necesidad de utilizar otro anticonceptivo que no tenga efectos secundarios como el parche transdérmico o el anillo vaginal, con la desventaja de que tienen 20 veces más probabilidades (Rolla E. 2008) de resultar con un embarazo no deseado que aquéllas, mientras que el Dispositivo Intrauterino es más seguro, sin duda, las inflamaciones genitales por varios gérmenes, causada con bastante frecuencia por la Neisseria Gonorreae o por la Chlamydia Trachomatis constituyen la complicación más grave que puede llegar a padecer una mujer portadora de DIU, se han descrito casos de muerte por inflamaciones pelvianas atribuibles a dispositivos intrauterinos. La infección por Chlamydia es una infección de transmisión sexual (ITS) frecuente, causada por la bacteria Chlamydia Trachomatis, que puede afectar los órganos genitales de la mujer. Su importancia radica en la magnitud de la diseminación de esta infección, las características peculiares de su presentación clínica y las complicaciones que pueden surgir a causa de una falta de diagnóstico o tratamiento o de ambos. (Handsfield, H. 2002) El espectro de las manifestaciones clínicas de las infecciones causada por Chlamydia Trachomatis en la mujer incluye cervicitis, síndrome uretral agudo, enfermedad inflamatoria pélvica (EPI). Aunque generalmente la infección por chlamydia no presenta síntomas o se manifiesta con síntomas leves, hay complicaciones graves que pueden ocurrir “en forma silenciosa” y causar daños irreversibles, como la infertilidad, de allí que se requiere de exámenes de laboratorio 1 especiales para realizar el correspondiente diagnóstico de la enfermedad. (Smith, J. 2004) En la mujer en edad fértil, la infección por Chlamydia Trachomatis constituye un problema en salud pública debido a la relativa dificultad para establecer su diagnóstico, porque la infección puede ocurrir aún en ausencia de manifestaciones clínicas, sospechándose de la misma por los síntomas que pueden aparecer generalmente entre 1 y 3 semanas después del contagio, historia sexual, número de compañeros sexuales y métodos de planificación familiar. (Schaechter M. 2004). Este estudio se realizó con el objeto de establecer la prevalencia de infección por Chlamydia Trachomatis en una población de mujeres en edad fértil de vida sexual activa que utilizan Dispositivo intrauterino mediante examen inmunológico en suero detectándose la presencia de anticuerpos específicos del tipo IgA contra Chlamydia Trachomatis mediante ELISA. La prevalencia de C. trachomatis en diversos estudios varía del 3 al 5% en mujeres asintomáticas que asisten a clínicas de planificación familiar, aumentando a cifras mayores del 20% en las clínicas de ITS. La OMS reporta una prevalencia global del 4.4% al 6.6%, en EE.UU. del 3 al 11%, en Europa del 2 al 9% y en América Latina del 6 al 40%, según las series estudiadas. (Zemilman J. 2006). El riesgo de ITS en mujeres portadoras de DIU es de 7 a 9 veces mayor que la población general (Bucheli Terán R.1977), relacionándose con el número de parejas sexuales, antecedentes de ITS. Sin embargo el realizar control de la natalidad con DIU puede contribuir a incrementar el riesgo de Infección genital por Chlamydia Trachomatis. (Infante N. et al 2005). 2 CAPITULO I PLANTEAMIENTO DEL PROBLEMA 1.1 DESCRIPCION DEL PROBLEMA Pese a que en el actual siglo XXI las infecciones vulvovaginales alcanzan niveles elevados originadas por la Chlamydia Trachomatis como único agente causal o asociado con otros microorganismos patógenos, no existen estudios suficientes realizados en nuestro medio para identificar este microorganismo en asociación con el uso de dispositivos intrauterinos (DIU), tal vez porque hacer dichas pruebas de detección implica alto costo en su estudio. De acuerdo a la Organización Mundial de la Salud (OMS), este tipo de infección puede ser asintomática en un 85% de los casos y se mantiene como la causante principal de enfermedad inflamatoria pélvica, uretritis e infertilidad. Además es terreno fértil para adquirir una infección mortal como lo es el VIH. (Corbeto E. et al 2011). Este cuadro clínico silente o inespecífico obliga al uso de otro tipo de métodos para la detección de la enfermedad, siendo necesario el uso de pruebas de laboratorio para el diagnóstico. Actualmente se utilizan muestras uretrales, cervicales y de orina para cultivos o la detección de antígenos por diferentes técnicas inmunológicas, análisis de sonda génica amplificada (AMP), detección de anticuerpos séricos, reacción en cadena de la ligasa (LCR) y reacción en cadena de la polimerasa (PCR). (Arango A I. 2001). Pero relacionar la Chlamydia Trachomatis con el uso de dispositivos intrauterinos (DIU) es un estudio que no se ha realizado en nuestro medio, puesto que no se ha demostrado si hay la prevalencia en mujeres que están o han utilizado este método anticonceptivo. 3 Si bien es cierto, existen muchas mujeres que utilizan el DIU para el control de la natalidad, son las mujeres casadas y que ya tienen hijos las que lo utilizan en mayor grado, pero en menor proporción es también utilizado por mujeres jóvenes que lo mantienen como método anticonceptivo. Este es el caso que se presenta en el Centro de Salud Norte de la Policía Nacional de Quito, observado por la investigadora. Existe una conexión entre el uso del dispositivo DIU y la mayor prevalencia de la Chlamydia Trachomatis, dato que se obtuvo del presente estudio, debiéndose monitorear en las poblaciones más afectadas para valorar la pertinencia y proponer programas de cribado en el entorno afectado. De no hacerlo, se correrá el riesgo de tener una enfermedad pandémica expansiva en la población femenina que utiliza el DIU, causando un malestar en salud pública y siendo necesario mantener un presupuesto Institucional alto que cubra el tratamiento y recuperación de las usuarias, además de los efectos adversos que puede ocasionar si la paciente está en estado gravidez. 1.2 ENUNCIADO DEL PROBLEMA ¿Será que la prevalencia de Chlamydia Trachomatis es alta en mujeres que acuden al Centro de Salud Norte de la Policía Nacional de Quito en los meses mayo-agosto del 2013 y dependerá del uso del Dispositivo Intrauterino (DIU) y guardará relación con la edad, tiempo del uso del DIU, el inicio de vida sexual y el número de compañeros sexuales? 1.3 DELIMITACION DEL PROBLEMA La presente investigación se realizará en el Centro de Salud Norte de la Policía Nacional de la ciudad de Quito, en pacientes que acuden al Servicio de Ginecología a control de planificación familiar, en el período comprendido entre los meses de mayo, junio, julio y agosto del año 2013. 4 1.4 HIPÓTESIS La prevalencia de Chlamydia Trachomatis en mujeres que asisten al Centro de Salud Norte de la Policía Nacional será alta y dependerá del uso del Dispositivo Intrauterino y guardará relación con la edad, el tiempo del uso del DIU, el inicio de vida sexual y el número de compañeros sexuales. 1.5. OBJETIVOS GENERAL Determinar la prevalencia de Chlamydia Trachomatis en mujeres portadoras de DIU, que asisten al Centro de Salud Norte de la Policía Nacional al Servicio de Ginecología en los meses de mayo, junio, julio y agosto del año 2013. ESPECÍFICOS 1. Determinar la prevalencia de Chlamydia Trachomatis en relación a la edad de las mujeres. 2. Establecer la prevalencia de Chlamydia Trachomatis en relación al inicio de la vida sexual de las mujeres. 3. Determinar la prevalencia de Chlamydia Trachomatis en relación al número de compañeros sexuales. 4. Establecer la prevalencia de Chlamydia Trachomatis de las mujeres en relación al tiempo del uso del dispositivo intrauterino. 5. Establecer la prevalencia de Chlamydia Trachomatis a través de determinaciones sanguíneas de IgA. 1.6 JUSTIFICACIÓN La infección por chlamydia, la más común de todas las infecciones de transmisión sexual puede afectar tanto a hombres como a mujeres. Las infecciones de transmisión sexual están en aumento, posiblemente debido a la mayor libertad y actividad sexual de las personas con múltiples parejas sexuales durante su vida. 5 Desafortunadamente muchas personas con infección por Chlamydia tienen poco o ningún síntoma de infección. Las complicaciones más comunes y graves ocurren en las mujeres e incluyen Enfermedad Inflamatoria Pélvica, Embarazo Ectópico e infertilidad. Las mujeres sufren síntomas más frecuentes y más grave que los hombres. Las infecciones por Chlamydia en mujeres también pueden asociarse con Ca. Cervical. (De Lucena, Oliveira M. 2008). Chlamydia trachomatis es el patógeno más prevalente en las ITS en el mundo occidental, y es el agente etiológico que subclínicamente se diagnostica. En los EE.UU se estima cada año 4 millones de nuevos casos y 50.000 mujeres quedan infértiles por la infección de chlamydia. trachomatis. Aunque la uretritis no gonocócica (UNG) no es debida solamente a chlamydia, se le atribuyen en los países Europeos y en EE.UU ser la causa de un 50% de UNG y responsable de un 45% de los casos de epidídimo-orquitis agudas. Se calcula que un 7% de los hombres asintomáticos se les puede detectar C. Trachomatis. En contraste las mujeres son más asintomáticas que los hombres, con un 14%, se calculó que el riesgo de infección es pequeño con un 3% cuando se tiene en el caso de las mujeres, un solo compañero sexual, pero significativamente más grande (33%) cuando se tiene 2 ó más compañeros sexuales en un mes. Respecto al impacto económico de la infección por C. trachomatis, se calcula que los costos directos e indirectos en EE.UU se acercan a los 2.4 billones de dólares (Arango A I. 2001). La prevalencia de la infección por chlamidia varía de acuerdo a la edad, historia sexual y clase social. En mujeres jóvenes con cervicitis se ha estimado que un 28% de este grupo pueden desarrollar complicaciones como la enfermedad pélvica inflamatoria. En Europa en las mujeres que optan por la planificación familiar también se ha encontrado una prevalencia de chlamydia en un 9%, y entre un 2.2% - 8.2% en 6 mujeres previas a la inserción de DIU. Por lo tanto se requiere un análisis de detección de antígenos de chlamydia trachomatis antes de implantar el DIU (Fuenzalida D. 2011) Basándose en los datos obtenidos publicados por el INEC en el año 2012 se reportaron 19 casos de infecciones por Chlamydia, cifra que se puede atribuir a la naturaleza asintomática de la infección y a la escasa cobertura diagnóstica existente en el País. Por lo antes dicho, es pertinente para la investigadora cumplir con su juramento hipocrático, de velar por la salud de la humanidad, esta temática es realmente importante para educar a la mujer en el cuidado y protección de su salud sexual con la finalidad de evitar complicaciones, por tanto el estudio a realizarse tiene una alta relevancia para la salud de nuestros jóvenes y en general para las mujeres que asisten a la consulta en el Centro de Salud Norte de la Policía Nacional. Siendo que la investigadora labora en el Centro antes mencionado, existe la factibilidad de investigar directamente con la población afectada, para lo cual se ha determinado considerar al personal femenino entre los 15 y 49 años de edad, que utilizan dispositivos intrauterinos de cobre (DIU), por ser el rango donde la población femenina mantiene actividades sexuales más frecuentes. Queda entonces por afirmar que la investigación a realizarse tendrá sus beneficios sobre todo en aquella población que utiliza el DIU como método anticonceptivo, a través del cual se determinará si existe o no prevalencia entre el uso de dicho dispositivo y la posibilidad de adquirir con mayor facilidad una patología infectocontagiosa como la Chlamydia Trachomatis. 7 CAPITULO II 2.1 ANTECEDENTES DE LA INVESTIGACIÓN Los primeros informes acerca de la presencia de Chlamydia en patologías infecciosas se deben a las descripciones sobre tracoma hechas en China y Egipto hace miles de años (Arango A I. 2001) En 1906, los austriacos Halbertaedler y Von Prowazek durante sus trabajos en la isla de Java, empleando la coloración de Giemsa observaron cuerpos punteados intracitoplasmáticos en un frotis conjuntival de orangutanes previamente inoculados con material tracomatoso humano. A estos cuerpos intracitoplasmáticos los denominaron “inclusiones”. En la década de los 80 chlamydia trachomatis es reconocido como un patógeno genital responsable de una variedad de síndromes clínicos. El género Chlamydia está clasificado taxonómicamente en el grupo 9 familias Chlamydiace en el Bergeys Systematic Bacteriology con el género Rickettsia. La secuenciación del 16s ARNr demuestra que existe una homología del 95% en las cuatro especies de Chlamydia que están estrechamente relacionadas: C. trachomatis, C.psittaci, C. pneumoniae y recientemente C.pecorum patógeno de rumianes. (Schaechter M. 2004). En los últimos años se ha descrito un aumento de las infecciones genitales producidas por este microorganismo, que se transmite por relaciones sexuales. Se ha señalado asimismo que es el agente causal más importante de infecciones de transmisión sexual (ITS) en sociedades industrializadas, con gran espectro de manifestaciones clínicas tanto en la mujer como en el varón. (Geisler W. 2004). Las infecciones genitales producidas por Chlamydia Trachomatis son la causa más común de infección de transmisión sexual (ITS) en el mundo, 90 millones de casos 8 nuevos se reportan cada año, con la peculiaridad de que su cuadro clínico en la mayoría de casos es asintomático y la mujer se entera de que padece dicha infección cuando sufre consecuencias reproductivas, por lo que es de gran importancia su diagnóstico temprano. (Schaechter M. 2004). Sin lugar a duda la Chlamydiasis es considerada como una enfermedad asintomática que necesita de cuidado, ya que puede provocar alteraciones graves en la mujer como la infertilidad, pero en la actualidad se puede realizar pruebas sensibles de laboratorio mediante examen serológico para la detección de anticuerpos específicos del tipo IgA contra Chlamydia con la finalidad de establecer un diagnóstico oportuno para su tratamiento respectivo. (Cook RL. 2003). Muchas de las veces esta bacteria puede ser tratado mediante antibióticos, pero lo más importante es su prevención mediante el uso del preservativo, mantener una relación estable, así como acudir a controles periódicos, la detección y tratamiento oportuno de esta infección evitará la diseminación de casos y disminuirá el riesgo de complicaciones que podrían ser irreversibles. (Underhill G. 2003). 2.2 MARCO TEÓRICO 2.2.1 FUNDAMENTACION TEORICA O BASES TEORICAS La Chlamydiasis es una infección de transmisión sexual (ITS) de origen bacteriano dada su modalidad de transmisión, que es una de las más extendidas en los países industrializados, conjuntamente con la infección por herpes y la infección por virus del papiloma humano (VPH), es causada por la colonización al nivel de los órganos genitales de varones y mujeres, de la bacteria intracelular gram-negativa Chlamydia Trachomatis (la misma que es también causante del cuadro denominado tracoma). Su importancia radica en la propagación de esta enfermedad, de sus manifestaciones clínicas, y las complicaciones en la mujer incluye cervicitis, síndrome uretral agudo, enfermedad inflamatoria pélvica, salpingitis y el riesgo del 9 recién nacido al pasar a través de un canal infectado y desarrollar conjuntivitis de inclusión y/o neumonía. (Handsfield H. 2002). La prevalencia de la infección por chlamydia varía de acuerdo a la edad, historia sexual y clase social. La prevalencia de la infección alcanza al 3-5% en jóvenes, los miembros de Fuerzas Armadas alcanzan un nivel de prevalencia de 10%. 15 a 20% en pacientes que acuden a clínicas especializadas en ITS. (Harrison´s. 2001). En Europa en las mujeres que optan por la planificación familiar también se ha encontrado una prevalencia de Chlamydia en un 9%, y entre un 2.2% -8.2% en mujeres previas a la inserción del DIU. Por lo tanto se requiere un análisis de detección de antígenos de Chlamydia trachomatis antes de implantar el DIU (McClarty 1994) 2.2.2 ANATOMOFISIOLOGIA DEL APARATO GENITAL FEMENINO El Aparato Genital Femenino está integrado por los órganos genitales internos (vagina, útero, ovarios y trompas de Falopio) y los genitales externos, llamados en conjunto vulva. (Martini F. 2009). a) ÓRGANOS GENITALES INTERNOS OVARIOS Los ovarios, las gónadas femeninas, son glándulas pares de forma y tamaño similares a los de una almendra, situadas a cada lado de la pelvis, inmediatamente por debajo de las trompas, su extremidad externa se incurva sobre ellos a manera de arco. Son de consistencia dura y miden 3 a 4 centímetros de largo por 1,5 centímetros de ancho, aunque hay considerables variaciones. En la niña adquieren una coloración rosada y en la mujer adulta son gris blanquecinos con formaciones de color amarilla producto, cada 28 días aproximadamente de la maduración de los 10 folículos (acumulaciones de células esféricas dentro del ovario, formando un ovocito. (Tortora G. 2008). Los ovarios están unidos a la parte superior del útero mediante las trompas de Falopio, sujetos en su posición a través del meso-ovario y los ligamentos suspensorio (Infundíbulo pélvico) y útero-ovárico. El ligamento suspensorio permite que cada ovario se una a la parte pelviana, mientras que el ligamento útero-ovárico los mantiene fijo al útero. Varios ligamentos lo fijan en su posición, el mesovario es una doble hoja corta que se extiende hacia atrás desde la hoja posterior del ligamento ancho hasta el borde anterior del ovario, sus dos hojas se insertan en los labios de este borde. El ligamento suspensorio del ovario o ligamento infundíbulo pélvico, los fijan a la pared pelviana, se extiende hacia arriba sobre los vasos iliacos externos y alcanza el tejido conectivo que recubre el músculo psoas mayor, contiene los vasos ováricos y el plexo nervioso ovárico. El ligamento ovárico pasa desde el extremo uterino del ovario hacia el cuerpo del útero inmediatamente caudal y dorsal a la entrada de la trompa de Falopio, es un cordón redondeado que contiene algunas fibras musculares lisas. Desempeñan dos funciones importantes: Los ovarios producen: 1) gametos, ovocitos secundarios que se desarrollan hasta formar el óvulo luego de la fecundación, y 2) hormonas, incluyendo la progesterona y estrógenos (la hormona sexual femenina), inhibina y relaxina. (Tortora G, Derrickson B. 2008). En cuanto a su estructura el ovario está revestido en su superficie por una hilera de células epiteliales, de tipo cúbico o aplanado, que constituyen el llamado epitelio germinal del ovario, término incorrecto, debido a que éste no da origen a los óvulos; sin embargo, al momento de denominarlo así, se creía que sí lo hacía. Hoy en día se sabe que las células progenitoras de los óvulos provienen del saco vitelino y 11 migran a los ovarios durante el desarrollo embrionario. Sus células tienen folículos inmaduros, que van madurando una por una durante el ciclo menstrual de la mujer que se inicia en la adolescencia bajo la influencia de la FSH. El óvulo madura durante la ovogénesis. Las células que forman la pared del folículo se llaman células granulosas las que fabrican la foliculina. Estas células forman cordones foliculares. El folículo maduro llamado folículo de Graaf comienza a producir luteína o progesterona antes de la ruptura del folículo que libera al oocito durante la mitad del ciclo después de la ovulación y bajo la acción de la LH (hormona gonadotropa de la hipófisis) el resto del folículo forma el cuerpo amarillo que secreta luteína o progesterona hasta el fin del ciclo menstrual. Esta hormona actúa en el útero para engrosar la mucosa y estimular a las glándulas endometriales preparando de esta manera al endometrio para la recepción del concepto (huevo fecundado). Si no hay suficiente estímulo de la LH el cuerpo amarillo deja de producir progesterona, el endometrio se desprende con la ruptura de vasos sanguíneos de la mucosa uterina formando la menstruación. (Thibodeau G, Patton K. 2007) La atresia del cuerpo amarillo regresivo toma la forma de una cicatriz en la superficie ovárica conocido como el cuerpo atrésico. En caso de que haya gestación el corion del embrión secreta la gonadotropina coriónica que mantiene al cuerpo amarillo y por tanto la producción de progesterona hasta que la placenta secreta progesterona. Al mismo tiempo los altos niveles de gonadotropina coriónica previene la secreción de FSH de la hipófisis impidiendo la maduración de otros folículos hasta el fin de la gestación. (Martini F. 2009). Cuando ya no hay folículos ováricos para producir estrógeno y progesterona la mujer entra en el período de la menopausia o climaterio que puede tener consecuencias negativas en los huesos debido a que la falta de estrógeno estimula a los osteoclastos los cuales aumentan las cavidades interóseas causando la osteoporosis. Otra de las consecuencias de la falta de estrógenos es la pérdida de la protección contra ataques del corazón que tienen las mujeres. La prevención de la osteoporosis y de enfermedades cardiovasculares durante este período de la vida femenina, se consigue con la administración terapéutica de estrógeno y progesterona. Se sospecha que mujeres 12 que mantienen un nivel normal de hormonas femeninas hasta la senescencia tienen un índice más bajo de la enfermedad de Alzheimer. La progesterona se usa para prevenir el cáncer de útero y mama, ya que el estrógeno sólo eleva un cierto porcentaje de incidencia de estas enfermedades. (Tortora G, Derrickson B. 2008). Los ovarios se hallan rodeados de una cápsula conjuntiva, tienen en su interior abundante estroma, por el que decurren los vasos sanguíneos y nervios. Su función es producir ovocitos después de la pubertad; adicionalmente, están encargados de producir dos hormonas: el estrógeno y la progesterona, que son responsables del proceso reproductivo y de las características sexuales secundarias. (Martini F. 2009). Riego sanguíneo. El ovario se halla irrigado por la arteria ovárica y por la rama ovárica de la arteria uterina. Tras descender hasta la pelvis la arteria ovárica pasa por el ligamento suspensorio y después entre las dos hojas del ligamento ancho y alcanza el mesovario, por el cual llega al hilio del ovario. La rama ovárica de la arteria uterina discurre por el ligamento ancho hasta alcanzar el mesovario, donde termina anastomosándose con la arteria ovárica. En este plexo se originan las venas, las cuales concluyen constituyendo un tronco único que alcanza el abdomen. Drenaje Linfático. Los vasos linfáticos del ovario se dirigen hacia arriba junto los vasos ováricos, desembocan en los ganglios lumbares o aórticos. Inervación. El ovario es inervado por el plexo ovárico. (Thibodeau G; Patton K. 2007). TROMPAS UTERINAS Las Trompas Uterinas ponen en comunicación la cavidad uterina con la cavidad abdominal e indirectamente con el ovario. Las trompas uterinas conducen los oocitos desde los ovarios a la cavidad uterina. Sirven también para conducir los espermatozoides en dirección opuesta, la fecundación ocurre en el tercio externo de este conducto. El término griego salpinx, 13 que significa trompa o tubo, se emplea también para referirse a la trompa uterina. (Drake R, Vogl W, Nitchell A. 2005). Aspecto Macroscópico Son conductos pares de 10-12 centímetros de longitud, tienen una forma más o menos cilíndrica con un diámetro externo de 1-1.5 cm. y una cavidad en su centro de aproximadamente 4 mm de diámetro. Se extienden a lo largo del borde superior de los ligamentos anchos del útero, desde los cuernos del útero hasta la superficie del ovario. En las trompas uterinas se distinguen cuatro partes o segmentos: Porción uterina o porción intramural. Tiene una longitud aproximada de 1 cm y un diámetro interno de 0.5-1mm, está situada en el espesor de la pared uterina. Porción ístmica. Es de 2-4cm de longitud y de 2 a 4mm de diámetro interno, es la porción más medial, corta, angosta y de paredes gruesas que se une al útero. Este segmento de la trompa uterina es casi cilíndrico y de consistencia firme. Porción ampular. Esla zona más gruesa de la trompa uterina. Alcanza de 7 a 8 cm de longitud y de 7 a mm de diámetro. No es cilíndrica como el istmo sino aplanada, ya que su consistencia es débil y su pared interna se aplica sobre la pared externa. Infundíbulo (pabellón) de la trompa uterina. La trompa uterina termina en un ancho embudo, denominado infundíbulo de la trompa uterina, que se ensancha bruscamente en el extremo de la ampolla de la trompa uterina, termina formando una serie de lengüetas, franjas o fimbrias, que se ha comparado a la corola de una flor. Esta zona se denomina pabellón y pone en relación la trompa con el ovario. (Rouviere H. 2005) Estructura 14 Están formadas por una capa muscular lisa, otra mucosa y una tercera serosa externa, dependiente del peritoneo. Las células epiteliales internas son ciliadas para ayudar el avance del óvulo o del huevo fecundado y están bajo la influencia del estrógeno que aumenta su secreción y actividad del ciclo menstrual. La mucosa.- posee muchos pliegues ramificados, de trayecto longitudinal, dan como resultado una organización de tipo laberíntico. Los cuales están revestidos de epitelio, el epitelio tiene una altura mayor de la ampolla, aparecen células portadoras de cinocilios (células ciliadas) y células secretoras (células no ciliadas) el batido ciliar se produce en dirección al útero causa una corriente de líquido que constituye una orientación para los espermatozoides ascendentes. Capa muscular.- la capa muscular cada vez se torna más gruesa en dirección al útero. Formada por dos planos de músculo liso, una externa longitudinal y otra interna circular. Las contracciones peristálticas de la muscular, junto con la acción ciliar de la mucosa, ayudan al ovocito o al óvulo fecundado a desplazarse hacia el útero. Serosa.- Es la capa externa de las trompas uterinas, se prolonga hacia abajo, poniéndose casi en contacto una hoja con la otra, y constituye el meso de la trompa y posteriormente el ligamento ancho. (Tortora G, Derrickson B. 2008). Las trompas de Falopio están irrigadas por las ramas tubáricas de las arterias uterinas y pequeñas ramas de las arterias ováricas. Los vasos linfáticos de las trompas de Falopio siguen a los vasos sanguíneos y desembocan en los ganglios lumbares (o aórticos). Están inervados por los plexos ováricos y por las fibras de los plexos hipogástricos inferiores. (Rouviere H. 2005) Riego sanguíneo. Las ramas tubáricas de las arterias uterinas y pequeñas ramas de las arterias ováricas irrigan las trompas de Falopio. 15 Drenaje linfático. Los vasos linfáticos de las trompas de Falopio siguen a los vasos sanguíneos y desembocan en los ganglios lumbares (o aórticos) Inervación. Están inervadas por los plexos ováricos y por las fibras de los plexos hipogástricos inferiores. ÚTERO Órgano muscular, impar y hueco, ubicado en la cavidad pelviana por detrás de la vejiga urinaria y delante del recto. El útero es el órgano en el cual anida la mórula, la cavidad del útero y la de la vagina, situada caudalmente, constituyen en conjunto el llamado conducto del parto a través de cual pasa el feto al término del embarazo. (Tortora G, Derrickson B. 2008). En la mujer nulípara las paredes del útero son gruesas y musculares, el órgano en conjunto tiene cierta semejanza con una pera invertida cuyo extremo inferior y se dirige hacia abajo y atrás formando un ángulo de más de 90º con la vagina (ángulo de anteversión) Sus dimensiones varían con la edad y con la paridad de la mujer, pero por término medio su longitud oscila entre 6 y 9 cm., su anchura entre 3 y 4 cm. y su profundidad o espesor entre 2 y 3 cm. El peso del útero varía entre 70 y 100g. El útero se compone de dos porciones anatómica y funcionalmente distintas, el cuerpo y el cuello, que están separadas por una zona, el istmo, que fuera del período de embarazo tiene escasa importancia. Cuerpo uterino. En la mujer sexualmente activa madura representa las dos terceras partes del volumen total del útero. Ocupa la porción superior del útero y es una formación netamente muscular. En su centro posee una cavidad aplanada de delante atrás y de perfil triangular. Esta cavidad se comunica en su extremidad 16 superior con las trompas, y en su extremidad inferior, a través del istmo, con el cuello uterino. Se continúa con el istmo. Cuello uterino. Tiene forma cilíndrica. Su longitud varía entre 2.5-3cm. En su extremidad superior se comunica con el istmo. Su extremidad inferior, cónica termina haciendo protrusión en la porción superior de la vagina y se denomina portio hocico de tenca. El cuello al igual que el cuerpo del útero, está tunelizado en su centro (cavidad cervical). Esta cavidad tiene forma cilíndrica o de huso y comunica la cavidad corporal con la vagina. La extremidad superior de la cavidad cervical, o zona de unión con el istmo, se denomina orificio cervical interno y la extremidad inferior orificio cervical externo, que tiene morfología distinta según la paridad de la mujer. En las nulíparas es puntiforme y en las multíparas tiene forma de hendidura transversal. Istmo.- Es una pequeña zona mal delimitada, situada entre el cuello y el cuerpo. En la gestación esta zona aumenta sus dimensiones y adquiere gran importancia funcional, pero fuera de la gestación carece de interés. A lo largo de la vida de la mujer, el útero sufre cambios importantes que se reflejan en la relación entre el volumen del cuerpo y el cuello y en la estructura histológica de su mucosa. Al nacimiento, el volumen del cuello es igual o superior al del cuerpo, sólo en la edad sexual madura el cuerpo alcanza los dos tercios del volumen total del útero. Estructuralmente, se halla formado por una gruesa capa muscular lisa, muy vascularizada o miometrio, una capa mucosa o endometrio, dispuesta de modo de permitir su regeneración constante en el ciclo menstrual, también sufre cambios durante el embarazo, pues tiene glándulas, las cuales atraviesan el estroma endometrial y una capa serosa o perimetrio está formada por el peritoneo. Está ligeramente adherida a la parte posterior del cuello. (Thibodeau G, Patton K. 2007) 17 Riego sanguíneo. El útero recibe sus vasos de la arteria uterina. Después de haber cruzado el uréter, la arteria uterina irriga el cuello y la parte superior de la vagina y asciende muy sinuosamente por el lado del útero a cierta distancia del cuello para adosarse al borde lateral del cuerpo del útero. Un poco antes de llegar al cuello, la arteria proporciona: a) ramas vesico-vaginales para la vejiga urinaria y la vagina, y b) una arteria cervicovaginal destinada a la parte inferior del cuello y a la pared anterolateral de la vagina. Las arterias uterinas aumentan de tamaño durante el embarazo y son tortuosas después del parto. Drenaje linfático. Los vasos linfáticos del fondo y la parte superior del cuerpo desembocan en los ganglios lumbares (o aórticos), los de la parte inferior del cuerpo en los ganglios iliacos externos y los del cuello en los ganglios iliacos externos, hipogástricos (iliacos internos) y sacros. Algunos vasos de la región del útero cerca de la entrada de las trompas de Falopio pasan junto con el ligamento redondo y desembocan en los ganglios inguinales superficiales Inervación. El útero está inervado por el plexo uterino. Dicho plexo nace del borde anterior del plexo hipogástrico inferior. (Rouviere H. 2005) VAGINA La vagina es un conducto tubular fibromuscular revestido de epitelio estratificado, que se extiende desde el vestíbulo hasta el útero. Está formada por tejido muscular liso, cubierto de una membrana mucosa, dispuesta en repliegues que dan a este órgano una gran elasticidad. (Drake R, Vogl W, Mitchell. 2005). La longitud de la vagina mide 7.5 cm a lo largo de su pared anterior y 9 cm a lo largo de la pared posterior, su anchura aumenta gradualmente de abajo hacia arriba de tal manera que el diámetro de los 2/3 superiores es mayor que el de 1/3 inferior. (Martini F. 2009) Es el órgano femenino de la cópula. También es el extremo inferior del conducto del parto y sirve como conducto excretorio del producto de la menstruación. La cavidad 18 de la vagina se comunica con la del útero por arriba, y se abre en el vestíbulo de la vagina por debajo. Riego sanguíneo. La parte superior de la vagina está irrigada por ramas vaginales de la arteria uterina. La arteria vaginal, algunas veces se origina como dos o tres ramas de la hipogástrica (iliaca interna), proporciona ramas que se distribuyen hacia delante y hacia atrás de la vagina. Estas pueden anastomosarse en el plano medio y formar dos troncos longitudinales, llamados arterias ácigos vaginales. Algunas ramas de la arteria del bulbo del vestíbulo llegan a la parte inferior de la vagina. La sangre de la vagina desemboca en el plexo venoso vaginal, el cual se anastomosa con los plexos uterino y vesical. Drenaje linfático. Los vasos linfáticos de la parte superior de la vagina pasan a lo largo de la arteria uterina y desembocan en los ganglios ilíacos externos e hipogástricos (iliacos internos). Los de la porción media van con la arteria vaginal y desembocan en los ganglios hipogástricos (iliacos internos), en tanto que los de la porción inferior van hacia los ganglios sacros e iliacos comunes. Los vasos linfáticos de la parte vaginal adyacente al himen van hacia los ganglios inguinales superficiales. Inervación. Los nervios de la vagina proceden del plexo hipogástrico inferior. (Rouviére H. 2005) b) ORGANOS GENITALES EXTERNOS Los órganos genitales externos femeninos conocidos en conjunto como vulva, comprenden: monte de Venus, labios mayores, labios menores, vestíbulo vaginal, clítoris, bulbos vestibulares y glándulas vestibulares mayores. (Rouviére H. 2005) 19 Monte de Venus zona situada por delante de la sínfisis pubiana cubierta por pelos, está constituido en su mayor parte por una acumulación de grasa. Después de la pubertad, la piel de esta región queda cubierta por pelos gruesos. Labios Mayores.- Son dos grandes pliegues cutáneos, miden aproximadamente 8 cm de longitud, su cara externa es de piel rugosa y muy pigmentada que contiene muchas glándulas sebáceas y que se cubre de pelo después de la pubertad. Su cara interna es lisa mantiene el aspecto de las mucosas. Son homólogos del escroto en el hombre. Labios Menores. Se sitúan por detrás de los labios mayores, miden 3 cm. Siguen la misma dirección que los labios mayores y terminan uniéndose a éstos en la unión de los tercios medio e inferior. A diferencia de los labios mayores, los labios menores no poseen vello púbico ni grasa y tienen sólo unas pocas glándulas sudoríparas, pero sí muchas glándulas sebáceas. Los labios menores son homólogos de la uretra esponjosa (peneana). Clítoris. Ubicada en la unión anterior de los labios menores. A semejanza del pene, del cual es homólogo, está formado principalmente por tejido eréctil. Una capa de piel llamada prepucio del clítoris se forma donde se unen los labios menores y cubre el cuerpo del clítoris. La porción expuesta de éste es el glande del clítoris. Igual que la estructura masculina, ésta se agranda con la estimulación táctil y juega un importante papel en la excitación sexual en las mujeres. Vestíbulo vaginal.- La región que queda entre los labios menores. Dentro de él se encuentra el himen (si aún está presente), el orificio vaginal, el orificio uretral externo (meato urinario) y los orificios de los conductos de varias glándulas. El vestíbulo es homólogo de la uretra membranosa en los hombres. Anterior al orificio vaginal y posterior al clítoris se encuentra el orificio el orificio uretral externo. A cada lado de éste se encuentra la apertura de los conductos de las glándulas parauretrales (de Skene) estas glándulas secretoras de moco se alojan en las 20 paredes de la uretra. Las glándulas parauretrales son homólogas de la próstata. A cada lado del orificio vaginal se encuentran las glándulas vestibulares mayores (de Bartholino). Varias glándulas vestibulares menores también se abren hacia el vestíbulo. Bulbos vestibulares. Son un par de masas alargadas de tejido eréctil que se encuentran a los lados del orificio vaginal, cubiertos por el músculo bulbocavernoso. El bulbo del vestíbulo se llena de sangre y crece durante la excitación sexual, estrechando el orificio vaginal y produciendo presión sobre el pene durante el acto sexual. El bulbo del vestíbulo es homólogo del cuerpo esponjoso y el bulbo del pene en el hombre. Glándulaas vestibulares mayores. Las glándulas vestibulares mayores (de Bartolino) están situadas lateralmente a la mitad posterior del orificio vaginal. Son alargadas de anterior a posterior y aplanadas transversalmente. Su volumen es muy variable. Son pequeñas en la pubertad; a partir de entonces aumentan rápidamente de volumen, para disminuir después de la menopausia. Producen una pequeña cantidad de moco durante la excitación y las relaciones sexuales y brindan lubricación. Son homólogas a las glándulas bulbouretrales en el hombre. Riego sanguíneo, drenaje linfático e inervación Riego sanguíneo. Los labios mayores y menores son regados por las ramas labiales anteriores de las arterias pudendas externas, y por las ramas labiales posteriores de las pudendas internas. Los cuerpos cavernosos del clítoris y sus raíces reciben sangre de las arterias profundas del clítoris. Los bulbos vestibulares y las glándulas vestibulares mayores reciben su riego sanguíneo de la arteria del bulbo vestibular y de la vagina anterior. Drenaje linfático. Los vasos linfáticos de los órganos genitales externos drenan en los ganglios inguinales superficiales. 21 Inervación. Los labios mayores y menores están inervados por el nervio labial anterior (rama del abdominogenital menor) y los nervios genitales posteriores (ramas del pudendo interno). El bulbo vestibular está inervado por el plexo uterovaginal, que se continúa con los nervios cavernosos del clítoris. El clítoris también está inervado por el nervio dorsal del clítoris. Estos nervios incluyen: 1) fibras sensitivas; algunas de ellas conducen impulsos dolorosos; 2) fibras autónomas, que inervan los numerosos vasos sanguíneos, y 3) fibras autónomas que inervan a las distintas glándulas. 2.3 CHLAMYDIA TRACHOMATIS Características generales. Fue descrita en 1906 cuando Prowazek y sus colaboradores observaron inclusiones de células conjuntivas tracomatosas del macaco siendo propuestos para esos agentes el nombre de Chlamydozoa, dos años más tarde Staydar en una de sus observaciones celulares encontró inclusiones en el hombre. En 1929 fue designada Bedsonia en honor a Bedson por sus estudios en Psitacosis y posteriormente se la denomino Miyagawanella en homenaje a Miyagawa por sus estudios morfológicos linfogranuloma. (Madigan M. 2003) Para los años posteriores la Chlamydia Trachomatis se consideró como un gran virus y se descubrió que por ser un microorganismo contaba con numerosos caracteres y poseían ADN y ARN, pared celular y ribosomas que se puede multiplicar por fusión binaria y que es sensible a ciertos antibióticos. Chlamydia es una bacteria que se parece a los virus, ya que su multiplicación es intracelular, es un procariote inmóvil, cocoide y de tamaño pequeño (0.2-0.4 um), se aproxima mucho a las bacterias Gram negativas, posee proteínas de membrana externa (MOP) altamente antigénica la cual representa el 60% con respecto a otras proteína ricas en cisteína. (Kodaman PH, Arici A, Seli E. 2004). 22 En la década de los años 80 Chlamydia Trachomatis es reconocido como un patógeno genital responsable de una variedad de síndromes clínicos: tracoma ocular (inmunotipos A-C), linfogranuloma venéreo (inmunotipos L1-L2-L3) Infecciones genitourinarias, salpingitis y enfermedad inflamatoria pélvica (EIP) (inmunotipos D-K) Las mujeres, hombres y niños pueden ser vulnerables a la infección; ya que el periodo de incubación dura alrededor de 30 días que puede producir varias complicaciones graves. (Madigan M. 2003). Para los años posteriores la Chlamydia Trachomatis se consideró como un gran virus y se descubrió que por ser un microorganismo contaba con numerosos caracteres y poseían ADN y ARN, pared celular y ribosomas que se puede multiplicar por fusión binaria y que es sensible a ciertos medicamentos. Los datos recopilados por la Organización Mundial de la Salud señalan que cerca de 89 millones de personas presentan infección por Chlamydia trachomatis; sólo en Estados Unidos de América (EUA) se reportan cada año más de cuatro millones de casos nuevos, de los cuales 2.6 se presentan en mujeres, 1.8 en varones y 250 000 en recién nacidos. Algunos estudios seroepidemiológicos han descrito que una proporción de 40 a 80% de los casos de EPI y de OTB son debidos a la infección por C trachomatis; es por ello que la detección primaria y el tratamiento de estas infecciones asintomáticas son necesarios e indispensables para evitar las secuelas que produce su presencia. (De Palo. 2007) 2.4 EPIDEMIOLOGIA Chlamydia trachomatis es el patógeno más prevalente en las ITS en el mundo occidental, y es el agente etiológico que subclínicamente menos se diagnostica. La Chlamydia en el momento actual se considera como el patógeno de trasmisión sexual más frecuente, superando incluso al gonococo. La salpingitis aguda 23 constituye una complicación más seria por Chlamydia en la mujer; es considerada la responsable de la salpingitis silenciosa llamada así por ausencia de síntomas y es responsable de la esterilidad por obstrucción tubárica en mujeres en edad fértil. (Kinghorn W. 2000). La OMS indica que 90 millones de casos nuevos aparecen cada año en el mundo; La infección ha aumentado en las últimas dos décadas, ocurriendo la mayor prevalencia en adolescentes de 15 a 19 años de edad. Es un problema de salud de la mujer, por el daño reproductivo que produce. La proporción de mujeres contaminadas es de 6:1en relación a los hombres. Así mismo, se sabe que los nuevos casos de infección por chlamydia son más o menos cuatro veces más que la suma de los casos nuevos de herpes genital y papiloma genital (Paavonen J. 1999). En los EE.UU se estima cada año 4 millones de nuevos casos y 50.000 mujeres quedan estériles. Aunque la uretritis no gonocócica (UNG) no es debida solamente a chlamydia, se le atribuye en los países Europeos y en EE.UU ser la causa de un 50% de UNG y responsable de un 45% de los casos de epidídimo-orquitis agudas. Se calcula que un 7% de los hombres asintomáticos se les puede detectar chlamydia trachomatis. En contraste las mujeres son más asintomáticas que los hombres, con un 14%. En estudios realizados en Inglaterra, se calculó que el riesgo de infección es pequeño con un 3% cuando se tiene en el caso de las mujeres, un solo compañero sexual, pero significativamente más grande (33%) cuando se tiene 2 o más compañeros sexuales en un mes. Respecto al impacto económico de la infección por C. trachomatis, se calcula que los costos directos e indirectos en EE.UU se acercan a los 2.4 billones de dólares (Arango A I. 2001). La prevalencia de la infección por chlamydia varía de acuerdo a la edad, historia sexual y clase social. En mujeres jóvenes con cervicitis se ha estimado que un 28% de este grupo pueden desarrollar complicaciones como la enfermedad pélvica inflamatoria. 24 Otro problema que se presenta en las mujeres con cervicitis que evolucionan a salpingitis, es la infertilidad, cuya incidencia oscila entre el 13% - 75% después de varios episodios de infección por chlamydia trachomatis. Es así como se ha demostrado con mujeres con problemas de infertilidad, especialmente a nivel de oclusión distal ovárica, poseían altos niveles de anticuerpos anti chlamydia. También la salpingitis incrementa de 7 a 10 veces el riesgo del embarazo ectópico. En un programa de screening en clínicas de planificación familiar en el norte y centro de California, se encontró que entre un 5.5 a 22.5% de mujeres tenían positividad para Chlamydia, entre las mujeres embarazadas la prevalencia de infección cervical a Chlamydia fue de 2 a 30%. En Europa en las mujeres que optan por la planificación familiar también se ha encontrado una prevalencia de chlamydia en un 9% y entre un 2.2% -8.2% en mujeres previas a la inserción del DIU. Por lo tanto, se requiere un análisis de detección de antígenos de chlamydia trachomatis antes de implantar el DIU. La detección del antígeno de chlamydia trachomatis se debe implementar como técnica rutinaria en toda sospecha de ITS y en mujeres embarazadas sometidas a control ginecológico. Algunos trabajos asocian las infecciones por Chlamydia con displasia cervical y con el carcinoma vulvar. Adicionalmente, C. trachomatis es considerada como un facilitador del ingreso del virus de inmunodeficiencia humana (VIH) y del virus papiloma humano (VPH) al epitelio cervical y ha sido implicada como posible factor en la etiología del cáncer cervical debido a que los virus se adquieren más fácilmente en presencia de células inflamatorias en el tracto genital. (De Lucena M.2008) 25 2.5 MECANISMO DE INFECCIÓN Chlamydia es una bacteria cocoide, no móvil, que crece y se replica en las células epiteliales y en los monocitos. Es incapaz de desarrollar un metabolismo con producción de energía, por lo que depende de la célula huésped como intermediario y de su ATP. Se conocen tres especies de Chlamydia: trachomatis, psittaci y pneumoniae. La primera incluye los serotipos A, B, Ba y C, relacionados con el tracoma y las infecciones de transmisión sexual. (López M, Rojas L. 2012) La infección de la chlamydia se produce cuando la bacteria utiliza las células para desarrollar sus ciclos de reproducción, para ello la bacteria presenta dos formas: (Kodaman PH, Arici A, Seli E. 2004) Cuerpos Elementales: de tamaño entre 300 y 400 nm, se hallan en el medio exterior para mantenerse latentes, allí son la forma infectante que se transmiten de una persona a otra. Estos cuerpos elementales se unirán a la membrana celular de las células epiteliales de los órganos a ser afectados (tracto genital, gónadas, etc.) donde inducen un proceso de fagocitosis, ingresando al interior de la célula para en un tiempo de 8 a 12 horas incrementar su tamaño, mostrar labilidad al medio externo y reorganizar su estructura. De tal modo que el cuerpo elemental se transforma en la segunda forma de la bacteria que es el cuerpo reticulado. La interacción determinada inicia los eventos de programación de la chlamydia y de sensibilización de la célula huésped a la infección. Cuerpos Reticulados Tiene un tamaño mayor de 800 a 1000nm, son formas no infectantes, metabólicamente activos, están adaptados a la vida intracelular y son capaces de reproducirse. La chlamydia sensibiliza a la célula huésped para su desarrollo intracelular obligado y el desarrollo de la inclusión. La C. Trachomatis despliega una sola inclusión, en la que se retiene glicógeno, fuente extra de energía de la chlamydia, ya que no tiene mitocondrias asociadas. La reproducción se da por fusión binaria hasta que la gran cantidad de cuerpos reticulados forma una masa denominada cuerpo de inclusión, a las 18 a 24 horas luego de la adhesión inicial 26 los cuerpos reticulados sufren una nueva reorganización para convertirse nuevamente en cuerpos elementales. A las 36 a 40 horas, la cantidad de nuevos cuerpos elementales dentro del cuerpo de inclusión muere, liberando los nuevos cuerpos elementales que a su vez infectarán a otras células, volviendo a iniciarse el ciclo. (Madigan M. 2003). 2.6 PERÍODO DE INCUBACION Se considera que la infección se puede producir entre 7 a 21 días posteriores al contacto con una persona infectada. (Schaechter M. 2004). 2.7 INMUNOGENICIDAD La Chlamydia Trachomatis es un potente inmunógeno, que incita respuestas inmunes humoral y celular. También, de los antígenos inmunogénicos, el resultado de la infección obedece de la interacción y el balance de las citoquinas segregadas por los linfocitos activados. Las alteraciones inmunes inducidas por la chlamydia pueden ayudar para su sobrevida en el huésped infectado e inducir infecciones persistentes. Por eso, la posibilidad de recaída o reinfección, aún después de un buen tratamiento; así como, la formación de adherencias, oclusiones e inflamaciones tubáricas (Shaechter 2004) El IFN-g, un producto típico de las células Th1, ha sido descrito como el factor más importante en la defensa contra Chlamydia, mientras que la susceptibilidad a la enfermedad ha sido relacionada al aumento en la expresión de IL-10, marcador de la activación de las células. In vitro, el tratamiento de células infectadas con IFN-g limita la replicación de la chlamydia, desplegándose formas atípicas de chlamydia con menos antígenos de proteína de membrana externa y lipopolisacáridos, pero con alta y continua producción de proteína de choque de calor chlamidyásica HSP60. In vivo, la 27 constancia de tales células infectadas podría servir como acúmulo de antígeno HSP60 capaz de inducir inflamación crónica. Anticuerpos El estudio de inmunoglobulina mide el nivel de ciertas inmunoglobulinas o anticuerpos en la sangre. Los anticuerpos son proteínas producidas por el sistema inmunológico para atacar a los antígenos, como las bacterias, los virus y los alérgenos (Ingraham 412). El cuerpo genera diferentes inmunoglobulinas para combatir cada antígeno. (Madigan M, Martinko J, Parker J. 2003) Los cinco tipos de anticuerpos son los siguientes: Inmunoglobulina A (IgA), presente en grandes concentraciones en las membranas mucosas, particularmente en las paredes internas de las vías respiratorias y el tracto gastrointestinal, como también en la saliva y las lágrimas. Inmunoglobulina G (IgG), el tipo de anticuerpo más abundante en los líquidos corporales. Brinda protección contra las bacterias y las infecciones virales. Inmunoglobulina M (IgM), se encuentra principalmente en la sangre y en el líquido linfático. Es el primer anticuerpo que el cuerpo genera para combatir una infección. Inmunoglobulina E (IgE), se la asocia principalmente con las reacciones alérgicas. Se encuentra en los pulmones, la piel y las membranas mucosas. Inmunoglobulina D (IgD), existe en pequeñas cantidades en la sangre y es el anticuerpo del que menos conocimiento se tiene. Por lo general tanto la IgA como la IgG y la IgM se miden simultáneamente. Al evaluarse juntas, le brindan al médico información importante sobre el 28 funcionamiento del sistema inmunológico, especialmente en lo relacionado con las infecciones y las enfermedades autoinmunes. 2.8 FACTORES PREDISPONENTES Se han identificado diversos factores predisponentes asociados con la historia natural de la infección por Chlamydia trachomatis: (Guerra F. 2003). Mujeres adolescentes y adultas jóvenes entre 15 y 24 años de edad sexualmente activas. En las adolescentes el epitelio columnar endocervical se extiende más allá del endocervix (ectopia cervical) produciendo una área cubierta por epitelio columnar y escamocolumnar siendo mayormente susceptible a las infecciones por ChyamydiaTrachomatis. Entre los factores predisponentes constan los siguientes: Varios compañeros sexuales: El no uso de métodos anticonceptivos de barrera Antecedentes de Infecciones de Trasmisión Sexual (ITS) El uso de anticonceptivos orales, facilitan el crecimiento y ascenso de la infección por chlamydia trachomatis, así como también pueden facilitar el desarrollo de ectopia cervical. Inserción del DIU en mujeres con infecciones cervicales asintomáticas no diagnosticadas en su etapa primaria. 2.8.1 DIU COMO FACTOR DE RIESGO La utilización, prescripción y manejo de los dispositivos intrauterinos (DIU), a pesar de los años transcurridos desde el inicio de su utilización práctica sigue siendo objeto de controversias. (Organización SEC. 2006). El DIU ha sido objeto de atención en diversos congresos y reuniones, tanto de sociedades nacionales como internacionales, en los que la Sociedad Española de Contracepción (SEC) tuvo la oportunidad de observar discrepancias respecto a 29 diferentes aspectos prácticos de la contracepción intrauterina: cuándo retirar un DIU, controles y recomendaciones previos y posteriores, selección de usuarias, etc. (Organización SEC. 2006). El adecuado asesoramiento y la correcta inserción de DIU resultan de gran importancia para asegurar un resultado aceptable del método, puesto que es la medida más eficaz para evitar algunos de sus efectos secundarios y sus complicaciones. El primer aspecto a tener en cuenta será realizar una adecuada anamnesis que intente profundizar en las posibles contraindicaciones. Una vez descartadas éstas y previamente a la inserción del DIU, no parece necesario realizar un cribado sistemático para detectar infecciones por gonorrea o chlamydia. Este hecho permite simplificar el manejo clínico del DIU permitiéndose su inserción. La nueva generación de Dispositivos intrauterinos en nuestro medio se halla representada por los DIU de alta carga de cobre. Todos ellos promocionan una alta eficacia contraceptiva. Sin embargo, las tasas de continuidad de este excelente método contraceptivo pueden verse afectadas de manera adversa si presentan efectos secundarios como sangrado, dolor, infecciones que motiven la extracción, o la expulsión del DIU, que coloque a la mujer en una situación de desprotección frente al riesgo de embarazo. No existen evidencias científicas concluyentes sobre el mecanismo de acción de los DIU. Se acepta que pueden actuar por diferentes mecanismos de acción. Todos los DIU provocan una reacción inflamatoria local de cuerpo extraño que produce un aumento de la permeabilidad capilar; edema endometrial; y aumento de la presencia de macrófagos La Organización Mundial de la Salud (OMS) estima que aproximadamente 160 millones de mujeres utilizan el DIU como método anticonceptivo a nivel mundial. Es utilizado por alrededor del 13% de las parejas, con mayor frecuencia en países en desarrollo que en países desarrollados. (Haimovich S. 2009). 30 Los DIU no poseen elementos protectores en contra de una infección de transmisión sexual o la enfermedad pélvica inflamatoria. Las inflamaciones genitales constituyen, sin duda, la complicación más grave que puede llegar a padecer una mujer portadora de un DIU y, aunque se ha descrito casos de muerte por inflamaciones pelvianas atribuibles a dispositivos intrauterino, habitualmente el cuadro es leve y de fácil tratamiento. (Guerra F. 2003). Las mujeres deben ser advertidas de que existe un riesgo mayor de padecer una EPI en los 20 primeros días tras la inserción, pero después el riesgo puede ser el mismo que en las no usuarias. Si contrae una infección vaginal cuando esté usando el DIU, puede aumentar la posibilidad de desarrollar una infección pélvica seria. Esto puede resultar en la pérdida de la fertilidad. (Fuenzalida D. 2011). El riesgo de desarrollar una EPI está fundamentalmente relacionado con el proceso de inserción y con la presencia de infecciones de transmisión sexual. Por esta razón, las usuarias deben revisar sus propios riesgos y comunicar al Facultativo antes de la inserción. (Hubacher D. 2008) Las pacientes con Chlamydia o Gonorrea en el momento de la inserción tienen un riesgo relativo mayor que aquellas que no tienen ITS, el DIU en estos casos no se recomienda, porque los riesgos del uso pesarán generalmente más que los beneficios. (Mohllajee AP. 2006). El DIU como reservorio de Cándida Albicans tiene la capacidad de adherirse a diferentes partes del DIU, generando un biofilm que parece tener relevancia a la hora de generar vulvovaginitis y recurrencia de las mismas, ya que se ha demostrado una tasa mayor de infección por Cándida en pacientes portadoras de DIU. Por tanto, parece que el DIU puede aumentar el riesgo de infecciones a nivel vaginal. (Tepper Nk.et al 2012) (Auler ME. 2010). La FDA en el 2005, incluye a las adolescentes de 16 ó más años, como posibles candidatas al DIU (Waknine. Y FDA. 2005). Las adolescentes (15 a 19 años) 31 tienen una tasa más alta de fallos anticonceptivos que las adultas. (20-49 años) y tasas más altas de discontinuación después de un año de uso. (Hubacher D, 2008). Una revisión sistemática concluye que el DIU debe ser ofertado como método anticonceptivo de primera línea a todas las mujeres, incluidas las adolescentes que pueden tener dificultades con otros métodos que requieren para el cumplimiento la participación de la usuaria. Presenta ventajas con respecto a otros ya que los adolescentes manifiestan un mayor cumplimiento con los métodos de acción prolongada que con los de acción más breve o que requieren un uso diario o rutinario. Su eficacia anticonceptiva es muy alta, comparable al resto de la población, y permite disminuir la tasa de embarazos no deseados. Se ha evidenciado un leve aumento en el riesgo de EPI y de expulsión. Esta población presenta mayor incidencia de infecciones por chlamydia y la coinfección con Gonorrea es frecuente. Se debería realizar una prueba de cribado a las adolescentes, con hábitos sexuales de riesgo, antes de la inserción de un DIU. Las mujeres que presenten riesgo de infección por VIH o ya estén infectadas se contraindica el uso del DIU, la presencia de un cuerpo extraño produce un fenómeno inflamatorio con presencia de una gran cantidad de leucocitos, macrófagagos aumentando el riesgo de adquirir una EPI, secundaria a una ITS. (Guerra F. 2003). 2.9 MANIFESTACIONES CLINICAS. Habitualmente la infección es silenciosa y asintomática; tanto hombres como mujeres infectados con chlamydia trachomatis pueden tener flujo genital anormal o dolor leve en la micción durante la primera a tercera semana de exposición. Esto ocurre en forma similar a la infección por gonorrea, con la que en ocasiones puede ir acompañada. (Blake D, Quinn T, Gaydos C. 2008) 32 En la mujer, rara vez se presenta sangrado vaginal o poscoital y dolor abdominal bajo; por tal razón la enfermedad puede no ser diagnosticada a tiempo lo que puede ocasionar complicaciones. Se conoce que la infección ascendente desde el cérvix puede producir la enfermedad pélvica inflamatoria. Entretanto, la infección ascendente durante la gestación conduce a la rotura prematura de membranas, la corioamniotitis, el parto prematuro, infección puerperal e infección neonatal. Se ha determinado también que la existencia de un cuadro de uretritis/cervicitis condiciona un riesgo tres veces mayor de adquirir infección por VIH, al promover un proceso inflamatorio que permite la migración de células blanco, en este caso macrófagos que son los huéspedes naturales para la adquisición del virus VIH, así como la presencia de lesiones sangrantes, sobre todo en el cérvix. Con respecto a esta última condición, las lesiones en el cuello uterino permiten procesos de cambio celular (displasia) que permitirían mayor daño ocasionado por el virus del papiloma humano (VPH), que se le ha identificado como responsable del cáncer de cérvix. Son consecuencias de la infección por chlamydia además de la enfermedad pélvica inflamatoria (EPI), el embarazo ectópico, la infertilidad por factor tubárico, la epididimitis, proctitis y la artritis reactiva (Schaechter M. 2004). La chlamdiasis es asintomática en la mayoría de los casos, sin embargo, son dos los cuadros clínicos más frecuentes asociados a la infección por esta bacteria, tanto en el hombre como en la mujer. (Frontela M.et al 2006) La infección endocervical por C trachomatis es un problema de salud pública de la mujer en edad reproductiva. Publicaciones recientes refieren que entre 70 y 90% de estas pacientes son asintomáticas, y que la infección puede persistir por meses o años. (Cates W. 1999). Cuando las pacientes no son identificadas ni tratadas se permite que el agente infeccioso invada los tejidos causando procesos patológicos como la enfermedad pélvica inflamatoria (EPI); además, se ha asociado con otros padecimientos como 33 la infertilidad por obstrucción tubárica (OTB), embarazos ectópicos, artritis reactiva y endocarditis. (Faro S. 1999). Algunos estudios seroepidemiológicos han descrito que una proporción de 40 a 80% de los casos de EPI y de OTB son debidos a la infección por Chlamydia trachomatis (Chernesky, M. 1998), por lo que se hace indispensable la detección primaria y el tratamiento oportuno de estas infecciones asintomáticas con la finalidad de evitar los riesgos y secuelas que produce esta bacteria. En el caso de una infección crónica los niveles de IgG e IgM se incrementan rápidamente, y permanecen elevados los anticuerpos de IgG, los anticuerpos IgA se desarrollan más lentamente que los anticuerpos IgG (56 días después de la inoculación (López M, Guerra F. 2002). 2.10 INFECCIONES EN EL HOMBRE Uretritis no gonocócica (UNG) Es el proceso inflamatorio de origen infeccioso localizado en la uretra masculina, denominada no gonocócica por tener signos y síntomas similares a la uretritis por gonococo, pero en ausencia del mismo. Chlamydia Trachomatis es la principal responsable del cuadro, pero también se puede relacionar con ureaplasma urealyticum, trichomona vaginalis y el virus del herpes simple (HSV). (López M. 2012) En Europa se estima que la prevalencia de la UNG por chlamydia es del 40%. Clínicamente con base a signos y síntomas es imposible distinguir una UNG por chlamydia, solamente el cultivo o la detección del antígeno puede determinar el caso. El período de incubación está entre 7 y 21 días, en el que aparece disuria y secreción moderada de color blanco amarillento. Frecuentemente los pacientes cursan con secreción en las primeras horas de la mañana, la cual va cediendo en el transcurso del día, es rara las linfadenopatías. Estudios seroepidemiológicos han demostrado que los serotipos D, F, G, H, I, J y K son los más comúnmente encontrados (Arango A I .2001). 34 Epidídimo-Orquitis El dolor testicular debe ser descartado de la torsión testicular. Sin embargo, la presencia de secreción uretral y disuria son claves para llegar al diagnóstico (Arango AI 1998). La epidídimo-orquitis es propia de los varones jóvenes con más de una pareja sexual. Los síntomas van desde una secreción abundante o moderada, dolor escrotal unilateral con inflamación importante y eritema edematoso. El diagnóstico se debe llevar a cabo detectando el antígeno en la secreción uretral. (Blake D. 2008). Conjuntivitis Esta patología recientemente descrita, y aunque rara se puede presentar en adolescentes con vida sexual activa. La infección se produce por autoinoculación desde el tracto genital. Básicamente es una conjuntivitis unilateral donde se pueden observar al interior de los párpados folículos clamidiales pustulosos. El diagnóstico se realiza tomando secreciones y realizando detección del antígeno por ELISA o IFD (Schaechter M. 2004). Enfermedad de Reiters La patología de Reiters es poco entendida y multifactorial. Es probable que una infección precedente dispare mecanismos desconocidos en el huésped, que hacen que a pesar de la erradicación de la infección, persistan los síntomas (peeling RW1995, Centers for Disease Control 1995). Las infecciones predisponentes asociadas al síndrome de Reiters han sido etiológicamente documentadas así: Shigella flexneri, Salmonella spp. Chlamydia trachomatis y Yersinia enterocolítica. La enfermedad es caracterizada por uretritis, conjuntivitis bilateral, artritis y lesiones mucocutáneas. Evidencias serológicas han demostrado que el 80% de los pacientes poseen anticuerpos contra C. trachomatis. También se sabe que los pacientes previo al síndrome de Reiters tuvieron un cambio de pareja sexual y desarrollaron uretritis. La conjuntivitis moderada se observó en un 50%, la artritis afecta básicamente rodillas y tobillos. La mayoría de los episodios 35 de Reiter curan entre 2 y 6 meses, pero algunas tardan en recuperarse hasta un año (Arango A I 2001). 2.11 INFECCIONES EN LA MUJER La prevalencia en las mujeres asintomáticas van en aumento cada día se cree que está entre un 3 – 5%. En mujeres embarazadas la prevalencia está alrededor de un 10% (López C. 2003) Cervicitis Chlamydia trachomatis es un parásito intracelular del epitelio columnar por lo tanto no causa vaginitis, aunque la cervicitis es común. Muchas mujeres son asintomáticas, pero se cree que un tercio de ellas tiene secreciones vaginales e inflamaciones. El diagnóstico clínico de la cervicitis por chlamydia depende del alto índice de sospecha y de una cuidadosa exploración del cérvix, también secreción mucopurulenta, hiperemia y edema son frecuentemente encontrados en las cervicitis. Se observa, también en las cervicitis por Chlamydia trachomatis un sangrado intermenstrual post-coito. No obstante, estos síntomas deben siempre ser confirmados por la detección del antígeno en las secreciones o por cultivo de la misma. Faringitis La faringitis por chlamydia ha sido descrita entre mujeres con infección del tracto genital bajo. Es un misterio como alcanza Chlamydia trachomatis el tracto respiratorio. Los pacientes afectados de faringitis tienen escozor, con un pequeño exudado pero sin síntomas de coriza. En los pacientes no tratados los síntomas ceden a las 2 – 6 semanas. (Hamdad F. 2004) Enfermedad pélvica inflamatoria Los gérmenes habitualmente implicados son Neisseria Gonorreae y Chlamydia Trachomatis, aunque aproximadamente entre el 30 y 40% son polimicrobianas. Chlamydia trachomatis ha sido aislada del trato genital femenino en un 40% de las mujeres que presentan salpingitis aguda. 36 Está bien demostrado que es la infección más importante y complicada de la mujer. Muchos ginecólogos y urólogos consideran que la detección de chlamydia en los hombres es muy importante para determinar la prevalencia y el riesgo que se puede presentar en las mujeres. La salpingitis aguda al comienzo de los síntomas cursa con dolor constante bajo abdominal o pélvico. La mayoría de las mujeres se quejan del dolor abdominal que llega a durar entre 3 y 4 semanas antes de visitar al médico. En algunos casos las trompas de Falopio se inflaman y se tornan rojizas, serosas e inmóviles. Después del primer episodio, el 15% de mujeres puede quedar infértil llegando a una cifra cercana al 100% después del cuarto episodio, cabe mencionar que después de una EPI el riesgo de embarazo ectópico aumenta de 5 a 7 veces. Tratamiento antimicrobiano adecuado y precoz hace que cedan rápidamente los síntomas, en contraste un tratamiento tardío podría resultar en una completa oclusión de las trompas con un consiguiente riesgo mayor de embarazo ectópico e infertilidad. De otro lado, es también importante la bartolinitis por chlamydia, al igual que la infección por gonococo, se produce una infección altamente exudativa a través de los ductos de Bartolini. Factores de riesgos que ayudan a la propagación del EPI Los factores de riesgos que ayudan a la propagación del EPI son: (Guerra F. 2003) 1) Edad.- El EPI aparece en la época reproductora de la mujer, pero la edad de mayor riesgo ocurre entre 15 y 39 años. 2) Hábitos sexuales.- La precocidad de relaciones sexuales, el número de coitos y la promiscuidad sexual. 3) Anticonceptivos.- los dispositivos intrauterinos considerablemente el riesgo de padecer EPI. 37 (DIU) incrementan 4) La menstruación puede favorecer la producción de EPI probablemente con la presencia de sangre, mayor dilatación del cuello uterino y reflujo de sangre infectada hacia la trompa. 5) La existencia de episodios previos de EPI incrementa el riesgo de padecimiento de enfermedades entre el 5 y el 20% de las mujeres que tienen entre sus antecedentes esta alteración. 6) Exploraciones intrauterinas (biopsias, citología endometrial, histeroscopía, histerosalpingografia) y los actos quirúrgicos, si no se realizan las debidas precauciones pueden favorecer la aparición de la EPI. (Wiesenfeld HC. 2002). Perihepatitis aguda Esta patología se caracteriza por una inflamación fibrinosa que afecta la superficie anterior del hígado. Ocurre en mujeres jóvenes sexualmente activas y se asocia a una EPI, conociéndose como el síndrome de Fitz-Hugh-Curtis. Aunque este síndrome se describió desde 1919, solo recientemente se demostró que el agente etiológico era Chlamydia trachomatis (Arango AI. 2001). 2.11.1 INFECCIONES PERINATALES En el embarazo la infección puede asociarse a prematuridad y bajo peso al nacer. Los recién nacidos de madres con chlamydia trachomatis tienen del 60 al 70% de probabilidad de infectarse durante el paso por el canal del parto. Algunos estudios sugieren que también puede producirse transmisión intrauterina en las últimas semanas del embarazo, especialmente si ha habido rotura prematura de bolsa amniótica asociada. La infección perinatal provoca una colonización de la faringe, el recto y la vagina de los recién nacidos. Cerca del 30 al 50% de estos niños desarrollarán conjuntivitis de inclusión y el 10–20% neumonía. (Stamm WE, Batteiger. 2009). 38 2.11.2 INFECCIONES POR CHLAMYDIA TRACHOMATIS EN NIÑOS Oftalmía neonatarun es una transmisión vertical de las más importantes y frecuentes en el recién nacido. La conjuntivitis de inclusión del neonato tiene un período de incubación entre 7 y 21 días. El espectro clínico va desde una conjuntivitis moderada con edema e hipertermia a una conjuntivitis mucupurulenta, el párpado inferior es al parecer el más afectado. La infección clamydial es clínicamente indistinguible de una conjuntivitis gonocócica. El tratamiento tópico antimicrobiano incluye colirios y algunas veces tratamiento sistémico a base de tetraciclinas. (Erbelding E, Zenilman J. 2007) Esta patología que se adquiere en el período perinatal puede persistir en la nasofaringe, el tracto urogenital o el recto durante más de dos años. Neumonía del neonato e infantil Las infecciones puerperales por Chlamydia trachomatis desencadenan algunas veces una neumonía intersticial en el neonato, la infección se produce por la aspiración del neonato de las secreciones de la madre infectada en el momento del parto, el período de incubación es de 3 – 6 semanas. Los síntomas que presenta el niño son febrícula, disnea y tos. 2.11.3 PATOLOGIAS COMUNES AL HOMBRE Y MUJER Tracoma es una infección que solo se da en el ser humano la etiología es por Chlamydia trachomatis. El tracoma conjuntival es una enfermedad muy antigua, aparece en el norte de África mediterránea, medio oriente y sud este asiático, pero el tracoma endémico está localizado en el Sub-Sahara donde es un problema serio de salud pública. (Arango AI, 2001). Los serotipos A, B, Ba y C son los más frecuentes en las zonas endémicas. Una higiene pobre y condiciones sanitarias deplorables contribuyen a la diseminación 39 de material infeccioso ocular. La enfermedad comienza como una conjuntivitis mucopurulenta aguda (frecuentemente complicada por una sobreinfección bacteriana) que evoluciona a queratoconjuntivitis folicular crónica, en ocasiones acompañada de neovascularización corneal. La enfermedad sigue con una ptósis ligera de los párpados e hipertrofia folicular de la conjuntiva superior. Después se produce una reacción inflamatoria importante con hipertrofia papular o folicular de la conjuntiva y un exudado mucopurulento, el tracoma deja en el mundo miles de personas ciegas, pero en ese mismo orden es la ceguera más prevenible. Linfogranuloma venéreo Es una ITS que se conoce desde 1913 pero solamente se descubrió su etiología hacia la década de los años 30. Las cepas de Chlamydia trachomatis responsables de la enfermedad son los serotipos L1, L2 y L3 (Woods et al 1989). Chlamydia trachomatis se disemina por vía hematógena alcanzando incluso el LCR y otros tejidos. La lesión primaria de inoculación aparece a algunos días después del contacto. La lesión es vesicular o herpetiforme que suele aparecer en el glande o en el prepucio. En las mujeres aparece en los labios, pared vaginal o cérvix. La lesión vesicular es no dolorosa y se rompe dejando una úlcera poco profunda que autocura espontáneamente pero sin cicatrizar. La fase siguiente es la invasión a los ganglios linfáticos, los inguinales en el hombre y los pélvicos en las mujeres se inflaman fuertemente y se tornan dolorosos. La tercera etapa se manifiesta con un síndrome urogénito-perineal, en las mujeres se producen cambios estructurales como elefantiasis no destructiva de los labios y el clítoris; en el hombre se producen cambios en el pene y el escroto y algunas veces se compromete el ano desarrollándose estenosis rectal. 2.12 DIAGNOSTICO Habitualmente, la infección es silenciosa y asintomática; tanto hombres como en mujeres con chlamydia trachomatis pueden tener flujo genital anormal o dolor leve en la micción durante la primera a tercera semana de exposición. Esto ocurre en 40 forma similar a la infección por gonorrea, con la que en ocasiones puede ir acompañada. (Schaechter M. 2004) En la mujer rara vez se presenta sangrado vaginal o poscoital y dolor abdominal bajo; por tal razón la infección puede no ser diagnosticada a tiempo lo que puede ocasionar complicaciones. Una vez se puso en evidencia el papel etiológico de Chlamydia trachomatis en las diferentes patologías, su importancia ha hecho que en los últimos años haya aumentado el interés por parte de los médicos especialistas como ginecólogos, pediatras, urólogos e infectólogos en obtener un diagnóstico útil para una prescripción más acertada y precisa. Cultivo celular. Es el método tradicional de Chlamydia trachomatis en la línea celular de McCoy el cual es un método laborioso costoso y que requiere por lo tanto una infraestructura adecuada con personal técnicamente bien capacitado para realizar el diagnóstico. (Martínez M. 2009). Inmunofluorescencia Directa. Las nuevas técnicas de detección de antígenos ya sea por Inmunofluorescencia Directa (IFD) o ELISA han facilitado enormemente el trabajo de diagnóstico. Al respecto la IFD es una técnica que depende del antígeno que se emplee. Así existen los antígenos LPS o las OMP (proteínas de membrana externa), siendo estas últimas las más específicas. La técnica requiere de personal especializado en microbiología para poder interpretar correctamente los cuerpos de inclusión, y además un microscopio de fluorescencia que no tienen todos los hospitales. La sensibilidad de la IFD está alrededor del 70% y la especificidad del 90%. Las pruebas de ELISA utilizan un antígeno de LPS requieren un lector de ELISA algunas veces costoso, tiene una sensibilidad del 67% endocervicales, y de un 89% en pacientes de alto riesgo. resultados falsos positivos. 41 en muestras Presenta algunos Anticuerpos Anti-Chlamydia trachomatis IgA. La detección serológica de los anticuerpos contra chlamydia representa un método más útil e incluso altamente sensible para el diagnóstico de las infecciones chlamydiales, facilitando también el diagnóstico en los casos en que el acceso físico es problemático. En la mayoría de las pruebas; con todo, la reactividad entre las especies impide la interpretación clínicamente significativa de los resultados. La prueba de micro- inmunofluorescencia (MIF), que permite la discriminación entre las especies, requiere un alto nivel de habilidad técnica para la realización e interpretación apropiadas (ORGENICS). Los anticuerpos IgA anti-chlamydia trachomatis indican el estado activo en las infecciones chlamydiales agudas, crónicas y recurrentes. Estos confirman los resultados positivos de IgG anti-chlamydia trachomatis y pueden ayudar en las evaluaciones de seguimiento de tratamientos con antibióticos. Además, los estudios clínicos sugieren un alto grado de correlación entre el nivel de IgA antichlamydial y la presencia real de antígenos chlamydiales. A través de un inmunoensayo enzimático cualitativo en fase sólida se detectan los anticuerpos IgA específicos contra Chlamydias, estos anticuerpos aparecen luego de las inmunoglobulinas tipo M y se encuentran presentes en infecciones agudas, crónicas y recurrentes. Los anticuerpos IgA declinan rápidamente a niveles basales seguidos al tratamiento y erradicación de la infección por chlamydia. La presencia de anticuerpos IgA es principalmente indicativa de una infección por chlamydia en un tiempo indeterminado; sin embargo, un incremento de esta inmunoglobulina específica puede indicar una infección sistémica o crónica. Esta técnica emplea antígenos de serotipo L2, de amplia reactividad múltiple, para la identificación y cuantificación de anticuerpos IgA anti-C. trachomatis. (ORGENICS). Diagnóstico serológico Los diagnósticos serológicos son limitados en cuanto al diagnóstico de infecciones urogenitales en adultos. La serología se puede utilizar 42 para diagnosticar LGV, es decir los antígenos se detectan mediante la fijación del complemento. Por ende es claro que esta prueba no tendrá utilidad práctica en el diagnóstico de tracoma por conjuntivitis por inclusión o infección a recién nacidos. Técnicas inmunológicas Las técnicas inmunológicas tuvieron un gran impacto en el diagnóstico de la Chlamydia ya que varias laboratorios pudieron acceder al diagnóstico de este microorganismo. La inmunoflurorecencia directa fue el primer procedimiento desarrollado ya que aparecieron los anticuerpos monoclonales, los cuales ayudan al reconocimiento de la proteina principal de la membrana externa de la Chlamydia, la que constituye más del 50% de las proteinas de la membrana, hay que mencionar que existen otros que contienen la mezcla de dos anticuerpos monoclonales. La sensibilidad de la IFD en comparación con el cultivo celular varía entre 60 y 93% y su especificidad entre 94 y 99%, que se podrá determinar con un test de sensibilidad. (López M , Guerra F.2002). Los procedimientos basados en EIA emplea un anticuerpo policlonal anti LPS. Los EIA directos, permiten que el anticuerpo se una directamente con los corpúsculos elementales de la Chlamydia. En los EIA indirectos un anticuerpo anti LPS cambia de color de un sustrato de incoloro o coloreado, que se podrá visualizar en un espectrofotómetro. Es decir es un reactivo que consiste en anticuerpo monoclonal anti LPS que bloquea el epitope al cual se une el anticuerpo policlonal. Las técnicas de inmunoensayo en fase sólida tipo sándwich con anticuerpos monoclonales que detectan antígenos (Clearview chlamydia. Unipath Basinstoke U.K) es sin duda las más adecuadas para los países en vías de desarrollo. El “test” de claerview posee una alta sensibilidad, especificidad y sencillez, ya que no necesita personal altamente calificado por su fácil realización, la lectura e 43 interpretación es sencilla lo que hacen de esta técnica una de las más útiles en el mercado (Arango 1998). El diagnóstico molecular de las infecciones por Chlamydia es sin duda el más adecuado por su alta sensibilidad y especificidad. Amplificación de los ácidos nucleicos basados en la técnicas de PCR y LCR (ligase chain reation) están ahora disponibles comercialmente. Con la nueva prueba de amplificación de ácido nucleico hay mayor eficacia en la detección del microorganismo, en comparación con otros estudios que lo reportan negativo (pacientes con anticuerpos anti-Chlamydia trachomatis positivos) La precisión de la hibridación de los ácidos nucleicos facilita el diagnóstico. La técnica de PCR tiene límites de detección tan bajos de apenas 1 – 10 cuerpos elementales por lo que alcanza una sensibilidad de casi el 99%. Otra de las ventajas de los métodos moleculares es la ausencia de cultivos, requerimientos especiales de transporte y rapidez en la obtención de resultados en 6 horas. Incluso actualmente existen “test” dúplex que pueden detectar simultáneamente ADN de N. gonorrheae y Chlamydia trachomatis a partir de un solo espécimen clínico. PCR y LCR ofrece sensibilidades entre el 89% al 100% de especímenes cervicales, uretrales y orinas de hombres como mujeres con UNG sintomática. (Hamdad F. et al 2004) No obstante, la excelente sensibilidad del PCR y LCR el diagnóstico molecular de laboratorio tiene algunos problemas como los resultados falsos-positivos que se presentan debido a la contaminación cruzada entre los especímenes, ya que para cada microorganismo que se trabaje se necesita un área específica. Los falsos negativos que existen en las técnicas moleculares de PCR y LCR se deben a algunas enzimas, iones fosfatos, grupos hem, detergentes y cristales presentes en las muestras de orina. 44 PCR y LCR a pesar de ser más costosos son más eficaces por los beneficios que otorga en el diagnóstico de infecciones por chlamydia en mujeres asintomáticas por las consabidas secuelas de infertilidad, EPI y embarazo ectópico. No obstante, parece estar todavía muy lejos de nuestro alcance que en los países en vías de desarrollo se puedan implementar rutinariamente las metodologías moleculares por su alto costo de infraestructura y reactivos. 2.13 ASPECTOS TERAPEUTICOS Ya que chlamydia tiene un ciclo de vida intracelular, se requieren antimicrobianos que penetren las células del huésped. Tradicionalmente las tetraciclinas han sido empleados con éxito en las infecciones del tracto genital. Sin embargo, hace pocos años la resistencia a este grupo de antibióticos se ha incrementado. (Erbelding E, Zenilmam J. 2007) Actualmente, para el tratamiento de la infección por Chlamydia trachomatis se recomienda un gramo de azitromicina en una sola dosis oral, esta dosis es equivalente al régimen tradicional de 7 días de doxiciclina. Comparado con la terapia tradicional, azitromicina tiene una excelente actividad farmacocinética que incrementa su biodisponibilidad, posee bajos efectos colaterales y molestias estomacales, y su excelente concentración al interior de los macrófagos y de los tejidos lo que le da una vida media de 5 a 7 días. Respecto a la posología de tetraciclina se deben administrar 500 mg. cada 12 horas por día. En el tratamiento de las UNG por chlamydia, también se ha demostrado que las quinolonas fluoradas como la ofloxacina y enoxacina, y las sulfas tienen éxito con altas tasas de curación. Las infecciones por Chlamydia en niños imponen un tratamiento sistémico con Eritromicina o sus derivados, 50 mg/kg/día durante 7 a 14 días para conjuntivitis, y 14 a 21 días para neumonía. La terapia tópica no está recomendada por el alto 45 índice de recaídas y la necesidad de erradicar el patógeno extraocularmente y prevenir el desarrollo subsecuente de neumonía. El tratamiento del tracoma se recomienda con ungüento de tetraciclina al 1%, aplicado intermitentemente. El objetivo de esta terapia es el de disminuir la carga infecciosa y reducir el desarrollo de la ceguera. El tratamiento de la infección del tracto genital se recomienda con tetraciclina, 2 gr/día por 7 días y está asociado con tasa de curación del 95%. La Eritromicina, con el mismo régimen, es el tratamiento alternativo. Las infecciones del tracto genital superior demandan un tiempo más prolongado de tratamiento. La psitacosis es tratada usualmente con tetraciclina 2 gr diarios por 10 A 14 días. La Eritromicina es el tratamiento alternativo. Para la neumonía por C. pneumoniae, se recomienda un vigoroso tratamiento antibiótico con eritromicina o tetraciclina. Las mujeres en etapa de gestación pueden ser tratadas con azitromicina o eritromicina o amoxicilina. En las gestantes con posible resistencia a la chlamydia, se sugiere iniciar el tratamiento con amoxicilina 500 mg 3 veces por día, durante 7 días, seguida de una dosis única de 1 g de azitromicina, la que resulta en una estrategia costo-efectividad. El sulfato de heparán se utiliza como receptor para la adherencia de virus herpes simple, chlamydi tatrachomatis, Neisseria gonorrea e indirectamente, el virus de inmunodeficiencia humana. Utilizando sistemas de cultivo humano primarios se ha identificado compuestos de hidratos de carbono sulfatados que semejan al sulfato de heparán y competitivamente privan la infección por estos patógenos. Estos compuestos son candidatos para formulaciones intravaginales para la prevención de enfermedades de transmisión sexual. 46 2.14 PREVENCIÓN Sin lugar a dudas la mejor forma de tratar esta infección es la prevención; en vista de que esta afección ocurre sin síntomas, las personas infectadas pueden infectar a sus parejas sin darse cuenta. La transmisión no ocurre si no hay sexo genital, anal u oral (Discaciatti V. 2004) Es aconsejable que a las mujeres y hombres que tengan más de una pareja sexual menores de 25 años, se realicen pruebas de despistaje de chlamydia. Se recomienda que a todas las personas con más de una pareja sexual, especialmente mujeres menores de 25 años, se les realice pruebas de despistaje de chlamydia, aún en ausencia de síntomas, pues se encuentra que la relación costo-beneficio es favorable. El empleo de condón o diafragma durante las relaciones sexuales pudieran reducir la transmisión de la chlamydia. Y de todas maneras, ayuda a la prevención la notificación a la pareja. Asimismo, se ha estimado que la profilaxis antibiótica contra chlamydia trachomatis reduce el riesgo de infección postaborto. 2.15 VALIDACION Y ESTANDARIZACIÓN Para el diagnóstico de Chlamydia Trachomatis se realizará determinaciones en suero sanguíneo de los niveles de IgA anti chlamydia trachomatis mediante micro ELISA para IgA, la misma que es altamente sensible para el diagnóstico de infecciones clamydiales. Los anticuerpos IgA indican el estado activo en las infecciones clamydiales agudas, crónicas y recurrentes. 47 2.15.1 TÉCNICA DE VALORACIÓN DE LAS PRUEBAS SANGUÍNEAS Muestra Valores nm Blanco de reactivo < 0.100 Control Negativo ≤ 0.90 Control Positivo ≥ 1.00 2.15.2 LUGARES DE EXTRACCIÓN Se utilizan las venas del pliegue del codo basílica, cefálica o la mediana cubital. PROCEDIMIENTO 1. Se colocó a la paciente en una posición cómoda, con el brazo confortablemente extendida sobre una superficie fija y se localizó la vena más accesible para la extracción. 2. Se desinfectó el área de punción con torunda con alcohol en el sentido de abajo hacia arriba. 3. Se aplicó el torniquete a presión de 60 mm de Hg a unos 10 cm encima del lugar de punción (no dejar actuar el torniquete más de 1 minuto), se indicó a la paciente apretar el puño. 4. Se introdujo la aguja con el bisel hacia arriba, paralelamente a un borde del trayecto venoso, avanzando la punta de la aguja un medio centímetro en el tejido celular subcutáneo y luego introduciéndola en la pared venosa, la llegada a la luz de la vena produce una sensación de pérdida de resistencia al avance de la aguja. 5. Se retiró el torniquete. 6. Se aspiró delicadamente la cantidad necesaria de sangre, manteniendo firmemente la posición de la jeringuilla. 7. Se sacó la aguja de la vena, y se instruyó a la paciente para que comprima el área con algodón. 48 8. Se retiró la aguja de la jeringuilla. 9. Se trasvasó la sangre de la jeringuilla por las paredes del recipiente. TÉCNICA IgA PARA CHLAMYDIA TRACHOMATIS La prueba ELISA de International Inmuno Diagnostics para Chlamydia trachomatis IgA ha sido desarrollada para la determinación de un anticuerpo específico de Chlamydia trachomatis IgA en una muestra simple de suero humano por un ensayo de una enzima-inmunoabsorbente unida. PRINCIPIO DE LA PRUEBA Con el antígeno purificado de Clamydia Tracomatis es recubierta la superficie de los micropozos. El suero del paciente diluído se agrega a los pozos, y el anticuerpo específico de Clamydia tracomatis IgA si está presente, se une al antígeno. Todos los materiales no adheridos se lavan. Después de agregar enzima conjugada, ésta se une al complejo del anticuerpo antígeno. El exceso de la enzima conjugada se lava separado y el Substrato Cromogénico TMB se agrega. La reacción catalítica de la enzima conjugada es detenida en un momento específico. La intensidad del color generado es proporcional a la cantidad del anticuerpo específico IgA en la muestra. Los resultados son leídos por un lector de micropozos y comparado de una manera paralela con el calibrados y los controles. MATERIALES PROPORCIONADOS 1. Tiras de micropozos: Pozos cubiertos de antígeno de Clamydia Tracomatis (12 x 8 pozos) 2. Enzima Conjugada: Solución color rojo 1 frasco (12 ml) 3. Control Negativo: Tapa Natural 1 vial (150 ul) 4. Calibrados Cutt-Off: Tapa Amarilla índice IgA=10 1 vial (150 ul) 5. Control positivo: Tapa roja 1 vial (150 ul) 49 6. Concentrado de lavado 1Cx: Tapa Blanca 1 botella (100 ml) 7. Solución absorbente: Tapa Negra 1 frasco (22 ml) 8. Substrato Cromogénico TMB: Botella ámbar 1 frasco (15 ml) 9. Solución de Paro: 2 N HCI 1 frasco (12 ml) ALMACENAJE Y ESTABILIDAD 1. Almacenaje del equipo de 2 a 8º C. 2. Siempre mantenga los micropozos herméticamente sellados en la bolsa con el desecante. Recomendamos que use hasta agotar todos los pozos dentro de las 4 semanas después de la apertura inicial de la bolsa. 3. Los reactivos son estables hasta la fecha de expiración del equipo. 4. No exponer los reactivos al calor, sol o luz fuerte durante el almacenaje o uso. ADVERTENCIAS Y PRECAUCIONES 1. Materiales potencialmente bio-peligrosos: Los calibradores y controles contienen componentes de origen humano que han sido probados y se han encontrado no reactivos para el antígeno de superficie de hepatitis B así como el anticuerpo de VIH con los reactivos autorizados por la FDA. Sin embargo, como con cualquier método de prueba no se puede ofrecer una completa seguridad de que los virus VIH, Hepatitis B u otros agentes infecciosos estén ausentes, estos reactivos deben manejar el Nivel 2 de Bio seguridad, como es recomendado en los Centers for Disease Contro/ National Institutes of Health manual, Biosafety in Microbiological and Biomedical Laboratories. 2. No pipetear con la boca. No fumar, comer o beber en las áreas en que las muestras o equipos son manejados. 3. Se entiende que los componentes en este equipo son para el uso de una unidad integral. Los componentes de diferentes lotes no deben mezclarse. 50 4. Estos productos contienen componentes preservados con azida de sodio. La azida de sodio puede reaccionar con el plomo y cobre de las cañerías para tomar una azida metálica explosiva. En disposición vacié con un volumen grande de agua. RECOLECCIÓN Y MANEJO DE LA MUESTRA 1. Recolectar la muestra de sangre y separar el suero. 2. Las muestras deben ser refrigeradas de 2 a 8 ºC hasta por siete días o congeladas hasta por seis meses. Evite congelación y descongelación repetitiva de las muestras de suero. PREPARACIÓN PARA LA PRUEBA 1. Prepare 1x el buffer de lavado: Prepare el buffer de lavado añadiendo agua destilada o desionizada al Concentrado de lavado 10x para un volumen final de un volumen de 1 litro. 2. Traiga las muestras y reactivos del equipo a temperatura ambiente (de 20 a 25 ºC) y mezcle cuidadosamente. PROCEDIMIENTO DEL ENSAYO 1. Se colocó el número deseado de tiras dentro del soporte. 2. Se preparó la dilución 1:40 añadiendo 5 ul de muestras para prueba, control negativo, control positivo y calibrados por duplicado a 200 ul de solución absorbente. Mezcle bien. 3. De la dilución preparada en el paso anterior, se agregó 100 ul de suero diluido, calibrador y controles dentro de los pozos apropiados. Para el reactivo en blanco, se depositó 100 ul de solución absorbente en el pozo de la posición 1A. Se golpeó suavemente el soporte para quitar las burbujas de aire del líquido y se mezcló bien. temperatura ambiente. 51 Se incubó por 30 minutos a 4. Se retiró el líquido de los pozos. Se repitió el lavado tres veces con buffer de lavado. 5. Se agregó 100 ul de enzima conjugada a cada pozo y se incubó por 30 minutos a temperatura ambiente. 6. Se removió la enzima conjugada de los pozos. Se repitió el lavado tres veces con buffer de lavado. 7. Se agregó 100 ul de Substrato Cromogénico TMB a cada pozo y se incubó por 30 minutos a temperatura ambiente y en la obscuridad. 8. Se añadió 100 ul de 2N HCI para detener la reacción 9. Se leyó a 450 nm de DO (Densidad óptica) con un lector de micro pozos. Nota: Se aseguró que no haya burbujas de aire en los pozos antes de la lectura. CÁLCULO DE RESULTADOS 1. Se Calcula la media del valor del calibrador Xc que se corrió por duplicado. 2. Se calcula la media del control positivo, control negativo y muestras del paciente que se corrieron por duplicado. 3. Se calcula el índice IgA de cada determinación dividiendo los valores medios de cada muestra por el valor medio de calibrador, Xc. CONTROL DE CALIDAD La prueba corrida puede ser considerada válida si reúne los siguientes criterios: 1. El valor de la D.O. (Densidad óptica) del blanco de reactivo contra el aire de un lector de micro pozos debe ser menor de 0.250. 2. Si el valor de la D.O. del calibrador es más bajo que 0.250, la prueba no es válida y debe repetirse. 52 3. El índice de IgA para el control negativo y positivo deben encontrarse en el rango indicado en las etiquetas. INTERPRETACIÓN Negativo: Índice IgA de 0.90 o menor es seronegativo para el anticuerpo de IgA. Erróneo: Índice IgA de 0.91 – 0.99 son equívocos. La muestra debe ser realizada de nuevo. Positivo: Índice IgA de 1.00 o mayor. RESUMEN Y PROCEDIMEINTO DE LA PRUEBA Paso 1 2 3 4 5 6 7 8 Temp. Ambiente (de 20 a25 “C) Dilución de la muestra 1:40 = 5 ul/200 ul Muestras diluidas, controles y calibrador Buffer de lavado (3 veces) Enzima Conjugada Buffer de lavado (3 veces) Substrato del Cromogénico TMB Solución de Paro Lectura a una densidad Óptica de 450 nm Volume n Tiempo de incubación 100 ul 30 minutos 350 ul 100 ul 350 ul 100 ul 30 minutos 30 minutos 100 ul La prueba ELISA de International Immuno Diagnostics, para Chlamydia Tracomatis IgA está destinada para la determinación de un anticuerpo específico de Chlamydia Tracomatis IgA en una muestra simple de suero humano por un ensayo de una enzima-inmunoabsorbente unida. (ORGENICS) 53 CAPITULO III METODOLOGÍA 3.1 DISEÑO En virtud de que la presente investigación pretendió establecer la prevalencia de Chlamydia Trachomatis en mujeres que realizan planificación familiar con dispositivo intrauterino (DIU) en el Centro de Salud Norte de la Policía Nacional. Quito, se utilizó un diseño epidemiológico transversal de punto en una muestra representativa. 3.2 SISTEMA DE VARIABLES V. MODERADORA Edad Tiempo de uso de DIU. Inicio de vida sexual. N. de compañeros sexuales V. INDEPENDIENTE V. DEPENDIENTE Uso del DIU Prevalencia de Chlamydia Trachomatis V. CONTROL Mujeres planificación familiar que acuden al CSN-PN 54 3.2.1 VARIABLES A ESTUDIAR Edad. Inicio de vida sexual Número de compañeros sexuales Tiempo de uso del DIU Niveles de IgA anticlamydia trachomatis 3.3 OPERACIONALIZACIÓN DE LAS VARIABLES VARIABLES DEFINICIÓN DIMENSIÓN INDICADOR ESCALA EDAD Tiempo transcurrido desde el nacimiento hasta el instante o período que se estima de la existencia de una persona. Tiempo Años < 20 años. 21 a 30 años. 31 a 40 años. > 41 años. PREVALENCIA DE CHLAMYDIA TRACHOMATIS Presencia de la bacteria. PRESENCIA Determinaciones de IgA> TIEMPO DE USO DEL DIU INICIO DE VIDA SEXUAL NÚMERO DE COMPAÑEROS SEXUALES Tiempo que transcurre desde la inserción del DIU hasta el momento actual Edad en la que mujer tuvo su primera relación sexual Número de compañeros sexuales que la mujer ha tenido desde el inicio de su vida sexual hasta la presente fecha Tiempo Meses años > 1.00 < 1.00 1-12mes 1+ años Edad de la primera relación sexual Años Años Número de compañeros sexuales 1 2 3+ 1 2 3+ 55 3.4 POBLACIÓN Y MUESTRA La población estuvo conformada por mujeres en edad fértil de 15 a 49 años de edad que acudieron a control de planificación familiar entre los meses de mayoagosto del año 2013 al CSN PN. Quito. Fórmula: Para el cálculo del tamaño de la muestra y en virtud de que se trata de un universo homogéneo, infinito y con la finalidad de establecer la prevalencia de Chlamydia Trachomatis, se utilizó muestreo aleatorio simple en base a la siguiente fórmula: 𝑛= 𝑝𝑞𝑧 2 𝑒2 Dónde: n= muestra p= prevalencia del objeto estudio: Chlamydia 0.25 (25%) q= probabilidad de no ocurrencia = 1-p z= nivel de confianza 95%= l.96 e= error de interferencia 10% =0.10 Reemplazando: 𝒏= (𝟎. 𝟕𝟓)(𝟎. 𝟐𝟓)𝟏. 𝟗𝟔𝟐 𝟎. 𝟏𝟎𝟐 𝒏 = 𝟕𝟐 𝒎𝒖𝒋𝒆𝒓𝒆𝒔 En el presente estudio y con la finalidad de asegurar la validez extrema del estudio, se reclutaron un total de 210 pacientes que acudieron a planificación familiar al Centro de Salud Norte de la Policía Nacional. 56 3.5 CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN 3.5.1 CRITERIOS DE INCLUSIÓN Mujeres entre los 15 y 49 años. Mujeres en estado sexual activo. Mujeres que asisten a la consulta del Centro de Salud Norte de la Policía Nacional a Planificación Familiar para control del DIU 3.5.2 CRITERIOS DE EXCLUSIÓN Mujeres que no firmen el consentimiento informado. Mujeres que no están en el rango de edades del estudio. Mujeres que no posean historia clínica. Mujeres embarazadas. Mujeres con alteración psicológica. Mujeres que realizan tratamiento con antibióticos durante los últimos 3 meses 3.6 INSTRUMENTOS Previa autorización del Instituto Superior de Postgrado y de las autoridades directivas del Centro de Salud Norte de la Policía Nacional se procedió a explicar la metodología y los objetivos del estudio a las pacientes que acudieron a la consulta de Ginecología para control de planificación familiar con DIU, se seleccionó a aquellas que quisieron participar por su propia voluntad y cumplieron los criterios de inclusión y exclusión. En el estudio se tomó como instrumento la determinación de IgA en sangre. 57 3.6.1 IgA ANTI CHLAMYDIA TRACHOMATIS Se extrajo 5 cm de sangre venosa mediante punción de una de las 3 venas del pliegue del codo, con una jeringuilla de 5 cc, se colocó en un tubo tapa roja sin coagulante y sus muestras fueron procesadas en el laboratorio del Centro de Salud Norte, rotulando: nombre, número de muestra, edad, número de historia clínica de la paciente. Las muestras fueron Centrifugadas a 3000 revoluciones por minuto, posteriormente se realizaron las determinaciones de los niveles de IgA Antichlamydia Trachomatis. Los valores de referencia fueron los siguientes: Negativo: Menor a 0.9 Dudoso: 0.91-0.99 Positivo: Indice de IgA de 1 o mayor 3.6.2 HOJA DE RECOLECCIÓN DE DATOS Se utilizó el llenado y recolección de datos de acuerdo a la hoja de datos del Anexo A 3.7 PROCEDIMIENTO Esquema de la Investigación. INICIO Mujeres Planificación familiar CONFORMACIÓN DEL GRUPO Mujeres con DIU Aleatorización 58 CUANTIFICACIÓN DE IgA. RESULTA DOS Determinación de IgA IIIgAuantificaci ón de Cuantificación de Las pacientes que cumplieron con los criterios de inclusión fueron sometidas a un examen sanguíneo para cuantificación de IgA Antichlamydia Trachomatis mediante Micro Elisa para IgA. Se registró la edad de la paciente, inicio de vida sexual, número de compañeros sexuales, tiempo de uso del DIU. Se estipuló como valor positivo para IgA el valor mayor o igual a 1.00 nm. Las muestras de sangre fueron tomadas en el laboratorio del Centro de Salud Norte en un periodo no mayor de tres horas de almacenamiento. Se registraron los resultados obtenidos de los exámenes del laboratorio de las mujeres en estudio, se realizó el análisis de los casos positivos y negativos para IgA Anti Chlamydia Trachomatis. 3.8 ANÁLISIS DE LOS DATOS. Los datos que caracterizaron a la población estudiada fueron sometidos a un análisis descriptivo, para lo cual las variables cualitativas se expresaron en frecuencias y porcentajes, mientras que las variables cuantitativas en promedios y desvíos estándar. La información se digitó en el programa Epi-Info VO.604 Atlanta y luego la base fue transferida para su análisis al SPSS V15. Se realizó un análisis inferencial para lo cual se calculó el Chi2, t de proporciones y t de promedios. El valor de “p” fue considerado como estadísticamente significativo si era igual o menor a 0,05. De igual manera se realizó el cálculo de intervalos de confianza con un nivel de seguridad del 95%. Los resultados obtenidos de la presente investigación, fueron presentados en tablas y gráficos. 59 3.9 CONSIDERACIONES ÉTICAS El presente estudio se ajustó a los principios éticos para seres humanos de acuerdo a la Declaración de Helsinki en 1975. A las pacientes se les hizo firmar una hoja de consentimiento informado previamente elaborado para el efecto. El estudio no representó un riesgo alguno para las pacientes, el análisis sanguíneo que se practicó no constituye riesgo al ser cuantificado. La información recopilada de la hoja de datos se manejó exclusivamente para el desarrollo de la presente investigación y únicamente por los investigadores participantes calificados, con carácter de confidencial, la identidad de las pacientes fue de absoluta reserva de los investigadores, los formularios fueron anónimos, absteniéndose de revelar por ningún concepto su contenido. 3.10 LIMITACIONES El Centro de Salud Norte de la Policía Nacional de la ciudad de Quito, atiende casos de la Especialidad de Ginecología para el Personal Policial en Servicio Activo, Servicio Pasivo y Familiares especialmente para aquellas que residen en el Sector Norte de la ciudad, es uno de los Centros de referencia de los Sub-Centros de la Policía. Una de las limitaciones que se observó en el transcurso del estudio fue en lo referente al Laboratorio, ya que no existe el Personal suficiente para la realización de exámenes, por lo que en ocasiones las pacientes fueron diferidas para otra fecha, retardando los reportes de los exámenes, así como también retardando el tratamiento en aquellas mujeres que fueron positivas para IgA anti Chlamydia Trachomatis. 60 CAPITULO IV ANALISIS E INTERPRETACIÓN DE RESULTADOS Gráfico No. 1 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” por uso de DIU según la edad. CSN-PN. mayo-agosto del 2013 50 46,2 45 41 40 35 % 30 25 20 15 11,4 10 5 1,4 0 <20 21-30 31-40 >41 años Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. Mayo-agosto 2013.Quito-Ecuador Elaboración: Norma Vaca A. En la presente investigación participaron un total de 210 mujeres sexualmente activas que acudieron al Centro de Salud Norte de la Policía Nacional de la ciudad de Quito entre los meses de mayo - agosto del 2013 con la finalidad de control de Planificación Familiar con el método del Dispositivo intrauterino (DIU). Con respecto a la edad de la muestra el promedio fue de 32.2±6.41 años, con un rango comprendido entre 15 y 49 años. En el gráfico Nº 1 se muestra la distribución de la edad de las mujeres que conforman la muestra. 61 Tabla 1 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU por edad de inicio de vida sexual activa. CSNPN. mayo-agosto 2013 Edad (años) “n” % 15 4 1,9 16 4 1,9 17 17 8,1 18 23 11 19 17 8,1 20 30 14,3 21 21 10,0 22 17 8,1 23 22 10,5 24 15 7,1 25 18 8,6 26 5 2,4 27 5 2,4 28 29 30 7 2 3 3,3 1,0 1,4 Total 210 100,0 Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. Mayo-agosto 2013 Elaboración: Norma Vaca A. El 45.2% (n=95) inició su vida sexual entre 15 y 20 años, el 44.3% (n=93) entre 21 y 25 años, en tanto que el 10.5% (n=22) inició su actividad sexual entre los 26 y 30 años. En cuanto a la edad de Inicio de vida sexual de la muestra en total se observó un promedio de 21.35±3.39 años con un rango de 15 a 30 años. 62 Gráfico No. 2 Distribución de mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU según el número de compañeros sexuales. CSN-PN. mayo- agosto 2013 70 60 58,1 50 % 40 28,6 30 20 11 10 2,4 0 1 2 3 4 compañeros sexuales Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. Mayo-agosto 2013 Elaboración: Norma Vaca A. En cuanto al número de compañeros sexuales de las mujeres, se pudo evidenciar que el 58.1% (n= 122) reportaron tener un solo compañero sexual desde que iniciaron su vida sexual, mientras que el 28.6% (n= 60) dijeron tener dos compañeros sexuales, el 11% (n= 23) revelaron tener tres compañeros sexuales, y únicamente el 2.4% (n= 5) reportaron tener al menos cuatro compañeros sexuales. La mayoría de mujeres son monógamas y el 41,9% refirieron haber tenido más de un compañero sexual 63 Tabla 2 Distribución de mujeres del estudio “prevalencia de Chlamydia Trachomatis” que utilizan DIU según el tiempo de uso del dispositivo intrauterino. CSN-PN. mayo-agosto 2013 Años de uso 1 2 3 4 5 6 7 Total ‘’n’’ % 38 18,1 76 36,2 52 24,8 23 11,0 14 6,7 5 2,4 2 1,0 210 100,0 Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto 2013 Elaboración: Norma Vaca A. En lo referente al tiempo de uso del DIU de las mujeres, se pudo observar que el 18.1% (n= 38 ) reportaron usar el DIU durante 1 año, el 36.2% (n=76) usaron el DIU por 2 años, mientras que el 24.8% (n=52) dijeron usar el DIU por 3 años, el 11% (n=23) reportaron usar el DIU por 4 años, el 6.7% (n=14) usaron el DIU por 5 años, el 2.4% (n=5) revelaron usar el DIU por 6 años, y únicamente el 1% (n=2) reportaron usar el DIU por 7 años. El promedio de tiempo de uso del dispositivo intrauterino fue de 2,63 años ±1,3 años, con un rango comprendido entre 1 y 7 años. 64 Gráfico No. 3 “Prevalencia de Chlamydia Trachomatis” por uso de DIU según determinaciones de Inmunoglobulina A. CSN-PN. mayo-agosto 2013 90 81,9 80 70 60 % 50 40 30 20 18,1 10 0 Positivo Negativo IgA Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto 2013 Elaboración: Norma Vaca A. En relación a los resultados de IgA se pudo observar que el 18.1% (n=38) presentó valores positivos (+) para IgA. 65 Gráfico No. 4 distribución de mujeres del estudio “prevalencia de chlamydia trachomatis” por uso de DIU según grupos por edad. CSN-PN. mayo-agosto 2013 60 52,6 50 44,8 39,5 40 41,3 Positivos % 30 Negativos 20 10 12,8 5,3 2,6 1,2 0 <20 21-30 31-40 >41 años Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto 2013 Elaboración: Norma Vaca A. p.NS En relación a la edad de las mujeres se pudo observar que el promedio para los casos positivos el 2.6% (n= 1) fueron menores de 20 años; el 52.6% (n= 20) estuvo en edades comprendidas de 21 a 30 años; mientras que el 39.5% (n= 15) de 31 a 40 años; y únicamente el 5.3% (n= 2) fueron mayores a 41 años de edad. El promedio de edad de los casos positivos fue de 30,74±6,02 años y de los casos negativos fue de 32,58±6,46 años (p=0,494). Con un nivel de significación p=0.494 no hubo diferencia estadísticamente significativa en lo que respecta a la edad de las mujeres que realizan planificación familiar con DIU. 66 Tabla 3 Distribución de las mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU por edad de inicio de vida sexual. CSN-PN. mayo-agosto 2013 Positivos Negativos Edad (años) “n” % “n” % 15 2 5,3 2 1,2 - 16 4 10,5 - 17 11 28,9 6 3,5 18 6 15,8 17 9,9 19 4 10,5 13 7,6 20 5 13,2 25 14,5 21 1 2,6 20 11,6 22 1 2,6 16 9,3 23 1 2,6 21 12,2 24 1 2,6 14 8,1 25 1 2,6 17 9,9 26 - - 5 2,9 27 - - 5 2,9 28 1 2,6 6 3,5 29 - - 2 1,2 3 172 100,0 30 - - Total 38 100 1,7 Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto2013 Elaboración: Norma Vaca A. P<0.01 Con respecto al inicio de vida sexual de las 210 mujeres del estudio que planifican con DIU, para los casos positivos para IgA el 97.4% (n= 37) inició su vida sexual en edades comprendidas entre los 15 a 25 años de edad, mientras que el 2.6% inició su vida sexual sobre los 25 años de edad. El promedio de inicio de vida sexual activa en las mujeres positivas para Chlamydia fue de 18,63±2,7 años y para quienes no presentan infección fue de 21,95±3,22 años (p=0,002). Con un nivel de significación p<0.01 hubo diferencia estadísticamente significativa, en lo que respecta a la edad de inicio de vida sexual. 67 Gráfico No. 5 Distribución de las mujeres del estudio “Prevalencia de Chlamydia Trachomatis” por uso de DIU según el número de compañeros sexuales. CSN-PN. mayo-agosto 2013 80 66,9 70 60 50 50 % positivos 40 30 20 30,8 18,4 negativos 18,4 13,2 10 2,3 0 0 1 2 3 4 compañeros sexuales Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto 2013 Elaboración: Norma Vaca A. P<0.01 A mayor número de compañeros sexuales mayor prevalencia de chlamydia trachomatis p<0,001 En relación al número de compañeros sexuales, para los casos positivos el 18.4% (n=7) refirió tener 1 compañero sexual; el 18.4% (n=7) dijo tener 2 compañeros sexuales; mientras que el 50% (n=19) reveló tener 3 compañeros sexuales y el 13.2% (n=5) manifestó tener 4 compañeros sexuales. El número de compañeros sexuales en las mujeres que usan DIU fue estadísticamente significativo Con un nivel de significación p<0.01 hubo diferencia estadísticamente significativa en las mujeres que usan DIU para planificación familiar en relación al número de compañeros sexuales. 68 Tabla No. 4 Distribución de las mujeres del estudio “Prevalencia de Chlamydia Trachomatis” que utilizan DIU según el tiempo de uso del método. CSN-PN. mayo-agosto 2013 Positivos Años de uso 1 2 3 4 5 6 7 Total Negativos “n” % “n” % 2 5,3 36 20,9 5 13,2 71 41,3 13 34,2 39 22,7 6 15,8 17 9,9 8 21,1 6 3,5 3 7,9 2 1,2 1 2,6 1 ,6 38 100,0 172 100,0 Fuente: Encuesta desarrollada y aplicada en la investigación en el CSN- PN. mayo-agosto 2013 Elaboración: Norma Vaca A. P<0.01 El promedio de tiempo de uso del dispositivo intrauterino paro los casos positivos fue de 3,68 ±1,4 años, con un rango comprendido entre 1 y 7 años y para el grupo negativo fue de 2,4±1,15 años (p=0,003). En lo referente al tiempo del uso del DIU para los casos positivos el 5.3% (n=2) usó el DIU por 1 año; el 13.2% (n=5) lo usó por 2 años; el 34.2% (n=13) por 3 años; el 15.8% (n=6) usó por 4 años; el 21.1% (n=8) por 5 años; el 7.9% (n =3) por 6 años; y el 2.6% (n=1) usó el DIU por 7 años. Ver tabla 4. Con un nivel de significación p<0.01 hubo diferencia estadísticamente significativa en relación al tiempo del uso del DIU. 69 DISCUSIÓN: La infección por Chlamydia Trachomatis constituye un problema en salud pública para la mujer en edad reproductiva, publicaciones recientes refieren que entre el 70 y 90% son asintomáticas. Las mujeres afectadas con este patógeno son a menudo asintomáticas y la infección puede persistir durante meses sin producir signos y síntomas, lo cual puede retardar el diagnóstico y aumentar el riesgo de secuelas a largo plazo como la infertilidad (Eng T, Butler W. 2005). Cuando las pacientes no son identificadas ni tratadas se permite que el agente infeccioso invada los tejidos, causando procesos patológicos en el aparato reproductor. Las complicaciones de estas infecciones incluyen cervicitis, uretritis, enfermedad inflamatoria pélvica, (EPI) infertilidad, entre otras. Sumado a esto, hay estudios que demuestran que la presencia de este agente facilita la transmisión del virus de la inmunodeficiencia humana y del virus papiloma humano. (Giuliano A. y Col. 2001). Los resultados revelados en el presente estudio presentan una prevalencia de Chlamydia Trachomatis del 18.1% en las mujeres que realizan planificación familiar con DIU, dosificado por micro ELISA según valores de IgA. , datos similares a los encontrados en estudios realizados por López C. 2003 (México); y por Hidalgo C. y col. 2005 (Ecuador) en su tesis de investigación realizado en mujeres fértiles asintomáticas que asisten a Consulta Externa del Dispensario Central del IESS-Quito reportando una prevalencia del 18,25%. La infección por Chlamydia Trachomatis es de distribución mundial y su importancia como problema de Salud Pública depende de la región geográfica estudiada, así se puede apreciar que la prevalencia del presente estudio es más 70 alta que la reportada en países desarrollados como E.U.A (Hasta un 11%), y Europa (2 al 9%), pero mucho más baja que la informada para Latinoamérica (Hasta un 40%). (Zenilmam J. 2006), lo que puede atribuirse a que en los países desarrollados las mujeres acuden periódicamente a controles, recibiendo tratamiento oportuno, incluido la pareja sexual. De igual manera la prevalencia en diversos estudios varían de acuerdo a la población analizada, en trabajadoras sexuales Chilenas que asistía a control a Unidades de atención de Salud sexual en Chile, (Venegas G. 2011), encontraron el 69.1%, dato que difiere mucho al reportado en esta investigación, pudiendo relacionarse con el número de compañeros sexuales, nuevas parejas, no utilización de métodos de barrera, así como a un inadecuado control de salud sexual. El promedio de Edad del grupo estudiado (Gráfico 1) fue de 32.24 ± 6.41 años con un rango de 15 a 49 años; y del grupo de mujeres positivas para Chlamydia Trachomatis (Gráfico 4) fue de 30,74± 6,02 años, (p=0,494), resultados no concordantes con los estudios realizados por Herrera, M. y col. 2005, quienes demostraron que la prevalencia de infecciones por Chlamydia es mayor en mujeres de 15 a 24 años, probablemente se debe a que el grupo etario que acude a control de planificación familiar al Centro de Salud Norte PN en su mayoría son mujeres mayores de edad, con educación Superior y profesionales en la carrera policial. La Edad en este estudio no fue estadísticamente significativa demostrándose que este factor no se relaciona con la prevalencia de Chlamydia trachomatis. 71 Factores como el inicio temprano de actividad sexual tienen un riesgo importante de adquirir infecciones por Chlamydia. Un reporte de la KFF en 1998 afirmó que la Chlamydia infecta con facilidad el cuello uterino inmaduro, haciendo que las mujeres adolescentes sean más susceptibles. La práctica de conductas sexuales de riesgo es una característica común en estas edades, lo que hace que este sector de la población esté sometido a un riesgo más elevado de ITS, EPI y sus secuelas. (Peláez J. 2012) En el estudio realizado se determinó que el promedio de edad de inicio de vida sexual (Tabla 1) de la población de estudio fue de 21,35±3,39 años, con un rango de 12 a 30 años. De las mujeres positivas para Chlamydia (Tabla 3) el promedio de inicio de vida sexual fue de 21,95±3,22 años (p=0,002). Estos resultados concuerdan con los referidos por numerosos autores que plantean que la población joven es vulnerable a estas entidades clínicas, tanto por razones biológicas como por razones de comportamiento. De hecho, a nivel mundial las tasas más altas de infecciones por Chlamydia Trachomatis son más frecuentes en mujeres adolescentes e inicio de la edad adulta entre los 15 a 24 años. (Zenilmam J. 2006, Emans J. 2005, Huneeus A. 2009). En cuanto al comportamiento sexual, diversos Autores han informado que el factor más influyente en las infecciones del tracto genital inferior femenino es el número de compañeros sexuales (Bukusi EA, Cohen CR, Meler AS. 2006) En estudios realizados en Inglaterra se calculó que el riesgo de infección es pequeño con un 3% cuando se tiene un solo compañero sexual, pero significativamente mayor al 33% cuando se tiene dos o más compañeros sexuales (Arango A I. 2001), encontrándose en esta investigación una asociación significativa con esta variable, en la que el 63.2%% de mujeres positivas para esta 72 bacteria refirió haber tenido más de 2 compañeros sexuales (Grafico No. 5) resultados que probablemente están en relación con su profesión, al tratarse de mujeres policías están sujetas a pases a distintos sitios del País, fuera del lugar de su residencia, creando inestabilidad con su pareja, desconociéndose además la conducta sexual de su compañero, lo que concuerda con la literatura en donde se menciona que los miembros de las fuerzas armadas alcanzan un nivel de prevalencia mayor al 20% (Harrison´s H. 2001). Dato importante que merece ser tomado en cuenta para la detección de Clamydia T. mediante realización de exámenes de laboratorio e instaurar tratamiento específico incluído a su pareja(s) sexual(s), evitando las complicaciones causadas por esta bacteria. El dispositivo intrauterino es un método anticonceptivo mecánico de mucha utilidad en mujeres en edad fértil, un 13% de las mujeres en edad de procrear utilizan DIU en el mundo, lo cual hace que sea el segundo método anticonceptivo de uso más generalizado luego de la salpingoclasia. (Barnet B. 2000). De las 210 usuarias estudiadas que emplearon el método, El 18.1% de mujeres presentaron infección por Chlamydia Trachomatis (Tabla 3), lo que sugiere que el empleo del dispositivo intrauterino puede ser un factor desencadenante en el desarrollo de las infecciones que permite la introducción de la bacteria en el tracto genital durante la colocación del mismo, tal como se hace referencia en las investigaciones realizadas por los Autores (Guerra-Infante FM. 2003, Berm. 2004). La mayor parte de las mujeres de la presente investigación (56.9%) usaron el DIU por 3 años (tabla Nº 4) tomando en cuenta que la duración de efectividad de la T de cobre es de 10 años. Las mujeres con dispositivo intrauterino tienen mayor riesgo de padecer enfermedades pélvicas inflamatorias, pues el DIU altera el epitelio al estar en contacto con el útero. (Guerra F. 2003) 73 El uso del DIU favorece la aparición de infecciones ginecológicas, por el hecho de ser un cuerpo extraño produce un fenómeno inflamatorio con presencia de una gran cantidad de leucocitos polimorfonucleares y macrófagos; este microambiente puede permitir el crecimiento y mantenimiento de C. trachomatis. (Guerra-Infante FM. 2003). En las infecciones genitales se debe contemplar como factor de riesgo el DIU, y además considerar que la prevalencia aumenta según se prolonga el uso de éste, existiendo la preocupación de que las guías del DIU constituyan un refugio para la colonización de gérmenes, aumentando la incidencia de infecciones resistentes. (Peláez J. 2009). De la población de estudio el promedio de tiempo de uso del DIU fue de 3,68 ± 1,4 años (P= 0.003) (Tabla Nº4) estableciéndose una asociación significativa con esta variable. De la misma manera en un estudio llevado a cabo en mujeres que asistieron a la consulta en la Clínica de Infertilidad del Instituto Nacional de Perinatología de la ciudad de México observaron que el uso del dispositivo intrauterino (DIU) fue un factor incidente en el desarrollo de la infección. (Guerra-Infante FM. 2003). Sin embargo, Hubacher, D. y col.2008; Cruz, J. y cols. 2007; Iglesias, J. y cols. 2010 por estudios llevados a cabo no encontraron asociación entre el uso de dispositivos intrauterinos y la frecuencia de ninguna de las infecciones vaginales investigadas en su estudio. De la misma manera, Alemán L. y col. 2007; González, C. 2006 en un estudio llevado a cabo en mujeres que asistieron a la consulta de ginecología del Instituto de Prevención y Asistencia Social del Ministerio de Educación del Estado de Mérida, Venezuela, al correlacionar el uso de métodos anticonceptivos (DIU) y vaginosis bacteriana tampoco encontraron diferencia estadísticamente significativa. Por la naturaleza asintomática de la infección por Chlamydia Trachomatis es difícil realizar un diagnóstico certero en base a los hallazgos clínicos y antecedentes 74 sexuales, por lo que se hace indispensable recurrir a exámenes de Laboratorio para su detección, y poder instaurar un tratamiento adecuado, evitando así la diseminación de nuevos casos y el riesgo de complicaciones asociado con ellas. Las nuevas técnicas de detección del antígeno para Chlamydia han sido de mucha utilidad en el diagnóstico, siendo catalogada la prueba de micro ELISA un buen método por su reproductividad, especificidad y sensibilidad para la investigación de anticuerpos anti chlamydia circulantes (Ostos O. 2003), por lo que en las mujeres de este estudio se realizó determinaciones de IgA mediante el método de micro ELISA encontrándose que un 18.1% resultó ser positiva para esta prueba. En el presente estudio hubo asociación de prevalencia de Chlamydia trachomatis por el uso del DIU en mujeres que lo utilizaron. Esto nos sugiere que debemos tener presente los factores de riesgo al momento de indicar un DIU, y en el caso de insertarlo habrá que vigilar más estrechamente a las usuarias. 75 CAPITULO V CONCLUSIONES Y RECOMENDACIONES CONCLUSIONES De los resultados obtenidos de la presente investigación se puede concluir: 1. La prevalencia de Chlamydia Trachomatis en las mujeres que realizan planificación familiar con DIU fue del 18,1%, confirmada con la dosificación de IgA en suero mediante el método de micro ELISA. El diagnóstico oportuno de esta infección es fundamental para prevenir las secuelas en el aparato genital, particularmente la infertilidad. Estos datos permiten concluir que la determinación de IgA anti Chlamydia Trachomatis constituye un método efectivo por su sensibilidad y especificidad, ofreciendo la ventaja de ser una prueba automatizada, procesando un gran número de muestras y los resultados se obtienen en 90 minutos. 2. La población de estudio, positiva para Chlamydia Trachomatis se caracterizó por estar dentro de un promedio de 30 años de edad, constituyéndose en esta investigación en un factor no determinante, contrario a lo que se ha establecido en varios estudios, en los que se hace referencia que esta patología se hace presente principalmente en adolescentes y jóvenes menores de 25 años de edad. 3. El promedio de inicio de actividad sexual de las mujeres positivas para Chlamydia Trachomatis fue de 21 años. Estos datos confirman que una mujer que inicia tempranamente su vida sexual tienen un mayor riesgo para estar colonizada por esta bacteria, o para la adquisición de enfermedades que 76 afectan el tracto genital inferior, muchas de las cuales se transmiten sexualmente. 4. El 63,2% de mujeres positivas para Chlamydia Trachomatis demostraron tener más de 2 compañeros sexuales, constituyéndose éste en un factor de alto riesgo para infecciones de transmisión sexual, siendo un indicador útil para la detección de Chlamydia Trachomatis mediante la realización de exámenes de laboratorio. 5. El promedio de tiempo de uso del DIU en mujeres positivas para Chlamydia Trachomatis fue mayor a 2 años. Toda usuaria de DIU debe ser supervisada periódicamente, se han reportado casos de infecciones genitales y pélvicas por DIU, si no se la descubre a tiempo invade varios órganos con las consiguientes complicaciones. Se debe recalcar la importancia de los métodos de diagnóstico para su detección y tratamiento oportuno. De esta manera el estudio ha logrado demostrar estadísticamente y con un alto nivel de confiabilidad que en la prevalencia de Chlamydia Trachomatis en la población de estudio influyó el uso del Dispositivo intrauterino asociado a algunos factores como los mencionados, y de estos resultados será posible hacer un seguimiento exhaustivo a usuarias que presentan estos factores predisponentes como probables infectadas por Chlamydia Trachomatis. 77 RECOMENDACIONES 1. Se recomienda a las autoridades de Salud investigar más exhaustivamente la prevalencia de Chlamydia Trachomatis en mujeres que utilizan dispositivo intrauterino en un grupo que abarque mayor número de pacientes y que incluya diferentes grupos etarios para conocer con mayor precisión la prevalencia de esta patología, para así implementar programas de vigilancia epidemiológica, así como también tomar medidas preventivas y oportunas que evitará la diseminación de casos y disminuirá el riesgo de complicaciones. 2. Prevención del inicio precoz de relaciones sexuales mediante la realización de programas de concienciación de la gravedad de esta enfermedad, sobre todo en la población más vulnerable que son los adolescentes y adultos jóvenes , encaminados a la prevención y difusión por diferentes medios, tal es el caso del uso adecuado de métodos de barrera (Preservativos masculino y femenino), e incentivar la relación estable y monogámica en las parejas sexualmente activas para evitar enfermedades de trasmisión sexual, entre otras la Chlamydia Trachomatis. 3. Todas las mujeres sexualmente activas deben ser examinadas anualmente en busca de Chlamydia Trachomatis, igualmente todas las mujeres con parejas sexuales nuevas o múltiples. 4. En las mujeres que decidan planificar con Dispositivo intrauterino, previa a su inserción el Facultativo deberá incluir un examen completo médico y pélvico, que incluya el pap-test, exámenes de ITS, entre otros, y efectuarse con medidas de asepsia y antisepsia estricta. Si se halla algo patológico tendrá que ser sometida a tratamiento antes de que se inserte el DIU con la finalidad de evitar infecciones en el tracto genital, debiendo acudir a controles periódicos. 5. Una vez demostrada la Prevalencia de Chlamydia Trachomatis en mujeres portadoras de DIU es importante que estas pacientes sean sometidas a controles para su respectivo tratamiento y seguimiento con determinaciones de IgA. De igual manera recibirá tratamiento su pareja o compañeros sexuales 78 para prevenir la trasmisión de la infección cada vez que sea necesario, porque no existe inmunidad después de la infección y una persona puede resultar infectada en forma repetitiva, así como también no se dispone de una vacuna para evitar la infección por Chlamydia Trachomatis. 6. Es muy importante luego del estudio realizado poder socializar la información, pues a partir de ella será posible enriquecer los conocimientos al personal de salud, lo cual permitirá disminuir la causa de esta infección o diagnosticarlos a tiempo, que es uno de los aspectos que afectan de manera significativa en este caso. 79 BIBLIOGRAFÍA AlemánL, Martínez C, Fernánez O. 2010. Diagnóstico y prevalencia de infecciones vaginales. Rev. Cubana Obstet Ginecol v.36 n.2. Ciudad de la Habana. Arango C, Salim M, Jorge V. 2001. Aspectos microbiológicos, clínicos y epidemiológicos. Rev. MVZ. Córdova; 6 (2): 87-96 Auler M, Morreira D, Rodrigues F, Margarido P, Matsumoto F, Silva E, SchneideR, Paula C. 2010 Biofilm formation on intrauterine devices in patients with recurrent vulvovaginal candidiasis. Feb.48 (1):211 Basuado JA, Cuto C, De Torres R. 1996. Microbiología Biomédica. Ed. Atlante. Buenos Aires, Argentina. 38:420-426 Berm O, Martínez V, Nieves B. 2004. Hallazgos clínicos y microbiológicos en pacientes con vaginosis bacteriana. Acta Científica SVBE. 3(1):2-17 Blake, D., Quinn. T., Gaydos, C. 2008. Should asymptomatic men be included in Chlamydia screening programs? Cost-effectiveness of Chlamydias creening among male and female entrants to a national job training program. Sex TransmDis. 35:91-101 Bucheli R. 1977 Temas de anticoncepción. Publicación HCAM-Quito. Edinec. pp:79 Bukusi EA, Cohen CR, Meler AS, Waiyaki P, Neguti R. 2006. Bacterial vaginosis risk factors among Kenyao women and their male pariners. Sex Transm Dis. 2776; 33(6) 361-7 Butler C. 2005. Are all genital Chlamydia trachomatis infections pathogenic? Sex Transm Infect. 81: 187. Cates W, Wasserheit J. 1991.Genital chlamydial infections: Epidemiology and reproductive sequelae. Am J Obstet Gynecology; 164:1771-1781. Cook RL; Ostergaard L. 2003. Current Issues in screening for Chlamydia trachomatis. Sex.Transm. Dis.5: 153–158. Corbeto E, Lugo R, Martró E, Falguera G.2011. Enfermedades infecciosas y micobiología clínica. 80 Cruz J, Yanes M, Isla A, Hernández P, Turcios S. 2007. Rev. Cubana de Medicina Gen. Integral. v.23. n.2. Ciudad La Habana. Daley. Diagnóstico Microbiológico . España : Editorial Médica Panamericana, 2007. De Lucena M, de Amorim MM, de Souza AS, de Albuquerque LC, Da Costa AA. 2008. Chlamydia infection in patients with and without cervical intraepithelial lesions. Rev Assoc. Med Bras. 54:506-512) Deluca G, Marin M, Schelover E, Chamorro E, Vicente L, Albhom M.2006. Infección por Chlamydia trachomatis y Papilomavirus en mujeres con alteraciones citohistológicas de cuello uterino. Medicina. 66(4):303306. De Palo. 2007. Patología y tratamiento del tracto genital inferior. España: Masson. Discaciatti, Vilda. 2004. Manejo de la infección genital por chlamydia Trachomatis. Evidencia Actualización en la práctica ambulatoria. Vol.7 N.1. Buenos Aires. Drake R, Vogl W, Nitchell A. 2005. Anatomy for students. First published. Main edition ISBN 0-443-06612-4. International ediktion ISBN 08089-23064. Pp 411-419 Emans J. 2005.Sexually Transmitted Infections. En Emans: Pediatric and Adolescent Gynecology. Philadelphia, Lippincott Williams & Wilkins. 565-614. Engg T, Butler W. 2003. The Hidden Epidemic: confronting sexually transmited diseases. Washington, D.C. National Academy Press. Faro S. 2001.Chlamydia trachomatis: Female pelvic infection. Am J Obstet Gynecol Franzini L, Marks E, Cromwell PF, Risser J, et al. 2004.Projectedeconomic costs due to health consequences of teenagers’ lossof confi dentiality in obtaining reproductive health care servicesin Texas. Arch Ped. Adolesc Med.158:1140-6.1999; 164:1767-1770. 81 Frontela M, Rodríguez Y, Verdejas O, Valdés F. 2006. Infección por Chlamydia trachomatis en mujeres cubanas en edad reproductiva. Rev. Cubana Endocrinol. 17(2) Fuenzalida D. 2011. El Dispositivo Intrauterino (DIU). Disponible en: http://www.monografias.com/trabajos88/dispositivointrauterino/dispositivo-intrauterino.shtml. Geisler W, Tang J, Wang C, Wilson C, Kaslow R. 2004. Epidemiological and Genetic Correlates of Incident Chlamydia trachomatis Infection in North American Adolescents. JID. 190:1723-1729 Giuliano A, Denman C, Guernsey De Zapien J. 2001.Desing and results of the USA-Mexico border human papiloma virus (HPV). cervical dysplasia, and chlamidya trachomatis study. Rev. Panam Salud pública; 9 (3):172-181 González C, Moreno MA, Nieves B, Flores A, Chille A, Carrero S. 2006. Infección vaginal en pacientes que asisten a consulta ginecológica. Revista de la Sociedad Venezolana de Microbiología. 26(1). Disponible en: http://www.scielo.org.ve/scielo.php Guerra-Infante F, Flores S, Arteaga G, Zamora A, López M, Ortiz J. 2003. Factores de riesgo y secuelas reproductivas asociados a la infección por Chlamydia trachomatis en mujeres infértiles. Salud Pública Méx.Vol. 45(5):672-680 Haimovich S. 2009. Profile of long-acting reversible contraception users in Europe. The European Journal of Contraception and Reproductive health CareMonth 2;14(0):1 Hamdad F, Orfi J, Boulanger JC. 2004. Chlamydia trachomatisurogenital infections in women. Best diagnostic approaches.Gynecol Obstet Fertil 2004; 32:1064-74. Handsfield. 2002 ETS (enfermedades de transmisión sexual). Infecciones por chlamydia 1º edición. Madrid: Marbán. ISBN 84-7101-328-7 Harrison´s 2001. Princple of Internal Medicine. Stamm W.Chlamydial infections. McGraw.15th Edition. ISBN 0-07-137479-5. 82 Herrera M, Mendoza R, Sánchez r, Parra I, Ostos O. 2005. Prevalencia de Chlamydia Trachomatis en pacientes con vaginosis y vaginitis inespecífica que asisten a Hospitales de la Secretaría de Salu de Bogotá. Nova-Publicación Científica ISSN: 1794-2470 Vol 3. 1-120k of tubal infertiliy among nulligravid women. NEngl J Med.; 345: 561-67 Hidalgo, C. Jiménez W. Toledo S. 2005. Tesis UCE. Prevalencia de Chlamydia trachomatis en mujeres fértiles asintomáticas del Dispensario Central del IESS. Hubacher D.2008. Do side effects from the copper IUD truly dissipate over time? Contraception. 78: 167195 Huneeus A, PumarinoM, Schilling A, Paz R, Bofil M. 2009. prevalencia de Chlamydia Trachomatis y Neisseria gonorrhoeae en adolescentes chilenas.Rev.Médica de Chile. V.137 N. 12 Infante N, Mendo N, Hernández T, Cala L. 2005. Factores de riesgo asociados a la infección vaginal por Chlamydia trachomatis INEC. Instituto Nacional de Estadísticas y Censos. 30 de septiembre de 2013 <http://www.inec.gob.ec/estadisticas/?option=com_content&view=article &id=75&Itemid=46&TB_iframe=true&height=720&width=1745>. Iglesias J, Rodríguez D, González G. 2007. Medicina Universitaria. 9 (35):53-57 Ingraham J, Ingraham Catherine.1998. Introducción a la microbiología. Barcelona: Reverté. Pp.410-415 KFF-Kaiser Family Foundation. 1998. Sexually Transmited Diseases in America How many Cases and What Cost? Mela Park, CA Kaiser Family Foundation and American Social Health Association. Kodaman PH, Arici A, Seli E. 2004. Evidence-based diagnosis and management of tubal factor infertility. Curr Opin Obstet Gynecol. 16:221-229 83 López C. 2003. Tesis UNAM. Agentes etiológicos más frecuentes de infección cervicovaginal en mujeres embarazadas atendidas en el HEODRA. León-México. López M, Guerra, F. 2002. Papel de los anticuerpos en el desarrollo de la infección por chlamydia trachomatis y su utilidad en el diagnóstico. Perinatología Reproducción Humana. 16: 140-150 México, DF. Madigan, M., Martinko. J. Parker J. 2003. Biología de los microorganismos. Pearson Educación, SA. 28006. Madrid. Pp. 714-718) Martínez, M. 2009. Diagnóstico microbiológico de las infecciones de transmisión sexual (ITS) parte 1. ITS. No virales. Revista Chilena de Infectología. 26 (6); 529-539 Martini F, Timmons M, Tallitsch R. 2009. Anatomía Humana. Pearson Educación, SA. Madrid. 6º Edición. ISBN: 978-84-7829-4. pp: 727-739 Mohllajee AP, Curtis KM, Peterson HB. 2006. Does insertion and use of an intrauterine device increase the risk of pelvic inflammatory disease among women with sexually transmittedinfection? A systematic review. Elsevier. Contraception. 73. 145–153. MSP. Anuario de camas e ingresos hospitalarios. 2008. Quito: Ministerio de Salud Pública del Ecuador. OMS. 2007. Estrategia Mundial de Prevención y Control de las Infecciones de Transmisión Sexual. Ginebra: Organización Mundial de la Salud. .Organización, SEC. 2006. Anticoncepción Intrauterina. http://www.comsegovia.com/pdf/cursos/gine/DIU.pdf. ORGENICS.«http://www.brassora.com.ar/productos/imagenes/pdf.técnica inmunocomb/CHLAMYDIA%20TRACHOMATIS%20IGA.» 26 de 08 de 2013. Ostos O. 2003. Chlamydia trachomatis: avances y perspectivas. 81-93. Colombia. Peláez J. 2012. Enfermedad pélvica y adolescencia. Rev. cubana de Obst. y Ginecol. vol.38. n.1. Ciudad de la Habana. 84 Peláez J.2009. Métodos anticonceptivos y adolescencia. Consideraciones para su selección e indicación. Controversias y aspectos novedosos sobre anticoncepción. La Habana: Editorial Científico-Técnica; 2009. pp. 3758. Rolla, Edgardo. 2008. Dispositivos intrauterinos. Asociación Médica de Anticoncepción. Argentina Rouviére H. 2005. Anatomía Descriptiva, Topográfica y Funcional. 11. ed. Barcelona. Masson SA. pp. 657-665. Schaechter M. 2004. The Desk Enciclopedia of Microbilogy. Elsevier Academic Press. San Diego, California 92101-44-95. USA. pp: 887-892 Smith, Roger. 2004. Ostetricia, Ginecología y Salud de la Mujer. México: Elsevier Masson. StammWE. 2001. Chlamydia trachomatis -the persistent pathogen: Thomas Parran Award Lecture. Sex Transm Dis 2001; 28: 684-689. Tepper Nk, Steenland MW, Gaffield ME, Marchbanks PA, Curtis KM. 2012.Retention of intrauterine devices in women who acquire pelvic inflammatory disease: a systematic. Contraception.S00107824 (12)00738. Thibodeau G. Patton, Kevin. Anatomía y Fisiología. 2007. Sexta Edición. Elsevier España, SA. 28020 Madrid. España. pp. 1130-1139 Tortora G. 2008. Principios de Anatomía y Fisiología. Editorial Médica Panamericana. 11ª Edición. pp: 1077-1095 Underhill G; Hewitt G; McLean RN; Randall S. 2003. Who has chlamydia? The prevalence of genital tract Chlamydia trachomatis within Portsmouth and South East Hampshire, UK. . J. Fam. Plann. and Reprod. Health Care. 29(1): 17–20. Venegas G, Boggiano G, Castro E.P. 2011. Prevalencia de vaginosis bacteriana en trabajadors sexuales chilenasa. Rev. Panam. Saludd Pública..30 (1) 46-50. 85 Waknine,Y FDA.2005 approvals: Paragard, sure-screen, collagen bone healing protective sheet. Medscape Medical News. Retrieved from http://www.medscape.com/viewarticle/51612 Workowski KA, Berman S. Centers for Disease Control and Prevention (CDC). Sexually transmitted diseases treatment guidelines, 2010. MMWR Recomm Rep. 2010; 59(RR-12):1-110. Zenilman J, Gaydós C, Diener W, Howell M. 2006. Infección por Chlamydia Trachomatis en mujeres cubanas en edad reproductiva. Rev. Cubana de Endocrinología. v.17. n.2 de la Habana. 86 ANEXOS 87 ANEXO A HOJA FRONTAL DE RECOLECCIÓN DE DATOS PROYECTO DE INVESTIGACIÓN: Prevalencia de Chlamydia Trachomatis en las mujeres que utilizan dispositivos intrauterinos (DIU), en edad fértil de 15 a 49 años de edad. Centro de Salud Norte de la Policía Nacional. Quito, Mayo - Agosto 2013 HOJA FRONTAL DE RECOLECCIÓN DE DATOS Datos Generales: HCI: Nombre y Apellido: Fecha: Edad: IVS 15 a 19 años __________ 15 a 19 años ___________ 20 a 24 años __________ 20 a 24 años ___________ 25 a 29 años __________ 25 a 29 años ___________ 30 a 34 años __________ 30 a 34 años ___________ 35 a 39 años __________ 35 a 39 años ___________ 40 a 44 años __________ 40 a 44 años ___________ 45 a 49 años __________ 45 a 49 años ___________ Laboratorio Resultado de IgA Para Chlamydia Trachomatis IgA > 1 ___________ IgA < 1 ___________ No. 1. 2. 3. 4. 5. 6. Compañeros Sexuales __________ __________ __________ __________ __________ __________ Planificación Familiar DIU T. de Cu. Tiempo de uso 1 año ___________ 2 años ___________ 3 años ___________ 4 años ___________ 5 años ___________ 6 años ___________ 7 años ___________ 8 años ___________ 9 años ___________ 10 años __________ Médico quien realiza la encuesta ……………………………………………………………………………………… Fecha de realización …………………………………………………………………………………………………………. Código…………………………………………………………………………………………………………… ………………….. Diagnóstico …………………………………………………………………………………………………………………… …. 88 ANEXO B CONSENTIMIENTO INFORMADO PREVALENCIA DE CHLAMYDIA TRACHOMATIS EN MUJERES QUE UTILIZAN DISPOSITIVO INTRAUTERINO (DIU) EN EDAD FÉRTIL DE 15 A 49 AÑOS DE EDAD. CENTRO DE SALUD NORTE DE LA POLICIA NACIONAL. 2013. FECHA día / mes / año: - - A QUIEN CORRESPONDA: Declaro libre y voluntariamente ____________________________ mi cédula que de mi identidad nombre es es número ____________________ y que acepto participar en el presente proyecto de investigación, que se realizará en el Centro de Salud Norte de la Policía Nacional, cuyo objetivo es Determinar si el uso del dispositivo intrauterino (DIU) constituye un factor desencadenante para la prevalencia de infección genital por Chlamydia Trachomatis. Se me ha indicado que la presente investigación no significa riesgo alguno para mi integridad personal y que se respetará mi identidad con formularios anónimos para la recolección de los datos. Se me ha informado explícitamente que soy libre de rechazar mi participación en el estudio si así lo decido, y que esta decisión no interviene en la atención que yo reciba por parte del Centro de Salud Norte. Estoy consciente de que puedo solicitar mayor información acerca del presente estudio si así lo deseo. FIRMA: ____________________ 89 ANEXO C RECURSOS PARA LA INVESTIGACION HUMANOS - Director de Tesis: Dr. Andrés Calle M. Investigadora: Dra. Norma Vaca A. Asesor: Dra. Jéssica Guarderas Laboratorista: Dra. Pilar Vásquez MATERIALES Una computadora Un lector de micro Elisa mara Human Una resma de hojas Cartucho de computadora Copias (información de Internet Movilización Costos de exámenes y reactivos Jeringuillas y tubos Otros TOTAL RECURSOS FISICOS - Equipo lector microELISA Medio de refrigeración 90 COSTO 400 500 25 25 30 250 600 70 100 2000 CURRICULUM VITAE Norma Jacqueline Vaca Acurio Nacido en Pujilí (Provincia de Cotopaxi), el 08 de febrero de 1961, hija de Luis Abelardo Vaca Estrella y Zoila Victoria Acurio Cepeda. Cursé mis estudios de primaria en el colegio Santa Mariana de Jesús y la secundaria en el colegio Victoria Vásconez Cuvi de la ciudad de Latacunga sin complicaciones. El 4 de agosto de 1986 me recibo como Doctor en Medicina y Cirugía en la Universidad Central del Ecuador de la ciudad de Quito. En el año 1990 ingreso al postgrado de Ginecología y Obstetricia en la Universidad Central del Ecuador. La práctica laboral médica inicio a temprana edad y realizo la medicatura rural en la parroquia de Canoa, del cantón Bahía de Caráquez de la provincia de ManabíEcuador (1986-1987), actualmente Mayor de Policía de Sanidad de la Policía Nacional del Centro de Salud Norte (FEPOL) DIRECCION DE CORRESPONDENCIA Nombre: Norma Jacqueline Vaca Acurio E-mail: [email protected] Número telefónico: 0984257206 Dirección Domiciliaria: Quito. Av. Galo Plaza Lazo y Santo Domingo de Carretas. Urbanización Urabá Calle H-134) Lugar de trabajo: Centro de Salud Norte de la PN. Número telefónico: 2482625 91