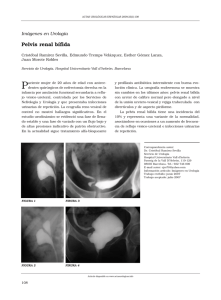
Texto completo en formato PDF - Sociedad Argentina de Urología
Anuncio

Revista Argentina de 1 Volumen 70 Año 2005 UROLOGIA Organo de la Sociedad Argentina de Urología Director: Asesores del Director: Dr. Ameri, Carlos A. Dr. Fayad, Elías J. Dr. Rovegno, Agustín R. Propietario Editor Responsable Sociedad Argentina de Urología Comité Editorial: Dr. Chéliz, Germán Dr. Bernardo, O. Norberto Director Dr. Carlos Alberto Ameri Comité de Redacción: Domicilio legal Pasaje De la Cárcova 3526, (1172) Ciudad de Buenos Aires, República Argentina. Tel.: 4963-8521/4336/4337 E-mail: [email protected] Dr. Contreras, Pablo Dr. Cobreros, Christian Dr. Barros, Diego Coordinador de las Noticias de la SAU: Revista Argentina de Urología Vol. 70, Nº 1, año 2005 Derecho de Propiedad Intelectual Nº 327.656/2004 COMITÉ EJECUTIVO CONSEJO EDITORIAL NACIONAL Dr. Bechara, Amado J.; Cap. Fed. Dr. Becher, Edgardo F.; Cap. Fed. Dr. Bogado, Humberto E.; Ba. Blanca Dr. Casabé, Alberto R.; Cap. Fed. Dr. Frattini, Gustavo; Mar del Plata Dr. Garrido, Gustavo; Cap. Fed. Dr. Ghirlanda, Juan; Cap. Fed. Dr. Giúdice, Carlos R. (h); Cap. Fed. Dr. Grossi, Omar; Luján Dr. Gueglio, Guillermo; Cap. Fed. Dr. Guzmán, Juan Manuel; Cap. Fed. Dr. Hernández, Alberto; Cap. Fed. Dr. López Laur, José Daniel; Mendoza Dr. Mazza, Osvaldo N.; Cap. Fed. Dr. Mingote, Pablo; Cipoletti Dr. Minuzzi, Pedro; Córdoba Dr. Moisés, Miguel J.; Tucumán Dr. Pautasso, Oscar; Córdoba Dr. Podestá, Miguel L.; Cap. Fed. Dr. Rey Valzacchi, Gastón; Cap. Fed. Dr. Rivero, Miguel A.; Cap. Fed. Dr. Romano, S. Víctor; Cap. Fed. Dr. Rozanec, José J.; Cap. Fed. Dr. Sáenz, Carlos; Cap. Fed. Dr. Zeno, Lelio; Rosario CONSEJO EDITORIAL INTERNACIONAL Dr. Arap, Sami; Brasil Dr. Boccon-Gibod, Laurent; Francia Dr. Escovar, Paul; Venezuela Dr. García Guido, Luis; Uruguay Dr. González, Ricardo; Estados Unidos Dr. Jiménez Cruz, Fernando; España Dr. Jordan, Gerald; Estados Unidos Dr. Lobel, Bernard; Francia Dr. Morales, Álvaro; Canadá Dr. Resnik, Martín I.; Estados Unidos Dr. Rodrigues Netto, Nelson (Jr.); Brasil Dr. Schulman, Claude; Bélgica Dr. Valdivia-Uría, José G.; España Dr. Vallancien, Guy; Francia Coordinación y corrección Rosa Frontera Tel.: 4504-0577 Compuesta e impresa en Argentina por «Marcelo Kohan/ diseño + broker de impresión», [email protected] Edición Abril de 2005 Foto de tapa Quiste celómico abdominal Revista Argentina de Urología indexada en la base de datos de LILACS. Rev. Arg. de Urol. · Vol. 70 (1) 2005 Dr. Atchabahian, Pablo I SOCIEDAD ARGENTINA DE UROLOGÍA C O M I S I Ó N D I R E C T I VA 2005-2006 Presidente: Vicepresidente: Secretario Científico: Prosecretario Científico: Secretario Administrativo: Prosecretario Administrativo: Dr. Norberto Miguel Fredotovich Dr. Oscar Héctor Damia Dr. Lorenzo Grippo Dr. Amado José Bechara Dr. Claudio Adrián Rosenfeld Dr. Ernesto Omar Rodríguez Vocales Titulares: Dr. Pablo Atchabahián; Dr. Hugo Carlos Borgnia; Dr. Emilio Miguel Longo; Dr. Héctor Natalio Malagrino; Dr. Andrés Rebaudi; Dr. Ángel Luis Tiscornia Vocales Suplentes: Dr. Daniel Jorge Ekizián; Dr. Jorge Enrique Labrador Órgano de Fiscalización: Dr. Miguel Ángel Costa; Dr. Alberto José Muzio; Dr. Miguel Luis Podestá COMITÉS DE LA SAU Comité de Congresos y Jornadas Comité de Publicaciones y Sesiones Científicas Dr. Miguel Ángel Costa Dr. Carlos Alberto Ameri Comité de Biblioteca Comité de Educación Médica Continua Dr. Pablo Alejandro Ranitzsch Dr. Jorge Humberto Schiappapietra Comité de Residencias Médicas en Urología Comité de Especialidades Urológicas Dr. Juan José Solari Dr. Osvaldo Néstor Mazza Comité Colegio Argentino de Urólogos Comité de Relaciones Internacionales Dr. Horacio A. Levati Dr. León Bernstein Hahn Comité de Interior Comité de Ética Dr. Carlos A. Acosta Güemes Dres. Marco Aurelio Castría; Alfredo Osvaldo Rizzi; Roberto Juan Barisio Comité de Defensa de los Intereses Profesionales Dr. Horacio Manuel Rey II Comité de Bioética Dr. César E. Aza Archetti Indice EDITORIAL 1 El problema ético del médico Dr. Luis Allegro HISTORIA DE LA UROLOGÍA 3 ARTÍCULOS ORIGINALES 8 Recopilaciones sobre una práctica quirúrgica vergonzante: la castración Dr. Norberto M. Fredotovich Epidemiología de la vejiga hiperactiva sobre una población de 3.692 consultas urológicas y 2.030 estudios urodinámicos Prof. Dr. García Salord, J.; Prof. Dr. Belén, R.; Dr. Bevilacqua, O.; Dr. Cabrera, R. 14 Adrenalectomía laparoscópica: experiencia inicial Dres. Jurado, A.; Piana, M.; Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. 21 Terapia intravesical con o sin mantenimiento de bacilo de Calmette-Guerin en carcinoma transicional T1G3 vesical Dres. Chernobilsky, V.; González Morales, M.; Momesso, A.; Elsner, B.; Becher, E.; Borghi, M.; Montes de Oca, L. 26 Estenosis de uretra anterior complejas. Resolución quirúrgica Dres. Chéliz, G. M. J.; Kogan, D.; Rizzo, M.; Castro, F.; Rey, H. M.; Fredotovich, N. 31 Lugar actual de la embolización transarterial en tumores renales Dres. Gueglio, G.; Piana, M.; García Mónaco, R.; Peralta, O.; Damia, O. 42 Evolución de diferentes estrategias de biopsia prostática en pacientes con tacto rectal no sospechoso y Antígeno Prostático Específico (APE) elevado: propuesta de un nuevo esquema “4 x 4” Dres. Borghi, M.; Becher, E.; Montes de Oca, L.; Momesso, A.; González Morales, M.; Repetti, P. TÉCNICA QUIRÚRGICA 54 Orquidopexia laparoscópica. Técnica de elección para el testículo intraabdominal Dr. Juan Moldes COMUNICACIÓN DE CASOS Rev. Arg. de Urol. · Vol. 70 (1) 2005 57 Schwannoma retroperitoneal. Reporte de un caso y revisión de la literatura Dres. Jurado, A.; Piana, M.; Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. V VI Quiste celómico abdominal. Un diagnóstico diferencial del quiste de uraco COMUNICACIÓN DE CASOS 61 COMENTARIO DE TRABAJOS 64 66 67 Dr. Mariano González Morales Dr. Carlos A. Ameri Dr. Horacio Manuel Rey XIV CORREO DE LECTORES XVII NOTICIAS DE LA SAU Dres. Rabin, G.; Rodrigo, J.; Lautersztein G.; Rovegno A.; Fernández H. Index EDITORIAL 1 Ethics questions in medicine Dr. Luis Allegro HISTORY OF THE UROLOGY 3 ORIGINAL ARTICLES 8 History of a shamefull urological practice: the castration Dr. Norberto M. Fredotovich Overactive bladder epidemiology in a population of 3692 urology visits and 2030 urodynamic studies Prof. Dr. García Salord, J.; Prof. Dr. Belén, R.; Dr. Bevilacqua, O.; Dr. Cabrera, R. 14 Laparoscopic adrenalectomy: initial experience Drs. Jurado, A.; Piana, M.; Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. 21 Intravesical bacillus Calmette-Guerin therapy with or without maintenance in transitional T1G3 bladder carcinoma Drs. Chernobilsky, V.; González Morales, M.; Momesso, A.; Elsner, B.; Becher, E.; Borghi, M.; Montes de Oca, L. 26 Complex anterior urethral strictures. Surgical treatment Drs. Chéliz, G. M. J.; Kogan, D.; Rizzo, M.; Castro, F.; Rey, H. M.; Fredotovich, N. 31 Current place of the transarterial embolization in renal cell carcinomas Drs. Gueglio, G.; Piana, M.; García Mónaco, R.; Peralta, O.; Damia, O. 42 Evolution of the different strategies of prostatic biopsy in patients with normal rectal examination and PSA rise: new technique “4 x 4” Drs. Borghi, M.; Becher, E.; Montes de Oca, L.; Momesso, A.; González Morales, M.; Repetti, P. SURGICAL TECHNIQUE 54 Laparoscopic orchidopexy. The gold standard for intraabdominal testicle Dr. Juan Moldes CASE REPORTS 57 Retroperitoneal Schwannoma. Case report and review of the literature Drs. Jurado, A.; Piana, M.; Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. 61 Abdominal celomic cyst. A differential diagnostic of urachus cyst Drs. Rabin, G.; Rodrigo, J.; Lautersztein G.; Rovegno A.; Fernández H. COMMENTARY OF ARTICLES Rev. Arg. de Urol. · Vol. 70 (1) 2005 64 66 67 Dr. Mariano González Morales Dr. Carlos A. Ameri Dr. Horacio Manuel Rey XIV READERS MAIL XVII SAU NEWS IX EDITORIAL EDITORIAL El problema ético del médico Ethics questions in medicine Dr. Luis Allegro Al médico –cuando está frente al paciente, en la intimidad de su consultorio y en la intimidad de sí mismo– se le plantean dos preguntas básicas: 1) qué puedo hacer por este paciente, y 2) qué debo hacer por esta persona. Si se observan con detenimiento estas preguntas, cada una tiene una categoría diferente: en la primera el ser humano es visto como un paciente y en la segunda, como una persona. Entre ellas hay una diferencia sideral, pero las dos son importantes. Cuando el médico se pregunta internamente “qué puedo hacer por este paciente”, el meridiano pasa por la ciencia. Se está refiriendo a su bagaje de conocimientos científicos, su experiencia médica y toda su capacitación profesional. Esto incluye todo lo que estudió y aprendió en la universidad, en el contacto con sus maestros, con sus colegas, con sus pacientes, con los libros, con las revistas médicas, con los congresos, con los cursos de postgrado, con las reuniones científicas, etc. etc. En ese momento, frente a su paciente, recurre a todas sus condiciones personales e intelectuales y las pone al servicio de su “poder hacer” en la que está incluida su potencialidad médica. Cuando el médico se pregunta “qué debo hacer por esta persona”, entonces el problema pasa por el meridiano de la ética y se está refiriendo al conjunto de normas, principios y valores con los cuales el médico maneja, conduce y regula su comportamiento profesional. Esta conducta médica adquiere siempre la forma primordial que la da arquitectura como persona humana, y es este enfoque el que le permite encontrar en este paciente que tiene delante, a la persona que está incluida en el mismo cuerpo, de tal modo que “paciente y persona” constituyen una unidad indisoluble. LA CONDICIÓN DE PERSONA Desde el año 1970 en adelante, se viene conociendo el “fenómeno bioético”, cosa que está logrando un desarrollo considerable en los últimos años. Este fenómeno surge de comprender que el ser humano no es un objeto, ni es una máquina que se descompone en partes o aparatos (digestivo, respiratorio, etc.). El ser humano es una persona que tiene conciencia de sí mismo, o sea que tiene conocimiento de sí mismo y de su propia existencia y que tiene autonomía, que es capacidad de autodeterminación. La noción de persona tiene un lugar privilegiado en este modelo. Esto plantea la obligación de distinguir y diferenciar lo que es la vida biológica, de lo que significa la vida personal. Presidente de la Sociedad de Ética en Medicina Asociación Médica Argentina Rev. Arg. de Urol. · Vol. 70 (1) 2005 El médico y la ética: operación ética mínima Veamos, qué debe hacer el médico en cuanto a la ética. En este sentido el panorama es muy amplio porque hoy, es importante que el médico tenga una buena formación ética. Por lo menos, debe contar con las nociones básicas de lo que puede llamarse una “operación ética mínima”. El médico debe tener presente frente al paciente una operación ética mínima que contemple los siguientes tres pasos: 1) la comunicación de la verdad, 2) el consenti- 1 miento informado, y 3) la “segunda opinión”. Estos tres puntos son conceptuales, es decir que el profesional debe tener el concepto bien claro de qué es lo que significa cada uno de ellos, para cumplirlos en el momento más adecuado de las primeras entrevistas. Es muy importante no dilatar el momento de efectuarlas. La comunicación de la verdad: La verdad debe regir permanentemente la comunicación en la relación médico-paciente. La verdad es importante porque permite establecer un vínculo de sinceridad en dicha relación. Es necesaria porque le da base firme a lo que el paciente debe conocer de su padecimiento para que pueda poner todo su interés al servicio de la curación. Es terapéutica, porque el paciente que conoce bien la realidad sobre su enfermedad puede administrar mejor sus energías dándoles un sentido positivo y así optimizar la evolución hacia la curación. Pero es necesario saber que la verdad debe ser comunicada en forma gradual, paso a paso, respetando la receptividad del paciente, de modo que –según la magnitud del caso– pueda tolerarla tanto mental, como emocionalmente. El consentimiento informado: Se refiere a que el médico debe dar una información clara y sencilla –en un lenguaje común que sea accesible al paciente– de todo lo concerniente tanto a la enfermedad como al tra- 2 tamiento. Antes de concretar alguna medida terapéutica o diagnóstica, debe ser consultada al paciente y éste debe dar su consentimiento. La consulta debe ser al interesado en primer lugar, y luego a los familiares del mismo, o en su defecto, a aquellas personas que están directamente vinculadas con el paciente. Esta condición de contar con dicho consentimiento plantea que la relación médico-paciente sea de carácter horizontal, de igual a igual entre dos personas que están igualmente interesadas en esa situación médica. Esto plantea una diferencia total con la relación que antes se establecía entre el médico y el paciente, que era una relación vertical y paternalista, en la cual el médico tomaba la decisión y asumía toda responsabilidad. La segunda opinión: Este es un concepto que ha surgido en los últimos años. Se refiere a que cuando el paciente tiene una duda respecto de su diagnóstico y/o de su tratamiento, tiene el derecho de consultar a otro médico o a todos los que necesite hasta resolver sus dudas. Es bueno asegurarle al paciente todas las condiciones para que tome sus decisiones y realice su tratamiento en las mejores condiciones posibles. En este sentido es importante darle la seguridad de que él debe adoptar una posición activa en las decisiones de la conducción de su tratamiento. HISTORIA DE LA UROLOGIA HISTORY OF THE UROLOGY Recopilaciones sobre una práctica quirúrgica vergonzante: la castración History of a shamefull urological practice: the castration Dr. Norberto M. Fredotovich* La historia es la recopilación de los hechos de la humanidad. La mayor parte de ellos están referidos a los logros como los descubrimientos de nuevas tierras, los conocimientos arquitectónicos, urbanísticos, culturales, estéticos, literarios y científicos. El resto, que también es historia, está conformado en parte por hechos aberrantes para la civilización. Es así como debemos conocer además la historia de la barbarie, la crueldad, la lujuria, el fanatismo religioso y el arte del “bel canto” a través de una práctica quirúrgica vergonzante: la castración. Para conocer sus orígenes debemos remontarnos al paso del período Paleolítico al Neolítico hace 10.000 a 7.000 años, en la Edad de Piedra, donde el hombre de hábito nómada, de cazar animales y recoger frutos para su sustento, se hace estable y mediante los cultivos de granos y la domesticación del ganado instaura una nueva forma de procurarse alimentos: la producción. El paso siguiente fue “la revolución urbana” con la aparición de las Ciudades Estados y posteriormente el desarrollo de los llamados Imperios. A partir de éstos se instalan nuevos hábitos en las sociedades, como la propiedad de las tierras, la construcción de grandes templos, las guerras entre los estados y la práctica de la esclavitud. De acuerdo con los antiguos documentos médicos, parece ser que “la castración” fue la primera cita de un procedimiento quirúrgico realizado por el hombre. Una tribu del Turkestán, en el Asia Central, llamada “Hien Hun” (2400 a.C.), castraba a sus caballos para mejorar la velocidad y resistencia de esta especie, se los denominaba “equs hunicus”. * Jefe División Urología, Hospital Carlos G. Durand. Rev. Arg. de Urol. · Vol. 70 (1) 2005 La práctica de la castración en humanos comenzó en los pueblos de Persia, Anatolia y la Mesopotamia después de la Edad de Bronce, estuvo asociada con la primera cultura Euroasiática, los “eunucos” nacieron en la cuna de la civilización. En ese entonces “los dueños” de los esclavos por temor a que se los roben o que se escapen, y al mismo tiempo para hacerlos más dóciles, comenzaron a marcarlos con fuego y a castrarlos. En la Civilización del Nilo (3.000 a.C.) los faraones ordenaron mutilar los penes de los enemigos muertos en batalla, para que posteriormente los escribas certificaran a los faraones el número de las bajas adversarias. Esta práctica se amplió posteriormente para castrar a los soldados derrotados tomados prisioneros. También la castración fue instalada como pena o castigo a los agresores sexuales en Egipto. Figura 1. Relieve en Medinet Haby mostrando a un soldado y un escriba egipcios, contar los penes avulsionados a los adversarios muertos en la batalla. 3 En Asiria, el “Código” del Rey Hammurapi (1750 a.C.) admitía la castración de los esclavos y establecía que debían realizarla los “gallabus” o “barberos”, considerados como auxiliares de la Medicina, que estaban autorizados para los procedimientos quirúrgicos menores, tales como: extracciones dentarias, marcar con hierro candente y la castración de esclavos. La castración también podía ser aplicada a los hombres enfermos y disminuidos. Tanto en el antiguo Egipto como en la Civilización Asiria existían mitos religiosos como el de Osiris y el de Kumarbi respectivamente que legitimaban la castración del enemigo vencido. De igual manera en la mitología griega Cronos castró a su padre con una hoz y con la sangre que brotaba de la herida de Urano, éste fecundó a la Tierra (Gaia); estando este mito de acuerdo con la teoría aristotélica que aseguraba que el esperma derivaba de la sangre. En los textos griegos se encuentran referencias respecto de indicar la castración no sólo a los esclavos y enemigos, sino también cuando estaban presentes defectos congénitos. De acuerdo con los escritos del historiador Marcelino Amiamus y al poeta Claudio Claudiano del siglo IV a. C., la Reina Semiramis de Asiria (900 a.C.), fundadora de Babilonia, fue quien inauguró la costumbre de castrar hombres, para evitar los riesgos del embarazo y satisfacer su libido sin peligro. Esta costumbre se expandió rápidamente en el Oriente y llegó a Roma, donde castrar a los esclavos era el motivo contraceptivo más seguro para las lujuriosas “matronas” de las clases dominantes. En esa época era frecuente escuchar entre las mujeres “no hay sexo más seguro que el sexo con eunucos”. Hasta comienzos del siglo I d.C. la operación era realizada por los “tonsores” o “barberos”; posteriormente y para asegurarse que la operación estaba bien realizada contrataban a hábiles cirujanos. En los libros de “Sátiras” el poeta Juvenal cuenta como el conocido cirujano griego Heliodoro cortaba los testículos maduros de los esclavos. En sus “Controversias” Séneca cuenta cómo las “matronas romanas” castraban a sus jóvenes amantes para satisfacer su indecente lujuria por más tiempo. Martial en sus “Epigramas” se pregunta:“Oh Pámido, te has preguntado por qué Gellia tiene sólo esclavos eunucos? Es claro que para satisfacer su lascivia sin embarazarse”. Esta práctica se prolongó tanto tiempo que cuenta el historiador Suetoño que el Emperador Dominiciano prohibió en 140 d.C. la castración de los esclavos. Dicha ley fue permanentemente violada, obligando a intervenir a distintos emperadores con castigos más severos. Estos procesos llegaron a su clímax con Constantino 4 el Grande (247-327) con penas capitales y confiscaciones de la casa donde se realizó la operación. Todo fue en vano, el historiador Lampridius en su “Vita Alexandri Severi” dice: “Existe una tercera clase de hombres, éstos son los eunucos, que no deben ser tomados en cuenta como hombres, sino sólo por las mujeres nobles y con moderación”. Cirujanos y barberos continuaron realizando castraciones confidencialmente. Algunos se excedían y cortaban no sólo los testículos, sino también el pene. Sus víctimas eran llamadas “casamartia” y la técnica se impuso en Bizancio donde el Emperador Justiniano en el año 644 poseía una guardia de palacio de eunucos. Además estos esclavos se comercializaban por un alto precio y este provechoso mercado se perpetuó durante cientos de años. El eminente cirujano Paulo de Egina le dedicó en sus escritos “Epitomes” un capítulo a esta vergonzosa operación. Afirmaba en dicho texto “mientras nuestro arte apunta a devolver a su estado natural los cuerpos que están en estado anormal, la castración apunta a lo contrario”. Un famoso cirujano árabe Ali Abbas (930-994) en su libro “Regalis dispositio” dice: “La castración puede ser realizada tanto por compresión o por amputación. La primera técnica es aplicable para los niños o jóvenes, se debe introducir al niño en un cubo con agua caliente, y cuando los testículos estén relajados y blandos, deben ser hechos pulpa con los dedos hasta su disolución por el tacto. La técnica de la castración por amputación debe ser hecha con navaja, por extirpación de los testículos solamente, o por la extirpación de ambos y del pene. La hemostasia debe practicarse con aloe, resina de árbol o polvo de incienso, cubriendo la zona con un vendaje. Finalmente se deberá cubrir la herida con ungüentos durante las curaciones.” Otro destacado cirujano árabe Albulcasis (936-1013) dice en su “práctica del método”: “Ustedes deben conocer que nuestra ley prohíbe y castiga la castración. Por lo tanto yo podría pasar por alto o en silencio este capítulo, así como negociar lo que parece ser necesario, excepto por dos razones: la primera, es que esta operación no debe caer fuera de la órbita del conocimiento médico, porque él sólo conoce cómo tratar el sufrimiento por tal defecto, y segundo porque a menudo nosotros necesitamos castrar algún animal, por ejemplo, carneros, machos cabríos o gatos. Siendo así la cosa, yo digo que realizamos la castración de dos maneras, por la compresión digital o por incisión y corte.” La castración es muy diferente en efectos cuando se efectúa en niños o en hombres adultos. La remoción de los testículos en el pospuberal vuelve al hombre infértil, no impide automáticamente la erección del pene ni tampoco el deseo sexual. No garantiza la castidad física o psicológica. Cuando se realiza en un prepuberal produciría esterilidad e impotencia en circunstancias normales. Esto no es así en todos los casos. Si las células intersticiales que producen testosterona estaban funcionando y producían erecciones antes de la castración, es posible que otras células del retroperitoneo secreten hormonas masculinas que continuarán produciendo erecciones después de la castración. Los eunucos pueden experimentar placer durante el acto sexual, pero no pueden fecundar, esto no los descalifica para el matrimonio. Algunos pueden tener capacidad eyaculatoria con líquido prostático y seminal sin esperma. Esto hizo que en Roma y Bizancio las damas recurrieran una y otra vez a sus “spadones” por sexo sin riesgo. La autocastración por motivos religiosos fue aceptada en el siglo IV entre la gente que se hacia llamar Cristianos. En el año 325 en el Concilio de Nicea se condenó la autocastración y la ordenación de sacerdotes eunucos también fue prohibida. La Iglesia Bizantina Cristiana continuó ordenando monjes y obispos castrados no dando cumplimiento a lo establecido. El Concilio realizado en Elvira, cerca de Granada en España en el año 330, prohibió a los curas de cualquier rango tener sexo con sus esposas, así como procrear niños. Sin embargo, no fue hasta el tiempo de San Agustín (354-430) que el Papa Siriaco determinó pecado, para los curas que continuaban las relaciones sexuales con sus esposas, después de su ordenación. El celibato contribuyó al Sisma de la Iglesia Romana y Bizantina. Mientras que el filosofo y teólogo francés Pierre Abelard (1079-1142) creía que la mutilación lo convertiría en mejor teólogo. Nada parecido sucedería según San Agustín, Abelard no se castraría así mismo. El sería castrado por su tío el abate Fulbert, para detener su ligazón sexual con Heloise su alumna 30 años más joven, que más tarde se convertiría en monja. Separados en vida, Abelard y Heloise serían finalmente enterrados juntos en un cementerio de París. En 1587 el Papa Sixto V prohibía bendecir la unión carnal de los castrados (“cualquier hombre privado de sus testículos”) y anulaba todos los que habían tenido lugar con anterioridad. Solamente el Cristianismo rechazaba bendecir la unión carnal de los castrados, en el Antiguo Egipto, en el Mundo Islámico y en la China los eunucos podían contraer matrimonio legal. Como de costumbre la prohibición imperial en Roma de castrar a los esclavos fue descuidada principal- Rev. Arg. de Urol. · Vol. 70 (1) 2005 mente en el Imperio Bizantino, por los llamados “sopranisti o castrati” creados a partir del siglo XII para formar los coros celestiales, también llamados de ángeles, constituidos por niños en las Iglesias Cristianas de Oriente, y por consiguiente bien pagos por los patriarcas. Esta vergonzosa moda de hacer eunucos pareció detenerse en el siglo XV, pero recrudeció en el siglo XVI cuando el Papa Clemente VIII (1535-1605) gustaba de escuchar en” los coros celestiales” de la Capilla Sixtina voces triples (femeninas), cuando éstas no podían integrar dichos coros. El más famoso de los “castrati” de todos los tiempos fue el italiano Carlo Brachi más conocido como Farinelli (1705-1782), actúo en los mejores teatros de Europa y logró tal renombre que fue designado ministro por el rey Felipe V de España quien lo había nombrado su favorito. Roma se convirtió en el gran centro de los “castrati” por la indecorosa costumbre de favorecer las triunfales carreras de estos “sopranos hombres”, que aparecían en los más famosos centros de la lírica del siglo XVIII. La práctica fue sólo terminada por el uso del famoso “motu propio” de Pío X en 1903 y con la muerte del áltimo gran sopranista, Alejandro Moreschi en 1922. Etimológicamente el vocablo “castrar” deriva del latín castrare y significa “extirpar los órganos de la generación”; mientras que “castración” deriva del latín castratio,“es la acción y efecto de castrar”. Indistintamente se utilizó durante mucho tiempo para la extirpación de los testículos solamente o de los testículos y el pene. Otras acepciones son “capar” que deriva del latín capon, cuyo significado “extirpar o inutilizar los órganos genitales” y “capón” que deriva del latín cappo, es un adjetivo que se aplica al hombre o animal castrado. La consecuencia de esta práctica cuando cercena los testículos y el pene se la denomina “emasculación” que deriva del latín emasculare, diferenciando para la Medicina Legal a ambas entidades. El resultado de cualquiera de estas mutilaciones da por resultado un “eunuco”, vocablo que deriva del griego y del latín eunuchus, que significa “guardar el lecho”, aplicable también “al hombre castrado que se destinaba a los harenes o serrallos a la custodia de las mujeres o concubinas del monarca”. En la Civilización Arabe y en el Imperio Otomano esta costumbre estuvo ampliamente difundida; el Emperador árabe Muaviye fue el primer islámico que reunió eunucos en su guardia personal de palacio. Posteriormente y dado que en el libro sagrado de los musulmanes, el Corán, se establecían reglas para evitar la poligamia, permitiendo tener concubinas, éstas eran reunidas en un “harén”, palabra que deriva del árabe y que significa “la cosa o persona que está prohibida”. 5 Figura 2 . Libro de “Cirugía Imperial Otomana” de Sabuncuogio (Siglo XV): Operación de los genitales: castración El palacio Topaky en Estambul reunía en su harén a más de 300 mujeres. Recién a partir de 1584 los “eunucos”, turcos en su mayoría fueron destinados a vigilar y defender el harén. Eran elegidos entre los esclavos de Armenia, Georgia y Circassan, llamados Ak Aga o maestros blancos en los registros de palacio. El emperador Musat II, fue el primero en comprar “eunucos” en Egipto, provenientes del Monasterio de Aboud Gerbe de sacerdotes Coptos. Aquí los jóvenes esclavos de Nubia y de Abisinia eran “castrados” por cirujanos judíos y cristianos, nunca por musulmanes porque su religión lo prohibía expresamente. La técnica Copta era una operación completa que incluía los testículos, el escroto y el pene (emasculación); donde la mortalidad era muy alta y donde la única hemostasia era la arena caliente del desierto. Un esclavo eunuco negro constaba en el mercado 600 escudos y alcanzaba en los mercados del El Cairo, Bagdad y Estambul cifras muy superiores. Los “eunucos” blancos constituían la guardia del harén, su tarea terminaba en las puertas de las mujeres (salvo cuando la mujer le facilitaba su acceso) y no se extendían en el interior del palacio. Dentro del harén sólo los eunucos negros (obviamente sin pene) podían permanecer, siendo su tarea controlar a las personas que entraban o salían del harén y acompañar a las mujeres en las raras excursiones fuera del palacio. Su jefe el “superintendente” también eunuco tenía una gran influencia y los controlaba a todos, e informaba al Sultán diariamente. Se ocupaba de proveer concubinas al harén, dictaba sentencias de muerte y supervisaba las ejecuciones. En este contexto el historiador y viajero inglés Cornelis de Bruyn escribió en 1698 a cerca de los “matrimonios” de los eunucos en los harenes de Turquía, donde “los eunucos en sus relaciones con los emperadores se 6 veían involucrados con las concubinas en complots contra el Estado”. Ali Pasha, un primer ministro del siglo XVIII fue la primera persona oficial de alto rango que trató de evitar la castración legalmente. La influencia de los eunucos fue cayendo a partir del siglo XVII y terminó en el siglo XIX con la transformación del Imperio Otomano en la República Turca. Durante el período de la Alta Edad Media el cirujano francés Guy de Chauliac (1280-1368) llamado el Padre de la Cirugía en su obra “Chirugia Magna” escribía: “ninguna herniotomía es satisfactoria si no se realiza la castración”. Esta actitud prevaleció en Europa cerca de 400 años, cuando los pacientes aceptaban el desafío de la reparación inguinoescrotal de una hernia. La práctica de la orquiectomía para el reparo de una hernia inguinal con el cierre completo de orificio inguinal profundo fue finalmente aceptada a finales del siglo XVIII, gracias a los esfuerzos de la Academia de Cirugía de Francia, agregando una nueva “indicación” para la castración. En el siglo XVIII, un profundo y místico movimiento se expandió sobre la Rusia zarista. En 1757 Andrei Ivanov, fundó la Secta de los Flagelados, también denominados la “Familia Skoptzy” de los castrados. Comenzó por castrarse a sí mismo y continuó con sus seguidores “los 13 apóstoles” de su nueva religión. Ivanov fue arrestado y deportado a Siberia donde murió. Su seguidor más fanático Kondriti Sselivanoff predicó su doctrina en San Petersburgo y se enfrentó con la Iglesia Ortodoxa Rusa teniendo una gran cantidad de seguidores entre la clase pudiente, especialmente los banqueros. Según Feodor Stein 5.444 “Skoptzy” fueron registrados por la policía en 1870; llegando a 144.000 antes de la Revolución Bolchevike, en 1917, que combatió a la secta hasta acabar con ella. En la antigua China, en los tiempos de la Dinastía Han (200 a.C. - 8 d.C.) los “eunucos” no eran más que sirvientes, se realizaban la emasculación total, colocando un tapón metálico en el extremo de la uretra proximal para que no se estenosara. Durante los tiempos tardíos de los Han llegarían a tener tareas oficiales en el gobierno. El emperador Guang Wu sólo autorizo a los eunucos a entrar en el palacio, esto los enemistó con la clase pudiente e intelectual de China. Adquirieron poder e influencia sobre los emperadores, quienes los designaron con rangos de generales y almirantes. Alcanzaron su máximo poder durante la Dinastía Ming donde controlaban las finanzas e intentaron deponer al Emperador. La Dinastía Quing (1700), proveniente de Manchuria, prohibió a la eunucos, quienes se retiraron totalmente del poder en 1906 luego de la Re- Figura 3. Dr. Charles Brenton Huggins (1901-1997). Premio Nobel de Medicina y Fisiología volución Boxer. En 1996 dejaba de existir en Beijin el último “eunuco”. Por desgracia estas prácticas aberrantes se perpetuaron en el territorio africano durante el siglo XIX. En Etiopía en la década del 30, los guerrilleros emasculaban a los soldados expedicionarios italianos que tomaban prisioneros. Así mismo durante la guerra de emancipación de Argelia en la década del 50 los rebeldes también emasculaban a los legionarios franceses capturados. En las revueltas tribales del Zaire en la década del 60 miles de varones sufrieron la emasculación durante las “purgas étnicas”. Un grupo de investigadores de la Universidad de Chicago en 1940, encabezados por los urólogos Charles Rev. Arg. de Urol. · Vol. 70 (1) 2005 Brenton Huggins y Clarence V. Hodges junto a los doctores R.E. Stevens y William W. Scott hicieron historia al alterar el medio interno hormonal del cuerpo y retardar o detener el crecimiento de células malignas. Ellos demostraron que con la remoción de los testículos, mediante la cirugía convencional con “técnica de castración” o con medicación supresora de la testosterona (con estrógenos), se podía “cerrar el combustible” que alimentaba a los receptores hormonales de las células malignas de la próstata. Este épico descubrimiento de la hormonodependencia tumoral hizo que 26 años después, en 1966, fueran galardonados con el Premio Nobel de Medicina y Fisiología. Después de haber conocido la práctica de la castración en los caballos y de reconocer el cúmulo de sus “indicaciones” en el hombre, pasando por los enemigos vencidos, los esclavos, los agresores sexuales, los que tenían taras congénitas, los amantes o “spadones”, los “sopranos hombres”, los eunucos del harén, los fanáticos religiosos o “Skoptzy”, hasta los de las purgas étnicas, no podemos, como médicos, sentirnos, menos que contrariados por la humillación y el sufrimiento al que fueron sometidos todos ellos. En el idioma la palabra que expresa un concepto opuesto a otra es un antónimo, y el de “vergüenza” es “honor”. Podemos entonces parangonar diciendo que Huggins nos devolvió el honor a los médicos, frente a la vergüenza de muchos de nuestros predecesores que supieron practicar la castración sin escrúpulos. 7 ARTÍCULO DE REVISIÓN REVISION ARTICLE Epidemiología de la vejiga hiperactiva sobre una población de 3.692 consultas urológicas y 2.030 estudios urodinámicos Overactive bladder epidemiology in a population of 3692 urology visits and 2030 urodynamic studies Prof. Dr. García Salord, J.1 Prof. Dr. Belén, R.2 Dr. Bevilacqua, O.3 Dr. Cabrera, R.3 1 2 3 Prof. Titular Encargado Cátedra de Urología Prof. Adjunto Cátedra de Urología Residentes Cátedra de Urología Cátedra de Urología Hospital Nacional de Clínicas. Facultad de Ciencias Médicas. Universidad Nacional de Córdoba. E-mail: [email protected] 8 Introducción: La Sociedad Internacional de Continencia ha definido: 1. El Síndrome de vejiga hiperactiva (VHA) como un “diagnóstico sintomático” basado en la presencia de urgencia miccional, con o sin incontinencia, usualmente acompañadas de polaquiuria diurna y nocturna, en ausencia obvia de enfermedad metabólica o neurológica. 2. Vejiga Hiperactiva (“detrusor hiperactivo”) como una “observación urodinámica” que se caracteriza por contracciones involuntarias del detrusor, durante la fase del llenado que pueden ser espontáneas o provocadas.1 Sobre la base de estudios poblacionales realizados en Europa y EE.UU. la prevalencia de vejiga hiperactiva (VHA) ha sido reportada en alrededor de 16%.3;4 En la Argentina no se conoce la epidemiología de la VHA y no hemos encontrado publicaciones nacionales en nuestra revisión bibliográfica. Objetivos: Establecer la tasa de prevalencia de VHA por sexo y edad en una población de 3.692 consultas urológicas y 2.030 estudios urodinámicos a fin de conocer la frecuencia e importancia de esta patología en los pacientes que consultaron en nuestro Servicio. Material y Métodos: Estudio de carácter epidemiológico, retrospectivo, sobre una población de 3.692 pacientes que consultaron consecutivamente, de los cuales 2.030 fueron estudiados mediante urodinamia de presión/flujo, estimándose la tasa de prevalencia de VHA. Se recolectó información adicional sobre edad y sexo de los pacientes con el objeto de ajustar la prevalencia de VHA a los diferentes estratos etarios y de género. Conclusiones: • La prevalencia de VHA en nuestra población fue del 23,4%: dos o tres de cada 10 consultas. • El 56,5% de los pacientes con VHA fueron de sexo masculino y el 43,5% del femenino. • El 54% de todas las VHA ocurrieron en mayores de 60 años, 65% de las masculinas y 40% de las femeninas, siendo el riesgo de VHA en nuestra comunidad en ese grupo etario hasta 7 veces superior respecto de la gente más joven. La manifestación clínica prevalente de VHA fue la incontinencia de orina (52%) seguidas por la urgencia (25%) y la polaquiuria (23%). La incontinencia fue 5 veces más frecuente en mujeres que en hombres y la polaquiuria fue 13 veces más frecuente en hombres que en mujeres. P A L A B R A S C L AV E : Vejiga hiperactiva; Prevalencia; Incontinencia de orina. Background: The International Continence Society has defined: 1 The overactive bladder syndrome (OAB) as a “symptomatic diagnosis” based in urgency with or without incontinence, commonly associated with diurnal and nocturnal frequency in abcens of any other metabolic or neurological disease. 2. Overactive bladder (overactive detrusor) as a urodinamic finding with caracteristic spontaneus o provocated non inhibited detrusor contraction during the filling fase. In reference to prevalence studies done in europe and United States, overactive bladder has been found in 16%. We have not found any argentinean publications about overactive bladder. Aim: To determine OAB age and sex prevalence rate in 3692 urology visits and 2030 urodynamic studies in order to learn about the pathology frequency and importance among the patients who attended our service. Materials and Methods: Epidemiological retrospective study on 3692 patients who attended our visit consecutively; 2030 of which underwent flow/ pressure urodynamic study to estimate the prevalence rate of OAB; information as to the age and sex of patients was gathered so as to adjust OAB prevalence to different age and sex stages. Conclusions: • OAB prevalence was 23,4% in our population: two or three out of ten visits. • 56,6% of our OAB patients were male and 43,5% were female • 54% out of all OAB were in patients above 60 years old, 65% of males, and 40% of females, being OAB risk in this age group up to 7 times above younger people. OAB prevailing clinical sign was urine incontinence (52%) followed by urgency (25%) and pollakiuria (23%) Incontinence was 5 times more frequent in women than in men and pollakiuria 13 times more frequent in men than in women. K E Y W O R D S : Overactive bladder; Prevalence; Urinary incontinence. I NTRODUCCIÓN La Sociedad Internacional de Continencia ha definido: 1. El Síndrome de vejiga hiperactiva (VHA) como un “diagnóstico sintomático” basado en la presencia de urgencia miccional, con o sin incontinencia, usualmente acompañadas de polaquiuria diurna y nocturna, en ausencia obvia de enfermedad metabólica o neurológica. 2. Vejiga Hiperactiva (“detrusor hiperactivo”) como una “observación urodinámica” que se caracteriza por contracciones involuntarias del detrusor, durante la fase del llenado que pueden ser espontáneas o provocadas.1 Sobre la base de estudios poblacionales realizados en Europa y EE.UU. la prevalencia de vejiga hiperactiva (VHA) ha sido reportada en alrededor de 16%.3;4 En la Argentina no se conoce la epidemiología de la VHA y no hemos encontrado publicaciones nacionales en nuestra revisión bibliográfica. Esta hiperactividad hace que los pacientes presenten un marcado aumento de la frecuencia de las micciones (polaquiuria), urgencia miccional con sensación de pérdida inminente y en un tercio de los casos incontinencia por urgencia. Este cortejo de síntomas provoca en el paciente ansiedad, angustia y/o depresión con una alteración marcada de su calidad de vida,2 y está frecuentemente asociada o seguida de infecciones urinarias.2 La prevalencia de VHA varía según las publicaciones internacionales entre el 30 y 50% de las consultas en los Servicios de Urología.5 En Argentina no se conoce la epidemiología de la VHA y no hemos encontrado publicaciones nacionales en nuestra revisión bibliográfica. Objetivo: Establecer la tasa de prevalencia de vejiga Rev. Arg. de Urol. · Vol. 70 (1) 2005 hiperactiva por sexo y edad en una población de 3.692 consultas urológicas y 2.030 estudios urodinámicos, a fin de conocer la frecuencia e importancia de esta patología en los pacientes que consultan nuestro Servicio. M AT E R I A L Y M É T O D O S El presente estudio es de carácter epidemiológico retrospectivo sobre una población de 3.692 pacientes que consultaron consecutivamente al Servicio de Urología, 2.030 de los cuales fueron estudiados mediante Urodinamia de Presión-Flujo por indicación. Todo paciente con sospecha o diagnóstico clínico de VHA fue valorado mediante el estudio urodinámico antes mencionado. Se estimó la tasa de prevalencia de VHA sobre 3.692 individuos con probables trastornos urológicos de toda índole, y la prevalencia de VHA sobre 2.030 individuos con indicación de estudio urodinámico por múltiples razones. Se recolectó información adicional sobre edad y sexo de los pacientes con el objeto de ajustar la prevalencia de VHA a los diferentes estratos etarios y de género. Se consideró polaquiuria a quienes tuvieran más de siete micciones diurnas y dos nocturnas; y Urgencia Miccional (UM) al deseo intenso con sensación de pérdida inminente de orina. Por Incontinencia de Orina de Urgencia (IOU), cuando dicha pérdida se produce efectivamente antes de conseguir la micción voluntaria. El enfoque de riesgo de VHA sobre la comunidad fue abordado a partir de cifras demográficas oficiales del INDEC para nuestra provincia (proyecciones 1990-2010). Para dicho análisis de prevalencia, se utili- 9 zó la razón desigual (Odds Ratio u OR) acompañado de su respectivo IC95% (intervalo de confianza). El objeto fue estimar el riesgo de VHA según edad y sexo de los individuos de nuestra comunidad. Para establecer diferencia entre proporciones y/o tasas se utilizó prueba de Chi Cuadrado (x2) siempre y cuando se cumplieran sus premisas acerca de valores esperados pequeños. Se fijó un nivel alfa del 5% (P<0,05) e IC95% que no incluyan la unidad (1) para establecer significación estadística. R E S U LTA D O S Sobre una población de 3.692 consultas urológicas de toda índole (2.030 con estudio urodinámico), asistidas entre enero de 1989 y mayo de 2000 en los consultorios del Servicio Cátedra de Urología del Hospital Nacional de Clínicas, fueron diagnosticados 864 pacientes con Vejiga Hiperactiva (VHA) (prevalencia 23,4%; IC95% 20,26% -26,54%). Estos 864 pacientes fueron diagnosticados mediante estudio urodinámico, estando presente este cuadro en el 42,56% de las 2.030 urodinamias realizadas en nuestro Servicio. Cuatrocientos ochenta y ocho de los pacientes con VHA fueron de sexo masculino (56,5%) y 376 del femenino (43,5%), proporciones con ligeras diferencias a la distribución de género general de consultas urológicas de nuestro Servicio (59,9% hombres y 40, 1 % mujeres; P=0,07), aunque no significativas. Sin embargo, según datos poblacionales del lNDEC para la provincia de Córdoba (1990-2010), el índice de masculinidad general sería de 0,959, siendo de 1.298 en la serie de VHA analizada. Esto nos permitió observar que dentro de nuestros pacientes con VHA habría un 41% más de hombres que en la población general, lo que determinaría un riesgo significativo de VHA para los hombres de nuestro medio (P < 0,0005; OR 1.4 IC95% 1,2- 1,7). Este riesgo mayor sobre la población masculina resultó relativo a la edad, ya que fue real para ciertos grupos etarios (>50 años), mientras que para otros el riesgo sería mayor sobre la población femenina. En la Tabla 1, se muestra la proporción de hombres y mujeres en cada grupo etario, resumiendo tal información como índice de masculinidad (IM-VHA) y contrastándolo con la distribución de género en la comunidad acorde a la edad. A partir de dicha tabla, pudimos evidenciar una proporción significativamente superior de mujeres entre los pacientes VHA ≤ 10 años respecto de los individuos de la comunidad (IM VHA versus IM INDEC; P<0,05; OR enfoque femenino = 2.8 IC95% 1,3 -6,3); lo que determinó un riesgo de VHA para las mujeres ≤10 años de nuestra comunidad casi 3 veces superior respecto de los niños varones de igual edad. Este riesgo sobre la población femenina, disminuye ligeramente entre los 11 y 30 años para luego incrementar nuevamente entre los 31 y 50 años (Tabla 1), representando el 52,5% y 62,7% respectivamente de todas las VHA analizadas en nuestro Centro en esos grupos etarios. Estos cambios también pueden ser evidenciados a partir de la variación del número absoluto de casos femeninos observados en relación con la edad (Figura 1); observándose un pico de mujeres entre los 31 y 50 años. Para las mujeres de dicha edad de nuestra comunidad, el riesgo de VHA fue, casi significativamente, un 59% mayor al de los hombres de igual edad (OR enfoque femenino = 1,59 IC95% 0,96 -2,62). Luego el número de casos femeninos disminuyó ligeramente para incrementar en un nuevo pico luego de los 60 años, aunque de menor intensidad que en el sexo masculino. Por el contrario, el número absoluto de VHA mas- Edad Nº Total Hombres Mujeres IM (VHA) IM (INDEC)# P OR (IC95%) ≤ 10 55 27,3% (15) 72,7% (40) 0,375 1,035 P < 0,05 0,4 0,2-0,9 11-30 80 47,5% (38) 52,5% (42) 0,905 1,026 P = 0,63 0,9 0,4-1,7 31-50 142 37,3% (53) 62,7% (89) 0,596 0,973 P = 0,06 0,6 0,4-1,0 51-60 120 55,0% (66) 45,0% (54) 1,222 0,936 P = 0,20 1,4 0,8-2,4 > 60 467 67,7% (316) 32,3% (151) 2,093 0,755 P < 0,0…* 3,5 2,6-4,6 Total 864 488 376 Entre paréntesis se expresa el número de casos. #: Fuente INDEC. Proyecciones de la Población para Provincia de Córdoba según sexo y grupos de edad (1990-2010). * P < 0,0000001 Tabla 1. Distribución de género según edad. Contraste del índice de masculinidad con la distribución de género en la comunidad y enfoque masculino de riesgo. 10 culino fue elevándose ligeramente con la edad hasta hacer un pico muy significativo luego de los 60 años (Figura 1). Como se puede observar en la Tabla 1, el 67,7% de las VHA en mayores de 60 años fueron hombres, que representa un IM de 2,1 muy significativamente superior al 0,76 comunitario (P<0,0000001), pudiéndose inferir un riesgo poblacional de VHA para hombres mayores de 60 años hasta 3,5 veces superior respecto del sexo opuesto. Como se desprende de la Figura 1 y Tabla 2, y hecha la salvedad de la prevalencia de VHA discriminada por género, pudimos observar que el 54,05% de todas las VHA ocurrieron en individuos mayores de 60 años, 64,75% de las masculinas y 40,16% de las femeninas, y el restante 45,95% en menores de 60. Según INDEC (1990-2010) la población mayor de 60 años sólo representa el 14,4% del total, por lo tanto y sin discriminar por sexo, los individuos mayores de 60 años de nuestra comunidad tendrían un riesgo de VHA hasta 7 veces superior respecto de individuos más jóvenes (OR = 7,02 IC95% 5,53-8,92). La manifestación clínica prevalente de la VHA en nuestra serie fue la Incontinencia de Orina (IO) con el 52% de los casos (Tabla 3), seguido en orden de frecuencia por la Urgencia Miccional (24,8%) y polaquiuria (23,2%). Sin embargo, esta distribución de prevalencia difiere significativamente según el género que se considere (Tabla 3). En la mujer, la forma prevalente fue la IU (72,4%; P<0,0000001), encontrándose casi 5 veces más frecuentemente esta manifestación respecto del sexo masculino (OR=4,6 IC95% 3,4-6.,2). Por el contrario, en hombres es tan frecuente la polaquiuria como la IU (37,7% y 36,3% respectivamente), aunque la polaquiuria se dio en este género a una razón 13 veces más frecuente respecto del sexo opuesto (OR=12,8 IC95% 7,4-22,3). Ambos sexos presentaron igual proporción de casos con Urgencia Miccional (26% hombres, 23% mujeres; P=0,3). Discriminando la prevalencia de lO por clase (Tabla 4), la prevalencia global de 10U fue del 40,6% y de 10M del 11,4%, donde las 10U constituyeron el 78,2% de todas las 10 asociadas con VHA de nuestra población. Nuevamente, esta prevalencia dependió directamente del género del paciente, siendo la prevalencia de 10U en mujeres del 51,1% y en hombres de 32,6% (P<0,0000001), poco más de dos veces más frecuentes en mujeres respecto de los últimos (OR=2,2 IC95% 1,6-2,9). Mientras que la prevalencia de 10M fue de hasta el 21,3% en mujeres y sólo 3,7% en hombres (P<0,0000001), hasta 7 veces más frecuentes en mujeres respecto de hombres de nuestra serie (OR=7,1 IC95% 4,0-12,5). Desde otro enfoque, el 89,8% de las 10 en hombres fueron 10U y 10,2% 10M, en tanto que Figura 1. Variación del número absoluto de VHA según edad y sexo. Edad Nº Total Hombres Mujeres Total % ≤ 10 55 3,07% (15) 10,64% (40) 6,36% 11-30 80 7,79% (38) 11,17% (42) 9,26% 31-50 142 10,86% (53) 23,67% (89) 16,44% 51-60 120 13,52% (66) 14,36% (54) 13,89% > 60 467 64,75% (316) 40,16% (151) 54,05% Total 864 100,0% (488) 100,0% (376) 100,00% Tabla 2. Distribución etaria según el género. Manifestación clínica Prevalencia % (n) Hombres N = 488 Mujeres N = 376 Hombres vs. Mujeres Incontinencia de Orina (IO) 52,0% (449) 36,3% (177) 72,4% (272) P < 0,0000001 Urgencia Miccional (UM) 24,8% (214) 26,0% (127) 23,1% (87) P = 0,33 (NS) Polaquiuria 23,2% (201) 37,7% (184) 4,5% (17) P < 0,0000001 Total 100,0% (864) 100,0% (488) 100,0% (376) Tabla 3. Manifestación clínica de VHA, prevalencia global y por género. Rev. Arg. de Urol. · Vol. 70 (1) 2005 11 Sexo femenino Sexo masculino 37,7% 26,0% 23,1% 4,6% 72,4% 36,3% IO UM Polaquiuria IO UM Polaquiuria Figura 2. Prevalencia de manifestación clínica de VHA por género. en mujeres estas proporciones fueron 70,6% y 29,4% respectivamente (P<0,000005), donde se objetivó una proporción significativa de 10M entre las mujeres. DISCUSIÓN Nuestros resultados muestran una prevalencia de VHA de 23,4% sobre consultas urológicas de toda índole sin distinción de edad ni sexo en nuestro Servicio, y en 42,15% sobre los estudios urodinámicos realizados, según lo indicaban los síntomas presentados. Estas cifras concuerdan con los trabajos de Hampel y Payne.6,7 Es importante considerar que la población estudiada analiza a pacientes que consultaron en forma espontanea en este Servicio de Urología y que la prevalencia no debe extrapolarse a la población de la cuidad y provincia de Córdoba. Resulta sí interesante destacar la coincidencia en la prevalencia entre los pacientes que consultan en los Servicios de Urología y que se repite en nuestro caso. Se repite aquí, como en otra patologías urológicas la observación de las diferencias entre pacientes en la población y los que llegan a la consulta. La prevalencia de VHA varía con la edad y el sexo, observándose una mayor frecuencia en los hombres mayores de 60 años, al igual que fuera comunicado por Obrien y Herzog. 8,9 Esto podría deberse a dos circunstancias: 1) Que la obstrucción urinaria, generalmente por Hiperplasia Benigna de Próstata tan frecuente en este grupo etario, provoca una hiperactividad vesical secundaria en la mitad de los casos.10,11 2) En el paciente geronte aumenta la frecuencia de VHA,12 como consecuencia del reemplazo de las uniones celulares musculares normales por otras uniones patológicas.13 De allí la importancia de establecer, en hombres con síntomas del aparato urinario bajo (polaquiuria, urgencia o IO), si éstos son debidos a la obstrucción, a la VHA, o a ambas patologías; a fin de proceder con la terapéutica adecuada (quirúrgica, farmacológica o combinada). También en la mujer, más del 40% de las VHA se correspondieron a mayores de 60 años, frecuentemente en asociación con IOU.14 Surge entonces la necesidad, ante una mujer con síntomas como polaquiuria y/o 10U, de establecer el diagnóstico diferencial con las Infecciones Urinarias y del tipo de Incontinencia (de esfuerzo, por urgencia o mixta) mediante Urodinamia. Ello, a fin de evitar cirugías anti-incontinencia en mujeres con VHA que fracasarían, debido a que en la hiperactividad vesical está indicado preferentemente el tratamiento farmacológico con anticolinérgicos del tipo de la oxibutinina o la tolterodina.15 CONCLUSIÓN La prevalencia de VHA en nuestra población de 3.692 consultas urológicas de toda índole (2.030 con estudio urodinámico), fue de 23,4% (IC95% 20,26% 26,54%); 2 o 3 de cada 10 consultas urológicas en nuestro Centro. El 54% de todas las VHA ocurrieron en individuos mayores de 60 años, 65% de las masculinas y 40% de las femeninas, siendo el riesgo de VHA en nuestra comunidad para personas mayores de 60 años hasta 7 veces superior respecto de gente más joven. La prevalencia y el riesgo comunitario de VHA en cada sexo estaría significativamente influido por la IO como Manifestación Clínica Prevalencia % (n) Hombres N = 488 Mujeres N = 376 Hombres vs. Mujeres Incontinencia de Orina de Urgencia (IOU) 40,6% (351) 32,6% (159) 51,1% (192) P < 0,0000001 Incontinencia de Orina Mixta (IOM) 11,4% (98) 3,7% (18) 21,3% (80) P < 0,0000001 IO Total 52,0% (449) 36,3% (177) 72,4% (272) Tabla 4. Clases de IO como manifestación clínica de VHA, prevalencia global y por género. 12 edad. El 72,7% y 62,7% de las VHA en niños de 10 años y pacientes entre 31 y 50 años respectivamente fueron mujeres, siendo dichos grupos etarios de particular riesgo para VHA en nuestra población femenina. Si bien a partir de los 60 años es mayor el número de hombres, esta edad también significa la de mayor prevalencia de VHA para la mujer, como quedara destacado en el párrafo previo. El 55,5% y 67,7% de las VHA en pacientes de 51-60 y mayores de 60 años respectivamente fueron hombres, siendo dichos grupos etarios de particular riesgo para VHA en nuestra población comunitaria masculina. La manifestación clínica de VHA prevalente en nuestra serie fue la IO, con evidente diferencia según el género considerado. La IO fue 5 veces más frecuente entre mujeres y la polaquiuria hasta 13 veces más frecuente entre hombres, siendo esta última manifestación tan frecuente como la IO en dicho sexo. BIBLIOGRAFÍA 1. Abrams, P. y col.: “The standarization of terminology in lower urinary tract function”. report of the SubCommitte of the international continence Society. Am. J. Obstet Gynecol 187: 116, 2002. 2. Grymby, A. y col.:“The influence of urinary incontinence on the quality of life on elderly women” Age Ageing 22:82, 1993. 3. Milsom L. y col.:“How Widespread are the symptoms of an overactive bladder. A population-based study”. Br. Urol. Int 87: 760,2001 C O M E N TA R I O E D I T O R I A L Se trata de un trabajo epidemiológico sobre vejiga hiperactiva con una notable estadística (3.692 consultas con 2.030 estudios urodinámicos) a través de 11 años, demostrando la mayor incidencia de esta patología en mayores de 60 años con predominio del sexo masculino. La manifestación prevalente fue la incontinencia de orina 5 veces más frecuentes en mujeres y la polaquiuria 13 veces más frecuentes en el sexo masculino. El tema “vejiga hiperactiva”, no se ve tratado con frecuencia en nuestro medio, pero es un tema de interés constante en los congresos de la AUA, motivo de cursos también en dichos congresos y también es tema de las asociaciones de pacientes con incontinencia de orina, expresándose a través de su folletería. Desde el punto de vista del enfoque clínico de estos pacientes, dada la índole del trabajo, surge inevitablemente la discusión acerca de las indicaciones de efectuar estudios urodinámicos en la práctica urológica Rev. Arg. de Urol. · Vol. 70 (1) 2005 4. Stewart W.F. y col.:“Prevalence and burden of overactive bladder in the United States”. World. J. Urol 20: 327, 2003. 5. Dehesa-Dávila, M. y col.: “Vejiga inestable: una unidad multifactorial”. Urod A 10 (2): 78, 1997. 6. Hampel, C.; y col.: “Definition of overactive bladder and epidemiology of urinary incontinence” Urology, 50 (6 A suppl) 4-14, 1997. 7. Payne, C. K.:“Epidemiology, pathophysiology, and evaluation of urinary incontinence and overactive bladder. Urology 51 (2 A suppl) 3-10, 1998. 8. O’ Brien, J. y col.;“Urinary incontinence: prevalence, need for treatment, and effectiveness of intervention by nurse”. Br Med J, 303:1308-1312,1991. 9. Herzog, AR. y col.; “Epidemiology of urinary incontinence: prevalence, incidence and correlates in community populations”. Urology 36 (suppl) 2-10,1990. 10. Chelfin, S.; Bradley, W.:“The etiology of detrusor hiperreflexia in patients with infravesical obstruction”. J of Urol 127:923, 1982. 11. Gormley, EA.; y col.:“Effect of transurethral resection of the prostate on detrusor instability and urge incontinence in elderly males”. Neurourology and Urodynamics 12:445-453, 1993. 12. Resnick, NM. y col.: “The Pathophysiology and clinical correlates of established urinary incontinence in froil elderly”. N Engl J Med 320:1-7, 1989. 13. Elbadawi, A. y col.: “Structural basis of geriatric voiding dysfunction. III Detrusor overactivity”. J UroI 150:16681680, 1993. 14. Molander, U. y col.: “Epidemiological study of urinary incontinence and related urogenital symptoms in elderly women”. Maturitas 12:51-60, 1990. 15. Anderson, K. y col.: “The Pharmacological treatment of urinary incontinence”. B J U Intern 84:923, 1999. diaria y que encuentro claramente expresada en un artículo publicado por Alan Wein en AUA News de enero 2002 volumen 7, donde dice: “los estudios Urodinámicos deben ser usados siempre que uno piense que pueden mejorar el manejo del paciente, determinando la precisa etiología de la disfunción miccional, identificar factores de riesgo urodinámico para el tracto urinario superior, deterioro del tracto urinario inferior e identificar factores que puedan afectar el éxito de una determinada terapia”. Felicito a los autores por este meduloso trabajo y por llamar la atención sobre la incidencia de una patología que es pasible de diversos tratamientos, lo que demuestra que ninguno es totalmente eficaz. Prof. Dr. Mario I Sember Jefe Servicio Urología Instituto de Rehabilitación Psicofísica Ciudad Autónoma de Bs. As. 13 ARTÍCULO ORIGINAL ORIGINAL ARTICLE Adrenalectomía laparoscópica: experiencia inicial Laparoscopic adrenalectomy: initial experience Dres. Jurado, A.; Piana, M.; Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. Introducción: La adrenalectomía laparoscópica se ha convertido en una técnica de referencia. El objetivo de este trabajo es mostrar nuestra experiencia inicial en cirugía adrenal laparoscópica, y analizar los resultados quirúrgicos y posquirúrgicos obtenidos. Material y métodos: De agosto del año 2001 a abril del año 2004 inclusive, realizamos en el Servicio de Urología del H.I.B.A 10 cirugías laparoscópicas por patología suprarrenal, por vía transperitoneal. Para el análisis valoramos: datos generales, tiempo operatorio y de internación, complicaciones, necesidad de transfusión sanguínea, evolución postoperatoria, analgesia, anatomía patológica y tiempo de reinicio a la actividad laboral. Indicamos la cirugía en nódulo suprarrenal funcionante, no funcionante mayores de 3 cm de diámetro, y no funcionante con aumento de tamaño en controles seriados. No incluimos los casos de sospecha de carcinoma suprarrenal. En todos los casos actuó el mismo equipo quirúrgico. Resultados: Fueron operados 10 pacientes, 5 (50%) varones y 5 (50%) mujeres. Edad promedio: 51,5 años (r:31-73). Presentación: 9 (90%) incidentalomas, y 1 (10%) hipertenso resistente a la medicación. Tiempo operatorio promedio, 172’ (r:120’-270’). No hubo conversión. La pérdida estimada de sangre fue de 181 ml. (r:50-700) No hubo mortalidad. Morbilidad representada por un caso de hemoperitoneo por sangrado del orificio de uno de los trócares, fue reoperado por vía laparoscópica y evolucionó satisfactoriamente. Analgésico (tramadol): dosis promedio 160 mg. El tiempo promedio de internación fue de 3 días (r:2-5). El peso promedio de los especímenes anátomopatológicos fue de 91,5 g (r: 35-170), y su tamaño promedio fue de 5 cm (r:3-8). Siete pacientes (70%) reiniciaron su actividad laboral a las 3 semanas de la cirugía; 3 (30%) a las 4 semanas. Conclusión: En nuestra experiencia inicial el abordaje laparoscópico transperitoneal de la glándula suprarrenal constituyó un acceso reproducible, y seguro. Los resultados postoperatorios en términos de dolor, tiempo de internación y recuperación postoperatoria resultaron ser auspiciosamente beneficiosos para los pacientes. P A L A B R A S C L AV E : Adrenalectomía laparoscópica; Tumores adrenales; Cirugía. Trabajo galardonado con el “Premio Presidente de la Sociedad Argentina de Urología 2004” Servicio de Urología del Hospital Italiano de Buenos Aires, Argentina. 14 Abstract: Laparoscopic adrenalectomy has become the standard approach to adrenal tumors. The aim of this study is to show our initial experience with this technique and to analyze the results. Materials and methods: Between 8/2001 and 4/2004 we performed ten laparoscopic surgeries due to adrenal pathology at the Urology Dept. of the Hospital Italiano de Buenos Aires, 5 men and 5 women. Average age was 51.5 years (r: 31-73). All the procedures were carried out through a transperitoneal approach. The data regarding general information of the patient, form of presentation, surgical time, number of days in the hospital, complications, need of blood transfusion, post op. evolution, analgesia requirements, final pathology report and time until back to work, was recorded. We indicate this surgery in cases of functioning adrenal masses, non functioning masses bigger than 3 cm and in continuously growing non functioning nodules. We don´t include those cases in which we suspected an adrenal neoplasm. All the patients were operated by the same surgical team. Results: Form of presentation: 9 (90%) were discovered incidentally and 1 (10%) due an arterial hypertension refractory to medical treatment. The average operating time was 172´ (r: 120-270). We didn’t have to convert to open surgery any case. Average blood loss was estimated in 181 ml. (r: 50-700). One patient had to be re-operated laparoscopically to drain a hemo-peritoneum due a blood loss from a trocar port. Analgesia (tramadol): average total dosis: 160 mg. Average hospital stay: 3 days (r: 2-5). Average weight of the resected specimens: 91.5 grs. (r: 35-170) being its average diameter 5 cms (r: 3-8). Seven patients returned to work by 3 weeks post-op and 3 patients at the fourth week. Conclusion: In this initial experience the laparoscopic transperitoneal approach of the adrenal masses appears to be a safe and reproductible procedure. The post-op. results in terms of pain, hospital stay and post-op. recovery seem to be very worthy for the patients K E Y W O R D S : Laparoscopic adrenalectomy; Adrenal tumors; Surgery. I NTRODUCCIÓN Desde la primera nefrectomía laparoscópica descripta por Clayman y cols. en 1991, el papel de la cirugía minimamente invasiva laparoscópica en urología ha experimentado un creciente auge.1 Gagner en 1992, fue el primero en publicar su experiencia inicial en cirugía laparoscópica suprarrenal.2 Desde entonces, esta técnica se ha popularizado hasta convertirse en una cirugía de referencia. Numerosas publicaciones de centros de todo el mundo atestiguan la eficacia y la seguridad de este abordaje y detallan los beneficios para el paciente. Con el objetivo de mejorar la calidad postoperatoria y la recuperación de nuestros pacientes, en agosto del 2001, realizamos nuestra primera adrenalectomía laparoscópica por vía transperitoneal. El objetivo de este trabajo es mostrar nuestra experiencia en cirugía adrenal laparoscópica transperitoneal, y analizar los resultados quirúrgicos y post-quirúrgicos obtenidos. M AT E R I A L Y M É T O D O S Entre los meses de agosto del año 2001 y abril del año 2004 inclusive, fueron realizadas en el Servicio de Urología del Hospital Italiano de Buenos Aires 10 abordajes laparoscópicos de la glándula suprarrenal. Para la revisión de la casuística se utilizó un modelo retrospectivo y descriptivo longitudinal, con revisión de historias clínicas. Luego los datos obtenidos fueron tabulados y ordenados para la realización de esta presentación. Los pacientes fueron evaluados mediante interrogatorio y examen físico completo. Se realizaron estudios de laboratorio generales y específicos para poder deter- Rev. Arg. de Urol. · Vol. 70 (1) 2005 minar la capacidad secretora de la lesión suprarrenal. En todos los casos se realizó tomografía computada de abdomen con contraste oral y endovenoso. En el análisis de los datos se incluyó tiempo operatorio y de internación, complicaciones, pérdida de sangre, evolución postoperatoria, tipo y dosis de analgésico utilizado, anatomía patológica y reinicio a la actividad laboral. Se incluyeron como indicaciones quirúrgicas la presencia de: • Nódulo suprarrenal funcionante. • Nódulo suprarrenal no funcionante mayores de 3 cm de diámetro en las imágenes. • Nódulo suprarrenal no funcionante que muestre cambios de tamaño con crecimiento entre los controles seriados. Descripción de la técnica quirúrgica: Todos los procedimientos se realizaron bajo anestesia general con intubación endotraqueal, con una monitorización de la saturación de oxígeno y del CO2, y profilaxis antibiótica. En todos los casos se procedió por vía transperitoneal con el paciente en decúbito lateral intermedio. Se colocó sonda nasogástrica, sonda vesical simple vía de 18 french y medias antitrombóticas a todos los pacientes. El paciente es posicionado en decúbito lateral a 45° con la ayuda de rodillos de tela. El miembro inferior que se encuentra por debajo es flexionado, manteniendo el otro extendido. El miembro superior homolateral a la glándula a operar es colocado por sobre el cuerpo del paciente, mientras que el contralateral se posiciona extendido para manejo anestésico. Posteriormente el paciente es fijado a la camilla, colocando almohadillas en las áreas de contacto de superficies óseas, para pre- 15 venir lesiones de decúbito. Se lateraliza la mesa quirúrgica hacia el lado opuesto a la glándula a operar, llevando al paciente a la posición quirúrgica semilateral. Luego se realiza antisepsia de la piel con povidona yodada y se colocan los campos quirúrgicos. La ubicación de la incisión y la colocación de los trocares debe ser hecha teniendo en cuenta la anatomía del paciente, los antecedentes de cirugías previas, y la experiencia del cirujano. El neumoperitoneo se induce con técnica abierta, con la introducción de un trocar de 10 mm, a través de incisión en la región umbilical. La presión de CO2 oscila entre 12 y 15 mmHg, durante todo el procedimiento. El cirujano se sitúa contralateral a la glándula a resecar. El ayudante se sitúa lateral al cirujano. Del lado derecho se colocan 4 trocares adicionales (2 de 5 mm y 2 de 10 mm), 2 sobre líneas axilares anterior y media, uno en línea medio clavicular y el último, en línea media supraumbilical. Del lado izquierdo utilizamos sólo 2 trocares adicionales, uno en línea media supraumbilical y otro en línea medio clavicular a la altura del ombligo. (Figura 1) En los casos de adrenalectomía derecha comenzamos realizando un amplio desplazamiento del hígado en sentido medial. Esta maniobra permite la identificación del polo superior del riñón derecho y glándula suprarrenal. La disección cuidadosa del margen medial de la glándula, lateralmente a la vena cava, nos permite identificar la vena adrenal derecha para su clipado temprano. (Foto 1) El resto de la glándula se diseca con facilidad empleando tijera ultrasónica y clips para vasos de mediano tamaño. En la adrenalectomía del lado izquierdo, el retroperitoneo se aborda con una disección en forma de T a lo largo del margen lateral colónico, el ángulo esplénico y el bazo. Se extiende medialmente la incisión entre el colon transverso y el páncreas. El bazo y el páncreas se retraen cranealmente hacia medial. El ángulo esplénico se desplaza por gravedad en sentido caudal y medial. El A A B Foto 1. Suprarrenalectomía derecha. A. Peritoneotomía. B. Clipado de la vena suprarrenal derecha. Foto 2 B Figura 1. Posición de los trocares. A. Suprarrenalectomía derecha. B. Suprarrenalectomía izquierda. 16 riñón izquierdo y su hilio se señalan para identificar la vena renal como referencia de la vena adrenal izquierda. Ésta se liga y secciona. (Foto 2) Al finalizar el procedimiento se extrae la pieza (“embolsada”) por el orificio de uno de los trocares. Se deja drenaje por el sitio del trocar más lateral. (Foto 3) Foto 3. Extracción de la pieza quirúrgica, en bolsa de polietileno R E S U LTA D O S Fueron operados 10 pacientes, 5 (50%) mujeres y 5 (50%) hombres. La edad promedio de los pacientes fue 51,5 años (r: 31-73). Nueve (90%) casos se presentaron como hallazgo casual (masas no funcionantes o incidentalomas), y 1 (10%) se presentó con hipertensión arterial resistente al tratamiento médico. Tuvimos 2 casos de feocromocitoma, uno en un paciente con hipertensión arterial refractaria a medicamentos antihipertensivos (antes nombrado) el cual fue confirmado con el aumento de los valores de catecolaminas en plasma, y metanefrinas y AVM en orina de 24 horas, y el otro caso fue un hallazgo anatomopatológico. En ambos hubo ascenso de la presión arterial intraoperatoria, la que fue controlada mediante la administración de bloqueantes alfaadrenérgicos (fentolamina) por el anestesiólogo actuante. El tiempo operatorio promedio de 172 minutos (r: 120-170). No hubo correlación directa entre los tiempos operatorios y el tamaño del tumor. En esta serie inicial todas las cirugías culminaron por vía laparoscópica. (Gráfico 1) En todos los casos se colocó un drenaje en la celda suprarrenal por el lapso de 36 horas (r: 24-54). La pérdida estimada de sangre fue de 181 ml. (r: 50-300). No hubo mortalidad. Se produjo un caso de hemoperitoneo postoperatorio secundario a sangrado en el orificio de uno de los trocares. Este paciente debió ser transfundido y reoperado, realizándose hemostasia por vía laparoscópica sin afectar significativamente la evolución postoperatoria (alta 5to día postoperatorio). El analgésico empleado para el control del dolor fue el tramadol, siendo su requerimiento promedio durante la hospitalización de 160 mg (3 a 4 dosis de 50 mg promedio por internación). El alta promedio fue de 3,2 días (r: 2-5 días). El peso promedio de los especímenes anátomo-patológicos fue de 91,5 g (r: 35-170), en tanto que su tamaño promedio fue de 5 cm (r: 3-8). En el Gráfico 2 se muestra la distribución porcentual de las estirpes anátomo-patológicas halladas. En 7 (70%) pacientes operados, el reinicio a la actividad laboral se produjo en un tiempo promedio de 3 semanas. En los 3 (30%) pacientes restantes éste se prolongó hasta las 4 semanas. El tiempo de seguimiento promedio fue de 19 meses (r: 2-36). Este corto período de seguimiento no nos permite inferir conclusiones sobre la radicalidad del método, pero hasta el momento no tenemos evidencia de recidiva local en todos los pacientes operados. 10 200 Tamaño 5 cm. (r:3-8) 9 8 cm. 8 7 cm. 7 cm. 150 6 5 cm. 100 5 4 cm. 4 cm. Minutos Tamaño cm. 7 4 cm. 4 3 cm. 3 cm. 3 cm. 3 50 2 1 0 10mo caso 9no caso 8vo caso 7mo caso 6to caso 5to caso 4to caso 3er caso 2do caso 1er caso 0 Pacientes Gráfico 1. Relación tiempo operatorio / tamaño del espécimen. Rev. Arg. de Urol. · Vol. 70 (1) 2005 17 Adenoma 5 (50%) Mielolipoma 1 (10%) Feocromocitoma 2 (20%) Mts. Ca. renal 1 (10%) Schwannoma 1 (10%) Gráfico 2. Distribución por estirpes anátomo-patológicas. DISCUSIÓN La cirugía de las glándulas adrenales es uno de los campos de la urología donde la cirugía laparoscópica se ha consolidado. El abordaje transperitoneal ofrece un adecuado acceso a la glándula, la existencia de puntos de reparos fácilmente identificables la hacen una cirugía reproducible con un satisfactorio control vascular.3-4 Estudios recientes sugieren que los resultados de las cirugías por vía retroperitoneal comparados con los de la vía transperitoneal son similares. 5-6-7 Nuestra experiencia inicial muestra resultados comparables a los obtenidos en otras series, el tiempo quirúrgico se redujo con el correr de los casos. 3-8-9-10 En los casos de feocromocitomas no tuvimos problemas anestésicos en cuanto al manejo de la tensión arterial, pudiendo ser controlados con la administración de fentolamina (bloqueante alfaadrenérgico).11-12 La morbilidad postoperatoria en nuestra serie fue baja, sólo tuvimos un caso de sangrado del orificio del trocar de acceso a la cavidad abdominal. En series mayores, el porcentaje de complicaciones posquirúrgicas es variable, y sus causas no difieren.8-13-14-15 Se describe que las causas de conversión se asocian comúnmente con las dificultades de disección, ya sea por la presencia de adherencias firmes o por el gran tamaño de la masa.9-13-16-17 La sospecha de carcinoma invasivo adrenal detectado mediante técnicas de imagen supone una contraindicación relativa para la realización de cirugía laparoscopia debido al riesgo de siembra tumoral. 18 Las grandes masas pueden dificultar la manipulación laparoscópica, y es difícil establecer el tamaño máximo aconsejable. Esto se debe a que en general depende de la experiencia del cirujano y el tipo de patología adrenal. Sin embargo, existe consenso para establecer un límite de 10 cm para evitar las dificultades técnicas y un tiempo operatorio prolongado.15-16-18 En cuanto al manejo de los incidentalomas, se sabe que la mayoría de estas lesiones son estadísticamente benignas, sin embargo la lesión maligna ocasional es potencialmente curable, por lo que se pregona la exéresis de masas de tamaño superior a 3-4 cm o con incremento de la masa durante el seguimiento.15-17-18-19 En un caso se indicó la exéresis de una masa suprarrenal izquierda detectada durante el seguimiento de un paciente con nefrectomía radical por carcinoma de células claras de riñón. El acceso laparoscópico significó para este paciente un valioso método de diagnóstico mínimamente invasivo para la identificación, categorización y resección de la metástasis.20-21-22 Obtuvimos el hallazgo de un Schwannoma “anciano” benigno retroperitoneal y un mielolipoma, entre los tumores no funcionantes, lo que confirma el criterio de indicación quirúrgica para incidentalomas mayores de 3 cm. Comparando nuestros resultados con los de la literatura es evidente que en casos correctamente seleccionados, la laparoscopia acorta la convalecencia, muestra menor dolor postoperatorio y por consiguiente menor consumo de analgésicos, una reincorporación más temprana del paciente, menos complicaciones significativas y probablemente, en definitiva, muestre también un menor costo.23-24 Por último, debemos mencionar un aspecto que no se desprende del trabajo y que por lo tanto es difícil de constatar, pero creemos que la experiencia obtenida en nefrectomía radical laparoscópica transperitoneal facilitó nuestro aprendizaje y desarrollo de la adrenalectomía laparoscópica, así como también la preferencia por el acceso transperitoneal. CONCLUSIÓN De acuerdo con los resultados obtenidos en nuestra experiencia inicial el abordaje laparoscópico transperitoneal de la glándula suprarrenal constituyó un acceso reproducible, y seguro. Si bien este trabajo no pretende, ni constituye un trabajo de carácter comparativo, los resultados postoperatorios en términos de dolor, tiempo de internación y recuperación postoperatoria resultaron ser auspiciosamente beneficiosos para el paciente. BIBLIOGRAFÍA 1. Clayman R. y cols.: Laparoscopic nephrectomy.: N. Engl. J. Med.; 324: 1370-1371, 1991. 2. Gagner M., Lacroix A., Bolte E.: Laparoscopic adrenalectomy in Cushing’s syndrome and pheochromocytoma. N. Engl. J. Med.: 327: 1033, 1992. 3. Guazzoni G., Cestari A., Montorsi F. y cols.: Eight-year experience with transperitoneal laparoscopic adrenal surgery. J. Urol.: Sep; 166 (3): 820-824, 2001. 4. Guazzoni G., Montorsi F., Bocciardi A., y cols.: Transperitoneal laparoscopic versus open adrenalectomy for benign hyperfunctioning adrenal tumors: A comparative study. J. Urol. May.: 153 (5): 1597-1600, 1995. 5. Gagner M., Pomp A., Heniford B., y cols.: Laparoscopy adrenalectomy: Lessons learned 100 consecutive procedures. Ann Surg 226: 38, 1997. 6. Takeda M. Laparoscopic adrenalectomy: transperitoneal vs. retroperitoneal approaches. Biomed Pharmacother. 54 Suppl 1: 207-210, 2000. 7. Kazuo S., Shinji K., Yasuhiro H., y cols.: Comparison of 3 surgical approaches to laparoscopic adrenalectomy: a nonrandomized, background matched analisis. J. Urol. 166: 437-443, 2001. 8. Lezoche E., Guerrieri M., y cols.: Laparoscopic adrenalectomy by the anterior transperitoneal approach: results of 108 operations in unselected cases. Surg. End.: 14: 920925, 2000. 9. Henry JF, y cols.: Complications of laparoscopic adrenalectomy: results of 169 consecutive procedures. World. J. Surg. 24: 1342-1346,2 000. 10. Higashihara E., y cols.: Learning curve and conversion to open surgery in cases of laparoscopic adrenalectomy and nephrectomy. J Urology 159: 650-653, 1998. 11. Clayman R.: Laparoscopic surgery for pheochromocytoma. J. Urol. 160 (2): 334, 1998. 12. Jaroszewski D., y cols.: Laparoscopic adrenalectomy for pheochromocytoma. Mayo Clin. Proc.: 78 (12): 15014, 2003. 13. Bonjer HJ., y cols.: Endoscopic retroperitoneal adrenalectomy: lessons learned from 111 consecutive cases. Ann. Surg. 232: 796-803, 2000. 14. Chapuis Y., Maignien B., Abboud B. : Surrénalectomie sous coelioscopie: expérience de 25 interventions. Presse Med. 24: 845-848, 1995. 15. Henry JF., y cols.: Leçons retenues après 274 surrénalectomies laparoscopiques. Ann. Chir. 127: 512-519, 2002. 16. Fernández-Cruz L., Sáenz A., y cols.. Cirugía endoscópica de las glándulas suprarrenales. Cir. Esp. 68: 370-374, 2000. 17. Pujol J., y cols.: Laparoscopic adrenalectomy: a review of 30 initial cases. Surg. Endosc. 13: 488-492,1999. 18. Smith CD. y cols.: Laparoscopic adrenalectomy: new gold standard. World J Surg. 23: 389-396, 1999. 19. Hobart M., Gill I., Schweizer D., y cols.: Laparoscopic adrenalectomy for large-volume (>or = 5cm) adrenal masses. J Endourol. 14 (2): 149-154, 2000. 20. Kim SH., y cols.: The role of surgery in the treatment of clinically isolated adrenal metastasis. Cancer, 82: 389-394, 1998. 21. Valeri A., y cols.:Adrenal masses in neoplastic patients. Surg. Endosc. 15: 90-93, 2001. 22. Elashry O., Clayman R., y cols.: Laparoscopic adrenalectomy for solitary metachronous contralateral adrenal metastasis from renal cell carcinoma. J. Urol. 157 (4): 12171222, 1997. 23. Brunt LM.: The positive impact of laparoscopic adrenalectomy on complications of adrenal surgery. Surg. Endosc. 16 (2): 252-7,2002. 24. Gill IS.: The case for laparoscopic adrenalectomy. J Urol.: 166 (2): 429-436,2001. C O M E N TA R I O E D I T O R I A L Este trabajo es la experiencia inicial de un prestigioso grupo de urólogos argentinos, a los que quiero felicitar porque siendo exiguos los aportes en cirugía suprarrenal entre los que practicamos esta especialidad, sienta nuestra posición en este campo, no dejando que cirujanos generales se hagan cargo de una patología que debe ser diagnosticada y tratada por nosotros mismos. El acceso laparoscópico ha demostrado ser el tratamiento estándar para el manejo quirúrgico de la mayoría de las masas adrenales benignas, pudiéndose obtener los mismos resultados que con la cirugía abierta cuando las indicaciones son adecuadas. Refiriéndome específicamente al trabajo quisiera hacer algunas consideraciones: Sugiero en algunos pacientes utilizar la cámara en Rev. Arg. de Urol. · Vol. 70 (1) 2005 línea axilar anterior, fundamentalmente cuando se emplea óptica de cero grado, ya que colocando la óptica a nivel umbilical en la mayoría de los casos la glándula suprarrenal se observa muy alejada. Estoy en un total acuerdo con el abordaje transperitoneal para las formaciones a operar del lado derecho, no tan así para las del lado izquierdo, ya que abordándolos por vía retroperitoneal permite acceder al tumor con una menor disección evitando la separación de vísceras intraperitoneales. En cuanto a la utilización de cinco trocares del lado derecho considero que cuatro serían suficientes, disminuyendo de este modo una complicación bastante frecuente que es el sangrado en el sitio de colocación de los mismos como les ocurrió a los autores. En la discusión se hace referencia a la resección de 19 una metástasis en adrenal izquierda de un carcinoma de células claras, no se aclara de qué lado era el tumor extirpado que dio origen a dicho proceso. Ya que en referencia a la cirugía de glándula suprarrenal cuando hubo cirugía renal previa está descripta la utilización de la vía transtorácica (Gill). Por último, de acuerdo con nuestra experiencia podríamos aportar que: 1. De ser posible la utilización de elementos de sellado y corte por radiofrecuencia, como así también clips de polímero, harían más segura esta cirugía. 20 2- La utilización de agujoscopía permite una disección correcta y transforma en casos seleccionados a esta técnica, en un procedimiento aún menos invasivo. 3- Finalmente cuando se trata de cáncer suprarrenal en los que el volumen es superior a 6 cm, hay infiltración local o trombo en la vena adrenal, la cirugía laparoscópica no sería la vía más conveniente y en ese caso sería preferible realizarlo por un abordaje convencional. Dr. Claudio Ariel Koren Hospital Churruca Visca ARTÍCULO ORIGINAL ORIGINAL ARTICLE Terapia intravesical con o sin mantenimiento de bacilo de Calmette-Guerin en carcinoma transicional T1G3 vesical Intravesical bacillus Calmette-Guerin therapy with or without maintenance in transitional T1G3 bladder carcinoma Dres. Chernobilsky, V.; González Morales, M.; Momesso, A.; Elsner, B.; Becher, E.; Borghi, M.; Montes de Oca, L. Introducción: La utilización del bacilo de Calmette-Guerin (BCG) ha mostrado una acción eficaz en la disminución de la recurrencia y la progresión en carcinomas de alto grado.2 Actualmente se discute el régimen más adecuado en el uso de BCG. Es el propósito del presente estudio comparar la evolución a largo plazo y tolerancia en pacientes con carcinoma transicional de alto grado T1G3, tratados mediante instilación intracavitaria de BCG, con o sin mantenimiento. Material y Métodos: En el Centro de Urología CDU fueron tratados por carcinoma transicional de vejiga con resección transuretral (RTU-V) 213 pacientes entre marzo de 1993 y agosto de 2004. Se evaluaron 56 pacientes (26,17%) con diagnóstico histopatológico de carcinoma transicional T1G3 con o sin carcinoma in situ asociado, informados por un mismo patólogo; 22 ingresaron en el esquema de inducción y mantenimiento con BCG, y 19 pacientes fueron tratados solo con inducción de BCG. Ocho pacientes no realizaron tratamiento posterior, 4 fueron tratados con mitomicina y 3 fueron perdidos en seguimiento. El tratamiento de BCG con mantenimiento se realizó según el esquema del Southwest Oncology Group (SWOG). Cada semana se registró los eventuales efectos adversos y de haberlos se los clasificó en leves, moderados o severos. Se analizaron los datos con test de Fisher para proporciones. Resultados: Promedio de seguimiento general de 50 meses (6-112). Fueron tratados con mantenimiento de BCG 22 pacientes. Se observó recidiva de la enfermedad en 8 pacientes, tres de los cuales recayeron en dos oportunidades siendo un total de 11 recidivas (50%). Un solo caso progresó a un estadio T2 (4,54%). Diecinueve pacientes fueron tratados solo con seis dosis de BCG, observándose una recidiva en 8 pacientes recayendo dos pacientes en 2 oportunidades, siendo un total de 10 recidivas (52,63%) y progresión en 2 pacientes (10,52%). No se observó diferencia en la recidiva (p=0,86) ni en la progresión (p=0,46). Al evaluar los efectos adversos se observaron en 24 pacientes, 13 en el grupo de mantenimiento con solo un caso de efecto sistémico severo y 11 en el grupo de inducción con dos casos de toxicidad sistémica severa. Conclusión: El tratamiento de pacientes con carcinoma transicional T1G3 con BCG es una terapia efectiva en la reducción de las tasas de recidiva y progresión. No encontramos diferencia entre la terapia de mantenimiento o de inducción solamente en las tasa de recurrencia y progresión de la enfermedad. Los efectos adversos fueron similares en ambos grupos. PALABRAS CLAVE: Carcinoma superficial de vejiga; T1G3; Terapia con BCG; Terapia de mantenimiento. Centro de Urología CDU, Buenos Aires, Argentina Rev. Arg. de Urol. · Vol. 70 (1) 2005 21 Purpose: We retrospectively evaluated the effects and results of treatment whit or whitout maintenance BCG therapy in patients with transitional T1G3 bladder carcinoma. Material and Methods: 56 patients with transitional T1G3 carcinoma were evaluated and treated with BCG for six consecutive weekly instillations. The patients in maintenance group therapy were administered tree consecutive weekly instillations in months 3,6,12,18,24,30,36 later. (SWOG) We analysed the recurrence, progression and side effects. Results: Twenty two patients were treated with maintenance and 19 with out maintenance therapy, after a median follow up of 50 months (6-112). In the first group 8 patients, 3 in two times, had recurrence (50 %) and one patient (4,54%) has progression. In the second group 8 patients, 2 in two times had relapse (52,63) and two patients had progression (10,52). p=0,86 and p=0,46. 65,8% of the patients received all the scheduled maintenance instillations. During the induction therapy 11 patients had symptoms of toxicity, but only one was severe adverse effect. During the maintenance therapy 13 patients had side effects, two was severe systemic reactions. Conclusion: Intravesical BCG reduces the risk of recurrence and progression in patient whit transitional T1G3 bladder carcinoma. Our study suggest no difference into induction or maintenance therapy in short terms results. The side effects were similar in two groups. K E Y W O R D S : Superficial bladder cancer, T1G3, BCG therapy, Maintenance therapy. I NTRODUCCIÓN El cáncer vesical es el 4º tumor más frecuente en hombres y el 8º en mujeres, siendo unas de las 10 primeras causas de muerte por enfermedades neoplásicas en los Estados Unidos de Norteamérica. Aproximadamente el 90% corresponde a carcinoma transicional y de éstos, el 70% es diagnosticado como superficial. Las tasas de recurrencia oscilan entre el 50 y 80% y la progresión entre el 15 y 40%, dependiendo del grado tumoral y su localización en la mucosa o en la lámina propia.1 La utilización del bacilo de Calmette-Guerin (BCG) descripto inicialmente por Morales y cols. en 1976 ha mostrado una acción eficaz en la disminución de la recurrencia y la progresión en carcinomas de alto grado.2 Actualmente se discute el régimen más adecuado en el uso de BCG. Es el propósito del presente estudio comparar la evolución a largo plazo y tolerancia en pacientes con carcinoma transicional de alto grado T1G3, tratados mediante instilación intracavitaria de BCG, con o sin mantenimiento. M AT E R I A L Y M É T O D O S En el Centro de Urología CDU fueron tratados por carcinoma transicional de vejiga con resección transuretral (RTU-V) 213 pacientes entre marzo de 1993 y agosto de 2004. Se evaluaron 56 pacientes con diagnóstico histopatológico de carcinoma transicional T1G3 con o sin carcinoma in situ asociado, informados por un mismo patólogo (BE). 22 La evaluación inicial consistió en una anamnesis detallada, así como un examen físico completo, con análisis de sangre y orina, incluyendo este último una muestra para citología (PAP). La RTU-V se realizó en todos los casos en forma completa tomando una muestra profunda del lecho a fin de evaluar la capa muscular propia. A continuación se solicitó urocultivo. De ser éste positivo se medicó con antibioticoterapia específica hasta negativizarlo. Veintidós pacientes ingresaron en el esquema de inducción y mantenimiento con BCG, y 19 pacientes fueron tratados sólo con inducción de BCG. Ocho pacientes no realizaron tratamiento posterior, 4 fueron tratados con mitomicina y 3 fueron perdidos en seguimiento. Las razones por las cuales un grupo de pacientes no realizó tratamiento se debió en 6 casos por negativa del individuo y en dos casos por tardanza en los trámites de la cobertura social. El tratamiento de BCG con mantenimiento se inició entre la cuarta y sexta semana posterior a la resección, con urocultivo negativo, según el esquema del Southwest Oncology Group (SWOG), comenzando con una inducción semanal por el lapso de seis semanas de 120 mg (10,5 ± 87, 108) diluida en 50 ml de solución salina.3 Se indicó contener la micción por un período aproximado de dos horas. Cada semana se registró los eventuales efectos adversos y de haberlos se los clasificó en tres categorías: 1) Leve (no requirió medicación específica): sintomatología irritativa urinaria menor a 48 horas de evolución que no impide la actividad habitual; febrí- cula; hematuria leve. 2) Moderada (requirió medicación específica o isoniacida): síntomas irritativos mayores a 48 hs. de evolución que interfieren en la actividad habitual, fiebre > 38°c y < 39,5°c, hematuria moderada con coágulos, reacciones alérgicas. 3) Severa (requirió internación): hematuria severa que precisó hemoderivados, BCG-ítis, SIRS o sepsis. Concluida la inducción de seis semanas se programó una cistofibroscopia bajo anestesia general, con toma de biopsias randomizadas de la mucosa vesical y PAP. Aquellos pacientes que no realizaron mantenimiento fueron seguidos mediante cistofibroscopias con anestesia uretral trimestralmente los primeros dos años, y semestralmente los subsiguientes. Para el grupo tratado con mantenimiento de BCG, éste consistió en instalaciones semanales por tres semanas a los 3, 6, 12, 18, 24, 30 y 36 meses. Al mes de cada fin del ciclo se practicó nueva cistofibroscopia con toma de PAP. Todos los ciclos se realizaron con urocultivo negativo. Nuevamente se consignaron los eventuales efectos adversos. Para ambos grupos fue considerada recaída la presencia de células neoplásicas en las biopsias vesicales o en eventuales re-resecciones ante la sospecha de neoformaciones vesicales o PAP positivo. Ante la presencia de una neoplasia se indicó un nuevo ciclo de inducción con seis dosis de BCG. Análisis estadístico: Se analizaron los datos con test de Fisher para proporciones. Software STATA 8.0. R E S U LTA D O S Fueron evaluados 56 pacientes con diagnóstico histopatológico de carcinoma transicional T1G3 representando el 26,17% de todas las resecciones vesicales. El promedio de seguimiento general fue de 50 meses (6112). La edad promedio fue 65,32 años (49-81), siendo la distribución por sexo de 51 hombres y 5 mujeres. Presentaban antecedentes de tabaquismo 45 pacientes (80,36%). En 11 casos se observó multiplicidad de neoformaciones. Se diagnosticó CIS asociado en 11 pacientes. Fueron tratados con mantenimiento de BCG 22 pacientes, con un seguimiento medio de 47,86 meses (6-100). Se observó recidiva de la enfermedad en 8 pacientes, tres de los cuales recayeron en dos oportunidades siendo un total de 11 recidivas (50%). Las recidivas se presentaron en su mayoría antes de finalizar el primer año de tratamiento, 8 de 11 (72%). En un solo caso se observó progresión a un estadio T2 (4,54%). En contraposición, 19 pacientes fueron tratados só- Rev. Arg. de Urol. · Vol. 70 (1) 2005 lo con seis dosis de BCG, siendo el seguimiento medio de 52,73 meses (6-112), observándose una recidiva en 8 pacientes recayendo dos pacientes en 2 oportunidades, siendo un total de 10 recidivas (52,63%) y una progresión en 2 pacientes (10,52%). La recidiva también en este grupo se observó mayoritariamente en el primer año, 7 de 10 (70%). Al comparar ambos grupos, no se observa diferencia en cuanto a la recidiva de la enfermedad (p= 0,86) ni en cuanto a la progresión (p= 0,46). Al evaluar los efectos adversos éstos se observaron en 24 pacientes (58,53%). Hallamos dos pacientes (4,87%) con cuadros catalogados como severos, que requirieron internación, isoniacida y en un caso lavado vesical para evacuar un molde de coágulos. En tres casos (7,31%) se observó sintomatología moderada, medicándose con isoniacida, y en 19 pacientes (46%) se presentó una sintomatología leve de resolución espontánea o con oxibutinina. (Gráfico 1). Trece pacientes se encontraban en tratamiento con mantenimiento y 11 sólo con inducción. No hay diferencias estadísticas en cuanto a los efectos adversos entre ambos grupos. Concluyeron el tratamiento propuesto el 65,8% de los pacientes. DISCUSIÓN Es conocido el potencial de recidiva y progresión de los carcinomas transicionales de alto grado, así como la importancia de la infiltración de la lámina propia en el pronóstico de la enfermedad. Las instilaciones con BCG constituyen actualmente el tratamiento de primera línea en carcinomas T1G3, obteniendo respuestas de hasta un 70%.4-11 Sin embargo, aún no queda del todo claro cuál debe ser el régimen de tratamiento con BCG a fin de obtener los mejores resultados. 2 3 19 17 Gráfico 1. Efectos adversos: ausente 17, leve 19, moderado 3, severo 2. 23 Lamm y cols. en el Southwest Oncology Group Study, han propuesto una modificación al régimen inicial de Morales y cols., el cual consiste en una inducción de seis ciclos de BCG seguido por un mantenimiento a los 3, 6, 12, 18, 24, 30 y 36 meses, de tres instilaciones cada uno.3 Debemos evaluar con cuidado los beneficios y riesgos de este tipo de terapia continua. Distintos autores han publicado en la literatura sus experiencias. En su publicación original el estudio del SWOG, prospectivo randomizado, compara 384 pacientes divididos en dos cohortes, con y sin mantenimiento de BCG, con un seguimiento mayor a 10 años, observando una ausencia de recurrencia de 76,8 vs. 35,7 meses respectivamente, un menor número de progresión y una sobrevida a los 5 años de 83% vs. 78%. No se registraron casos de toxicidad severa, pero sólo el 16% de los pacientes completaron en forma íntegra el esquema de mantenimiento.3 En noviembre de 2002 se publicó un metaanálisis sobre 24 estudios y 5.456 pacientes con carcinoma superficial de vejiga y tratamiento con BCG. Concluye este análisis que el tratamiento con BCG con algún tipo de mantenimiento resulta en una reducción del riesgo de progresión de 37%.12 Nosotros no hemos encontrado diferencias en cuanto al tratamiento utilizado. Esta diferencia con las citadas publicaciones podría deberse a la necesidad de un mayor número de pacientes a evaluar por nuestro Centro. En cuanto a las tasas de recurrencia, oscilan entre 16 a 50%, y las tasas de progresión de 7 a 22%.4-11,13-14 Nosotros hemos encontrado una recurrencia del 50 y 52,63% en el grupo tratado con mantenimiento y en el grupo de BCG solamente, respectivamente siendo estos valores similares a reportes con valores elevados de recidiva. En contraposición sólo hemos encontrado una progresión del 4,54 y 10,52% respectivamente, equiparándose a los reportes más bajos. En cuanto a los efectos adversos hemos hallado un 58,53% de pacientes sintomáticos. Sin embargo, sólo un 12% correspondieron a cuadros moderados o severos. Estos valores son inferiores a reportes de otros autores.14-15 No encontramos a su vez diferencia estadística entre los grupos de tratamiento estudiado. CONCLUSIÓN El tratamiento de pacientes con carcinoma transicional T1G3 con BCG es una terapia efectiva y segura, con escasos efectos adversos severos. No encontramos diferencia entre la terapia de mantenimiento o de inducción solamente en las tasas de recurrencia y progresión de la enfermedad. 24 BIBLIOGRAFÍA 1. Messing, E. M. y Catalona, W.J.: Urothelial tumors of the urinary tract. En: Campbell’s Urology 7th ed. Editado por P.C Walsh y Cols. Philadelphia: W.B Saunders C. 1998. 2. Morales, A. y cols.: Intracavitary bacillus Calmette Guerin in the treatment of superficial bladder tumors. J. Urol., 116: 180-183, 1976. 3. Lamm, D. L.; Blumenstein, B. A.; Crawford, E. D y cols.: Maintenance bacillus Calmette Guerin inmunotherapy for recurrent Ta T1 and CIS transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study. J. Urol., 163: 1124-1129, 2000. 4. Herr, H. W.; Wartinger, D. D. y cols.: Bacillus Calmette Guerin therapy for superficial bladder cancer: a 10 year follow-up. J. Urol., 147: 1020, 1992. 5. Herr, H. W.; Laudone y cols.: Bacillus Calmette Guerin therapy alters the progression of superficial bladder cancer. J. Clin. Oncol., 6: 1450, 1988. 6. Pansadoro, V.; Emilliozzi, P. y cols.: Bacillus Calmette Guerin in the treatment of stage T1G3 transitional cell carcinoma of the bladder long term results. J. Urol., 154: 2054, 1995. 7. Baniel, J.; Grauss D. y cols.: Intravesical bacillus Calmette Guerrin treatment for stage T1G3 transitional cell carcinoma of the bladder. Urology, 52: 785, 1998. 8. Lebret, T.; Gaudez F. y cols.: Low dose BCG instillations in the treatment of stage T1G3 bladder tumors: recurrence progression and success. Eur. Urol., 34: 67, 1998. 9. Hurle, R.; Losa A. y cols.: Intravesical bacille Calmette Guerin in stage T1G3 bladder cancer therapy: a 7 year follow-up. Urology 54: 258, 1999. 10. Coplen, D. E.; Marcus, M. D. y cols.: Long Term followup of patients treated whit 1 or 2, 6 week courses of intravesical bacillus Calmette Guerin analysis of possibles predictors of response free of tumor. J. Urol., 144: 652, 1990. 11. Patard, J. J.; Moudouni S. y cols.: Tumor progression and survival in patients whit T1G3 bladder tumors: multicentric retrospective study comparing 94 patients treated during 17 years. Urology 58: 551, 2001. 12. Richard, J.; Lamm, D. L. y cols.: Intravesical bacillus Calmette Guerin reduces the risk of progression in patients whit superficial bladder cancer: a meta analysis of the published results of randomized clinical trials. J. Urol., 168: 1964-1970, 2002. 13. Peyromaure, M.; Guerin, F. y cols.: Intravesical bacillus Calmette Guerin therapy for stage T1G3 transitional cell carcinoma of the bladder: recurrence progression and survival in a study of 57 patients. J. Urol., 169: 2110-2112, 2003. 14. Kolodziej, J.; Dembowski, R. y cols.: Treatment of high risk superficial bladder cancer with maintenance bacille Calmette Guerin therapy: preliminary results. BJU, 89: 620-622, 2002. 15. Saint, F.; Irani, J. y cols.: Tolerability of bacille Calmette Guerin maintenance therapy for superficial bladder cancer. Urology 57: 883-888, 2001. C O M E N TA R I O E D I T O R I A L Se realiza un análisis sobre 56 pacientes con un período de control de 11 años, un número importante y largo período de seguimiento le dan real valor al trabajo. En la evaluación dentro de los estudios solicitados no se mencionan pruebas funcionales hepáticas, como tampoco se menciona si se realizaron Tests de Alergia Cutánea PPD, que consideramos de gran valor. Material y métodos El tratamiento con inducción y seguimiento y el de inducción con seis dosis sin seguimiento, fueron evaluados. En nuestra experiencia, luego de evaluar los diversos seguimientos optamos por la inducción de seis semanas y una nueva instilación cada seis meses en ausencia de enfermedad, basándonos en lo que da en llamarse la memoria inmunológica, que sería reactivada con la instilación de los seis meses. En cuanto a los tratamientos intensivos, se debe tener en cuenta que se puede incrementar la toxicidad y disminuir la reacción inmunológica. Efectos adversos Los autores presentan 24 casos; 19 con sintomatología leve, 3 con tratamientos con isoniacida y 2 severos con internación. He mencionado en la evaluación del paciente el Test cutáneo PPD de suma importancia. El grado de positividad nos permitirá vislumbrar la acción y las probables complicaciones de la BCG intravesical. A saber: Con Test positivo cutáneo de menos de 2 cm (que demuestra alergia tuberculínica), el tiempo límite de enfermedad era más prolongado y, en muchos casos, no se observaron recidivas. Rev. Arg. de Urol. · Vol. 70 (1) 2005 Si la reacción cutánea era mayor de 2 cm, ya nos hacía poner en guardia, dado que podría, por hiperergia, dar síntomas mayores con complicaciones que podrían llegar a BCGítis que podría llegar a ser sistémica, pudiendo derivar en serios problemas hepáticos, como así también francas hematurias. En este caso, al inicio de los primeros síntomas se suspende el tratamiento y se pasa a otra droga alternativa. Puede observarse también que la reacción cutánea PPD puede hacer negativa en la evaluación, la cual se positiviza con el tratamiento intravesical de BCG. Lo cual habla de la efectividad que puede tener la BCG. En cuanto a las recidivas, coincidimos en los tiempos, principalmente de los casos de tumores múltiples. En los tumores T1 G3 el diagnóstico anátomo-patológico oscila entre el 35 y el 50% de error, según la bibliografía. Está motivado por la poca profundidad del corte en la RTU y la acción del calor en el corte que está en relación con la intensidad del mismo, donde se producen necrosis celulares que dificultan el diagnóstico. Respecto de las conclusiones, considero es la justa. La BCG es la más efectiva de los tratamientos endovesicales. No tenemos, todavía, la medicación ideal, ya que para ello debería cumplir: • • • • Efectividad 100% Fácil aplicación Sin efectos adversos Económico El tiempo dirá. A los expositores, considero el trabajo bueno y los aliento para continuar en la investigación. Dr. Elvio Omar Soldano Ex Presidente de la S.A.U. 25 ARTICULO ORIGINAL ORIGINAL ARTICLE Estenosis de uretra anterior complejas. Resolución quirúrgica Complex anterior urethral strictures. Surgical treatment Dres. Chéliz, G. M. J.*; Kogan, D.; Rizzo, M.; Castro, F.; Rey, H. M.; Fredotovich, N. Objetivo: Evaluar la respuesta terapéutica quirúrgica en pacientes con estenosis de uretra bulbar (EUB) adyacentes al piso perineal, coincidentemente con una estenosis de la uretra péndula (EUP). Material y Métodos: Se estudió una población de 15 pacientes con estas características. Se definieron dos grupos según la técnica empleada en la resolución de la EUB: Grupo a) 13 pacientes requirieron la realización de una Resección Anastomosis Primaria (RAP). Grupo b) En 2 casos se emplearon técnicas en dos tiempos. La EUP fue resuelta con un colgajo fasciocutáneo longitudinal de piel de pene a lo Orandi o transversal de prepucio. El seguimiento promedio de toda la población fue 4,3 años, Resultados: El 33,33% de los pacientes tuvieron que ser reintervenidos quirúrgicamente: Grupo a) fueron reintervenidos el 23% y en el grupo b) el 100%. Topografía de la recurrencia: Grupo a) en todos los casos involucraba la EUB, Grupo b) se registraron estenosis a nivel de la EUB en un caso y de la boca proximal del Orandi en otro. La plástica que más recurrencia registró fue la RAP. Los tiempos de recurrencia fueron bajos con una media de 3,48 meses (2 a 9 meses). Conclusión: a) La recurrencia observada fue elevada, especialmente en las RAP. b) La recurrencia suele ser temprana y suele requerir resolución quirúrgica, siendo improbable que opciones mínimamente invasivas sean la opción a considerar. P A L A B R A S C L AV E : Uretra, Estenosis, Uretroplastia. Servicio de Urología Hospital Durand, Buenos Aires, Argentina. *Av. Díaz Vélez y Ambroseti [email protected] 26 Purpose: Communicate the observed outcome in a group of patients with bulbar urethral stricture close to the perineal floor in coincidence with a pendulous urethral stricture. Material and Methods: 15 patients with this clinical settings were divided in two groups depending upon the technique employed in the treatment of the bulbar stricture: Group a) 13 patients were done a primary anastomosis. Group b) 2 patients underwent a 2 stage procedure. Pendulous urethral stricture was resolved in 12 cases with a longitudinal fasciocutaneous flap and in 3 cases with a transversal preputial flap. Average follow-up was 4.3 years. Average age was 58.3 years. Results: 33.3% of patients underwent a surgical procedure for stricture recurrence. Group a) Bulbous urethral stricture was involved in all cases. Group b) 1 case recurrence at the primary anastomosis and 1 case recurrence at the proximal Orandi end were observed. Time to recurrence was 3.48 months (2 to 9 months). All but one recurrence was resolved with open surgery procedures. Conclusion: 1. The treatment of a bulbar urethral stricture adjacent to the perineal floor and a pendulous urethral stricte is prone to a high recurrence rate. 2. Usually recurrence is early and an open surgery procedure is the usual choice of treatment. K E Y W O R D S : Urethra, Stricture, Urethroplasty. I NTRODUCCIÓN Los pacientes en los cuales coexisten estenosis extensas de la uretra péndula (EUP) y de la uretra bulbar (EUB) adyacentes al piso perineal, constituyen un grupo aparte dentro de las estenosis de uretra. En algunos casos, la única forma de acceder a la estenosis de la uretra bulbar, es sacrificando las arterias bulbares. En estos casos la sección de las mismas, compromete la vitalidad de la uretra anterior, que depende exclusivamente de la comunicación entre las arterias dorsales y las bulbo uretrales. Si la espongiofibrosis de la EUP es lo suficientemente densa para evitar un flujo adecuado proximal a la misma, la vitalidad de la uretra bulbar y por ende la viabilidad de la plástica se ven comprometidas, por ende la recomendación más frecuente es no realizar una resección anastomosis en estos casos. Cuál es la mejor estrategia sigue siendo materia de discusión y motivo de comunicaciones anecdóticas. Curiosamente no encontramos en la literatura revisada comunicaciones acerca de la evolución de este grupo tan particular de pacientes. M AT E R I A L Y M É T O D O S a) Población: Criterios de inclusión: pacientes con EUB completas (sin luz uretral) de 1 a 2 cm de longitud, adyacente al piso perineal, asociadas a EUP extensas de 4 o más cm, en los cuales las arterias bulbares hayan tenido que ser sacrificadas para realizar la plástica de la EUB. Criterios de exclusión: 1) pacientes que presentaran estenosis por Balanitis Esclerosante Atrófica; 2) Plásticas uretrales previas fallidas. Como resultado de estos criterios fueron seleccionados 15 pacientes con una edad promedio de 58,3 años (22 a 71), en un período comprendido entre 1995 y marzo del 2004, con un seguimiento promedio de 3,8 años. Se definió como fracaso la necesidad de reintervención del paciente, a cielo abierto o por vía endoscópica, por recurrencia de la estenosis. b) Antecedentes: Todos los casos se asociaban con reiteradas dilataciones instrumentales ciegas traumáticas con o sin varios intentos de uretrotomías internas. Un paciente sufrió una lesión intraoperatoria de la uretra durante un procedimiento cosmético de ampliación peneana (inyección de grasa autóloga y sección del ligamento suspensorio) en el cual se practicó una reparación primaria que evolucionó hacia la estenosis seguida de múltiples dilataciones. Un paciente presentaba como antecedente quirúrgico significativo una adenomectomía transvesical; 2 casos: uretrotomías internas falli- Rev. Arg. de Urol. · Vol. 70 (1) 2005 das con extravasación de líquido en escroto, 1 caso: celulitis necrotizante de escroto, 1 caso: fístula uretrocutánea (perineo). c) Evaluación preoperatorio: Se realizó el par radiológico de uretrografía retrógrada y cistouretrografía miccional y uretroscopia siempre que fuera posible. Todos se encontraban con derivación suprapúbica al momento de la consulta. d) Técnica quirúrgica empleada: 1) EUP: La resolución de la estenosis se realizó en todos los casos de distal a proximal, comenzando por la EUP. En 12 casos se empleó un colgajo fasciocutáneo de piel de pene longitudinal a lo Orandi,1 en 3 uno transversal de piel de pene o prepucio. 2) EUB: Una vez completada la plástica de la uretra péndula se colocó al paciente en posición de litotomía forzada y se prosiguió con la resolución de la EUB. En 13 casos se realizó simultáneamente una RAP. Específicamente en 7/13 casos la RAP se realizó en el pico prostático y en 6/13 a la uretra membranosa. En 2 casos, al momento de seccionar las arterias bulbares se decidió no realizar una RAP por escasa irrigación de la uretra bulbar y se convirtió con una técnica en 2 tiempos a lo Schritter-Noll.2 Según la técnica empleada en el tratamiento de la EUB dividimos a la población en dos grupos: Grupo a) tratamiento con técnicas en un tiempo (RAP), Grupo b) tratamiento con técnicas en dos tiempos (Tabla 1). R E S U LTA D O S El 33,33% de los pacientes (5/15 casos) tuvieron que ser reintervenidos quirúrgicamente para resolver una recurrencia en el sitio de la plástica. El tiempo quirúrgico empleado osciló entre las 5 y las 7 horas (promedio: 5,5 horas). Recurrencia por grupo: Grupo a) fueron reintervenidos el 23% (3/13 pacientes) por recurrencia de la EUB; Grupo Grupo a Grupo b Criterio Técnicas en un tiempo Técnicas en dos para la EUB tiempos para la EUB N 13 2 Reintervención quirúrgica 23% (3 pacientes) 100% (2 pacientes) Tabla 1. Población en estudio 27 Grupo Técnica UP Recurrencia en meses Lugar de recurrencia Tratamiento 1 Quartey + RAP 9 EUB Uretrotomía interna 1 Orandi + RAP 3 EUB Anastomosis ampliada + Injerto de mucosa bucal 1 Orandi + RAP 3 EUB Anastomosis ampliada + Injerto piel de pene 2 Orandi + Schritter-Noll 2 Boca distal del Orandi Puesta a plano de la boca proximal del Orandi y posterior cierre 2 Orandi + Schritter-Noll 2 EUB (boca proximal del Schritter Noll(1) CFC de Escroto a lo Blandy en 2 Tiempos(2) Tabla 2. Recurrencia de la estenosis 1) Schritter-Noll: injerto de piel parcial en dos tiempos. 2) Colgajo escroto uretral intubado, plástica en dos tiempos. Grupo b) fueron reintervenidos el 100% (2/2 pacientes). Topografía de la recurrencia: 4/5 recurrencias se localizaron en la EUB y 1/5 en la boca proximal del Orandi. Recurrencia por técnica: Recurrieron el 23% de las RAP (3/13), el 6,6% de los colgajos fasciocutáneos (1/15) y el 50% (1/2) de las técnicas en dos tiempos. Los tiempos de recurrencia fueron bajos con una media de 3,8 meses (2 a 9 meses). Sólo en un caso se pudo emplear una uretrotomía interna en la boca de la EUB, el resto requirió procedimientos a cielo abierto (Tabla 2). Se registró una fístula uretrocutánea distal en el paciente que había recibido un procedimiento de ampliación peneana con inyección de grasa autóloga. No se registró incontinencia de orina o disfunción eréctil postoperatorias. DISCUSIÓN Teniendo en cuenta que la discusión gira alrededor de una población muy especial como la presente, los resultados obtenidos y la literatura revisada nos merecen las siguientes consideraciones. 1) Vitalidad de la uretra anterior: Cada vez que uno secciona las arterias bulbares debe considerar que la vitalidad de la uretra anterior depende de la permeabilidad de las arterias uretrales que a su vez dependen de las arterias dorsales del pene y en menor medida de las arterias perforantes entre los territorios cavernoso y uretral. Hasta la fecha no hay forma de cuantificar el flujo de las arterias uretrales en condiciones normales o patológicas, como ser una estenosis de uretra péndula, cuya espongiofibrosis, no favorece y seguramente com- 28 promete la vitalidad de la uretra bulbar. Al respecto son por demás interesantes los trabajos de Chiou3,4 el cual utiliza la ultrasonografía con transductor de alta frecuencia y el ecodoppler color para localizar las arterias bulbares. Indirectamente evalúa la vascularización del segmento de espongiofibrosis oprimiendo el cuerpo esponjoso distalmente a la estenosis. Esta maniobra, según el autor, permitiría resaltar la vascularización de la uretra sin espongiofibrosis, en contraste con la cicatriz que constituye la estenosis, donde la vascularización sería nula. Teóricamente, pacientes con una estenosis en la que espongiofibrosis que respetara parte de la uretra serían candidatos para una RAP sin mayores riesgos. Si uno pudiera cuantificar el flujo sanguíneo en la zona de la estenosis se podría inferir y cuantificar la vitalidad de la uretra bulbar luego de la sección de las arterias bulbares. 2) Elección de la técnica destinada al tratamiento de la EUB: Partiendo de la base de que en estos casos uno debe evitar la sección de las arterias bulbares y por ende una RAP, nuestra postura frente a estos casos es: A) Primera elección: Ampliación uretral con injerto de mucosa bucal,5,6 siempre y cuando la boca proximal sea accesible y el lecho receptor adecuado (no es recomendable la colocación de un injerto en forma transesfinteriana). B) Segunda elección: RAP, siempre y cuando que el sangrado retrógrado del bulbo y de la zona de espongiofibrosis de la EUP sea adecuado. Si la vitalidad de la uretra bulbar parece comprometida o la espongiofibrosis lo suficientemente densa nos planteamos dos alternativas: 1) Técnicas en dos tiempos: sea el empleo de un injerto de piel parcial en dos tiempos a lo Schritter-Noll siempre que sea posible, o un colgajo escroto uretral intubado a lo Blandy como última opción. 2) Anastomo- sis ampliada con injerto de mucosa bucal. Cuál es la mejor de las dos últimas posturas es materia de discusión. Obviamente toda apreciación subjetiva respecto de la vitalidad de la uretra bulbar está sujeta a error y seguramente explica la recurrencia del 23% de las RAP, decididamente superior a la que tendría si no estuviera asociada con una EUP. Si bien la población del Grupo b de nuestra serie es escasa, la recurrencia del 100% marca una tendencia a evaluar en este sentido en poblaciones más importantes. Esta recurrencia es especialmente elevada en la uretra bulbar y la plástica más frecuente afectada la RAP. En el caso en particular de las RAP el 23%, con una recurrencia esperada 2 a 3 veces menor en población no seleccionada tratadas con RAP (Tabla 3) . No debe sorprender la buena evolución de los colgajos de piel peneana, ya que éstos, desde el punto de vista vascular dependen de otro territorio, siendo las pudendas externas (colaterales de la femoral) las responsables de su vitalidad. CONCLUSIÓN 3) Tiempo de recurrencia: En nuestra opinión el tiempo de recurrencia de una plástica es un factor pronóstico importante, a la hora de afrontar el tratamiento de la misma. Creemos, basados en la observación de nuestra población, que hay básicamente tres tipos de recurrencia a) temprana (hasta los 6 meses), b) mediata (6 a 12 meses) y c) alejada (posterior al año). Las tempranas, suelen obedecer sea a limitantes técnicos importantes, o a problemas vasculares no evaluados, no evaluables o imprevistos. Este es sin duda el grupo de peor pronóstico y el que habitualmente requiere una nueva uretroplastia para afrontar el problema. Cuanto más tardía sea la estenosis, más probable que las opciones mínimamente invasivas (Ej.: uretrotomía interna) sean una opción satisfactoria y más improbable que una cuestión técnica importante, o vascular, sea la causa. Como era de esperar, la recurrencia en la población descripta en esta comunicación es temprana (3,8 meses de promedio), debido a que hay un problema vascular no resuelto, que es el hipoflujo seguramente presente y no evaluable, en la uretra bulbar. 4) Recurrencia: Las consideraciones realizadas en los puntos 1, 2 y 3 explican fácilmente el elevado índice de recurrencia observado en nuestra población (33,33%). Autor Recurrencia Jakse y col.7 7 Panagakis y col.8 5 Azoury y col.9 Webster y col.10 8 0 Jensen y col. 0 Presente serie 23 Tabla 3. Recurrencia esperada en RAP Rev. Arg. de Urol. · Vol. 70 (1) 2005 a) La resolución quirúrgica de una EUB adyacente al piso perineal y una EUP se asocian con una incidencia de recurrencia elevada, especialmente en las RAP realizadas. b) La recurrencia suele ser temprana y suele requerir resolución quirúrgica, siendo improbable que opciones mínimamente invasivas sean la opción. BIBLIOGRAFÍA 1. Orandi, A: One stage urethroplasty: 4 year follow up. J. Urol., 107: 977-780, 1972. 2. Schritter, F. y Noll, F.: Mesh graft urethroplasty using split thickness skin graft or foreskin. J. Urol., 142: 12231226, 1989. 3. Chiou, R. K.; Anderson J. C.; Tran, T.; Paterson R. H.; Wobig, R. y Taylor, R.: Evaluation of urethral strictures and associated abnormalities using High-resolution and color doppler ultrasound. Urol., 47 (1): 102, 1996. 4. Chiou, R. K.; Donovan, J. M.; Anderson. J. C.; Matamoros, A.; Wobig, R. K. y Taylor, R. J.: Color doppler ultrasound assessment of urethral arthery location: potential implication for technique of visual internal urethrotomy. J. Urol., 159: 796, 1998. 5. El-Kasaby A. W.; Alla. M. F.; Noweir, A. y col.: One stage anterior urethroplasty. J. Urol., 156: 975-978, 1996. 6. Belinky, J.; Cobreros, C.; Perlcanachis, D. E.; De Bonis, W.: Kogan, D.; Rizzo, D.; Castro, F.; Rey, H. M.; Fredotovich, N. y Chéliz, G. M. J.: Uretroplastía con injerto de mucosa bucal en el tratamiento de la estenosis de uretra anterior. Rev. Argent. Urol., (1990); 68 (2): 83-89, abr.-jun. 2003. 7. Jakse, G. y Marberger, H.: Excitional repair of urethral stricture, Follow-up of 90 patients. Urology, 27: 233, 1986. 8. Panagakis, A.; Smith J. C.; Williams J. L.: One-stage excision urethroplasty for stricture. Br. J. Urol., 50: 410, 1978. 9. Azoury, R. S. y Freiha, F. S.: Excision of urethral stricture and end to end anastomosis. Urology, 8: 138, 1976. 10. Webster, G. D.; Koefot, R. B. y Sihelnik, S. A.: Urethroplasty management in 100 cases of urethral stricture: A rational for procedure selection. J. Urol., 134: 892, 1985. 29 C O M E N TA R I O E D I T O R I A L Agradezco a la Comisión Directiva la designación para comentar el Trabajo de los Dres. Chéliz y col. Los autores presentan un problema de solución difícil que sin duda será materia de discusión como ellos mismos lo dicen. Comenzando por el título, agregaría la palabra difícil a “resolución quirúrgica” porque así lo plantea la presentación. Concretamente se trata de un estudio retrospectivo sobre 13 pacientes operados mediante una resección anastomosis primaria RAP por una estenosis bulbar completa, sin luz uretral, coexistente con una estenosis extensa de la uretra péndula. Ante la necesaria sección de las arterias bulbares el problema radica en la posible falta de aporte sanguíneo por el cabo distal (secundaria a espongiofibrosis de importancia variable en la uretra péndula) y como preveerla. La bibliografía consultada reconoce el problema sin dar solución. En general, los métodos utilizados para valorar la 30 irrigación del cuerpo esponjoso se basan en apreciaciones subjetivas, el mismo Chiou así lo reconoce. Los autores proponen como primera elección terapéutica el injerto de mucosa bucal y como segunda la RAP, si el cabo distal fuera viable, ¿cómo saberlo? A otras alternativas las juzgan discutibles, pero no presentan bibliografía al respecto. En conclusión considero que la presentación tiene el gran mérito de plantear un problema de incierta solución, que si bien con la técnica empleada muestra alto porcentaje de recurrencia abre una mejor posibilidad al sugerir otra. Como modesta contribución agregaría mis dudas: ¿por qué no el colgajo fasciocutáneo de Quartey? por más que para cubrir el pene haya que recurrir a un injerto libre de piel (o más seguro a un Cecil) en este caso quedará un pene peludo, pero con buena uretra. Y otra, ¿han probado de mejorar y tal vez de evaluar mejor la irrigación de cuerpo cavernoso mediante la bomba de vacío? Prof. Dr. Carlos Sáenz Ex Presidente de la S.A.U. ARTÍCULO ORIGINAL ORIGINAL ARTICLE Lugar actual de la embolización transarterial en tumores renales Current place of the transarterial embolization in renal cell carcinomas Dres. Gueglio, G.*; Piana, M.**; García Mónaco, R.***; Peralta, O.****; Damia, O.***** Servicio de Urología del Hospital Italiano. Buenos Aires, Argentina. Objetivo: Establecer el lugar actual de la embolización renal en el manejo de los tumores renales. Material y Métodos: Entre 11/96 y 4/04 se realizaron 29 procedimientos de embolización arterial renal transcatéter por patología renal (23 carcinomas y 6 angiomiolipomas). La eficacia del método fue evaluada según si se logró, o no, el objetivo que motivó la indicación. Los pacientes fueron divididos 3 grupos: 1) Embolización como único tratamiento en tumores asintomáticos; 2) Embolización prequirúrgica en el tratamiento combinado de carcinomas renales y 3) Embolización como tratamiento único en tumores sintomáticos. Resultados: Grupo 1: Se realizaron 6 procedimientos: 5 carcinomas renales y 1 angiomiolipoma. No se presentaron complicaciones intra-procedimiento. El seguimiento promedio fue de 21,5 meses (r: 2-80). Tres pacientes fallecieron por progresión de su enfermedad. La paciente con el angiomiolipoma no ha sangrado. Grupo 2: Se realizaron 7 procedimientos. Todos fueron carcinomas renales. El intervalo embolización/cirugía promedio fue de 7,5 días (r: 1-15). El sangrado operatorio fue leve a moderado. El grado de dificultad técnica fue considerado como menor del habitual, salvo en un caso. El tiempo de seguimiento promedio fue de 46 meses (r: 4-67). No se evidenciaron signos de recidivas. Grupo 3: Formado por 16 pacientes, divididos en 2 grupos: a) complicaciones derivadas del propio tumor (15 casos, 94%) y b) complicaciones de procedimientos previos (1 paciente, 6%). El procedimiento fue bien tolerado por todos los pacientes. No se observó progresión de la enfermedad ni recidiva del síntoma que motivó la embolización. Conclusión: Las indicaciones actuales de la embolización arterial transcatéter para tumores renales son: 1. Como único tratamiento en pacientes asintomáticos, con objetivo paliativo en enfermedad maligna avanzada: carcinoma renal metastásico y/o inoperable, y preventivo de posibles complicaciones hemorrágicas en angiomiolipomas de gran tamaño (> 8 cm). 2. Prequirúrgica en el tratamiento combinado de carcinomas renales de 15 cm o más, con el objetivo de disminuir la morbimortalidad del acto quirúrgico. 3. Como tratamiento único en pacientes con tumores sintomáticos no operados (hematuria macroscópica o dolor lumbar) y en complicaciones vasculares postquirúrgicas. P A L A B R A S C L AV E : Embolización transarterial; Carcinoma renal. * Sub-Jefe del Servicio de Urología. ** Residente del Servicio de Urología. *** Jefe del Servicio de Angiografía Digital y Terapia Endovascular. **** Médico Contratado del Servicio de Angiografía Digital y Terapia Endovascular. ***** Jefe del Servicio de Urología. Rev. Arg. de Urol. · Vol. 70 (1) 2005 Aim: The aim of this presentation is to define which is the place for renal embolization in the management of kidney tumors. Material and Methods: Between 11/96 and 4/04, 29 transartery renal embolizations were done due to kidney pathology, 23 carcinomas and 6 angio myo lipomas (AML). The efficacy of the procedure was determined whether the goal for which it was indicated was achieved or not. Patients were divided into 3 groups: 1) embolization as the unique treatment of asymptomatic tumors. 2) In a combined treatment strategy prior to surgery and 3) as the unique treatment of symptomatic tumors. 31 Results: Group 1: six procedures were carried out (5 for malignant tumors and one AML). There were no complications during the procedure. Mean follow-up was 21.5 months (r: 2 - 80). Three patients died because of their malignancy. The patient with the AML has not presented any bleeding. Group 2: seven procedures, all for renal cell carcinomas. The average time between embolization and surgery was 7.5 days (r: 1 - 15). Post-op bleeding was mild to moderate. The surgical procedure was considered easier than usual but in one case. Mean follow-up was 46 months (4 - 67). There were no signs of recurrence. Group 3: 16 patients divided into 2 sub-groups: a) with complications due to the tumor (15 cases, 94%) and b) with complications due to prior procedures (1 patient, 6 %). The procedure was well tolerated by all the patients. There was no progression of the disease nor relapse of the symptom that motivated the indication. Conclusion: Current indications for renal transartery embolization are: 1. as the only treatment in asymptomatic patients, with palliative purposes in advanced disease and in big AMLs (>8 cms) as a preventive of massive bleeding. 2. Prior to surgery in the treatment of big masses (15 cms. or more) with the aim of diminishing the operation morbid-mortality. 3. As the unique treatment in non-operated patients with symptomatic tumors (hematuria and/or lumbar pain) K E Y W O R D S : Transarterial embolization; Renal cell carcinoma. I NTRODUCCIÓN En 1969 Lalli y Almgard en 1973, introdujeron el angioinfarto renal como modalidad terapéutica en casos seleccionados de carcinoma renal.1-2 La idea, era lograr la interrupción del flujo sanguíneo arterial de todo, o de un sector, del riñón enfermo. Estos autores sugirieron que la necrosis tisular resultante (dada la capacidad angiogénica que estos tumores tienen) provocaba la reducción de volumen de la masa blástica, la disminución del sangrado intraoperatorio, la consecución de un mejor plano de clivaje del órgano afectado y un menor índice de complicaciones vasculares. En los últimos años, el mejor conocimiento de la anatomía funcional vascular del riñón y el avance tecnológico, han permitido el desarrollo de la angiografía terapéutica, y con ello, la embolización arterial renal transcatéter (E.A.T.), como procedimiento endovascular mínimamente invasivo. La técnica de embolización terapéutica percutánea transcatéter consiste en la reducción intencional del flujo vascular tumoral por oclusión mecánica del territorio vascular seleccionado mediante agentes oclusivos introducidos por vía endovascular. El área que quedará isquémica es predecible convirtiéndolo así en un procedimiento selectivo y controlado.3 La experiencia mundial demuestra que la E.A.T. es un método eficaz y de mínima morbimortalidad para casos seleccionados de enfermedad neoplásica renal. Los objetivos por los cuales se realiza este procedimiento son paliativos y/o preventivos de posible complica- 32 ciones, especialmente vasculares. Sin dudas, este método requiere de un equipo de trabajo multidisciplinario (intervencionistas endovasculares y urólogos) y de un equipamiento sofisticado, lo cual hace que sólo pueda realizarse en centros de alta complejidad médica.4 OB J ET I VO S El propósito de este trabajo es mostrar la experiencia del Hospital Italiano de Buenos Aires (H.I.B.A.) en la E.A.T. en patología oncológica renal, analizar los resultados obtenidos (si se logró o no el objetivo buscado) y valorar así, sobre la base de la experiencia obtenida en los últimos 8 años, el lugar actual de esta técnica dentro del arsenal terapéutico urológico. M AT E R I A L Y M É T O D O S Entre los meses de noviembre de 1996 y abril del 2004 inclusive, se realizaron en el H.I.B.A. 29 procedimientos de embolización arterial renal transcatéter por patología oncológica renal. Los mismos fueron efectuados en 23 casos por tumores malignos y en 6 pacientes por angiomiolipomas renales. En el registro de pacientes se utilizó un modelo prospectivo mediante fichas en el momento del procedimiento, con seguimiento personal. Luego, los datos recabados fueron tabulados y ordenados para la realización de este trabajo científico. Todos los procedimientos fueron realizados por el mismo equipo quirúrgico. Se tuvieron en cuenta los siguientes datos: 1. Preembolización: edad, sexo, comorbilidades asociadas (riesgo quirúrgico) y función renal; estirpe celular (cuando se disponía del dato), tamaño y estadio tumoral; indicación médica por cual se solicitó el procedimiento. 2. Intraembolización: tipo de anestesia, y agentes oclusivos utilizados. 3. Postembolización: tipo y dosis de analgésico requerido, tiempo de internación, presencia de complicaciones y reinicio de la actividad habitual. La eficacia del método fue evaluada según si se logró, o no, el objetivo que motivó la indicación. Todos los tumores fueron diagnosticados y estadificados pre-procedimiento mediante ecografía renal, tomografía computada o resonancia magnética nuclear (según el caso particular) de abdomen y tórax, y centellografía ósea en los casos en que se sospechó un origen maligno de la masa a embolizar. Para este trabajo, los pacientes fueron divididos en 3 grupos, según la indicación del procedimiento: • Como paliativa en enfermedad maligna avanzada: carcinoma renal metastásico y/o inoperable, ya sea por factores dependientes del paciente (comorbilidades asociadas, negativa del paciente a ser intervenido quirúrgicamente, monorrenos con alto riesgo de quedar anéfricos, (ver Figura 1) o del propio blastoma (tamaño, bilateralidad). • Como preventiva de posibles complicaciones hemorrágicas en angiomiolipomas (A.M.L.) de gran tamaño. Se tomó 8 cm de diámetro máximo como valor de corte a partir del cual se indicó la embolización. (Figuras 2 y 3) 2. Embolización quirúrgica en el tratamiento combinado de carcinomas renales: El objetivo en esta indicación, tomando el concepto de que el angioinfarto disminuye el sangrado operatorio y mejora el plano de clivaje por edema peritumoral, fue el de disminuir la morbi-mortalidad del acto quirúrgico en tumores que, por su tamaño, dificultarían la técnica quirúrgica, poniendo en riesgo la vida del paciente. Se tomó como valor de corte a partir del cual indicamos la embolización 1. Embolización como único tratamiento en pacientes asintomáticos (se define como asintomáticos a los pacientes que no presentaban dolor lumbar ni hematuria macroscópica). A A C Figura 2: Embolización de angiomiolipoma como tratamiento preventivo de complicaciones vasculares. (A) T.A.C abdominal donde se observa una masa renal derecha que distorsiona su anatomía (flechas). Compresión de vena cava inferior (círculo). (B) Angiografía digital que muestra lesión hipervascularizada de polo inferior. B D E Figura 1: Embolización de tumor renal como tratamiento paliativo. Evolución diagnóstico-terapéutica de un paciente de 65 años con carcinoma renal bilateral. T.A.C. abdominal. (A) Gran masa renal izquierda con tumor mesorrenal derecho de valva posterior. (B) Post-nefrectomía radical izquierda. Angiografía digital renal derecha selectiva. (C) Presencia de dicha lesión hipervascularizada. (D) Cateterismo hiperselectivo del área tumoral. (E) Desvascularización tumoral secundaria a embolización. Rev. Arg. de Urol. · Vol. 70 (1) 2005 B A B C Figura 3: Embolización de angiomiolipoma como tratamiento preventivo de complicaciones vasculares. Angiografía digital renal derecha selectiva. (A) Fase arterial que demuestra la capacidad angiogénica del tumor, con vasos sanguíneos múltiples, tortuosos y pseudoaneurismas arteriales (flecha), (B) Cateterismo hiperselectivo del área tumoral, (C) Desvascularización tumoral con conservación de parénquima renal 33 prequirúrgica 15 cm de diámetro tumoral máximo. En estos casos, la nefrectomía fue realizada de 1 a 15 días después del procedimiento (intervalo embolización/cirugía), según el criterio del urólogo actuante. Se valoró la pérdida estimada de sangre intraoperatoria (Tabla 1), el grado subjetivo de dificultad técnica del acto quirúrgico (menor de la habitual, habitual y mayor que la habitual), y el tiempo operatorio. La cirugía fue realizada por diferentes urólogos. 3. Embolización como tratamiento único en tumores sintomáticos: Dentro de este grupo se incluyeron todas aquellas neoplasias no operadas que presentaban hematuria macroscópica o dolor lumbar que alteraba la calidad de vida del paciente (Figura 4). También fue incluido un paciente con una complicación derivada de una nefrectomía parcial que desarrolló a los 30 días postoperatorios una hematuria franca persistente que resultó ser consecuencia de un pseudoaneurisma originado en la superficie de corte del parénquima renal (Figura 5). Volumen de sangrado Leve < 200 ml Moderado 200-500 ml Importante > 500 ml Tabla 1. Pérdida estimada de sangre intraoperatoria. Técnica de Embolización La E.A.T. fue realizada en una sala de Angiografía Digital, bajo sedación conciente y control radioscópico. Los pacientes ingresaron al hospital el mismo día del procedimiento. La embolización intra-arterial transca- Figura 4: Embolización de angiomiolipoma renal en una paciente con dolor lumbar y hematuria macroscópica. Angiografía digital. (A) Distorsión del polo inferior del riñón izquierdo, (B) (C) Vasos de angiogénesis, (D) Angiografía de control que muestra la desvascularización selectiva del área que compromete el angiomiolipoma. Figura 5: Embolización de pseudoaneurisma post-nefrectomía parcial por carcinoma renal en un paciente con hematuria microscópica 30 días después de la cirugía. Angiografía digital, (A) Fuga de contraste a través de pseudoaneurisma (flecha), (B) Angioinfarto con histoacryl, (C) Angiografía de control que muestra la oclusión vascular. Hemostasia satisfactoria. 34 téter del riñón afectado fue realizada previa aortografía y arteriografía renal selectiva para determinar la anatomía y eventual compromiso vascular. Todos los procedimientos se realizaron por punción percutánea de la arteria femoral derecha y ulterior cateterismo selectivo. Para acceder a las lesiones vasculares se utilizaron catéteres de 5 Fr. de diámetro, o microcatéteres de 3 Fr. cuando fue necesario un cateterismo de arterias renales periféricas. Fueron utilizados distintos agentes embólicos, tales como esponja de gelatina absorbente (Gelfoam), micropartículas de polivinilalcohol (P.V.A.), espiras metálicas (Coils), embosferas, cianocrilato (Histoacryl) y/o alcohol absoluto (Figura 6), tomando como criterios de selección la angioarquitectura de la lesión, la factibilidad del cateterismo supraselectivo, el objetivo terapéutico, la indicación médica del procedimiento y la disponibilidad hospitalaria. Después del procedimiento los pacientes permanecieron internados en una habitación individual o compartida. Se utilizaron analgésicos narcóticos (tramadol) y antiinflamatorios no esteroides (ibuprofeno) para el control del dolor. R E S U LTA D O S 1. Embolización como único tratamiento en pacientes asintomáticos: Se trataron 6 pacientes, 4 mujeres y 2 hombres, con una edad promedio de 56 años (r: 36-76). Las indicaciones del procedimiento, y el agente embólico utilizado se muestran en la Tabla 2. En este grupo no se presentaron complicaciones intra-procedimiento. El procedimiento fue bien tolerado por todos los pacientes, quienes permanecieron internados en habitaciones individuales o compartidas durante 24 horas, con control clínico y analgésico con derivados opioides (tramadol) con una dosis promedio de 150 mg/día (r: 100-250). La paciente número 6 presentó a las 48 horas del procedimiento un cuadro de fiebre, dolor lumbar, y leucocitosis, compatible con síndrome postembolización, que cedió con tratamiento médico analgésico por vía parenteral (tramadol) siendo externada a los 2 días. El seguimiento promedio fue de 41,5 meses (r: 2-84). Todos los pacientes ingresaron en seguimiento oncológico reglado. En los controles imagenológicos no hubo modificación del tamaño tumoral, Figura 6: Agentes embolizantes más utilizados: (A) Polivinilalcohol –P.V.A.–, (B) Esponja de gelatina absorbente (Espongostan), (C) Lipiodol, (D) Histoacryl (cianocrilato), (E) Coils fibrados. N Monorreno Indicación de Embolización Émbolo 1 No Enfermedad diseminada. Alto riesgo quirúrgico. P.V.A.* 2 No Tumor renal bilateral. P.V.A. 3 Sí Localización mesorrenal. Embosferas** 4 Sí Enfermedad diseminada. Alto riesgo quirúrgico Embosferas 5 No Enfermedad diseminada. Alto riesgo quirúrgico P.V.A. + Coils*** 6 Sí A.M.L. > 8 cm Embosferas Tabla 2. Indicaciones del procedimiento y agente embólico utilizado. * P.V.A.: Polivinilalcohol. ** Embosferas: microesferas de polímero entrelazadas con colágeno. *** Coils: espiras metálicas. Rev. Arg. de Urol. · Vol. 70 (1) 2005 35 salvo en el paciente número 3 en quien se redujo la masa en un 50%. Los pacientes 1, 4 y 5 fallecieron a causa de su enfermedad de base a los 8, 9 y 12 meses del procedimiento, sin presentar complicaciones locales. La paciente con el angiomiolipoma hasta la fecha (seguimiento 38 meses) no ha presentado complicaciones por su tumor. El reintegro a las actividades habituales se produjo en un tiempo promedio de 7 días (r: 6-9). 2. Embolización prequirúrgica en el tratamiento combinado de carcinomas renales: Con este objetivo se realizaron 7 procedimientos. En el mismo período se operaron 345 tumores de riñón por vía abierta o laparoscópica; por lo tanto, la embolización prequirúrgica fue realizada sólo al 2% de los pacientes operados. La distribución por sexo fue de 4 hombres y 3 mujeres, con una edad promedio de 60 años (r: 40-71). El tamaño pre-embolización promedio de los blastomas fue de 18 cm (r: 15-22). En estudios prequirúrgicos de rutina se verificaron parámetros de función renal normal en todos los casos. Los agentes embolizantes utilizados se muestran en la Tabla 3. Durante el intervalo embolización/cirugía no se observaron complicaciones en este grupo. Con respecto a la cirugía no se presentaron complicaciones intraoperatorias. El tiempo de intervalo embolización/cirugía promedio fue de 7,5 días (r: 1-15) dependiendo del urólogo actuante. Valorando el acto quirúrgico y según la subjetividad del cirujano, el sangrado operatorio fue leve a moderado, requiriéndose en un solo caso una transfusión de sangre intraoperatoria. El tiempo operatorio promedio fue de 140 minutos (r: 112-175). El grado de dificultad técnica fue considerado como menor del habitual, salvo un caso, por los dis- 3. Embolización como tratamiento único en tumores sintomáticos: Este grupo estuvo representado por 16 pacientes, 8 (50%) mujeres y 8 (50%) hombres con una edad promedio de 46 años (r: 21-77). Se dividieron las complicaciones en 2 grupos: a) derivadas del propio tumor (15 casos, 94%) y b) como consecuencia de procedimientos previos (1 paciente, 6%). Las indicaciones, los agentes embólicos utilizados y el tipo de tumor, se expresan en la Tabla 4. No se presentaron complicaciones derivadas del procedimiento. En todos los casos se obtuvieron controles satisfactorios cumpliendo las expectativas previas. El promedio de internación fue de 36 horas (r: 21-50). El analgésico utilizado fue tramadol empleando una dosis promedio de 150 mg/día (r: 100-250). Todos los pacientes revirtieron el cuadro clínico por el Nº Sexo Etiología Agente Embolizante Sangrado Operatorio Dificultad Quirúrgica Objetivo Cumplido 1 F Adenocarcinoma P.V.A. Leve Menor de la habitual Sí 2 F Adenocarcinoma Gelfoam* Leve Menor de la habitual Sí 3 M Adenocarcinoma P.V.A. + Gelfoam Moderado Menor de la habitual Sí 4 M Adenocarcinoma P.V.A. Moderado Habitual Sí 5 F Adenocarcinoma Gelfoam Moderado Menor de la habitual Sí 6 M Adenocarcinoma P.V.A Leve Menor de la habitual Sí 7 M Adenocarcinoma Embosferas Leve Menor de la habitual Sí Tabla 3. Valoración subjetiva del acto quirúrgico post-embolización. * Gelfoam: partículas de microcolágeno hemostático. 36 tintos cirujanos a pesar de tratarse de tumores de tamaño considerable (Tabla 3). El diagnóstico histológico de todos fue adenocarcinoma renal; en seis casos (86%) los tumores resultaron ser órgano-confinados o localmente avanzados (TI, T2 o T3 con N0 o N1 y M0). El caso restante (14%) fue un paciente con metástasis pulmonares (estadio IV), que motivaron el síntoma de diagnóstico (hemoptisis). En 5 pacientes operados (71%), el reinicio a la actividad habitual se produjo en un tiempo promedio de 25 días (r: 21-29). En los 2 pacientes restantes, éste se prolongó hasta las 6 semanas. El tiempo de seguimiento promedio fue de 46 meses (r: 4-67). No se evidenciaron signos de recidiva local ni a distancia hasta la fecha de realización de este trabajo. El paciente con metástasis pulmonares falleció a los 17 meses de la cirugía por insuficiencia respiratoria y progresión de la enfermedad. cual fueron embolizados. En los casos de hematuria los pacientes fueron controlados en forma seriada con valor de hematócrito, no observándose descenso postembolización. De los 11 (69%) pacientes con carcinoma renal embolizados, 10 (62,5%) tienen registro de seguimiento oncológico reglado. No se observó progresión de la enfermedad ni recidiva del síntoma motivo de la embolización. Hasta la fecha de realización de este trabajo todos los pacientes están vivos y con buena calidad de vida. Un paciente se perdió en el seguimiento. Los 5 (31%) pacientes con angiomiolipoma no volvieron a presentar sintomatología alguna. Puede decirse que se cumplieron de esta manera, en forma absoluta y satisfactoria los objetivos por los cuales se indicó el procedimiento (Tabla 4). DISCUSIÓN En 1969, Lalli, utilizando partículas sintéticas como agente embólico en un modelo canino, es el primero en describir el concepto de embolización renal terapéutica.1 En 1973, Almgard, reporta la aplicación del infarto embólico renal a pacientes con enfermedad neoplásica metastásica; a la mitad de ellos les realizó en forma asociada nefrectomía radical describiendo como apreciación subjetiva que el procedimiento era técnicamente más sencillo y de menor tiempo.2-4 A partir de estos trabajos se comienzan a establecer las pautas de utilización de esta técnica endovascular en patología oncológica renal para casos seleccionados. El aporte de la E.A.T. al tratamiento de la patología neoplásica renal es como terapéutica paliativa en Complicación por el propio tumor N Indicación Émbolo Tipo de Tumor Síntomas post-embolización 1 Hematuria P.V.A + Alcohol Carcinoma renal Ausentes 2 Dolor P.V.A + Alcohol Carcinoma renal Ausentes 3 Hematuria P.V.A Angiomiolipoma Ausentes 4 Hematuria P.V.A Angiomiolipoma Ausentes 5 Hematuria P.V.A + Alcohol Carcinoma renal Ausentes 6 Hematuria P.V.A + Coils Carcinoma renal Ausentes 7 Hematuria P.V.A + Coils Carcinoma renal Pérdida del seguimiento 8 Hematuria Histoacryl* Carcinoma renal Ausentes 9 Dolor Embosferas Angiomiolipoma Ausentes 10 Hematuria Histoacryl Angiomiolipoma Ausentes 11 Hematuria Histoacryl Carcinoma renal Ausentes 12 Hematuria Gelfoam Carcinoma renal Ausentes 13 Hematuria Gelfoam Carcinoma renal Ausentes 14 Dolor - hematuria P.V.A Carcinoma renal Ausentes 15 Dolor P.V.A Angiomiolipoma Ausentes Complicación postquirúrgica N Indicación Émbolo Tipo de Tumor Síntomas post-embolización 16 Hematuria P.V.A Carcinoma renal Ausentes Tabla 4. Indicaciones, agentes embólicos utilizados, tipo de tumor tratado y evolución. * Histoacryl: cianocrilato. Rev. Arg. de Urol. · Vol. 70 (1) 2005 37 enfermedad maligna avanzada, o como preventiva de posibles complicaciones hemorrágicas en angiomiolipomas de gran tamaño. Son numerosos los autores que enfatizan la mayor sobrevida de pacientes con carcinoma renal metastásico tratados con E.A.T. con o sin nefrectomía consecuente. Refieren que el beneficio de esta técnica se basa en que provoca lisis tumoral, y mayor estimulación inmunológica con respuesta inmunogénica intensa.5-6-7 Más controvertida es la postura de algunos sobre la evolución de las metástasis post-embolización, pues se han llegado a relatar hasta regresión de metástasis a distancia post-E.A.T.2 A pesar de lo enunciado, no existe hasta la fecha evidencia cierta de la forma en la que la E.A.T. actúa sobre la progresión de la enfermedad y de esto puede inferirse que no existen datos convincentes sobre la mejoría de la sobrevida de estos pacientes.8 En la presente serie el número de pacientes analizados es escaso para obtener conclusiones, pero a pesar de eso no pareciera observarse prolongación de la sobrevida con respecto a pacientes no embolizados. El angiomiolipoma (A.M.L.) fue llamado como tal por Morgan en 1951.9 En el 20% de los casos forma parte de un cuadro nosológico llamado Enfermedad de Bourneville o Esclerosis Tuberosa (E.T.), descripta en 1880 y caracterizada con la tríada de retardo mental, epilepsia y A.M.L.10-11 Es un tumor benigno (hamartoma), compuesto por tejido adiposo, músculo liso y vasos sanguíneos. La principal complicación del A.M.L. es la hemorragia espontánea, cuyo riesgo de producirse depende del tamaño de la lesión.12-13 Esta última variable y la presencia de síntomas (hematuria, dolor) son los parámetros utilizados para el manejo del A.M.L.14-11-16-17 Como conducta preventiva de posibles complicaciones, Œsterling18 sugiere que el manejo intervencionista del A.M.L. sea a partir de 4 cm de diámetro máximo, nosotros, basados en autores como Mourikis9 utilizamos 8 cm como tamaño a partir del cual se debe actuar en el paciente asintomático. En esta serie todos los A.M.L. fueron hallados de forma casual (incidentalomas) y no asociados a E.T., cumpliendo los objetivos pre-embolización planteados, logrando así mejorar la calidad de vida de los pacientes. Importante es el papel que cumple la E.A.T. en el tratamiento de complicaciones propias del tumor (dolor y hematuria) que alteran la calidad de vida del paciente, en aquellos con carcinoma renal inoperable y/o con angiomiolipomas, en los cuales esta técnica de mínima invasión logra reducir los síntomas con escaso impacto sobre el estado general. Este concepto descripto por la mayoría de los autores coincide con lo hallado en esta revisión.20-21-22 38 La utilización de la E.A.T. como procedimiento prequirúrgico, se basa en la creación de un mejor plano de clivaje peritumoral por el edema peri-infarto y en el menor sangrado intraquirúrgico, facilitando la técnica quirúrgica y reduciendo así el tiempo operatorio.23-24-25-26 En este trabajo puede observarse, al menos en forma subjetiva, las ventajas de la embolización como indicación prequirúrgica. Son contradictorios los informes sobre el tiempo óptimo entre la embolización y la cirugía; Singsaas27 reporta un período embolización/cirugía óptimo de menor de 24 horas, en contraposición, Wallace28 refiere que ese período debería ser de mayor de 72 horas, para facilitar la reducción de la circulación colateral. En esta serie los mejores resultados fueron conseguidos cuando la cirugía fue realizada a 24 horas del procedimiento. Cuando se valora la técnica de E.A.T. se debe considerar el material embólico utilizado. Su elección depende del tamaño del vaso a ocluir, del diámetro del catéter a utilizar, de la indicación del procedimiento y del tiempo considerado (temporario o permanente). Los agentes que ofrecen oclusión temporaria (días o semanas), de disolución espontánea (reabsorbibles) son: la esponja de gelatina absorbente y las partículas de alcohol de polivinilo. Los coils, el cianocrilato (Histoacryl) y el etanol son materiales de oclusión permanente. El alcohol absoluto, de uso frecuente, requiere un uso cauteloso para evitar su diseminación en áreas no deseadas; para evitar este efecto se necesita experiencia del operador y utilizar catéter con balón oclusivo para evitar el reflujo.29-30-31 La E.A.T. es un procedimiento de mínima invasión, pero no es una técnica inocua.29-30 El efecto colateral no deseado más descripto es el denominado síndrome postinfarto renal, que depende de la extensión del angioinfarto y que se caracteriza por fiebre, dolor lumbar, elevación de los leucocitos (15.000 a 20.000/mm3, con desviación a la izquierda de la fórmula), náuseas, vómitos e íleo paralítico. El dolor, que es el síntoma más común, puede ser severo y requiere del uso de analgésicos narcóticos. Generalmente comienza 30 a 60 minutos después de la embolización y perdura por 24 a 48 horas. El reconocimiento de este cuadro es importante porque puede ser confundido con un cuadro infeccioso renal (especialmente con el absceso renal).32 En esta casuística sólo una paciente presentó dolor lumbar y fiebre que revirtieron con terapia analgésica-antipirética. El angioinfarto de áreas de tejidos no deseadas y el reflujo de material embólico, especialmente etanol, son complicaciones poco descriptas que no hemos observado en nuestros pacientes.11-29-32 CONCLUSIÓN La embolización renal transcatéter para patología oncológica renal es una eficaz alternativa terapéutica, de baja morbimortalidad, en pacientes seleccionados. De la presente comunicación se desprende que la E.A.T. cumple un importante papel dentro del arsenal de procedimientos con los que cuenta el urólogo para el manejo de las neoplasias renales. Sus indicaciones actuales pueden limitarse a: 1) Embolización como único tratamiento en pacientes asintomáticos, con objetivo paliativo en enfermedad maligna avanzada: carcinoma renal metastásico y/o inoperable, y preventivo de posibles complicaciones hemorrágicas en angiomiolipomas (A.M.L.) de gran tamaño. Se tomó 8 cm de diámetro máximo como valor de corte a partir del cual se indicó la embolización. 2) Embolización prequirúrgica en el tratamiento combinado de carcinomas renales, con el objetivo de disminuir la morbi-mortalidad del acto quirúrgico. Se tomó como valor de corte a partir del cual indicamos la embolización prequirúrgica 15 cm de diámetro tumoral máximo. 3) Embolización como tratamiento único en tumores sintomáticos, se incluyen todas aquellas neoplasias no operadas que presentaban hematuria macroscópica o dolor lumbar que alteraba la calidad de vida del paciente. También incluimos a un paciente con una complicación vascular derivada de una nefrectomía parcial. El control de síntomas postembolización es bueno. El rol en la citorreducción e isquemia tumoral prequirúrgica está demostrado, razón por la cual la E.A.T. está indicada en el preoperatorio de grandes masas renales. El efecto de la embolización per se en la progresión de la enfermedad neoplásica renal se desconoce. A pesar de las descripciones de resolución espontánea de metástasis de carcinoma renal postembolización, tal situación no ha podido ser comprobada en el presente trabajo. BIBLIOGRAFÍA 1 . Lalli, A.; Peterson. N. y Bookstein. J.: Rœntgen-guided infarction of kidneys and lungs. A potential therapeutic technique. Radiology, 93: 434-435, 1969. 2. Almgard, L.; Fernström, I.; Haverling, M. y Ljungqvist, A.: Treatment of renal adenocarcinoma by embolic occlusion of the renal circulation. B.J.U. Int., 45: 474-479, 1973. 3. Drooz, A.; Lewis, C.; Allen, T. y col.: Quality improvement guidelines for percutaneous transcatheter embolization. J. Vasc. Interv. Radiol., 14: 237-242, 2003. 4. Lanigan, D.; Jurriaans, E.; Hammonds, J. y col.: The current status of embolization in renal cell carcinoma survey of local and national practice. Clin. Radiol., 46: 176178, 1992. 5. Swanson D., Wallace S., Johnson D.: The role of emboli- Rev. Arg. de Urol. · Vol. 70 (1) 2005 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. zation and nephrectomy in the treatment of metastatic renal carcinoma. Urol. Clin. North. Am., 7: 719-730, 1980. Nurmi M., Satokari K., Puntala P.: Renal artery embolization in the palliative treatment of renal adenocarcinoma. Scand. J. Urol. Nephrol., 21: 93-96, 1987. Hom D., Eiley D., Lumerman J., y col.: Complete renal embolization as an alternative to nephrectomy. J. Urol., 161: 24-7, 1999. Onishi T., Oishi Y., y col.: Prognostic evaluation of transcatheter arterial embolization for unresectable renal cell carcinoma with distant metastasis. B.J.U Int., 87 (4): 312325, 2001. Morgan G., Straumfjord J., Hall E.: Angiomyolipoma of the kidney. J. Urol., 65: 525, 1951. Bourneville D.: Contribution à l’etude de l’idiotic, sclerose tubereuse des circonvolutions cerebrales. Arch. Neurol., 1: 69, 1880. Lingeman J., Donohue J., Madura M.: Angiomyolipoma: emerging concepts in management. Urology, 20 (6): 566570, 1982. Price E., Mostofi F.: Symptomatic angiomyolipoma of the kidney. Cancer, 18: 761, 1965. Steiner M., Goldman S., y col.: The natural history of renal angiomyolipoma. J. Urol., 150: 1782-1786, 1993. Soulen M., y col.: Elective embolization for prevention of hemorrhage from renal angiomyolipomas. J. Vasc. Interv. Radiol., 5: 587-591, 1994. Han Y., Kim., Roh B.: Renal angiomyolipoma: selective arterial embolization effectiveness and changes in angiomyogenic components in long-term follow-up. Radiology, 204 (1): 65-70, 1997. Smith D. C., Salama A.: Treatment of renal angiomyolipoma. N. Engl. J. Med., 339: 1400, 1998. De Luca S., Terrone C., Rosseti R.: Management of renal angiomyolipoma: a report of 53 cases. B.J.U. Int., 83: 3, 1999. Œsterling J., Fishman E., y col.: The management of renal angiomyolipoma. J. Urol., 135: 1121-4, 1986. Mourikis D., Chatziioannou A., Antoniou A.: Selective arterial embolization in the management of symptomatic renal angiomyolipomas. Eur. J. Radiol., 32 (3): 153-159, 1999. Hansmann D.: Renal tumor embolization. Radiologe, 39 (9): 783-789, 1999. Munro N., Woodhams S, Thomas P.: The role of transarterial embolization in the treatment of renal cell carcinoma. B. J. U. Int., 93 (1): 18 1, 2004. Mebust W., Weigel J., Lee K.: Renal cell carcinoma-angioinfarction. J. Urol., 131: 231-5, 1984. Kaisary A., Williams G., Riddle P.: The role of preoperative embolization in renal cell carcinoma. J. Urol., 131: 641-656, 1984. Zielinski H., Szmigielski S., Petrovich Z.: Comparison of preoperative embolization followed by radical nephrectomy with radical nephrectomy alone for renal cell carcinoma. Am. J. Clin. Oncol., 23 (1): 6-12, 2000. Bakal C., Cynamon J., y col.: Value of preoperative renal artery embolization in reducing blood transfusion requirements during nephrectomy for renal cell carcinoma. J. Vasc. Interv. Radiol., 4 (6): 727, 1993. 39 26. Fischedick A., Peters P., y col.: Preoperative renal tumor embolization. A useful procedure. Acta Radiol., 28 (3): 303-306, 1987. 27. Singsaas M., Chopp R., Méndez R. Preoperative renal embolization as adjunct to radical nephrectomy. Urology, 14: 1, 1979. 28. Wallace S., Chuang V., Swanson D., y col.: Embolization of renal carcinoma. Radiology, 138: 563-570, 1981. 29. Ward J., Velling M.: Transcatheter therapeutic emboliza- tion of genitourinary pathology. Rev. Urol., 2 (4): 236245, 2000. 30. Mc Lean G., Meranze S.: Embolization techniques in the urinary tract. Urologic Clinics of North America, 12: 4, 1985. 31. Christensen K., Dyreborg U., Andersen J.: The value of transvascular embolization in the treatment of renal carcinoma. J. Urol., 133: 191-192, 1984. 32. Chuang V., Wallace S., Swanson D.: Technique and complications of renal carcinoma infarction. Urol. Radiol., 2: 223-228, 1981. C O M E N TA R I O E D I T O R I A L cos en enfermedad maligna avanzada, como paliativo, es una indicación dudosa, ya que el beneficio que puede obtenerse de la embolización es dudoso. Si bien los autores tuvieron 1 solo caso de síndrome postinfarto renal, éste aparece hasta en el 80% de los pacientes tratados en otras series,1 junto con casos de embolización no deseada de otros órganos y hasta mortalidad relacionada con el procedimiento.2 De aquí surge la necesidad de conocer el real beneficio que se ofrece ante cada indicación. En el año 1999, en ocasión del cumpleaños Nº 70 de Lars Erik Almgard, Disa Kalman y Eberhard Varenhorst del departamento de Cirugía y Urología del Hospital Vrinnevi, Norrköping, Suecia, le dedican una revisión sistemática de 389 artículos, publicado en el Scan J. Urol. Nephrol.3 La pregunta que se formularon es: ¿Hay en la literatura médica información adecuada sobre la cual basar la decisión médica de indicar la embolización, conocer cuál es la mejor técnica, conocer la morbilidad y la eficacia del procedimiento? La revisión concluye con que hay pocos datos objetivos que soporten la eficacia de la embolización arterial prequirúrgica. En los años ’80 se planteó un estudio controlado randomizado que nunca fue reportado. La mayoría de los trabajos testifican que algunos pacientes se benefician con el angioinfarto, que el etanol sería el agente de elección y que el sangrado es la indicación más firme de este procedimiento. Podemos agregar que es aceptada la embolización selectiva de los angiomiolipomas de riesgo.4 Pero en las otras indicaciones no hay suficiente evidencia clínica como para aseverar que la embolización sea realmente un procedimiento beneficioso, por lo cual la toma de decisiones en presencia de tumores de gran volumen, presencia de trombos tumorales o tumores asintomáticos no operables deberían ser analizados como casos particulares en los cuales se evaluará el riesgobeneficio de la embolización. Los autores revisan en este trabajo cuáles fueron los resultados obtenidos con embolización arterial en pacientes portadores de patología tumoral renal, con el objetivo de determinar cuál es el rol actual de dicho procedimiento. Luego de la publicación de Almgard (1973) surgieron numerosos trabajos utilizando esta técnica, perfeccionándola, experimentando nuevos agentes para embolizar y tratando de definir su indicación precisa. El objetivo teórico de la embolización fue preoperatoria a la nefrectomía radical para facilitarla técnicamente, disminuir el sangrado y crear un edema perirrenal. Asimismo se pretendía paliar la hemorragia de los casos no operables y se teorizaba acerca del beneficio de la necrosis tumoral para la estimulación inmunológica, a la manera de una autovacuna tumoral. En el presente trabajo, de los 29 procedimientos realizados, 13 fueron indicados por hematuria en tumores avanzados no operados y en un caso de una hematuria postnefrectomía parcial, con resolución satisfactoria de la misma en todos los casos. Esto reafirma una de las indicaciones más claras de la embolización arterial, junto con la embolización arterial selectiva del angiomiolipoma de 8 cm en forma preventiva de una posible hemorragia retroperitoneal espontánea. Cuatro pacientes fueron embolizados por dolor, dos de ellos carcinomas inoperables y los otros dos angiomiolipomas, siendo de destacar que en todos ellos remitió el dolor. La indicación de embolización arterial preoperatoria de tumores mayores de 15 cm en forma rutinaria y la aseveración de que este procedimiento disminuye la morbimortalidad del acto quirúrgico puede ser más controvertida. Los autores señalan que de los 7 procedimientos realizados por distintos cirujanos seis consideraron la dificultad técnica como menor a la habitual, lo cual puede ser un dato muy subjetivo y difícilmente comparable a otro caso similar. Finalmente, la indicación de embolización de tumores asintomáti- 40 Dr. José J. Rozanec Docente Autorizado UBA BIBLIOGRAFÍA 1. Fichtner, J.; Swoboda, A.; Hutschenreiter, G. y Neurburg, J.: Percutaneus embolization of the kidney: indications and clinic results. Aktuelle Urol., 34 (7): 475-777, 2003. 2. Hammer, J.; Justich, E.; Schreyer, II. y Pettek, R.: Complications of renal tumor embolization. Cardiovasc. Intervent Radiol., 8: 31-5, 1985. Rev. Arg. de Urol. · Vol. 70 (1) 2005 3. Kalman, D. y Varenhorst, E.: The role of arterial embolization in renal cell carcinoma. Scand. J. Urol. Nephrol., 33: 162-170, 1999. 4. Soulen, M. C.; Fykus, M. H.; Shlansky-Goldberg, R. D.; Wein A. J. y Cope, J.: Elective embolization for prevention of hemorrhage from renal angiomyolipomas. JVIR 5: 587-591, 1994. 41 ARTÍCULO ORIGINAL ORIGINAL ARTICLE Evolución de diferentes estrategias de biopsia prostática en pacientes con tacto rectal no sospechoso y Antígeno Prostático Específico (APE) elevado: propuesta de un nuevo esquema “4 x 4” Evolution of the different strategies of prostatic biopsy in patients with normal rectal examination and PSA rise: new technique “4 x 4” Dres. Borghi, M.*; Becher, E.*; Montes de Oca, L.*; Momesso, A.**; González Morales, M.**; Repetti, P.** Introducción: Si bien el incremento del número de tomas en biopsias prostáticas aumenta la positividad de las mismas, el esquema más ventajoso aún no está definido. Objetivos: Revisar los distintos esquemas utilizados en nuestra institución, presentar y evaluar el esquema de 16 biopsias, denominado 4 x 4, en pacientes con Tacto Rectal no sospechoso y elevación del APE. Materiales y Métodos: Entre 1991 y 2003 se realizaron 3.021 biopsias prostáticas ecodirigidas a pacientes con sospecha de Cáncer de Próstata. Se tomaron muestras de las imágenes sospechosas, y de acuerdo con el esquema en curso, se completó con tomas randomizadas de diferentes zonas de la próstata. En los pacientes biopsiados con el esquema 4 x 4, el promedio (rango) de APE, Volumen de Próstata y Densidad de APE fue 8,6 ng/ml (2,5-37), 55,9 ml (8-140) y 0,171 (0,04-1,3), respectivamente. Se tomaron un promedio de 15,9 tomas por pacientes. Resultados: Se hallaron 421 (31,2%) CaP. El índice de positividad del sextante fue de 22,9%, el sextante lateral de 29,6%, 31,7% para el de 10 tomas, y el esquema 4 x 4 fue positivo en el 38,4%. La mayor diferencia se produjo en el subgrupo de APE entre 4 y 10 ng/ml. Conclusiones: El aumento del número de punciones (16 tomas), 4 mediales y 4 laterales por lóbulo, tiene un índice de positividad mayor al sextante y otros esquemas. P A L A B R A S C L AV E : Biopsia; Próstata; APE. Centro de Diagnóstico Urológico, Buenos Aires, Argentina * Director, Centro de Diagnóstico Urológico ** Staff, Centro de Diagnóstico Urológico. Centro de Diagnóstico Urológico. Córdoba 2424. Ciudad Autónoma de Buenos Aires (1120) TE: 4964-2424 Fax 4964-0200 [email protected] Ninguno de los autores tienen relación comercial o financiera con alguna empresa que pueda significar un conflicto de intereses con los datos revelados en este trabajo. 42 Introduction: Despite the rise of cores in prostatic biopsies increases positivity, the more useful biopsy technique has not been defined yet. Objective: Revision of different techniques at our center, to present and evaluate the 16 core’s technique, named 4x4, in patients with normal rectal examination and PSA rise. Materials and Methods: Between 1991-2003, 3021 prostatic biopsies have been performed in patients with high risk of prostate cancer. During transrrectal ecography we performed cores in regard of the schedule in course and all the images suspected of cancer. The patients that had been biopsy with the 4 x 4 technique had a PSA range, prostate volume, and PSA density of 8.6 ng/ml (2.5-37), 55.9 ml (8140) and 0.171 (0.04-1.3) respectively. A mean of 15.9 cores for patient had been performed. Results: We found 421 (31.2%) cases with prostate cancer. The positive index for the sextant was 22.9%, and for the lateral sextant was 29.6%; in the 10 cores group was 31.7%, and in the 4 x 4 technique was positive in 38.4%. The biggest differences were found in the PSA 4 to 10 ng/ml subgroup. Conclusions: The increase in the number of cores (16), 4 medial and 4 lateral per lobe, has increased the positive index compared to the sextant and other techniques. K E Y W O R D S : Biopsy; Prostate; PSA I NTRODUCCIÓN Librado a su libre evolución, el Cáncer de Próstata (CaP) es diagnosticado en estadios avanzados: 30-50% con metástasis (MTS) óseas y 15-30% con invasión ganglionar y sólo el 15-40% son hallados en estadios localizados.2 Sin embargo, en estos últimos, en la pieza quirúrgica se encuentra un 68% de invasión capsular y 18% de las vesículas seminales comprometidas,2 ambos factores de mal pronóstico. Asimismo, la sobrevida promedio en los pacientes con metástasis es de 24 a 30 meses.1,3 Debido a la limitada oportunidad de curación que ofrece el CaP por su propia historia natural, es necesario el diagnóstico de pacientes en estadios tempranos con el objetivo de lograr una mayor sobrevida a la enfermedad. Esto significa, diagnosticar pacientes con tacto rectal negativo (TRN) (T1c) y con APE lo más bajo posible. La aparición del APE en los finales de los ´80, junto con el desarrollo de transductores transrectales de alta resolución y la pistola automática de biopsia, ha provocado un gran cambio en la capacidad de diagnóstico del CaP, sobre todo en la migración hacia los estadios más tempranos36 de la enfermedad. Las biopsias directas mediante la Ecografía Transrectal de Próstata (ETP) a la imagen sospechosa fue el primer avance ultrasonográfico, siendo Lee4 quien describe por primera vez el área hipoecoica como la imagen sospechosa de CaP, correlacionando la estructura ecogénica con la histopatología de las tomas biopsias. El rendimiento de estas biopsias fue superior a las históricas realizadas con guía digital, por simple palpación del nódulo. La ETP era capaz de diagnosticar 57% de CaP en pacientes cuya primera biopsia, ciega, con guía digital, había sido negativa.5 Sin embargo, estas biopsias dependían de la ecoestructura (habitualmente relacionada con el volumen tumoral) del CaP para ser visibles. Hodge5 diseña un esquema en que espacía las muestras en base, medio y pico, bilateral (sextantes), con el objetivo de hallar CaP no visibles y mejorar la detección, adicionándolo o reemplazando a las tomas directas. Subsecuentemente, se mejora los resultados del sextante por la lateralización de las tomas, logrando mayor tejido de la Zona Periférica.10 Posteriomente Kteech,17 Dvajan7 y Levine14 biopsian pacientes de manera serial, y demuestran que el sextante omite un porcentaje importante de los CaP en la primera biopsia, sobre todo de los órgano-confinados. De aquí se desprende la necesidad de aumentar la positividad de la primera biopsia, tanto en pacientes con TRN como sospechoso. Rev. Arg. de Urol. · Vol. 70 (1) 2005 El número y la ubicación de las tomas todavía está en discusión. Varios Centros muestran distintos esquemas11,13,15 de biopsias en que aumentan el número de tomas en el mismo paciente. Estas series incluyen pacientes con TRN como con tacto rectal positivo (TRP), por lo que la comparación entre los distintos esquemas debe ser cautelosa, debido a que la proporción de ambos grupos diferirá en el resultado general. En nuestro Centro comenzamos en 1990 a realizar las primeras ecografías transrectales y biopsias ecodirigidas. Con la experiencia fuimos aprendiendo de las mismas y cambiando el esquema de biopsia, buscando un mayor índice de detección, sobre todo en pacientes con TRN para el CaP. Presentamos nuestra experiencia con los distintos esquemas de biopsia en pacientes con TRN y APE elevado. Finalmente, mostramos y evaluamos un nuevo esquema de 16 tomas por paciente. M AT E R I A L Y M É T O D O S Entre octubre de 1991 y febrero de 2003 se realizaron y tabularon 3.012 ecografías transrectales con biopsia ecodirigida (ETP) en pacientes que consultaron espontáneamente o fueron derivados a nuestro Centro por sospecha de CaP por TR y/o APE patológico. Hasta 1993 las biopsias se realizaban exclusivamente en las imágenes sospechosas. A partir de esa fecha, se comenzó a aumentar el número de tomas hasta llegar al sextante de Hodge.6 En 1996 se comenzó con los estudios de comparación de los distintos esquemas. A partir de 1996 hasta febrero de 2003, se biopsiaron 2.022 pacientes. De ellos, 1.348 tenían TRN y APE elevado. Los esquemas utilizados fueron variando como se describe más adelante, de acuerdo con el estudio que fuera realizado en ese momento, para evaluar y confeccionar el esquema de mayor ventaja diagnóstica. El Tacto Rectal fue realizado inmediatamente antes de la exploración ultrasonográfica por un urólogo certificado, con el paciente en decúbito dorsal, y clasificado en Sospechoso (TRP) o TRN, considerando sospechoso a toda irregularidad en la superficie, nodularidad o aumento de la consistencia. El APE fue procesado por el método de micropartículas MEIA (Abbott) y se tomó como válido el último realizado antes de la biopsia. El valor de corte fue de 4 ng/ml. En el grupo del esquema 4x4, 13 pacientes fueron biopsiados con APE entre 2,5 y 4 ng/ml. En 562 pacientes fue posible obtener el índice PSA Libre/Total, ambos también con el método MEIA. 43 La Densidad del APE (DAPE) es la relación entre el APE y el Volumen Prostático Total (VPT). No hay valores de referencias considerados “estándar de oro”. Los pacientes reciben un enema la noche anterior, y profilaxis antibiótica con ciprofloxacina 250 mg, 30 minutos previos al estudio. El antibiótico se continúa hasta completar 5 días de tratamiento. Exploración ecográfica y biopsia la guía electrónica. Se avanza con la aguja por la guía del transductor hasta tocar el recto. Se comprime suavemente y se dispara el gatillo de la pistola automática. Se asegura que la aguja esté incluida en la imagen que deseamos biopsiar, y se procede a retirar la muestra de tejido de la aguja. Se consideran biopsias mediales a las tomas parasagitales, equidistantes entre la línea media y el extremo prostático. Biopsias laterales son consideradas aquéllas que son tomadas en los extremos laterales de la glándula. (Figura 1) A partir de octubre de 2001 comenzamos a realizar bloqueo anestésico local (AL), con el objetivo de mejorar la tolerancia del procedimiento. En estos pacientes, se procedió infiltrando 5 ml de lidocaína al 1% alrededor de cada uno de los paquetes neurovasculares en la unión vesículo-prostático bajo visión directa de los mismos, de manera bilateral, con aguja 20 G de 25 cm diseñada ad hoc. Cuando se utilizó neuroleptoanalgesia (NLA) el procedimiento se realizó en quirófano, utilizando generalmente fentanilo y midazolam, con la colaboración de un anestesiólogo. Para el estudio ecográfico se utilizaron equipos Bruel & Kjaer, con transductor endfire multifrecuencia de 6-10 MHz o Acoustic Imaging con trasductor transrectal endfire de 6,5 MHz. El paciente es colocado en decúbito lateral izquierdo. Se toman los diámetros prostáticos y se calculan los volúmenes prostáticos totales y de la Zona Transicional mediante la fórmula del elipsoide (transverso X anteroposterior X longitudinal X 0,52). El diámetro transverso es tomado en el plano axial, mientras que los anteroposterior y longitudinal son medidos en el plano longitudinal. Se realiza la exploración semiología ecográfica, buscando la aparición de lesiones sólidas de aspecto hipoecogénico o heterogéneo. En ese caso, las muestras de las lesiones son identificadas separadamente. Las biopsias se realizaron, el plano más conveniente para el operador. Sin embargo, en general, se utilizó el axial para el lado derecho, y el longitudinal para el lado izquierdo. Se ubica la región de la ZP más conveniente en el centro del haz del ultrasonido, para luego centrarla en Sextante Las biopsias por sextantes fueron realizadas según lo sugerido por Hodge,6, en ubicación parasagital, en la base, medio y pico de ambos lóbulos (Figura 2). Todas sus tomas son consideradas mediales. Biopsia medial Biopsia lateral Esquemas de biopsias Figura 1: Biopsias mediales y laterales. Nótese que en la biopsia medial, la aguja penetra en la Zona Transicional (ZT), mientras que en la lateral, la aguja toma una muestra solamente de la Zona Periférica. 44 Figura 2: Esquema de Hodge. Los puntos negros representan la zona de la toma. Todas son mediales. Sextante lateral La tomas fueron realizadas en la base, medio y pico de ambos lóbulos, en la porción de la Zona Periférica (ZP) más cercana al límite lateral (Figura 3). Con estas tomas se intenta evitar la inclusión de la Zona Transicional en la muestra, tomando solamente la ZP (Figura 3). Figura 3: Sextante lateral. Las tomas del sextante fueron llevadas hacia los extremos de la glándula. 10 laterales Se toman 5 muestras, todas laterales, desde la base hasta el pico prostático, con una separación equidistante entre ellas (Figura 4). Equivale al sextante lateral al que se le agregan una toma entre la base y el medio lateral, y otra entre el medio lateral y el pico. Esquema 4 x 4. Se lo designó de esta manera porque toma 4 biopsias mediales y 4 laterales por lóbulo, totalizando 16 biopsias por paciente. Para la región medial, agrega una biopsia media al sextante de Hodge, totalizando 4 tomas mediales. Para las laterales, agrega a las laterales de Presti, 2 tomas intermedias. Una entre la base y la lateral medial, y la segunda entre la lateral medial y el pico (Figura 6), totalizando 4 tomas laterales, de base a pico. Se realiza siempre con bloqueo anestésico local. Este esquema es propuesto e investigado originalmente por nuestro grupo. Figura 6: Esquema 4 X 4. Los puntos negros representan las tomas mediales, mientras que los grises las tomas laterales. El sombreado de la base representa la zona del bloqueo anestésico local. Estudios comparativos de esquemas Sextante Vs. sextante lateral Entre 1/12/96 y 29/4/98 se realizaron 354 biopsias prostáticas randomizadas ecodirigidas, las cuales se dividieron en forma aleatoria en 2 grupos: A) sextantes parasagitales, según esquema de Hodge, 183 pacientes, y B) sextantes lateralizados, 171 pacientes. Los parámetros de ambos grupos son comparables (Tabla I). Grupo Figura 4: Esquema de 10 tomas laterales: al sextante lateral se le agregaron tomas intermedias. Sextante # 183 S. Lateral 171 Edad (rango) APE VPT DAPE A Hipoec 63,4 (48-79) 10,2 63,1 0,18 31,5% 62,9 (42-81) 9,35 55,1 30,2% 0,2 Presti13 Esquema de Se incluye al sextante de Hodge, tomas laterales en la base y medio prostática, tomando en total 10 muestras (Figura 5). De alguna manera, es la suma del sextante y el sextante lateral. Figura 5: Esquema de Presti. Rev. Arg. de Urol. · Vol. 70 (1) 2005 APE: Antígeno Prostático Específico. VPT: Volumen Prostático Total. DAPE: Densidad del Antígeno Prostático. A. Hipoec: Area hipoecoica. S. Lateral: Sextante lateral. Tabla I. Comparación de los parámetros de ambos grupos. Sextante lateral Vs. 10 laterales (X 10 L) Entre 06/05/98 y 22/10/2001 se realizaron 1.222 biopsias ecodirigidas, de las cuales 725 fueron en pacientes con APE mayor de 4 ng/ml y TRN para CaP. Ambos grupos son comparables en los parámetros 45 diagnósticos, tanto en número, edad, distribución del APE y Volumen Prostático (Tabla II). S. Lateral X 10 L Gral. Número 407 318 725 Edad 64,1 (38-84) 63,1(36-84) 63,8 (36-84 ) APE ng/ml(rango) 9,3 (4.1-50) 10,8 (4-89) 9,8 (4-89 ) APE 4-10 ng/ml (%) 277 (68) 208 (65.5 ) 485 APE10,1-20 ng/ml 113 (27,8) (%) 89 (27,9 ) 202 APE >20.,1 ng/ml 17 (4,2) (%) 21 (6.6 ) 38 VPT ml (rango ) 56,6 (13-244) 62,4 (19-196) 59,5 (13-244) DAPE 0,19 (0,04-1,1) 0,20 (0,02-1,2) 0,19 (0,02-1,2) S Lateral: esquema Sextante lateral. X10 L: esquema de 10 tomas laterales. APE: Antígeno Prostático Específico. VPT: Volumen Prostático Total. DAPE: Densidad de Antígeno Prostático. Tabla II . Variables de ambos grupos. Esquema 4 x 4. Entre el 22/10/01 y el 6/02/03 se realizaron 538 ecografías transrectales. En 278 pacientes con TRN y APE elevado se les realizó la biopsia según el esquema 4 x 4. A todos los pacientes se les administró la AL. En 140 pacientes fue posible obtener el índice APE Libre/ Total. El promedio (rango) de edad, APE, Volumen de Próstata (VP) y Densidad de APE (DAPE) fue de 63,3 años (42-82), 8,6 ng/ml (2,5-37), 55,9 ml (8-140) y 0,171 (0,04-1,3), respectivamente (Tabla III). Se tomaron 15,9 (12-23) tomas por paciente. Promedio Rango Edad (años) 63,3 42-82 APE (ng/ml) 8,6 2,5-37 VPT (ml) 55,9 8-140 DAPE 0,17 0,04-1,3 # tomas 15,9 12-23 APE: Antígeno Prostático Específico. VPT: Volumen Prostático Total. DAPE: Densidad de Antígeno Prostático Tabla III. Parámetros de los pacientes biopsiados con el esquema 4 x 4 46 Para 218 pacientes era la primera biopsia, en 51 la segunda y en 9 más de 2. Cada toma fue colocada en frascos distintos, individualizando la zona de la muestra. Luego de cada toma se hace una compresión con el transductor, en la zona de la entrada de la punción para disminuir la posibilidad de hematoma y/o sangrado. A los pacientes con AL, una vez finalizado el estudio, se les entrega una escala visual analógica, de 0 a 10, para evaluar el dolor. La Anatomía Patológica fue procesada de manera habitual con hematoxilina-eosina, y se completó con inmunomarcación con citoqueratina 34ß-E12. La lectura fue realizada por un solo patólogo. Las complicaciones fueron evaluadas en el consultorio a partir del décimo día posterior a la biopsia. En caso de pacientes referidos por otros urólogos, se realizó un contacto telefónico posterior al mes del procedimiento. El estudio estadístico fue realizado con el programa EPIINFO 6,04. Test de Chi cuadrado para bondad de ajuste. R E S U LTA D O S De los 2.022 pacientes biopsiados entre el 2/12/96 y 6/2/03 se hallaron 901 CaP (44,5%). De los 1.348 que tenían TRN y APE elevado, 421 (31,2%) fueron positivos para CaP. En el esquema del sextante resultaron positivos para CaP 42 entre 183 pacientes (22,9%). En el caso del sextante lateral, en la suma de ambos trabajos que se muestran adelante, se diagnosticaron 171/578 (29,6%) de CaP, y 101 sobre 318 en el esquema de 10 tomas (31,7%). Para el esquema 4x4, 107 de los 278 pacientes fueron positivos para CaP (38,4%). Sextante medial vs lateral Se diagnosticaron 97/354 CaP (27,4%), 42 en los mediales (22,9%) y 58 en los laterales (33,9%). Sin embargo, esta diferencia se mantiene solamente en los APE bajos, menores de 10 ng/ml (Tabla IV). El grupo de APE > 20,1 ng/ml es considerado como insuficiente en su número para hacer el estudio estadístico. Sextante lateral vs 10 tomas laterales Se diagnosticaron 214 CaP (29,5%), 113 con sextantes laterales (27,7%) y 101 con 10 tomas laterales (31,7%) (Tabla V), siendo el esquema de 10 tomas laterales más efectivo para el diagnóstico. Sin embargo, al analizar los resultados según el valor de APE en el momento del diagnóstico, la diferencia se hace significativa entre 4 y 10 ng/ml. A partir de los 10,1 ng/ml, nuevamente no hay diferencia estadística. APE(ng/ml) 4-10 10,1-20 >20,1 Totales Esquema % CaP/T % CaP/T % CaP/T CaP/T (%) Medial 18,8 20/110 29,3 17/58 30 5/15 42/183 (22,9) Lateral 28,1 29/103 33,3 19/57 63,3 7/11 58/171 (33,9) Totales 23 49/213 31,3 36/115 46,1 12/26 97/354 (27,4) p 0,01 0,5 0,05 APE: Antígeno Prostático Específico. CaP: Cáncer de Próstata. T: Total. p: prueba de chi cuadrado. Tabla IV. Porcentaje de positividad para CaP en cada esquema, según los valores de APE APE (ng/ml) 4-10 10,1-20 > 20,1 CaP/Total(%) CaP/T %(IC) CaP/T %(IC) CaP/T %(IC) X6L 69/277 24,9 (20-30) 34/113 30,1 10/17 58,8 (33-81) 113/407 (27,7) X 10 L 63/208 30,3 (24-37) 26/89 29,2 12/21 57,1 (34-78) 101/318 (31,7) Totales 132/485 27,2% 60/202 29,7% 22/38 57,9 (33-81) 214/725 (29,5) p 0,1 0,98 0.82 APE: Antígeno Prostático Específico. X 6 L: sextante lateral. X 10 L: diez tomas laterales. CaP: Cáncer de Próstata. IC: Intervalo de Confianza. p: prueba de chi cuadrado de diferencia estadística. Tabla V. Positividad para CaP, de acuerdo con el valor de APE Esquema 4 x 4 Se diagnosticaron 107/278 CaP (38,4 %), hallándose escasas diferencias entre los grupos con APE superior o inferior a 10 ng/ml (Tabla VI). En el grupo de APE entre 2,5 y 4 ng/ml, el índice de positividad fue del 25%. Al seleccionar solamente los pacientes con TRN, cuando se los divide por APE, la gran mayoría se en- cuentra en el grupo con APE entre 4,1 y 20 ng/ml, siendo escasos en los subgrupos entre 2.5 y 4 (12) y mayor de 20,1 ng/ml. Las biopsias mediales diagnosticaron 76 (71%) CaP y las laterales 92 (85,9%), y fueron positivas en ambas zonas en 61 pacientes (57%). En 15 (14%) pacientes la biopsia fue positiva exclusivamente en las me- APE CaP/total % VPT(rango) DAPE(rango) PSAL/T 2,5-4 3/12 25 33 (21-71) 0,08 (0,04-0,14) n/e 4,1-10 76/197 38,5 54 (8-140) 0,14 (0,05-0,55) 0,15 (0,04-0,41) 10,1-20 24/58 41,3 62 (31-121) 0,23 (0,09-0,27) 0,13 (0.07-0,24) >20,1 4/10 40 76 (21-136) 0,52 (0,18-1,3) 0,09 (0.07-0,11) Total 107/278 38,4 55,9 (8-140) 0,17 (0,04-1,3) 0,14 (0,04-0,41) APE: Antígeno Prostático Específico. CaP: Cáncer de Próstata. VPT: Volumen Prostático Total. DAPE: Densidad de Antígeno Prostático. n/e: no evaluable, por escaso número. Tabla VI. Resultados con esquema 4 x 4. Rev. Arg. de Urol. · Vol. 70 (1) 2005 47 diales, mientras que en 31 (28,9%) lo fue sólo en las laterales (Tabla VII). De esta manera, las biopsias por sextantes (mediales) hubiesen perdido casi el 30% de los CaP, mientras que las laterales sólo el 14%. La diferencia estadística del esquema 4 x 4 con respecto a las mediales o laterales considerados individualmente es altamente significativa (p=0,00001). Positividad/Total CaP % Exclusiva % IC 8-22 Mediales 76/107 71 15 14 Laterales 92/107 85,9 31 29 20,6-38,5 Coinciden 61/107 61 57 47,8-66,5 CaP: Cáncer de Próstata. IC: Intervalo de Confianza Tabla VII. Grupo 4 x 4. Análisis de los CaP, según la ubicación de las muestras Al separarlas por el valor de APE, no se halló diferencias entre ambos grupos (Tabla VIII ). APE < 10 % >10,1 % Mediales 12/80 15 3/27 11,1 Laterales 25/80 30,25 6/27 22,2 Coinciden 43/80 54,7 18/27 66,7 Tabla VIII. Grupo 4 x 4. Análisis por ubicación y APE. El esquema 4 x 4 permite, por intermedio de la simulación, compararlo con otros esquemas de biopsia. Con excepción del octante, los esquemas alternativos con biopsias numerosas, alcanzan un porcentaje de positividad alto, independiente del valor del APE (Tablas IX, X). CaP(%) APE (ng/ml) <10 >10,1 Esquema ROC total % CaP/Total Octante8 56 (70) 20 (74,1) 76 (71) 27,3 0,85 Sext lat10 71 (88,7) 23 (85,1) 94 (87,8) 35,6 0,93 Presti12 73 (91,2) 22 (81,5) 95 (88,8) 35,9 0,93 4x4 80 (100) 27 (100) 107 (100) 38,4 0,99 APE: Antígeno Prostático Específico. Sext Lat (10): Sextante lateral. El paréntesis representa la cantidad de tomas biópsicas según el esquema. CaP: Cáncer de Próstata. ROC: Área debajo de la curva. Tabla IX. Distribución de los CaP según el valor de APE y los diferentes esquemas. APE (ng/ml) <10 > 10.1 Gral # perdidos % # perdidos % Total % Octante 24 30 6 22,2 30 28 X 10 lat 9 11,2 4 14,8 13 12,1 Presti 7 8.7 5 18,5 12 11,2 Total de CaP 80 Esquema APE: Antígeno Prostático Específico. Lat: lateral. Gral.: General Tabla X. CaP perdidos según el esquema alternativo, divididos por APE. 48 27 107 Los valores de PSAL/Total, tanto para las biopsias positivas como las negativas, han sido prácticamente idénticos para cada uno de los esquemas (Tabla XI). PSAL/T promedio Esquema CaP Benigno Sextante 0,11 0,15 Sextante lateral 0,11 0,15 X 10L 0,13 0,16 Presti 0,09 0,14 4x4 0,10 0,15 PSAL/T: índice PSA libre/total Tabla XI. Índice PSA libre/total, según el resultado de la patología y su relación con los esquemas. A los pacientes que se les realizó el esquema 4 x 4, se les hizo un bloqueo anestésico local, y se les dio una escala analógica de dolor, entre 0 y 10. El valor promedio de dolor obtenido fue de 1,7 (0-7), no hallándose diferencias en el puntaje con la edad del paciente. Las complicaciones Se evaluaron 198/278 (71,2%) pacientes del esquema 4 x 4. La evaluación fue realizada a los 22,5 días de promedio (10-95). Veintisiete (14,1%) pacientes refieren ninguna complicación. La complicación más frecuente ha sido la hematuria (59%), siguiendo la hemospermia (46,8%) La hematuria estuvo presente en 116 pacientes, con una duración promedio de 7,4 días (1-30). Un paciente refiere hematuria con coágulos, pero no bloqueo; 18 (9,1%) pacientes refieren proctorragia. La duración varió de 1 a 10 días, 1,3 de promedio. La hemospermia fue referida por 93 (46,9%) pacientes. La fiebre estuvo presente en 6 (3%) pacientes. Un paciente desarrolló una Infección Urinaria; 27 (14,1%) pacientes padecieron dolor perineal. El aumento de la frecuencia miccional fue referido por 39 (19,6%) pacientes. Ningún paciente requirió internación por sangrado o sepsis. Un dato interesante ha sido que, en la evaluación al mes de la biopsia, la percepción del dolor se incrementó en 2,75 puntos (promedio). Rev. Arg. de Urol. · Vol. 70 (1) 2005 DISCUSIÓN Varios autores muestran la necesidad de aumentar el número de tomas de biopsias por pacientes.3,5,9,10 Sin embargo, aún resta definir el esquema más ventajoso y sobre todo, individualizar cada esquema según el TR y APE del paciente. La generalización del uso bloqueo anestésico local ha permitido el aumento del número de punciones, con el consiguiente incremento de la positividad para CaP en una sola sesión, eliminando un número importante de falsos negativos del sextante. Sin embargo, consideramos que el incremento de tomas debe realizarse en los sitios de mayor positividad. Por este motivo en nuestro esquema hemos aumentado la cantidad en los puntos laterales y mediales. El sextante El sextante ha mostrado que omite un número significativo de cánceres. Los trabajos de Kteech,17 Djavan,7 Levine14 y Roehl29 son los mejor diseñados para este propósito. También lo demuestran los trabajos que analizan las re-biopsias.18,19 Los dos primeros biopsiaron un grupo secuencial de pacientes con TR y/o APE patológicos. En aquellos cuya biopsia fue negativa para CaP fueron biopsiados sucesivamente a las 6-8 semanas, hasta llegar a la cuarta biopsia. El estudio de Dvajan es parte del screening multicéntrico Europeo, y los pacientes con CaP fueron sometidos a Prostatectomía Radical. La positividad de las biopsias fueron de 22, 10, 5 y 4%, de la primera a la cuarta sesión (Tabla XII). Es interesante notar que el APE promedio y el puntaje de Gleason promedio no variaron entre los cuatro grupos, pero sí el volumen tumoral. En los pacientes diagnosticados en las 2 primeras biopsias, los volúmenes fueron de 4,2 y 4,9 ml., vs 0,8 ml en aquellos pacientes diagnosticados en las subsiguientes. Los autores concluyen que los CaP diagnosticados en las 2 primeras sesiones son clínicamente importantes, mientras que, debido al bajo volumen tumoral hallado en las biopsias subsiguientes, se corre el peligro de diagnosticar CaP clínicamente no significativos. En el caso del trabajo de Kteech,17 las positividades fueron de 29 y 17%, 46% en total (Tabla XII ). Las diferencias de porcentajes entre ambos se podrían explicar por diferencias en la población (gran proporción de pacientes negros), o bien por el porcentaje de TRP. El promedio de positividad en la suma de las primeras 2 biopsias entre los 4 trabajos (Tabla XII ) es de 35,7 %, por lo que se puede inducir que ése sería un buen índi- 49 ce de positividad para un esquema de una primera sesión de biopsia prostática. APE 1ra 2da 3ra 4ta total Kteech 4-10 29 17 7 7 60 Dvajan 4-10 22 10 5 4 41 Levine 4-10 17 8 29 11 8 6 54 24,25 11,5 8 6 54 Suma: 35,75 Roehl 4,6 ± 1,8 Promedio APE: Antígeno Prostático Específico Tabla XII. Biopsias Seriales Biopsias laterales Varios reportes revelan que las biopsias laterales tienen mayor sensibilidad para el diagnóstico de CaP que las mediales o parasagitales. Chang10 en un estudio sobre 273 pacientes, con TRP o negativo, obtuvo un 44% de positividad para CaP, aunque en su estudio realizaba en el mismo paciente tanto el esquema del sextante como las tomas laterales, con un promedio de 12,6 (10-20) tacos por paciente. Concluye que el agregado de las tomas laterales ayudó en diagnosticar un 20% de CaP no ubicables por el sextante, datos similares a los de Eskew.9 Chen M.16 en un estudio basado en 180 piezas de prostatectomía radical, realizó una simulación computarizada de los esquemas de biopsias, y concluye que es importante tanto el número de biopsias como la ubicación de las mismas, dando prioridad a las tomas laterales. Brossner11 tomó 12 muestras en cada paciente, un esquema sextante con la técnica de Hodge y otro con la técnica de Chen. Concluye que la sensibilidad de las laterales es mayor (96,2 vs 88,8%) a las parasagitales, sobre todo en pacientes con APE < de 10 ng/ml. Los 280 pacientes estudiados tenían tanto TRP como negativo. McNeal y Stamey12 reportan que los CaP menores a 1,2 cc están mayoritariamente localizados en el aspecto lateral de la Zona Periférica, revelando la importancia de lateralizar el muestreo para poder diagnosticar los CaP de volumen bajo. Estos trabajos coinciden con el nuestro, en que cuanto menor sea el APE, mayor importancia tienen las biopsias laterales, ya que la diferencia es mayor en el 50 grupo de APE entre 4 y 10 ng/ml. Si bien en los pacientes con APE alto hay diferencia a favor de las muestras laterales, esta tendencia está influida por el bajo número de pacientes de ese grupo (Tabla VIII). Si bien las muestras laterales tienen mayor positividad, creemos que no es conveniente perder las tomas mediales. Un esquema debe incluir ambas. Sí es verdad que la prioridad debe ser de las laterales, de tal manera que el sextante debe ser abandonado, sobre todo en pacientes con APE bajo. Pero el esquema mínimo, independientemente del valor del APE, debe ser el de Chang y Presti, con 10 tomas. Esquemas Babaian13 propone como alternativa al sextante un esquema de 11 sitios, que incluyen los laterales (1 toma), las Zonas de Transición (ZT) (1 toma) y la línea media (sextante + 2 laterales + 2 de la ZT + 1 de la línea media, total: 11 punciones). En pacientes con TRN encuentra un 23% de positividad (vs. 13% del sextante), y en los pacientes con APE entre 4 y 10, independientemente del TR, 30% (vs. 19% del sextante), concluyendo que el esquema es superior al sextante. Esquew9 propone un esquema que denomina de 5 regiones, en el cual al sextante agrega 3 tomas de la línea media y 2 tomas laterales por lado (13 en total). En los pacientes con TRN y PSA entre 4 y 10 ng/ml halló un 28% de CaP. En ambos casos, agregan al sextante, 1 toma lateral por lóbulo, la línea media, y en el caso de Babaian, la ZT. En nuestra experiencia, la línea media en pacientes con TRN, poco agrega al índice de positividad. Eskew presenta sólo 2 CaP en 119 pacientes. Terris25 muestra que es una zona abandonada en la sistematización. En cuanto a la ZT, es válida biopsiarla sólo en segundas oportunidades (20-24, 28). Por lo tanto, las biopsias que realmente agregan positividad en ambos estudios, son las laterales. En nuestro esquema, al sextante se le agregan 4 tomas laterales y se incorpora una toma medial. Esto último tiene por objetivo que la distancia entre todas las tomas del sextante, sea menor de 10 mm. Chang y Presti,10,15 proponen un esquema de 10 tomas, en el que agregan 2 tomas laterales por lóbulo (12,6 de promedio, rango entre 10 y 20), hallando 36% de positividad. Posteriormente sugieren eliminar la biopsia de la base, logrando un valor similar de predicción positiva. Creemos que el muestreo de la Zona Periférica, en su primer intento, debe ser amplio, pero siguiendo un esquema racional y seguro. Mazzal24 muestra que la ubicación de los CaP de la segunda biopsia son más apicales, dorsales, multifocales y de menor volumen que los diagnosticados en la primer biopsia. Sin embargo Dvajan7 encuentra el volumen tumoral similar en la primera y segunda biopsia, que disminuye en las terceras y cuartas sesiones. Nuestro esquema toma 2 muestras por lado del pico (el pico y el lateral inferior), y la zona dorsal es tomada por las tomas laterales al penetrar enteramente en la ZP. En el caso que el asta anterior (definida como aquella ZP lateral, superior a los 17 mm de penetración de la aguja) sea importante y necesite ser biopsiado, la anestesia local permite penetrar la aguja unos milímetros para abarcar toda la ZP. Nuestro esquema, a diferencia de los otros, divide la próstata en octantes en vez de sextantes, con el objetivo de lograr una menor distancia entre las distintas biopsias. Este diseño ha pretendido lograr un muestreo muy amplio de la ZP, pero en sus lugares de mayor índice de positividad. Esto es, de la zona parasagital o medial y de los laterales. Las 4 tomas de cada una de éstas logra un muestreo confiable. Por eso hemos dividido a la toma medial del sextante en 2. En ocasiones, la biopsia deja una marca, probablemente de aire, visible al ultrasonido, del sector donde fue obtenida la toma. Una ventaja que consideramos importante en nuestro esquema de 4 x 4 es que, cuando hemos podido tomar la distancia entre los distintos sitios de las tomas, siempre han sido menores de 10 mm, tanto en el plano longitudinal (por eso se agrega una toma medial al sextante), como en el plano transverso. Esto asegura que el muestreo de la Zona Periférica sea lo suficientemente amplio. De esta manera, y como especulación teórica, el tumor que pudiera perderse en el diagnóstico tendría un volumen menor de 1ml, con excepción de aquellos ubicados en una zona más anterior a los 17 mm (cuerno anterior), o en la zona de transición. Este no es un tema menor, sobre todo en aquellos pacientes que ya tienen una biopsia negativa y el APE persistentemente elevado, con alta sospecha clínica de CaP. 19 De haber practicado sólo biopsias mediales se hubiesen perdido el 28% (30/107) de los CaP, mientras que con el esquema x10 y el de Presti hubiéramos perdido 12,1% y 11,2%, respectivamente (Tabla X) de los CaP. Por este motivo, el esquema mínimo a realizar es el de Presti, ya que es el que menos CaP pierde. Mian27 re-biopsia 89 de los 939 pacientes biopsiados previamente con el esquema de Presti de 10 tomas, hallando sólo 15 (17%) CaP. La mitad de éstos estaban ubicados en las zonas alternativas, el 33% en el sextante y el resto en ambas, concluyendo que el esquema de 10 tomas pierde pocos CaP.27 El área debajo de la curva (ROC) muestra que el es- Rev. Arg. de Urol. · Vol. 70 (1) 2005 quema 4 x 4 es el que mayor sensibilidad y especificidad para el diagnóstico del CaP (Tabla IX), comparándolo con otros esquemas alternativos. En el análisis de las tablas se desprende que, al comparar el sextante con los esquemas alternativos, en los pacientes con APE entre 4 y 10 ng/ml es donde el aumento del número de biopsias produce el mayor incremento en la positividad para el CaP, no así en el grupo de APE entre 10,1 y 20 ng/ml. Sin embargo, el esquema 4 x 4 es superior en ambos grupos (Figura 7). Figura 7. Porcentaje de Positividad para CaP de los distintos esquemas de este trabajo, de acuerdo con el valor del Antígeno Prostático Específico. La comparación de nuestro esquema con otros descriptos en la literatura muestran que, en los pacientes con APE entre 4 y 10 ng/ml., el índice de positividad es mayor con 16 tomas (Tabla XIII), con excepción del descripto por Chang-Presti. Autor Aus 32 # tacos % CaP >5 14,2 9 13 28,1 Chang-Presti 10 12 36 Levine 14 12 28,5 11 30,1 16 38,5 Eskew Babaian Borghi 11 % CaP: porcentaje de Cáncer de Próstata. Tabla XIII. Comparación del esquema propuesto con otros esquemas alternativos al sextante, en pacientes con APE entre 4 y 10. 51 Un avance significativo ha sido el uso de la anestesia local, permitiendo el incremento del número de tomas, con una confortabilidad mayor al sextante sin anestesia, y sin aumentar la morbilidad.31 Sin embargo, distintos autores ponen en duda que el aumento de biopsias disminuya la necesidad de segundas biopsias.25,26 Otro aspecto negativo de los esquemas con aumento del número de tomas, es que inicialmente incrementa el costo por estudio, ya que requiere anestesia local y la mayor cantidad de muestras a analizar eleva el costo de la anatomía patológica.25 Es nuestra opinión, en el futuro se deberá personalizar el esquema de biopsia. Son casos diametralmente opuestos un paciente con TRN, APE de 6 ng/ml, y un VPT de 70 ml, a un paciente con TRP y APE de 20 ng/ml. En ambos casos, los esquemas a utilizar no deberían ser los mismos. Deberá ser tenido en cuenta el Tacto Rectal, el valor de APE tanto el total como el Indice Libre/Total, el VPT, la edad y si ha sido biopsiado previamente. Estos datos condicionarán el número y la ubicación de las tomas a realizar. Nuestro esquema apunta a obtener un muestreo amplio para, en un futuro, poder obtener los distintos subgrupos de pacientes y el mejor esquema para ellos, de acuerdo con los datos referidos anteriormente. Complicaciones Las complicaciones son concordantes con la literatura internacional,31 en que el aumento del número de tomas puede aumentar levemente las complicaciones menores, pero no las mayores, definiendo las menores a aquellas que tienen curación espontánea, y mayores las que requieren la intervención de un médico. Hay pocos trabajos especialmente diseñados para evaluar las complicaciones de las biopsias ecodirigidas,30-35 y el método evaluatorio varía entre uno y otro. La hematuria varía desde el 13% reportado por Aus, 32 con un promedio de 2,6 tomas por paciente, a 60-70% en los estudios con 6-12 tomas.30 La proctorragia varía, considerando un máximo de 30% de leves a un 8% de moderado/severo. La hemospermia aparece entre el 9% al 89 %, en este último caso en los pacientes con 12 tomas. Obek31 muestra que el uso del bloqueo anestésico local produce un leve aumento de las complicaciones menores, pero no de las mayores. Los cuadros infecciosos varían en su evaluación, ya que los reportan como infecciones urinarias, fiebre o sepsis. El antibiótico utilizado suele ser quinolonas o fluoroquinolonas, pero varía en los días de tratamiento. 52 Los cuadros menores como fiebre o infecciones urinarias suelen variar entre 1,7%35 a 10%,31 mientras que la sepsis entre 0,1%7 a 4%.31 La tolerancia y aceptación del paciente en los primeros trabajos era alta, entre 92%32 y 78%, con 22% de dolor importante.33 Naughton C muestra primero que no hay diferencia en la morbilidad y tolerancia entre 6 y 12 tacos por paciente,30 y posteriormente que la biopsia no alteró la calidad de vida posterior,34 sin diferencias estadísticas entre 6 y 12 tomas, aunque el grupo con mayores tomas tiene un porcentaje mayor de complicaciones leves. Nuestras complicaciones, para un esquema en el que se toman 16 biopsias, tienen un índice aceptable. La hematuria (59 vs 13-70%), la hemospermia (46,9 vs 9-89%), la proctorragia (9,1 vs 8-30%) o la fiebre (3 vs 1,7-10%) alcanzan cifras comparables a los datos ya descriptos en la literatura. CONCLUSIONES De acuerdo con los datos de nuestra propia base de datos, y en concordancia con los datos internacionales, creemos que, en pacientes con TRN, 1. Con APE entre 4 y 10 ng/ml, el sextante lateral es superior al sextante de Hodge. 2. Con APE entre 4 y 10 ng/ml, el esquema de 10 tomas laterales es superior al sextante lateral. 3. Con APE superior a 10 ng/ml, el esquema mínimo a realizar es el de Presti. 4. La anestesia local brinda un significativo confort al paciente, permitiendo biopsiar las zonas necesarias para el diagnóstico, sin aumentar las complicaciones. 5. A menor APE, mayor debe ser el número de biopsias. 6. El índice APE libre/total no es útil para definir el número de tomas a realizar. 7. El esquema 4 x 4 ha mostrado superioridad con respecto a otros esquemas de biopsias, sobre todo en los pacientes más difíciles, con TRN y APE ligeramente elevado, con un buen índice de tolerabilidad. BIBLIOGRAFÍA 1. Schmidt JD, Mettlin CJ, Natarajan N y col.: Trends in patterns of care for prostatic cancer, 1974-1983: Results of surveys by the American College of Surgerons. J Urol 1986; 136: 416-421. 2. Rosen M, Lapin S, Goldstone L y col.: The frecuency of extracapsular extension and positive surgical margin in radical prostatectomy specimens. J Urol 1990; 143: 315. 3. Murphy GP, Beckley S, Brady MF, y col.: Treatment of newly diagnosed metastatic prostate cancer patients with chemotherapy agents en combination with hormones versus hormones alone. Cancer 1983; 51: 1264-1272. 4. Lee F, Littrupp PJ, Mc Leary RD y col.: Transrectal Ultrasound in the diagnosis of Prostate Cancer: location, echogenicity, histophathology and staging. Prostate 1985; 7: 117-129. 5. Hodge KK, McNeal JE, Stamey TA. Ultrasound guided transrectal core biopsies of the palpably abnormal prostate. J Urol 1989; 142: 66-70. 6. Hodge KK, McNeal JE, Terris MK y col.: Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989; 142: 71-75. 7. Dvajan B, Ravery V, Zlotta A. y col.: Prospective evaluation of prostate cancer detected on biopsies 1, 2, 3 and 4: when should we stop? J Urol 2001; 166: 1679-1683. 8. Uzzo RG, Wei JT, Waldbaum RS y col.: The influence of prostate size on cancer detection. Urology 1995; 46: 831-836. 9. Eskew LA, Bare RL y McCullough DL.: Systematic 5 region prostate biopsy is superior to sextant method for diagnosing carcinoma of the prostate. J Urol 1997; 157: 199-203. 10. Chang J, Shinohara K, Bhargava V, Presti J.: Prospective evaluation of lateral biopsies of the peripheral zone for prostate cancer detection. J Urol 1998; 160: 2111-2114. 11. Brossner C, Madersbacher S, Bayer G, Pycha A, Klinger C y Maier U.: Comparative Study of two different TRUS-guided sextant techniques in detecting prostate cancer in one biopsy session. Eur Urol 2000; 37: 65-71. 12. Stamey TA.: Making the most out of six systematic sextant biopsies. Urology 1995; 45: 2-8. 13. Babaian JR, Toi A, Kamoi K, Troncoso P, Sweet J, Evans R, Johnson D y Chen M: A comparative analysis of sextante and an extended 11 core multisite directed biopsy strategy. J Urol 2000; 163: 152-159. 14. Levine M, Ittman M, Melamed J y Lepor H: Two consecutive sets of transrectal ultasound guided sextant biopsies of the prostate for the detection of prostate cancer. J Urol 1998; 159: 471-476. 15. Presti Jr JC, Chang JJ, Bhargava V, Shinohara K, Moul J.: The optimal systematic prostate biopsy scheme should include 8 rather than 6 biopsies: result of a prospective clinical trial. J Urol 2000; 163: 163-169. 16. Chen M,Troncoso P, Kuang T, y col.: Comparison of prostate biopsy schemes by computer simulation. Urology 1999; 53: 951-960. 17. Kteech DW, Catalona W. y Smith DS: Serial prostatic biopsies in men with persistently elevated serum prostate specific antigen levels. J Urol 1994; 151: 1571-1576. 18. Borboroglu P, Comer S, Riffenburgh R y Amling C.: Extensive repeat transrectal ultrasound guided prostate biopsy in patients with previous bening sextant biopsies. J Urol 2000; 163: 158-163. 19. Rieterbergen J, Boeken A, Hoedemaeker R y col.: Repeat screening for prostate cancer after 1 year followup in 984 biopsied men: clinical and pathological features of detected cancer. J Urol 1998; 160: 2121-2126. 20. Lui PD, Terris MK, McNeal JE, Stamey TA.: Indications for ultrasound guided transitional zone biopsies in the detection of prostate cancer. J Urol 1995; 153: 10001004. Rev. Arg. de Urol. · Vol. 70 (1) 2005 21. Kojima Y, Nonomura N, Nose T y col.: Transition zone biopsy in the detection of prostate cancer. Eur Urol 2000; 37: 675-680. 22. Noguchi M, Stamey T, McNeal J y Yemoto C.: An analysis of 148 consecutive transitional zone cancers: clinical and histologycal characteristics. J Urol 2000; 163: 17511755. 23. Peyromaure M, Ravery V, boccon-Gibod.: Biopsies de la zone de transition: impact sur la détection de cancer prostatic et valeur pronostic. Progrès en Urol: 2002; 12: 812. 24. Mazzal PR, Haiten A, Windischberger C, Dvajan B y col.: Spatial distribution of Prostate Cancers undetected on initial needle biopsies. Eur Urol 2001; 39 (6): 662-667. 25. Terris MK: Extended field prostate biopsies: too much of a good thing? Urology 2000; 55: 457-460. 26. Babaian RJ.: Extended field prostate biopsy enhances cancer detection. Urology 2000; 55: 453-456. 27. Mian B, Naya Y, Troncoso P, Vakar F y col.: Predictors of Cancer in repeat extended multi-site Prostate biopsy in men with previous negative extended multi-site biopsy. AUA Meeting 2002, abst 401. 28. Sur R, Borboroglu P, Roberts J, Amling C.: A randomized prospective comparison of extensive transrectal prostate biopsy to standard sextant biopsy for the diagnosis of prostate cancer. AUA Meeting 2002, abst 1317. 29. Roehl K, Antenor J, Catalona W.: Serial biopsy results in prostate cancer screening study. J Urol 2002; 16, 24352439. 30. Naughton C, Ornstein D, Smith D y Catalona W.: Pain and morbility of transrectal ultrasound guided prostate biopsy: a prospective randomized trial of 6 versus 12 cores. J Urol 2000; 163, 168-171. 31. Obek C, Onak B, Ozkan B, y col.: Is periprostaticc local anesthesia for transrectal ultrasound guided prostate biopsy associated with increased infectious or hemorrhagic complications? A prospective randomized trial. J Urol 2002; 168, 558-561. 32. Aus G, Hermansson C, Hugosson J, Pedersen K.: Transrectal ultrasound examination of the prostate: complication and acceptance by patients. Br J Urol 1993; 71, 547459. 33. Collins G, Lloydd S, Herir M y McKelvie G.: Multiple transrectal ultrasound-guided prostatic biopsies- True morbility and patient acceptance. Br J Urol 1993; 71, 460463. 34. Naughton C, Miller D y Yan Y.: Impact of transrectal ultrasound guided prostate biopsy on Quality of Life: a prospective randomized trial comparing 6 versus 12 cores. J Urol 2001; 163, 100-103. 35. Rodríguez L, Terris M.: Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol 1998; 163, 2115-2120. 36. Hankey BF, Feuer EJ, Clegg LX, Hayes RB y col.: Cancer surveillance series: interpreting trends in prostate cancer- part I: Evidence of the effect of screening in recent prostate cancer incidence, mortality and survival rates. J Natl Cancer Inst, 91: 1017, 1999. 53 TÉCNICA QUIRÚRGICA SURGICAL TECHNIQUE Orquidopexia laparoscópica. Técnica de elección para el testículo intraabdominal Laparoscopic orchidopexy. The gold standard for intraabdominal testicle Dr. Juan Moldes ✃ Servicio Cirugía y Urología Infantil Hospital Italiano de Buenos Aires, Argentina. 54 Resumen: La valoración de los pacientes con testículo no palpable a través de métodos por imágenes, ha demostrado un alto índice de falsos positivos. Ante la ausencia de gónada en escroto, la conducta debe ser la exploración abdominal a través de una laparoscopia, que ha demostrado ser un mejor método diagnóstico y en caso de hallar la gónada intrabdominal, el método terapéutico de elección. La conducta inicial ante una gónada en abdomen, debe ser valorar si la longitud de los vasos espermáticos es suficiente como para que la misma alcance el escroto con una adecuada disección de los mismos. Si esto es así, se realiza el descenso en un tiempo, como se describe a continuación. Si los vasos son cortos, realizamos un descenso en dos tiempos. 1) Clipado inicial de los vasos espermáticos en la primera cirugía. 2) Reoperación a los 6 meses, con sección de los vasos espermáticos y descenso con técnica similar a la descripta. Figura 1. Se coloca trocar de 5 mm en cicatriz umbilical y 2 trocares de 3 mm en ambas fosas ilíacas. Como alternativa, se puede utilizar uno de los trocares de 3 mm en posición suprapúbica. Figura 2. Anatomía normal: a) Vasos ilíacos, b) Orificio Inguinal Profundo (OIP), c) Conducto deferente y sus vasos, d)Vasos espermáticos Figura 3. Se debe seccionar el peritoneo parietal a 1 cm de cada lado de los elementos nobles. Los vasos espermáticos deben ser disecados hacia proximal y el conducto deferente hacia distal. El peritoneo que rodea al OIP debe ser también seccionado. Rev. Arg. de Urol. · Vol. 70 (1) 2005 55 Figura 4. Una vez completada la sección, se moviliza todo el medallón de peritoneo con los elementos. ✃ Figura 5. Se incide el escroto y se introduce una pinza de Bertola a través del conducto inguinal hasta ingresar a la cavidad por el OIP. Se introduce el testículo en el escroto a través del conducto, traccionando de la pinza Bertola, para luego fijarlo con 4 puntos al Dartos. 56 COMUNICACIÓN DE CASOS CASE REPORT Schwannoma retroperitoneal. Reporte de un caso y revisión de la literatura Retroperitoneal Schwannoma. Case report and review of the literature Dres. Jurado, A.; I NTRODUCCIÓN Piana, M.; El Schwannoma es un tumor neurogénico originado a partir de células de Schwann (responsables de la producción de mielina en el nervio periférico). Su infrecuente localización retroperitoneal fue comunicada por Deming C. y Newman H. en el año 1954.1 Habitualmente su forma de presentación clínica inespecífica, y la ausencia de un patrón imagenológico característico, dificultan su diagnóstico preoperatorio. Se reporta el caso clínico de una paciente con Schwannoma retroperitoneal, extirpado por vía laparoscópica, con diagnóstico preoperatorio de tumor suprarrenal derecho. Se realiza además, una revisión de la literatura. Gueglio, G.; Daels, F.; Villamil, W.; Damia, O. CASO CLÍNICO Paciente de 51 años de edad, sexo femenino, sin comorbilidades asociadas, que consulta a su médico de cabecera por molestias en región lumbar derecha. Este le solicita una ecografía abdominal donde se detecta masa hiperecogénica, heterogénea de 4 x 3 cm., en proyección del área suprarrenal derecha (Figura 1). Posteriormente se le solicita tomografía axial computada (T.A.C) de abdomen con contraste informando aumento del tamaño de la glándula suprarrenal derecha a expensas de lesión hipodensa, de contornos definidos, con calcificaciones puntiformes en su interior, de 43 x 31 mm en sus diámetros máximos. Los estudios bioquímicos (excreción urinaria de 24 horas de metanefrinas y AVM, sodio, potasio y catecolaminas séricas) realizados descartaron funcionalidad alguna. La paciente es vista en el Servicio de Urología del Hospital Italiano 4 meses después manifestando empeoramiento de la sintomatología y refiriendo dolor lumbar irradiado a hipocondrio derecho. Se decide actualizar los estudios de imagen solicitán- Servicio de Urología del Hospital Italiano de Buenos Aires, Argentina. Rev. Arg. de Urol. · Vol. 70 (1) 2005 Figura 1. Ecografía abdominal que muestra lesión hiperecogénica en proyección del área suprarrenal derecha. 57 dose nueva T.A.C helicoidal (cortes c/4 mm.), siendo el informe de similares características al anteriormente descripto (Figura 2). Debido a la persistencia de los síntomas y a la falta de diagnóstico se indica su extirpación laparoscópica. Durante la intervención, se advierte la presencia de una glándula suprarrenal de características normales, desplazada por la presencia de una masa retroperitoneal de ubicación retrocava. Ante este hallazgo quirúrgico se realiza biopsia por congelación la que es informada como lesión compatible con Schwannoma retroperitoneal. Con este diagnóstico se efectúa su extirpación total por la misma vía. La paciente evoluciona de manera satisfactoria, indicándose el alta hospitalaria a las 72 horas. Figura 2. Tomografía Helicoidal. Lesión hipodensa en proyección suprarrenal derecha, que desplaza la vena cava inferior. Figura 3. Imagen macroscópica. Figura 4. Microscopia. 1. Anthony A. 2. Anthony B. 58 El informe anatomopatológico definitivo describió a la lesión como un Schwannoma retroperitoneal de estirpe “anciano” (Figuras 3 y 4). DISCUSIÓN Fue Verocay en el año 1910, quien describe el primer tumor de nervio periférico.2 Masson en 19323 le asigna el término Schwannoma y Stout en 19324 introduce la denominación de neurinoma, usándose desde entonces ambos términos indistintamente. Es el más frecuente de los tumores neurogénicos y se encuentra derivado de la cresta neural ectodérmica. Propio de tejidos blandos, se desarrolla comúnmente en pares craneales, raíces medulares o nervios periféricos del cuello, extremidades y mediastino.5 La localización retroperitoneal, comunicada por primera vez por Deming y Newman en el año 1954,1 es rara, y representa el 0,5 al 3,5% de todas las localizaciones.6 Su incidencia varía del 1% (Scalan 1959)7 al 10% (Felix 1981)8 de los tumores retroperitoneales; esto es explicado por la multitud de sinónimos empleados (Schwannoma, fibroblastoma, neurinoma neurilemoma, glioma de nervio periférico, o fibroblastoma perineural). La mayoría de los Schwannomas son benignos y solitarios. Se presentan entre la 3ª y 5ª décadas de la vida, con predominio por el sexo femenino. Ocasionalmente pueden ser múltiples, habitualmente formando parte de la enfermedad de Von Recklinghausen, trastorno genético mesodérmico, en la que se asocian a una típica pigmentación dérmica de color “café con leche”; en cuyo caso se presenta a menor edad, pueden malignizarse (neurofibrosarcoma), y tener localización atípica.9 Clínicamente este tumor suele ser silente y de diagnostico casual (“incidentaloma”). Si presenta síntomas, suele ser en forma de dolor lumbar sordo; la aparición de síndrome constitucional, hematuria y/o fiebre sugieren la forma maligna. El Schwannoma en su forma típica es bien encapsulado. Cuando es pequeño es circunscripto y sólido; pudiendo llegar a ser hemorrágico, necrótico y/o quístico cuando aumenta de tamaño. Su crecimiento es lento, y en su evolución habitualmente comprime, pero no invade, las estructuras anatómicas normales.10 Los estudios por imágenes pueden ayudar a identificar la masa retroperitoneal, pero no aportan un diagnóstico definitivo. La ultrasonografía es habitualmente utilizada como método inicial. Se visualiza como masa sólida, e hipoecogénica. En la TAC sin contraste endovenoso los Schwannomas aparecen como masas hipodensas, homogéneas y bien delimitadas. Después de la administración de contraste aparece con estructura he- terogénea con realce periférico. Algunos autores describen procesos degenerativos intratumorales (necrosis, proliferación e hialinización endotelial vascular y degeneración quística) en 63% de los tumores benignos, especialmente los de largo tiempo de evolución y en 75% aquellos con degeneración maligna, especialmente en pacientes con Von Recklinghausen. También se describen áreas de calcificaciones intratumorales en algunos tumores benignos.11 En la RNM son hipointensos en T1, con densidad similar al músculo y hiperintensos en T2, densidad símil grasa. R.N.M con supresión grasa persisten hiperintensos.12 La punción aspiración con aguja fina de estas lesiones no suele ser concluyente. Pueden describirse distintas variables diagnósticas que dificultan la eficacia del método a saber: pleomorfismo celular que pueden presentar estos tumores, disminución de la reditualidad cuanto mayor componente quístico posea, los diagnósticos diferenciales sin técnicas especiales frecuentemente son imposibles. Si a esto se agregan la posibilidad de desencadenar una crisis hipertensiva en caso de presentar un feocromocitoma, y los riesgos potenciales de la técnica, podemos inferir que la extirpación quirúrgica con estudio histopatológico e inmunohistoquímico de la pieza aportarán el diagnóstico de certeza. A pesar de eso algunos autores justifican su realización para distinguir otros procesos retroperitoneales (abscesos, hematomas).13 Macroscópicamente, al corte es de coloración blanquecina grisácea y consistencia firme. En su apariencia histológica, con tinción de hematoxilina-eosina se reconocen dos patrones característicos: Tipo A de Anthony, con un componente celular denso, altamente ordenado, constituidas por células fusiformes que con frecuencia se disponen en “empalizada” con sus ejes longitudinales paralelos, o en estructuras organoides (cuerpos de Verocay). Tipo B de Anthony, con un componente mixoide suelto (sustancia intercelular amorfa), hipocelular, en el cual las células tumorales están separadas por un fluido edematoso, formando en ocasiones espacios quísticosmicrovacuolas. Existen distintas variantes histológicas del Schwannoma, celular, plexiforme, melanocítico, anciano “envejecido” o gigante, plexiforme, fascicular (hamartoma neural congénito), y intraneural. El subtipo anciano, antiguo o gigante es una variante histológica del Schwannoma común benigno, raras veces comunicado en la literatura. Se caracteriza por su crecimiento silente, y por presentar notables alteraciones degenerativas, tales como necrosis, degeneración quística, hemorragia, calcificaciones y/o hialinización. Microscópicamente es Rev. Arg. de Urol. · Vol. 70 (1) 2005 hipocelular con ausencia de figuras mitóticas, núcleos atípicos y predominancia de cambios degenerativos antes nombrados. Con el estudio inmunohistoquimico se confirma el origen neural de las células tumorales en huso, presenta inmunorreactividad intracitoplasmática para vicentina y proteína S-100 positiva y presencia de mielina, proteína básica del tejido neural periférico. 14 Estos neoplasmas son radio-quimioresistentes. Su tratamiento consiste en la extirpación cuidadosa y completa de la lesión, con márgenes quirúrgicos negativos. En la era de la mínima invasividad y dependiendo de la experiencia del equipo quirúrgico en la mayoría de los trabajos actuales se sugiere su extirpación laparoscópica.15 Aunque el pronóstico de los Schwannomas benignos retroperitoneales es muy bueno, no debemos subestimar el daño que puede originar por compresión sobre órganos vecinos asociado con recidivas generalmente por extirpación incompleta de la lesión, así como su infrecuente pero posible transformación maligna, especialmente en pacientes con Von Recklinghausen. Por lo tanto, es prudente realizar una adecuada vigilancia del enfermo.16 Cuando la extirpación no es completa el neurilemoma puede recidivar (30-35% de los casos). Aquí nuevamente la cirugía es el tratamiento de elección.17 BIBLIOGRAFÍA 1. Deming C. y Newman H.: Schwannomas. J. Urol., 72: 316, 1954. 2. Verocay J.: Zur kenntnis Der Neurofibrome. Beitr. Path. Anat. Allag. Path., 48: 1, 1910. 3. Masson P.: Experimental and spontaneous scwannomas (peripheral gliomas). Amer. J. Path., 8: 367-88 (part 1) and 389-416 (part 2), 1932. 4. Stout Ap.: The peripheral manifestation of the specific nerve sheath tumor (neurilemmoma). Amer. J. Cancer., 24: 751-796, 1935. 5. Sewng H. Y Byung I.: Retroperitoneal neurilemmoma: CT and MR findings. A.J.R., 159: 1023-1026, 1992. 6. Pinson W. y Remine G.: Long-term results with primary retroperitoneal tumors. Arch. Surg., 124: 1168-1173, 1989. 7. Scalan B.: Primary retroperitoneal tumors. J. Urol., 81: 740–745, 1959. 8. Félix E. y Wood D.: Tumours of the retroperitoneum. Curr. Probl. Cancer., 6: 1, 1981. 9. Regan J.; Juler G. y Schmutzer K.: Retroperitoneal neurilenoma. Am. J. Surg., 117: 529-531, 1886. 10. Cortés A. y Fernández A.: Schwannoma retroperitoneal benigno: revisión de la literatura y aportación de un nuevo caso. Actas Urol. Esp., 23 (7): 621-624, 1999. 11. Chung-huang K. y Chi-sin C.: Sonographic features of retroperitoneal neurilemmoma. J. Clin. Ultrasound., 21: 309-312, 1993. 12. Sewng H. y Byung I.: Retroperitoneal neurilemmoma. C.T. and M.R. Findings. A.J.R., 159: 1023-1026, 1992. 59 13. Neifer R. y Nguyen G.: Aspiration cytology of solitary schwannoma. Acta Cytol. 29: 1, 1985. 14. Takatera H. y Takiuchi H.: retroperitoneal schwannoma. Urology, 28: 529-531, 1986. 15. Guz B. y Wood D. Jr.: Retroperitoneal nerve sheath tumors: Cleveland Clinic Experience. J. Urol., 142: 14341437, 1989. 60 16. Melicow M.: Primary tumors of the retroperitoneum: a clinicopathologic analysis of 162 cases: review of the literature and tables of classification. J. Int. Coll. Surg. 19: 401449, 1953. 17. Pack G. y Tabah E.: Collective review: primary retroperitoneal tumors: Study of 120 cases. Surg. Gynecol. Obstet., 99: 209-231,1954. COMUNICACIÓN DE CASOS CASE REPORT Quiste celómico abdominal. Un diagnóstico diferencial del quiste de uraco Abdominal celomic cyst. A differential diagnostic of urachus cyst Dres. Rabin, G.*; I NTRODUCCIÓN Rodrigo, J.**; Los quistes peritoneales o quistes celómicos se localizan con mayor frecuencia a nivel pelviano, por dentro o por fuera del peritoneo. Fue Plaut en 1928 quien describió el primer caso bajo el nombre de epitelioma quístico benigno de peritoneo. Más del 80% se encuentran en mujeres, principalmente durante la edad reproductiva. Pueden ser uni o multiloculados. Suelen presentarse adheridos a los órganos pélvicos o al peritoneo parietal, simulando un quiste de ovario, un mioma uterino o formando parte del contenido de una hernia inguinal.1-2 La presentación clínica más frecuente es el dolor abdominal (75%), siguiendo en frecuencia la presencia de masa palpable (46%). También pueden presentarse con metrorragia, polaquiuria y tenesmo vesical o constipación. Es posible que sean asintomáticos y resulten un hallazgo en cirugías por otras causas.3 El 80% de los pacientes en quienes se halla un quiste peritoneal, tienen historia de cirugía abdominal previa, enfermedad pélvica inflamatoria, endometriosis o combinación de éstas; sugiriendo una etiología inflamatoria como causa de la entidad.4-5 Los quistes celómicos son estructuras únicas o múltiples, translúcidas, rosadas y de paredes finas, que miden entre 4 y 20 cm de diámetro. Presentan contenido seroso, amarillento, líquido o gelatinoso y a veces purulento o hemorrágico. Sus paredes se encuentran tapizadas por un epitelio cúbico simple de células mesoteliales.6 Los multiloculados tienen loculaciones que varían en tamaño y forma, separadas entre sí por una cantidad variable de tejido conectivo. La mayoría muestran un infiltrado estromal inflamatorio crónico linfocitario, en general con signos de hemorragia reciente o antigua. Suelen estar adheridos a las estructuras vecinas por un pequeño pedículo de tejido conectivo, aunque a veces están libres dentro del abdomen.7-8-9 El tratamiento consiste en su remoción quirúrgica. El índice de recurrencia llega al 40% y se debe a la resección incompleta. La recurrencia se ubica en la misma localización de la lesión primaria o en sitios previamente no afectados.10-11-12 Lautersztein G.***, Rovegno A.****, Fernández H.*****. * Residente de la Sección Urología. Departamento de Cirugía. CEMIC. ** Residente de la Sección Cirugía General. Departamento de Cirugía. CEMIC. *** Médico Adscripto de la Sección Urología. Departamento de Cirugía. CEMIC **** Médico de Planta de la Sección Urología. Departamento de Cirugía. CEMIC. ***** Jefe de la Sección Urología. Departamento de Cirugía. CEMIC. Autor responsable: Gabriel E. Rabin. Sección Urología, Departamento de Cirugía. C.E.M.I.C., Buenos Aires, Argentina. Dirección: 3 de febrero 4696, Capital Federal. Teléfono: (011) 4701-2520. E-mail: [email protected] Rev. Arg. de Urol. · Vol. 70 (1) 2005 CASO CLÍNICO Paciente de 32 años de edad, sexo masculino, sin antecedentes médicos de importancia. Consultó por dolor difuso en hipogastrio, leve, que se incrementaba con la actividad física, de 10 días de evolución. El examen físico y el laboratorio incluyendo el sedimento urinario resultaron normales. Estudiado mediante ecografía abdominal, se visualizó una formación quística por encima de la vejiga, que la desplazaba en sentido caudal, alcanzando un volumen de 220 ml (Figura 1). Por tomografía axial computada, se trataba de un quiste con contenido hemorrági- 61 co, entre la vejiga y el recto anterior del abdomen, de 6,5 cm de diámetro. La resonancia magnética lo visualizó como una masa quística por encima de la vejiga, aunque separada de ella (Figura 2). Se consideraron como diagnósticos posibles el quiste de uraco y el quiste hidatídico. Este último fue descartado por la negatividad del “arco 5” por lo que se decidió una laparotomía exploradora con la presunción de quiste de uraco no complicado. Se procedió con una incisión mediana infraumbilical, separando en forma roma las masas de los músculos rectos anteriores. Una vez incidido el peritoneo a 3 cm de la línea media y ya adentro de la cavidad peritoneal se comprobó que la masa quística no estaba en el trayecto del uraco, sino adherida al peritoneo que cubre la cúpula vesical. Su diámetro mayor era de 10 cm y presentaba superficie abollonada. Se logró la exéresis sin perforar su pared, resultando fácil la separación de la serosa peritoneal con maniobras romas. Al abrirla en la mesa de Anatomía Patológica, se derramó un líquido rosado y transparente que sugirió líquido citrino con tinción hemática (Figuras 3 y 4). El estudio histológico (Dr. Roberto Iotti) estableció que se trataba de un quiste celómico benigno tapizado por epitelio cúbico, y con la pared revestida por tejido fibroso. Presentaba sectores de hemorragia reciente intraquística vinculable con compresión mecánica. DISCUSIÓN La observación de una formación quística vinculada con el peritoneo anterior infraumbilical y vecina a la Figura 1. Ecografía transabdominal Figura 2. RMI. Quiste supravesical. Figura 3. Cavidad pélvica que contenía el quiste. Figura 4. Quiste celómico. Pieza operatoria. 62 cúpula de la vejiga, en un sujeto con molestias periumbilicales o hipogástricas imprecisas, sugiere el diagnóstico de quiste de uraco no complicado.13 Los estudios por imágenes no brindaron en el caso que presentamos indicios que orientaran hacia otra etiología, de tal manera que resultó sorprendente el hallazgo de un quiste celómico. Tan firme era la presunción diagnóstica de quiste de uraco que el diagnóstico final de quiste celómico nos movió a considerar esta entidad como un diagnóstico diferencial en los quistes de uraco no complicados. BIBLIOGRAFÍA 1. Mónaco M; Mulé V. Mondillo B. Surgical treatment of celomic cysts. G Chir. 1-may-2005; 25(5): 171-174. 2. Lascano E.; Villamayor , M. Loose Cysts of the peritoneal cavity. Annals of Surg. Nov 1960. 152 (5): 836-844. 3. Syckes P. Peritoneal inclusion cysts. Female reproductive system and peritoneum.1990. P: 2680-2704. 4. Caropreso, P.; Harrisburg, P. Mesenteric cysts, a review. Arch Surg. Feb 1974. Vol 108. 242-246. Rev. Arg. de Urol. · Vol. 70 (1) 2005 5. Moore, J; Christopher, P. Benign cystic mesothelioma. Cancer. May 1980: 2395-2399. 6. Ross, M.; Welch, W. Multilocular peritoneal inclusion cysts (so-called cystic mesotheliomas). Cancer 64, 1989: 1336-1346. 7. Adolph A.; Smith T. Benign multicystic mesothelioma: a case report. J Obstet Gynaecol Can. 1-mar-2002; 24 (3): 246-247. 8. Ford, J. Mesenterio cysts. Review of the literature with report of an unusual case. Am J of Surg. Vol 99. Jun 1960: 878-884. 9. Sienkowski, I.; Russell, A. Peritoneal cystic mesothelioma: an electron microscopic and immunohitochemical study of two male patients. J Clin Pathol 1986; 39: 440-445. 10. Kurtz, R; Heimann, T. Mesenterio and retroperitoneal cysts. Ann Surg. Jan 1986. Vol 203 (1): 109-112. 11. Hinshaw, J.; Phil, D. Unattached cysts in the peritoneal cavity. Ann of Surg. Jan 1957. Vol 145 (1): 138-143. 12. Katsube, Y.; Kiyoshi, M. Cystic mesothelioma of the peritoneum. A report of five cases and review of the literature. Cancer. Oct 1982: 50 (8): 1615-1620. 13. Keun P.; Medel P; Iriarte P. Quiste de uraco infectado: presentación de caso clínico y revisión del tema. Rev. Arg. de Urol. 2003. 68 (4): 235-237. 63 Comentario de trabajos Prediction of extraprostatic extension in the neurovascular bundle based on prostate needle biopsy pathology, serum prostate specific antigen and digital rectal examination. Vol 173, 450-453, Feb 2005. Toyonori Tsuzuki, David J. Hernandez, Hakan Aydin, Bruce Trock, Patrick C. Walsh and Jonathan I. Epstein Objetivo: Hay pocos estudios predictores de extensión extraprostática (EEP) en la región de la bandeleta neurovascular (BNV). Investigamos si la información clínica y los datos de las biopsias de próstata podían predecir la EEP del cáncer de próstata clínicamente localizado. Materiales y Métodos: A través de un análisis retrospectivo de la base de datos de patologías identificamos 2.660 casos de cáncer de próstata clínicamente localizado tratados con una prostetectomía radical retropúbica sin terapia adyuvante preoperatoria en el Hospital Johns Hopkins. La muestra del estudio abarcó un total de 3.006 lóbulos con cáncer de próstata que incluía 2.070 con enfermedad confinada al órgano, 620 con EEP en la BNV en el borde posterolateral de la próstata y 316 con EEP fuera de la BNV. Mediante análisis de regresión logística univariable y multivariable determinamos si la edad del paciente, el año de la cirugía, el antígeno prostático específico en suero, el tacto rectal, el puntaje Gleason más elevado de la biopsia, la invasión perineural, el porcentaje de cores de biopsia específicos de cada lado con cáncer, el porcentaje de cada core con cáncer y el porcentaje máximo de un core con cáncer eran predictores de EEP en la BNV. Resultados: El antígeno prostático específico (10 o mayor vs. menos de 10), el puntaje Gleason de la biopsia (7 o mayor vs. 6 o menos), el tacto rectal (anormal vs. normal), el porcentaje de cores específicos de un lado con tumor (mayor a 33,3% vs. 33,3% o menos) y el compromiso porcentual promedio de cada core positivo (mayor a 20% vs. 20% o menos) resultaron ser predictores independientes estadísticamente significativos de la penetración de las BNV en el análisis multivariable. El modelo generado estratifica cada una de estas variables en alto y bajo riesgo. La probabilidad de EEP en la BNV fue inferior al 10% en los casos con 1 o menos de las variables de más alto riesgo y de 10% o superior en los casos con más de 1 de las variables de más alto riesgo. Conclusiones: El modelo generado en este estudio permite la identificación preoperatoria de los pacientes con 10% o más probabilidad de EEP en la BNV. Nuestro algoritmo ayudará a proporcionar parámetros objetivos que contribuyan para tomar la decisión de conservar la BNV con seguridad. C O M E N TA R I O Con el desarrollo de las técnicas actuales de screening, tanto la edad de diagnóstico como el estadio de la enfermedad se han modificado de manera importante. En la actualidad hay un aumento en la incidencia en individuos más jóvenes, sexualmente activos; hoy el cáncer de próstata es una patología de hombres de mediana edad, donde las consecuencias de un procedimiento quirúrgico podrían afectar severamente la calidad de vida de estos pacientes. Además, la incidencia de enfermedad órgano confinado también ha sufrido un vuelco radical, aumentado del 43% en 1973 a el 75% en 1998, con una reducción muy 64 significativa en el porcentaje de márgenes positivos y de invasión de las vesículas seminales. Por lo tanto, en la actualidad la prostatectomía radical (PR) es uno de los mejores tratamientos para el cáncer de próstata órgano confinado, pero está asociada como todos sabemos con la disfunción sexual eréctil (DSE). Con la introducción de nuevas técnicas de identificación y preservación de las bandeletas neurovasculares (BNV), el mantenimiento de la potencia sexual después de la cirugía ha aumentado significativamente. La clave para lograr buenos resultados luego de la PR es la correcta selección del paciente, la realización de un procedimiento metódico, hemostático y cuando sea posible con preservación de las BNV, pero no debemos olvidar que el principal objetivo es curar la enfermedad. La importancia de este artículo que se presenta en el Journal of Urology de febrero radica en que los autores tratan de crear un modelo que permita identificar a los pacientes que realmente sean candidatos para un correcta preservación de las BNV, y evitar la extensión extraprostática (EEP), tanto a nivel de las BNV como en otra región. Está basado en la experiencia de los Servicios de Patología y de Urología del Hospital Johns Hopkins, sobre un análisis retrospectivo de 2.660 casos de cáncer de próstata clínicamente localizado que fueron sometidos a una PR. Se definieron 8 parámetros preoperatorios para identificar a los pacientes de alto y bajo riesgo para la EEP a nivel de la región posterolateral de las BNV a fin de realizar un procedimiento seguro. Es importante recordar en este punto los estudios de McNeal quien describió los pedículos neurovasculares del ápex y de la base, y el espacio que los rodea como conducto potencial de EEP. Las 8 variables fueron la edad del paciente, el PSA sérico, score de Gleason, año de la cirugía, tacto rectal (TR) palpable o no (también específico del lado), presencia o ausencia de invasión perineural, porcentaje de los cores positivos para cáncer por lado y porcentaje de cada core con cáncer, incluyendo el core con máxima cantidad de tumor, también específico de cada lado. La ecuación generada por el modelo se usó para predecir la probabilidad de EEP en la BNV y se desarrolló un algoritmo que se tradujo en menos o más del 10% de probabilidad de EEP. En cuanto a los resultados 560 pacientes (21%) tuvieron EEP a nivel de las BNV y 268 (10%) en otra región. De las variables antes mencionadas se destaca el PSA, el score de Gleason, el porcentaje promedio de cores afectados, el porcentaje de core afectados y el TR. Los pacientes de alto riego fueron los de PSA de 10 o más, Gleason de 7 o más, 20% de los cores afectados o más, 33,3% del core afectado o más y TR patológico. La probabilidad de EEP en las BNV fue menor al 10% en caso de una o menos de las variables de alto riesgo. Teniendo en cuenta estas datos los autores predicen con gran exactitud qué paciente es el candidato ideal para una preservación de las BNV, sin riesgo de los márgenes positivos. Dr. Mariano González Morales Centro de Urología. CDU BIBLIOGRAFÍA Comprehensive Textbook of Genitourinary Oncology, LWW. 2002 Campbell´s Urology. 2003 Urol Clin N America 30 (2003) Rev. Arg. de Urol. · Vol. 70 (1) 2005 65 Cirugía conservadora renal electiva para masa ocupante: Experiencia de un centro con 129 pacientes consecutivos. Marszalek M, Phonolzer A, Brössner C, Wachtter J, Maier U y Maderbnacher S. Urology 64: 38; 2004. Instituto Ludwig Bolyzmann de Urología Oncológica. Donauspital, Viena, Austria. Objetivos: Presentar nuestra experiencia con cirugía conservadora electiva en masa ocupante renal. Metodo: En un estudio retrospectivo, se tabularon todos los pacientes a quienes se les realizó una cirugía conservadora electiva desde enero de 1996 a diciembre de 2002 en nuestra institución. Se realizó como estudio preoperatorio ecografía y tomografía computada de abdomen. Se analizó la histopatología, complicaciones y el comportamiento oncológico. La técnica quirúrgica fue en todos los casos con isquemia e hipotermia regional. Resultados: Fueron analizados un total de 129 pacientes con una edad media de 61 años. La media del tamaño tumoral según la tomografía preoperatoria fue de 4 cm +/- 2,4 cm. El carcinoma renal se halló en 86 pacientes (66,7%), quiste benigno en 18 (13,9%), oncocitoma en 10 (7,8%), angiomiolipoma en 7 (5,5%), adenoma en 4 (3,1%), pielonefritis xantogranulomatosa en 3 (2,3%) y en 1 caso metástasis de un melanoma maligno. Dos pacientes por hemorragia postoperatoria requirieron nefrectomía (1,6%). Con una media de seguimiento de 34 meses (rango 2 a 91) ningún paciente presentó recidiva local, un caso (0,8%) tuvo metástasis ganglionar y 2 (1,6%) desarrollaron metástasis a distancia. El clearance de creatinina disminuyó de 77 +/- ml/minuto antes de la cirugía a 64 +/- 23 ml/minuto despues de 34 meses como media de seguimiento. Conclusiones: Los resultados de esta actualizada experiencia, en un solo centro, con cirugía conservadora, especialmente en masas renales pequeñas determina que es la táctica terapéutica de elección basado en hallazgo de que 1/3 de los casos fueron formaciones benignas. C O M E N TA R I O Los autores presentan su experiencia en cirugía conservadora electiva en masa ocupante renal con un tamaño menor de 5 cm y de hallazgo incidental. Dentro de los exámenes prequirúrgicos quiero resaltar que solicitan tomografía computada de abdomen en lugar de lo que habitualmente se suele hacer que es solicitar dicho estudio incluyendo imágenes pelvianas, en el estudio de un tumor renal, y más aún tumores incidentales, la tomografía de pelvis no es de utilidad, con ello se ahorra un 25% de los costos del estudio. Referente a la técnica quirúrgica realizada, llama la atención, que fueron todos los casos con clampeo vascular e hipotermia, considero que por el tamaño de los tumores, dicha técnica, es de excepción ya que, generalmente son tumores que se pueden resecar satisfactoriamente sin necesidad del clampeo de la arteria renal, mas aún si son tumores periféricos, aquellos ubicados en alguna de las caras del riñón suelen ser los más proclives a necesitar un clampeo vascular y habitualmente sin hipotermia, la hipotermia se la suele reservar para casos de tumores complejos donde podemos contar con una isquemia de hasta 3 hs., en los casos presentados el tiempo de clampeo varió entre 17 y 30 +/- 19 minutos, con ese tiempo medio se puede hacer clampeo sin hipotermia y sin consecuencias para la suficiencia renal. Se utilizó la ecografía intraoperatoria para tumores intraparenquimatosos, considero útil dicho estudio para estos casos ya que, poder tener una correcta ubicación del tumor permitirá su resección con el menor compromiso de tejido renal sano; la ecografía para determinar tumores multicéntricos actualmente no tiene utilidad en base a la alta definición con que cuentan los exámenes complementarios que permiten diagnosticar tumores entre 0,7 y 1 cm. 66 Los tumores seleccionados en esta serie, menores de 5 cm e incidentales son los casos en que actualmente no se discute que la cirugía conservadora es la elección por encima de la nefrectomía radical, los argumentos que se pueden obtener del trabajo son más que válidos y ampliamente sustentados en la bibliografía, a saber: Los tumores incidentales son tumores de bajo grado de malignidad, en dicha serie el 97,3% fueron tumores circunscriptos al riñón y el 70% fueron Fuhrman 1 y 2. Se demostró en la serie que no hubo casos de recidiva local. Los resultados que se obtienen son similares a los tratados con nefrectomía radical.1,2 El 30% de los casos fueron masas ocupantes por patología benigna. El hallazgo de tumores benignos presentó su más alto índice en pacientes menores de 50 años, 56% de los casos. Respecto de las complicaciones fueron hemorragias las más frecuentes, ellas son atinentes a cualquier acto quirúrgico y no específicamente de la cirugía parcial, la unica que sería propia de la técnica es la fístula arteriovenosa, pero su presentación fue en dos casos y con resolución que permitió conservar las unidades renales. Como conclusión del trabajo rescato la necesidad de cirugía conservadora en masa ocupante renal incidental menor de 5 cm como presentan los autores, por los buenos resultados terapéuticos en los casos oncológicos, similares a cirugía radical y por evitar la innecesaria pérdida de unidades renales en un alto porcentaje de casos por ser patologías benignas y dentro de ellas en pacientes menores de 50 años el mayor porcentaje. Dr. Carlos A. Ameri Encargado Sección Oncología Servicio de Urología del Hospital Alemán. BIBLIOGRAFÍA 1. Uzzo RG y Novick AC. Nephron sparing surgery for renal tumors: Indications, techniques and outcomes. J Urol 166: 6; 2001. 2. Herr HW. Partial nephrectomy for unilateral carcinoma and a normal contralateral kidney; 10 years followup. J Urol 161: 33; 1999. Epidemiología del cáncer de próstata bajo la óptica de una campaña de detección temprana Dres. López, M. A.; Grosman, H.; Bellora, O. G.; Surur, D. M.; Grinspon, D.; Nolazco, C. A.; Sandoval, M. A.; Elsner, B.; Mazza, O. N. Premio Dr. Luis E. Pagliere 2003. Rev. Arg. de Urol. Vol. 69 (4) 2004 Se publica aquí el comentario del Dr. Rey omitido por error en la Revista Argentina de Urología Vol. 69 (4) 2004. Rev. Arg. de Urol. · Vol. 70 (1) 2005 Introducción: El cáncer de próstata (Ca P) es la segunda causa de muerte por cáncer entre los hombres. Desde hace más de una década, para disminuir la mortalidad por Ca P se desarrollan campañas de rastreo poblacional, tendientes a identificar carcinomas precozmente e instituir tratamientos con mayor potencial curativo. Este estudio resume los hallazgos de la campaña denominada “Semana de la Próstata 2001”, desarrollada por la División Urología del Hospital de Clínicas “José de San Martín”, utilizando un algoritmo creado especialmente. Material y Métodos: A 2.686 varones (edad: 63,41 ± 0,188 años) se les realizó examen digital rectal, dosaje de antígeno prostático específico (PSA) total y, según los resultados de estos exámenes, PSA libre y/o biopsia prostática ecodirigida. Resultados: Se detectaron 65 Ca P (índice de detección global = 2,42 %; índice respecto de indi- 67 viduos biopsiados = 22,82%). Se encontró un ascenso progresivo del índice de detección desde los 50 años y hasta los 80. El 53,85 % de los adenocarcinomas diagnosticados pueden considerarse confinados al órgano y pertenecientes, por ello, a la población que busca identificar una campaña de rastreo poblacional. Conclusiones: La “Semana de la Próstata 2001” implicó grandes costos y esfuerzos, justificados, sobre todo, por la información recogida y la formación adquirida por quienes intervinieron en ella. C O M E N TA R I O : P R U E B A D E U N A P R U E B A El diagnóstico médico puede contemplarse como un intento de tomar decisiones idóneas manejando información insuficiente. Los procedimientos e instrumentos diagnósticos se constituyen en un medio para reducir la incertidumbre. Sin embargo, para aplicar correcta y oportunamente cada prueba diagnóstica es necesario conocer cómo reducen la incertidumbre y cuánto le corresponde a la incertidumbre restante. El desafío de la práctica médica está constituido por el empleo apropiado y selectivo de las tecnologías que nos reduzcan la brecha de la incertidumbre, aumenten la precisión diagnóstica y eviten la utilización de prácticas innecesarias con el consecuente incremento de los costos en la atención de los pacientes. Saber cómo vivir en la incertidumbre es una característica central del juicio clínico La prueba o criterio utilizado para definir inequívocamente una enfermedad se conoce con el nombre de prueba de oro o “gold standard”. No obstante, el problema que surge con frecuencia es que si bien nos facilitaría el diagnóstico definitivo en la mayoría de los casos, la prueba de oro puede acarrear un riesgo excesivo, es tardía para el máximo beneficio o no es práctica en el sentido clínico. De este modo se necesita recurrir a otras pruebas diagnósticas, en general menos cruentas, de menor costo operativo, menor complejidad y con mayor aceptación de los pacientes. La utilidad de la nueva prueba se basa en su comparación con la mejor prueba disponible (la de oro) para determinar el rendimiento que ofrece. La prueba perfecta no existe, el médico debe seleccionar la prueba adecuada. La valoración de las pruebas diagnósticas se basa en la variabilidad observada en: • Reproducibilidad • Variabilidad de la población de sanos empleando el concepto de intervalo de normalidad • Variabilidad de la población de personas enfermas y su relación con las sanas por medio de los conceptos de sensibilidad, especificidad y valor predictivo La capacidad diagnóstica de una prueba para discriminar sanos y enfermos , se mide con la sensibilidad y especificidad. Estas miden la discriminación diagnóstica de la prueba comparada con la del criterio de referencia, que, por definición, tiene una sensibilidad y especificidad de 100%. C U RVA C O R O R O C La Curva COR o ROC es un acróstico para curva de la Característica con que Opera el Receptor y proviene de los primeros días del radar, cuando los intérpretes tenían que distinguir entre las señales causadas por los aeroplanos de los ruidos provenientes de otras fuentes. La curva ROC es simplemente un gráfico de los pares de tasas de verdaderos positivos, sensibilidad, especificidad y falsos positivos , que corresponden a cada punto de corte para el resultado de la prueba diagnóstica. La curva permite visualizar la elección del punto de corte. La tendencia al buscar el punto de corte es disminuir la suma de falsos positivos. Para disminuir la tasa de falsos positivos se recurri- 68 rá a seleccionar un punto de corte hacia la izquierda. Por el contrario, si la necesidad fuera disminuir los falsos negativos se debería seleccionar un punto de corte que aumente la tasa de verdaderos positivos. Como aporte al trabajo y a los efectos de fortalecer el argumento de selección del punto de corte, además de la curva ROC, se calcularon los valores predictivos para 15 y para 20, de acuerdo con los valores de sensibilidad y especificidad que surgen del gráfico (Figura 2): Para 15: Sensibilidad 90% y Especificidad 50%. Para 20: Sensibilidad 90% y Especificidad 15%. Los valores predictivos positivo y negativo para 15 comparado con los mismos para 20 identifican: el VPP se reduce en un 20% al pasar de 15 a 20 y el VPN en casi 28%, lo que fortalece y valida la decisión de elección del punto de corte en 15. Es necesario observar que al disminuir el Valor Predictivo Negativo, aumentan por complementariedad los falsos negativos, con el peligro de desechar desde la prueba a individuos enfermos. Cuando disminuye el valor Predictivo Positivo , aumenta su complemento, los falsos positivos, lo que nos hace recurrir innecesariamente a pruebas de instancia superior. Dr. Horacio Manuel Rey Servicio de Urología Hospital Durand 120 100 80 60 Punto de Corte Valor Predictivo Positivo Valor Predictivo Negativo 64 % 83% 40 20 15 0 13 20 51% 60% 14 15 16 17 18 19 20 21 22 sensibilidad especificidad Sensibilidad y especificidad para los diferentes puntos de corte Deducciones de los valores predictivos hallados: Corte en 15 Enfermos Sanos Total Valor predictivo Corte en 20 Enfermos Sanos Total Valor predictivo Test positivo 90 50 140 VPP 64% Test positivo 90 85 175 VPP 51% Test negativo 10 50 60 VPN 83% Test negativo 10 15 25 VPN 60% Sensib. 90% Especif. 50% Sensib. 90% Especif. 15% BIBLIOGRAFÍA 1. Riegelman, R., Hirsh R.: Cómo estudiar un estudio y probar una prueba: la lectura crítica de la literatura médica. Publicación científica Nª 53. OPS. OMS. 1992. 2. Sackett, D., Haynes R., Gordon H., Tugwell P.: Clinical Epidemiology: A Basic Science for Clinical Medicine. Little, Brown and Company- Boston 1991. Rev. Arg. de Urol. · Vol. 70 (1) 2005 69 Correo de lectores Rosario, febrero 28, 2005 Señor Director de la Revista Argentina de Urología Dr. Carlos Ameri De nuestra mayor consideración: Hemos leído detenidamente el artículo “Epidemiología del Cáncer de Próstata bajo la óptica de una Campaña de detección temprana” publicado en Rev. Arg. de Urol. 69: 210, 2004 y notamos que en la abundante bibliografía citada no figuran las comunicaciones que hicimos a los Congresos Argentinos de Urología1,2,3 referentes a los resultados obtenidos en la “1ª Campaña de la Salud del Hombre y su Próstata” que realizamos en la ciudad de V. G. Gálvez (prov. de Santa Fe) en mayo de 1998. Esta campaña, primera en su tipo en Latinoamérica, revisó 326 voluntarios a los que se efectuó examen físico completo, incluido examen odontológico, y numerosos análisis bioquímicos, entre ellos PSA, con posterior congelamiento y archivo de las muestras de sangre remanentes que se conservan en perfecto estado.4 Consideramos lamentable la omisión de la cita de nuestros trabajos en la bibliografía, ya que priva a los lectores de la posibilidad de conocer y tomar como referencia comunicaciones originales de nuestro país. Rogando tenga a bien disponer la publicación de la presente en la Revista de vuestra dirección, aprovechamos la oportunidad para saludarle con nuestra consideración más distinguida. Por los autores Dr. Fernando Premoli Urólogo Miembro del Comité Editor de la Revista Médica de Rosario Presidente del Comité de Certificación y Recertificación Urología. Colegio Médico de la provincia de Santa Fe (2ª Circunscripción). Email: [email protected] 1. Premoli, F.; Sosa, C.; Garimaldi, N. y col.: Antígeno Prostático Específico (APE) resultados obtenidos con 849 determinaciones en 641 pacientes de la ciudad de Rosario. Resúmenes del Congreso Argentino de Urología 1994 (Buenos Aires) Nº 80. 2. Premoli, F.; Re, I.; Asenjo, G. y col.: PSA y Tacto Rectal en Voluntarios Concurrentes a una Campaña de Prevención de la Salud del Hombre (comunicación preliminar). Actas del Congreso Argentino de Urología (Buenos Aires) 1998, Nº 71. 3. Premoli, F.; Bragagnolo, J.; Domínguez, E. y col.: PSA en 326 concurrentes a la “Primera Semana de la Salud del Hombre y su Próstata - Mayo 1998” V. G. Gálvez (S. Fe) y su relación con distintas variables. XXXVIII Congreso Argentino de Urología 2001 (Buenos Aires), Abst. P 53, pág. 65. XIV 4. Premoli, F.; Sosa, C.; Domínguez, E. y col.: Estudio de la estabilidad del PSA en muestras congeladas de 326 hombres voluntarios. Resultados secuenciales. XXXIX Congreso Argentino de Urología 2003 (Buenos Aires), Abst. P 28, pág. 94. Carta de lectores Respuesta a la carta original 23 de marzo de 2005 Sr. Director de la Revista Argentina de Urología Dr. Carlos A. Ameri De nuestra consideración: Con referencia a la carta de lectores que hiciera llegar a vuestra redacción el Dr. Fernando Premoli, aludiendo a nuestro trabajo “Epidemiología del cáncer de próstata bajo la óptica de una campaña de detección temprana”, publicado en el número 4 de 2004: el Dr. Premoli considera “una lamentable omisión” el no citar los resúmenes presentados en congresos argentinos referentes a la “1ª Campaña de Salud del Hombre y su Próstata”, diciendo que ello “…priva a los lectores de la posibilidad de conocer y tomar como referencia comunicaciones originales en nuestro país…” Los autores, respetuosamente, rechazamos esa imputación y, a modo de respuesta, nos permitimos recordar algunas premisas básicas en redacción científica. Los propios autores deben velar por la máxima difusión del informe de sus investigaciones, y dado que los resúmenes publicados en congresos se consideran comunicaciones preliminares, no indexadas y no accesibles a ningún motor de búsqueda, deberían intentar –si el trabajo es lo suficientemente importante o relevante– publicarlo en alguna revista médica de la especialidad, reconocida o indexada, y del mayor impacto al que puedan acceder. Pretender que terceros, a través de la bibliografía de sus comunicaciones, sean mecanismo de difusión alternativo, no constituye una vía adecuada. La bibliografía de un trabajo original sólo tiene como objetivo apoyar el resultado del mismo en las secciones “introducción” y “discusión”. Debe ser puntualmente restringida a los temas que alude. Las publicaciones técnicas sobre redacción científica remarcan que la bibliografía sólo debe incluirse para respaldar el trabajo intelectual y no debe ser un catálogo para el exhibicionismo.1 Debe enumerar sólo las obras importantes, publicaciones preferentemente primarias de revistas indexadas y no deben abarrotar la sección de referencias u obras citadas;2 y lo recomendado por las revistas de mayor impacto es no exceder las 20 publicaciones.3 Aun las publicaciones de actualización o puesta al día (no es el caso de nuestro trabajo) limitan el número de referencias y sólo consideran publicaciones completas de trabajos originales. Creemos, con lo expuesto, demostrar que no se trató de una omisión, dado que hacemos mención a los resúmenes presentados por Borghi, Scorticati y colaboradores quienes, efectivamente, realizaron las primeras campañas de detección temprana del cáncer de próstata en 1993 y 1994, lo que les otorga un valor histórico que amerita la inclusión en la discusión del trabajo y, necesariamente, en la bibliografía. Las aclaraciones precedentes constituyen una respuesta técnica de los autores a una queja infundada del Dr. Premoli, y ello no implica que este equipo de trabajo no valore ni deje de reconocer el esfuerzo realizado en la 1ª Campaña de Salud del Hombre y su Próstata. Agregamos que la originalidad de la misma residió en que la detección tem- Rev. Arg. de Urol. · Vol. 70 (1) 2005 XV prana de enfermedades se ampliaba a otras áreas de la salud humana, además de la próstata, pero esta particularidad no era objeto de discusión en nuestro trabajo. Sin otro particular y en la espera de la publicación de nuestra réplica en la sección carta de lectores, les hacemos llegar un cordial saludo. Dr. Miguel A López Dr. Osvaldo N. Mazza 1. Cataldi Amatrian, R. M.: Los informes científicos. Editorial Lugar, Buenos Aires, 2001, página 57. 2. Day, R. A.: Cómo escribir y publicar trabajos científicos. Editorial Organización Panamericana de la Salud, Washington, 1996, página 49. 3. Información para autores. J. Urol. (2004), 172: 2514. XVI NOTICIAS DE LA SAU Coordinador: Dr. Pablo Atchabahian Congreso Argentino de Urología 2005 XLII Congreso de la Sociedad Argentina de Urología - XXXV Congreso de la Federación Argentina de Urología XXV Jornadas Rioplatenses de Urología - V Reunión de la Asociación de Médicos Residentes 26, 27, 28 y 29 de octubre Comité Organizador Presidente: Dr. Norberto Fredotovich Secretario: Dr. Lorenzo Grippo Tesorero: Dr. Claudio Rosenfeld Director de Congresos y Jornadas: Dr. Miguel A. Acosta Invitados Especiales Dr. Claude Abou, Francia Dr. Jo Ampe, Bélgica Dr. Gustavo Ayala, USA Dr. Ignace Billiet, Bélgica Dr. Paul Carpentier, Bélgica Dr. Octavio Castillo, Chile Dr. Marc Hardeman, Bélgica Dr. Gerald Jordan, USA Dr. F. Keuppens, Bélgica Dr. Johan Mattelaer, Bélgica Dr. Jems Rassweiler, Alemania Dr. Marc Stroiger, Bélgica Dr. Jon Vanhaverbeke, Bélgica Dr. Eric Vignaul, Canadá Reunión Conjunta Sociedad Argentina de Urología y Asociación Belga de Urología Cursos • Actualización en el tratamiento del cáncer superficial de vejiga • Nuevas perspectivas en el diagnóstico y tratamiento de la disfunción sexual Presentación de Trabajos Científicos • Aportes al Tema Central: Tratamiento del cáncer avanzado en Urología • Aportes Tema Libre • Posters • Videos • Premios: para cada uno de los ítems anteriores. Programa Tentativo Conferencias • Cirugía urogenital reconstructiva • Cirugía endourológica en la litiasis • Biología molecular y genética del cáncer urogenital • Cirugía laparoscópica en el cáncer urogenital • Alternativas quirúrgicas en la incontinencia urinaria de esfuerzo • La circuncisión a través de la Historia • Nuevas tecnologías en la radioterapia del cáncer de próstata • Tratamientos alternativos en la hipertrofia de la próstata Mesas Redondas • Sociedad Argentina de Urología: Tratamiento del cáncer avanzado en Urología • Federación Argentina de Urología: Tratamiento de las fístulas genitourinarias • Sociedad Uruguaya de Urología: Manejo actual de la Tuberculosis urinaria Fecha límite de presentación de trabajos: 31 de agosto de 2005 Inscripción al Congreso Categorías Socios SAU, FAU, SUU, CAU Médicos No Socios Residentes Socios AAMRU Residentes No Socios Acompañantes Hasta el 31/08/05 $500 $1.000 $200 $300 $200 Desde 01/09/05 $1.000 $1.500 $300 $400 $300 Secretaría e Informes Sociedad Argentina de Urología. Pasaje de la Cárcova 3526 (1172) Buenos Aires, Argentina. Tel./Fax (5411) 4963-8521 / 4336 / 4337. e-mail: [email protected] / www.sau-net.org Hilton Buenos Aires Hotel Av. Macacha Güemes 351 - Puerto Madero - Buenos Aires - Argentina Rev. Arg. de Urol. · Vol. 70 (1) 2005 XVII XVIII ■ Curso superior en monitoreo e investigaciones clínicas y farmacológicas, a realizarse en la Escuela de Salud Pública de la Facultad de Medicina de la UBA, durante el año 2005. Osteoporosis. Inf. [email protected] ■ 4to Curso de Postgrado en Urología. Seminarios de Actualización en Urología 2005 Cátedra de Urología. Facultad de Ciencias Médicas. Universidad Nacional de Rosario. A dictarse durante el año 2005. ■ Curso Teórico Práctico de Litotricia y Endourología Duración 1 mes. Organiza: División Urología del Hospital Durand. A dictarse de marzo a noviembre de 2005. Directores: G. de la Torre. M. A. Massa. Coordinador: Dr. W. De Bonis. Director de Docencia: Dr. N. Fredotovich. Inf: Dr. De Bonis. Teléfono Hospital: 4982-5555 Int. 222224. mail: [email protected] ■ VIII Curso Anual de la Regional Noroeste de la Provincia de Buenos Aires - 2005 Duración de 60 horas con evaluación final. Se realizara en distintas localidades del Noroeste de la Provincia de Buenos Aires. 1° reunión: 26 de marzo. Lugar: Baradero Tema: Hipertrofia Prostática. Nuevos enfoques terapéuticos. Disertante: Dr. Horacio Pintado ■ AUA Annual Meeting 21 a 26 de mayo. San Antonio, Texas. 1-800-908-9414 [email protected] ■ VXIII Congreso Nacional de la Sociedad Cubana de Urología 6 al 10 de junio de 2005. Información: Dr. Alberto Toledo Lozano [email protected] y Dr. Andrés Ferndandéz García [email protected] ■ 1º Curso Universitario de Medicina Sexual. A realizarse en el Aula Magna de la Facultad de Medicina entre el 13 de junio y el 17 de octubre de 2005. Informes e inscripción: [email protected], o Secretaría de Extensión Universitaria de la Facultad de Medicina. ■ 1ª Reunión Científica Latinoamericana en Urología. “Curso de Actualizaciones en Urología 2005” - Conmemoración 40º aniversario de la F.A.U. Reunión Regional - Región Centro. 25, 26 y 27 de agosto de 2005. Centro de Convenciones Hotel Holiday Inn Córdoba, Argentina. Informes: 054 0351 4683111. Mail: [email protected] [email protected] Pág. web: www.tau.org.ar ■ American Urological Association. Vancouver, Canadá. Del 26 de agosto al 1º de septiembre de 2005. ■ 34º Congreso Argentino de Anestesiología VI Curso Internacional de Anestesia y Analgesia en Obstetricia A realizarse del 31 de agosto al 3 de septiembre de 2005, en Buenos Aires. ■ Meeting de la SIU sobre Cáncer de Próstata 29 de septiembre al 1 de octubre. San Carlos de Bariloche. Informes: Secretaría de la SAU e-mail: [email protected] ■ Congreso Argentino de Urología A realizarse del 26 al 29 de octubre de 2005, en la Ciudad de Buenos Aires. Inf.: Secretaría SAU. ■ XIX Congreso Argentino de Patología de Urgencia y Emergentología XX Congreso Rioplatense de Medicina y Cirugía en la Emergencia V Jornadas de Residentes en la Emergencia VIII Jornadas de Enfermería en la Emergencia IV Jornadas de Instrumentadotas en la Emergencia 2, 3 y 4 de noviembre de 2005, Crowne Plaza Panamericano Hotel E-mail:[email protected] Sarmiento 1617 Local 39,Paseo La Plaza. C1042 ABE – Ciudad de Buenos Aires ■ III Congreso Argentino de Transplante y I Congreso Argentino de Enfermería en Transplante. A realizarse los días 24, 25 y 26 de noviembre de 2005, en el Mariot Plaza Hotel de Buenos Aires. Informes: French 2727, 8º piso “A”, Buenos Aires. Mail: [email protected] - Pág. web: www.sat.org.ar Asociación Médica Argentina De acuerdo con la tarea encomendada por la Corte Suprema de Justicia de la Nación mediante la Resolución Nº 669/2002, confiere a dicha Asociación Médica la inscripción de Profesionales Médicos para desempeñarse ante todos los fueros judiciales como peritos médicos, ante la Justicia Nacional y Federal de la Ciudad Autónoma de Buenos Aires. C o n d i c i o n e s p a r a o p t a r a l a c a t e g o r í a d e M i e m b r o Ti t u l a r d e l a S A U Para ser Miembro Titular se requiere: c1. Ser Miembro Adherente de la Sociedad Argentina de Urología, Asociación Civil, con una antigüedad no menor de cinco años; c2. Ser médico urólogo con título de especialista otorgado por esta Sociedad Argentina de Urología, Asociación Civil; c3. Acreditar una asistencia mínima a cuatro sesiones científicas al año, o veinte en los últimos cinco años; c4. Haber presentado cinco trabajos a la Sociedad, uno de ellos personal, con la posibilidad de ser éste reemplazado por la actuación del candidato como relator en Congresos, Jornadas o Mesas Redondas, por designación de la Sociedad Argentina de Urología, Asociación Civil, o por un trabajo realizado en equipo integrado por el miembro que opte a titular, el que deberá así comunicarlo con treinta días de anticipación a la Comisión Directiva, para que ésta designe un comentador del mismo. El referido trabajo deberá ser leído y defendido por el candidato y en carácter de primer autor; c5. Para solicitar su promoción a Miembro Titular, el aspirante presentará una solicitud escrita, acompañando a la misma una relación detallada de antecedentes, títulos y trabajos. A estos efectos, se abrirá un período de presentación, comprendido entre el uno y treinta de septiembre de cada año, el que se hará conocer a todos los socios adherentes; c6. Aprobada la solicitud por la Comisión Directiva, el candidato pasará a ser Miembro Titular de la Sociedad Argentina de Urología, Asociación Civil, con todos sus derechos y obligaciones, una vez aceptado por la Asamblea General. Facultad de Medicina de la Universidad de Buenos Aires Por Resolución 2126/02 del Consejo Directivo de la Facultad de Medicina se resuelve la figura de Docente Adscripto. Serán designados aquellos médicos que cursaron y aprobaron la totalidad de los módulos de los cursos de la formación pedagógica en Ciencias de la Salud y que hayan cumplimentado todos los requisitos de la Carrera Docente, aún los que completaron dicha Carrera en planes anteriores de estudios. Los interesados que lo deseen podrán recibir un certificado que acredite su condición de Docente Adscripto, debiendo solicitarlo por nota elevada al Señor Decano, mencionando la Resolución 2126/02 en Mesa de Entradas de la Facultad de Medicina. Rev. Arg. de Urol. · Vol. 70 (1) 2005 XIX Premio “Juan Agustín Pagano” Este premio se presenta en forma bienal, años impares; el correspondiente al año 2005 puede presentarse antes del 1º de octubre de 2005. El mismo versa específicamente sobre el tema: “Cirugía Urológica, en cualquiera de sus modalidades”. Premio “Presidente de la Sociedad Argentina de Urología” Se otorgará este Premio al mejor trabajo presentado en las Reuniones Científicas del año. P r e m i o “ D r. L u i s E . P a g l i e r e ” Este premio se presenta en forma anual, el correspondiente al año 2005 se podrá presentar antes del 1º de septiembre de 2005. Los respectivos reglamentos de estos premios se encuentran a su disposición en la Secretaría de la Sociedad Argentina de Urología. Premio Cooperación Art. 1) La Sociedad Argentina de Urología otorgará en forma bienal (años pares) el “PREMIO COOPERACIÓN” a la mejor presentación (trabajo cooperativo, libro, protocolo, programa educativo, proyecto telemático) desarrollado por un Sub-Comité de especialidades en el bienio concursado. Art. 2) El premio se instituirá en el año que coincida con la finalización del mandato bienal de los respectivos coordinadores de Sub-Comité, siendo el año de inicio el 2004. Art. 3) El premio consistirá en el otorgamiento de los diplomas que acrediten su mérito a cada miembro del Sub-Comité, que a criterio del coordinador, haya participado en el trabajo distinguido. Art. 4) El trabajo o proyecto deberá ser inédito, en el caso de una publicación (libro, pauta, trabajo) realizado en el ámbito de la Sociedad Argentina de Urología, se podrá tener en cuenta el año de su publicación. Art. 5) Los autores deberán ser miembros de la SAU en su totalidad y en cualquiera de sus categorías. Art. 6) Se considerarán inscriptos para concursar a todos los que antes del 1ro. de Diciembre del bienio correspondiente, XX sean presentados para tal fin a la Secretaria de la SAU, con la entrega de tres originales firmados por el Coordinador del SubComité y su secretario o quienes los reemplacen. Art. 7) El otorgamiento de premio lo hará un jurado de 3 (tres) miembros que serán el Presidente de la SAU del período en el cual se presentaron los trabajos a evaluar, quienes también ejercerá la presidencia del Jurado y los Presidentes correspondientes a los 2 (dos) períodos anteriores. Oficiará como primer Jurado suplente el Director del Comité de Especialidades con cargo vigente al cierre del concurso, y como ulteriores Jurados suplentes los Presidentes precedentes en orden cronológico. Art. 8) El Jurado tendrá un plazo de 60 días a partir de la recepción de los trabajos para expedirse debiendo reunirse por lo menos una vez antes de entregar su dictamen individual con los considerandos que evalúen su fallo. Quedará consagrado el trabajo que hubiera obtenido el dictamen individual favorable de la mayoría, 2 (dos) de los 3 (tres) Jurados. Art. 9) El premio adjudicado será entregado en la Sesión Pública Solemne del cambio de Autoridades de la SAU del año siguiente a su presentación. Art. 10) La Comisión Directiva de la SAU determinará la mejor forma de exponer el trabajo premiado, de acuerdo con su naturaleza y posibilidades (publicación, presentación en sesiones científica, etc.) quedando facultada para resolver cualquier cuestión relativa al premio y no prevista en el presente reglamento. Premio Presidente de la Sociedad Argentina de Urología Se hace entrega del Premio Presidente de la Sociedad Argentina de Urología 2004, que se adjudica al mejor trabajo seleccionado entre los presentados en las Reuniones Científica de la SAU, correspondiente al año 2004. En esta oportunidad fue distinguido el trabajo: “Adrenalectomía laparoscópica. Experiencia inicial”. Autores: Dres. Alberto M. Jurado; Martín A. Piana, Francisco P. J. Daels; Guillermo Gueglio; Antonio Agustín Villamil; Oscar Héctor Damia. Premio Cooperación (Bienio 2002-2004) Se hace entrega del Premio Cooperación de la Sociedad Argentina de Urología 2004, en forma bienal a la mejor presentación (trabajo cooperativo, libro, protocolo, programa educativo, proyecto telemático) desarrollado por un Subcomité de Especialidades en el bienio concursado. En esta oportunidad fue distinguido el “Subcomité de Disfunciones Sexuales” con el trabajo Cooperativo Multidisciplinario “II Consenso Argentino de Disfunción Eréctil y Sexualidad”. Colaboraron los Dres. Miguel A. Rivero, Amado J. Bechara, Guillermo Gueglio, Federico Zeller, Edgardo Becher, Adolfo Casabé, Claudio Terradas, Gustavo Alvarez, Raúl Belén, María Victoria Bertolino, Fernando Cenice, Germán Chéliz, Isidoro Davidzon, Claudia Viviana de Andrea, Martín de Loyola, Luis Finger, Ernesto Grasso, Marcelo Kobelinsky, Guillermo Lassalle, Manuel López Seoane, Osvaldo N. Mazza, Patricio Medel, Miguel S. Moisés, Adrián Momesso, Hugo M. Moviglia, Alberto Nagelberg, Carlos Nolazco, Malén Pijoan Molina, Marta Rajtman, Gastón Rey Valazcchi, Gustavo Rodríguez Baigorri, Luis Roletto, Claudio Rosenfeld, Fernando Urrutia, Carlos Vaamonde, José Vázquez, Lic. Josefina Lance. En la Reunión Solemne del 7 de abril de 2005 realizada en la Asociación Médica Argentina Se entregaron los diplomas a: Maestro Urólogo Dr. Alberto J. Claret Miembro Honorario Nacional Dr. Ernesto P. Mattos Miembro Correspondiente Nacional Dr. Antonio J. Rivarola Miembros Honorarios Extranjeros Dr. Octavio Castillo Cádiz Dr. Gustavo Malfatto Miembros Titulares Dr. Christian Héctor Cobreros Dr. Daniel Jorge Cóppola Dr. Norberto Omar Rodríguez Dr. Carlos Humberto Scorticati Dr. Diego Miguel Surur Dr. Claudio Marcial Terradas Dr. Antonio Wenceslao Villamil Rev. Arg. de Urol. · Vol. 70 (1) 2005 XXI Título de Especialista en Urología. Reglamento Título I Normas para solicitar el Título de Especialista en Urología. Artículo I - Son requisitos indispensables: a) Solicitud de inscripción. b) Presentar el título de médico expedido por una Universidad del país o extranjera, en este caso revalidado por organismo competente o fotocopia autenticada por Escribano o Perito Calígrafo. e) Acreditar condiciones ético-morales mediante el aval de dos Miembros Titulares de la Sociedad Argentina de Urología, que puedan ser consultados por la Comisión Evaluadora. Estos Miembros Titulares, deberán colocar en la solicitud de inscripción: nombre y apellido, domicilio, teléfono y su firma. d) Dedicación a la especialidad. e) Curriculum Vitæ, donde se hará constar preferencialmente sus antecedentes en la especialidad. El Curriculum Vitæ deberá confeccionarse de acuerdo con las pautas del modelo aprobado por la S.A.U. La Comisión Evaluadora, designada por el Comité Argentino de Urólogos, determinará el puntaje obtenido por el postulante conforme a los valores acordados y que estarán a disposición de los candidatos. 1) Postulantes con Residencia Completa cumplida y reconocida por la S.A.U: Certificado debidamente confeccionado de su finalización. 2) Postulantes con Título de Especialista, otorgados por otras Instituciones que tengan convenio de reciprocidad con la Sociedad Argentina de Urología. 3) Postulantes con Residencia Completa cumplida y No reconocida por la S.A.U: Certificado debidamente confeccionado de la residencia cumplida con la firma del Jefe de Servicio, Jefe del Departamento de Docencia e Investigación, si lo hubiere y del Director de la Institución. Deberá acompañar con carácter de Declaración Jurada una reseña de las actividades realizadas durante su residencia, especificando los siguientes puntos: horario semanal, guardias activas o pasivas, horarios de consultorio externo, intervenciones quirúrgicas (variedad y grado de complejidad) asistencia y presentación en Ateneos del Servicio y toda otra información de interés sobre la actividad desarrollada con la firma del postulante y del Jefe de Servicio. 4) Postulantes con cinco años de antigüedad como Concurrentes a un Servicio de la especialidad: certificado con carácter de Declaración Jurada de su concurrencia mínima de cinco años en forma regular y continua a un Servicio de Urología Universitario, Nacional, Municipal, Provincial, de las Fuerzas Armadas, de Seguridad, Bancario, Privados Reconocidos, de Colectividades, Ferroviario Central, Penitenciario Nacional. Dicho certificado deberá estar firmado por el Jefe de Servicio, el Jefe del Departamento de Docencia e Investigación si lo hubiere y por el Director de la Institución. Deberá acompañar con carácter de Declaración Jurada y firmada por el Postulante y el Jefe de Servicio una reseña de sus actividades desarrolladas durante sus cinco años de concurrencia: horario semanal, guardias activas o pasivas, horarios de consultorio externo, reseña de intervenciones quirúrgicas realizadas (variedad y grado de complejidad) acompañando fotocopia de diez protocolos quirúrgicos firmados por el Postulante y el Jefe de Servicio, asistencia y presentación en Ateneos del Servicio y toda otra información de interés sobre la actividad desarrollada. Además deberá presentar un detalle de las características del Servicio de su concurrencia con carácter de Declaración Jurada firmada por el Postulante y Jefe del Servicio: número de camas, número de consultas externas por año, número de intervenciones quirúrgicas anuales, aparatología de la especialidad con que cuenta el Servicio. Toda la documentación antes mencionada deberá obrar en manos del Comité, indefectiblemente, antes de los treinta días de la fecha establecida para la evaluación, para su análisis y aprobación. XXII Título II Artículo 1 - La evaluación se efectuará a los postulantes cuyos requisitos anteriores hayan sido debidamente cumplimentados a juicio del Comité y consistirá en una entrevista y prueba escrita y en caso de duda a juicio del Comité, un examen oral. Artículo 2 - Los resultados serán comunicados por escrito a los postulantes por la Comisión Directiva de la Sociedad Argentina de Urología y los mismos serán inapelables. Artículo 3 - Los postulantes podrán solicitar copia del Acta de Examen. Artículo 4 - Los postulantes deberán abonar un arancel que la Sociedad Argentina de Urología establecerá cada año. Artículo 5 - El postulante que no apruebe el examen podrá volver a rendirlo el año siguiente. La Comisión Evaluadora aconsejará a éste las rotaciones por determinadas subespecialidades para completar su formación. Título III Artículo 1 - Se establecen tres categorías de especialistas: Especialista en Urología, Especialista Jerarquizado en Urología y Especialista Consultor en Urología. Para acceder a estos títulos se deberán alcanzar: treinta (30) puntos para el título de Especialista en Urología, cien (100) puntos para el título de Especialista en Urología Jerarquizado y doscientos (200) puntos para el título de Especialista Consultor en Urología, en todos los casos deberán aprobar la evaluación indicada en el artículo 1 del Título II. Artículo 2 - Al cumplir los diez años de su iniciación en la especialidad, el postulante podrá presentarse a una nueva evaluación para obtener el título de Especialista Jerarquizado en Urología, a los veinte años de iniciación en la especialidad podrá presentarse a nueva evaluación para obtener el título de Especialista Consultor en Urología. Artículo 3 - El postulante para obtener el título de Especialista Jerarquizado o Consultor, además de la solicitud deberá presentar un Curriculum Vitæ actualizado, cuyo puntaje será evaluado. Artículo 4 - Los profesores Titulares, Adjuntos, Docentes Autorizados de las Universidades estatales o privadas reconocidas, deberán presentar la solicitud y el Curriculum Vitæ, siendo eximidos del examen evaluatorio. La Comisión Evaluadora determinará la categoría a otorgarse. Artículo 5 - Los Jefes de Servicio de Urología reconocidos por los Ministerios de Salud y Medio Ambiente y/o por la Comisión Evaluadora de la Sociedad Argentina de Urología serán equiparados en sus derechos a lo establecido en el art. 4 precedente. Artículo 6 - El urólogo que posea el título de Especialista otorgado por entidades médicas o Sociedades Científicas que tengan reciprocidad con la Sociedad Argentina de Urología serán equiparados en sus derechos a lo establecido en el art. 4 precedente. Igualmente lo serán quienes posean título otorgado por una Institución reconocida mundialmente. Título IV Artículo 1 - La Comisión Directiva de la Sociedad Argentina de Urología fijará las fechas de evaluación. Artículo 22 - La Comisión Evaluadora será designada por el Comité del Colegio Argentino de Urólogos, y contará además con un veedor del Consejo de Certificación de Profesionales Médicos, tal como lo prevee el convenio oportunamente firmado por la Sociedad Argentina de Urología y ese Consejo de Certificación. Rev. Arg. de Urol. · Vol. 70 (1) 2005 XXIII Artículo 3 - El Comité del Colegio Argentino de Urólogos elevará a la Comisión Directiva de la Sociedad Argentina de Urología, los resultados de las evaluaciones correspondientes, para su posterior comunicación a los postulantes. Artículo 4 - La Comisión Directiva de la Sociedad Argentina de Urología elevará a las autoridades del Ministerio de Salud y Ambiente la nómina de los especialistas que hayan aprobado el examen, a los fines de que se les expida la correspondiente certificación. Artículo 5 - La Comisión Directiva de la Sociedad Argentina de Urología elevará al Consejo de Certificación de Profesionales Médicos, auspiciado por la Academia Nacional de Medicina la mencionada nómina de especialistas, a los fines de que se tome nota de la misma. REQUISITOS: Fecha de presentación: hasta el 31 de marzo de 2005. – Curriculum Vitæ confeccionado de acuerdo con el modelo aprobado por la Sociedad Argentina de Urología. – El Curriculum Vitæ debe acompañarse por una copia en diskette alta densidad (3.5”) en formato de Word for Windows (no se aceptarán otros lenguajes). El Curriculum presentado en soporte papel será devuelto una vez finalizada la evaluación. – La fotocopia del Título de Médico deberá estar autenticada por Escribano Público. – No se aceptarán solicitudes que no cumplan estrictamente los requisitos estatutarios. – El formulario correspondiente deberá solicitarse en la Secretaría de la S.A.U. – Recertificación: Se recuerda que debe realizarse cada 5 (cinco años). Si bien la actualización es voluntaria, se recomienda a los señores profesionales cumplir con ella. Los interesados deberán solicitar la recertificación por escrito, avalando su presentación con la firma de dos Socios Titulares de la Sociedad Argentina de Urología y presentando Curriculum Vitæ actualizado con la correspondiente copia en diskette. – El formulario correspondiente deberá solicitarse en la Secretaría de la S.A.U. Forma de presentación Curriculum Vitæ ANTECEDENTES, TÍTULOS Y TRABAJOS PROPUESTA DE ORDENAMIENTO DE LA S.A.U. Índice: IDENTIFICACIÓN: 1) Títulos XXIV DATOS PERSONALES a) Universitarios b) No Universitarios 2) Actividad Docente a) Carrera Docente b) Cargos Desempeñados c) Cargos Actuales d) Otros 3) Actividad Asistencial a) Cargos Pregrado b) Cargos Postgrado e) Cargos Actuales d) Otros 4) Cursos de perfeccionamiento a) Asistente b) Relator/Coordinador e) Cargos Administrativos d) Otros 5) Congresos/Jornadas/Simposios a) Asistente b) Relator/Coordinador e) Cargos Administrativos d) Otros 6) Publicaciones a) Libros/Capítulos b) Tesis c) Trabajos d) Otros 7) Sociedades Científicas a) Miembro b) Cargos Desempeñados e) Cargos Actuales d) Otros 8) Premios/Becas/Subsidios 9) Otros elementos de juicio que se consideren valiosos Soporte magnético: diskette alta densidad 3.5” en formato Word for Windows (no se aceptarán otros lenguajes). Cuotas sociales atrasadas La Sociedad Argentina de Urología pretende brindar cada vez más y mejores servicios a sus miembros. Para ello, obviamente se requiere contar con los medios económicos necesarios, gran parte de los cuales provienen del pago en término de la cuota social por parte de todos los socios. La morosidad que se registra se debe muchas veces -nos consta- a olvidos involuntarios o a dificultades postales. Por ello, rogamos a todos los que se encuentran en situación de morosidad, que normalicen su situación para que podamos continuar con los servicios de los cuales la remisión gratuita de la revista es un ejemplo. Transcribimos a continuación el texto del artículo 14 de nuestros Estatutos: “Los Miembros, cualesquiera sea su categoría, perderán su condición de tales por: a) Renuncia. b) Cancelación de título. c) Cesantía por falta de pago de una anualidad. Para recuperar la categoría deberán depositar previamente en Tesorería la suma adeudada desde su separación hasta la fecha de reincorporación, al valor actualizado de la cuota social”. Informes: Secretaría S.A.U. 4963-8521/4336/4337 de 12 a 20 horas. e-mail: [email protected] Ta r j e t a s d e c r é d i t o La SAU ha efectuado contrato con las tarjetas de Crédito: Visa, Mastercard y Cabal para facilitar el cobro por débito automático de la cuota societaria respectiva. El asociado que acepte esta forma de pago deberá elevar la autorización correspondiente, además se puede abonar con cheque o giro postal a Sociedad Argentina de Urología. Efectuar transferencia bancaria a nuestra Cuenta Corriente Nº 96.223/74, CBU. 0110012920000096223741, Cuit 30-63697274-2, Sucursal Congreso, a Sociedad Argentina de Urología, enviando fotocopia del depósito por fax a nuestra Secretaría. Rev. Arg. de Urol. · Vol. 70 (1) 2005 XXV Centro de autorización de medicamentos oncológicos Se recuerda a los colegas urólogos que para los pacientes con cáncer de próstata sólo se autorizarán las recetas de aquellos pacientes con anatomía patológica e informe del médico urólogo con estudios que documenten el estadio o la razón por la que se inicia el bloqueo hormonal. Además, a fin de evitar el rechazo de recetas se solicita que en forma periódica, cada tres meses, se envíe junto con la receta un informe con la evolución del paciente y el PSA. Residencias Se invita a los Jefes de Servicio que tengan Residencias en Urología, que aún no lo hayan hecho a solicitar la Acreditación de las mismas a la S.A.U. La acreditación facilitará los trámites para la obtención del Titulo de Especialista y habilitará a los Residentes para solicitar la inscripción en la Carrera de Urólogo Universitario. Solicitar información en la Secretaría de la S.A.U. Comité de Residencias en Urología - Sociedad Argentina de Urología Residencias acreditadas por la Sociedad Argentina de Urología • • • • • • • • • • • • • • • XXVI Hospital de Clínicas Gral. San Martín Instituto Emergentología Integral Antártida Hospital Italiano Hospital Francés Hospital Británico Hospital Durand Hospital Alemán Hospital de la Comunidad Mar del Plata Policlínica Bancaria Hospital Churruca Visca Hospital Argerich Hospital Ramos Mejía Hospital Posadas Hospital Aeronáutico Central Hospital Tornú FICHA DE SUSCRIPCIÓN 2005 4 NÚMEROS ANUALES Revista Argentina de UROLOGIA Exclusivamente para no socios de la SAU Enviar ficha de suscripción a: SOCIEDAD ARGENTINA DE UROLOGÍA Pasaje de la Cárcova 3526, (1172), Buenos Aires, Argentina IMPORTE DE LA SUSCRIPCIÓN ANUAL Argentina $40. Latinoamérica u$s 80. Otros países u$s 100. DIRECCIÓN DE ENVÍO: Nombre y Apellido: ............................................................................................................................ Dirección: ........................................................................Nº: .................... Piso: ............................ Código Postal: .......................... Provincia: .............................................. País ............................ Tel: ............................................ Fax: .................................. Mail: .................................................. Especialidad: .................................................................................................................................... Departamento: .................................................................................................................................. Hospital: .......................................................................................................................................... FORMA DE PAGO: Cheque Nº: .............................................................. Banco: .................................................. Giro Postal Nº: ............................................................................................................................ ✃ ........................................................................................................................................................ Firma del Titular DOBLAR Remitente: .......................................................................................................................... Dirección: .......................................................................................................................... C.P.: ........................ Ciudad: ............................................................................................ País: .................................................................................................................................... DOBLAR Pasaje de la Cárcova 3526, (1172), Buenos Aires, Argentina SOCIEDAD ARGENTINA DE UROLOGÍA REVISTA ARGENTINA DE UROLOGÍA Sr. Director de la FRANQUEO