CETis 91 BIOQUIMICA KENIA RODRIGUEZ HERNANDEZ 6°H
Anuncio

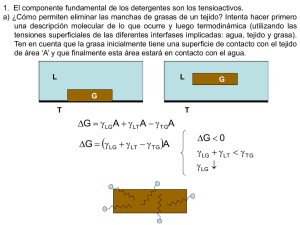
CETis 91 BIOQUIMICA KENIA RODRIGUEZ HERNANDEZ 6°H Nanthza Hgo a 03 de Junio del 2010 BIOQUIMICA DEL AGUA ¿QUE ES EL AGUA? El agua (del latín aqua) es una sustancia cuya molécula está formada por dos átomos de hidrógeno y uno de oxígeno (H2O). Es esencial para la supervivencia de todas las formas conocidas de vida. El agua es una sustancia que químicamente se formula como H2O; es decir, que una molécula de agua se compone de dos átomos de hidrógeno enlazados covalentemente a un átomo de oxígeno METABOLISMO DEL AGUA Al nacimiento constituye el 79% del peso corporal Al año de edad 60% (mantendiendose esta proporción hasta la edad adulta. Del agua corporal total: -Músculos….50% -Piel………..20% -Sangre……..10% -Otros ……...20% AGUA CORPORAL TOTAL AGUA EXTRACELULAR AGUA INTRACELULAR AGUA INTERSTICIAL T H H U E U ES SO O E J I D O C O N E C T O T R O S L I Q U I D O S I I N T E R S I T I C I A L E S P L A S M A A G U A T R A N C E L U L A R V O 0 5 10 15 20 25 30 35 40 45 50 55 AGUA INTRACELULAR 30-40% del peso corporal total (330 ml/kg en el adulto) Sus limites están dados por la membrana celular la cual tiene permeabilidad selectiva. Regulación del equilibrio hídrico Dada fundamentalmente por : -La sed -Liberación de hormona antidiurética o vasopresina. *Estos mecanismos regulan la relación entre solutos y agua (osmolaridad de los líquidos) PROPIEDADES FISICOQUIMICAS El agua es insípida e inodora en condiciones normales de presión y temperatura. El color del agua varía según su estado: como líquido, puede parecer incolora en pequeñas cantidades, aunque en el espectrógrafo se prueba que tiene un ligero tono azul verdoso. El hielo también tiende al azul y en estado gaseoso (vapor de agua) es incolora El agua bloquea sólo ligeramente la radiación solar UV fuerte, permitiendo que las plantas acuáticas absorban su energía. La fuerza de interacción de la tensión superficial del agua es la fuerza de van der Waals entre moléculas de agua. La aparente elasticidad causada por la tensión superficial explica la formación de ondas capilares. A presión constante, el índice de tensión superficial del agua disminuye al aumentar su temperatura.12 También tiene un alto valor adhesivo gracias a su naturaleza polar La capilaridad se refiere a la tendencia del agua de moverse por un tubo estrecho en contra de la fuerza de la gravedad. Esta propiedad es aprovechada por todas las plantas vasculares, como los árboles. Propiedades Coligativas (en Disolución) Propiedades que dependen únicamente de la cantidad (concentración) de soluto añadida (moles o moléculas de soluto), pero no de su naturaleza (de qué soluto sea). Es decir el soluto modifica propiedades del disolvente Dependen del número de partículas disueltas La temperatura de ebullición aumenta Desciende temperatura de congelación. Disminución de la presión de vapor. Se eleva la presión osmótica El agua tiene el segundo índice más alto de capacidad calorífica específica —sólo por detrás del amoníaco así como una elevada entalpía de vaporización (40.65 kJ mol-1); ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía APLICACIONES QUIMICAS Las reacciones orgánicas generalmente se templan con agua o con una solución acuosa que puede estar compuesta por ácido, por una base o por un tampón químico. El agua es generalmente eficaz para eliminar sales inorgánicas. En las reacciones inorgánicas el agua es un solvente común, debido a que no disuelve los reactivos en su totalidad, también es anfótera (puede reaccionar en su estado ácido y base) y nucleófila. Sin embargo, estas propiedades a veces son deseadas. También se ha observado que el agua causa una aceleración en la reacción de Diels-Alder. Los fluidos supercríticos están siendo investigados en la actualidad, ya que el agua supercrítica (saturada en oxígeno) hace combustión en los contaminantes de manera eficiente.