Tendencias actuales en el tratamiento y seguimiento
Anuncio

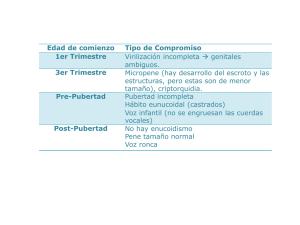
SAP. Subcomisiones, Comités y Grupos de Trabajo Arch Argent Pediatr 2009; 107(2):176-180 / 176 Tendencias actuales en el tratamiento y seguimiento de la criptorquidia Cryptorchidism: current tendences about treatment and follow up Comité Nacional de Endocrinología* INTRODUCCIÓN En el año 2001, el Comité Nacional de Endocrinología de la Sociedad Argentina de Pediatría publicó en Archivos Argentinos de Pediatría sus “Recomendaciones para el diagnóstico y tratamiento de la criptorquidia”.1 En los años siguientes, se profundizó la discusión en foros internacionales acerca de cuál es el tratamiento óptimo para esta entidad en la edad pediátrica. En algunos lugares de Europa2 y en EE.UU. se recomendaba el tratamiento antes de los 2 años de edad, mientras que en otros se prefería realizarlo entre los 2 y 4 años. Esto motivó que se realizara en Escandinavia, en el año 2006, un encuentro entre expertos pediátricos nórdicos (endocrinólogos, urólogos, patólogos, anestesistas y fisiólogos testiculares) cuyas conclusiones fueron publicadas en un número especial de Acta Pædiatrica.3 Actualmente, en nuestro país, los diferentes centros reconocidos adoptan también distintos modos y tiempos de tratamiento en el niño con criptorquidia. Tal situación motivó a este Comité a realizar un análisis crítico de la bibliografía, a invitar a un grupo de especialistas nacionales en el tema para su discusión y a elaborar un documento con acuerdos locales. Antes de exponer dicho documento, se efectúa un breve repaso de algunos conceptos relacionados con el tema. ESTADO ACTUAL DEL CONOCIMIENTO Etiopatogenia de la criptorquidia El testículo se desarrolla a partir de una gónada indiferenciada desde la sexta semana de gestación. El descenso a su posición definitiva en el escroto se produce en dos fases: transabdominal e inguinoescrotal. 1ª fase (transabdominal): Los testículos se deslizan sobre los conductos genitales, quedan enclavados caudalmente por el ligamento gubernáculo, junto con el epidídimo e ingresan en el anillo inguinal interno. Esta fase se completa en la semana 15ta de la gestación y es dependiente princi- * Comité Nacional de Endocrinología: Dra. Mirta Gryngarten, Dra. Viviana R. Pipman, Dra. María Eugenia Escobar, Dra. Titania Pasqualini, Dra. Sonia V Bengolea, Dra. Elizabeth Boulgourdjian, Dr. Miguel Blanco y Dr. Guillermo Alonso. Coordinadoras: Dra. Mirta Gryngarten y Dra. Viviana Pipman. Expertos invitados: Endocrinólogos Pediátricos: Dra. Silvia Gottlieb (Hospital de Correspondencia: Niños “Dr. Ricardo Gutiérrez”); Dr. Rodolfo Rey (Hospital de Niños “Dr. Ricardo Dra. Viviana Pipman [email protected] Gutiérrez”); Dra. Verónica Gacitúa Figueroa (Hospital de Niños “Dr. Pedro de Elizalde”); Dra. Elisa Vaiani (Hospital Nacional de Pediatría “Prof. Dr. Juan P. Garrahan) y Dra. Conflicto de intereses: Mirta Stivel (Hospital Durand). Endocrinólogo Adultos: Dr. Pablo Knoblovits (Hospital Nada que declarar Italiano BA); Cirujanos Pediátricos: Dr. Luis Zuccardi (Hospital de Niños “Dr. Ricardo Recibido: 16-12-08 Gutiérrez”); Dr. Francisco De Badiola (Hospital Italiano BA); Dr. Juan Moldes (Hospital Aceptado: 16-12-08 Italiano BA); Dr. Enrique Denes (Hospital de Niños “Dr. Pedro de Elizalde”). Tendencias actuales en el tratamiento y seguimiento de la criptorquidia / 177 palmente del factor insulino simil 3 (INSL3), secretado por las células de Leydig fetales en la semana 9, que actúa a nivel de su receptor RXFP2 e induce el desarrollo masculino del gubernáculo. Los andrógenos tienen un papel menor: gatillan la regresión del ligamento suspensorio craneal.4,5 2ª fase inguinoescrotal: El testículo es guiado por el ligamento gubernáculo desde el área inguinal al escroto. Esta fase, que se completa al final de la semana 35, es altamente dependiente de andrógenos y, en parte, de otros factores anatómicos.4,5 Frecuentemente, la criptorquidia se debe a anormalidades anatómicas en la fase inguinoescrotal del descenso testicular. La fase transabdominal está raramente alterada, y sólo cerca de un 5% de los testículos no descendidos operados se hallan en posición intrabdominal.4,5 Las causas genéticas de criptorquidia pueden estar relacionadas a alteraciones cromosómicas (síndrome de Klinefelter) o a mutaciones en los genes INSL3/RXFP2 o receptor de andrógenos. Se halló una asociación significativa entre causa genética y criptorquidia persistente y bilateral.6 Definición de criptorquidia La criptorquidia representa la forma más común de trastorno endocrino en los varones. Se define como la falta de descenso al escroto de uno (criptorquidia unilateral) o de ambos testículos (criptorquidia bilateral). La criptorquidia puede estar presente en forma aislada o asociada a alteraciones de la diferenciación sexual, enfermedades endocrinas y cuadros malformativos o genéticos. El testículo criptórquido puede estar situado a lo largo de su trayecto habitual de descenso, ya sea intraabdominal, en el canal inguinal o en la raíz del escroto, o fuera del trayecto, en una posición ectópica, como, por ejemplo, el testículo subcutáneo. Testículos no descendidos congénitos: Están fuera del escroto desde el nacimiento, pueden ser palpables, o no palpables por su localización intraabdominal, o bien estar ausentes. Testículos no descendidos adquiridos: Son los testículos que descienden durante el primer año de vida y luego reascienden. Con el crecimiento somático del niño, el cordón permanece corto y retrae el testículo. El 40% de los testículos criptórquidos al nacimiento que bajan espontáneamente reascienden7 y pueden requerir tratamiento quirúrgico a los 5-10 años de edad. Por lo tanto, en estos pacientes se debe controlar la ubicación testicular hasta la pubertad. El testículo retráctil: Representa una variante normal de la posición testicular, resultante de un reflejo cremasteriano exagerado.8 (Este reflejo está ausente en el primer año de vida y se exacerba alrededor de los 6 años). Resultado satisfactorio del tratamiento El objetivo del tratamiento de la criptorquidia es permitir una adecuada semiología de la gónada, preservar la fertilidad y disminuir el riesgo de cáncer testicular. Estos resultados son, por lo general, incompletamente evaluados en las publicaciones ya que las casuísticas son reducidas o el tiempo de seguimiento insuficiente y habitualmente consideran otros resultados como expresión de tratamiento exitoso. Resultado anatómico satisfactorio: Se define como la localización y persistencia del testículo en el escroto sin atrofia obvia. Resultado funcional satisfactorio: Se define como el logro de una adecuada espermatogénesis y fertilidad futura. El seguimiento de los pacientes pediátricos a largo plazo, para evaluar la fertilidad, es dificultoso. Prevención de cáncer testicular: Se la valora por la disminución del riesgo de cáncer. La criptorquidia se asocia con 4-5 veces mayor riesgo de cáncer testicular. Estas observaciones indican, palmariamente, que en la mayoría de los casos la criptorquidia es causada por una alteración primaria del desarrollo testicular que ya ocurre in útero.3 De hecho, la criptorquidia de causa genética, con mayor frecuencia bilateral, también se asocia a daño testicular progresivo (aun en el testículo escrotal en caso de ser unilateral), con mayor riesgo de infertilidad y cáncer testicular. Por otro lado, el porcentaje de cáncer testicular atribuíble a criptorquidia es de sólo el 5%. Este riesgo es mayor en los pacientes con criptorquidia bilateral y disminuye en aquellos con criptorquidia unilateral, con criptorquidia adquirida operada entre los 8-11 años o en aquellos con descenso testicular espontáneo.8 Discusión con los expertos La construcción de este documento se basó en la discusión de preguntas que intentan considerar los aspectos más polémicos: 1. ¿Cuál es la edad óptima para el tratamiento médico o quirúrgico? La prevalencia de la criptorquidia oscila en 28% al nacimiento. La criptorquidia congénita puede resolverse espontáneamente y el descenso ocurre, por lo general, durante los primeros meses de vida, en coincidencia con la activación del eje 178 / Arch Argent Pediatr 2009;107(2):176-180 / Subcomisiones, Comités y Grupos de Trabajo hipotalamohipofisogonadal. Por lo tanto, se describe una prevalencia menor, de 1-2% entre los 3 y 12 meses de vida7, 0,8-1,2% al año de edad.1 Estos datos motivan la sugerencia de una conducta expectante los primeros 6 meses de vida, luego de los cuales debería realizarse una valoración clínica precisa con el objetivo de definir posición y tamaño del testículo criptórquido. Asimismo, sería conveniente valorar la función testicular con dosaje de gonadotrofinas, testosterona, hormona antimülleriana e inhibina B. Estos datos permitirían seleccionar a aquellos pacientes en los que el tratamiento hormonal tendría más posibilidades de resultado satisfactorio (testículos con adecuado volumen, de localización en el canal inguinal, próximo al orificio inguinal externo y apropiada funcionalidad hormonal). Muchas publicaciones subrayan que la localización escrotal del testículo permitiría una adecuada transformación de gonocitos a espermatogonias tempranas,9,10 evidenciado por mayor volumen testicular o patrones histológicos, y sugieren el beneficio de la resolución quirúrgica en edades tempranas. Sin embargo, los efectos de esta conducta sobre la fertilidad no han sido comprobados. Los adelantos en la anestesiología pediátrica, la mejor tolerancia al procedimiento en niños menores y el desarrollo de instrumental apropiado que facilita la técnica quirúrgica junto con un menor impacto psicológico en el niño y los padres, ha llevado a muchos cirujanos expertos a recomendar la resolución quirúrgica antes de los dos años de vida. 2. ¿Tiene indicación actual el tratamiento con gonadotrofina coriónica humana (hCG)? La eficacia del tratamiento hormonal es variable, con tasas de éxito de 0-55% (hCG) y 9-78% (factor liberador de gonadotrofinas [GnRH]).11 Pyorala y col.12 revisaron 33 estudios publicados entre 1975 y 1990, y analizaron en un metanálisis 9 trabajos aleatorizados disponibles. La terapia con GnRH fue efectiva (posición escrotal del testículo) en 21%, con hCG 19% y con placebo 4%. Esta tasa de éxito de tratamiento es menor si se excluyen los pacientes con testículos retráctiles. Cuando el análisis considera la posición del testículo antes del tratamiento, el éxito es mayor cuando la posición es más caudal. En otro metanálisis,13 que incluye trabajos hasta 2003, se concluyó que hCG fue eficaz en 25% y GnRH en 18%. Los autores puntualizan que los trabajos exhiben muestras pequeñas, poco poder estadístico y que en ninguno de ellos se describe el método de aleatorización. Ong y col.,14 que resumen trabajos aleatorizados y no aleatorizados publicados entre 1991 y 2003, alcanzan conclusiones similares a las de Pyorala.11 En cuatro de estos trabajos analizados se sugiere una tasa de éxito mayor cuando la criptorquidia es bilateral. Además, se destaca el reascenso en el 25% de aquellos testículos criptórquidos que descienden con tratamiento hormonal. En nuestro país, Gottlieb y col.,15,16 en una revisión retrospectiva de registros clínicos de alrededor de 2.100 pacientes de un centro endocrinológico de referencia, observaron descenso testicular con hCG en 30-40% de los casos, directamente relacionado con la posición inicial del testículo. Los estudios que valoran el beneficio a largo plazo del tratamiento hormonal son escasos. Richter y col. analizan 121 pacientes tratados hormonalmente. En 39% encontraron recuento espermático normal; infertilidad en 18% de los pacientes con criptorquidia unilateral y en 25% de aquellos con criptorquidia bilateral.17 En la criptorquidia congénita, especialmente en pacientes prematuros, un porcentaje de testículos presenta descenso espontáneo en el primer semestre de la vida en relación con la activación fisiológica del eje hipotalamohipofisogonadal en esa etapa, por tal razón, la valoración de la presencia o no de testículos en el escroto en el recién nacido, seguida de una nueva valoración clínica alrededor del año de edad, permitiría definir: 1) si se produjo descenso testicular espontáneo y 2) la posibilidad de éxito del tratamiento hormonal. En nuestra reunión con expertos nacionales se opinó que la tasa de éxito anatómico depende de la localización y capacidad de respuesta del testículo criptórquido al estímulo hormonal. Una valoración apropiada del paciente permitiría seleccionar a aquellos en los que este tratamiento sería efectivo. Los protocolos de administración de hCG descriptos en la bibliografía son variables. Dada la forma de presentación comercial de esta hormona en nuestro país, se podría utilizar un esquema que incluya la administración vía intramuscular de 2.500 o 5.000 Unidades Internacionales según la edad del paciente, repartidas en 5 semanas consecutivas. 3. ¿Daña la hCG? En los últimos años ha surgido preocupación debido a estudios que refieren apoptosis de células germinales y cambios inflamatorios en biopsias testiculares de pacientes tratados previamente con hCG y en modelos animales, y disminución del número de células germinales y volumen testicular Tendencias actuales en el tratamiento y seguimiento de la criptorquidia / 179 en pacientes adultos. Basándose en tres trabajos previos,18-20 el Consenso Nórdico para el tratamiento de la criptorquidia no recomienda el uso de hCG, en general, para el tratamiento de esta entidad.3,21 De todos modos, en estos trabajos no se demuestra que esos cambios sean deletéreos sobre el número de espermatozoides en el semen ni aclaran el significado biológico del fenómeno apoptótico. El diseño de estos trabajos es cuestionable por cuanto no se trata de trabajos aleatorizados y el método de recuento de células germinales por sección transversal del túbulo es discutible. Demirbilek22 demostró cambios inflamatorios y vasculares en biopsias testiculares de pacientes operados recientemente tratados con hCG, aunque esos cambios fueron transitorios. Otros efectos adversos conocidos del tratamiento hormonal son los producidos por el aumento de la testosterona que llega a niveles puberales (efectos androgénicos),11 como erecciones, cambios de conducta, crecimiento peneano, que revierten al finalizar el tratamiento. 4. ¿Tiene la hCG indicación prequirúrgica para mejorar los resultados de la cirugía? La utilización de hCG antes de la cirugía se ha utilizado durante mucho tiempo. Los beneficios referidos para esta conducta se basan en el aumento de la elasticidad de estructuras vasculares y en la elongación del cordón espermático. El uso creciente de la laparoscopia que permite una mayor magnificación óptica, así como la utilización de material más delicado ha hecho que la atrofia postquirúrgica sea una complicación extremadamente infrecuente en manos de un cirujano o urólogo pediatra entrenado. Por otro lado, no existen trabajos en la bibliografía que destaquen el beneficio de administrar hCG previo a la orquidopexia, por lo cual, en esta Reunión de Expertos, no se sugiere su utilización en esta circunstancia. CONCLUSIONES Y RECOMENDACIONES FINALES 1. El recién nacido debe ser evaluado por el neonatólogo para definir si los testículos están o no presentes en el escroto. 2. El niño con criptorquidia unilateral o bilateral aislada o asociada a otros trastornos del desarrollo sexual debe ser evaluado en forma temprana, tanto anatómicamente como funcionalmente, por un médico experto. 3. El tratamiento debe diferirse hasta por lo menos los 12 meses considerando la posibilidad de descenso espontáneo del testículo al escroto. 4. En pacientes cuidadosamente seleccionados, puede utilizarse como tratamiento inicial hCG. 5. Aquellos pacientes que no sean pasibles de tratamiento hormonal deben referirse tempranamente al cirujano o urólogo pediatra entrenado. 6. La corrección quirúrgica antes de los 2 años de vida, si bien no es obligada, es recomendable. 7. La utilización de hCG previa a la cirugía, a fin de facilitar el acto quirúrgico, no está indicada. 8. El seguimiento de los niños con alteraciones del descenso testicular, con especial énfasis en la revaloración del volumen y función hormonal gonadal, debe ser realizada por pediatras endocrinólogos. ! BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Comité Nacional de Endocrinología. Recomendaciones para el diagnóstico y tratamiento de la criptorquidia. Arch Argent Pediatr 2001; 99(4):372-374. Hadziselimovic F, Herzog B, Seguchi H. Surgical correction of cryptorchism at 2 years: electron microscopic an morphometric investigations. J Pediatr Surg 1975; 10(1):19-26. Ritzén EM, Bergh A, Bierknes R, et al. Nordic consensus on treatment of undescended testes. Acta Paediatr 2007; 96(5):638-643. Virtanen HE, Cortes D, Rajpert-De Meyts E, et al. Development and descent of the testis in relation to cryptorchidism. Acta Paediatr 2007; 96(5):622-627. Hutson J. Treatment of undescended testes-time for a change in European traditions. Acta Paediatr 2007; 96:608-610. Ferlin A, Zuccarello D, Zuccarello B, et al. Genetic alterations associated with cryptorchidism. JAMA 2008; 300(19): 2271-6. Thorup J, Haugen S, Kallin C, et al. Surgical treatment of undescended testes. Acta Paediatr 2007; (96):631-637. Virtanen H, Bierknes R, Cortes D, et al. Cryptorchidism: classification, prevalence and long-term consequences. Acta Pediatr 2007; 86(5):611-616. Hadziselimovic F, Burckhard H, Herzog B, Buser M. Infertility in cryptorchidism is linked to the stage of germ cell development at orchidopexy. Horm Res 2007; 68:46-52. Hadsiselimovic F, Zivkovic D, Bica DT, Emmons LR. The importance of mini-puberty for fertility in cryptorchidism. J Urol 2005; 174(4 Pt2):1536-9. Thorsson A, Christiansen P, Ritzen M. Efficacy and safety of hormonal treatment of cryptorchidism. Current state of the art. Acta Paediatr 2007; 96:628-630. Pyorala S, Huttnen NP, Uhari M. A review and metaanalysis of hormonal treatment of cryptorchidism. J Clin Endocrinol Metabol 1995; 80:2795-2799. Henna MR, Del Nero R, Sampaio C, et al. Hormonal cryptorchidism therapy: systematic review with metaanalysis of randomized clinical trials. Pediatr Sur Int 2004; 20:357-359. Ong C, Hasthorpe S, Hutson JM. Germ cell development in the descended and cryptorchid testis and the effects of hormonal manipulation. Pediatr Sug Int 2005; 21:240-245. Gottlieb S, Chemes H, Bergadá C. Criptorquidia en la infancia y la adolescencia. Rev Hosp Niños (B. Aires) 1994; 36(157):115-121. Gottlieb S, Bergadá C. Criptorquidia en infancia y adoles- 180 / Arch Argent Pediatr 2009;107(2):176-180 / Subcomisiones, Comités y Grupos de Trabajo cencia. En: Levalle OA (ed.): Andrología, Fisiopatología y Clínica. Biblioteca Médica Digital en CD-ROM. Buenos Aires: Asociación Médica Argentina; 2002. 17. Richter W, Pröschold M, Butenandt O, Knorr D. Fertility after treatment with hCG for undescended testes. Klin Wochenschr 1976; 54:467-473. 18. Dunkel L, Taskinen S, Hovatta O, et al. Germ cell apoptosis after treatment of cryptorchidism with human chorionic gonadotropin is associated with impared reproductive function in the adult. J Clin Invest 1997; 100:2341-2346. 19. Cortes D, Thorup J, Visfeldt J. Hormonal treatment may harm the germ cells in 1 to 3 year-old boys with cryptorchidism. J Urol 2000; 163:1290-1292. 20. Heiskanen P, Billig H, Toppari J, et al. Apoptotic cell death in the normal and cryptorchid human testis: the effect of human chorionic gonadotropin on testicular cell survival. Pediatr Res 1996; 40:351-356. 21. Hadziselimovic F, Zivkovic D. Is the prohibition of hormonal treatment for cryptorchidism, as suggested by the Nordic consensus group, justifiable? Acta Pædiatr 2007; 96:1368-1379. 22. Dermirbilek S, Atayurt H, Çelik N, Aydin G. Does treatment with human chorionic gonadotropin induce reversibles changes in undescended testes in boys? Pediatr Surg Int 1997; 12:591-594.