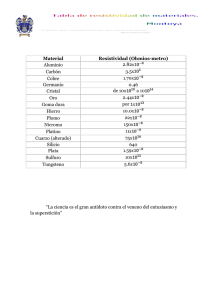
Br. Colmenares M. Rafael A.
Anuncio

Universidad de Los Andes Facultad de Ciencias Departamento de Química Laboratorio de Espectroscopia Molecular Trabajo Especial de Grado Desarrollo de un método analítico para la determinación de Platino, en muestras de suero sanguíneo, tomado en pacientes con cáncer que reciben quimioterapia a base de cis-dichlorodiamine de platino (II) (cisplatino), por Espectroscopia de Absorción Atómica con Atomización Electrotérmica. Br. Rafael Alexander Colmenares Molina Tutor: Dr. Carlos Rondón MÉRIDA - VENEZUELA 2009 Br. Colmenares M. Rafael A. RESUMEN. En este trabajo se desarrolló un método analítico para la determinación de platino en suero sanguíneo, mediante Espectroscopia de Absorción Atómica con Atomización Electrotérmica (ETAAS). Se optimizó la temperatura de pirólisis y de atomización, las cuales fueron 1600ºC y 2700ºC respectivamente. Los experimentos se realizaron utilizando un espectrofotómetro de absorción atómica marca Varian, modelo SpectrAA Zeeman 220Z, equipado con un atomizador de grafito con calentamiento transversal y un corrector de fondo de efecto Zeeman. Las características analíticas del sistema fueron: masa característica (mo) 216 pg, límite de detección (LOD) 4,06 µg L-1, intervalo, intervalo lineal (LOL) entre 4,06 – 700 µg L-1, y la desviación estándar relativa (%RSD) 0,0626%. La exactitud del método se evaluó mediante recuperación cuantitativa del elemento agregado a muestras reales de suero sanguíneo, los valores obtenidos para la recuperación del platino en las diferentes muestras estudiadas, se encuentran dentro de lo propuesto por las normas internacionales ((100 ±3)%). Finalmente, se aplicó la metodología desarrollada a la determinación de platino en muestras de suero sanguíneo provenientes del Hospital Universitario de Los Andes en pacientes que reciben quimioterapia a base de cisplatino, obteniéndose una concentración de 1204,7±0,7 mg L-1 de Pt. Trabajo especial de grado Br. Colmenares M. Rafael A. INDICE 1. Introducción……………………………………………………………………………..1 2. El Cáncer……………………………………………………………………………......5 2.1. Características del Cáncer…………………………………………………..5 2.2. Causas del Cáncer…………………………………………………………...5 2.3. Epidemiologia del Cáncer…………………………………………………...6 2.4. Tipo de Cáncer……………………………………………………………….7 2.5. Modalidades Terapéuticas para el Cáncer………………………………..7 3. Quimioterapia…………………………………………………………………………...9 3.1. Tipos de Quimioterapia…………………………………………………….10 3.2. Evaluación de la Respuestas……………………………………………...11 3.3. Ensayo Clínico en Oncología……………………………………………...11 3.4. Prevención y Tratamiento de los Efectos Secundarios de la Quimioterapia.......................................................................................12 3.4.1. Monitorización de la toxicidad………………………………......13 3.4.2. Toxicidad hematológica………………………………………….13 3.4.3. Toxicidad gastrointestinal………………………………………..14 3.4.4. Náuseas y vómitos………………………………………………..16 4. Platino………………………………………………………………………………….16 4.1. Propiedades y Estado Natural…………………………………………….17 4.2. Aplicaciones…………………………………………………………………18 4.3. Efectos del Platino sobre la Salud………………………………………..18 4.4. Efectos ambientales del Platino…………………………………………..19 5. Cisplatino………………………………………………………………………………20 5.1. Mecanismo de Acción………………………………………………………21 5.2. Farmacocinética del Cisplatino……………………………………………21 5.3. Contraindicaciones y Precauciones………………………………………22 5.4. Efectos Adversos……………………………………………………………23 6. Espectroscopia de Absorción Atómica……………………………………………..23 6.1. Instrumentación……………………………………………………………..25 6.2. Características de la Absorción Atómica…………………………………26 6.3. Aplicaciones de la Absorción Atómica……………………………………27 6.4. Absorción Atómica Electrotérmica………………………………………..28 6.4.1. Atomización Electrotérmica……………………………………...29 6.4.2. Atomizadores Electrotérmicos…………………………………..30 6.4.3. Señal de Salida……………………………………………………32 6.4.4. Características del Funcionamiento de los Atomizadores Electrotérmicos…………………………………………………………...32 6.4.5. Horno de grafito………………………………………………….33 Trabajo especial de grado Br. Colmenares M. Rafael A. 6.4.6. Etapas del Proceso del Horno de grafito para la Absorción Atómica…………………………………………………………………....33 6.4.7. Ventajas y Desventajas de la Espectroscopia de Absorción Atómica Electrotérmica………………………………………………….34 6.4.8. Interferencias……………………………………………………..35 7. Matriz………………………………………………………………………………......36 8. Antecedentes………………………………………………………………………….39 9. Hipótesis……………………………………………………………………………….42 10. Objetivos……………………………………………………………........................42 10.1. General……………………………………………………………………..42 10.2. Específicos…………………………………………………………………42 11. Parte Experimental…………………………………………………………………..43 11.1. Instrumentación……………………………………………………………....43 11.2. Materiales y Reactivos………………………………………………............44 11.3. Preparación de las Disoluciones Patrón…………………………………...46 11.4. Preparación de las Disoluciones para la Curva de Calibrado……..........46 11.5. Identificación de la Matriz Biológica………………………………………..46 11.6. Toma y Conservación de las Muestras…………………………………….47 11.7. Tratamiento del suero sanguíneo previo a su respectivo análisis……...47 11.8. Parámetros Instrumentales…………………………………………….…...48 11.8.1. Estudio de la Conservación y Almacenamiento a partir del Patrón Acuoso…………………………………………………………………………..49 11.8.2. Optimización de la temperatura de Pirólisis y Atomización………56 11.8.3. Perfiles de Absorbancia……………………………………………...64 11.9. Curva de Calibración…………………………………………………………69 11.10. Estudio de Interferencia……………………………………………………71 11.11. Parámetros Analíticos del Sistema………………………………………..72 11.12. Evaluación del Método Analítico…………………………………………..75 12. Determinación de Platino en Suero Sanguíneo………………………………….77 13. Conclusiones…………………………………………………………………………79 14. Recomendaciones…………………………………………………………………..80 15. Bibliografía……………………………………………………………………………81 Trabajo especial de grado Br. Colmenares M. Rafael A. INDICE DE TABLAS 1. Reactivos Empleados en la Preparación de las Disoluciones Patrón…………....................................................................................................45 2. Programa de temperatura y parámetros instrumentales recomendados por el manual, para la determinación de platino en Horno de Grafito Varian SpectrAA Zeeman 220………………………………………………………………………….…..48 3. Absorbancia para las distintas soluciones de platino sin ácido………………….49 4. Absorbancia para las distintas soluciones de platino con ácido…………………50 5. Estudio de las distintas concentraciones de acido presente en soluciones de platino de 250 ppb (patrón acuoso)….………………………………………………..52 6. Estudio de las distintas concentraciones de acido presente en soluciones de platino de 250 ppb (suero sanguíneo)…..…………………………………………….53 7. Estudio de la estabilidad de las soluciones de platino en la semana 1 (patrón acuosos)……………………………………………………………………….………….54 8. Estudio de la estabilidad de las soluciones de platino a partir de la semana 2 (patrón acuoso)……………………………………………………………………….....54 9. Estudio de las distintas intensidades de corriente de la lámpara presente en soluciones de platino de 250 ppb (patrón acuoso)……………………………….…55 10. Valores obtenidos en la optimización de la temperatura de pirólisis para el patrón acuoso…………………………………………………………………………….57 11. Valores obtenidos en la optimización de la temperatura de pirólisis para la matriz biológica (suero sanguíneo)…………………………………………………….58 12. Valores obtenidos en la optimización de la temperatura de atomización para el patrón acuoso…………………………………………………………………………….60 13. Valores obtenidos en la optimización de la temperatura de atomización para la Matriz Biológica (suero sanguíneo)……………………………………………………61 Trabajo especial de grado Br. Colmenares M. Rafael A. 14. Programa de temperatura y parámetros instrumentales optimizados, para la determinación de platino en Horno de Grafito Varian SpectrAA Zeeman 220…………………………………………………………………………………………67 15. Valores obtenidos en la verificación de la estabilidad del platino contenido en soluciones de 100ppb de suero sanguíneo………………………………………….68 16. Intervalo de trabajo útil para el platino…………………………………………..69 17. Valores de la pendiente, corte, correlación lineal y porcentaje de desviación estándar relativa, para la curva de calibración de platino…………………………...70 18. Valores de los distintos parámetros para la curva del patrón acuoso………....71 19. Valores de los distintos parámetros para la curva del suero sanguíneo………72 20. Efecto del volumen de inyección en la masa característica……..…….……….75 21. Características analíticas del sistema…………………………………………….76 22. Estudio de recuperación realizado en el intervalo de trabajo………………..76 23. Estudio de recuperación realizado en algunos de los puntos del intervalo útil………………………………………………………………………………………….77 24. Análisis de la muestra real de suero sanguíneo proveniente del Hospital Universitario de los Andes (HULA)…………………………………………………....78 Trabajo especial de grado Br. Colmenares M. Rafael A. INDICE DE FIGURAS 1. Estructura del cisplatino……………………………………………………………...20 2. Componentes básicos de un espectrofotómetro de absorción atómica………..25 3. Lámpara de Cátodo Hueco…………………………………………………………..26 4. (a) Sección transversal de un atomizador de horno de grafito, (b) Plataforma de L`vov…………………………………………………………………………………...31 5. Etapas de la absorción atómica electrotérmica……………………………………33 6. Suero Sanguíneo……………………………………………………………………..37 7. Representación de la molécula de fibrinógeno……………………………………38 8. Espectrofotómetro de Absorción Atómica, marca Varian SpectrAA Zeeman 220Z, equipado con horno de grafito. Laboratorio de Espectroscopia Molecular (LEM) Facultad de Ciencias, Mérida-Venezuela……………………………………..43 9. Otros equipos utilizados……………………………………………………………...44 10. Perfiles de pirólisis y atomización para el patrón acuoso……………………….66 11. Perfiles de pirólisis y atomización para el suero sanguíneo……………………67 12. Intervalo lineal de un método analítico. LOQ = límite de cuantificación; LOL = límite de linealidad……………………………………………………………………….74 Trabajo especial de grado Br. Colmenares M. Rafael A. INDICE DE GRÁFICOS 1. Gráfica de Absorbancia vs Concentración (ppb) de las soluciones de platino sin ácido……………………………………………………………………………………….50 2. Gráfica de la Absorbancia vs Concentración (ppb) de las soluciones de platino con ácido………………………………………………………………………………….51 3. Gráfica de Absorbancia vs Concentración de HNO3 en soluciones de platino de 250 ppb (patrón acuoso)………………………………………………………………..52 4. Gráfica de la Absorbancia vs Concentración de HNO3 en soluciones de platino de 250 ppb (suero sanguíneo)…………………………………………………………53 5. Gráfica de la Absorbancia vs Intensidad de Corriente de la Lámpara (mA)……56 6. Gráfica de optimización de la temperatura de Pirólisis para el Patrón Acuoso..57 7. Gráfica de optimización de la temperatura de Pirolisis para la Matriz Biológica (suero sanguíneo)……………………………………………………………………….58 8. Gráfica de optimización de Pirolisis tanto para el patrón acuoso como para el suero sanguíneo…………………………………………………………………………59 9. Gráfica de optimización de la temperatura de Atomización para el patrón acuoso…………………………………………………………………………………….60 10. Gráfica de optimización de la temperatura de Atomización para la Matriz Biológica (suero sanguíneo)……………………………………………………………61 11. Gráfica de optimización de Atomización tanto para el patrón acuoso como para el suero sanguíneo………………………………………………………………………62 12. Gráfica de optimización de la temperatura de Pirólisis y Atomización para el patrón acuoso…………………………………………………………………………….62 13. Gráfica de optimización de la temperatura de Pirólisis y Atomización para el suero sanguíneo…………………………………………………………………………63 14. Gráfica de optimización de la temperatura de Pirólisis y Atomización para patrón acuoso y suero sanguíneo……………………………………………………..63 15. Curva de calibración de platino…………………………………………………….70 16. Gráfica de Adición Estándar para el patrón acuoso y el suero sanguíneo……71 Trabajo especial de grado Br. Colmenares M. Rafael A. DEDICATORIA A Dios todo Poderoso, por darme fuerza, vida y llenarme de mucha sabiduría y entendimiento para alcanzar esta meta. Al Dr. José Gregorio Hernández, por iluminarme en todo momento para seguir adelante y superar adversidades. A mis Padres, lo más hermoso que poseo, a quienes debo y agradezco todo lo que me han dado, sin pedirme nada a cambio, solo teniendo por recompensa el sentirse felices y dichosos de lograr mi bienestar y felicidad. Todo lo que hasta ahora he logrado en mi vida, es gracias a la sabia educación con la que me instruyen, gracias a ustedes aprendí a valorar la vida, la familia y las cosas por las que vale la pena luchar a pesar de los obstáculos que se nos presenten. No existe en el mundo nada más valioso que ustedes. LOS AMO…. A mi novia Glenda, gracias por estar siempre conmigo llegaste a mi vida para llenare de amor, respeto y muchísima felicidad, eres muy importante para mi, gracias a tus consejos, risas y hasta disgustos me mostraste el camino para llegar a la meta. El éxito se logra solo si se cuenta con personas como tú mi princesa, TE AMO. A mi hermano Nelsón, desde niños siempre juntos compartiendo momentos de felicidad y tristeza, luchando por alcanzar nuestras metas y sueños. Gracias por tu apoyo. Te adoro tito. A la memoria de mis abuelos Ana María, Ramón de Jesús y Ricardo Molina, que desde el cielo me guiaron para consolidar mi sueño. A mi abuela María, por tu cariño y tus sabios consejos. A mi sobrino NELSÓN ANDRÉS, por ser mi alegría y llenarme con su luz de inocencia. Dios Te Bendiga bebé. Trabajo especial de grado Br. Colmenares M. Rafael A. AGRADECIEMIENTO Hoy se hace realidad una de mis metas, pero sabia que para alcanzarla tendría que aprender a conocer virtudes como la paciencia, constancia, sacrificio y dedicación. En este camino existieron momentos difíciles que me llenaron de angustia, depresión y tristeza, queriéndome apartar de mi sueño, pero gracias a Dios todopoderoso y a al Dr. José Gregorio Hernández que me iluminaron siempre para poder vencer estos grandes obstáculos. Sé, que sin su luz de guía probablemente no lo hubiese alcanzado, por lo cual considero que ha sido un triunfo en conjunto y son muchas las personas especiales a las quiero agradecer. A mis Padres, a quienes les debo la vida, son los mejores padres del mundo; gracias por su inmenso amor, sus esfuerzos, apoyo y por la confianza que depositaron en mí. Gracias por sacarme adelante y regalarme la oportunidad de lograr una de mis metas, la cual constituye la herencia más valiosa que pudiera recibir para continuar superándome. Los Amo. A mi hermano y sobrino, por ser mis amigos incondicionales, fuente de inspiración, motivo de superación, con su apoyo, ayuda y cariño he logrado este sueño hoy día. Dios los bendiga. Gracias al profesor Carlos Rondón (Tutor), por creer en mí y abrirme las puertas del Laboratorio de Espectroscopia Molecular para que realizara mi trabajo especial de grado. Gracias por todo. A Edyleiba, Marlene, Soleida y Marta del Laboratorio de Espectroscopia Molecular, gracias por haber estado ahí cada vez que los necesite, ustedes me ayudaron siempre que se los pedí, mil gracias de verdad. Dios se los pague. A los Profesores Alexis y Lester de la Facultad de Farmacia, gracias por brindarme tanto apoyo y confianza durante todos estos meses que estuve desarrollando mi trabajo, Dios se los pague profes. Trabajo especial de grado Br. Colmenares M. Rafael A. A la Lic. Carmen y la Dra. Milagros, en el Hospital Universitario de Los Andes, por su colaboración y apoyo. A mis verdaderos amigos, cada uno ocupa un espacio importante en mi vida con ellos compartí buenos y malos momentos y hoy en día llenan mi mente de gratos recuerdos, nunca los olvidaré pues marcaron mi vida. Tengan siempre presente que todo lo que se quiere en la vida se puede. Luchen por sus sueños. A todos los integrantes del Laboratorio de Espectroscopia Molecular, por permitirme trabajar con ellos durante todos estos meses que estuve desarrollando mi trabajo, gracias por su amistad, asesoría y apoyo. A la Ilustre Universidad de los Andes, mi casa de estudio, por brindarme la oportunidad de formar parte de ella, orientándome con sus profesores, quienes impartieron sus conocimientos para formarme como profesional. A todas y cada una de esas personas que confiaron, creyeron en mí y se atrevieron a apostar, sabiendo que sí lo lograría, hoy pueden decir que han ganado, pues ya la espera ha terminado, a ustedes gracias por estar allí formando parte de mi vida. Lo Logré. etytxÄ VÉÄÅxÇtÜxá Trabajo especial de grado Br. Colmenares M. Rafael A. Trabajo especial de grado Br. Colmenares M. Rafael A. 1. INTRODUCCION. El cáncer es básicamente una enfermedad a nivel celular caracterizada por la pérdida de los mecanismos de control que gobiernan la proliferación y diferenciación celular. Las células que han sufrido transformación neoplásica generalmente expresan antígenos de la superficie celular que pueden ser de tipo fetal normal, exhibir otros signos de aparente inmadurez y exhibir otras alteraciones cualitativas o cuantitativas a nivel de los cromosomas, incluyendo varias translocaciones y la aparición de secuencias amplificadas de genes. Tales células proliferan excesivamente y forman tumores localizados que comprimen o invade las estructuras normales adyacentes. Una pequeña subpoblación, celular dentro del tumor puede describirse como células madre tumorales. Éstas mantienen la capacidad de atravesar por diferentes ciclos de proliferación, así como de migrar a sitios distantes dentro del cuerpo para colonizar órganos en un proceso denominado metástasis. Tales células madre tumorales pueden expresar capacidades clonogénicas y formadoras de colonias, y a menudo tienen alteraciones cromosómicas que reflejan su inestabilidad genética, lo que origina una selección progresiva de subclones que son más aptos para sobrevivir en el medio multicelular del huésped. Las alteraciones cuantitativas de varias vías metabólicas y de componentes celulares son fenómenos asociados a esta progresión neoplásica. Los procesos invasivos y metastásicos, así como las serie de alteraciones metabólicas resultantes de la enfermedad, causan la muerte del paciente, a menos que la neoplasia se erradique con el tratamiento (1). Los estudios epidemiológicos de las enfermedades neoplásicas permiten no sólo determinar la incidencia y mortalidad de cada tipo de cáncer sino también su distribución y las causas o factores de riesgo para cada uno de ellos (2). Actualmente el cáncer es un problema sanitario de primer orden en los países desarrollados, constituyendo la segunda causa de mortalidad después de las enfermedades cardiovasculares. La incidencia actual en los países desarrollados Trabajo especial de grado Página 1 Br. Colmenares M. Rafael A. se sitúa alrededor de 300 casos nuevos por cada 100.000 habitantes y año. Refiriéndonos a España, aunque la incidencia y la mortalidad están por debajo de las cifras medias de los estados miembros de la Unión Europea, en 1990 se diagnosticaron más de 113.000 cánceres y más de 76.000 personas murieron de esta enfermedad (2). La estrategia terapéutica a plantear es distinta dependiendo del objetivo perseguido, que puede ser (2): – Curación (terapia curativa): la consecución de un estado libre clínica y patológicamente de enfermedad es el objetivo primario del tratamiento del cáncer. – Paliación de síntomas y/o prolongación de la supervivencia, manteniendo el estado funcional del paciente y su calidad de vida (terapia paliativa). – Uso experimental en ensayos clínicos en fase I, determinando la dosis segura de una nueva estrategia en humanos. El tipo de terapia más apropiada se determina en función de los objetivos planteados con el tratamiento, del tipo de tumor y su extensión, y de condiciones del paciente como su estado funcional, edad y patología concomitante. Las principales modalidades terapéuticas utilizadas solas o en combinación en el tratamiento del cáncer son la cirugía, la radioterapia, la quimioterapia (incluyendo la hormonoterapia) y la terapia inmunológica (o modificadora de la respuesta biológica) (2). El platino es un metal blanco grisáceo con una dureza de 4,3. Tiene un punto de fusión alto, es dúctil y maleable, se expande ligeramente al calentarlo y tiene una gran resistencia eléctrica. El metal es relativamente inerte y resistente al ataque del aire, el agua, los ácidos aislados y los reactivos ordinarios. Se disuelve lentamente en agua regia, formando ácido cloroplatínico (H2PtCl6); es atacado por Trabajo especial de grado Página 2 Br. Colmenares M. Rafael A. los halógenos y combina, bajo ignición, con hidróxido de sodio, nitrato de sodio o cianuro de sodio (5). El cisplatino es un medicamento antineoplásico que contiene platino (II) en su estructura. Actúa inhibiendo la multiplicación de las células tumorales. Ha sido el tema de muchas investigaciones clínicas especialmente para el tratamiento de los tumores ováricos y de la vejiga. Sin embargo, el uso de tales compuestos del platino puede inducir efectos tóxicos (3). Este medicamento ocasiona efectos secundarios agresivos, ocasionando daños a órganos importantes, como los riñones, en los pacientes que reciben tratamiento de quimioterapia a base de este, daños reales, hematológicos y gastrointestinales y por lo tanto, en algunas veces la muerte (3). La espectroscopia de absorción atómica (a menudo llamada AA) es un método que utiliza comúnmente un nebulizador pre-quemador (o cámara de nebulización) para crear una niebla de la muestra y un quemador con forma de ranura que da una llama con una longitud de trayecto más larga (4). La temperatura de la llama es lo bastante baja para que la llama de por sí no excite los átomos de la muestra de su estado fundamental. El nebulizador y la llama se usan para desolvatar y atomizar la muestra, pero la excitación de los átomos del analito es hecha por el uso de lámparas que brillan a través de la llama a diversas longitudes de onda para cada tipo de analito (4). En la Absorción Atómica, la cantidad de luz absorbida después de pasar a través de la llama determina la cantidad de analito en la muestra. Una mufla de grafito es usada para calentar la muestra a fin de desolvatarla y atomizarla para aumentar la sensibilidad. El método del horno de grafito puede también analizar algunas Trabajo especial de grado Página 3 Br. Colmenares M. Rafael A. muestras sólidas o semisólidas. Debido a su buena sensibilidad y selectividad, sigue siendo un método de análisis comúnmente usado para ciertos elementos traza en muestras acuosas (y otros líquidos) (4). El suero sanguíneo es el líquido amarillento resultante tras la coagulación de la sangre, sin anticoagulante como se muestra en la figura 6. Se define además como la parte liquida del plasma sanguíneo. El suero sanguíneo contiene en solución albúminas, globulina, sales, enzimas, hormonas, vitaminas, lípidos, hidratos de carbono, aminoácidos, entre otros (19). Trabajo especial de grado Página 4 Br. Colmenares M. Rafael A. MARCO TEORICO 2. EL CÁNCER. Una neoplasia es “una masa anormal de tejido cuyo crecimiento es excesivo y está descoordinado con el del resto de tejidos normales del organismo, y que persiste de la misma manera excesiva una vez que ha cesado el estímulo que lo ha originado”. La diferenciación entre neoplasias benignas y malignas o cánceres se basa en criterios histológicos y biológicos. Estas diferencias sin embargo no son absolutas siendo la capacidad de invasión de los tejidos circundantes al tumor y la posibilidad de producción de metástasis las que mejor las diferencian (2). 2.1. Características del cáncer Las células cancerosas presentan cuatro características esenciales (2): – Clonalidad: cada tumor maligno se origina en una única célula que prolifera y da lugar a un clon de células malignas. – Autonomía: El crecimiento y desarrollo de la célula cancerosa no es regulado de forma correcta por los moduladores hormonales y bioquímicos normales. – Anaplasia: las células tumorales tienen una pérdida de diferenciación celular. En líneas generales, cuanto mayor sea el grado de anaplasia de un tumor mayor será su potencial metastásico y más intensa su diseminación. – Metástasis: la célula cancerosa tiene capacidad de difundir (invadir otros tejidos) a distancia de su lugar de origen. 2.2. Causas del cáncer En la etiología del cáncer se encuentran una serie de factores tanto de tipo exógeno como endógeno que hoy en día se encuentran ya plenamente Trabajo especial de grado Página 5 Br. Colmenares M. Rafael A. contrastados. Entre los de tipo exógeno destacan: el tabaco, el alcohol, la dieta, las radiaciones, factores ocupacionales asociados a determinadas sustancias (asbesto, arsénico, cuero, níquel, etc.), algunos fármacos y determinados virus. Los factores endógenos se encuentran ligados a determinadas alteraciones genéticas reconociéndose hoy en día, como principales implicados los oncogenes dominantes y los genes supresores de tumores u antioncogenes (2). Existe una gran variedad de cánceres diferentes y la terminología que se emplea derivada de las células o tejidos donde se originan. Los que nacen en el tejido mesenquimatoso se denominan genéricamente sarcomas y los que se producen en los epitelios, carcinomas (2). Se ha identificado un retrovirus humano (HTLV-1) como agente causal para la leucemia de células T humanas. El virus que causa el SIDA (VHI-1) está muy relacionado. Se sabe que los genes celulares son homólogos a los genes de transformación oncogénica (1). 2.3. Epidemiologia del cáncer Los estudios epidemiológicos de las enfermedades neoplásicas permiten no sólo determinar la incidencia y mortalidad de cada tipo de cáncer sino también su distribución y las causas o factores de riesgo para cada uno de ellos. Los datos suelen recogerse a través de los registros de tumores que cubren zonas geográficas concretas extrapolándose o no al resto de un país o países. Se expresan en tasas por 100.000 habitantes y año. En los hombres los cánceres más frecuentes fueron: pulmón (21% de los nuevos casos), intestino grueso (12%), vejiga (10%), próstata (8%) y ORL (7%). En mujeres los más frecuentes fueron: mama (26%), intestino grueso (14%), estómago (6%) y ginecológicos (útero 7%, cuello de útero 5%, ovario 4%). Trabajo especial de grado Página 6 Br. Colmenares M. Rafael A. 2.4. Tipo de cáncer Existen numerosos tipos cánceres, entre los que destacan 3 subtipos principales. En primer lugar hay que mencionar los sarcomas, que proceden del tejido conjuntivo presente en los huesos, cartílagos, nervios, vasos sanguíneos, músculos y tejido adiposo. El segundo tipo lo constituyen los carcinomas que surgen en los tejidos epiteliales como la piel o las mucosas que tapizan las cavidades y órganos corporales como el sistema respiratorio o digestivo o en los tejidos glandulares de la mama y la próstata. Los carcinomas incluyen algunos de los cánceres más frecuentes como el cáncer de pulmón, el de colon o el de mama. Los carcinomas de estructura similar a la piel se denominan carcinomas de células escamosas. Los que tienen una estructura glandular se denominan adenocarcinomas. En el tercer subtipo se encuentran las leucemias y los linfomas, que incluyen los cánceres que se originan en los tejidos formadores de las células sanguíneas. Pueden producir una inflamación de los ganglios linfáticos (adenopatías), aumento de tamaño del bazo (esplenomegalia) o invasión y destrucción de la médula ósea, así como una producción excesiva de leucocitos o linfocitos inmaduros (5). 2.5. Modalidades terapéuticas para el cáncer El cáncer es la segunda causa de muerte en EUA, ocasionando alrededor de 500000 decesos al año. Con los tratamientos actuales una tercera parte de los pacientes se alivia con medidas locales cuando el tumor no ha tenido metástasis durante el curso de tratamiento. Una detección temprana podría conducir a un aumento en el índice de curación de pacientes con este tratamiento local; no obstante, en los casos retantes, la micrometástasis temprana es una característica de neoplasia, lo que indica que se requerirá un método sistémico como la quimioterapia (a menudo junto con cirugía o radiación) para el control efectivo del cáncer (2). Trabajo especial de grado Página 7 Br. Colmenares M. Rafael A. La posibilidad de curación de los tumores malignos depende de numerosas variables, siendo la más importante el grado de extensión o estadio de la enfermedad en el momento del diagnóstico. El tipo de terapia más apropiada se determina en función de los objetivos planteados con el tratamiento, del tipo de tumor y su extensión, y de condiciones del paciente como su estado funcional, edad y patología concomitante (2). Las medidas terapéuticas tradicionales incluyen la cirugía, la radioterapia y la quimioterapia (5): Cirugía. La principal estrategia para el tratamiento curativo del cáncer es la escisión de todas las células malignas mediante una intervención quirúrgica. En el pasado, esto implicaba la extirpación de todo el tejido afectado y de la mayor cantidad posible de tejido potencialmente afectado, incluidos los tejidos vecinos y los ganglios linfáticos. Para algunos tumores, y en especial el cáncer de mama, no es precisa una cirugía tan ablativa (mastectomía) en la mayor parte de los casos. Las mejoras en las técnicas quirúrgicas, la posibilidad de realizar una biopsia intraoperatoria, los avances en los conocimientos de fisiopatología, los progresos en las técnicas anestésicas y la disponibilidad de potentes antibióticos y hemoderivados, han permitido realizar cirugías más limitadas, con menos secuelas y más pronta recuperación. Sin embargo, muchos cánceres están demasiado extendidos en el momento del diagnóstico para que la cirugía curativa sea posible. Radioterapia. Consiste en irradiar rayos x o gama en el tejido afectado. La desventaja de éste método es el hecho de que puede infligir daño genético, es posible que no acabe del todo con las células cancerígenas y tampoco ataca la metástasis. La radiación de partículas incluye haces de electrones, protones, neutrones, partículas alfa (núcleos de helio) y piones. La propiedad de la radiación es de respetar hasta Trabajo especial de grado Página 8 Br. Colmenares M. Rafael A. cierto punto los tejidos normales permite el tratamiento de tumores en localizaciones donde no es posible la cirugía por la proximidad de tejidos vitales o porque el tumor ha empezado a infiltrar estructuras adyacentes que no pueden ser sacrificadas. La radioterapia puede ser útil como coadyuvante a la cirugía. La radiación preoperatoria puede esterilizar las células tumorales con rapidez, impidiendo su diseminación en el acto quirúrgico. Quimioterapia. 3. QUIMIOTERAPIA. Consiste en la utilización de fármacos para el tratamiento del cáncer. Puesto que los fármacos se distribuyen en el organismo a través del sistema circulatorio, la quimioterapia es útil para aquellos tumores cuya diseminación los hace inaccesibles a la cirugía o a la radioterapia. Existen multitud de fármacos anticancerosos, la mayor parte de los cuales actúan interfiriendo la síntesis o función del ADN. Por tanto las células en división son más sensibles a la quimioterapia (5). La quimioterapia tiene un papel limitado en el tratamiento primario del cáncer localizado, siendo la base del tratamiento de los tumores diseminados, en los cuales la cirugía y la radioterapia tienen escaso valor. El tratamiento del cáncer diseminado incluye varias situaciones clínicas (2): – Cánceres que, por su naturaleza, se consideran de amplia diseminación en el momento del diagnóstico. Aquí se incluyen la mayoría de neoplasias hematológicas, como leucemias, y algunos linfomas. En estos casos la quimioterapia se utiliza como tratamiento primario y con intención curativa o de prolongar la supervivencia. Trabajo especial de grado Página 9 Br. Colmenares M. Rafael A. – Cánceres con diseminación metastásica clínicamente evidente. La quimioterapia es sólo muy raramente curativa en el tratamiento de tumores sólidos metastásicos. Se administra con el objetivo de prolongar la vida o de paliar síntomas. – Cánceres que, si bien parecen localizados, pueden haber desarrollado micrometástasis clínicamente indetectables. En ellos la terapia sistémica se da en un intento de erradicar estas micrometástasis e incrementar el porcentaje de curación tras la cirugía o la radioterapia (terapia adyuvante). Finalmente, si bien la ventaja principal de la quimioterapia respecto la cirugía y la radioterapia es su capacidad de llegar a la mayoría de células corporales, en algunas ocasiones se administra en regiones corporales concretas para tratar la enfermedad localizada. 3.1. Tipos de quimioterapia Existen tres formas de empleo de la quimioterapia (2): – Quimioterapia de inducción: es la utilizada como tratamiento primario a pacientes que presentan enfermedad avanzada y para los cuales no hay tratamiento alternativo. – Quimioterapia neoadyuvante o primaria: indica el uso de quimioterapia como tratamiento inicial de pacientes que presentan un tumor localizado para el cual existe la alternativa de un tratamiento local, pero que no es totalmente efectivo. – Quimioterapia adyuvante: administración de un tratamiento sistémico (con agentes antineoplásicos, hormonales o biológicos) después de que el tumor primario ha sido tratado mediante un método local, bien cirugía o radioterapia. También puede administrarse cuando el tumor primario se ha eliminado mediante antineoplásicos, como ocurre en el tratamiento de las leucemias agudas. Trabajo especial de grado Página 10 Br. Colmenares M. Rafael A. 3.2. Evaluación de la respuesta Se han utilizado diferentes clasificaciones para evaluar la respuesta de un tipo específico de tumor o de un paciente frente a un régimen quimioterápico. Los criterios de la OMS internacionalmente aceptados de valoración de la respuesta de una enfermedad medible, determinada sobre las masas tumorales (uní o bidimensionalmente, y calculando la suma de todas las masas medibles) son (2): – Remisión completa (RC): desaparición de toda evidencia clínica del tumor, en dos observaciones separadas al menos cuatro semanas. – Remisión parcial (RP): reducción de al menos un 50% en todas las masas, sin progresión en ninguna o aparición de otras nuevas, al menos durante cuatro semanas. – Enfermedad estable (EE) o No cambio (NC): reducción menor del 50% o crecimiento inferior al 25% de cualquiera de las masas medibles. – Progresión de la enfermedad (PE): crecimiento del 25% o más de cualquiera de las masas medibles o aparición de nuevas lesiones. 3.3. Ensayo clínico en oncología Con el uso de la quimioterapia se han alcanzado éxitos muy importantes en el tratamiento de algunos tipos de tumores, pero la elevada toxicidad de los fármacos disponibles y la resistencia natural o adquirida de los tumores a la acción de los mismos, enfrenta al oncólogo clínico a la necesidad de adquirir nuevos agentes menos tóxicos y que sean más efectivos sobre los tumores refractarios a la quimioterapia actual. En oncología, como en otras áreas de la actividad médica, el ensayo clínico, siempre que sea correctamente diseñado, constituye el único mecanismo para obtener respuestas a cuestiones clínicas con el menor riesgo posible (2). Trabajo especial de grado Página 11 Br. Colmenares M. Rafael A. Las fases de un ensayo clínico en oncología son (2): Fase I Los objetivos principales de estos estudios son caracterizar la farmacología, la farmacocinética, la farmacodinamia, evaluar la toxicidad aguda, establecer la máxima dosis tolerada (MDT) o mayor dosis que producirá un efecto tóxico tolerable y la toxicidad limitante de dosis (TLD). Fase II Intentan determinar la actividad antitumoral y además evaluar con más exactitud el perfil de toxicidad del fármaco en un grupo de pacientes relativamente homogéneo afectos de un tipo específico de neoplasia. Fase III Tienen como objetivo final definir el papel de un fármaco antineoplásico en el régimen de tratamiento de un tipo concreto de cáncer. En este tipo de ensayos se estudian la actividad terapéutica y la toxicidad del fármaco experimental respecto a los del tratamiento estándar. Fase IV Estos ensayos clínicos son estudios postcomercialización que se realizan una vez que el fármaco antineoplásico se utiliza en la práctica clínica. Suelen tratarse de grandes estudios multicéntricos que estudian el uso de un fármaco para una indicación específica. Los objetivos se dirigen a definir nuevas indicaciones, nuevos esquemas de dosificación e información adicional sobre seguridad a largo término y reacciones adversas potenciales que pudieran no haber sido documentadas en los ensayos clínicos en fases previas realizados con un número limitado de pacientes. 3.4. Prevención y tratamiento de los efectos secundarios de la quimioterapia Cuando se realiza un tratamiento de quimioterapia antineoplásica el objetivo ideal es disponer de una acción selectiva y tóxica sobre las células tumorales y, de este Trabajo especial de grado Página 12 Br. Colmenares M. Rafael A. modo, alcanzar una remisión completa. Desgraciadamente siempre se obtiene determinado grado de toxicidad, especialmente sobre aquellos tejidos sanos cuyas células tienen una multiplicación rápida como es el caso de la médula ósea, epitelio del tracto gastrointestinal, folículos pilosos y órganos linfoides. Por esta razón, esta toxicidad se convierte en uno de los factores limitantes de la utilización de esta terapéutica antineoplásica (2). 3.4.1. Monitorización de la toxicidad La evaluación y seguimiento de la toxicidad se debe realizar prospectivamente de acuerdo a la escala de la Organización Mundial de la Salud (OMS) o los criterios comunes de toxicidad (CTC) del National Cancer Institut (NCI) americano, clasificados ambos en función de los órganos y sistemas afectados. En estas escalas se utiliza una numeración de 0 a 4 para indicar el grado de afectación. Un grado 5 correspondería la muerte relacionada con la reacción adversa (2): 0 = normal, sin efectos secundarios; 1 = efecto adverso ligero; 2 = efecto adverso moderado; 3 = efecto adverso grave y no deseado; 4 = efecto adverso muy grave o incapacitante. 3.4.2. Toxicidad hematológica La toxicidad en la médula ósea es el efecto secundario más importante que producen los antineoplásicos, siendo el factor limitante de dosis para la mayoría de ellos, si bien existen algunas excepciones (estreptozotocina y bleomicina). El momento en que se manifiesta en relación a la administración, su gravedad y duración dependen tanto del citostático como de la dosis empleada (2). Trabajo especial de grado Página 13 Br. Colmenares M. Rafael A. Esta toxicidad afecta mucho más frecuentemente a leucocitos y plaquetas que a eritrocitos. Por esta razón, las consecuencias inmediatas son la susceptibilidad a las infecciones y a las hemorragias, así como la aparición de anemia (2). En el caso de la trombocitopenia, las transfusiones de plaquetas pueden provocar reacciones alérgicas o una aloinmunización, lo que limita su eficacia. La trombopoyetina (MGDF) ha demostrado ser un estimulador potente de la producción plaquetar frente a la asociación paclitaxel-carboplatino; pero su uso, así como el de otras citoquinas, no ha alcanzado todavía la práctica clínica rutinaria (2). La aparición de anemia postquimioterapia ha sido significativamente retrasada por la utilización de la eritropoyetina, especialmente en pacientes tratados con cisplatino con dosis preventivas de 100- 200 U/kg tres días por semana por vía subcutánea. Su elevado coste debe ser valorado teniendo en cuenta el coste de almacenamiento de la sangre y sus derivados, la reducción del riesgo de infecciones relacionadas con las transfusiones y por la mejora de la calidad de vida de los pacientes (2). 3.4.3. Toxicidad gastrointestinal La toxicidad gastrointestinal es, junto con la hematológica, la más común y puede manifestarse de varias formas. La emesis es un efecto de aparición inmediata. La mucosa del tracto gastrointestinal, por tratarse de un tejido en continua proliferación, es muy sensible a la acción de la quimioterapia. La toxicidad resultante se denomina mucositis o estomatitis. Se manifiesta de forma más retardada y suele afectar con mayor incidencia a la mucosa oral, aunque puede extenderse a otras áreas del tubo digestivo. Se presenta con más frecuencia en aquellos pacientes sometidos a dosis elevadas de quimioterapia o a ciclos de Trabajo especial de grado Página 14 Br. Colmenares M. Rafael A. tratamiento prolongados. Se manifiesta con una sensación de quemazón inicial, que puede evolucionar a úlceras en 2-3 días (2). Casi todas las familias de citostáticos pueden producir mucositis. A nivel individual hay que destacar especialmente doxorrubicina, etopósido, 5- fluorouracilo (sobre todo cuando se administra en infusión continua), metotrexato y vinblastina (2). En algunos pacientes se observa la denominada mucositis intestinal. Tal es el caso de 5-fluorouracilo administrado en perfusión continua (sus derivados orales tienen menor incidencia de este efecto adverso) y la quimioterapia a dosis altas en el tratamiento de tumores sólidos. El 5-fluorouracilo presenta todo tipo de toxicidades a nivel gastrointestinal, tales como estomatitis, úlceras, esofagitis y diarrea, siendo todas ellas frecuentes, llegando a ser la toxicidad limitante de la dosis (2). Aunque se han empleado numerosos fármacos tanto en la profilaxis como en el tratamiento de la mucositis, no existen resultados concluyentes sobre la efectividad de los mismos. Las disoluciones que contienen un anestésico local como la lidocaína al 1-2% suelen proporcionar buenos resultados, siempre que se tenga la precaución de no efectuar gargarismos, ya que pueden producir problemas de deglución. El sucralfato se muestra más eficaz en la prevención de la mucositis que en el tratamiento una vez instaurada (2). Otro tipo de toxicidad gastrointestinal importante, ya que es un factor limitante de la dosis, es la diarrea producida por el irinotecán. Un 87% de pacientes padecen diarrea con este fármaco, siendo grave en un 30% (grados 3 y 4 de la CTC). Se trata de una diarrea de inicio rápido (antes de 24 h) y de naturaleza colinérgica, por lo que requiere premedicación con 0,25- 1,0 mg de atropina IV. La diarrea de inicio retardado (>24 h) se trata con loperamida 4 mg seguidos de 2 mg cada 2 h hasta que el paciente está libre de diarrea un mínimo de 12 h (2). Trabajo especial de grado Página 15 Br. Colmenares M. Rafael A. 3.4.4. Náuseas y vómitos Las náuseas y vómitos inducidos por quimioterapia pueden afectar de forma importante a la calidad de vida del paciente oncológico. Entre otros efectos, se ha descrito su contribución al desarrollo de desequilibrios hidroelectrolíticos y metabólicos, depleción de nutrientes, anorexia, lesiones mecánicas, etc. Además, la magnitud del efecto que experimentan determinados pacientes puede inducirles al abandono de tratamientos potencialmente curativos o beneficiosos (2). 4. PLATINO. El platino es un elemento químico de número atómico 78 situado en el grupo 10 de la tabla periódica de los elementos. Su símbolo es Pt. Se trata de un metal de transición blanco grisáceo, precioso, pesado, maleable y dúctil. Es resistente a la corrosión y se encuentra en distintos minerales, frecuentemente junto con níquel y cobre; también se puede encontrar como metal. Se emplea en joyería, equipamiento de laboratorio, contactos eléctricos, empastes y catalizadores de automóviles (6). El platino no es afectado por la atmósfera aun en ambientes industriales con contenido de azufre. Conserva su brillantez y no exhibe película de óxido cuando se calienta, aunque se forma una película fina adherente debajo de los 450ºC (842ºF). El hidrógeno u otras atmósferas reductoras no son peligrosos para el platino a temperaturas elevadas. El platino puede ser maquinado en alambres finos y láminas delgadas y, por procesos especiales, en alambres extremadamente finos (7). El platino puede obtenerse en forma esponjosa por descomposición térmica del cloroplatinato de amonio o al reducirlo de una solución acuosa. En esta forma Trabajo especial de grado Página 16 Br. Colmenares M. Rafael A. muestra un alto poder de absorción respecto a los gases, especialmente oxígeno, hidrógeno y monóxido de carbono. La alta actividad catalítica del platino está relacionada directamente con esta propiedad. El platino posee una fuerte tendencia a formar compuestos de coordinación (7). Es el elemento más importante del denominado grupo de metales del platino; los otros elementos del grupo son el rutenio, el rodio, el paladio, el osmio y el iridio. Es probable que los metales del platino se utilizaran en formas aleadas en la antigüedad, en Grecia y Roma, y fueron mencionados por primera vez en la literatura europea a principios del siglo XVI. El explorador español Antonio de Ulloa participó en una expedición por tierras americanas y fue el primero en describir en sus Observaciones astronómicas y físicas (1748) el platino como un cuerpo simple. La separación de los elementos del grupo del platino se llevó a cabo en el siglo XIX (5). 4.1. Propiedades y estado natural El platino es un metal blanco grisáceo con una dureza de 4,3. Tiene un punto de fusión alto, es dúctil y maleable, se expande ligeramente al calentarlo y tiene una gran resistencia eléctrica. El metal es relativamente inerte y resistente al ataque del aire, el agua, los ácidos aislados y los reactivos ordinarios. Se disuelve lentamente en agua regia, formando ácido cloroplatínico (H2PtCl6); es atacado por los halógenos y combina, bajo ignición, con hidróxido de sodio, nitrato de sodio o cianuro de sodio. El platino tiene un punto de fusión de 1.769 °C, un punto de ebullición de 3.827 °C y una densidad relativa de 21,45. Su masa atómica es 195,09 (5). Trabajo especial de grado Página 17 Br. Colmenares M. Rafael A. Ocupa el lugar 72 en abundancia natural entre los elementos de la corteza terrestre. Excepto en el mineral esperrilita (arseniuro de platino), el platino existe en estado metálico, a menudo aleado con otros metales del platino (5). 4.2. Aplicaciones Debido a su poca reactividad y su punto de fusión elevado, el platino es muy útil para ciertos instrumentos de laboratorio como crisoles, pinzas, embudos, cápsulas de combustión y platos de evaporación. Normalmente se le añaden pequeñas cantidades de iridio para aumentar su dureza y durabilidad. El platino se usa también en los puntos de contacto de los aparatos e instrumentos eléctricos utilizados para medir altas temperaturas. El platino finamente dividido, en forma de espuma de platino y negro de platino, se usa mucho como catalizador en la industria química. Una considerable cantidad de platino se dedica a la joyería, a menudo aleado con oro. También se utiliza para los empastes dentales (5). Los enlaces del platino son a menudo aplicados en la medicina para curar el cáncer (7). El platino se extrae en todo el mundo; la República de Sudáfrica, Rusia y Canadá, junto con Estados Unidos, Japón y Colombia son los principales productores (5). 4.3. Efectos del platino sobre la salud El platino es un metal noble. Las concentraciones de platino en el suelo, agua y aire son mínimas. En algunos lugares los depósitos, pueden ser muy ricos en platino, mayormente en Sur África, la Unión Soviética y Estados Unidos. Los efectos sobre la salud del platino están fuertemente ligados a la clase de enlace que estos forman y el nivel de exposición y la inmunidad de la persona que es expuesta (7). Trabajo especial de grado Página 18 Br. Colmenares M. Rafael A. El platino como metal no es muy peligroso, pero las sales de platino pueden causar varios efectos sobre la salud, como son (7): • Alteración del ADN. • Cáncer • Reacciones alérgicas de la piel y mucosas • Daños en órganos, como es el intestino, riñones y la médula. • Daños en la audición Finalmente, un peligro del platino es que este puede causar la potenciación de toxicidad de otros productos químicos peligrosos en el cuerpo humano, como es el Selenio (7). 4.4. Efectos ambientales del platino La aplicación del platino en productos metálicos no es conocido que cause muchos problemas ambientales, pero sabemos que causa problemas de salud serios en el lugar de trabajo. El platino es emitido al aire a través de los escapes de los coches que utilizan gasolina. Consecuentemente, los niveles de platino en el aire pueden ser más altos en ciertas localizaciones, por ejemplo en garajes, en túneles y en terrenos de empresas de camiones (7). Los efectos del platino sobre los animales y el ambiente posiblemente no hayan sido investigados todavía extensamente. La única cosa que se conoce es que el Platino se acumulará en las raíces de plantas después de ser tomado. Si se come raíces de plantas que contengan platino puede hacer un daño en los animales y humanos, pero no está todavía claro. Los microorganismos pueden ser capaces de convertir las substancias de platino en sustancias más peligrosas en suelos, pero sobre este tema se tiene poca información (7). Trabajo especial de grado Página 19 Br. Colmenares M. Rafael A. 5. CISPLATINO. Hablando del primer fármaco anticancerígeno metálico; su descubrimiento fue totalmente casual cuando Barnett Rosenberg, profesor de Biofísica de la Universidad del estado de Michigan, examinaba el efecto de campos eléctricos en células en crecimiento. El hecho fue que el cultivo de células, que crecía en un aparato que contenía platino, comenzó a mostrar inhibición del crecimiento celular. Se descubrió que este efecto fue causado por un producto de electrólisis entre el platino de la celda y amonio del medio de cultivo; este producto fue identificado como cis-[PtCl2(NH3)2], comúnmente conocido hoy en día como Cisplatino (Figura 1). La molécula como tal ya había sido sintetizada en 1844 por Michele Peyrone, sin embargo nunca se le había dado un uso en especial. Rosenberg sintetizó tres moléculas parecidas al cisplatino y comenzó a experimentar en tumores de ratas, encontrando que efectivamente tenían un efecto antitumoral. Una vez comprobada las moléculas y la investigación, se escogió al cisplatino para pasar a las siguientes fases de investigación por ser el más activo. En 1971 el fármaco llegó a las pruebas clínicas, y para 1978 fue aprobado para el tratamiento de cáncer de ovario y testicular (8). El cisplatino requiere de la sustitución del Cl- con agua (acuación) para la respectiva activación, la activación es lenta (2,5 horas) y sólo el enantiómero Cis es citotóxico (8). Figura. 1. Estructura del cisplatino Trabajo especial de grado Página 20 Br. Colmenares M. Rafael A. El cisplatino tiene gran actividad antitumoral para una amplia variedad de tumores sólidos incluyendo cáncer pulmonar de células pequeñas y de células no pequeñas, cáncer esofágico y cáncer gástrico, cáncer de cabeza y cáncer de cuello, y cánceres genitourinarios particularmente testiculares, de ovario y de vejiga. Cuando se usa en esquemas combinados con vinblastina y bleomicina o etopósido y bleomicina, el tratamiento con base de cisplatino ha logrado la curación del cáncer testicular de tipo seminomatoso (1). 5.1. Mecanismo de acción Aún cuando no se ha definido el mecanismos de acción preciso del cisplatino, se cree que actúa de manera similar a los agentes alquilantes. Elimina las células en todas las etapas del ciclo celular, inhibe la biosíntesis de DNA y se fija al DNA por la formación de entrecruzamientos intercadena. El sitio de fijación primario es el N7 de la guanina, pero también se presenta una interacción covalente con adenina y citosina. Los complejos de platino al parecer crean sinergia con ciertos fármacos anticancerosos. La hidratación intensiva con infusión de solución salina intravenosa sola o con sal y manitol u otros diuréticos parece reducir significativamente la incidencia de la nefrotoxicidad (1). El cisplatino también actúa como un agente alquilante bifuncional, causando entrecruzamientos entre las bandas parece correlacionarse bien con la citotoxicidad del fármaco (9). 5.2. Farmacocinética del cisplatino • Absorción: El cisplatino no se administra por vía oral o intramuscular (9). • Distribución: El cisplatino se distribuye ampliamente en los tejidos, con sus concentraciones más altas presentes en los riñones, hígado y próstata. El cisplatino puede acumularse en los tejidos del cuerpo y el fármaco puede Trabajo especial de grado Página 21 Br. Colmenares M. Rafael A. identificarse hasta seis meses después de la última dosis. El cisplatino no cruza fácilmente la barrera hematoencefálica. Se fija de manera extensa e irreversible a las proteínas del plasma y los tejidos (9). • Metabolismo: No esta claro el destino metabólico del cisplatino (9). • Excreción: El cisplatino se excreta principalmente en la orina, sin cambios. En pacientes con función renal normal, la vida media de la fase inicial de eliminación es de 25 a 79 minutos y la terminal de 58 a 78 horas. La vida media terminal del cisplatino total es de hasta 10 días (9). 5.3. Contraindicaciones y precauciones El cisplatino está contraindicado en pacientes con antecedentes de hipersensibilidad al cisplatino o a otros compuestos que contienen platino. Los pacientes que previamente se han expuesto a esto fármacos se someterán a pruebas cutáneas antes de la terapéutica con cisplatino por el potencial de que se presente una reacción alérgica. El cisplatino también esta contraindicado en aquellos con mielosupresión o transtornos de audición porque el fármaco puede agravar estos problemas (9). El cisplatino se usará con precaución o se ajustará la dosis en pacientes con deterioro de la función renal por los efectos nefrotóxicos del medicamento. No suelen usarse en quienes tienen depuración de creatinina menor de 50mL/minuto. Antes de comenzar el tratamiento se recomienda llevar a cabo audiometría basal. El cisplatino puede alterar la fertilidad. Se ha comunicado aspermia después de la terapéutica con cisplatino (9). Trabajo especial de grado Página 22 Br. Colmenares M. Rafael A. 5.4. Efectos adversos El principal efecto adverso del cisplatino es la toxicidad renal con daño tubular y necrosis, similar a la que se observa con metales pesados. Los procedimientos protectores para evitar esto son la hidratación y la diuresis. Si no, entonces es la toxicidad renal lo que limita la dosis. Es frecuente la aparición de ototoxicidad con pérdida de audición, las reacciones alérgicas, las náuseas graves y los vómitos (8). 6. ESPECTROSCOPIA DE ABSORCIÓN ATÓMICA. Es la medición e interpretación de la radiación electromagnética absorbida, dispersada o emitida por átomos, moléculas u otras especies químicas. Estos fenómenos están asociados con cambios en los estados de energía de las diferentes especies. Por consiguiente, dado que cada especie posee estados energéticos característicos, la espectroscopia puede utilizarse para identificarlos (10,11) . La espectroscopia de absorción atómica usa la absorción de la luz para medir la concentración de la fase gaseosa de átomos. Ya que la mayoría de las muestras son sólidas o líquidas, los átomos o iones de los analitos deben ser vaporizados en la flama o en un horno de grafito, y así completar la etapa (1) de la espectroscopia de absorción atómica, ya que es la producción de átomos libres de la muestra. Los átomos adsorben luz visible o ultravioleta y hacen transiciones a niveles de energía más altos, llevándose a cabo la segunda etapa de esta técnica, que no es más que la absorción de la radiación de una fuente externa. La concentración del analito es determinada por la cantidad de absorción. Las mediciones de concentración son generalmente determinadas de una curva de calibración, después de haber calibrado el aparato con los estándares de concentración conocida (4,13). Trabajo especial de grado Página 23 Br. Colmenares M. Rafael A. La fuente de luz usualmente es una lámpara de cátodo con vacío de los elementos a ser medidos. Los láseres son también usados en estos instrumentos. Los láseres son suficientemente intensos para excitar los átomos a mayores niveles de energía, esto permite a las mediciones de absorción atómica y fluorescencia atómica en un solo instrumento. Los espectrómetros de absorción atómica usan monocromadores y detectores de luz visible y ultravioleta. Los tubos fotomultiplicador son comúnmente usados como detectores de espectroscopia de absorción atómica (4). El tratamiento previo de la muestra es disolver la matriz en solución, luego se transporta la muestra bien sea por aspiración, uso de bombas peristáticas o por la utilización de jeringas; luego se realiza la nebulización que consiste en la conversión de la disolución en una niebla muy fina o aerosol líquido (un tipo muy común de nebulizador es aquel en el que la muestra se aspira a través de un tubo capilar por efecto Venturi), el líquido se dispersa en gotitas muy finas en el extremo del capilar, únicamente se introducen en la llama las gotitas de diámetro inferior a 10 μm, que constituyen sólo un 10% (las gotitas mas grandes se eliminan de la corriente de la muestra con paletas mezcladoras o se dispersan a gotas mas pequeñas por bolillas de impacto o por colisión con superficies de la pared) el aerosol final, que ahora es una niebla fina, se combina con la mezcla oxidante/combustible y es transportada hacia el quemador. Finalmente la etapa de atomización debe convertir al analito, dentro del aerosol, en átomos libres en estado basal; dentro de esta etapa se encuentran dos tipos de atomizadores, atomizador de llama y atomizadores electrotérmicos, la diferencia entre ambos es la sensibilidad, el volumen de la muestra a utilizar y la posibilidad de utilizar la muestra sólida sin tratamiento previo. Por último viene la absorción de la radiación de una fuente externa, que generalmente es una lámpara de cátodo hueco o láser, para excitar los átomos desde su estado basal a un nivel excitado y así obtener el espectro de absorción (13). Trabajo especial de grado Página 24 Br. Colmenares M. Rafael A. Figura. 2. Componentes básicos de un espectrofotómetro de absorción atómica 6.1. Instrumentación - Componentes básicos de un espectrómetro de absorción atómica (4): •Sistema de atomización; que suministre energía suficiente para la disociación del analito y la formación de átomos libres. •Fuente de radiación; que emita la línea espectral del elemento de interés. •Monocromador; para aislar la línea espectral medida. •Detector; acoplado con un sistema lector o de registro. SISTEMAS DE ATOMIZACIÓN • Con llama y quemador de premezcla que opera en régimen laminar • Sin llama (atomización electrotérmica) FUENTES DE RADIACIÓN • Cada especie química es capaz, en condiciones adecuadas, de absorber sus propias radiaciones. Trabajo especial de grado Página 25 Br. Colmenares M. Rafael A. • Se han desarrollado las lámparas de cátodo hueco y las lámparas de descarga sin electrodos (menos usadas, ampollas con un gas del elemento metaloide que se excita por calentamiento con radiación microondas). *Lámpara de cátodo hueco. Figura. 3. Lámpara de Cátodo Hueco - Para cada elemento se utiliza una lámpara, si bien se han comercializado lámparas de cátodo hueco multielementales como por ejemplo, Ca/Mg, Ag/Au, Cu/Pb/Zn, Co/Cr/Cu/Fe/Mn/Ni. MONOCROMADORES - La única finalidad del monocromador es aislar la línea de medida del elemento de interés. No son necesarios monocromadores de muy altas resoluciones. - La rendija deberá ser lo más estrecha posible, con objeto de reducir la cantidad de radiación emitida por la llama que llega al detector. DETECTORES -El detector universalmente usado en absorción atómica es el tubo fotomultiplicador. 6.2. Características de la espectroscopia absorción atómica • Es un excelente método para la determinación de elementos a nivel de trazas. Trabajo especial de grado Página 26 Br. Colmenares M. Rafael A. • El método está basado en la absorción de radiación electromagnética, cumpliéndose la ley de Beer. • Sensibilidad se define como la concentración en solución del elemento a determinar que origina una absorbancia de 0,004 (1 % de absorción) unidades a la longitud de onda usada, respecto al disolvente (blanco). • Límite de detección es la más baja concentración que estadísticamente puede distinguirse del cero (blanco). 6.3. Aplicaciones de la espectroscopia absorción atómica MÉTODOS DIRECTOS - Determinación de más de 60 elementos en las más variadas muestras: rocas, suelos, aguas, vegetales, muestras biológicas, productos petrolíferos, metales y aleaciones, combustibles nucleares, productos farmacéuticos, vinos, entre otros (4) . - Los fluidos biológicos, sangre y orina, pueden, con frecuencia, ser introducidos directamente en la llama después de una simple dilución. - Cuando se requiere la destrucción de la materia orgánica, ésta puede llevarse a cabo por calcinación en seco, o por vía húmeda. - Las muestras metálicas y las aleaciones suelen disolverse en ácidos minerales. En relación con cuestiones medioambientales, es importante conocer las concentraciones de metales pesados en aguas potables (plomo, cadmio y mercurio), debido a su toxicidad. Determinaciones directas especiales basadas en la volatilización del elemento o algún derivado (4). * Técnica del vapor frío para el mercurio (Hg). * Técnica de generación de hidruros.(As,Se,Sb,Te,Bi,Sn,Pb) - Con estas técnicas se pueden medir concentraciones muy bajas y en la práctica sin interferencias, pues los elementos se separan en fase gaseosa. Trabajo especial de grado Página 27 Br. Colmenares M. Rafael A. - Las señales generadas por las técnicas de volatilización son transitorias y por tanto la medida se debe sincronizar con la vaporización/atomización (4). MÉTODOS INDIRECTOS Los elementos no metálicos presentan sus líneas de resonancia en la región espectral correspondiente al ultravioleta de vacío y, por lo tanto, no es posible su determinación directa mediante la utilización de instrumentos convencionales (4). • Métodos basados en aumento o disminución de la absorbancia. Algunos aniones, cationes o compuestos orgánicos producen un aumento o más frecuentemente una disminución en la absorción atómica de algún metal en particular (ej. P04 3-, SO4 2-, SiO4 4 -, F-). • Precipitación del analito con un ión metálico cuya absorción pueda medirse (ej. SO4 2- con Ba2+, C2O4 2- con Ca2+). • Formación de compuestos de asociación iónica con quelatos metálicos, seguida de la extracción en fase orgánica y medida de la absorbancia atómica del metal (ej. bromoazepan con Ni2+ y ClO4-). 6.4. Absorción atómica electrotérmica La espectrofotometría de absorción atómica electrotérmica, se basa en el mismo principio que la atomización directa en llama, con la diferencia que en este caso se emplea un atomizador calentado eléctricamente (horno de grafito) en lugar del quemador de llama. Normalmente el calentamiento de la muestra se realiza en varias etapas, a temperaturas crecientes: secado, pirólisis, atomización y limpieza (12) . Tras la etapa de atomización, se obtienen átomos en estado elemental del elemento a medir. Estos átomos absorben radiación monocromática procedente Trabajo especial de grado Página 28 Br. Colmenares M. Rafael A. de la fuente (lámpara de cátodo hueco), siendo esta absorción proporcional a la cantidad de átomos elementales en el trayecto óptico (interior del tubo de grafito). Para reducir al mínimo las interferencias en la medida, se suelen añadir modificadores de matriz (12). 6.4.1. Atomización electrotérmica Los atomizadores electrotérmicos, que aparecieron por primera vez en el comercio aproximadamente en 1970, proporcionan generalmente una mayor sensibilidad debido a que toda la muestra se atomiza en un período muy corto y el tiempo promedio de permanencia de los átomos en el camino óptico es de un segundo o más. Los atomizadores electrotérmicos se utilizan para las medidas de absorción atómica y de fluorescencia atómica, pero, por lo general, no se han aplicado para la obtención directa de espectros de emisión. Sin embargo, se están empezando a utilizar para vaporizar las muestras para la introducción de las mismas en espectroscopia de emisión en plasma de acoplamiento inductivo (11). En los atomizadores electrotérmicos, unos pocos microlitros de muestra se evaporan primero a baja temperatura y, luego, se calcinan a una temperatura algo más alta en un tubo de grafito, similar al de la Figura 4b, o cubeta de grafito calentado eléctricamente. Tras la calcinación, la corriente se incrementa rápidamente a varios cientos de amperios, lo que eleva la temperatura a unos 2.000 o 3.000 ºC; la atomización de la muestra se produce en un período de tiempo de unos pocos milisegundos a segundos. En estas condiciones, se mide la absorción o la fluorescencia de las partículas atomizadas en la zona situada inmediatamente por encima de la superficie calentada (11). Trabajo especial de grado Página 29 Br. Colmenares M. Rafael A. 6.4.2. Atomizadores electrotérmicos Un equipo de atomización electrotérmica consta de tres componentes: la cabeza atomizadora, la fuente de alimentación y los controles para el suministro de gas inerte. La cabeza atomizadora reemplaza al conjunto nebulizador-quemador en el espectrómetro de absorción atómica. La fuente de alimentación suministra la corriente de operaciones al voltaje propio de la cabeza atomizadora. El control por computadora de la cámara atomizadora asegura la reproducibilidad en las condiciones de calentamiento, lo que es necesario para el análisis. La unidad de control de gas mide y controla el flujo de un gas inerte, dentro de la cabeza atomizadora y en su derrededor, durante el análisis. Este ambiente inerte evita la destrucción del grafito a temperaturas elevadas por oxidación con el aire (13). La Figura 4(a), representa una sección transversal de un atomizador electrotérmico comercial. En este sistema, la atomización tiene lugar en un tubo cilíndrico de grafito abierto por ambos extremos y que tiene un orificio central para la introducción de la muestra mediante una micropipeta. El tubo es de unos 5cm de largo y tiene un diámetro interno de algo menos de 1 cm. El tubo intercambiable de grafito se ajusta perfectamente a un par de contactos eléctricos de grafito cilíndricos que se ubican en los dos extremos del tubo. Estos contactos se mantienen dentro de una caja metálica refrigerada por agua. Existen dos corrientes de gas inerte. La corriente externa previene la entrada de aire exterior y la consiguiente incineración del tubo. La corriente interna fluye por entre los dos extremos del tubo y sale por el orificio central del compartimiento de muestra. Esta corriente no sólo elimina el aire sino que sirve también para desalojar los vapores generados a partir de la matriz de la muestra durante los dos primeras etapas de calentamiento (11). Trabajo especial de grado Página 30 Br. Colmenares M. Rafael A. Figura. 4. (a) Sección transversal de un atomizador de horno de grafito, (b) Plataforma de L`vov. La Figura 4(b) ilustra la denominada plataforma de L`vov, que se utiliza con frecuencia en los hornos de grafito, como el que se muestra en la Figura 4(a). La plataforma también es de grafito y se encuentra debajo del orificio de entrada de la muestra. La muestra se evapora y se calcina sobre esta plataforma (11). Se ha demostrado empíricamente que reduciendo la porosidad natural del tubo de grafito, se pueden mitigar algunos de los efectos de la matriz de la muestra y la pobre reproducibilidad, asociados a la atomización en horno de grafito. Durante la atomización, parte del analito y de la matriz difunden aparentemente en el tubo, lo Trabajo especial de grado Página 31 Br. Colmenares M. Rafael A. que hace más lento el proceso de atomización, obteniéndose así señales más bajas del analito. Para evitar este efecto, la mayoría de las superficies de grafito se recubren con una delgada capa de carbono pirolítico, que permite sellar los poros del tubo de grafito. El grafito pirolítico es un tipo de grafito que se ha depositado capa a capa en un medio altamente homogéneo, lo que se consigue pasando una mezcla de gas inerte y un hidrocarburo como metano a través del tubo mientras se mantiene a una temperatura elevada (11). 6.4.3. Señal de salida A la longitud de onda a la que tiene lugar la absorbancia, la señal del detector aumenta al máximo algunos segundos después de la ignición y cae rápidamente a cero cuando los productos de la atomización salen fuera. El cambio es lo suficientemente rápido (con frecuencia < 1 s) como para necesitar un sistema de adquisición de datos de alta velocidad. Los análisis cuantitativos se basan por lo general en la medida de la altura de pico, aunque también se ha utilizado el área de pico (11). 6.4.4. Características del funcionamiento de los atomizadores electrotérmicos Los atomizadores electrotérmicos ofrecen la ventaja de su elevada sensibilidad para pequeños volúmenes de muestra. En general, se utilizan volúmenes de muestra entre 0,5 y 10 µL; en estas condiciones, los límites de detección absolutos se encuentran normalmente en el intervalo de 10-10-10-13 g de analito (11). La precisión relativa de los métodos sin llama se encuentra generalmente en el intervalo del 5 al 10 por 100 en comparación con el 1 por 100 o menos que se puede esperar en la atomización con llama o plasma. Además, los métodos de horno son lentos requiriendo habitualmente varios minutos por elemento. Otra Trabajo especial de grado Página 32 Br. Colmenares M. Rafael A. desventaja es que el intervalo analítico es pequeño, siendo por lo general menor de dos órdenes de magnitud- por todo ello, la atomización electrotérmica se aplica normalmente sólo cuando la atomización con llama o plasma proporcionan límites de detección inadecuados (11). 6.4.5. Horno de grafito Presenta las siguientes características (4): -Es el tipo más popular de atomización electrotérmica. Se usa altas temperaturas para atomizar por completo una alícuota de muestra. - El descubrimiento de la cubeta de L’vov (1969) hizo que por 1ª vez la técnica del horno se aplicase con éxito en análisis cuantitativo por absorción atómica. - Esa cubeta ya no se usa, se ha mejorado y actualmente se utilizan otro tipo de hornos de temperatura programada. 6.4.6. Etapas del proceso del horno de grafito para la absorción atómica Figura. 5. Etapas de la absorción atómica electrotérmica Trabajo especial de grado Página 33 Br. Colmenares M. Rafael A. Las etapas son las siguientes (13): • Secado: La muestra se calienta por 20-30 seg a 110-125 ºC, para evaporar cualquier solvente o componente de la matriz que sea muy volátil. La muestra que queda después de esta etapa aparece como una manchas (o costra), insignificante en el interior del tubo o de la barra de grafito. La evaporación del solvente en el ciclo de secado debe ser suave para evitar pérdidas mecánica por espumaje o por salpicaduras. • Pirólisis: El ciclo de pirólisis se hace a una temperatura intermedia seleccionada para efectuar los procesos necesarios de volatilización de los componentes de la matriz con alto punto de ebullición y de pirólisis de los materiales en ella, tales como grasas y aceites, que se fraccionarán y se carbonizarán. A menudo, esta etapa conduce al analito a un estado químico diferente. El problema en esta etapa es la pérdida del analito si la temperatura de pirólisis es demasiado alta o se mantiene por mucho tiempo. • Atomización: En esta se aplica la potencia óptima máxima para elevar la temperatura del horno hasta la temperatura de atomización seleccionada. Los restos del analito se volatilizan y se disocian en átomos libres, que son los responsables de la absorción observada. • Limpieza y enfriamiento: Un flujo de gas inerte fluye limpiando las partes del tubo para evitar una vaporización subsecuente y por consiguiente una gran señal de absorción de fondo. El enfriamiento de la cubierta del metal del horno se hace con agua para evitar también vaporización subsecuente. 6.4.7. Ventajas y desventajas de la espectroscopia de absorción atómica electrotérmica (11,18): Ventajas • Sensibilidad de µg/L • Límites de detección bajos Trabajo especial de grado Página 34 Br. Colmenares M. Rafael A. • Volumen de muestra µL • Medidas en la región UV-vacio • Menor dependencia de la señal analítica de la viscosidad de la muestra (tensión superficial, densidad) • Formación escasa de óxidos de analitos • Muestras sólidas • La matriz puede ser eliminada durante la pirólisis Desventajas • Tiempo de análisis largo • Inyección volumétrica de la muestra • Interferencias espectrales (se minimizan usando corrector de fondo, modificador químico) • Costo elevado 6.4.8. Interferencias Se considera aquí la influencia de diversos factores sobre la absorbancia atómica del elemento a determinar y la forma de evitar o paliar dichos efectos (4): * Físicas * Químicas * Espectrales FÍSICAS - Se deben a cambios en las propiedades físicas, tales como viscosidad, densidad, tensión superficial, etc., en la disolución del analito y en los patrones, los cuales pueden afectar al proceso de nebulización. - Pueden evitarse procurando que las propiedades físicas y la matriz sea la misma en la muestra y en los patrones. También utilizando el método de adición estándar o, incluso, simplemente operando con disoluciones más diluidas. Trabajo especial de grado Página 35 Br. Colmenares M. Rafael A. QUÍMICAS - Son aquellas en las cuales algún tipo de compuesto molecular está presente, o se forma en la llama (óxidos, hidróxidos, carburos o nitruros metálicos térmicamente estables), con la consiguiente disminución de la población de átomos libres. - Son también interferencias aniones o elementos que pueden formar oxoaniones, tales como fosfato, silicato, aluminio, boro, etc. - Las interferencias se pueden evitar aumentando la temperatura, o bien empleando agentes liberadores (La o Sr) o agentes complejantes (AEDT). - Interferencia de ionización, supresor de ionización o tampón de ionización (Cs). ESPECTRALES - Tiene lugar cuando se produce absorción o emisión por una especie a la misma longitud de onda que el analito, o a una longitud de onda tan próxima que el monocromador no puede separar ambas señales. Pueden considerarse los siguientes casos: • Superposición de líneas de resonancia de algún componente de la matriz con la línea de resonancia del analito. • Presencia en la llama de productos con bandas de absorción anchas. Ejemplo, CaOH. • Debido a la absorción por moléculas o radicales originados en la llama por la matriz de la muestra, por la propia llama, así como la dispersión de radiación por partículas sólidas o gotitas de líquido, etc. 7. MATRIZ. Suero sanguíneo es el líquido amarillento resultante tras la coagulación de la sangre, sin anticoagulante como se muestra en la figura 6. Se define además como la parte liquida del plasma sanguíneo. El suero sanguíneo contiene en Trabajo especial de grado Página 36 Br. Colmenares M. Rafael A. solución albúminas, globulina, sales, enzimas, hormonas, vitaminas, lípidos, hidratos de carbono, aminoácidos, entre otros (19). Existe diferencia entre el plasma y el suero sanguíneo; primero son diferentes en cuanto a como se toma la muestra pues el plasma se toma con anticoagulante y el suero se obtiene de sangre sin anticoagulante... pero en realidad su diferencia radica en la proteína fibrinógeno (que ayuda a la coagulación), que el plasma si lo contiene y el suero no, pero el suero sanguíneo presenta la misma composición que el plasma sanguíneo (19). El plasma sanguíneo es la porción líquida de la sangre en la que están inmersos los elementos que la forman. Es salado y de color amarillento (19). Además de transportar las células de la sangre, también lleva los alimentos y las sustancias de desecho recogidas de las células. Esta compuesto principalmente por agua, en aproximadamente un 90%. El 10% restante lo forman sales minerales, proteínas (albúminas, globulinas y fibrinógeno), lípidos y glucosa. Al coagularse el fibrinógeno del plasma, obtenemos el suero sanguíneo (19). El fibrinógeno es una proteína del plasma sanguíneo que interviene en la coagulación (19). Figura. 6. Suero Sanguíneo. Trabajo especial de grado Página 37 Br. Colmenares M. Rafael A. El fibrinógeno (factor I) es una glicoproteína compuesta por seis cadenas polipeptídicas(figura 7): dos A-alfa, dos B-beta y dos gamma; unidas entre sí por puentes disulfuro (20). Se trata de una molécula alargada y simétrica formada por tres dominios globulares conectados por segmentos fibrilares (20). Cada mitad de la molécula se encuentra formada por tres cadenas (A-alfa, B-beta y gamma) que se enrollan en una triple hélice muy compacta en los sectores fibrilares. Los extremos amino de las seis cadenas se reúnen en el dominio globular central (20). En un hecho que parecería muy curioso, los extremos N-terminales de las cadenas A-alfa y B-beta emergen como cabos libres del dominio globular central (20) . Figura. 7. Representación de la molécula de fibrinógeno Estas cadenas son muy ricas en aspartato y glutamato, además las cadenas Bbeta poseen en esta región residuos Trabajo especial de grado formados Página 38 tirosina-O-sulfato Br. Colmenares M. Rafael A. postraduccionalmente. Estos residuos con una alta tendencia a adquirir carga negativa contribuyen a formar una región central con una muy alta densidad de carga (20). Esta región electronegativa central es la responsable de la repulsión entre moléculas de fibina que las mantiene en solución (20). La trombina ataca los enlaces arginina-glicina presentes en estos "cabos libres", separando cuatro péptidos; dos segmentos A de 18 aminoácidos cada uno (provenientes de las cadenas A-alfa), y dos segmentos B de 20 aminoácidos (provenientes de las cadenas B-beta). A estos péptidos se los suele denominar "fibrinopéptidos". El resto que queda de la molécula es un monómero de fibrina de composición alfa2beta2gamma2. Al eliminarse los fibinopéptidos desaparecen las fuerzas de repulsión intermoleculares con lo que los monómeros de fibrina tienden a agruparse espontáneamente formando asociaciones altamente ordenadas (20). Los monómeros se disponen uno a continuación del otro, cabeza con cabeza en forma de largas hebras. Estas hebras a su vez forman manojos, emparejándose con otras hebras de tal manera que la región central de los monómeros de fibrina de una se encuentra rodeada por las cabezas de los monómeros de fibrina de las otras (20). Este emparejamiento se hace posible gracias a interacciones de tipo electrostático y puente hidrógeno entre las regiones centrales de los monómeros de una y las cabezas globulares de otras (20). 8. ANTECEDENTES. En 1977 Martin F. Pera, Jr. y Colaboradores, realizaron uno de los primeros análisis de platino en material biológico por espectroscopia de absorción atómica Trabajo especial de grado Página 39 Br. Colmenares M. Rafael A. sin llama (horno de grafito) donde las muestras analizadas provenían de un canino, el resultado obtenido indica que el límite mas bajo de la detección del platino total en muestras biológicas son cerca de 2ng (21). Para ese mismo año LeRoy AF, y colaboradores, realizaron el análisis de platino en sangre y tejidos finos (riñones e hígado) tomados de ratas, utilizando la técnica de espectroscopia de absorción atómica horno grafito, obteniendo resultados no muy satisfactorios por la presencia de lípidos en la muestra, para lo cual se trató con metanol y acetona pero los resultados se mantuvieron. Finalmente se lavó con HNO3 concentrado caliente obteniéndose así buenos resultados favorables con un r=0.989 y una pendiente m=0.944 (22). En 1981 Smeyer-Verbeke J, y colaboradores, realizaron la determinación de platino en muestras biológicas por espectroscopia de absorción atómica en horno de grafito las muestras fueron sangre, plasma y orina, con tratamiento previo solo a la sangre (liofilización). Obtuvieron que la curva de calibración para patrón acuoso y una curva de adición estándar para el suero fueran iguales. La precisión obtenida del análisis del plasma y del suero era 3.1% y la sensibilidad era 1% (23). Para 1984, Drummer OH, y colaboradores realizaron la determinación cromatográfica líquida de alto rendimiento de platino (II) en plasma ultrafiltrado y orina y lo compararon con un método de espectroscopia sin llama de espectroscopia de absorción atómica; ellos determinaron que el perfil cromatográfico era idéntico para los estándares acuosos, para el plasma ultrafiltrado y para la orina (24). Para 1996, Christodoulou J, y colaboradores, determinaron oro y platino presente en proteínas de plasma de sangre utilizando ICP y espectroscopia de masas con nebulización de inyección directa, determinaron que los resultados obtenidos son Trabajo especial de grado Página 40 Br. Colmenares M. Rafael A. mas óptimos por inyección directa, ya que se omite la necesidad de un compartimiento del aerosol (25). En 1999, kloft C, y colaboradores, utilizaron la técnica de espectroscopia de absorción atómica para determinar los niveles de platino en plasma y plasma ultrafiltrado de pacientes que reciben quimioterapia, obteniendo como el limite de cuantificación mas bajo de 40ng/mL y 20ng/mL para el plasma y plasma ultrafiltrado respectivamente (26). En Febrero de 2000, Meerum Terwogt JM, y colaboradores, lograron validar un método por espectroscopia de absorción atómica electrotérmica, para determinar los niveles de platino de una fuente liposómica (SPI-77), en plasma sanguíneo (27). Luego en junio de 2001, Vouillamoz-Lorenz S, y colaboradores, lograron la validación de un método por espectroscopia de absorción atómica (AAS), para la determinación de platino en fluidos biológicos de pacientes que reciben vía oral el derivado de platino JM216, permitiendo alcanzar el límite de las cuantificaciones de hasta sólo 50, 10 y 5 ng mL-1 de Pt, para orina, plasma y plasma ultrafiltrado, respectivamente (28). Ya para febrero de 2004, O. Nygren – Cecilia Lundgren, realizaron la determinación del platino en aire del taller, en sangre y orina de las enfermeras que atiende a los pacientes que reciben la quimioterapia a base de cisplatino ellos usaron la técnica de voltametría de barrido lineal, también fueron tomadas muestras del personal médico. Se reveló diferentes concentraciones de platino para cada uno de los estudiados, en donde se obtuvo mayor concentración de platino en las enfermeras que atendían pacientes sometidos a la quimioterapia que en el aire y el personal médico (29). Trabajo especial de grado Página 41 Br. Colmenares M. Rafael A. 9. HIPÓTESIS. Dado que para el tratamiento de pacientes con cáncer, se utiliza el cisplatino en la quimioterapia como medicamento antineoplásico para inhibir la multiplicación de las células tumorales, es de suponer que si no existe un buen procedimiento que nos permita determinar los niveles de platino en estos pacientes, se encontrarán entonces niveles elevados de platino en el organismo de dichos pacientes, acarreando efectos secundarios como daños renales y en ocasiones la muerte, o niveles muy bajos del metal en dichos pacientes, trayendo como consecuencia que el tratamiento no esta siendo efectivo en su papel antineoplásico. 10. OBJETIVOS. 10.1. General: 1. Desarrollar una metodología analítica para la determinación de platino en muestras de suero sanguíneo tomados en pacientes con cáncer que reciben quimioterapia a base de cisplatino provenientes del Hospital Universitario de los Andes (IAHULA), por Espectroscopia de Absorción Atómica con Atomización Electrotérmica. 10.2. Específicos: 1. Evaluar la conservación de la muestra, tomando en consideración el envase y tiempo de almacenamiento. 2. Optimizar las etapas de secado, pirolisis y atomización del analito en patrones acuosos y en las muestras. 3. Determinar las características analíticas del método analítico. 4. Estudiar el efecto de la matriz en la determinación de platino en las muestras de suero sanguíneo. 5. Analizar muestras reales. 6. Discusión de los resultados obtenidos. Trabajo especial de grado Página 42 Br. Colmenares M. Rafael A. 11. PARTE EXPERIMENTAL. Para llevar a cabo la determinación de la concentración de platino en suero sanguíneo, se utiliza como método analítico la espectroscopia de absorción atómica con atomización electrotérmica. 11.1. Instrumentación: Se utilizó un espectrómetro de absorción atómica modelo SpectrAA Zeeman 220Z, equipado con un atomizador de grafito con calentamiento transversal y un corrector de fondo de efecto Zeeman. Se utilizaron tubos de grafito equipados con plataformas integradas de grafito pirolitíco (Varian, parte Nº 63-100012-00). Como fuente de radiación se utilizó una lámpara de cátodo hueco específica para el platino marca Varian. Figura 8. Espectrofotómetro de Absorción Atómica, marca Varian SpectrAA Zeeman 220Z, equipado con horno de grafito. Laboratorio de Espectroscopia Molecular (LEM) Facultad de Ciencias, Mérida-Venezuela. Trabajo especial de grado Página 43 Br. Colmenares M. Rafael A. Otros Equipos utilizados: Figura 9. (a) (b) (c) (d) (e) Figura 9. (a y b) Horno Microondas 1.2 pies/cúbicos, (c) Centrifugadora marca Clay Adams, (d) Balanza analítica AND, ER180A y (e) Lámparas de cátodo hueco para platino marca Varian. 11.2. Materiales y reactivos: 11.2.1. Reactivos: los reactivos usados para el análisis son los de mas alta pureza disponible y de grado analítico. El agua empleada para la preparación de soluciones y lavado de material de laboratorio, fue doblemente destilada y desionizada con resistividad especifica de 18 MΩ/cm, obtenida en un sistema Trabajo especial de grado Página 44 Br. Colmenares M. Rafael A. Millipore Milli-Q plus. Tabla Nº 1. Reactivos empleados en la preparación de las disoluciones patrón. Reactivo Pureza (%) Casa Comercial Ácido clorhídrico (HCl) 37 Riedel-de Haen Ácido nítrico (HNO3) 65 Riedel-de Haen Cloruro de Sodio (NaCl) 99,9 Riedel-de Haen 11.2.2. Material de laboratorio: ¾ Matraces aforados de diversas capacidades. ¾ Vasos de precipitado de diversas capacidades. ¾ Cilindros graduados de diversas capacidades. ¾ Pipetas graduadas y volumétricas de diversas capacidades. ¾ Propipeta. ¾ Vidrio de reloj. ¾ Gradillas metálicas, de plástico y de madera. ¾ Piseta plástica. ¾ Espátula. ¾ Micropipetas de 10-100µL, 20-200µL y 100-1000µL. ¾ Puntas plásticas desechables. ¾ Viales. 11.2.3. Limpieza del material de vidrio: todos los materiales de laboratorio y recipientes usados (vidrio, polietileno, entre otros), fueron lavados con detergente líquido y abundante agua, enjuagados con mezcla sulfocrómica, seguidamente Trabajo especial de grado Página 45 Br. Colmenares M. Rafael A. enjuagados con solución de ácido nítrico 20% (v/v), y luego se enjuagaron repetidas veces con agua desionizada de alta pureza, con el propósito de evitar la contaminación de patrones y muestras. 11.3. Preparación de la disolución patrón: .- Solución de 1000 mg/L de platino. Se requiere la disolución de 0.1000 g de platino metálico en un mínimo volumen de agua regia y evaporar justo hasta sequedad. Se le adiciona 5 mL de HCl y 0.1 g de NaCl y nuevamente evaporar hasta sequedad. El residuo se disuelve en 20 mL (1+1) de HCl y diluir en 100 mL de agua desionizada (32). 11.4. Preparación de las disoluciones para la curva de calibrado: se prepararon disoluciones de diversas concentraciones en matraces aforados de 25 mL, previamente lavados y curados con ácido nítrico 20% y agua destilada y desionizada de alta pureza. 11.5. Identificación de la matriz biológica: Suero sanguíneo: líquido amarillento y transparente, más denso que el agua, obtenido de la sangre después que ésta coagula y se centrifuga para retirar el coágulo y las células sanguíneas. El suero es la parte liquida del plasma sanguíneo, se diferencia del plasma que no contiene fibrinógeno, ésta es una proteína del plasma que, durante el proceso de coagulación, se transforma en fibrina gracias a la acción conjunta de la protrombina, una sustancia fabricada en el hígado, y de la tromboplastina, presente en las plaquetas. El coágulo es, por tanto, una red de fibrina en la cual quedan aprisionados los glóbulos de la sangre y que actúa a modo tapón de las heridas. El suero sanguíneo contiene en solución albúminas, globulinas, minerales, enzimas, hormonas, vitaminas, lípidos, hidratos de carbono, hormonas, aminoácidos, entre otros (19,20). Trabajo especial de grado Página 46 Br. Colmenares M. Rafael A. 11.6. Toma y conservación de las muestras. El muestreo se realizó en el Hospital Universitario de los Andes a un paciente que se le práctica quimioterapia a base de cisplatino tomando en cuenta la ficha clínica de este paciente. El paciente tiene 15 años de edad, y la infusión es de 100 mg de cisplatino. La muestra fue tomada después de la aplicación del medicamento, es decir a las 0 horas. La sangre se recolectó en un tubo de ensayo rotulado y sin anticoagulante. La muestra se dejo en reposo unos minutos y luego se centrifugo a 2500 r.p.m. durante 15 minutos para separar el suero sanguíneo que luego se almacenarán en un tubo rotulado. La muestra fue conservada en un envase plástico tapado y refrigerada a una temperatura de 15ºC. Para la conservación de las muestras se deben tener en cuenta ciertas consideraciones como lo son las siguientes: proteger de la luz y mantenerse a temperatura ambiente no mayor a 27°C, se considera que bajo estas condiciones es estable. Se debe evitar el contacto con partes metálicas (9,31). 11.7. Tratamiento del suero sanguíneo previo a su respectivo análisis. No se realizó ningún tratamiento preliminar para su análisis. El cisplatino puede acumularse en los tejidos del cuerpo y el fármaco puede identificarse hasta seis meses después de la última dosis. El cisplatino no cruza fácilmente la barrera hematoencefálica. Se fija de manera extensa e irreversible a las proteínas del plasma y los tejidos. Este medicamento es estable por 24 horas Trabajo especial de grado Página 47 Br. Colmenares M. Rafael A. en solución salina normal a temperatura ambiente, no se puede refrigerar porque podría haber precipitación (9). En pacientes con función renal normal, la vida media de la fase inicial de eliminación es de 25 a 79 minutos y la terminal de 58 a 78 horas. La vida media terminal del cisplatino total es de hasta 10 días (9). Por medio de estudios han demostrado que la velocidad de excreción del compuesto está íntimamente ligado a la edad del paciente, mientras más joven es el mismo, la velocidad de excreción aumenta y viceversa. En niños la excreción renal es de al menos un 50 % del cisplatino total mientras que en adultos solo un 27-35% de la dosis administrada dentro de las 48 horas después de terminar la infusión (30). 11.8. Parámetros instrumentales: las condiciones de trabajo adecuadas fueron verificadas con un patrón acuoso específico del elemento (platino). Tabla Nº 2. Programa de temperatura y parámetros instrumentales recomendados por el manual, para la determinación de platino en Horno de Grafito Varian SpectrAA Zeeman 220. Paso Temperatura (ºC) Tiempo (s) Flujo (L/min) Tipo de Gas 1 85 5.0 3.0 Normal 2 95 40.0 3.0 Normal 3 120 10.0 3.0 Normal 4 1000 5.0 3.0 Normal 5 1000 1.0 3.0 Normal 6 1000 2.0 0.0 Normal Trabajo especial de grado Página 48 Br. Colmenares M. Rafael A. 7 2700 1.3 0.0 Normal 8 2700 2.0 0.0 Normal 9 2700 2.0 3.0 Normal El volumen de inyección es de 20µL,la intensidad de corriente de la lámpara es de 10 mA, el ancho de rendija es de 0,2nm, y la longitud de onda es de 265,9nm. 11.8.1. Estudio de la conservación y almacenamiento a partir del patrón acuoso: Influencia del HNO3: Uno de los parámetros a considerar es que para la conservación y mejoras de la señal analítica es necesario acidificar todas las soluciones como lo recomienda el equipo (HNO3 al 0.2%). Para ello se realizaron pruebas donde efectivamente la señal mejoraba y las muestras mantenían su valor en el tiempo al acidificarlas. Tabla Nº 3. Absorbancia para las distintas soluciones de platino sin ácido. Concentración (ppb) Absorbancia 0 0 50 0,013 + 0,003 100 0,020 + 0,004 150 0,039 + 0,004 200 0,045 + 0,003 Trabajo especial de grado Página 49 Br. Colmenares M. Rafael A. Sol de Pt sin acidificar 0,06 0,05 Absorbancia 0,04 0,03 0,02 0,01 0,00 0 50 100 150 200 Concentración (ppb) Grafica Nº 1. Gráfica de Absorbancia vs Concentración (ppb) de las soluciones de platino sin ácido. Pendiente (m) Corte (b) 2,3x10-4 + 2x10-5 3,4x10-4 + 3x10-5 Coeficiente de Desviación Estándar correlación lineal (r) Relativa (%RSD) 0, 98839 0, 0644 Tabla Nº 4. Absorbancia para las distintas soluciones de platino con ácido. Concentración (ppb) Absorbancia 0 0 50 100 0,0136+ 0,0008 0,0288+ 0,0005 150 0,0410+ 0,0007 200 0,057+ 0,001 Trabajo especial de grado Página 50 Br. Colmenares M. Rafael A. Sol de Pt acidificadas 0,06 0,05 Absorbancia 0,04 0,03 0,02 0,01 0,00 0 50 100 150 200 Concentración (ppb) Grafica Nº 2. Gráfica de la Absorbancia vs Concentración (ppb) de las soluciones de platino con ácido. Pendiente (m) Corte (b) 2,82x10-4 + 5x10-6 -1,4x10-4 + 0, 00067 Coeficiente de Desviación Estándar correlación lineal (r) Relativa (%RSD) 0, 99944 0, 01722 Haciendo una comparación entre la grafica 1 y 2 se puede observar que efectivamente al acidificar las soluciones se mejora la respuesta instrumental, arrojando en el primer caso un coeficiente de correlación lineal (r) de 0,98839, y en el segundo caso de 0,99944. Una vez verificado que sí, era necesario acidificar las soluciones, se realizó un análisis acidificando varias soluciones de platino de 250 ppb con diferentes concentraciones de HNO3 para evaluar la respuesta instrumental. Trabajo especial de grado Página 51 Br. Colmenares M. Rafael A. Tabla Nº 5. Estudio de las distintas concentraciones de acido presente en soluciones de platino de 250 ppb (patrón acuoso). Concentración (%HNO3 ) Absorbancia 0,10 0,0452+ 0,0009 0,15 0,047+ 0,001 0,20 0,0602+ 0,0005 0,25 0,047+ 0,001 0,30 0,046+ 0,002 Soluciones de Pt a diferentes 0,065 concentraciones de HNO 3 Absorbancia 0,060 0,055 0,050 0,045 0,040 0,10 0,15 0,20 0,25 0,30 Concentración de HNO3 (%) Grafica Nº 3. Gráfica de Absorbancia vs Concentración de HNO3 en soluciones de platino de 250 ppb (patrón acuoso). Trabajo especial de grado Página 52 Br. Colmenares M. Rafael A. Este estudio también se realizo con la matriz biológica en este caso suero sanguíneo obteniéndose los siguientes resultados. Tabla Nº 6. Estudio de las distintas concentraciones de acido presente en soluciones de platino de 250 ppb (suero sanguíneo). Concentración (%HNO3 ) Absorbancia 0,10 0,0538+ 0,0006 0,15 0,051+ 0,001 0,20 0,0632+ 0,0007 0,25 0,051+ 0,001 0,30 0,0509+ 0,0009 S o lu ció n d e P t a d ife re n te s co n ce n tra cio n e s d e H N O 3 0 ,0 6 5 Absorbancia 0 ,0 6 0 0 ,0 5 5 0 ,0 5 0 0 ,1 0 0 ,1 5 0 ,2 0 0 ,2 5 0 ,3 0 C o n ce n tra ció n d e H N O 3 (% ) Grafica Nº 4. Gráfica de la Absorbancia vs Concentración de HNO3 en soluciones de platino de 250 ppb (suero sanguíneo). A partir de estas mediciones, todas las soluciones posteriores fueron acidificadas con 0.2% de HNO3, para obtener la respuesta instrumental mas óptima. Trabajo especial de grado Página 53 Br. Colmenares M. Rafael A. Estabilidad de las soluciones de platino: Se verifico la estabilidad del platino en solución, midiendo varias soluciones de platino en un intervalo interdiario en la primera semana y posteriormente en un intervalo semanal a partir de la segunda semana. Tabla Nº 7. Estudio de la estabilidad de las soluciones de platino en la semana 1 (patrón acuosos). Muestra (ppb) Día 1 Día 3 Día 5 Día 7 100 0,0276+ 0,0008 0,0276+ 0,0009 0,0281+ 0,0005 0,028+ 0,001 200 0,056+ 0,001 0,056+ 0,001 0,056+ 0,001 0,056+ 0,001 300 0,0636+ 0,0007 0,0639+ 0,0009 0,064+ 0,001 0,064+ 0,001 400 0,078+ 0,001 0,078+ 0,001 0,078+ 0,001 0,078+ 0,001 500 0,089+ 0,001 0,089+ 0,002 0,089+ 0,001 0,089+ 0,001 600 0,111+ 0,001 0,112+ 0,001 0,109+ 0,002 0,111+ 0,001 700 0,131+ 0,002 0,131+ 0,001 0,132+ 0,001 0,1312+ 0,0009 Tabla Nº 8. Estudio de la estabilidad de las soluciones de platino a partir de la semana 2 (patrón acuoso). Muestra (ppb) Semana 2 Semana 3 Semana 4 100 0,0277+ 0,0007 0,028+ 0,001 0,028+ 0,001 200 0,056+ 0,001 0,563+ 0,001 0,056+ 0,001 300 0,064+ 0,001 0,0641+ 0,0009 0,064+ 0,001 400 0,0777+ 0,0009 0,078+ 0,001 0,078+ 0,001 Trabajo especial de grado Página 54 Br. Colmenares M. Rafael A. 500 0,089+ 0,001 0,082+ 0,001 0,089+ 0,001 600 0,111+ 0,001 0,111+ 0,001 0,110+ 0,001 700 0,131+ 0,001 0,131+ 0,001 0,131+ 0,001 Tipos de envases y temperatura de almacenamiento: Los envases para el almacenamiento de las soluciones eran de polietileno sin previo uso, los cuales fueron lavados con abundante agua desionizada. Fueron conservadas a temperatura ambiente (22 – 28 ºC). En base a estos resultados se puede apreciar que las soluciones acuosas de platino son muy estables en esas condiciones por un periodo largo de tiempo. Intensidad de corriente de la lámpara: Para optimizar la intensidad de corriente de la lámpara se utilizó una solución de 250 ppb de platino (patrón acuoso), con una inyección de muestra en el equipo de 20 µL. El resto de los parámetros utilizados en este estudio, son los correspondientes a los sugeridos por el equipo representados en la tabla 1. Tabla Nº 9. Estudio de las distintas intensidades de corriente de la lámpara presente en soluciones de platino de 250 ppb (patrón acuoso). Intensidad de la lámpara (mA) Absorbancia 12 0,059+ 0,001 13 0,0595+ 0,0008 14 0,060+ 0,001 15 0,0607+ 0,0005 16 0,0600+ 0,0009 Trabajo especial de grado Página 55 Br. Colmenares M. Rafael A. 0,0610 Absorbancia 0,0605 0,0600 0,0595 0,0590 0,0585 12 13 14 15 16 Intensidad de Corriente (mA) Grafica Nº 5. Gráfica de la Absorbancia vs Intensidad de Corriente de la Lámpara (mA). Se obtuvo que la mejor corriente para la lámpara es de 15mA, como se puede observar en la gráfica anterior. 11.8.2. Optimización de la temperatura de pirólisis y atomización: para este estudio se fijó la concentración del analito en 250 µg/L de Pt. Utilizando el programa de calentamiento de horno de grafito, se varió la temperatura de pirólisis y atomización entre 800-2000ºC y 2400-2800ºC, respectivamente. Es importante señalar que el objetivo fundamental de la atapa de pirólisis es el de eliminar la máxima cantidad de componentes de la matriz incluyendo la materia orgánica que causa interferencia durante la determinación del elemento. Esto se logra incrementando la temperatura de pirólisis al máximo valor posible sin que se pierdan cantidades apreciables del analito. Por otro lado no es conveniente calentar el horno de grafito hasta temperaturas muy altas, ya que esto reduce drásticamente la vida útil del mismo. Por lo tanto la temperatura de atomización se fija en el valor mínimo posible que proporciona la mejor señal analítica. Trabajo especial de grado Página 56 Br. Colmenares M. Rafael A. Se procedió a determinar de manera definitiva la temperatura de pirólisis manteniendo la temperatura de atomización en 2700ºC para la determinación de platino tanto en patrones acuosos como en muestras de suero sanguíneo. Los resultados se muestran a continuación. Tabla Nº 10. Valores obtenidos en la optimización de la temperatura de pirólisis para el patrón acuoso. Temperatura Absorbancia 800 0,0514+ 0,0001 1000 0,060+ 0,003 1200 0,059+ 0,002 1400 0,069+ 0,004 1600 0,074+ 0,005 1800 0,066+ 0,001 2000 0,059+ 0,003 PATRON ACUOSO (P IR O L IS IS ) 0 ,0 8 0 ,0 7 ABSORBANCIA 0 ,0 6 0 ,0 5 0 ,0 4 0 ,0 3 0 ,0 2 0 ,0 1 0 ,0 0 800 1000 1200 1400 1600 1800 2000 T E M P E R A T U R A D E P IR O L IS IS ( º C ) Gráfica Nº 6.- Gráfica de optimización de la temperatura de Pirólisis para el Patrón Acuoso. Trabajo especial de grado Página 57 Br. Colmenares M. Rafael A. En el caso de la optimización con la matriz se realizó el mismo procedimiento que en el caso de la calibración del patrón acuso, solo que la solución preparada era de suero sanguíneo a 250 ppb de concentración de platino, obteniéndose los siguientes resultados: Tabla Nº 11. Valores obtenidos en la optimización de la temperatura de pirólisis para la matriz biológica (suero sanguíneo). Temperatura Absorbancia 1000 0,073+ 0,004 1200 0,074+ 0,002 1400 0,0759+ 0,0009 1600 0,079+ 0,004 1800 0,0736+ 0,0007 2000 0,069+ 0,002 S U E R O (C O N A C ID O ) (P IR O LIS IS ) 0,08 0,07 ABSORBANCIA 0,06 0,05 0,04 0,03 0,02 0,01 0,00 1000 1200 1400 1600 1800 2000 T E M P E R A T U R A D E P IR O LIS IS (ºC ) Gráfica Nº 7. Gráfica de optimización de la temperatura de pirolisis para el suero sanguíneo. Trabajo especial de grado Página 58 Br. Colmenares M. Rafael A. PATRON ACUOSO S U E R O (C O N A C ID O ) 0,08 0,07 ABSORBANCIA 0,06 0,05 0,04 0,03 0,02 0,01 0,00 800 1000 1200 1400 1600 1800 2000 T E M P E R A T U R A D E P IR O L IS IS (ºC ) Gráfica Nº 8. Gráfica de optimización de pirolisis tanto para el patrón acuoso como para el suero sanguíneo. Este paso para el caso del patrón acuoso se utilizó la misma solución acuosa (250 ppb) con la cual se optimizó la temperatura de pirólisis. Para alcanzar la optimización de la temperatura de atomización, se mantuvo constante la temperatura de pirólisis óptima obtenida en los gráficos Nº 6 (1600 ºC), mientras que se variaban las temperaturas de la etapa de atomización para determinar la apropiada para el método. Igualmente para la optimización de la temperatura de atomización con la matriz biológica, fue utilizada la solución de suero sanguíneo con una concentración de platino de 250 ppb y una temperatura de pirolisis óptima de 1600ºC, obtenida en el gráfico Nº 7. Trabajo especial de grado Página 59 Br. Colmenares M. Rafael A. Tabla Nº 12. Valores obtenidos en la optimización de la temperatura de atomización para el patrón acuoso. Temperatura Absorbancia 2400 0,052+ 0,004 2500 0,0601+ 0,0008 2600 0,069+ 0,005 2700 0,073+ 0,003 2800 0,066+ 0,004 PATR ON ACU OSO (ATOMIZACION 0,08 ABSORBANCIA 0,07 0,06 0,05 0,04 0,03 2400 2500 2600 2700 2800 TEMPER ATURA D E ATOMIZACION (ºC) Gráfica Nº 9. Gráfica de optimización de la temperatura de atomización para el patrón acuoso. Trabajo especial de grado Página 60 Br. Colmenares M. Rafael A. Tabla Nº 13. Valores obtenidos en la optimización de la temperatura de atomización para el suero sanguíneo. Temperatura Absorbancia 2400 0,0534+ 0,0008 2500 0,0623+ 0,0001 2600 0,0706+ 0,0008 2700 0,0808+ 0,0004 2800 0,0685+ 0,0006 SUERO (CON ACIDO) (ATOMIZACION) 0,08 ABSORBANCIA 0,07 0,06 0,05 0,04 0,03 2400 2500 2600 2700 2800 TEMPERATURA DE ATOMIZACION (ºC) Gráfica Nº 10. Gráfica de optimización de la temperatura de Atomización para el suero sanguíneo. Trabajo especial de grado Página 61 Br. Colmenares M. Rafael A. PATRON ACUOSO SUERO (CON ACIDO) ABSORBANCIA 0,08 0,07 0,06 0,05 2400 2500 2600 2700 2800 TEMPERATURA DE ATOMIZACION (ºC) Gráfica Nº 11. Gráfica de optimización de atomización tanto para el patrón acuoso como para el suero sanguíneo. PATRON ACUOSO (PIROLISIS-ATOMIZACION) 0,08 ABSORBANCIA 0,07 0,06 0,05 0,04 0,03 800 1200 1600 2000 T. PIROLISIS (ºC) 2400 2800 T. ATOMIZACION (ºC) Gráfica Nº 12. Gráfica de optimización de la temperatura de pirólisis y atomización para el patrón acuoso. Trabajo especial de grado Página 62 Br. Colmenares M. Rafael A. SUERO (PIROLISIS-ATOMIZACION) 0,08 ABSORBANCIA 0,07 0,06 0,05 0,04 0,03 800 1200 1600 2000 T. PIROLISIS (ºC) 2400 2800 T. ATOMIZACION (ºC) Gráfica Nº 13. Gráfica de optimización de la temperatura de pirólisis y atomización para el suero sanguíneo. PATRON ACUOSO S U E R O S A N G U IN E O 0 ,0 8 ABSORBANCIA 0 ,0 7 0 ,0 6 0 ,0 5 0 ,0 4 0 ,0 3 800 1200 1600 2000 T . P IR O L IS IS (º C ) 2400 2800 T . A T O M IZ A C IO N (º C ) Gráfica Nº 14.- Gráfica de optimización de la temperatura de pirólisis y atomización para patrón acuoso y suero sanguíneo. Trabajo especial de grado Página 63 Br. Colmenares M. Rafael A. Los resultados obtenidos son muy similares en ambos casos, es decir, el comportamiento del platino presente en el patrón acuoso como en la muestra de suero sanguíneo. Por lo que se obtuvo que la temperatura óptima de pirólisis sea de 1600 ºC. Los gráficos de atomización muestran que la temperatura óptima de atomización total del analito es de 2700 ºC. 11.8.3. Perfiles de Absorbancia: en las graficas de la figuras 10 y 11 se muestran las señales de pirólisis y atomización para el platino presente en patrones acuosos y en la matriz de suero sanguíneo. En las graficas se puede observar que los perfiles que presentan una señal más óptima con buena simetría y baja señal de fondo para la etapa de pirólisis son los presentados a una temperatura de 1600ºC, ya que los perfiles obtenidos a temperaturas anteriores son menos simétricos, presentando una señal instrumental mas baja dando a entender que estas temperaturas no dan un calentamiento adecuado al analito, además se puede observar en los perfiles de la matriz biológica que estas temperaturas inferiores a 1600ºC no son adecuadas, ya que no se realiza una volatilización completa de los componentes orgánicos de la misma, y esto se puede observar ya que dichos perfiles presentan mucho ruido. En los perfiles de las temperaturas superiores a 1600ºC, se puede observar que son muy altas debido a que se tiene pérdida del analito ya que se obtienen señales instrumentales mas bajas, además se obtienen perfiles menos simétricos. También se puede notar que el tiempo de aparición para el patrón acuoso el cual es de 2,71seg es muy similar al de la matriz biológica que es de 2,79seg, dichos valores no presentan diferencia significativa para un 95% de confianza. Para la temperatura de atomización se tiene que la más óptima es la de 2700ºC, podemos observar que los perfiles son mas simétricos y presentan una señal instrumental mas alta por lo que a esta temperatura se tiene una optimización Trabajo especial de grado Página 64 Br. Colmenares M. Rafael A. completa del analito, temperaturas mas altas conllevan a perdida de analito y señales mas bajas y perfiles menos simétricos tal como se puede observar en la figura 10 y 11. Utilizando temperaturas inferiores a 2700ºC, se obtienen señales mas bajas y perfiles con baja simetría, indicando que no existe una atomización completa del analito. Además podemos observar que el tiempo de aparición para la temperatura de atomización es muy similar tanto para el patrón acuoso el cual es de 2,65seg como para la matriz biológica en este caso suero sanguíneo el cual es 2,67seg, realizando el análisis estadístico para un 95% de probabilidad no existe diferencia significativa entre dichos valores. TEMPERATURA DE PIROLISIS 1000 ºC Respuesta Instrumental Señal de Fondo 0,09 Respuesta Instrumental Señal de Fondo 0,09 0,07 0,07 0.07 0,06 0,06 0.06 0,04 Absorbancia 0.08 0,05 0,05 0,04 0.04 0,03 0.03 0,02 0,02 0.02 0,01 0,01 0,00 0,00 4 0.01 0.00 0 6 2 4 6 1600 ºC Respuesta Instrumental Señal Fondo 4 0,02 2000 ºC Respuesta Instrumental Señal de Fondo 0,08 0,07 0,07 0,06 0,06 0,05 0,04 4 6 0,04 0,03 0,02 0,02 0,01 0,00 0,00 tiempo (seg) 0,05 0,03 0,01 0,00 Respuesta Instrumental Señal de Fondo 0,09 0,08 Absorbancia 0,04 6 tiempo (seg) 0,09 Absorbancia 0,06 2 2 1800 ºC 0,08 0 0 tiempo (seg) tiempo (seg) 0 2 4 6 0 2 4 6 tiempo (seg) tiempo (seg) Trabajo especial de grado Página 65 0.05 0,03 2 Respuesta Instrumental Señal de Fondo 0.09 0,08 0 Absorbancia 1400 ºC 0,08 Absorbancia Absorbancia 1200 ºC Br. Colmenares M. Rafael A. TEMPERATURA DE ATOMIZACION 2400 ºC Respuesta Instrumental Señal de Fondo 0,07 0,07 0,06 0,06 Absorbancia 0,08 0,05 0,04 0,08 0,05 0,04 0,03 0,03 0,02 0,02 0,01 0,01 Respuesta Instrumental Señal de Fondo Respuesta Instrumental Señal de Fondo 0,09 0,08 2600 ºC Absorbancia 0,09 Absorbancia 2500 ºC 0 2 4 0,04 0,02 0,00 0,00 0,00 0,06 0 6 2 4 0 6 2 4 2700 ºC 6 tiempo (seg) tiempo (seg) tiempo (seg) 2800 ºC Respuesta Instrumental Señal de Fondo Respuesta Instrumental Señal de Fondo 0,09 0,08 0,08 Absorbancia Absorbancia 0,07 0,06 0,04 0,06 0,05 0,04 0,03 0,02 0,02 0,01 0,00 0,00 0 2 4 6 0 2 tiempo (seg) 4 6 tiempo (seg) Figura 10. Perfiles de pirólisis y atomización para el patrón acuoso. TEMPERATURA DE PIROLISIS 1000 ºC Respuesta Instrumental Señal de Fondo 0,12 1400 ºC Respuesta Instrumental Señal de Fondo 0.12 0,10 0,08 0.08 0,08 Absorbancia 0.10 0,06 0.06 0,04 0.04 0,02 0.02 0 2 4 0,02 0,00 0 6 0,06 0,04 0.00 0,00 Respuesta Instrumental Señal de Fondo 0,12 0,10 Absorbancia Absorbancia 1200 ºC 2 4 6 0 2 tiempo (seg) tiempo (seg) 1600 ºC 1800 ºC Respuesta Instrumental Señal de Fondo 0,12 4 6 tiempo (seg) 2000 ºC Señal Instrumental Señal de Fondo Respuesta Instrumental Señal de Fondo 0.12 0,10 0,10 0.10 0,08 0.08 0.06 0.04 0,02 0.02 0,02 0,00 0.00 0 2 4 6 tiempo (seg) 0 2 4 6 0 2 4 6 Tiempo (seg) tiempo (seg) Trabajo especial de grado Página 66 0,06 0,04 0,04 0,00 Absorbancia Absorbancia Absorbancia 0,08 0,06 Br. Colmenares M. Rafael A. TEMPERATURA DE ATOMIZACIÓN 2400 ºC 2500 ºC Respuesta Instrumental Señal de Fondo 0,12 2600 ºC Repuesta Instrumental Señal de Fondo 0,12 Señal Instrumental Señal de Fondo 0,12 0,11 0,10 0,10 0,10 0,08 0,08 0,07 0,06 0,05 0,04 Absorbancia 0,08 Absorbancia Absorbancia 0,09 0,06 0,06 0,04 0,04 0,02 0,02 0,03 0,02 0,01 0,00 0,00 0 2 4 0,00 0 6 2 4 2700 ºC 0 2 4 6 Tiempo (seg) 2800 ºC Respuesta Instruemental Señal de Fondo 0,12 0,10 0,08 0,08 0,06 0,04 Señal Instrumental Señal de Fondo 0,12 0,10 Absorbancia Absorbancia 6 Tiempo (seg) tiempo (seg) 0,06 0,04 0,02 0,02 0,00 0,00 0 2 4 6 0 2 Tiempo (seg) 4 6 Tiempo (seg) Figura 11. Perfiles de pirólisis y atomización para el suero sanguíneo. En base a las pruebas realizadas se modificaron algunos parámetros analíticos para optimizar el método, los cuales se presentan a continuación. Tabla Nº 14. Programa de temperatura y parámetros instrumentales optimizados, para la determinación de platino en Horno de Grafito Varian SpectrAA Zeeman 220. .Paso Temperatura (ºC) Tiempo (s) Flujo (L/min) Tipo de Gas 1 85 5.0 3.0 Normal 2 95 40.0 3.0 Normal 3 120 10.0 3.0 Normal 4 1600 5.0 3.0 Normal Trabajo especial de grado Página 67 Br. Colmenares M. Rafael A. 5 1600 1.0 3.0 Normal 6 1600 2.0 0.0 Normal 7 2700 1.3 0.0 Normal 8 2700 2.0 0.0 Normal 9 2700 2.0 3.0 Normal El volumen de inyección es de 20µL, la intensidad de corriente de la lámpara es de 15 mA, longitud de onda es de 265,9nm, ancho de rendija es de 0,2nm. Una vez optimizados los parámetros instrumentales se procedió a realizar mediciones con muestras de la matriz biológica (suero sanguíneo), comenzando por el estudio de la estabilidad del platino contenida en dichas muestras. Estas muestras de matriz biológica se almacenaron en envases tapados de polietileno, sin previo uso y lavados con abundante agua desionizada y unas fueron conservadas a temperatura ambiente y otras refrigeradas a 14 -16 ºC. Los resultados de este estudio se muestran a continuación: Tabla Nº 15. Efecto de la temperatura y tiempo de almacenamiento en la muestra de suero sanguíneo tratada con ácido y sin ácido sobre la señal de absorbancia. Suero Sin Acido Suero Con Acido (Temperatura (Temperatura Ambiente) Ambiente) Día 1 0,035+ 0,001 Día 2 Suero Sin Acido Suero Con Acido (Refrigerada) (Refrigerada) 0,036+ 0,002 - - 0,036+ 0,002 0,031+ 0,002 0,037+ 0,001 0,034+ 0,002 Día 3 0,032+ 0,004 0,031+ 0,002 0,029+ 0,002 0,031+ 0,009 Día 4 0,029+ 0,004 0,029+ 0,006 0,027+ 0,003 0,031+ 0,005 Trabajo especial de grado Página 68 Br. Colmenares M. Rafael A. Día 5 0,025+ 0,003 0,035+ 0,002 0,039+ 0,002 0,034+ 0,002 Día 6 0,031+ 0,001 0,037+ 0,002 0,033+ 0,002 0,032+ 0,009 Día 7 0,020+ 0,001 0,019+ 0,001 0,0194+ 0,0009 0,021+ 0,001 Día 8 0,013+ 0,002 0,017+ 0,002 0,014+ 0,001 0,013+ 0,001 11.9. Curva de calibración: en este caso se preparan diversas soluciones de concentración de platino para calibrar el equipo, en ella se determina los parámetros analíticos del sistema y en especial el intervalo de trabajo. Tabla Nº 16.- Intervalo de trabajo útil para el platino. Concentración (µg/L) Absorbancia 0 0,0000 50 0,026 + 0,002 100 0,039 + 0,002 150 0,053 + 0,002 200 0,069 + 0,002 Trabajo especial de grado Página 69 Br. Colmenares M. Rafael A. PA T R O N A C U O S O 0,07 0,06 ABSORBANCIA 0,05 0,04 0,03 0,02 0,01 0,00 0 50 100 150 200 C O N C EN TR A C IO N (ppb) Gráfica Nº 15.- Curva de calibración de platino. Tabla Nº 17.- Valores de la pendiente, corte, correlación lineal y porcentaje de desviación estándar relativa, para la curva de calibración de platino. (m) (b) (r) (%RSD) 3,4x10-4 + 2x10-5 0,0023+ 0,0024 0,99484 0,0626 m: pendiente; b: corte; r: coeficiente de correlación lineal; %RSD: porcentaje de desviación estándar relativa. Ecuación de la recta: a partir de la ecuación de la recta (y=mx + b), se calcula la concentración de las muestras, donde: y= A; x= C, obteniéndose (33): A= b + m C C =(A - b) / m (Ecuación 1) Donde: A = Absorbancia registrada C= Concentración del analito (µg/L) m = Pendiente de la curva b = Punto de corte en el eje Y Trabajo especial de grado Página 70 Br. Colmenares M. Rafael A. 11.10. Estudio de interferencia: el estudio de interferencia se realiza con el propósito de observar si existe interferencia de matriz, se realizó un estudio de adición estándar Gráfica Nº 16. Al realizar el análisis estadístico para comparar las pendientes de los gráficos de calibración respectivos (Tabla Nº 18 y 19), esto refleja que no existe diferencia significativa entre las mismas. Lo cual pone de manifiesto que la matriz de las muestras suero sanguíneo no interfiere en la determinación de platino en las mismas y que es posible realizar la calibración con patrones acuosos de platino. PATRON ACUOSO SUERO SANGUINEO 0,20 0,18 0,16 ABSORBANCIA 0,14 0,12 0,10 0,08 0,06 0,04 0,02 0,00 0 100 200 300 400 500 600 700 800 CONCENTRACION (ppb) Gráfico Nº 16.- Gráfica de Adición Estándar para el patrón acuoso y el suero sanguíneo. Tabla Nº 18.- Valores de los distintos parámetros para la curva del patrón acuoso. Pendiente (m) Corte (b) Coeficiente de correlación lineal (r) Desviación Estándar Relativa (%RSD) 2,4x10-4 + 1x10-5 0,0032+ 0,0060 0,9972 0,1600 Trabajo especial de grado Página 71 Br. Colmenares M. Rafael A. Tabla Nº 19.- Valores de los distintos parámetros para la curva del suero sanguíneo. Pendiente (m) Corte (b) Coeficiente de correlación lineal (r) Desviación Estándar Relativa (%RSD) 2,2x10-4+ 1x10-5 0,0370+ 0,0059 0,9967 0,1612 Observando las dos rectas es apreciable y bajo la comparación del programa ANOVA no existe diferencia significativa entre las pendientes por lo que no existe interferencia de la matriz y no es necesaria la aplicación de un método de adición de estándares. Adicionalmente se realizó un tratamiento estadístico que verifica que no existe diferencia significativa a un 95% de confianza indicado por el hecho de que el tstudent experimental el cual fue de 0,00353, es menor que el teórico el cual es de 2,78 (34) . 11.11. Parámetros analíticos del sistema: ¾ Límite de detección (LOD): es la mínima concentración o la mínima cantidad de analito que se puede detectar para un nivel de confianza dado. Este límite depende de la relación entre la magnitud e la señal analítica y el valor de las fluctuaciones estadísticas de la señal del blanco; se calcula mediante la ecuación 2, siendo SDbl la desviación estándar del blanco y m la pendiente de la curva de calibrado (11): 3xSDbl LOD = ---------m (Ecuación 2) ¾ Límite de cuantificación (LOQ): es la concentración que produce una señal analítica mayor a la señal del blanco en 10 veces la desviación estándar del mismo, siendo además el límite inferior de las curvas de Trabajo especial de grado Página 72 Br. Colmenares M. Rafael A. calibrado e indica la cantidad mínima de platino que se puede medir con exactitud (11). 10xSDbl LOD = ---------m (Ecuación 3) ¾ Límite de linealidad experimental (LOL): es el límite que representa el último punto antes del cambio de pendiente de la recta (11). ¾ Intervalo lineal: es el intervalo que va desde el límite de detección (LOD) hasta el límite de linealidad (LOL). ¾ Intervalo lineal útil: es el intervalo que va desde la concentración más pequeña en la que aún se pueden realizar medidas cuantitativas (límite de cuantificación LOQ) hasta la concentración a la que la curva de calibrado se desvía de la linealidad (límite de linealidad LOL) (11). ¾ Intervalo trabajo: es una fracción del intervalo lineal que contiene la concentración aproximada esperada, esta fracción es la que se toma al realizar los análisis (11). Este intervalo va desde el 13,53 – 200 ppb. Trabajo especial de grado Página 73 Br. Colmenares M. Rafael A. Figura 12. Intervalo lineal de un método analítico. LOQ = límite de cuantificación; LOL = límite de linealidad. ¾ Masa característica: la masa característica esta definida como la concentración de platino, requerida para producir una señal de 1% de absorción (0,0044 unidades de absorbancia) (36). La masa característica reportada en la literatura por Bernhard Welz(38), para las mediciones de platino es de 220 pg, sin embargo este valor es muy similar con el obtenido experimentalmente, el cual es de 216 pg. Se realizaron unas pruebas en el equipo variando el volumen de inyección de la muestra obteniéndose que los resultados se mantuvieron, como se muestra en la tabla Nº 20. Trabajo especial de grado Página 74 Br. Colmenares M. Rafael A. Tabla Nº 20. Efecto del volumen de inyección en la masa característica. Volumen (µL) Masa Característica (pg) 5 222 10 220 20 216 30 218 Comparando los valores obtenidos con los valores reportados, se puede decir que se esta mejorando la sensibilidad del método en un 2%. 11.12. Evaluación del método analítico: ¾ Precisión: la precisión se define como el grado de concordancia mutua entre los datos que se han obtenido de una misma forma. La precisión indica la medida del error aleatorio, o indeterminado, se determinó mediante el porcentaje de desviación estándar relativa (%RSD) de acuerdo a la ecuación 4, siendo < 2% encontrándose ubicados dentro del intervalo (35) recomendado internacionalmente , donde SD viene a ser la desviación estándar absoluta de una serie de medidas de un patrón o muestra, y x es el promedio de las mismas medidas: SD %RSD = ---------- x 100 x Trabajo especial de grado Página 75 (Ecuación 4) Br. Colmenares M. Rafael A. Tabla Nº 21. Características analíticas del sistema. ELEMENTO Platino (Pt) mo (pg) 216 LOD LOL LOQ (µg/L) (µg/L) (µg/L) 4,06 700 13,53 m r %RSD 3,4x10-4 0,9948 0,0626 Mo= masa característica, LOD= límite de detección, LOQ= límite de cuantificación, LOL = concentración a la que la curva se desvía de la linealidad, m = pendiente, r= coeficiente de correlación, %RSD = porcentaje de desviación estándar relativa. ¾ Exactitud: la exactitud se refiere a que tan cerca del valor real se encuentra el valor medido (37) . para determinar la exactitud del método se puede realizar un estudio de recuperación o la comparación con una muestra certificada. Al carecer de una muestra certificada, se aplica un estudio de recuperación. Estudios de recuperación: los estudios de recuperación del analito en la muestra nos permite evaluar la exactitud del procedimiento. Se determinó la absorbancia a la matriz que contenía una cantidad conocida de analito (Pt). El porcentaje de recuperación alcanzado se encuentra dentro de lo propuesto por las normas internacionales ((100 ±3)%) (35). Formula de recuperación: (Ecuación 5) (µg/L analito (muestra + patrón)) – (µg/L analito (muestra)) %Recuperación = ------------------------------------------------------------------------- x 100 µg/L analito (patrón) Tabla Nº 22. Estudio de recuperación realizado en el intervalo de trabajo. Elemento Platino (Pt) Valor Agregado Valor Encontrado (µg/L) (µg/L) 50 50,4 Trabajo especial de grado 101 Página 76 % Recuperado Br. Colmenares M. Rafael A. Platino (Pt) 100 99,7 100 Platino (Pt) 150 147,8 99 Platino (Pt) 200 197,3 99 Del intervalo útil se tomaron dos puntos intermedios para verificar la exactitud del método. Tabla Nº 23. Estudio de recuperación realizado en algunos de los puntos del intervalo útil. Valor Agregado Valor Encontrado (µg/L) (µg/L) Platino (Pt) 300 300,9 100 Platino (Pt) 600 596,9 99 Elemento % Recuperado 12. DETERMINACION DE PLATINO EN SUERO SANGUINEO (muestras reales): La metodología desarrollada se aplicó para la determinación de platino en una muestra de suero sanguíneo proveniente de un paciente que recibe quimioterapia en el Hospital Universitario de Los Andes (HULA). Esta muestra fue recolectada unos minutos después de la administración del medicamento, a la cual se le aplicó un factor de dilución de 0,01:100 mL para ubicarla dentro del intervalo de trabajo escogido, obteniéndose la concentración que se muestra en la tabla Nº 24; la determinación de platino en la muestra se realizó utilizando el programa de temperatura y las condiciones instrumentales presentes en la tabla Nº 14. Trabajo especial de grado Página 77 Br. Colmenares M. Rafael A. Tabla Nº 24. Análisis de la muestra real de suero sanguíneo proveniente del Hospital Universitario de los Andes (HULA). Muestra Concentración 1(Diluida) 120,47 ± 0,07 ppb 2(Real) 1204,7 ± 0,7 ppm Este resultado confirma que esta persona se encuentra expuesta a este elemento, como era de esperarse ya que recibe el tratamiento de quimioterapia con un medicamento a base de este metal tal como es el cisplatino. Trabajo especial de grado Página 78 Br. Colmenares M. Rafael A. 13. CONCLUSIONES. • El método analítico desarrollado mediante la técnica de espectroscopia de absorción atómica con atomización electrotérmica (ETAAS), es útil para el análisis de suero en la determinación de platino de pacientes que reciben quimioterapia a base de cisplatino en forma sensible, precisa y exacta, representando una alternativa viable y válida. • De acuerdo a la bibliografía consultada y a los resultados obtenidos experimentalmente mediante el método analítico desarrollado, se obtuvo que el valor de la masa característica es de 220 y 216pg respectivamente, resultados que son muy similares y mejorándose la sensibilidad en un 2%. • Los resultados obtenidos en los estudios de interferencia realizados nos dan a entender que no se necesita el uso de ningún modificador químico, ya que no existe ningún tipo de interferencia significativa para un 95% de confianza entre las pendientes de la curva de calibración de patrón acuoso y de la matriz suero sanguíneo. • La metodología desarrollada para la determinación de platino en muestras de suero sanguíneo demuestra que es necesario la acidificación de las soluciones tanto de patrón acuoso como de la matriz en estudio, para su conservación, estabilidad en el tiempo y precisión del método. Trabajo especial de grado Página 79 Br. Colmenares M. Rafael A. 14. RECOMENDACIONES. • Prolongar el periodo de muestreo al menos durante el tiempo que dura un ciclo de quimioterapia. • Extender este trabajo en otras matrices tales como sangre completa, suero sanguíneo, entre otros. Trabajo especial de grado Página 80 Br. Colmenares M. Rafael A. 15. BIBLIOGRAFÍA. (1) CHU Edward., y otros. QUIMIOTERAPIA DEL CÁNCER. Cap. 55. Editorial Manual Moderno. Pag. 885-914. (2) CAJARAVILLE G., y otros. ONCOLOGÍA. Farmacia Hospitalaria. Tomo 2. Cap. 14. Pag. 1171-1219. (3) http://www.pisa.com.mx./cont_priv.asp?com_id=&id_prod=159&idioma=0. Novedades Cisplatino Solución Inyectable. (Fecha de Citación: 28/03/08). (4) http://es.wikipedia-org/wiki/Espectroscopia_de_absorción_Atomica. (Fecha de Citación: 28/03/08). (5) MICROSOFT ENCARTA 2007. Microsoft Corporation. Reservados Todos los Derechos. (1993-2006). (6) http://es.wikipedia.org/wiki/Platino. (Fecha de Citación: 29/03/08). (7) http:/www.lenntech.com/español/tabla-periodica/Pt.hm. (Fecha de Citación: 29/03/08). (8) PAGE P. Elive., y otros. FARMACOLOGÍA INTEGRADA. Editorial Elsevier. España. (1998). Pag. 511. (9) Mc VAN Bárbara F., INDICE de MEDICAMENTOS. Editorial El Manual Moderno; S.A. de C.V. México, D.F. (1989). Pag. 337-339. (10) HARVEY David. QUÍMICA ANALÍTICA MODERNA. Primera Edición. Editorial Mc Graw Hill. España. (2000). Pag. 412-418. (11) SKOOG Douglas., y otros. PRINCIPIOS DE ANALISIS INSTRUMENTAL. Quinta Edición. Mc Graw Hill. (2001). Pag. 223-239. (12) http:/www.personal.us.es/jmorillo/ai3/zeeman.pdf. (Fecha de Citación: 03/04/08). Trabajo especial de grado Página 81 Br. Colmenares M. Rafael A. (13) HOBART H. Willard., y otros. MÉTODOS INSTRUMENTALES DE ANÁLISIS. Grupo Editorial Iberoamericana. Cap. 9. (1991). Pag. 219-249. (14) R. Francis., y otros. ANÁLISIS QUÍMICO MÉTODOS Y TÉCNICAS INSTRUMENTALESMODERNAS. Mc Graw Hill. (2003). Pag. 229-249. (15) NAVARRO M. LA LIOFILIZACIÓN DE PRODUCTOS FARMACÉUTICOS. SINTEFARMA. Vol. 4(1). (1998). (16) GOMEZ H., y otros. MODELO COMPUTACIONAL PARA LA LIOFILIZACIÓN DE ALIMENTOS DE GEOMETRÍA FINITA. E-Grosis. Revista Digital Científica y Tecnológica. Vol. 1 (1).(2003). (17) GLASSTONE S. TERMODINÁMICA PARA QUIMICOS. Quinta Edición. Edición Española. Madrid-España. (1972). Pag. 285-286. (18) CARRERO Pablo. GUIA DE ANÁLISIS INSTRUMENTAL. (19) http://es.wikipedia.org/wiki/Plasma_Sangu%C3%AOneo (20) http://es.wikipedia.org/wiki/Coagulaci%C3%B3n (21) PERA, Martin F, Jr., y otros. ANALYSIS FOR PLATINUM IN BIOLOGICAL MATERIAL BY FLAMELESS ATOMIC ABSORPTION SPECTROMETRY. Clin Chem. Vol. 23. No. 7. (1977). Pag. 1245-1249. (22) LeRoy AF., y otros. ANALYSIS OF PLATINUM IN BIOLOGICAL MATERIALS BY FLAMELESS ATOMIC ABSORPTION SPECTROPHOTOMETRY. Biochem Med. Vol. 18. No. 2. (1977). Pag. 184-191. (23) SMEYERS-Verbeke J., y otros. THE DETERMINATION OF PLATINUM IN BIOLOGICAL FLUID BY MEANS OF GHRAPHITE FURNACE ATOMIC ABSORPTION SPECTROMETRY. Clin Chim Acta. Vol. 113. No. 3. (1981). Pag. 329-333. Trabajo especial de grado Página 82 Br. Colmenares M. Rafael A. (24) OH Drummer., y otros. HIGH-PERFORMANCE LIQUID CHROMATOGRAPHIC DETERMINATION OF PLATINUM (II) IN PLASMA ULTRAFILTRATE AND URINE: COMPARISON WITH A FLAMELESS ATOMIC ABSORPTION SPECTROMETRIC METHOD. Clin Chim Acta. Vol. 136. No. 1. (1984). Pag. 65-74. (25) CHRISTODOULOU J., y otros. DETERMINATION OF GOLD AND PLATINUM IN THE PRESENCE OF BLOOD PLASMA PROTEINS USING INDUCTIVELY COUPLED PLASMA MASS SPECTROMETRY WITH DIRECT INJECTION NEBULIZATION. Journal of Analytical Atomic Spectrometry. Vol. 11. No. 11. (Noviembre 1996). Pag. 1031-1035. (26) Kloft C., y otros. DETERMINATION OF PLATINUM COMPLEXES IN CLINICAL SAMPLES BY A RAPID FLAMELESS ATOMIC ABSORPTION SPECTROMETRY ASSAY. Therapeutic Drug Monitoring. Vol. 21. No. 6. (1999). Pag. 631-637. (27) MEERUM Terwogt JM., y otros. VALIDATED METHOD FOR THE DETERMINATION OF PLATINUM FROM A LIPOSOMAL SOURCE (SPI-77) IN HUMAN PLASMA USING GRAPHITE FURNACE ZEEMAN ATOMIC ADSORPTION SPECTROMETRY. Fresenius J Anal Chem. Vol. 366. No. 3. (2000). Pag. 298-302. (28) VOUILLAMOZ- Lorenz S., y otros. VALIDATION OF AN AAS METHOD FOR THE DETERMINATION OF PLATINUM IN BIOLOGICAL FLUIDS FROM PATIENTS RECEIVING THE ORAL PLATINUM DERIVATIVE JM216.J Pharm Biomed Anal. Vol. 25. No. 3-4. (2001). Pag. 465-475. (29) O. NYGREN., y otro. DETERMINATION OF PLATINUM IN WORKROOM AIR AND IN BLOOD AND URINE FROM NURSING STAFF ATTENDING PATIENTS RECEIVING CISPLATIN CHEMOTHERAPY. International Archives of Occupational and Environmental Healh. Vol. 70. No. 3. (2004). Pag. 209-214. Trabajo especial de grado Página 83 Br. Colmenares M. Rafael A. (30)GRONINGER E., y otros. PHARMACOKINETIC STUDIES IN CHILDREN WITH CANCER. Oncology Hematology. (2004). Pag. 179. (31) file:///G:/otros/Cisplatino%20Cons.htm . Cisplatino. (Fecha de Citación: 14/06/08). (32) MANUAL DE PERKIN ELMER. SPECIAL TOPICS. Pag. 88. (33) W. Daniels., BIOESTADISTICA. BASES PARA EL ANALISIS DE LAS CIENCIAS DE LA SALUD. Editorial Limusa, S.A. de C.V., Grupo Noriega Editores, México. (1999). (34) J. G. DICK., QUIMICA ANALITICA., Editorial el Manual Moderno, S.A. México, 11, D.F. (1979). (35) FERNANDEZ D., VASQUEZ A., OCANTO A., MANZANILLA J., GARCIA C., NAVA M., MARTINEZ J., HERNANDEZ M., GRANADILLO V., VI CONGRESO VENEZOLANO DE QUIMICA. Soc. Ven. Quim. 2003; 296: 976 – 979. (36) ROJAS E., DETERMINACION DE ALUMINIO EN AGUAS NATURALES MEDIANTE ESPECTROSCOPIA DE ABSORCION ATOMICA CON ATOMIZACION ELECTROTERMICA. Facultad de Ciencias. Universidad de Los Andes, Mérida - Venezuela. (2001). (37) http://es.wikipedia.org/wiki/Precisi%C3%B3n_y_exactitud (38) BERNHARD W., SPERTING M., ATOMIC ABSORPTION SPECTROMETRY. Editorial Wiley – VCH Verlag Gmbh. Alemania. (1999). Trabajo especial de grado Página 84