evaluacion de las diferentes técnicas de análisis de emisiones de
Anuncio

EVALUACION DE LAS DIFERENTES TÉCNICAS DE ANÁLISIS DE EMISIONES DE
LOS ÓXIDOS DE AZUFRE Y NITRÓGENO PROVENIENTES DE FUENTES FIJAS.
JOHANNA MILENA LAYTON PINILLA
UNIVERSIDAD INDUSTRIAL DE SANTANDER
FACULTAD DE CIENCIAS
ESCUELA DE QUIMICA
ESPECIALIZACION EN QUIMICA AMBIENTAL
Bucaramanga
2004
EVALUACION DE LAS DIFERENTES TÉCNICAS DE ANÁLISIS DE EMISIONES DE
LOS ÓXIDOS DE AZUFRE Y NITRÓGENO PROVENIENTES DE FUENTES FIJAS.
JOHANNA MILENA LAYTON PINILLA
Trabajo de Grado para optar al título de
Especialista en Química Ambiental
Directora
LUZ YOLANDA VARGAS FIALLO
Química, Msc
UNIVERSIDAD INDUSTRIAL DE SANTANDER
FACULTAD DE CIENCIAS
ESCUELA DE QUIMICA
ESPECIALIZACION EN QUIMICA AMBIENTAL
Bucaramanga
2004
Dios y mi familia por ser mis
guías cuando deseo alcanzar
grandes cosas en mi vida
CONTENIDO
Pag.
0. INTRODUCCION
1
1. JUSTIFICACION
3
2. LA CONTAMINACION POR EMISIONES
4
2.1. QUÍMICA ELEMENTAL DE OXIDACIÓN – REDUCCIÓN DEL
AZUFRE Y EL NITRÓGENO
5
2. 2. PRINCIPALES FUENTES GENERADORAS DE ÓXIDOS DE
AZUFRE HACIA LA ATMÓSFERA
2.2.1 Efectos para la Salud y el Ecosistema por Óxidos de Azufre
8
9
2.3. PRINCIPALES FUENTES GENERADORAS DE ÓXIDOS DE
NITRÓGENO HACIA LA ATMÓSFERA
12
2.3.1 Efectos para la Salud y el Ecosistema por Óxidos de Nitrógeno
13
2.4. PRINCIPIOS DEL MUESTREO Y ANÁLISIS DEL AIRE
14
2.4.1. Muestreo y Mediciones
16
2.4.2. Frecuencia
17
2.4.3. Selección de los puntos de muestreo
17
2.4.4. Ubicación del Plano de muestreo
17
2.4.5. Número Mínimo de Puntos de Muestreo
18
2.4.6. Ubicación de los Puntos de Muestreo
18
2.4.7. Pruebas Manuales en Chimeneas
18
2.4.7.1. Actividades de pre-muestreo
18
2.4.8. Actividades de Muestreo y Mediciones in situ
19
2.4.8.1. Mediciones in situ
19
2.4.8.2. Medición de la velocidad y flujo de gases
19
2.4.9. Actividades de Post Muestreo
19
2.4.9.1. Calibración de equipos
19
2.4.9.2. Análisis químicos
20
2.5. DESCRIPCION DE LOS METODOS DE ANALISIS DE SO2 Y
NO2 SUGERIDOS POR LA EPA.
20
2.5.1. Método Colorimétrico para la evaluación de las emisiones de NOX.
Método del Permanganato Alcalino.
20
2.5.1.1. Principio del método
20
2.5.1.2. Rango y sensibilidad
21
2.5.1.3. Interferencias
21
2.5.1.4. Equipos
21
2.5.1.4.1. Absorbedor o Colector
21
2.5.1.4.2. Sonda
21
2.5.1.4.3.Impingers
21
2.5.1.4.4. Grasa para Llaves
22
2.5.1.4.5. Tubo Secante
22
2.5.1.4.6. Bomba
22
2.5.1.4.7. Rotámetro
23
2.5.1.4.8. Medidor de Volumen
23
2.5.1.5. Reactivos
23
2.5.1.5.1. Agua Destilada
23
2.5.1.5.2. Solución Alcalina de Permanganato de Potasio 4%
23
2.5.1.5.3. Solución de Ácido Oxálico
23
2.5.1.5.4. Solución de Hidróxido de Sodio 0.5N
23
2.5.1.5.5. Solución de Hidróxido de Sodio 10N
24
2.51.5.6. Solución de EDTA 6.5%
24
2.5.1.5.7. Columna de Reducción
24
2.5.1.5.8. Ácido Clorhídrico 2N
24
2.5.1.5.9. Sulfanilamida
24
2.5.1.5.10. NEDA
24
2.5.1.5.11. cadmio
25
2.5.1.5.12. Solución de NaNO2 1000 µg No2/ml
25
2.5.1.5.13. Solución de KNO3
25
2.5.1.5.14. .Solución Trabajo de KNO3
25
5.1.5.15. Solución para el blanco
25
2.5.16. Procedimiento
25
2.5.16.1. Muestreo
25
2.5.16.2. Recuperación de la muestra
26
2.5.16.3. Calibración y Estandarización
26
2.5.16.4. Determinación de NO2
27
2.5.16.5. Determinación de NO3
29
2.5.16.6. Cálculos
29
2.5.16.7. Efecto del Almacenamiento
30
2.5.2.
METODO
TITRIMETRICO
PARA
LA
EVALUACION
DE
EMISIONES DE DIOXIDO DE AZUFRE – TITULACION BORO-TORINA
30
2.5.2.1. Principio del Método
30
2.5.2.2. Aplicabilidad
31
2.5.2.3. Equipos
31
2.5.2.3.1. Equipo para análisis
31
2.5.2.4. Reactivos de análisis
32
2.5.2.4.1. Absorbente de Tetracloromercurato de Potasio
32
2.5.2.4.2. Agua destilada Tipo II
32
2.5.2.4.3. Isopropanol
33
2.5.2.4.4. Thorina
33
2.5.2.4.5. Perclorato de Potasio
33
2.5.2.4.6. Estandarización
33
2.5.2.5. Procedimiento de análisis
34
2.5.2.5.1. Análisis para HSO4 - SO2
34
2.5.2.5.2. Análisis de SO2
35
2..6.
MONTAJE
DE
LAS
TECNICAS
ANALITICAS
PARA
LA
DETERMINACION DE NOX Y SO2 EN EMISIONES.
36
2.6.1. Montaje para NOx
36
2.6.2. Montaje para SO2
38
3. Conclusiones
41
Bibliografía
42
Anexos
43
LISTA DE FIGURAS
Pag.
Figura 1. Procesos que afectan el transporte y formación de óxidos de azufre
y de nitrógeno en la atmósfera.
5
Figura 2. Eliminación del SO2 en las vías respiratorias superiores
11
Figura 3. Tren de muestreo para monitoreo de NOx
22
Figura 4. Tren de muestreo para monitoreó de SO2
31
Figura 5. Curva de Calibración para NO2
37
Figura 6. Curva de Calibración para NO3
38
Figura 7. Carta De Control Para El Análisis De SO2 En Emisiones Por El Método
Del Bario/Torina.
40
LISTA DE TABLAS
Pag.
Tabla 1. Oxidación y reducción del azufre y del nitrógeno
7
Tabla 2. Efectos del SO2 a Diversas Concentraciones
11
Tabla 3. Fuentes de NOx
13
Tabla 4. Métodos de Análisis
20
Tabla 5. Curva de Calibración para NO2
37
Tabla 6. Curva de Calibración para NO3
37
Tabla 7. Estandarización del BaCl2
39
LISTA DE ANEXOS
Pagina
Anexo 1. Localización De Puntos De Muestreo En Ductos Circulares.
43
RESUMEN
TITULO:
EVALUACION DE LAS DIFERENTES TÉCNICAS DE ANÁLISIS DE EMISIONES DE LOS
ÓXIDOS DE AZUFRE Y NITRÓGENO PROVENIENTES DE FUENTES FIJAS∗
AUTORA : Layton, Pinilla Johanna Milena**∗
Palabras Clave: Técnicas, Óxidos de Azufre, Óxidos de Nitrógeno, Aire.
Se identificaron inicialmente las principales fuente de generación de NO2 y SO2 en fuentes fijas
reglamentadas por la EPA, e implementando finalmente estas técnicas en el Laboratorio Químico de
Consultas Industriales de la Escuela de Química de la Uis, laboratorio que no contaba con estas
pruebas para análisis de emisiones de NOx y SO2 en fuente fijas como contaminantes atmosféricos los
cuales son los principales compuestos generados por la combustión.
Estas técnicas tuvieron como principio la recolección del contamínate sobre una solución adsorbente
que luego era llevada al Laboratorio para determinar las concentraciones de estos contaminantes por
medio de la adición de un compuesto que formaba un complejo que luego desarrollaba un color al
reaccionar con otro reactivo, este color era medido por espectrometría a una longitud de onda
determinada. En el caso del análisis de NOx la solución adsorbente fue la Permanganato Alcalino, el
reactivo de color para NO2 fue 1( Naphthyl)- Etilendiamina Dihidrocloruro y la longitud de onda de
medida 540nm, y para el NO3 el salicilato de sodio que da un color amarillo con los nitratos y se miden a
una longitud de onda de 415nm. Así mismo, en la determinación de SO2 se uso como solución
adsorbente el Tetracloromercurato de potasio y se titulo con una solución de tiosulfato de sodio
utilizando como reactivo indicador la sal disodica del ácido 1-o-arsenofenilazo-2naftol-3,6-disulfónico
(Torina).
El método del permanganato alcalino fue usado en la determinación de NO2, se encontró una
sensibilidad de 0.3358, un límite de detección de 0,007 µg/ml y un límite de cuantificación de 0,01µg/ml,
para el NO3, una sensibilidad de 0.0578, un límite de detección de 0,005 µg/ml y un límite de
cuantificación de 0,01µg/ml. Igualmente para el método titrimétrico de la Torina usado en la
determinación de SO2, se encontraron unos límites de advertencia superior e inferior de 0.0153 y 0.0079
respectivamente y unos límites de confianza superior e inferior de 0,0171 y 0.0061 respectivamente. Se
implementaron estas técnicas en el Laboratorio Químico de Consultas Industriales donde según lo
encontrado estadísticamente se dio su aprobación como técnica estandarizada de análisis, así mismo se
abrió la posibilidad de efectuar laboratorio de aire para los estudiantes nuevos de la Especialización en
Química Ambiental aplicando las técnicas ya mencionadas
∗
Trabajo de grado
Facultad de Ciencias, Escuela de Química, Especialización en Química Ambiental. Yolanda Vargas Fiallo
∗∗
ABSTRACT
TITLE: EVALUATION OF THE DIFFERENT TECHNIQUES FROM ANALYSIS OF EMISSIONS OF
OXIDES OF ORIGINATING SULFUR AND NITROGEN DE FIXED FUENTES ∗
AUTHOR : Layton, Pinilla Johanna Milena ∗∗
Key words: Techniques, Oxides of Sulfur, Oxides of Nitrogen, Air.
They identified initially main the source of generation of NO2 and SO2 in fixed sources regulated by EPA,
and finally implementing these techniques in the Chemical Laboratory of Industrial Consultations of the
School of Chemistry of the Uis, laboratory that did not count on these tests for analysis of emissions of
NO x and SO2 in source fixed ones like atmospheric polluting agents which are the main ones composed
generated by the combustion.
These techniques had like principle the harvesting of contaminate on an adsorbent solution that soon
was taken to the Laboratory to determine the concentrations of these polluting agents by means of the
addition of a compound that formed a complex that soon developed a color when reacting with another
reagent, this color was measured by spectrometry to a certain wavelength. In the case of the analysis of
NOx the adsorbent solution was the Alkaline Permanganate, the reagent of color for NO2 was
1(Naphthyl) - Etilendiamina Dihidrocloruro and the wavelength of measurement 540nm, and for NO 3 the
sodium salicylate that gives a yellow color with nitrates and is not moderate to a wavelength of 415nm
Also, in the determination of SO 2 use as adsorbent solution the Tetracloromercurato of potassium and
titled with a solution of tiosulfato of sodium using like indicating reagent the disodica of 1-oarsenofenilazo-2naftol-3,6-disulfónico acid (Torina).
The method of Alkaline Permanganate used in the determination of NO2 was a sensitivity of 0.3358, it
limits of detection of 0.007µg/ml and it limits of quantification of 0.01µg/ml; for NO3 a sensitivity of
0,0578, a limit of detection of 0.005µ g/ml and a limit of quantification of 0.01 µ g/ml. Also for the method
of the Thorin/Barium used in the determination of SO2 were respectively limits of superior and inferior
warning of 0,0153 and 0,0079 and limits of superior and inferior confidence of 0.0171 and 0,0061
respectively.
These techniques in the Chemical Laboratory of Industrial Consultations were implemented where
according to the found thing statistically its approval like standardized technique of analysis occurred,
also the possibility was opened already of carrying out air laboratory for the new students of the
Specialization
in
Environmental
Chemistry
applying
the
mentioned
techniques.
∗
Work Degree
Faculty of Sciences – Shool of Chemical Yolanda Vargas Fiallo
∗∗
0. INTRODUCCION
La contaminación del aire forma parte de la vida moderna. Es la consecuencia del
desarrollo urbano de las ciudades, es el residuo de los métodos que utiliza la
industria, de la energía que utilizamos para iluminar los lugares donde vivimos, nos
divertimos y trabajamos.
La causa principal de la contaminación del aire es la
combustión, y esta es esencial para el hombre.
Cuando ocurre la combustión perfecta o teórica, el hidrógeno y el carbono del
combustible se combina con el oxigeno del aire para producir calor, luz, dióxido de
azufre y vapor de agua. Sin embargo, las impurezas del combustible, una incorrecta
relación entre el combustible y el aire, o temperaturas de combustión demasiado altas
o bajas son causa de la formación de productos secundarios, tales como monóxido de
carbono, óxidos de azufre, óxidos de nitrógeno, cenizas finas e hidrocarburos no
quemados, todos ellos contaminantes del aire.
La determinación de la cantidad de un contaminante del aire, presente en una
corriente de gas de escape, o en el ambiente atmosférico, requiere de mucho cuidado
y uso de instrumentación sensible, puesto que en muchos casos las concentraciones
de estos contaminantes es muy pequeña, aunque significativa para la salud de las
personas.
La cuantificación adecuada del SO2 y NOx, facilita el diseño de dispositivos de control
en la fuente de generación y predecir, mediante modelos matemáticos, cuál es la
concentración de estos en los sitios de impacto y aproximar el efecto que una emisión
puede tener sobre la población expuesta.
Los protocolos Ambientales a nivel mundial tienen entre sus objetivos, fomentar la
prevención de la contaminación, la producción más eficiente y determinar los límites
máximos permisibles (LMP) para el Sector Industrial. Las empresas que requieran
hacer monitoreo de emisiones atmosféricas ya sea por iniciativa propia o por
disposición de la Autoridad Competente, deberán ceñirse a lo dispuesto en un
protocolo que si no se encuentra implementado en el país para el sector industrial,
debe tomarse como referencia un estándar internacional o de nivel internacional, cuya
selección deberá ser debidamente sustentada, como es el caso de nuestro país, el
cual se ciñe en las normas internacionales para realizar cualquier investigación en el
campo de las emisiones a la atmósfera, así que durante este proceso de evaluación
de métodos de análisis se tendrán en cuenta los LMP de óxidos de azufre y nitrógeno
emitidos a la atmósfera propuestos por las autoridades internacionales como la EPA
(Agencia de protección ambiental de los Estados Unidos).
2
1. JUSTIFICACION
Debido al crecimiento que se ha venido generando en la industria en los últimos años
y a la emisión de contaminantes presentes en el aire que ellas han generado se ha
hecho necesario mantener un control de aquellas emisiones hechas hacia la
atmósfera. Una de estas emisiones es la de óxidos de azufre y nitrógeno, los primeros
son generalmente provenientes de la combustión de material fósil que contenga
azufre y del procesamiento de minerales y procesos de fabricación donde se utilice
ácido sulfúrico, los segundos provienen principalmente de la oxidación del Nitrógeno
contenido en el aire y/o presente en el combustible.
Para que el control de estas emisiones sea efectiva es necesario conocer la carga
aportante por una determinada fuente, lo cual implica obtener una muestra
representativa y un análisis químico de la sustancia, que debe efectuarse bajo
protocolos establecidos con alto grado de rigurosidad.
Por esta razón se hacen necesario evaluar las distintas técnicas de análisis de estos
contaminantes para plantear cual de ellas es la que mejor se adapta a las condiciones
actuales de los laboratorios y que tan conveniente es la implementación de esas
técnicas.
3
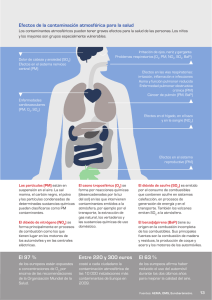
2. LA CONTAMINACION POR EMISIONES
Los óxidos de azufre y nitrógeno no se pueden capturar en forma económica por
medios físicos, ni se vuelven inocuos por combustión. Su captura y control se debe
realizar por medios químicos en lugar de físicos.
Los óxidos de azufre y nitrógeno son contaminantes que se encuentran en todas
partes, los cuales tienen muchas fuentes como lo son
el transporte, quema de
combustible, procesos industriales, disposición de desechos sólidos, entre otras.
Estos gases son fuertes irritantes respiratorios que pueden causar daño a la salud en
concentraciones elevadas, también contribuyen al problema de las partículas menores
a 10micras (PM10) y al deterioro de la visibilidad. Son las causas principales de la
lluvia ácida.
Para comprender mejor el papel que ellos hacen en la contaminación del aire es
necesario revisar algunos aspectos de su comportamiento químico.
La contaminación de un contaminante en un tiempo y lugar determinado depende:
1. De la tasa de emisión y configuración de la fuente.
2. De las reacciones químicas y físicas que transforman una especie de
contaminante en otro.
3. Del transporte y difusión (dilución) de los contaminantes como resultado de
diversas variables meteorológicas y de la difusión del contaminante en los
suelos y el agua (deposito seco) y por interacción con gotas de agua o nubes
(deposito húmedo), según se observa en la figura 1.
4
Figura 1.
Procesos que afectan el transporte y formación de óxidos de azufre y de
nitrógeno en la atmósfera.
2.1 Química Elemental de Oxidación – Reducción del Azufre y El Nitrógeno
La química del azufre y el nitrógeno es bastante semejante, tanto el azufre como el
nitrógeno en estado elemental son relativamente. Inertes e inocuos para la flora y
fauna. Los dos son necesarios para la vida; todos los animales necesitan algo de
nitrógeno y azufre en sus organismos. Si embargo, los óxidos de ellos son
contaminantes ampliamente conocidos del aire.
En algunos casos, los productos
reducidos también son contaminantes potentes del aire.
Si se reduce el nitrógeno se produce amoniaco. De manera análoga, si se reduce el
azufre se produce sulfuro de hidrógeno.
Tanto el sulfuro de hidrógeno como el
amoniaco son sustancias de olor muy fuerte, gaseosas a temperatura ambiente y
toxicas a altas concentraciones, que pueden causar la muerte. Éstas ocurren en la
5
producción y uso del amoniaco como fertilizante y refrigerante, así como en la
producción y procesamiento del gas “ácido” y el petróleo, los cuales contienen sulfuro
de hidrógeno. Ni el amoniaco ni el sulfuro de hidrógeno han demostrado ser tóxicos
en las bajas concentraciones con las que por lo general existen en la atmósfera.
En la atmósfera, el NO2 y el SO3 reaccionan con el agua para formar los ácidos nítrico
y sulfúrico, los cuales, a continuación, reaccionan con el amoniaco o cualquier otro
catión disponible, para formar partículas de nitrato o sulfato de amonio, o algún otro
nitrato o sulfato. Estas partículas que generalmente se encuentran en el rango de
tamaños de 0.1 a 1 µ son dispersoras muy eficientes de la luz, persisten en la
atmósfera hasta que las atrae la coagulación y precipitación. Colaboran de manera
significativa a los problemas urbanos de las PM10.
6
La tabla 1 muestra los productos de la oxidación y de la reducción del nitrógeno y del
azufre.
Tabla 1. Oxidación y reducción del azufre y del nitrógeno
Oxidación
Reducción
Reacción con
Oxidación
segundo
primer paso
paso
NH4+
Reacción
el
con el agua
otros
u
cationes
Con lentitud,
La velocidad
La
en
la
depende del
depende de la
que se realice
atmósfera, o
contenido de
concentración
temperatura,
por la reacción
con rapidez,
humedad
de
gas hidrogeno y
con el oxígeno
en
atmosférica.
atmosféricos.
Forma
de
reactor
elemental
atmósfera, con
HNO3
Partículas de
Ácido nítrico
nitrato
H2SO4
Partículas de
Ácido
sulfato
Normalmente
Lo
requiere
alta
frecuente
presión,
alta
un
catalizador.
Ocurre
en
mas
es
la
muchos
rapidez a altas
procesos
temperaturas,
biológicos
a
en el caso de
presiones
y
la combustión;
temperaturas
o
bien,
bajas.
lentitud
un
velocidad
cationes
catalítico.
con
a
bajas
temperaturas.
NH3
N2
NO
NO2
Ácido nítrico
Amoniaco
Bióxido
de
nitrógeno
H2S
Sulfuro de Hidrógeno
S
SO3
SO2
Bióxido
de
azufre
Trióxido
azufre
7
de
sulfúrico
2. 2. PRINCIPALES FUENTES GENERADORAS DE ÓXIDOS DE AZUFRE HACIA
LA ATMÓSFERA
El azufre es decimosexto elemento más abundante en la corteza terrestre, con una
abundancia de más o menos 260ppm. La vasta mayoría de este azufre existe en la
forma de sulfatos, en su mayoría como yeso CaSO4.2H2O, y como anhidrita, CaSO4.
Todos los combustibles usados por los humanos contienen algo de azufre. Los
combustibles como la madera contienen muy poco (0.1% o menos), en tanto que la
mayor parte de los carbones minerales tienen del 0.5% hasta el 3%. En general, los
combustoleos tienen mas azufre que la madera, pero menos que el carbón mineral.
Si se queman los combustibles, el azufre contenido, en su mayor parte, formará
bióxido de azufre:
S
SO2
+ O2
Si se pone esto en la atmósfera, llegará un momento en que vendrá hacia el suelo, en
su mayor parte con precipitación y formará CaSO4 inerte.
En el gas natural, la mayor parte del azufre se encuentra en la forma H2S, el cual se
separa con facilidad de los otros constituyentes del gas. En el petróleo líquido, así
como en los equipos petrolíferos y las arenas alquitranadas, el azufre está combinado
químicamente con los compuestos hidrocarburos; en general, no se puede extraer sin
romper los enlaces químicos. En el carbón mineral, gran parte del azufre también
esta en forma de azufre ligado químicamente, pero algunos carbones tienen una gran
fracción de su azufre en la horma de cristales pequeños (10m) de pirita de hierro
(FeSO2). Cuando el combustible se quema, casi todo el azufre que se encuentra en él
se convierte bióxido de azufre (SO2) y es arrastrado junto a con los gases de la
chimenea. Una pequeña fracción queda capturada en las cenizas y otro poco se
convierte en SO3.
8
2.2.1 Efectos para la Salud y el Ecosistema por Óxidos de Azufre
El depósito ácido, particularmente en la forma de lluvia ácida, se ha convertido en un
serio problema ambiental, y se ha asociado en diversas partes del mundo con la
acidificación de lagos, ríos y aguas superficiales, dando como resultado la
desaparición de la flora y fauna acuática.
Generalmente las calderas de las plantas generadoras de energía son la causa de
más del 50% del total de emisiones, ya que el azufre es un compuesto de todos los
petróleos y carbones naturales con una composición que varía entre 0.1 y 5%.
Algunas mediciones indican que una fracción importante de sulfatos presente en el
aire urbano tiene un tamaño efectivo de menos de 2µm y como la longitud de onda del
rango visible del espectro electromagnético varía aproximadamente entre 0.4 y 0.8nm
la presencia de este tipo de compuestos pueden causar una pronunciada reducción
de la visibilidad.
Se considera que la lluvia ácida puede producir daños directos e indirectos a los
bosques y a la vegetación y aun, a monumentos y edificios, y así contribuir a la
corrosión de metales y pinturas.
La precipitación ácida se ha definido
convenientemente como aquella lluvia con un pH menor de 5,6 ya que en un ambiente
geoquímicamente limpio, el pH de la lluvia es aproximadamente de 5,6, debido a la
combinación de bióxido de carbono con agua en el aire, produciendo así ácido
carbónico. Los cambios mas significativos que se han observado en ecosistemas
acuáticos con acidez creciente, sobre todo cuando el pH es inferior a 5,5 son los
siguientes:
a. Reducción o eliminación de la población de peces.
b. Reducción de la descomposición bacteriana y aumento de los hongos en la
materia en descomposición.
c.
Reducción de la diversidad de plantas y animales acuáticos.
d. Reducción de la productividad el fitoplancton debido a la alteración del ciclo de
generación de nutrientes.
9
e. Incremento de la biomasa y la productividad de las plantas microscópicas
bentonitas.
f.
Disminución de la biomasa y número de invertebrados herbívoros.
g. Multiplicidad de cambios en la cadena alimenticia. El aparato respiratorio esta
formado por diversas estructuras que corresponden a la nariz, boca, traquea,
bronquios, bronquiolos, alvéolos y acilos pulmonares.
Con respecto al
deposito en las vías respiratorias y a la depuración de los aerosoles inhalados,
se consideran tres grandes regiones; extratoráxica, correspondiente a las vías
que van desde la nariz hasta la epiglotis y laringe (incluyendo la boca cuando
se trata de respiración oral); traqueo bronquial, desde la traquea hasta los
bronquiolos terminales; y la región pulmonar, que incluye el parénquima
pulmonar, o sea los bronquiolos respiratorios, los conductos alveolares, los
sacos alveolares y alvéolos, es decir la región de intercambio gaseoso.
Como el bióxido de azufre es altamente soluble en el agua, es fácilmente absorbido
en la superficie húmeda de la nariz y de las vías respiratorias superiores.
La
eliminación del SO2 en las vías respiratorias superiores durante la inhalación,
determina que la cantidad penetra a las regiones traqueó bronquiales y pulmonares
del pulmón.
A las altas concentraciones de SO2 incluyen efectos sobre enfermedades de la
respiración, alteraciones en defensas pulmonares, y la provocación de la enfermedad
cardiovascular existente. Los niños, los ancianos, y la gente con asma, enfermedad
cardiovascular o enfermedad del pulmón crónica (tal como bronquitis o enfisema), son
los más susceptibles a los efectos de salud adversos asociados a la exposición al
SO2. El estándar de calidad nacional salud-health-based EPA del aire para el SO2 es
0,03 ppm (medidos en una concentración anual del medio Aritmético) y 0,14 ppm
(medidos sobre 24 horas). El SO2 es un precursor a los sulfatos, que se asocian a la
acidificación de los lagos y las corrientes, corrosión acelerada de edificios y de
monumentos, visibilidad reducida, y los efectos de salud adversos.
Como los SOx
tienden a presentarse en los mismos tipos de atmósferas contaminantes con
partículas y altas humedades relativas es difícil diferenciar los efectos de cada uno de
ellos aunque en varias especies de animales incluyendo el hombre, reaccionan ante el
10
SO2 con bronco constricción, lo que se evalúa en un ligero aumento en la resistencia
del consumo de aire.
Generalmente se muestra una reacción al SO2 a concentraciones de 5ppm o
mayores. La asociación entre la exposición a largo plazo y la mortalidad no es tan
obvia como se puede observar en la tabla 2.
Figura 2. Eliminación del SO2 en las vías respiratorias superiores.
Tabla 2. Efectos del SO2 a Diversas Concentraciones
CONCENTRACIÓN
0.03ppm, promedio anual
0.11-0.19ppm, media en 24h
0.19 ppm, media en 24 h
0.25ppm. media en 24h
0.3ppm, 8h
0.52ppm, promedio en 24h
EFECTO
Normas para la calidad del aire de
1974, lesiones crónicas en plantas.
Con un bajo nivel de partículas puede
haber un aumento en la admisión de
personas de edad mayor en los
hospitales,
debido
a
trastornos
respiratorios. Aumento en la tasa de
corrosión de los metales.
Puede haber un aumento en la
mortalidad con bajos niveles de
partículas
Puede haber un aumento en la tasa
diaria de mortalidad, acompañado por
partículas a una concentración de
750µg/m3; una marcada elevación en la
tasa de morbilidad
Algunos árboles muestran lesiones
Puede haber un aumento en la
mortalidad,
acompañado
por
la
presencia de partículas, puede ocurrir
aumento en tasa de mortalidad.
11
2.3. PRINCIPALES FUENTES GENERADORAS DE ÓXIDOS DE NITRÓGENO
HACIA LA ATMÓSFERA
Proviene de la combustión de la gasolina, el carbón y otros combustibles. Es una de
las principales causas del smog y la lluvia ácida. El primero se produce por la reacción
de los óxidos de nitrógeno con compuestos orgánicos volátiles en presencia de luz
solar. En altas concentraciones, el smog puede producir dificultades respiratorias en
las personas asmáticas, accesos de tos en los niños y trastornos en general del
sistema respiratorio. La lluvia ácida afecta la vegetación y altera la composición
química del agua de los lagos y ríos, haciéndola potencialmente inhabitable para las
bacterias, excepto para aquellas que tienen tolerancia a los ácidos.
Los óxidos estables de nitrógeno incluyen NO2, NO, N2O3, N2O y N2O5. También
existe una forma inestable NO3, de estos los únicos presentes en la atmósfera
significativamente son NO2, NO, N2O.
Por tanto, estos 3 contribuyentes
potencialmente a la contaminación del aire. El oxido nitroso N2O es un gas inerte con
características anestésicas. Su concentración ambiental 0.50ppm, que esta
considerada por debajo de la concentración de umbral que puede producir efectos
biológicos.
El NO es un gas incoloro y su concentración ambiental es por lo general menor de
0.5ppm.
a estas concentraciones, su toxicidad biológica en términos de la salud
humana es insignificante. Sin embargo el NO es un precursor de la formación del
NO2 y es además un compuesto activo en las reacciones que generan contaminantes
del aire. Por consiguiente, el control del NO es un factor importante en la reducción
de la contaminación del aire.
Más del 90% de todos los óxidos de nitrógeno producidos por el hombre se originan
por el uso de combustibles.
Principalmente proviene de fuentes estacionarias, y
fuentes móviles tales como: motores de encendido por chispa o compresión
instalados en camiones y automóviles. En la tabla 3 se pueden observar algunas de
las fuentes de emisiones de NOx.
12
Tabla 3. Fuentes de NOx
FUENTES
Transporte
Consumo
de
combustible,
en
fuentes
estacionarias
Procesos industriales
Disposición de desechos sólidos
Fabricación y uso de ácido nítrico
misceláneas
Con base en los conocimientos médicos actuales y las concentraciones de NOx este
ultimo no se considera, por ser, un riesgo para la salud, el daño real presentado por el
NOx, que se encuentra en las áreas metropolitanas se basa en el papel que tiene en
las reacciones fotoquímicas que conllevan a la formación de neblina.
Estas
reacciones forman compuestos químicos que tienen efectos adversos directos sobre
los seres humanos y las plantas.
2.3.1. Efectos para la Salud y el Ecosistema por Óxidos de Nitrógeno
El dióxido del nitrógeno puede irritar los pulmones y bajar resistencia a las infecciones
respiratorias tales como gripe. Los efectos de la exposición a corto plazo siguen
siendo exposición confusa, pero continuada o frecuente a las concentraciones que
son típicamente mucho más altas que ésos encontrados normalmente en el aire
ambiente
Pueden causar incidencia creciente de la enfermedad respiratoria aguda en niños.
El estándar de calidad nacional salud-health-based EPA del aire para NO2 es 0,053
ppm (medidos como concentración anual del medio aritmético).
Los óxidos del
nitrógeno contribuyen a la formación del ozono y pueden tener efectos nocivos en
13
ecosistemas terrestres y acuáticos.
Los óxidos del nitrógeno en el aire pueden
contribuir perceptiblemente a un número de efectos ambientales tales como lluvia
ácida y el eutroficación en aguas costeras.
2.4. PRINCIPIOS DEL MUESTREO Y ANÁLISIS DEL AIRE
Entre los componentes de un sistema de monitoreo de la contaminación del aire
incluyen: la recolección o muestreo de contaminantes del aire ambiental y de fuentes
específicas, el análisis o medición de la concentración de los contaminantes, y la
notificación y uso de la información recopilada. El muestreo y análisis del aire
ambiental y de la emisión de las fuentes puntuales son importantes para probar el
progreso en el cumplimiento de las metas nacionales de calidad del aire y para
evaluar la exposición humana. Asimismo, para desarrollar y evaluar los modelos de
dispersión del aire, ejecutar planes y realizar estudios científicos de la contaminación
del aire.
Las instituciones responsables del monitoreo de emisiones de contaminantes
generalmente designan los métodos de referencia para el muestreo y análisis de
estos. Los métodos especifican procedimientos precisos que se deben seguir para
cualquier actividad de monitoreo relacionada con el cumplimiento de
la
reglamentación.
Estos procedimientos orientan el muestreo, análisis, calibración de instrumentos y
cálculo de las emisiones. La elección del método específico de análisis depende de un
número de factores, siendo los más importantes las características químicas del
contaminante y su estado fisicoquímico. Los métodos de referencia se diseñan para
determinar la concentración de un contaminante en una muestra. La concentración se
expresa en términos de masa por unidad de volumen, usualmente en microgramos
por metro cúbico.
Hay algunos principios básicos y terminología asociada al muestreo y análisis del
contaminante. La recolección de la muestra puede realizarse mediante técnicas
14
manuales o automáticas. El análisis y medición de los contaminantes puede hacerse
por diversos medios, según las características químicas y físicas de este.
Por lo tanto, la persona encargada del diseño y ejecución del muestreo deberá ser un
profesional calificado, capacitado, con conocimiento de procesos industriales, y que
actúe en colaboración con el Laboratorio de Análisis.
Para efectos del muestreo de emisiones se realiza un muestreo isocinético (muestreo
a la misma velocidad ducto o chimenea), con el objetivo de obtener una muestra del
material particulado, el cual se halla suspendido en una corriente gaseosa, sin que se
presente separación mecánica de esta debido a la inercia que presentan las partículas
que son esencialmente polvo, humo, hollín, neblinas, vapores, escorias, cisco, cenizas
y carboncilla.
En el diseño del Programa de Monitoreo se debe considerar:
•
Objetivos
•
Actividad de la empresa
•
Etapas del proceso
•
Parámetros a medir
•
Selección de los equipos
•
Toma de muestras y su frecuencia
•
Mediciones in situ
•
Selección de los métodos analíticos
•
Evaluación de posibles errores
•
Determinación del tiempo requerido
•
Información necesaria para la interpretación y reporte de los resultados.
El objetivo principal de un monitoreo de emisiones es la obtención de información
adecuada sobre la composición de las emisiones y la cantidad relativa o tasa de la
materia que se emite a la atmósfera.
El Monitoreo de emisiones está dirigido a la obtención de información para:
15
•
Caracterizar las emisiones
•
Identificar las fuentes contaminantes específicas
•
Mantener bajo observación la tendencia de las fuentes de contaminación o de
sustancias peligrosas.
•
Evaluar la eficiencia del sistema de tratamiento de las emisiones.
•
Determinar la eficiencia de las medidas de mitigación.
•
Evaluar las variaciones de las emisiones, ocasionadas por cambios en el
proceso o en el equipo.
•
Evaluar el cumplimiento de los planes, políticas de control y fiscalización.
•
Establecer los límites máximos permisibles y controlar su grado de
cumplimiento.
•
La selección y diseño de equipos.
•
El autocontrol de la gestión empresarial.
2.4.1. Muestreo y Mediciones
El muestreo será usado para determinar la distribución de uno o varios parámetros
que sirvan de base para el programa de control de emisiones atmosféricas y para la
asignación de LMP.
En la toma de muestras y los análisis de emisiones debe considerarse los siguientes
pasos:
•
Determinación del tipo de emisión
•
Seguimiento del proceso y del estado de los conductos o chimeneas
•
Inspección de los puntos de muestreo
•
Selección del método para la toma de muestras
•
Condiciones de proceso
•
Medición de la velocidad y del flujo de gases
•
Toma de muestras
•
Análisis de las muestras
•
Cálculos
16
2.4.2. Frecuencia
Se llevará a cabo un monitoreo de los puntos de emisiones atmosféricas, con un
mínimo de tres veces para las de combustión y dos veces para las de los procesos,
en 8 períodos representativos de la fuente. En ambos casos se diferenciarán las
emisiones procedentes de la combustión y de los procesos industriales. Además se
complementará con mediciones de caudal y dos parámetros contaminantes típicos del
proceso, como mínimo.
2.4.3. Selección de los puntos de muestreo
Los puntos de muestreo serán seleccionados y ubicados en el plano de muestreo de
acuerdo al método 1 de la EPA1, para mediciones de velocidad y método isocinético
de partículas para lo cual será necesario realizar previamente las siguientes
actividades:
•
Revisión del plan de muestreo con los interesados
•
Verificación de las condiciones atmosféricas
•
Confirmación de los parámetros de las operaciones y de los procesos de la
planta.
2.4.4. Ubicación del Plano de muestreo
En cuanto a la ubicación del plano de muestreo, los criterios normativos establecen
que debe estar en un tramo recto de sección y área constante, preferiblemente
vertical, tan alejado como sea posible de cualquier perturbación que pueda originar
cambios en la dirección del flujo.
La distancia del plano de muestreo hacia la perturbación más cercana según las
normas de la EPA debe ser mayor o igual a dos (2) diámetros en el sentido contrario
al del flujo y medio (0,5) diámetro en el sentido igual al flujo.
_______________________________
1. Esta información se encuentra en la página www.epa.gov.
17
2.4.5. Número Mínimo de Puntos de Muestreo
La velocidad, generalmente no es igual en todos los puntos de la sección transversal
de un ducto por lo que será necesario obtener valores representativos, dividiendo la
sección en un mayor número de áreas y realizar mediciones en el centro de gravedad
de cada uno. El valor promedio de todas las mediciones será la velocidad media de la
sección.
Según los criterios de la EPA, el número mínimo de puntos dependerá del número de
diámetros entre la perturbación más cercana y el plano de muestreo. Se debe usar la
figura correspondiente a la norma EPA Método 1, a fin de obtener el número de
puntos en el plano de muestreo (ver Anexo 1).
2.4.6. Ubicación de los Puntos de Muestreo
Después de determinado el número de puntos, será necesario ubicarlos en los
diámetros del área, en ductos rectangulares, para la ubicación de los puntos de
muestreo se determinarán las dos dimensiones (largo y ancho), luego el numero de
puntos mínimos y la matriz de los puntos se presentará en una tabla. Los puntos de
muestreo se ubicarán en el centro de cada rectángulo. Se determinarán las descargas
de contaminantes a la atmósfera procedente de la emisión de los gases de
combustión y de los procesos industriales.
2.4.7. Pruebas Manuales en Chimeneas
Se distinguen tres etapas en el proceso de muestreo: premuestreo, toma de muestra y
post muestreo.
2.4.7.1. Actividades de pre-muestreo: Previamente al muestreo se debe realizar las
siguientes actividades:
•
Calibración de los equipos e instrumentos
18
•
Preparación de filtros, reactivos y materiales
•
Confección de una lista de equipos, materiales, reactivos, accesorios, etc., los
que serán llevados al campo, así como, hojas de datos de campo, formularios,
cronograma de muestreo, etc.
•
Embalaje para el transporte
•
Traslado al lugar de muestreo.
2.4.8. Actividades de Muestreo y Mediciones in situ
2.4.8.1. Mediciones in situ
Las mediciones in situ en los puntos de emisión, se llevan a cabo mediante equipos
que se montan en las mismas chimeneas. Los equipos para el análisis de SO2, NOx y
CO están basados en el infrarrojo, ultravioleta, espectrofotometría y electroquímico.
El analizador de combustión permite analizar la eficiencia de combustión y los
parámetros ambientales que se emiten a la atmósfera.
2.4.8.2. Medición de la velocidad y flujo de gases
El medidor de velocidad de salida de gases consta de un medidor con conectores de
plástico, escala de lectura en pulgadas de agua y pies por minuto, tubo Pilot de 8" o
18", el mismo que es introducido en el orificio de muestreo de la chimenea.
El caudal será medido en forma indirecta a través del registro de velocidades
utilizando un manómetro diferencial y un tubo pilot. Con la sección de la chimenea se
establecerá el caudal correspondiente a cada evaluación.
2.4.9. Actividades de Post Muestreo
2.4.9.1. Calibración de equipos
19
Se deberá chequear que los equipos mantengan la calibración establecida.
2.4.9.2. Análisis químicos
Los métodos de análisis que se seleccionen dependerán principalmente de la
tecnología disponible y siguiendo los métodos recomendados por la EPA.
2.5. DESCRIPCION DE LOS METODOS DE ANALISIS DE SO2 Y NOX
PARA
EMISIONES, SUGERIDOS POR LA EPA.
Estos métodos aplican en la medida de emisiones de NOx y SO2 del vapor generado
por la combustión de combustible fósil, plantas eléctricas, plantas de producción de
ácido nítrico, y otras fuentes.
Tabla 4. Métodos de Análisis
Contaminante
Método de Análisis EPA
Método 6
Dióxido de Azufre
Titrimétrico de la Torina (Thorin)
Óxidos de
Método 7C
Nitrógeno
Colorimétrico / Permanganato Alcalino
Estos métodos se describen a continuación.
2.5.1. MÉTODO COLORIMETRICO PARA LA EVALUACION DE LAS EMISIONES
DE NOX. MÉTODO DEL PERMANGANATO ALCALINO
2.5.1.1. Principio Del Método
El dióxido de nitrógeno es absorbido del aire por una solución alcalina de
permanganato de potasio, en la cual el NOx (NO + NO2) de las emisiones se oxida a
NO2 y NO3, el NO3 se reduce a NO2 con el cadmio2, y el NO2 se analiza
colorimétricamente usando un reactivo que forma un compuesto azo-coloreado.
El color producido por el reactivo es medido en un espectrofotómetro a 540nm.
20
2.5.1.2. Sensibilidad
La mínima concentración para la cual este método puede ser usado con confianza es
7 mg NO2/m3 (7ppmv).
2.5.1.3. Interferencias
Las posibles interferencias son los dióxidos de azufre (SO2) y el amoníaco (NH3). Las
altas concentraciones de SO2 podrían interferir porque el SO2 consume MnO4- (como
lo hace el NOx) y, por consiguiente, se reduce la eficiencia de cuantificación del NOx.
La oxidación del amoníaco (NH3) a NO3 en la solución absorbente es lenta. Después
de 10 dias se puede observar que en la muestra se presenta una interferencia de 6
ppm NOx (11 mg NO2/m3) cuando la muestra presenta 100 ppm de NH3. Por
consiguiente, el método no es recomendable en plantas que usen inyección de NH3
para controlar las emisiones de NOx.
2.5.1.4. EQUIPOS
2.5.1.4.1. Absorbedor o Colector
En la figura 3 se observan las partes que componen el equipo de recolección y
recuperación de la muestra a analizar. La exactitud y precisión de la recolección
depende del buen manejo que el técnico le de al equipo.
2.5.1.4.2. Sonda
Es esencialmente un tubo de Borosilicato que se caliente lo suficiente para prevenir la
condensación de agua y provisto con un filtro que elimina el material particulado.
También pueden usarse acero o teflón entubado para la sonda.
2.5.1.4.3. Impingers
Son tres tubos de vidrio con orificios restringidos que se requieren para cada tren de
muestreo. Los impingers deben ser conectados en serie con los conectores de vidrio
que gotean libremente. Se puede usar grasa sobre las llaves de paso para evitar el
goteo.
__________
2. Este procedimiento es nocivo para el medio ambiente, por lo que se variará por un método francés ya validado
21
Figura 3. Tren de Muestreo para NOx (NO2 + NO)
2.5.1.4.4. Grasa para las Llaves Bomba de Aire
Puede usarse si es necesario acetona insoluble, o grasa de silicona.
2.5.1.4.5. Tubo Secante
Es un tubo condensador de 6 a 16 mallas empacado con silica gel que ayuda a secar
la muestra de gas y proteger la bomba. Antes de usar la silica gel, debe secarse a
177ºC (350 ºF) durante 2 horas.
2.5.1.4.6. Bomba
La bomba de diafragma de goteo libre, tira el gas a través del tren. Se debe instalar un
pequeño disminuidor de tensión entre la bomba y el rotámetro para evitar
perturbaciones durante el trabajo del rotametro.
22
2.5.1.4.7. Rotámetro
Debe ser capaz de proporcionar un flujo con una precisión de la medición dentro del
2%, la cual es aproximadamente 1litro/min.
2.7.1.4.8. Medidor de volumen
Se req uiere de un medidor de gas seco, suficientemente exacto para medir el
volumen de la muestra con una exactitud del 2 %, calibrado a la proporción de flujo
seleccionada y a las condiciones realmente encontradas durante la prueba preliminar,
y equipado con un sensor de temperatura.
2.5.1.5. Reactivos
Todos deben ser grado analítico.
2.5.1.5.1. Agua Destilada
Libre de nitritos
2.5.1.5.2. Solución Alcalina de Permanganato de Potasio 4%
Disolver 40 g de KMnO4 y 20 g de NaOH en 940 ml de agua.
2.5.1.5.3. Solución de ácido oxálico
Disolver 48 g de ácido oxálico [(COOH)2.2H2O] en el agua, y diluir a 500 ml. Sin
calentar la solución.
2.5.1.5.4. Solución de Hidroxido de sodio 0.5 N
Disolver 20 g de NaOH en el agua, y diluir a 1 litro.
23
2.5.1.5.5. Solución de Hidroxido de sodio, 10 N
Disolver 40 g de NaOH en el agua, y diluir a 100 ml.
2.5.1.5.6. Solución de EDTA 6.5% w/v
Disolver 6.5 g de EDTA (Acido etilendiaminotetracético) en agua, y diluir a 100 ml. La
disolución se mezcla mejor usando un agitador magnético.
2.5.1.5.7. Columna impregnada con Solución de EDTA.
Agregar 20 ml de solución de EDTA 6.5% a 960 ml de agua, y ajustar el pH entre 11.7
y 12.0 con NaOH 0.5N.
2.5.1.5.8. Ácido clorhídrico (HCl), 2 N.
Adicionar 86 ml de HCl concentrado a un balón volumétrico de 500ml. Guardar en
botella de vidrio ambar.
2.5.1.5.9. Solución de Sulfanilamida
Se disuelven 10g de sulfanilamida en 400ml de agua destilada, luego se adiciona
25ml de ácido fosfórico concentrado (85%), llévando hasta 500ml. Esta solución es
estable por varios meses si se almacena en un frasco oscuro y hasta un año si se
mantiene refrigerada.
2.5.1.5.10. Solución de N – (1 Naphthyl)- Etilendiamina Dihidrocloruro (NEDA)
Se disuelven 0.1g de NEDA en 100ml de agua destilada. La solución es estable por
un mes si se mantiene en una botella oscura en el refrigerador.
24
2.5.1.5.11. Cadmio
Se prepara enjuagando en HCl 2N durante 5 minutos hasta que el color sea plata-gris.
Después, se enjuaga el cadmio con el agua hasta que los enjuagues sean neutros
probando con papel indicador del pH. Se debe tener cuidado con el desprendimiento
de H2 durante la preparación.
2.5.1.5.12. Solución de Nitrito de sodio (NaNO2) 1000 µg NO2/ml
El NaNO2 debe permanecer en el desecador. Con precisión pese 1.4 a 1.6 g de
NaNO2 disolver en agua, y diluir a 1 litro. Calcule la concentración de NO2. Esta
solución es estable por lo menos 6 meses bajo las condiciones del laboratorio.
2.5.1.5.13. Solución Normal de Nitrato de Potasio (KNO3)
Secar durante 2 horas KNO3 a 110ºC (230 ºF), y dejar enfriar en el desecador. Con
precisión pese 9 a 10 g de KNO3, disuelva en el agua, y diluya a 1 litro. Calcular la
concentración de NO3. Esta solución es estable durante 2 meses sin preservación
bajo las condiciones del laboratorio.
2.5.1.5.14. Solución trabajo de KNO3
Pipetar 7 ml de solución normal de KNO3 en un balón aforado de 100ml, y diluir.
2.5.1.5.15. Solución para el Blanco
Disolver 2.4 g de KMnO4 y 1.2 g de NaOH en 96 ml de agua. Alternativamente, diluir
60ml de solución de KMnO4/NaOH a 100 ml.
2.5.1.6. Procedimiento
2.5.1.6.1. Muestreo
Se adicionan 200 ml de la solución de KMnO4/NaOH a cada uno de los impingers del
tren de muestreo y se ensambla como se muestra en la figura 3, ajustando el
25
calentador de la sonda a una temperatura suficiente que prevenga la condensación de
agua. Se ajusta el flujo de la muestra a un valor entre 400 y
500 ml/min (0.014 y 0.018 cfm), teniendo en cuenta no exceder esta tasa de flujo, y
una vez ajustado, se mantiene constante durante 60 minutos.
NOTA: Cuando la concentración de SO2 sea mayor que 1200 ppm, el tiempo de
muestreo debe ser reducido a 30 minutos, para evitar que los orificios de los impinger
se tapen con MnO2.
2.5.1.6.2. Recuperación de la muestra.
Se desconectan los impingers. Se traspasa la solución absorbente que tiene cada uno
de los impingers a una botella de polietileno de 1litro usando un embudo y Agitando
con una varilla de vidrio para prevenir pérdida de la muestra. Se completa el traslado
cuantitativo enjuagando los impingers y los tubos que los une con el agua hasta que
los enjuagues estén de un color rosa pálido, y agregarlos a la botella. Se mezcla la
muestra, y se marca el nivel de la solución.
2.5.1.6.3. Calibración y Estandarización
•
Curva de Calibración para NO2
Se diluyen 5.0 ml de solución de 1000 µg NO2 /ml a 200 ml con el agua. Esta solución
contiene 25µg NO2 /ml. Usar esta solución para preparar una curva de calibración que
cubra el rango de 0.25 a 3.00 µg NO2/ ml.
Se miden 0, 0.25, 0.5, 1, 2 y 3 ml de solución trabajo de nitrito (25µgNO2/ ml) en
balones aforados de 25ml, aforando con solución de KMnO4/NaOH. Se pipetean 10ml
del patrón en un vaso de precipitado de 150ml, se adicionan 10 ml de solución del
sulfanilamida y 1.4 ml de solución de NEDA, Se mezcla la solución con una varilla de
vidrio dejando reaccionar por 10min. Se elabora la grafica de concentración contra
absorbancia haciendo las mediciones a 540mn.
Esta curva debe verificarse
semanalmente, para observar si han cambiado la respuesta de los reactivos.
26
•
Curva de Calibración para NO3
Diluir 50 ml de la solución de 500 µg NO3/ml y agregar 1 ml de cloroformo CHCl3 antes
de aforar a 500 ml como método d preservación. La solución es estable por lo menos
seis meses. Esta solución contiene 50 µg NO3 /ml, de ahí preparar una curva de
calibración que cubra el rango de 0.50 a 6.00µgNO3/ml.
Se miden 0, 0.25, 0.5, 1, 2 y 3 ml de solución trabajo de nitrito (50µgNO2/ ml) en
balones aforados de 25ml, aforando con solución de KMnO4/NaOH. Tomar de cada
uno de los anteriores patrones un volumen de 10 ml en cápsulas pequeñas de
porcelana o en crisoles grandes de porcelana y agregar a cada una 1 ml de solución
de salicilato de sodio al 1 %. Recordando que para este análisis se debe trabajar las
muestras y los patrones decolorados con ácido oxálico.
Evaporar a sequedad en la estufa por dos o tres horas a 105 ºC (evitando la
carbonización). Dejar enfriar las cápsulas y disolver el residuo con 1 ml de H2SO4
concentrado, dejando caer el ácido sobre toda la superficie de la cápsula. Agitar y
esperar 10 minutos, agregar a la cápsula 10ml de agua destilada y 15 ml de NaOH
5N, agitar bien y determinar la absorbancia a 415 nm. Hacer un blanco con solución
de KMnO4/NaOH decolorada para elaborar la curva de calibración respectiva. La
coloración amarilla es estable durante una hora. .
2.5.1.6.4. Determinación de NO3
Se toma una alícuota de 100ml de la muestra y del blanco y se transfieren a un vaso
de precipitado de 400ml que contienen barras agitadoras magnéticas. Usando un
pHmetro, agregue H2SO4 concentrado agitando hasta un pH de 0.7, permitiendo que
las soluciones entren en contacto por 15 minutos. Se tapan los vasos con vidrio de
reloj hasta que la temperatura de las soluciones llegue a
Se
disuelven
4.8g
de
ácido
oxálico
en
un
50 ºC.
volumen
mínimo
de
agua,
aproximadamente, 50ml, a la temperatura ambiente. No se debe calentar la solución.
Se agrega esta solución a la muestra, despacio, en varios intervalos, hasta que la
solución de KMnO4 se decolora. Si el color no es completamente eliminado, se
27
prepara un poco más de solución de ácido oxálico, y se agrega hasta que una se
obtenga una solución incolora.
Se agrega un exceso de ácido oxálico, disolviendo 1.6 g de ácido oxálico en 50 ml de
agua, y agregando 6 ml de esta solución a la solución incolora. Si hay materia en
suspensión, agregue H2SO4 concentrado hasta obtener una solución clara.
Seguidamente se ajusta el pH entre 11.7 y 12.0 con NaOH 10 N.
Se transfiere
cuantitativamente la mezcla a un embudo de Buchner y se filtra el precipitado. La
mezcla es recogida en un erlenmeyer de filtración de 500ml y lavando el material
sólido cuatro veces con el agua. Cuando la filtración se completa, el embudo es
lavado, y cuantitativamente es trasladado el filtrado a un frasco volumétrico de 500ml
hasta completar el aforo. Las muestras están ahora listas para la reducción del
cadmio.3
Se pipetea una alícuota de 50ml de la muestra en un vaso de precipitado de 150ml
poniendo a agitar la muestra con un agitador magnético. Se pipetea 1.0ml de la
solución de EDTA 6.5%, y se mezcla.
Se debe establecer un flujo en la llave de paso a una proporción de flujo de 7 a 9
ml/min de solución de enjuague a través de la columna de reducción de cadmio.
Usando una probeta de 50ml para recolectar y medir el volumen de la solución.
Después del último del enjuague la solución se pasa a un balón aforado de 250ml.
Completando el traspaso cuantitativo de la muestra a través de la columna. Las
muestras están ahora preparadas para el análisis de NO2.
La variación que se hace en esta parte del método de análisis de NO3 análisis se basa
en la complejidad que da este método y en el grado de toxicidad que genera el
cadmio, por ello el análisis de NO3 se cuantificará utilizando el método francés de
CARON y BACQUET.
______________________________
3. El procedimiento que sigue es el que se variará por el de Caron Y Bacquet.
28
El método de CARON y BACQUET para el análisis de nitratos se basa en que en
presencia de salicilato de sodio, los nitratos dan el p.-nitrosalicilato de sodio de color
amarillo, susceptible de medirse colorimétricamente.
Se toman 10 ml de la muestra decolorada en una cápsula pequeña de porcelana y se
realiza el mismo procedimiento que a los patrones. Si el contenido de nitratos es alto,
es necesario hacer una dilución previa.
2.5.1.6.5. Determinación de NO2
•
Tratamiento de la Muestra
Se completa cualquier pérdida en la solución absorbente llevándola hasta la marca de
1000ml del frasco de muestreo con agua destilada. Se transfiere una alícuota de
10ml de la solución problema o muestra a un vaso de precipitado de 150mL, se
adicionan 10 ml de solución del sulfanilamida y 1.4 ml de solución de NEDA, Se
mezcla la solución con una varilla de vidrio. Se prepara así mismo el blanco con la
solución KMnO4/NaOH no expuesta, siguiendo el procedimiento que se le hizo a la
muestra. Se deja en reposo por 10min esperando el desarrollo de color.
Se mide la absorbancia de la solución de muestra contra el blanco a 540nm, en la
curva de calibración construida con anterioridad.
2.5.1.6.6. Cálculos
•
Para el Análisis de NO3
Se leen los µgNO3- /ml directamente de la curva patrón.
•
Para el Análisis de NO2
29
Se leen los µgNO2-/ml directamente de la curva patrón. Teniendo en cuenta la
siguiente tabla:
1 ppm NO2 = 1.912 mg NO2/m3
1 ft3 = 2.832 * 10-2 m3
2.5.1.6.7 Efecto del Almacenamiento
Después del muestreo, la solución absorbente puede ser almacenada hasta 3
semanas sin pérdidas, si se mantiene tapada en la oscuridad. Sin embargo después
de que se produzca el calor por los reactivos adicionados, la muestra debe ser
analizada en pocas horas. La absorbancia de la solución coloreada decrece cerca del
4% por día.
2.5.2. MÉTODO TITRIMÉTRICO PARA LA EVALUACION DE EMISIONES DE
DIÓXIDO DE AZUFRE - TITULACION BARIO-TORINA
2.5.2.1. Principio Del Método
Una muestra de gas es extraída de un punto de muestreo en la fuente por medio de
un tren de muestreo como el que se observa en la figura 4, y las neblinas ácidas
incluyendo el trióxido de azufre es separado del dióxido de azufre. Ambas fracciones
son cuantificadas separadamente por titulación del Bario-Torina.
30
Figura 4. Tren de Muestreo para Emisiones de SO2
2.5.2.2. Aplicabilidad
Este método es aplicable para la determinación de neblinas de ácido sulfúrico
(incluyendo el trióxido de azufre) y dióxido de azufre en fuentes fijas.
2.5.2.3. Equipos
2.5.2.3.1. Equipo para el Análisis
Bureta de 50 ml.
Pipetas volumétricas, 10, 25, 50, ml.
Erlenmeyers de 250ml
Cilindro graduado.
Agitador magnético.
Porta muestra.
31
Espátulas.
Balanza Analítica.
Gotero
Se debe realizar el lavado de material preferiblemente con solución sulfocromica.
2.5.2.4. Reactivos De Análisis
2.5.2.4.1. Absorbente Tetracloromercurato de Potasio, 0.04M
Precaución: Altamente tóxico, usar guantes de caucho.
Disolver 10.86g de cloruro mercúrico, 0.065g de sal disódica del ácido etilendiamino
tetraacético EDTA, y 6.0g de cloruro de potasio en agua destilada y completar a un
litro.
El pH de este reactivo debe ser aproximadamente 4.0, pudiendo usarse si se
mantiene un rango de 3.0 a 5.0. Fuera de este rango, debe descartarse.
El reactivo no debe usarse por más de seis (6) meses y desecharse cuando aparezca
un precipitado visible.
Disposición: A cada litro de solución absorbente agregar carbonato de sodio
Na2CO3, hasta neutralización (alrededor de 10g) y 10g de zinc granular, agitar varias
veces y dejar decantar por 24H, después secar el precipitado y colocarlo en un
recipiente para su posterior disposición.
2.5.2.4.2. Agua Destilada, desionizada, tipo II
Agua tipo II: Para la verificación de la pureza adicionar 0.20 mililitros de permanganato
de potasio KMnO4 (0.316 gr de KMnO4 en un litro de agua), a 500 mililitros de agua
destilada adicionar 1 mililitro de ácido sulfúrico (H2SO4) concentrado y el
permanganato de potasio (KMnO4). El agua toma un color púrpura, si no desaparece
32
el color en una hora a temperatura ambiente el agua es apta para el análisis, si el
color desaparece, el agua no debe utilizarse.
2.5.2.4.3. Isopropanol.
2.5.2.4.4. Sal disodica del Ácido 1-o-arsenofenilazo-2naftol-3,6-disulfonico.
(Thorin).
Disolver 0.20 gr en 100 ml de agua destilada tipo II.
2.5.2.4.5. Perclorato de Bario (0.010N)
Pesar 1.95 gr de Ba(ClO4)2.3H2O en 200 ml de agua destilada y diluir a 1lt con
isopropanol. También se puede usar 1.22 gr de BaCl2.2H2O.
•
Reacción del bario con el thorin:
Ba 2++ SO4= + THORIN (X2+) --------> BaSO4 + THORIN (Ba2+)
Amarillo
Rosado
2.5.2.4.6. Estandarización del Ba(ClO4)2.3H2O.
Tomar 25 ml de H2SO4 0.01 N, en un erlenmeyer de 250 ml, adicionar 100 ml de
isopropanol, 2-4 gotas de thorin, titular hasta que pase de amarillo a rosado. Para el
blanco se realiza el mismo procedimiento con la variación que el blanco es agua
destilada tipo II.
•
Cálculos
NBa(ClO4)2 = NH2SO4 * 25/ ml Ba(ClO4)2
NBa(ClO4)2: Normalidad del perclorato de bario en eq-gr/lt.
H2SO4: Normalidad del ácido sulfúrico utilizado en la estandarización del perclorato de
bario en eq-gr/lt
33
25: mililitros de ácido sulfúrico tomados para la estandarización del perclorato de
bario.
ml Ba(ClO4)2: mililitros de perclorato de bario, utilizados en la estandarización.
De esta manera se pueden hacer otras titulaciones con alícuotas de concentraciones
bajas, medias y altas. Pipetando 3, 10 y 20 ml de alícuotas de H2SO4 0.01 N en tres
erlenmeyers de 250 ml, diluir cada uno a 25 ml con agua destilada, adicionar 100 ml
de isopropanol, 2-4 gotas de thorin, y titular con perclorato de bario hasta determinar
el punto final.
2.5.2.5. Procedimiento De Análisis
2.5.2.5.1. Análisis Para El H2SO4-SO3
Agitar el contenido de isopropanol y el filtro; si el filtro se rompe en fragmentos se
debe filtrar la muestra. Tomar 100 ml de la muestra en un erlenmeyer de 250 ml,
adicionar 2-4 gotas de thorin (la cantidad de (H2SO4-SO3). se asume por la intensidad
de la coloración amarilla), titular hasta punto final (color rosa), la titulación se hace con
el perclorato de bario estandarizado, haciéndose el procedimiento mínimo por
duplicado, y el resultado no debe excederse del 1%
(0.2 ml).
Blanco: 100 ml de isopropanol, se le adiciona de 2-4 gotas de thorin, titular hasta
obtener el punto final. (Color rosa).
•
Cálculos
NH2SO4 = K2 {N(Vt - Vtb)[Vsln/Va]} Vgse
NCH2SO4: Concentración del ácido sulfúrico a condiciones estandares y base seca.
34
K2: 1.081*10-4 lb/meq (U.I): Factor de conversión incluye el número de gramos por
equivalente gramo de ácido sulfúrico. 0.04904 g/meq (U.M)
N: NBa(ClO4)2, g-eq/lt: Normalidad del perclorato de bario, usado en la
titulación, g-eq/lt.
Vt: VBa(ClO4)2 : Volumen del titulante usado para la muestra, ml
Vtb: VBa(ClO4)2 : Volumen del titulante usado en el blanco, ml
Vsln:Vt: Volumen total de la solución en la muestra, 250 ml
Va: Volumen de la alícuota titulada, 100 ml
Vgse: Volumen de gas seco medido
2.5.2.5.2. Análisis Para El SO2
La muestra se absorbe en solución de peróxido de hidrógeno al 3%. Mezclar muy bien
las soluciones contenidas en el segundo y tercer impingers, tomar 10 ml de la muestra
en un erlenmeyer de 250 ml, adicionarle 40 ml de isopropanol, 2-4 gotas de thorin (si
la solución queda amarilla es porque hay suficiente SO2), y titular hasta obtener un
color rosado.
Titular hasta punto final, con el perclorato de bario estandarizado, realizando la
titulación por duplicado, y el resultado no debe excederse del 1%
(0.2 ml).
Blanco. 100 ml de isopropanol, se le adiciona de 2-4 gotas de thorin, titular hasta
obtener el punto final. (color rosa).
•
Cálculos
CSO2 = K3 {N(Vt -Vtb)[Vsln/Va]} Vgse
35
CSO2: Concentración del dióxido de azufre a condiciones estandares y base seca.
K3: 7.061*10-5 lb/meq (U.I): Factor de conversión incluye el número de gramos por
equivalente gramo de dióxido de azufre. 0.03203 g/meq (U.M)
N: NBa(ClO4)2, g-eq/lt: Normalidad del perclorato de bario, usado en la titulación, g-eq/lt.
Vt: VBa(ClO4)2 - Volumen del titulante usado para la muestra, ml
Vtb: VBa(ClO4)2 - Volumen del titulante usado en el blanco, ml Vsln:
Vt: Volumen total de la solución en la muestra, 1000 ml
Va: Volumen de la alícuota titulada, 10 ml.
Vgse: Volumen de gas seco medido
2.6. MONTAJE DE LAS TECNICAS ANALITICAS PARA LA DETERMINACION DE
OXIDOS DE NITROGENO Y AZUFRE EN EMISIONES.
Debido a la necesidad que el Laboratorio Químico de Consultas Industriales de la
Escuela de Química de la Universidad Industrial de Santander tiene de ofrecer el
servicio de análisis de emisiones a entidades de ámbito ambiental, se hizo necesario
además de la recopilación de lo referente a las emisiones de SO2 y NOx el montaje de
las técnicas de análisis de estos contaminantes para muestras de emisiones de
fuentes estacionarias.
2.6.1. Montaje Análisis de NOx.
Después de realizar el ensayo siguiendo lo descrito en el Método de la EPA se
obtuvieron los siguientes resultados para la curva de calibración, la cual se hizo 7
veces para poder calcular la desviación estándar y sensibilidad con la cual el método
contará.
36
Tabla 5. Datos de Calibración para NO2
MEDICIONES DE ABSORBANCIA
µg/ml
s
2
0,000
3
0,001
4
0,002
5
0,000
6
0,001
7
0,000
X
Desv.
0,000
1
0,000
0.001
0.0007
0.25
0.112
0.113
0.112
0.114
0.113
0.112
0.112
0.113
0.0008
0.50
0.212
0.211
0.210
0.212
0.212
0.212
0.211
0.211
0.0008
1.00
0.352
0.352
0.352
0.353
0.353
0.351
0.353
0.352
0.0011
2.5
0.852
0.854
0.853
0.854
0.854
0.852
0.853
0.853
0.0010
Figura 5. Curva de Calibración para NO2
Sensibilidad de Calibración
Pendiente m = 0.3358
Mínima Señal Analítica Distinguible
Sm = Sb + 3S = 0.003
Límite de Detección
Cm =( Sm – Sb)/m = 0.007µg/ml
Límite de Cuantificación
LOQ = 10Sb = 0.01µg/ml
Tabla 6. Datos de Calibración para NO3
MEDICIONES DE ABSORBANCIA
µg/ml
s
2
0,001
3
0,001
4
0,002
5
0,000
6
0,001
7
0,000
X
Desv.
0,000
1
0,000
0.0003
0.0008
0.50
0.035
0.033
0.033
0.035
0.035
0.033
0.033
0.034
0.0011
1.50
0.095
0.095
0.096
0.095
0.095
0.096
0.095
0.095
0.0007
2.50
0.151
0.151
0.152
0.152
0.151
0.152
0.153
0.152
0.0008
3.5
0.203
0.202
0.202
0.203
0.203
0.203
0.202
0.203
0.0005
37
Figura 6. Curva de Calibración para NO3
Sensibilidad de Calibración
Pendiente m = 0.0578
CURVA DE CALIBRACION PARA
NO3
Mínima Señal Analítica Distinguible
Absrorbancia
0,25
Sm = Sb + 3s = 0.004
0,2
0,15
Límite de Detección
0,1
y = 0,0578x + 0,0044
Cm =( Sm – Sb)/m = 0.005µg/ml
2
R = 0,998
0,05
Límite de Cuantificación
0
0
1
2
3
4
LOQ = 10sb =0.01µg/ml
Concentración NO3 (µg/ml)
2.6.2. Montaje Análisis de SO2
Después de realizar el ensayo siguiendo lo descrito en el Método de la EPA se
obtuvieron los siguientes resultados para sacar el promedio de la medición y con
estos valores determinar los límites de advertencia y control superior e inferior, y de
esta forma mantener una carta de garantía de control analítico para la solución
titulante.
L.A.S. Límite de Advertencia Superior
L.A.I. Límite de Advertencia Inferior
L.C.S. Límite de Confianza Superior
L.C. I. Límite de Confianza Inferior
L.A.S. = Xprom + 2s
L.A.I. = Xprom - 2s
L.C.S. = Xprom + 2s
L.C.S. = Xprom - 2s
38
Tabla 7. Datos para la Creación de la Carta de Control
Análisis de SO2 en emisiones por el Método del Bario/Torina
Perclorato de Bario Normalidad
1
2
3
4
5
6
7
8
9
10
Media
DesviStand
LAS
LAI
LCS
LCI
0,010
0,013
0,011
0,015
0,010
0,010
0,014
0,012
0,010
0,011
0,0116
0,0018
0,0153
0,0079
0,0171
0,0061
DIAS
PROMEDIO
LAS
LCS
LAI
LCI
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,0116
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,015
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0171
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0079
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
0,0061
39
Datos
reales
0,013
0,012
0,011
0,015
0,011
0,013
0,010
0,011
0,010
0,010
0,012
Figura 7. Carta De Control Para El Análisis De SO2 En Emisiones Por El
Método Del Bario/Torina
Normalidad del Titulante
VERIFICACION DE LA CONCENTRACION DEL
PERCLORATO DE BARIO (0.01N)
Patrón: de H2SO4 0.01N
0,015
0,005
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
DIAS
PROMEDIO
LAS
LCS
LAI
40
LCI
Datos reales
22
23
24
25
3. CONCLUSIONES
•
La implementación de las técnicas de análisis sugerida por la EPA para las
emisiones de NOx y SO2 fue efectiva y conveniente ya que se contaba con
todos los equipos y reactivos necesarios, lo que hace posible que a corto plazo
el laboratorio químico de consultas industriales incluya dentro de su portafolio
de servicios el análisis de SO2 y NOx en muestras provenientes de emisiones
de fuentes fijas.
•
El análisis de NOx el cual consta de una reducción del NO3 a NO2 utilizando
una columna empacada de cadmio, se vario debido al inconveniente tanto
ambiental como de costo que este procedimiento presenta, así que se hizo
conveniente determinar por separado el NO3 y el NO2 en la muestra, sin
necesidad de reducir el NO3 y determinándolo directamente por el método de
CARON y BACQUET.
•
Aunque existen otros métodos de medición de estas emisiones como el equipo
Orsat, es necesario aclarar que las mediciones de nitrógeno que este equipo
hace se refiere al nitrógeno total y no distingue entre sus óxidos, por lo tanto no
es selectivo, lo que hace que no sea posible remplazar los métodos analíticos
que se tratan en esta monografía por el equipo Orsat.
•
Queda por probar estos métodos utilizando una muestra real, muestra que se
espera pueda ser suministrada por el Nodo de Producción más Limpia, ente
que realiza monitoreos para emisiones, ya que la Escuela de Química no
cuenta con el equipo para monitoreo de estas fuentes, además, seria
apropiado ya que se puede comparar la respuesta del análisis como
contramuestra de la que el Nodo envía al laboratorio que en la actualidad hace
sus análisis.
41
BIBLIOGRAFIA
1. CASTILLO, Edgar. Sistema de información para la Evaluación Ambiental
de Sectores Productivos Colombianos. Universidad Industrial de Santander.
Capítulos I, II y IV. Bucaramanga, 1999.
2. EPA. Epa Compilation Of Air Pollutant Emission Actors. Fith Edition y
upplements. AP-42 by Chapter.
3. NEVERS, Noel. Ingeniería del Control de la Contaminación del Aire.
Editorial Mc Graw Hill. México, 1982.
4. PERRY, Robert H. Manual del Ingeniero Químico. Editorial Mc Graw Hill.
Sexta Edición. Tomo I, II, III y IV. México, 1994.
5. WARNER, Wark. Contaminación del Aire. Editorial Limusa. México, 1998.
6. www. Epa.gov.com/Air pollution.
42
ANEXOS
Anexo 1. Ejemplos de la Localización de los Puntos de Muestreo.
•
Ducto Circular Dividido en 12 Secciones Iguales.
•
Ducto Rectangular Dividido en 12 Secciones Iguales.
43