Problemas del Tema 1
Anuncio

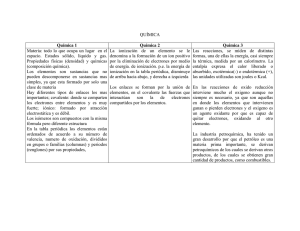
Problemas de Materiales de Interés Tecnológico Hoja 1 1. Dibuja la celda unidad de una estructura cúbica centrada en las caras (fcc) y señala los siguientes planos cristalinos: (a) ( 1 ,1,1); (b) (0,1,0); (c) (1,0, 1 ); (d) (2,2,1) 2. Dibuja la superficie (1,1,0) de correspondiente a la sal común y al CsCl. 3. Calcula los índices de Miller del plano de la figura. (0,0,1) (0,1,0) (1,0,0) 4. Dibuja las superficies (1,1,1) y (1,0,0) de un material que cristaliza según una estructura diamante. Calcula la distancia entre los vecinos más próximos (primeros vecinos) y entre los siguientes más próximos (segundos vecinos). ¿Cuál será la densidad superficial en ambas caras, si el parámetro de red es de 5.43 Å? Compara ambos resultados. 5. Calcula la energía de fotones necesaria para poder resolver la estructura diamante del problema anterior. Si en lugar de fotones queremos utilizar electrones, calcula la energía que deberían tener éstos. DATO: La longitud de onda de los electrones, λ, viene dada por: h λ = , donde h es la constante de Planck y p es el momento lineal de los p electrones. 6. En una ampolla de vidrio se tienen vapores de sodio que son ionizados mediante elevados potenciales eléctricos, de manera que existe una alta concentración de iones Na+. Estos iones son neutralizados mediante la captura de electrones, también generados en el proceso de ionización. ¿Será visible la luz emitida por la ampolla durante este proceso de neutralización? Dato: La energía de ionización del Na es de aproximadamente 5.1 eV. 7. La condición para que exista un máximo en la difracción de rayos X por planos cristalinos, viene dada por la condición de Bragg: nλ = 2 d senθ donde n es el orden del máximo de difracción, d es el espacio entre planos cristalinos, λ es la longitud θ θ de onda de la radiación incidente y θ es el ángulo que forma la radiación incidente con el plano d cristalino. Calcula el ángulo que debe formar la radiación con los planos cristalinos de Ni, que están separados 0.91 Å, para que exista un máximo de difracción de primer orden, supuesto que se incide con rayos X de 1.65 Å de longitud de onda. ¿Qué energía habría que suministrar a un haz de electrones, si queremos obtener el resultado anterior? 8. La energía de ionización del sodio es de 5.1 eV y la afinidad electrónica del cloro es de 3.6 eV. Por otro lado se sabe que cuando se enlazan dos iones Cl- y Na+, que estaban independientes, se libera una energía de 7.9 eV. ¿Cuanto vale la energía correspondiente a un enlace Cl-Na de un cristal de sal? Ayuda: Se considera como energía de enlace la diferencia entre la energía correspondiente a dos átomos de Cl y Na aislados y la energía del par Cl-Na ya enlazado. 9. Obtener la configuración electrónica correspondiente a un átomo de número atómico 16 ¿Sería muy electronegativo o muy electropositivo? ¿Qué tipo de enlace sería de esperar en un sólido constituido únicamente por átomos de este tipo? 10. ¿Qué tipo de enlace presentarían los compuestos que se citan a continuación? ¿Cuáles de ellos serían conductores a bajas temperaturas? CrV (aleación), CuO, CdTe, F4C, AsGa, SFe, ClNa, InSb 11. Se tienen dos tubos iguales, en los cuales hay dos electrodos separados algunos centímetros. Uno de los tubos contiene vapores de cesio y otro de arsénico. Si se aplica una pequeña diferencia de potencial se observa que por ninguno de los tubos existe paso de corriente. En cambio, si se iluminan ambos con un láser UV de 200 nm de longitud de onda sólo en uno de los tubos se produce paso de corriente. Explicar éste efecto (mediante los cálculos adecuados). Datos: Las energías de ionización del Cs y del As son, respectivamente, de 3.9 eV y 9.8 eV, aproximadamente. 12. Calcular la configuración de tres átomos con 16, 20 y 26 electrones respectivamente. Razonar cuál de ellos tendrá una energía de ionización mayor y cuál menor. 13. ¿Qué tipo de enlace tendrían los compuestos que se citan a continuación? ¿Cuáles de ellos serían conductores a bajas temperaturas? CrV (aleación), CuO, TeCd, F4C, AsGa, SFe, ClNa, InSb 14. Calcular qué tipo de luz (visible, UV, IR, etc.) sería necesaria para ionizar vapores de Sodio. Datos: la energía de ionización del Sodio es aproximadamente de 5.1 eV y la constante de Planck vale, también aproximadamente, 4.13 10-15 eV s.