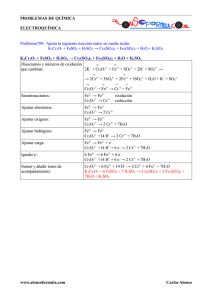
PROBLEMA 4.- Dada la reacción (no ajustada): K2Cr2O7 + FeSO4
Anuncio

COMUNIDAD VALENCIANA / JUNIO 03. LOGSE / QUÍMICA / ELECTROQUÍMICA / BLOQUE A / PROBLEMA Nº 4 PROBLEMA 4.Dada la reacción (no ajustada): K2 Cr2 O7 + FeSO4 + H2 SO4 Cr2 (SO4 )3 + K2 SO4 t Fe2 (SO4 )3 + a) Razone cuál es la especie oxidante y cuál la especie reductora. b) Ajuste la reacción molecular. c) Calcule los gramos de sulfato de Fe(II) que reaccionarán con 50 mL de una disolución acuosa que contiene 1 g de dicromato potásico. Datos: Masas atómicas Cr: 52 O: 16 K: 39 Fe: 56 S: 32 H: 1 Solución: a) Las dos especies que cambian su número de oxidación son el hie rro y el cromo; cada una dará lugar a una semirreacción, en la que se produce una transferencia de electrones: Fe2+ - 1 e- t Fe3+ Cr2 O7 2- + 14 H+ + 6 e- t 2 Cr2+ + 7 H2O En la primera semirreacción, se pierden electrones, luego es una oxidación el sulfato de hierro (II) será el agente reductor. En la segunda semirreacción, hay ganancia de electrones, es. Pues, una reducción, y el dicromato será la especie oxidante. b) Para obtener la reacción global ajustada, se multiplica la 1ª semirreacción por 6 y se suman, quedando: 6 · (Fe2+ - 1 e- t Fe3+) Cr2 O7 2- + 14 H+ + 6 e- t 2 Cr3+ 6 Fe2+ + Cr2O72- + 14 H+ t + 7 H2O 6 Fe3+ + 2 Cr3+ + 7 H2O Se puede ya ajustar la reacción mo lecular: 6 FeSO4 + K 2Cr2 O7 + 14 H2 SO4 t 3 Fe2 (SO4 )3 + Cr2 (SO4 )3 + K2 SO4 + 7 H2O c) Se determinan los moles contenidos en la disolución de dicromato dada: moles dicromato = 1 / 294 = 3,4 · 10-3 La relación estequiométrica indica: www.profes.net es un servic io gratuito de Ediciones SM COMUNIDAD VALENCIANA / JUNIO 03. LOGSE / QUÍMICA / ELECTROQUÍMICA / BLOQUE A / PROBLEMA Nº 4 1 mol de K2 Cr2 O7 6 moles de FeSO4 3,4 · 10-3 x De donde: x = 0,0204 moles de FeSO4 = 3,1 g de FeSO4 www.profes.net es un servic io gratuito de Ediciones SM