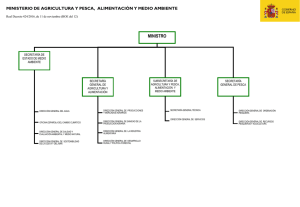
La pesca artesanal de los crustáceos decápodos
Anuncio

111 LA PESCA ARTESANAL DE LOS CRUSTÁCEOS DECÁPODOS MEDIANTE ARTES MENORES EN EL PAÍS VASCO DR. JUAN BALD DR. J. GERMÁN RODRÍGUEZ D. LUIS ARREGI D. IBON GALPARSORO DR. ÁNGEL BORJA INFORME TÉCNICO N.º 111 LA PESCA ARTESANAL DE LOS CRUSTÁCEOS DECÁPODOS MEDIANTE ARTES MENORES EN EL PAÍS VASCO DR. JUAN BALD DR. J. GERMÁN RODRÍGUEZ D. LUIS ARREGI D. IBON GALPARSORO DR. ÁNGEL BORJA NEKAZARITZA, ARRANTZA ETA ELIKADURA SAILA DEPARTAMENTO DE AGRICULTURA, PESCA Y ALIMENTACIÓN Vitoria-Gasteiz, 2008 Un registro bibliográfico de esta obra puede consultarse en el catálogo de la Biblioteca General del Gobierno Vasco: <http://www.euskadi.net/ejgvbiblioteka>. Edición: 1.ª octubre 2008 © Administración de la Comunidad Autónoma del País Vasco Departamento de Agricultura, Pesca y Alimentación Internet: www.euskadi.net Edita: Eusko Jaurlaritzaren Argitalpen Zerbitzu Nagusia Servicio Central de Publicaciones del Gobierno Vasco Donostia-San Sebastián, 1 - 01010 Vitoria-Gasteiz Impresión: Grafo, S.A. Avda. Cervantes, 51 - 48970 Basauri (Bizkaia) ISBN: 978-84-457-2827-7 D. L.: BI-3335-08 Crustáceos decápodos en el País Vasco AGRADECIMIENTOS Este trabajo no habría sido posible sin la inestimable colaboración de D. Romualdo Corveira, patrón del barco Romu, D. Iñaki Artetxe, patrón del barco Farolín y D. Cayetano Gómez (Txixo), patrón del barco Txitxo I. Gracias a ellos pudieron realizarse los muestreos necesarios para disponer de información biológica in situ de las especies sujeto del presente trabajo. A todos ellos un especial agradecimiento. De igual forma, quisiera extender un agradecimiento a D. Xiker Salaberria, analista en prácticas de AZTI-Tecnalia por su colaboración en las tarea de muestreo y a todo el personal de AZTI, técnicos, analistas y muestreadotes que han hecho posible la elaboración de este trabajo. 3/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco ÍNDICE 1. ANTECEDENTES..............................................................................................15 2. INTRODUCCIÓN...............................................................................................17 3. OBJETIVOS ....................................................................................................... 19 4. METODOLOGÍA DE TRABAJO .......................................................................21 4.1 Recopilación de información biológica sobre las especies ...........................21 4.1.1 Recopilación bibliográfica .................................................................... 21 4.1.2 Toma de datos de campo .....................................................................21 4.1.2.1 Área de estudio ................................................................................21 4.1.2.2 Método de muestreo ........................................................................22 4.1.3 Procesado de las muestras. Datos biológicos ...................................... 34 4.1.3.1 Introducción .....................................................................................34 4.2 Descripción del estado del arte técnico y jurídico ....................................... 35 5. RESULTADOS ...................................................................................................37 5.1 INFORMACIÓN BIOLÓGICA SOBRE LAS ESPECIES...........................37 5.1.1 Introducción .........................................................................................37 5.1.2 Centollo (Maja squinado) ....................................................................38 5.1.2.1 Área de distribución ........................................................................38 5.1.2.2 Ciclo vital .........................................................................................38 5.1.3 Nécora (Necora puber), Linnaeus, 1767 .............................................41 5.1.3.1 Área de distribución ........................................................................41 5.1.3.2 Relaciones biométricas ....................................................................41 5.1.3.3 Ciclo biológico ..................................................................................45 5.1.3.4 Cópula ..............................................................................................46 5.1.3.5 Incubación........................................................................................46 5.1.3.6 Desarrollo larvario ..........................................................................46 5.1.3.7 Muda ................................................................................................47 5.1.3.8 Ciclo reproductivo............................................................................47 5.1.3.9 Proporción sexual ............................................................................50 5.1.3.10 Crecimiento....................................................................................51 5.1.3.11 Capturas ........................................................................................51 5.1.4 Bogavante (Homarus gammarus, Linnaeus, 1758) ...........................54 5.1.4.1 Distribución .....................................................................................54 5.1.4.2 Morfología ........................................................................................55 5.1.4.3 Relaciones biométricas ....................................................................56 5.1.4.4 Proporción sexual ............................................................................60 5.1.4.5 Ciclo reproductivo............................................................................60 5.1.4.6 Comportamiento ..............................................................................63 5.1.4.7 Mortalidad .......................................................................................66 5.1.4.8 Capturas ..........................................................................................66 5.1.5 Langosta (Palinurus elephas, Fabricius 1787) ..................................67 5.1.5.1 Distribución .....................................................................................67 5/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.1.5.2 Morfología ........................................................................................68 5.1.5.3 Muda ................................................................................................68 5.1.5.4 Crecimiento......................................................................................70 5.1.5.5 Ciclo reproductivo............................................................................70 5.1.5.6 Desarrollo larvario ..........................................................................71 5.1.5.7 Sex-ratio ...........................................................................................72 5.1.5.8 Hábitos alimenticios........................................................................72 5.1.5.9 Comportamiento ..............................................................................72 5.2 MARCO JURÍDICO .....................................................................................74 5.2.1 De la pesca artesanal costera .............................................................. 74 5.2.1.1 Reglamentación de la Unión Europea ............................................74 5.2.1.2 Reglamentación del Estado Español ..............................................74 5.2.1.3 Reglamentación de la CC.AA. del País Vasco ................................76 5.2.2 Del ejercicio de la pesca .......................................................................76 5.3 ESTADO DEL ARTE....................................................................................78 5.3.1 La flota .................................................................................................78 5.3.2 El Arte ..................................................................................................80 5.3.2.1 Artes fijos de enmalle: Trasmallo. ..................................................80 5.3.2.2 Arte de pesca a Nasa .......................................................................82 5.3.2.3 Modo de empleo de las artes de pesca ............................................ 84 5.3.2.4 Oficios de pesca ............................................................................... 89 5.3.3 Tipologías de actividad de la flota artesanal costera .........................92 5.3.4 Caladeros ............................................................................................. 94 5.3.5 Capturas...............................................................................................94 6. DISCUSIÓN .......................................................................................................99 6.1 Medidas basadas en criterios biológicos ....................................................104 6.1.1 Revisión de las épocas de veda y tallas mínimas de captura ..........104 6.1.1.1 Nécora ............................................................................................104 6.1.1.2 Bogavante ......................................................................................106 6.1.1.3 Langosta ........................................................................................106 6.1.1.4 Centollo ..........................................................................................106 6.1.2 Prohibición expresa de la captura de hembras ovadas ....................107 6.1.3 Cultivo y repoblación .........................................................................108 6.2 Medidas de ordenación ...............................................................................109 6.2.1 Establecimiento de zonas de reserva ................................................109 6.2.2 Establecimiento de zonas de pesca ...................................................111 6.2.3 Establecimiento de zonas de pesca rotativas ...................................113 6.2.4 Diario de pesca ...................................................................................114 6.2.5 Competencia entre artes por un mismo recurso ..............................114 6.2.6 Diseño de artes de pesca más selectivas ..........................................115 6.2.7 Regulación del esfuerzo pesquero .....................................................116 6.3 Marco de investigación ...............................................................................116 7. CONCLUSIONES ............................................................................................119 8. REFERENCIAS................................................................................................123 6/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco ÍND ICE DE FIGURAS Figura 1. Capturas con baja epibiosis y coloración del caparazón. Tomado de Corgos (2004). ................................................................................................................... 27 Figura 2. Capturas con abundante epibiosis y coloración del caparazón. Tomado de Corgos (2004). .............................................................................................................. 27 Figura 3. Forma de medición del ancho (AC) y la longitud del caparazón (LC) en la nécora. .......................................................................................................................... 28 Figura 4. Forma de medición la altura (AQPD) y longitud (LQPD) del propodio del quelípedo derecho en la nécora. ................................................................................. 29 Figura 5. Sexo basado en la morfología del primer par de pleópodos en el bogavante. ........................................................................................................................ 30 Figura 6. Forma de medición de la altura del quelípedo triturador (AQT), altura del quelípedo cortador (AQC), longitud del quelípedo triturador (LQT) y longitud del quelípedo cortador (LQC). ........................................................................... 30 Figura 7. Forma de medición de la profundidad del quelípedo cortador (PQC), triturador (PQT) y ancho del propodito triturador (APT). ............................................. 31 Figura 8. Forma de medición de la longitud del caparazón (LC), longitud total (Ltot) y longitud de la cola (Lcola)................................................................................... 31 Figura 9. Forma de medición del ancho abdominal (AA). ................................................... 32 Figura 10. Distinción del sexo en la langosta (Palinurus elephas). ...................................... 33 Figura 11. Forma de medición de la longitud del caparazón (LC), longitud total (Ltot), longitud de la cola (Lcola) y ancho abdominal (AA) en la langosta (Palinurus elephas). ......................................................................................................... 34 Figura 12. Distribución geográfica de Maja squinado. Tomado de Corgos (2004). .............. 38 Figura 13. Fotografía de Maja squinado. Fuente: Encyclopedia of Marine Life of Britain and Ireland (http://www.habitas.org.uk/marinelife/). ....................................... 39 Figura 14. Fotografía de Necora puber. Fuente: Wilson, E., 2006. Necora puber. Velvet swimming crab. Marine Life Information Network: Biology and Sensitivity Key Information Sub-programme. Plymouth: Marine Biological Association of the United Kingdom. Available from: <http://www.marlin.ac.uk/species/Necorapuber.htm>. .................................................. 42 Figura 15. Distribución geográfica de la nécora (Necora puber). Tomado de Wilhelm (1995). ................................................................................................................ 42 Figura 16. Ciclo anual en el porcentaje de hembras ovígeras en cada uno de los emplazamientos controlados por Borja (1987) (observar que el 0% se 7/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco encuentra desplazado para evitar que los puntos caigan sobre el eje). Tomado de Borja (1987). ................................................................................................................ 49 Figura 17. Box and Whisker Plot de la anchura y longitud del caparazón (AC y LC respectivamente) de los individuos de nécora obtenidos en los litorales de Zierbana, Arminza y san Sebastián tomando de forma conjunta los valores de AC y LC de machos y hembras. ....................................................................................... 53 Figura 18. Distribución geográfica de Hommarus gammarus. Tomado de Cooper y Uzmann (1980). ................................................................................................................ 55 Figura 19. Vista lateral de un individuo de H. gammarus. Tomado de Phillips et al. (1980). .......................................................................................................................... 55 Figura 20. Noticia publicada en el Diario Vasco. ................................................................... 57 Figura 21. Posición de cada uno de los individuos muestreados en relación con el primer y segundo factor y el primer y tercer factor extraído por el análisis factorial realizado. ........................................................................................................... 59 Figura 22. Esquema del tipo de cavidades que el bogavante excava bajo las piedras: (A) sección longitudinal de la clásica cavidad con una única salida; (B) pared semicircular frente a la cavidad excavada; (C) sección longitudinal de una cavidad con dos aperturas; (D) extensión de la cavidad bajo la roca y (C) cavidad con tres salidas. Tomado de Cooper y Uzmann (1980). .............................. 65 Figura 23. Posición de los lances de nasa efectuados para la captura de bogavante en el litoral de San Sebastián y Pasajes. ........................................................................ 65 Figura 24. Evolución de las capturas por unidad de esfuerzo (CPUE) entre enero y diciembre de 1971 en la pesquería de bogavante en Devon (Inglaterra). Adaptado de Bennet (1974). ............................................................................................ 66 Figura 25. Distribución geográfica de la langosta (Palinurus elephas). Tomado de http://www.mnhn.fr/mnhn/bimm/protection/maps/Crustacea/Palinuruselepha s.jpg. 68 Figura 26. Morfología externa de una langosta adulta (Palinurus elephas, Fabricius, 1787). (A) vista dorsal, (B) hembra portadora de huevos, vista ventral, (C) macho, vista ventral, (D) hembra, vista ventral. A1, anténulas; A1, anténas; An, ano, Em, masa de huevois, Fgo, apertura genital de una hembra, Mgo, apertura genital de un macho, P1-P5, pereiópodos 1 a 5, Pp, pleópodos, Te, telson, Ur, urópodos. Tomado de Hunter (1999). ................................... 69 Figura 27. Desarrollo larvario de Palinurus elephas (Fabricius, 1787). A, estado I phyllosoma (vista dorsal); B, estado X phyllosoma y metamorfosis (vista dorsal); c, puerulus (vista dorsal); d, post-puerulus (vista dorsal). Tomado de Hunter (1999). .................................................................................................................. 71 Figura 28. Ficha técnica de trasmallo. Abreviaturas: P: paño exterior; p: paño interior; PA: poliamida, PE: polietileno; PB: plomo; mono.: monofilamento; 8/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco multif.: multifilamento; F: flotabilidad; cabl: cableado. Actualizado de Puente (1993). ............................................................................................................................... 81 Figura 29. Ficha técnica de nasa de langosta. Abreviaturas: PE: polietileno; WD: eucalipto; mono.: monofilamento; multif.: multifilamento; cabl.: cableado. Actualizado de Puente (1993). ......................................................................................... 85 Figura 30. Ficha técnica de nasa de nécora – pulpo. Abreviaturas: PE: polietileno; Fe: hierro; mon: monofilamento; multif.: multifilamento; cabl.: cableado. Actualizado de Puente (1993). ......................................................................................... 86 Figura 31. Diferentes tipos de nasas: (A) nasa de nécora; (B) nasa de langosta con estructura de madera de eucalipto; (C) nasa de quisquillón: detalle de dos modelos de boca diferentes. ............................................................................................. 87 Figura 32. Modo de empleo del arte de pesca a nasas: a) primera baliza en el agua con el barco acercándose en virada; b) nasas saliendo por la popa; c) halador virando las nasas; d) nasa con pesca saliendo del agua; e) nasas estibadas en cubierta. 88 Figura 33. Modo de empleo de las artes de pesca fijos de enmalle: a) Barco de enmalle con cajonadas; b) Largado de la baliza; c) Redes saliendo por la popa; d) Largado de la baliza; e) Primera baliza en el agua con el barco acercándose para comenzar a virar; f) Carro por el que entra la red a bordo; g) Tambor de halador virando la red con capturas; h) Red entrando por el tubo; i) Despescando y limpiando la red; j) Planeo de la red a las cajonadas. ........................... 90 Figura 34. Principales zonas de pesca de la nécora entre Zarauz y Hondarribia según Borja (1987). .......................................................................................................... 95 Figura 35. Principales zonas de pesca de la nécora entre Getaria y Ea según Borja (1987). ............................................................................................................................... 96 Figura 36. Principales zonas de pesca de la nécora entre Elantxobe y el Abra de Bilbao según Borja (1987). ............................................................................................... 97 Figura 37. Capturas de bogavante (H. gammarus) en Noruega, Suceia y Dinamarca entre 1930 y 1996. Tomado de Browne et al. (2001). ................................ 100 9/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco ÍNDICE DE TABLAS Tabla 1. Embarques realizados entre octubre de 2006 y enero de 2007 para la toma de datos in situ........................................................................................................ 24 Representación temporal de las diferentes fases del ciclo vital de Maja squinado, así como la época de veda y capturas de la mencionada especie. ................. 39 Tabla 2. Tabla 3. LC, AC, LPQD, APQD, AA medio (en mm) y peso medio (en gramos) de los individuos de nécora capturados en el entorno de los puertos de Donostia, Zierbana y Arminza entre octubre de 2006 y junio de 2007. ......................................... 43 Tabla 4. Relaciones biométricas entre la longitud y anchura del caparazón y el peso de la nécora en los puertos de Zierbana, Donostia y Arminza. ............................. 44 Tabla 5. Longitudes y pesos húmedos obtenidos, para anchuras estándar en cada sexo, a partir de las ecuaciones de regresión calculadas. Por encima y debajo de las líneas punteadas se encuentran resultados teóricos al no haberse medido individuos con dicha anchura. Clave: * = resultados obtenidos por Borja (1987); ** = resultados obtenidos por González-Gurriarán (1985b). ................... 45 Representación temporal de las diferentes fases del ciclo vital de Necora puber, así como la época de veda y capturas de la mencionada especie. Clave: Tabla 6. Incor.Juv.Pesq. = incorporación de los juveniles a la pesquería. ................................... 46 Tabla 7. Porcentaje de hembras y machos con anchura del caparazón superior a 60 y 70 mm respectivamente. .......................................................................................... 48 Tabla 8. Porcentaje de hembras ovígeras en el litoral de Zierbana, Arminza y Donostia. ........................................................................................................................... 49 Tabla 9. Porcentaje de hembras con respecto a los machos en el litoral de Zierbana, Arminza y Donostia. ....................................................................................... 50 Tabla 10. Anchura del caparazón (Lt) y peso (Wt) correspondientes a cada edad de la nécora. Tomado de Borja (1987). ................................................................................. 52 Tabla 11. Capturas por Unidad de Esfuerzo (kg/100 nasas) en el litoral de Zierbana, Arminza y Donostia. ....................................................................................... 54 Tabla 12. Parámetros biométricos (en mm) y peso medio (en gramos) de los individuos de bogavante capturados en el litoral de San Sebastián entre junio y agosto de 2007. .............................................................................................................. 56 Tabla 13. Valores propios para cada uno de los 12 factores extraídos mediante el método de componentes principales. Asimismo se detalla el porcentaje de varianza explicado por cada factor, así como el porcentaje de varianza acumulado entre todos los factores extraídos. ................................................................ 57 Tabla 14. Peso de cada variable en relación con cada factor extraído................................... 58 11/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 15. Relaciones biométricas entre la longitud del caparazón, la cola y total del individuo y el peso del bogavante en el litoral de San Sebastián. ........................... 58 Tabla 16. Pesos húmedos obtenidos, para longitudes del caparazón estándar a partir de las ecuaciones de regresión calculadas. Por encima y debajo de las líneas punteadas se encuentran resultados teóricos al no haberse medido individuos con dicha anchura. ......................................................................................... 60 Tabla 17. Porcentaje de machos con respecto a hembras en el litoral de San Sebastián. ......................................................................................................................... 60 Tabla 18. Representación temporal de las diferentes fases del ciclo vital del bogavante Homarus gammarus (Linnaeus, 1758), así como la época de veda y capturas de la mencionada especie. ................................................................................ 61 Tabla 19. Porcentaje de hembras capturadas en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007 con una longitud del cefalotórax superior a 98 y 110. mm. ................................................................................................. 62 Tabla 20. CPUE para el bogavante en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007. ....................................................................................... 67 Tabla 21. Porcentaje individuos capturados en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007 con una longitud del cefalotórax superior a 87 mm. 67 Tabla 22. Representación temporal de las diferentes fases del ciclo vital de la langosta Palinurus elephas (Fabricius, 1787), así como la época de veda y capturas de la mencionada especie. ................................................................................ 69 Tabla 23. Cuadro de vedas y tallas mínimas de las especies objeto de este estudio para el sector profesional y deportivo, de acuerdo con el Decreto 198/2000, de 3 de octubre, por el que se aprueba el Reglamento de Pesca Marítima Recreativa y el Anexo I del Decreto 102/1997, de 6 de mayo. ........................................ 77 Tabla 24. Distribución de la flota artesanal costera en los diferentes puertos del País Vasco de Oeste a Este. ............................................................................................. 78 Tabla 25. Características técnicas de la flota de pesca artesanal costera (175 barcos). 79 Tabla 26. Principales características de las nasas muestreadas. Abreviaturas y unidades de medida: Mat.: material; Diam.: grosor del cabo (mm); Int.: intervalo entre punteras (m); L.P.: longitud de puntera (m); L.N.: longitud de la nasa (cm); Anch.: anchura de la nasa (cm); Alt.: altura de la nasa (cm); Diam. Boca: diámetro de la boca de la nasa (cm); PE: polietileno. ................................ 83 Tabla 27. Características técnicas de la tipología naseros (11 barcos). ................................ 93 Tabla 28. Número de barcos dedicados a la pesca de la nécora en la Costa Vasca mediante artes de nasa. ................................................................................................. 100 12/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 29. Representación temporal de las diferentes fases del ciclo vital de Necora puber, así como la época de veda y capturas de la mencionada especie. Clave: Inco.Juv.Pesq. = incorporación de los juveniles a la pesquería. .................................. 105 Tabla 30. Representación temporal de las diferentes fases del ciclo vital de la langosta Palinurus elephas (Fabricius, 1787), así como la época de veda y capturas de la mencionada especie. .............................................................................. 107 Tabla 31. Representación temporal de las diferentes fases del ciclo vital de Maja squinado, así como la época de veda y capturas de la mencionada especie. ............... 107 13/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 1. ANTECEDENTES El 29 de septiembre de 2005, D. Josu Santiago, Director de Pesca del Departamento de Agricultura, Pesca y Alimentación del Gobierno Vasco trasladó a D. Lorenzo Motos, Director de la Unidad de Investigación Marina de la Fundación AZTI-Tecnalia la necesidad de llevar a cabo una revisión de las vedas y tallas mínimas establecidas para diversas especies de crustáceos decápodos por medio del Decreto 198/2000, de 3 de octubre, por el que se aprueba el Reglamento de Pesca Marítima Recreativa y el Anexo I del Decreto 102/1997, de 6 de mayo. Del mismo modo, trasladó el interés de la Dirección de Pesca del mencionado organismo por llevar a cabo estudios relacionados con especies como la langosta y el bogavante, en acciones conjuntas con el sector. En respuesta a dicha demanda se llevó a cabo la elaboración de la propuesta de un proyecto cuyo principal objetivo fuese la realización de una revisión del estado del arte de la pesquería dirigida a crustáceos decápodos (langosta, bogavante, centollo y nécora) en el País Vasco de cara a su futuro seguimiento y gestión. La propuesta fue aprobada y se planteó un proyecto para una duración de dos años cuyos resultados se indican en el presente informe. 1. Antecedentes 15/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 2. INTRODUCCIÓN Según Borja et al. (2004), las especies de crustáceos explotadas de forma comercial en el País Vasco son escasas: quisquilla (Palaemon serratus), buey (Cancer pagurus), centollo (Maja squinado), santiaguiño (Scyllarus arctus), bogavante (Hommarus gammarus), langosta (Palinurus elephas) y la nécora (Necora puber) como la especie más significativa desde el punto de comercial (Borja, 1987,1988). La pesca artesanal costera es practicada en el País Vasco por un importante número de embarcaciones de pequeño y mediano porte (175 unidades) que faenan con un amplio abanico de artes de pesca en caladeros próximos al litoral, efectuando mareas de corta duración, generalmente inferiores a 24 horas. Las embarcaciones que practican la pesca artesanal costera están adscritas a diferentes censos por modalidad de pesca entre los que cabe destacar el censo de “Artes Menores” y el de “Palangre de Fondo”. El volumen de capturas de la flota objeto del estudio es reducido si lo comparamos con el de otros subsectores como el de arrastre o el de cerco de cebo vivo; sin embargo no se puede olvidar su importancia en términos sociales y de interés económico-cultural en los municipios costeros en los que está presente esta flota (Arregi et al., 2004). Las principales características que definen a la flota artesanal costera son las que se enumeran a continuación, y como criterio general la población de barcos de pesca estudiados las cumple en algún momento a lo largo del año en su actividad cotidiana (Arregi et al., 2004): • Las artes de pesca utilizadas son las denominadas artes menores: artes de enmalle (beta o mallabakarra y trasmallo), aparejos de anzuelo (líneas a mano, potera, curricán y palangrillo), nasas y artefactos (rasco y rastro para algas). Las nasas y determinadas redes de enmalle son las artes con las que se llevan a cabo las capturas de especies como la langosta, el bogavante, la nécora y el centollo. • Efectúan mareas1 de corta duración, generalmente de menos de 24 horas2. • Faenan sobre fondos de pesca con profundidades inferiores a 1000 metros de profundidad (excepto las mareas de bonito). • Su actividad de pesca tiene lugar dentro de los límites del mar territorial (límite exterior de las 12 millas). 1 Se entiende por marea el periodo comprendido entre la salida a la mar del barco y la entrada a puerto para descargar la captura; el puerto de entrada y de salida pueden no ser el mismo. 2 La excepción a esta norma general la tenemos en las mareas que efectúan en verano a por bonito del norte, cuya duración puede llegar a ser incluso superior a 15 días en los casos más extremos. 1. Antecedentes 17/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco • Las embarcaciones son en su mayoría de pequeño o mediano porte. En los últimos 20 años son varios los estudios realizados en el País Vasco sobre diferentes aspectos relacionados con la pesca artesanal costera: artes de pesca (Igelmo et al., 1984), 1984), dinámica de la actividad de la flota al pincho de Hondarribia (Motos y Uriarte, 1986), pesca de la nécora (Borja, 1987), pesca artesanal de merluza (Castro, 1992) y besugo (Castro, 1990), pesca con redes fijas de fondo (Puente, 1990) y pesca artesanal en su conjunto (Puente, 1993). Más recientemente, otros estudios han abordado aspectos referentes al seguimiento y a la gestión de las pesquerías de enmalle artesanales (Puente, 1997a,1997b,1997c). Por último, los aspectos técnico-pesqueros además de los socio-económicos de una porción de la flota artesanal del País Vasco han sido estudiados en profundidad (Puente, 2002). Las modificaciones en la reglamentación pesquera que afecta a esta flota, conjuntamente con la disponibilidad de los recursos, hace que la situación de esta flota sea de continuo cambio. A ello contribuye en gran medida la polivalencia en cuanto a las artes de pesca utilizables que caracteriza a la flota artesanal costera objeto del estudio. La principal característica de la pesquería de crustáceos decápodos (langosta, bogavante, nécorta y centollo) mediante artes menores en el País Vasco es la ausencia de un registro de las capturas, debido a que éstas no siguen el circuito de venta en las cofradías (Borja, 1987) estando muy probablemente subestimadas (Puente, 2002). Una de las pocas referencias en este sentido es la realizada por Borja (1987), el cual cifró las capturas de nécora en 47 t·año-1 en la década de los 80. Situaciones similares se han descrito en Inglaterra (Hunter et al., 1996), lo cual hace prácticamente imposible tener información sobre la densidad de la especie o las tasas de explotación de la misma. En el establecimiento de una ordenación pesquera confluyen múltiples intereses que, debidamente contrastados, deben reunirse para una eficaz gestión del recurso. Así, por un lado están los intereses biológicos, que pueden ir dirigidos desde a una mera conservación de la especies, hasta la gestión biológica que permita un máximo de beneficio, en términos de producción, durante el máximo tiempo posible. Por otro lado, se encontrarían los intereses del pescador, que lógicamente deben ir encaminados hacia la obtención del máximo beneficio económico al menor coste. Por último se encuentran los del legislador que debe procurar armonizar ambos conceptos y cualesquiera otros que concurran en el hecho en si (Borja, 1987). Uno de los objetivos de este trabajo, largamente solicitado por los pescadores, es la revisión de las épocas de veda que vienen rigiendo desde 2000, y por tanto una nueva regulación que permita desarrollar sus intereses. 1. Antecedentes 18/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 3. OBJETIVOS El objetivo principal del presente trabajo es llevar a cabo una revisión de las vedas de la pesquería dirigida a crustáceos decápodos (langosta, bogavante, centollo y nécora) en el País Vasco y por tanto el desarrollo de un nuevo marco de gestión que permita desarrollar sus intereses. Como objetivos operacionales se plantean los siguientes: 1. Recoger información biológica sobre las especies objetivo. 2. Descripción del estado del arte técnico y jurídico de la pesca artesanal mediante artes menores de especies de crustáceos decápodos (langosta, bogavante, centollo y nécora) en el País Vasco. 3. Desarrollo de una propuesta para el futuro seguimiento del recurso y su gestión. 3. Objetivos 19/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 4. METODOLOGÍA DE TRABAJO 4.1 Recopilación de información biológica sobre las especies Para la recopilación de información biológica sobre las especies se han llevado a cabo dos tipos de tareas: 1. Recopilación bibliográfica. 2. Toma de datos de campo o muestreo. 4.1.1 Recopilación bibliográfica La recopilación bibliográfica se ha llevado a cabo empleando las fuentes de información disponibles en la Unidad de Investigación Marina de la AZTI-Tecnalia. Estas son las siguientes: - Isi Web of Knowledge. - Aquatic Sciences and Fisheries Abstracs (ASFA). - Fisheries Information and Services (FIS). - Science Direct. - Base de datos bibliográfica del CSIC. - Documentación propia de AZTI-Tecnalia. 4.1.2 Toma de datos de campo 4.1.2.1 Área de estudio El área de estudio del presente proyecto depende fundamentalmente de la localización del puerto base de las embarcaciones colaboradoras con el proyecto y dedicadas a la captura de las especies objetivo mediante nasa (ver apartado 4.1.2.2). Así, en Vizcaya el área de estudio se corresponde con el Abra de Bilbao y el litoral de Arminza, mientras que en Guipúzcoa, el área de estudio se corresponde con el litoral de San Sebastián y Pasajes. 4. Metodología 21/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 4.1.2.2 Método de muestreo La escasez de información previa sobre métodos de muestreo cuantitativos para especies como de crustáceos decápodos, hizo que Corgos (2004) desarrollase, para el estudio del centollo (Maja esquinado), una serie de ensayos preliminares sobre diferentes métodos de muestreo para el estudio de la mencionada especie. A continuación se describen las ventajas e inconvenientes de cada uno de los métodos ensayados por Corgos (2004): • • Artes de enmalle: Estos aparejos son estáticos e interceptan a los animales en sus desplazamientos, en especial, en el caso de la centolla, durante sus migraciones (Freire et al., 2002a). Están formados por uno o varios paños que se disponen perpendiculares al fondo, tocando éste y alcanzando una altura de hasta 1.5 m aproximadamente. La red es de sección muy fina, consiguiendo así que los organismos demersales queden totalmente atrapados una vez interceptados por el aparejo. A pesar de su elevada eficiencia en la captura de especies como la centolla, las artes de enmalle presentan una serie de problemas que dificultan su utilización en muestreos experimentales en aguas someras. Observaciones realizadas en operaciones de pesca comercial en áreas de juveniles indican que, cuando las capturas son elevadas y de pequeño tamaño corporal, el enmallamiento de numerosos ejemplares en el aparejo conlleva una extracción difícil y larga, que causa importantes daños en los individuos (amputación de apéndices y daños en el caparazón) que pueden producir una elevada mortalidad y cuantiosos daños en el propio aparejo (que en numerosas ocasiones queda inutilizable tras un único lance). Por otra parte, la longitud de este tipo de aparejos (como mínimo de 250-500 m para que sean operativos) impide una adecuada resolución espacial para obtener información sobre la distribución de los organismos en áreas pequeñas como las analizadas en este trabajo. Buceo: La realización de censos directos mediante buceadores parece, en un principio, un método adecuado para organismos epibentónicos de gran tamaño corporal que habitan aguas someras. Teniendo en cuenta los resultados obtenidos por Corgos (2004), se evidencian una serie de problemas en la aplicación de esta metodología: 1. El área que un buceador puede prospectar en un día de trabajo es muy reducida, en especial en la zona de estudio, donde la visibilidad es en numerosas ocasiones muy baja, en especial en fondos arenosos donde la turbidez puede ser muy elevada. 2. En el caso concreto de M. squinado la distribución de juveniles y adultos postpubertales presenta niveles de agregación muy acusados, por lo que, desde un punto de vista estadístico, su densidad local (respecto al área muestreada) presenta una varianza muy elevada (en numerosas muestras no se capturan ejemplares y en un número muy reducido las capturas son 4. Metodología 22/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco muy elevadas), por lo que sería necesario un esfuerzo de muestreo muy elevado para obtener estimaciones precisas y no sesgadas de la abundancia de esta especie. • Nasas: las principales ventajas de las nasas son que producen elevadas capturas (observaciones preliminares y de operaciones de pesca), son baratas y duraderas, y se pueden utilizar tanto en substratos rocosos como arenosos. Sin embargo se desconoce el área efectiva de pesca, la capturabilidad es desconocida y puede ser variable en el tiempo debido a los cambios en el nivel de actividad de los animales. Las nasas también presentan problemas de saturación en casos de elevada abundancia y capturas elevadas. Por tanto, la relación entre capturas por unidad de esfuerzo y abundancia puede ser creciente hasta un cierto nivel de abundancia (o de tiempo de permanencia de la nasa en el mar) en que las capturas alcanzan un máximo. Así, en el caso de que las nasas permanezcan más de 24 h en el mar, es probable que la relación lineal entre capturas y tiempo de calado no sea válida, es decir, las capturas de una nasa calada 48 h no van a ser el doble de las capturas de una nasa calada 24 h. Según Goñi et al. (2003a), las nasas presentan determinadas características que la hacen especialmente favorable tanto para la pesca como para el muestreo científico de crustáceos decápodos, entre otras, presenta un bajo porcentaje de capturas accesorias o no deseadas (Miller, 1990), la captura suele estar viva y producen un impacto bajo sobre las comunidades del bentos (Eno et al., 2001). La capturabilidad de una nasa, entendida como la probabilidad de capturar un individuo aplicando de forma aleatoria una unidad de esfuerzo, puede verse influenciada por diversidad de factores, además de la propia abundancia local de la especie, tales como factores fisiológicos, de comportamiento o la saturación del arte (Goñi et al., 2001). • Artes de arrastre: Sus principales ventajas son que se conoce el área muestreada, y que la capturabilidad no depende, en principio, del comportamiento de los organismos de un modo tan directo como en el caso de las nasas. Aunque, en especies como la centolla, que se entierra en ocasiones en el sedimento, la capturabilidad es altamente dependiente de este tipo de actividad y de su variabilidad espacial y temporal. Sus principales desventajas son que sólo son utilizables en fondos blandos y que se puede colmatar el copo cuando la duración del lance es elevada y/o se acumulan animales, algas o sedimento. En coincidencia con los resultados obtenidos por Corgos (2004) y teniendo en cuenta las consideraciones anteriores, el método de muestreo cuantitativo más adecuado para este estudio son las nasas. Así, para llevar a cabo las tareas de campo se realizaron los contactos necesarios con las embarcaciones que actualmente se dedican en algún momento del año a la pesca de las especies objetivo mediante el arte de nasa. 4. Metodología 23/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco El muestreo relativo a nécora se centró en el litoral de Arminza y el Abra de Bilbao (ver Figura 36). Para ello se contó con la colaboración de D. Iñaki Artetxe, patrón de la embarcación “Farolín” del puerto de Zierbana y D. Romualdo Corbeira patrón de la embarcación “Romu” del puerto de Arminza en Vizcaya. En la provincia de Guipúzcoa no se llevaron a cabo muestreos debido a la imposibilidad de llegar a un acuerdo con una de las embarcaciones dedicadas a la captura de nécora en Getaria. El muestreo relativo a bogavante se centró en el litoral de San Sebastián y Pasajes, contando para ello con la colaboración de D. Cayetano Gómez (Txitxo), patrón de la embarcación Txitxo I. En relación con la langosta, no se pudo disponer de ninguna embarcación dedicada a su captura mediante nasa, por lo que no pudo realizarse el muestreo para esta especie. En la Tabla 1 se pueden observar los embarques realizados en cada una de las embarcaciones colaboradoras (ver apartado 4.1.2.2), las fechas, zonas de pesca y los individuos capturados. En total se han realizado 19 embarques, 11 de ellos durante la época de capturas de nécora y 8 durante la de bogavante y langosta. Tabla 1. Embarques realizados entre octubre de 2006 y enero de 2007 para la toma de datos in situ. Individuos capturados Fecha Barco Zona Nécora Bogavante Langosta Centollo 10 Oct. 2006 Farolin Zierbena 154 11 Oct. 2006 Romu Arminza 54 17 Oct. 2006 Romu Arminza 56 31 Oct. 2006 Farolín Zierbena 31 15 Nov. 2006 Farolín Zierbana 45 1 1 28 Nov. 2006 Farolín Zierbana 87 1 2 21 Dic. 2006 Romu Arminza 64 16 Ene. 2007 Romu Arminza 37 17 Ene. 2007 Romu Arminza 20 30 Ene. 2007 Romu Arminza 58 31 Ene. 2007 Romu Arminza 59 2 7 Jun. 2007 Txitxo I Donostia 16 1 8 jun. 2007 Txitxo I Donostia 10 12 2 12 Jun. 2007 Txitxo I Donostia 12 20 13 Jun. 2007 Txitxo I Donostia 12 8 14 Jun. 2007 Txitxo I Donostia 3 15 20 Jun. 2007 Txitxo I Donostia 20 15 29 Jun. 2007 Txitxo I Donostia 6 1 10 Ago. 2007 Txitxo I Donostia TOTAL 4. Metodología 11 6 739 95 24/143 2 1 3 8 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco En total se obtuvieron 739 individuos de nécora, 95 bogavantes, 3 langostas y 8 centollos. Hay que hacer notar que las capturas de nécora en la zona de San Sebastián se corresponden con capturas accesorias durante la campaña de bogavante que se inició en junio. En cada una de las salidas se determinaron los parámetros biológicos que a continuación se describen para cada especie. • Centollo (Maja squinado) - Sexo: basado en la morfología del abdomen. En los machos el abdomen es estrecho y triangular, mientras que en las hembras es más ancho y redondeado. - Longitud del caparazón (LC, medido con calibre al 0.1 mm más cercano) entre la unión de las espinas rostrales y el borde posterior del cefalotórax, de acuerdo con la siguiente figura: - Altura del quelípedo derecho en machos (AQD, medida con calibre al 0.1mm más cercano) detrás de la inserción del dáctilo. Aunque no existen diferencias de tamaño entre los dos quelípedos ((Sampedro et al., 1999), se midió el quelípedo derecho, excepto cuando el ejemplar no tenía este apéndice, o se encontraba en proceso de regeneración, en cuyo caso se midió el izquierdo, de acuerdo con la siguiente figura: - Longitud del quelípedo derecho (LQD): medida desde la base de la inserción del carpus hasta la parte inferior de la articulación del dáctilo. 4. Metodología 25/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco LQD - Morfología del abdomen en hembras, con el fin de determinar la madurez morfométrica (Sampedro et al., 1999). Las hembras juveniles presentan el abdomen plano sin pleópodos desarrollados, mientras que las adultas presentan el abdomen abombado y significativamente más ancho que las juveniles para poder incubar la puesta, y los pleópodos están desarrollados. - Estado de maduración ovaria basado en el color de los ovarios: Estado I: gónadas sin desarrollar completamente, color blanco o marfil blanquecino Estado II: gónadas desarrollándose, color marfil o naranja pálido Estado III: gónadas con color naranja extendiéndose completamente bajo la cavidad torácica. Estado IV: gónadas completamente desarrolladas y con color anaranjado muy vivo. - - Epibiosis algal. Se estimó el grado de cobertura del caparazón en una escala de 0 (sin epibiosis) a 3 según la siguiente clasificación: o Epibiosis grado 0: Sin epibiosis o Epibiosis grado 1: Caparazón cubierto hasta un 25% de su superficie. o Epibiosis grado 2: Caparazón cubierto entre el 25 y el 75 % de su superficie. o Epibiosis grado 3: Más del 75% del caparazón cubierto con algas, y presencia de algas en los pereiópodos o patas marchadoras. Coloración del caparazón. Se diferenció entre caparazón poco pigmentado (coloración “blanca”) (Figura 1) y fuertemente pigmentado (que denominaremos coloración “roja”) (Figura 2). 4. Metodología 26/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 1. Capturas con baja epibiosis y coloración del caparazón. Tomado de Corgos (2004). Figura 2. Capturas con abundante epibiosis y coloración del caparazón. Tomado de Corgos (2004). - Estado de muda determinado mediante criterios macroscópicos: Para la determinación de estos estados macroscópicos a cada individuo se le aplicó una ligera presión para determinar su estado de muda según los siguientes criterios. (i) Estado A: cuerpo flácido, lleno de agua y totalmente deformable por la presión de los dedos. (ii) Estado B: caparazón blando y flexible, pero no deformable. En una fase inicial presenta consistencia pergaminosa, y se van endureciendo progresivamente diferentes partes del cuerpo: en primer lugar las puntas de los quelípedos y partes de la boca y finalmente los artejos del último par de pereiópodos o patas marchadoras. 4. Metodología 27/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco (iii) Estado C: todas las partes del cuerpo rígidas, no se observa depresión. (iv) Estado D: la rigidez es normal (como el estado C), pero se puede apreciar un nuevo caparazón por debajo del actual rompiendo la uña del último par de pereiópodos. (v) Estado E: ejemplares desprendiéndose del viejo caparazón. • Nécora (Necora puber) - Sexo: basado en la morfología del abdomen. En los machos el abdomen es estrecho y triangular, mientras que en las hembras es más ancho y redondeado. - Ancho del caparazón (AC, medido con calibre al 0.1 mm más cercano): medido entre el quinto par de dientes anterolaterales, excluyendo las espinas laterales (Figura 3). AC LC Figura 3. Forma de medición del ancho (AC) y la longitud del caparazón (LC) en la nécora. - Altura del propodio del quelípedo derecho (APQD, medido con calibre al 0.1 mm más cercano) (Figura 4). Largo del propodio del quelípedo derecho (LPQD, medido con calibre al 0.1 mm más cercano) (Figura 4). - - Longitud del caparazón (LC, medido con calibre al 0.1 mm más cercano): medida desde la parte posterior del cefalotórax al espacio entre los dientes frontales centrales (Figura 3). Ancho del sexto segmento abdominal en hembras (AA, medido con calibre al 0.1 mm más cercano). 4. Metodología 28/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco APQD LPQD Figura 4. Forma de medición la altura (AQPD) y longitud (LQPD) del propodio del quelípedo derecho en la nécora. - Estado de maduración ovaria basado en el color de los ovarios: (i) Estado I: sin color (ii) Estado II: color blanco o marfil (iii) Estado III: amarillo o amarillo anaranjado (iv) Estado IV: anaranjado • Peso total. Medido in situ en balanza digital. Bogavante (Homarus gammarus) - Sexo (y presencia de hembra ovígera): basado en la morfología del primer par de pleópodos (el más próximo al cefalotórax, también llamados gonopodios). En los machos, los gonopodios son largos, duros y blanquecinos, mientras que en las hembras son más pequeños y blandos (Figura 5). - Altura del quelípedo triturador (AQT, medido con calibre al 0.1 mm más cercano) (Figura 6). - Altura del quelípedo cortador (AQC, medido con calibre al 0.1 mm más cercano) (Figura 6). - Longitud del quelípedo triturador (LQT, medido con calibre al 0.1 mm más cercano) (Figura 6). - Longitud del quelípedo cortador (LQC, medido con calibre al 0.1 mm más cercano) (Figura 6). 4. Metodología 29/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Macho Figura 5. Hembra Sexo basado en la morfología del primer par de pleópodos en el bogavante. T AQ AQ C T LQ C LQ Figura 6. Forma de medición de la altura del quelípedo triturador (AQT), altura del quelípedo cortador (AQC), longitud del quelípedo triturador (LQT) y longitud del quelípedo cortador (LQC). 4. Metodología 30/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco - Profundidad del quelípedo cortador y del quelípedo triturador (PQC y PQT, medido con calibre al 0.1 mm más cercano) (Figura 7). PQ C T PQ T P A Figura 7. Forma de medición de la profundidad del quelípedo cortador (PQC), triturador (PQT) y ancho del propodito triturador (APT). - Anchura del propodito triturador (APT) medido con calibre al 0.1 mm más cercano) (Figura 7). - Longitud del caparazón (LC, medido con calibre al 0.1 mm más cercano) entre la punta del rostrum hasta el punto medio del borde posterior del caparazón del cefalotórax (Figura 8). Ltot Lcola LC Figura 8. Forma de medición de la longitud del caparazón (LC), longitud total (Ltot) y longitud de la cola (Lcola). 4. Metodología 31/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco - Longitud total (Ltot, medido con calibre al 0.1 mm más cercano en ejemplares juveniles y con ictiómetro en ejemplares adultos) como el largo total medido desde el borde anterior del cefalotórax hasta el final del telson (Figura 8). - Longitud de cola (Lcola, medido con calibre al 0.1 mm más cercano en - Ancho abdominal (AA, medido con calibre al 0.1 mm más cercanos) medido ejemplares juveniles y con ictiómetro en ejemplares adultos) medida desde el borde anterior del primer segmento hasta el extremo final del último segmento (Figura 8). en el segmento más próximo al cefalotórax (Figura 9). - Peso total. Medido in situ en balanza digital. AA Figura 9. • Forma de medición del ancho abdominal (AA). Langosta (Palinurus elephas) - Sexo (y presencia de hembra ovígera) basado en (i) la morfología de los pleópodos (apéndices abdominales), (ii) localización del oviducto y (iii) morfología del último segmento de las quintas patas (Figura 10). Los pleópodos en la hembra son de mayor tamaño. El orificio sexual de los machos se encuentra en la base del quinto par de patas torácicas, mientras que en la hembra los oviductos salen al exterior muy cerca de la base del tercer par de patas torácicas (Figura 10). Los machos se distinguen porque todas las patas torácicas terminan en uña; por contra, en las hembras el último par de patas tiene el final bifurcado (Figura 10). 4. Metodología 32/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Macho Hembra diferencia en el último segmento de la quinta pata orificios reproductores pleópodos Figura 10. Distinción del sexo en la langosta (Palinurus elephas). - Longitud de las antenas (LA, medido con calibre al 0.1 mm más cercano en ejemplares juveniles y con ictiómetro en ejemplares adultos) medida entre la inserción en el cefalotórax y el extremo. - Longitud del caparazón (LC, medido con calibre al 0.1 mm más cercano) como la línea mediana desde el borde del caparazón, entre los dos rostros (entre las espinas supraorbitales rostrales), hasta el borde posterior del cefalotórax (Figura 11). - Longitud total (Ltot, medido con calibre al 0.1 mm más cercano en ejemplares juveniles y con ictiómetro en ejemplares adultos) como la largo total medido desde el borde anterior del cefalotórax hasta el final del telson (Figura 11). - Longitud de cola (Lcola, medido con calibre al 0.1 mm más cercano en - Ancho abdominal (AA, medido con calibre al 0.1 mm más cercanos) medido en el segmento más próximo al cefalotórax (Figura 11). - Peso total. Medido in situ en balanza digital. ejemplares juveniles y con ictiómetro en ejemplares adultos) medida desde el borde anterior del primer segmento hasta el extremo final del último segmento (Figura 11). 4. Metodología 33/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Ltot Lcola LC LC AA Figura 11. Forma de medición de la longitud del caparazón (LC), longitud total (Ltot), longitud de la cola (Lcola) y ancho abdominal (AA) en la langosta (Palinurus elephas). 4.1.3 Procesado de las muestras. Datos biológicos 4.1.3.1 Introducción El crecimiento de determinadas partes del cuerpo en los crustáceos (pinzas, patas, abdomen, pleópodos, etc) se encuentra relacionada con determinadas funciones biológicas (González-Gurriarán y Freire, 1994b). Una de estas funciones es el inicio de la madurez sexual, tal y como se ha observado en diversas especies de Portunidae (Haefner, 1985; Davidson y Marsden, 1987; Abelló et al., 1990) y en particular en especies como la nécora (Necora puber) (Drach, 1933; Choy, 1988; González-Gurriarán y Freire, 1994b). Así, las ecuaciones que establecen una relación de alometría (Teissier, 1948) entre las dimensiones o pesos de órganos o partes han sido utilizadas habitualmente en estudios de crustáceos (Huxley y Richards, 1931; Teissier, 1948; Hepper, 1966; Pope y Thomas, 1967; Hartnoll, 1974,1978), incluidos la nécora (GonzálezGurriarán, 1985a,1985b; González-Gurriarán y Freire, 1994b), el bogavante (Debuse et al., 2001; Rowe, 2002), el centollo (Sampedro et al., 1999) y la langosta (Goñi et al., 2003b; Tidu et al., 2004). Así, de igual forma que González-Gurriarán (1994b), tanto para machos como hembras, el modelo alométrico empleado se expresa según la siguiente ecuación: Y = a·ACb donde a y b son constantes y tomando la anchura del caparazón (AC) como la dimensión de referencia en relación con el tamaño del individuo. 4. Metodología 34/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Debido a que los datos obtenidos no se distribuyen de acuerdo con una distribución normal, con objeto de detectar diferencias significativas en cualquiera de los parámetros controlados por sexo o zona de captura, se llevó a cabo un análisis mediante el test de Kruskall-Wallis, previa transformación logarítmica de los mismos (log10). 4.2 Descripción del estado del arte técnico y jurídico La descripción del estado del arte y el marco jurídico que regula la flota artesanal costera se basó principalmente en los siguientes trabajos: 1. Arregi, L., A. Bilbao, I. Galparsoro y E. Puente, 2004. Descripción de la tipología de oficios de pesca actuales de la pesca artesanal costera. Informe inédito para Dpto. Industria, Comercio y Turismo del Gobierno Vasco:117. 2. Puente, E., 2002. Estudio técnico-pesquero y socio-económico de las pesquerías artesanales costeras del País Vasco. Colección Itsaso nº25. Servicio Central Publicaciones, Gobierno Vasco (Vitoria). 152 pp. 4. Metodología 35/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5. RESULTADOS 5.1 INFORMACIÓN BIOLÓGICA SOBRE LAS ESPECIES 5.1.1 Introducción Los crustáceos decápodos presentan ciclos vitales complejos, que comprenden en general fases larvarias planctónicas y fases postlarvarias bentónicas, lo que determina que su distribución espacial y dinámica de poblaciones se encuentre en estrecha relación tanto con procesos de dispersión larvaria, mediados por factores físicos, como de selección de hábitat ligados a los patrones de movimientos y migraciones en estadíos postlarvarios (Corgos, 2004). De acuerdo con Corgos (2004), en peces de arrecife y otros invertebrados marinos sésiles o de escasa movilidad que habitan áreas intermareales o submareales, la abundancia y estructura de las poblaciones depende: (i) en primer lugar de procesos oceanográficos que determinan el aporte de larvas hacia los hábitats adecuados. (ii) en segundo lugar de procesos que afectan a las fases juveniles, especialmente predación y canibalismo, dependientes de la densidad y de la disponibilidad de hábitats adecuados como refugio. Al igual que la centolla, muchas especies de crustáceos decápodos y peces utilizan los estuarios como hábitat en su fase juvenil y emigran a zonas más profundas cuando alcanzan la madurez. En estos hábitats estuáricos los juveniles se encuentran en grandes densidades, sufren menores tasas de predación o presentan mayores tasas de crecimiento que en otros hábitats. Según Corgos (2004), la estructura espacial que genera la heterogeneidad del hábitat junto con los procesos de dispersión larvaria y selección de hábitat, pueden dar lugar a la generación de una estructura metapoblacional (Botsford et al., 1994; Botsford, 1995), constituida por subpoblaciones postlarvarias locales cuya dinámica depende de: 1. el aporte de larvas planctónicas, 2. los procesos locales de crecimiento y mortalidad y 3. los movimientos de dispersión y migratorios entre zonas. El conocimiento de los procesos de reclutamiento, del comportamiento individual (movimientos y selección de hábitat) y de la distribución a distintas escalas y sus cambios estacionales presenta una gran importancia para la comprensión de la estructura poblacional y la interconexión y factores de regulación de las distintas poblaciones locales. 5. Resultados 37/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco El término y el concepto “metapoblación” en sentido estricto fue introducido por Levins (1969; Levins, 1970), pero hasta los años 90 no se generalizó el uso de este término (Corgos, 2004). El modelo de metapoblación propuesto por Levins (1970) incluye tres asunciones: 1. las poblaciones locales son equivalentes en tamaño y en grado de aislamiento, 2. las dinámicas poblacionales internas de las poblaciones locales son asíncronas, y 3. la tasa de intercambio de individuos entre poblaciones locales es demasiado baja para afectar a la dinámica de las poblaciones locales. 5.1.2 Centollo (Maja squinado) 5.1.2.1 Área de distribución El centollo, Maja squinado (Herbst, 1788) (Decapoda, Majidae), se distribuye latitudinalmente desde 15ºN hasta 60ºN en el Atlántico Nordeste y el Mediterráneo (INGLE, 1980), aunque sólo se encuentra en densidades explotables entre 30ºN y 50ºN (Meyer, 1993) (Figura 12). Figura 12. Distribución geográfica de Maja squinado. Tomado de Corgos (2004). 5.1.2.2 Ciclo vital El ciclo vital de M. squinado (Figura 13) consta de tres fases principales: fase larvaria, fase juvenil o de crecimiento y fase adulta o reproductiva (Corgos, 2004). Las fases juvenil y adulta están separadas por una muda terminal (Kergariou, 5. Resultados 38/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 1984; Le Foll, 1993; Sampedro et al., 1999) tras la cual M. squinado deja de crecer. La fase larvaria planctónica consiste en dos estadíos zoea y un estadío megalopa. La duración aproximada es de 2 a 3 semanas desde la eclosión hasta el asentamiento del primer estadío postlarvario (Iglesias et al., 2002; Lebour, 1927; Schlegel, 1911). Figura 13. Fotografía de Maja squinado. Fuente: Encyclopedia of Marine Life of Britain and Ireland (http://www.habitas.org.uk/marinelife/). La fase juvenil empieza tras el reclutamiento postlarvario, que tiene lugar probablemente desde finales de primavera hasta el otoño (Corgos, 2004) (Tabla 2). Los individuos juveniles habitan fondos someros (<15 m) mixtos, rocosos y arenosos (González-Gurriarán y Freire, 1994a; Kergariou y Veron, 1981; Latrouite, 1989,1990,1991; Le Foll, 1993; Meyer, 1993), y realizan movimientos limitados (González-Gurriarán y Freire, 1994a; Hines et al., 1995). La fase juvenil dura de 2 a 3 años (Meyer, 1993; Le Foll, 1993), dependiendo del momento del reclutamiento. Tabla 2. Representación temporal de las diferentes fases del ciclo vital de Maja squinado, así como la época de veda y capturas de la mencionada especie. E Capturas Veda Reclutamiento Muda Term. Migración ʐ Ad. Migración ʑ Ad. Apareamiento Cría 5. Resultados Ņ F M A Ń Ń M 39/143 J J A S O N D Ņ Ņ Ņ Ņ Ņ Ņ Ņ © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco La fase adulta empieza cuando los juveniles alcanzan la madurez sexual tras la muda terminal, que en la Ría de Arousa, tiene lugar en verano (GonzálezGurriarán et al., 1995; Sampedro et al., 2003; Freire et al., 1999) y a principios de otoño en el Golfo Normano-Bretón (Meyer, 1993; Le Foll, 1993). Los adultos postpubertales, definidos como individuos que alcanzaron la madurez recientemente (dentro de los 2-3 meses anteriores), llevan a cabo una migración reproductiva entre el final del verano y el otoño hacia aguas profundas (aprox. 30 a 100 m) en fondos blandos (González-Gurriarán y Freire, 1994a; GonzálezGurriarán et al., 2002; Hines et al., 1995; Le Foll, 1993; Freire y GonzálezGurriarán, 1998; Latrouite y Foll, 1989; Stevcic, 1973) (Tabla 2). Las hembras adultas realizan esta migración principalmente en Noviembre (con un rango de Septiembre a Enero) y dura unos 10 días (Freire y González-Gurriarán, 1998; Freire et al., 1999; González-Gurriarán et al., 2002) (Tabla 2). Aunque existe muy poca información sobre el apareamiento de la centolla en medio natural, las evidencias disponibles indican que se produce principalmente en aguas profundas, donde se pueden formar agregaciones (González-Gurriarán et al., 2002). En el caso de la centolla, la migración supone un cambio dramático de actividad (desplazamientos rápidos de más de 1-10 km en pocos días), tras un período juvenil con movimientos exclusivamente de pequeña escala (cientos de metros) (GonzálezGurriarán y Freire, 1994a; González-Gurriarán et al., 2002; Hines et al., 1995). Por otra parte, esta migración debe realizarse tras la muda terminal, un proceso fisiológico y energéticamente crítico (Corgos, 2004). Por tanto, durante un período corto inmediatamente posterior a la muda y previo a la migración se debe producir la recuperación del proceso de muda y el almacenamiento de energía preciso para la migración (Corgos, 2004). Inmediatamente tras el apareamiento (Enero y Febrero), las hembras llevan a cabo una migración de retorno a aguas someras para la incubación de la primera puesta del ciclo anual (Corgos, 2004). Según Corgos (2004), aunque no se dispone de datos sobre los machos, las observaciones de pescadores en Galicia indican que no participan en la migración de regreso a aguas someras, permaneciendo en los hábitats de invernada. El período de incubación de la puesta oscila entre 30 y 74 días, dependiendo de la temperatura del agua (Kergariou, 1984; González-Gurriarán et al., 1998; Iglesias et al., 2002; Brosnan, 1981; Kergariou, 1975; Rodhouse, 1984), y gracias a la presencia de espermatecas (estructuras que permiten mantener el esperma viable durante largos períodos de tiempo) pueden fertilizar varias puestas sin necesidad de nuevos apareamientos, como se ha demostrado en otras especies de esta familia (Elner y Beninger, 1995; Sainte-Marie y Lovrich, 1994; Sainte-Marie y Carriére, 1995). El ciclo de cría de Maja squinado en el sur de Galicia se observó entre Marzo y Noviembre, y se estima que el número de puestas al año para una hembra primípara es de tres (González-Gurriarán et al., 1998; González-Gurriarán et al., 1993). En latitudes más septentrionales el número de puestas anuales varía entre 5. Resultados 40/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 1 en las islas británicas (Brosnan, 1981; Rodhouse, 1984; Hartnoll, 1965; Edwards, 1979) y 2 en la costa francesa (Kergariou, 1975; Martin, 1983). La muda terminal, la maduración gonadal, la migración y el apareamiento están estrechamente coordinados entre sí y juegan un papel muy importante dentro del ciclo biológico de la centolla, ya que van a determinar cambios radicales en la estructura espacial y demográfica de las poblaciones y van a ser fundamentales para determinar el éxito reproductivo (Corgos, 2004). 5.1.3 Nécora (Necora puber, Linnaeus, 1767) Otras denominaciones por la cual se la conoce son las siguientes: Cancer puber, Linnaeus 1767; Cancer velutinus, Pennant 1977; Portunus puber, Leach 1816; Macropipus puber, Janus 1961; Liocarcinus puber, Linnaeus, Necora puber, Holthius 1987. Según Wilhelm (1995), hasta un pasado reciente la biología de la nécora no ha sido objeto de ningún estudio en particular. De acuerdo con el citado autor, en Francia el único trabajo consagrado a esta especie a una escala local fue el realizado por Peronnet en 1976. A partir de 1977, González-Gurriarán llevo a cabo un estudio sistemático de la nécora en Galicia (González-Gurriarán, 1977; 1978a; 1978b; 1981a; 1981b; 1981c; 1982; 1985a; 1985b; González-Gurriarán y Freire, 1994b), posteriormente Choy en 1986 y 1988 en el sur de Gales (Choy, 1988,1991) y Norman en 1989 en Plymouth (Norman, 1989). En 1987, Borja realizó un estudio en la costa vasca (Borja, 1987,1988). La nécora es un crustáceo omnívoro y caníbal (González-Gurriarán, 1977) (Figura 14). Vive en fondos rocosos cercanos a zonas arenosas y areno-fangosas. Puede nadar gracias a los cinco pares de pereiópodos de que dispone siendo capaz de desplazarse rápidamente, lo que le permite huir de posibles depredadores (Wilhelm, 1995). 5.1.3.1 Área de distribución El área de distribución de la especie comprende la costa oeste de noruega, islas Hébridas y la bahía de Heligoland, el oeste de Alemania, las costas holandesas y belgas, la costa este de las islas británicas, el oeste de Escocia e Irlanda (Figura 15). La especie desciende hacia el sur hasta situarse al nivel del Mediterráneo (Wilhelm, 1995). 5.1.3.2 Relaciones biométricas En la Tabla 3 se puede observar los resultados obtenidos para cada uno de los parámetros biológicos por sexo y puerto en los muestreos realizados en el presente trabajo. 5. Resultados 41/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 14. Fotografía de Necora puber. Fuente: Wilson, E., 2006. Necora puber. Velvet swimming crab. Marine Life Information Network: Biology and Sensitivity Key Information Sub-programme. Plymouth: Marine Biological Association of the United Kingdom. Available from: <http://www.marlin.ac.uk/species/Necorapuber.htm>. Figura 15. Distribución geográfica de la nécora (Necora puber). Tomado de Wilhelm (1995). 5. Resultados 42/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 3. LC, AC, LPQD, APQD, AA medio (en mm) y peso medio (en gramos) de los individuos de nécora capturados en el entorno de los puertos de Donostia, Zierbana y Arminza entre octubre de 2006 y junio de 2007. Donostia n Media LC 29 73,17 AC 29 LPQD ʑ Error Est. Min. Max. n Media 2,25 60,00 115,00 39 63,71 90,69 2,58 75,00 135,00 38 29 66,48 2,31 55,00 115,00 APQD 29 28,72 1,84 20,00 AA --- --- --- Peso 29 201,24 10,16 ʐ Error Est. Min. Max. 1,10 54,10 80,00 79,06 1,18 57,80 95,00 38 53,03 1,62 40,00 80,00 71,00 39 22,33 1,04 15,00 47,20 --- --- 36 39,03 0,95 25,00 50,00 140,00 350,00 39 153,97 7,73 60,00 259,00 Min. Max. Zierbana n Media LC 159 55,21 AC 159 LPQD ʑ Error Est. ʐ Error Est. Min. Max. n Media 0,54 36,20 70,00 158 52,23 0,51 37,70 70,40 72,22 0,78 46,60 95,80 158 67,03 0,70 50,00 96,60 157 51,56 0,70 14,30 70,00 158 44,43 0,49 22,00 66,90 APQD 157 22,21 0,42 9,80 48,70 158 17,83 0,34 8,00 51,00 AA --- --- --- --- --- 158 27,43 0,46 13,30 41,00 Peso 117 120,00 5,00 11,00 250,00 113 89,42 3,64 20,00 250,00 Min. Max. Arminza n Media LC 188 59,14 AC 188 LPQD ʑ Error Est. ʐ Error Est. Min. Max. n Media 0,59 39,00 89,50 161 56,11 0,61 34,80 88,00 76,04 0,74 40,50 107,70 161 70,68 0,67 36,70 103,60 188 48,36 0,93 10,70 70,30 161 43,93 0,58 28,30 69,00 APQD 188 27,99 1,03 14,00 85,00 161 24,11 1,15 11,00 82,50 AA --- --- --- --- --- 161 29,02 0,50 16,60 48,80 Peso 173 142,15 3,49 40,00 250 133 110,12 2,43 50,00 185 De acuerdo con estos resultados, los individuos capturados en Donostia (tanto machos, como hembras) presentan un tamaño significativamente mayor (p<0,05) al de los individuos de Zierbana y Arminza para todos los parámetros controlados (Tabla 3). Por sexos, el tamaño de los machos es significativamente mayor al de las hembras (p>0,05) en todas las zonas estudiadas y para todos los parámetros controlados (Tabla 3). 5. Resultados 43/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco En la Tabla 4 se pueden observar las ecuaciones obtenidas en el análisis de las relaciones biométricas entre la longitud y anchura del caparazón y el peso de los individuos en las diferentes zonas costeras controladas. Como se puede observar, tan sólo las relaciones obtenidas en Zierbana obtienen una buena correlación. En la Tabla 5 se han calculado las longitudes y peso húmedo que corresponderían a cada sexo para anchuras estándar entre 10 y 100 mm, teniendo en cuenta las relaciones obtenidas en el litoral de Zierbana. Tabla 4. Relaciones biométricas entre la longitud y anchura del caparazón y el peso de la nécora en los puertos de Zierbana, Donostia y Arminza. Zierbana ʑ Relaciones ECUACION n r2 y = 1,4159*x0,856048 158 0,87 Peso(y) – LC(x) y = -216,605 + 7,04202*x 116 Peso(y )– AC(x) y = (-4,9735 + 0,216031*x)2 116 LC(y) – AC(x) ʐ (no ovígeras) ECUACION n r2 y = 1,36376*x0,866829 157 0,83 0,82 y = (-5,3851+0,2842*x)2 112 0,87 0,80 y = (-4,5278+0,2034*x)2 112 0,88 n r2 Donostia ʑ Relaciones LC(y) – AC(x) ʐ (no ovígeras) ECUACION ECUACION n r2 y = -0,16823 + 0,80869*x 28 0,85 1/(0,02967 – 0,00017*x) 37 0,60 Peso(y) – LC(x) y = 1/(0,0008 + 0,3148/x) 28 0,18 y=exp(3,4406+0,0240*x) 36 0,20 Peso(y )– AC(x) y = 1/(0,0004 + 0,5139/x) 28 0,33 y=exp(7,6884-214,67/x) 35 0,37 n r2 160 0,59 102 0,36 102 0,33 Arminza ʑ Relaciones LC(y) – AC(x) Peso(y) – LC(x) Peso(y )– AC(x) ECUACION n r2 y = 11,8412 + 0,62204*x 187 0,60 172 0,50 172 0,42 y = 380,028 - 13827,2/x y = -77,2184 + 2,89168*x ʐ (no ovígeras) ECUACION y = 1/(0,0043+0,9457/x) y =exp(5,707-8,6851/x) y = -7,3181 + 1,6406*x Al igual que los resultados obtenidos por Borja (1987), la Tabla 5 muestra cómo las hembras, bien sean ovígeras o no, presentan longitudes superiores a los machos para igual anchura del caparazón, especialmente a partir de tallas superiores a 50 mm. Asimismo, se observa que los machos presentan mayor peso que las hembras, especialmente a partir de 50 mm, en que adquieren una mayor robustez proporcionada por sus caracteres sexuales (Borja, 1987). 5. Resultados 44/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco La comparación con los datos obtenidos por Borja (1987) y González-Gurriarán (1985b), indicarían que a igual anchura, las longitudes, tanto en machos como hembras, son ligeramente mayores en el presente trabajo (Tabla 5). En relación con el peso, se observa el mismo comportamiento a partir de los 70 mm de anchura del caparazón (Tabla 5). Tabla 5. Longitudes y pesos húmedos obtenidos, para anchuras estándar en cada sexo, a partir de las ecuaciones de regresión calculadas. Por encima y debajo de las líneas punteadas se encuentran resultados teóricos al no haberse medido individuos con dicha anchura. Clave: * = resultados obtenidos por Borja (1987); ** = resultados obtenidos por González-Gurriarán (1985b). ANCHURA 10 20 30 40 50 60 70 80 90 100 ʑ 10,16 18,40 26,03 33,30 40,31 47,12 53,77 60,28 66,67 72,97 ʐ 10,04 18,30 26,01 33,38 40,50 47,43 54,22 60,87 67,41 73,86 LONGITUD ʑ* ʐ* 9,95 7,47 16,93 15,15 23,9 22,83 30,87 30,51 37,85 38,2 44,82 45,88 51,79 53,56 58,77 61,24 65,74 68,92 72,71 76,61 ʑ** 8,85 16,05 23,25 30,45 37,65 44,85 52,05 59,25 66,45 73,65 ʐ** 9,19 16,44 23,69 30,94 38,19 45,44 52,69 59,94 67,19 74,44 ANCHURA 10 20 30 40 50 60 70 80 90 100 ʑ 7,91 0,43 2,27 13,45 33,97 63,81 103,00 151,51 209,36 276,54 ʐ 6,22 0,21 2,48 13,04 31,87 58,99 94,38 138,06 190,01 250,25 PESO HÚMEDO ʑ* ʐ* 0,32 0,5 2,49 3,19 8,23 9,47 19,21 10,48 37,08 37,25 63,45 60,72 99,93 91,79 148,1 131,3 209,54 180,04 285,81 238,8 ʑ** 0,31 2,44 8,12 19,05 36,92 63,38 100,08 148,67 210,79 288,06 ʐ** 0,34 2,51 8,08 18,5 35,18 59,47 92,7 136,18 191,17 258,95 5.1.3.3 Ciclo biológico Con un año de edad la especie es madura realizando varias puestas a lo largo del año (González-Gurriarán, 1985a; Choy, 1986; 1988; Norman, 1989). Existen algunas hipótesis con relación a la edad de los individuos. Así, aproximadamente a los tres años de edad los machos miden alrededor de 68,1 mm en Inglaterra y 69,3 mm en España, mientras que las hembras miden 55,1 y 62,5 mm respectivamente (Wilhelm, 1995). 5. Resultados 45/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco La esperanza de vida de la especie en la costa del País Vasco es de 4 años, con una longitud del caparazón máxima de 99,4 mm y 280,9 g de peso para los machos y 90,1 mm y 180,5 g para las hembras (Borja, 1987). En el presente trabajo sin embargo se han observado en el litoral de San Sebastián machos con una longitud del caparazón máxima de 115 mm y 350 g de peso (Tabla 3). Según Borja (2004), los parámetros poblacionales de la nécora en el País Vasco no difieren significativamente de los parámetros obtenidos por González-Gurriarán (1985a; 1985b) en Galicia. 5.1.3.4 Cópula La cópula tiene lugar entre una hembra madura y un macho con la estructura corporal calcificada. Tiene lugar desde finales de julio a mediados de octubre y su inicio sólo se da tras la ecdisis de la hembra (González-Gurriarán, 1985a) (Tabla 6). El periodo post-cópula es corto (1 a 2 días). La hembra permanece con un tapón de esperma hasta que maduran las gónadas y se inicia la puesta (entre enero y febrero); es entonces cuando los huevos son fertilizados (Borja, 1987). Tabla 6. Representación temporal de las diferentes fases del ciclo vital de Necora puber, así como la época de veda y capturas de la mencionada especie. Clave: Incor.Juv.Pesq. = incorporación de los juveniles a la pesquería. E F M A M J J A S O N D Capturas Veda Cópula Puesta Reclutamiento Incor. Juv. Pesq. ʐ Ovígeras Muda ʑ Muda ʐ 5.1.3.5 Incubación Según González-Gurriarán (1985a) el periodo de incubación varía mucho y depende de la temperatura. 5.1.3.6 Desarrollo larvario El desarrollo larvario de la especie ha sido estudiado, entre otros autores, por Lebour (1927), Rice y Ingle (1975), Mené (1987), Mene et al. (1991), Bigot en 1971, Valdés et al. (1990) y Valdés (1991). 5. Resultados 46/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tras la eclosión el periodo de vida larvaria varía entre los 50 días (Rice y Ingle, 1975) y los dos meses y medio, con lo que según Borja (1987; 1988), se puede calcular que la incorporación de los juveniles de 2,06 mm (Lebour, 1927) a la población tiene lugar en abril (Tabla 6). A partir de entonces sufrirán varias mudas, hasta alcanzar la talla con la que se incorporan a la pesquería en noviembre Borja (1987; 1988). 5.1.3.7 Muda A partir de la incorporación o reclutamiento de los juveniles, éstos sufrirán varias mudas, hasta alcanzar la talla con la que se incorporan a la pesquería en noviembre Borja (1987; 1988). Según González-Gurriarán (1985b), la nécora muda 11 veces hasta cumplir un año de edad, 3 veces en el segundo año y una vez en cada uno de los años siguientes. Borja (1987), pudo observar que los machos empezaban a mudar antes que las hembras, especialmente en abril (Tabla 6). De acuerdo con el mencionado autor, esto dura hasta julio, mes en el cual los machos ya tenían el caparazón calcificado, pero las hembras todavía se encontraban mudando en una importante proporción. 5.1.3.8 Ciclo reproductivo Según González-Gurriarán (1985a; 1985b) y González-Gurriarán y Freire (1994b) los machos no presentan ningún ciclo de madurez o reproductivo a lo largo del año, encontrando que el 50% se hallaban maduros con unos 56 mm de anchura del caparazón y el 100% con 70 mm. Así, en Zierbana una media del 61% de los machos capturados estarían 100% maduros (Tabla 7). En Arminza el porcentaje aumenta hasta un 72% debido a que se capturaron individuos en diciembre y enero, por lo que el crecimiento puede dar lugar a que el porcentaje sea mayor (Tabla 7). Así, en Donostia, en donde el muestreo se llevó a cabo en la época estival, prácticamente el 100% de los machos supera los 70 mm de anchura del caparazón (Tabla 7). Según González-Gurriarán (1985a; 1985b) y González-Gurriarán y Freire (1994b), las hembras eran maduras en un 50% con una anchura del caparazón de 50 mm y el 100% con 60 mm. Teniendo en cuanta dichas referencias, una media del 67% de las hembras del litoral de Zierbana superaban los 60 mm de anchura del caparazón. En Arminza, dicho porcentaje asciende hasta un 90%, probablemente debido al efecto del crecimiento, mientras que en Donostia el 93% de las hembras se encontraban 100% maduras. 5. Resultados 47/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 7. Porcentaje de hembras y machos con anchura del caparazón superior a 60 y 70 mm respectivamente. Puerto Fecha 10-oct-06 31-oct-06 Zierbana 15-nov-06 28-nov-06 Promedio 11-oct-06 17-oct-06 21-dic-06 Arminza 16-ene-07 17-ene-07 30-ene-07 31-ene-07 Promedio 08-jun-07 12-jun-07 13-jun-07 Donostia 14-jun-07 20-jun-07 10-ago-07 Promedio %>60 mm ʐ 80,82 100,00 39,13 71,11 67,14 100,00 85,00 95,45 94,87 85,71 92,31 81,82 90,73 87,50 75,00 100,00 100,00 100,00 100,00 93,75 %>70 mm ʑ 60,49 100,00 27,27 54,76 60,63 73,08 69,44 90,00 65,00 69,23 77,14 60,53 72,06 84,21 100,00 100,00 100,00 100,00 100,00 97,36 Así, en el caso de las hembras, Borja (1987; 1988) determinó un ciclo muy marcado que era patente, entre otras cosas, en las variaciones en el porcentaje de hembras ovígeras a lo largo del año (Figura 16). El ciclo reproductivo de las hembras alcanza su máximo en los meses de enero a marzo (60-80% de las hembras con huevos) (Borja et al., 2004). Posteriormente, en primavera, se da un descenso muy fuerte en el porcentaje, quedando un pequeño resto de hembras ovadas (20%). En verano y otoño, hasta principios de diciembre, no existen hembras ovígeras, o estas aparecen en muy baja proporción (Figura 16). A partir de este mes el aumento porcentual es progresivo (Figura 16) (Borja, 1987). Según Borja (1987), este ciclo es prácticamente similar al encontrado por González-Gurriarán (1985a) en Galicia. Similares resultados a los descritos por Borja et al. (2004) y Borja (1987) se han obtenido en el litoral de Arminza, en donde a partir de mediados de enero el porcentaje de hembras ovígeras asciende a más de un 50% (Tabla 8). En el litoral de Zierbana no se observaron hembras ovígeras al realizarse los muestreos entre octubre y noviembre, mientras que en San Sebastián, en junio de 2007, el porcentaje de hembras ovígeras se situó entre un 0 y un 25% (Tabla 8). 5. Resultados 48/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 16. Ciclo anual en el porcentaje de hembras ovígeras en cada uno de los emplazamientos controlados por Borja (1987) (observar que el 0% se encuentra desplazado para evitar que los puntos caigan sobre el eje). Tomado de Borja (1987). Tabla 8. Porcentaje de hembras ovígeras en el litoral de Zierbana, Arminza y Donostia. Puerto Zierbana Arminza Donostia 5. Resultados Fecha 10-oct-06 31-oct-06 15-nov-06 28-nov-06 11-oct-06 17-oct-06 21-dic-06 16-ene-07 17-ene-07 30-ene-07 31-ene-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 49/143 % Ƃ Ovigeras 0,00 0,00 0,00 0,00 0,00 0,00 6,82 52,94 57,14 39,13 31,82 12,50 0,00 25,00 0,00 0,00 0,00 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.1.3.9 Proporción sexual El porcentaje de hembras se mantuvo alrededor del 50% durante octubre y noviembre. A partir de enero éste descendió hasta situarse entre un 30-50 %, mientras que en entre junio y agosto vuelve a ascender hasta situarse en un máximo del 80% (Tabla 9). Tabla 9. Porcentaje de hembras con respecto a los machos en el litoral de Zierbana, Arminza y Donostia. Puerto Zierbana Arminza Donostia Fecha 10-oct-06 31-oct-06 15-nov-06 28-nov-06 11-oct-06 17-oct-06 21-dic-06 16-ene-07 17-ene-07 30-ene-07 31-ene-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 % Ƃ frente a ƃ 47,40 54,84 51,11 51,72 51,85 35,71 68,75 45,95 35,00 39,66 36,67 70,00 33,33 33,33 66,67 60,00 81,82 González-Gurriarán (1978a; 1985a) encuentra diferencias significativas en febrero y marzo, asociándolo a un incremento de puesta en esta época (con un cambio asociado en la actividad de la hembra, lo cual podría favorecer su captura) o a migraciones reproductivas. Esas migraciones reproductivas parece que tienen lugar según la preferencia por sustratos o zonas determinadas para la puesta (Edwards, 1979). Así, las hembras necesitan fondos de arena, o sustrato similar, para que los huevos se fijen a los pleópodos. De acuerdo con Wilhelm (1995), existen zonas de desove en donde se da una concentración de hembras ovígeras. Dichas zonas se sitúan en fondos arenofangosos, en donde la nécora tiende a enterrarse y salir de vez en cuando para ventilar los huevos. Desde finales de verano se da un aumento gradual en el porcentaje de hembras, antes de iniciarse la puesta, hasta situarse en diciembre en el 70% del total, lo cual parece indicar según Borja (1987) que, efectivamente, existen migraciones 5. Resultados 50/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco reproductivas. Parece que las hembras se reúnen para la puesta, lo cual explicaría el porqué muchas veces en una nasa o una andana vienen sólo hembras, o hembras ovígeras o sólo machos (Borja, 1987). Una vez se inicia la puesta el porcentaje de hembras permanece más cercano al 50%. En el caso de la nécora, parece que hay lugares a los que dirigen sus preferencias para la puesta, en general parece que son lugares protegidos, como rías o desembocaduras. En estos lugares convergen además otras circunstancias favorables, como tipo de sustrato y la alta productividad, que favorecerá posteriormente el desarrollo de las larvas que se encuentran en el plancton (Borja, 1987). 5.1.3.10 Crecimiento Borja (1987) llevó a cabo el cálculo de las funciones teóricas de crecimiento de machos y hembras de acuerdo con el modelo de crecimiento de von Bertalanffy (1938). Así, el crecimiento en talla (anchura del caparazón) quedó expresada mediante la siguiente ecuación: Lt = 112,4*(1-e-0,535*(t+0,035)) en los machos y, Lt = 96,3*(1-e-0,680*(t+0,032)) en las hembras. Por su parte, el crecimiento en peso calculado por Borja (1987) a partir de las relaciones biométricas obtenidas por el mencionado autor quedó expresada mediante la siguiente ecuación: Wt = 403,32*(1-e-0,535*(t+0,035))2,9463 en los machos y, Wt = 215,84*(1-e-0,680*(t+0,032))2,6805 en las hembras. Según Borja (1987), las hembras crecen más deprisa hasta haber alcanzado aproximadamente 55 mm de anchura del caparazón (primer año de vida aproximadamente), siendo más lento posteriormente. Dicha talla resulta crítica, pues es entonces cuando se produce la maduración de ambos sexos y cuando empieza a haber un gran número de hembras ovígeras. A partir de las ecuaciones anteriormente indicadas, en la Tabla 10 se puede observar la anchura y peso correspondientes a cada edad en la nécora según los cálculos realizados por Borja (1987). 5.1.3.11 Capturas La captura de esta especie en el País Vasco se centra fundamentalmente alrededor de los puertos de San Sebastián y Getaria en Gipuzkoa y Arminza y el Abra de Bilbao en Bizkaia. 5. Resultados 51/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 10. Anchura del caparazón (Lt) y peso (Wt) correspondientes a cada edad de la nécora. Tomado de Borja (1987). Machos EDAD 0 I II III IV Lt (mm) 2,06 47,78 74,55 90,23 99,42 Wt (g) 0,003 32,46 120,35 211,18 280,96 Hembras Lt (mm) Wt (g) 2,07 0,007 48,56 34,45 72,11 99,42 84,05 149,87 90,09 180,54 Las capturas se dieron, a partir de unos 46 y 40 mm de anchura el caparazón en el litoral de Zierbana y Arminza respectivamente (Tabla 3). En cuanto al LC, las capturas se dieron a partir de los 36 y 39 mm. Así, en la zona del Abra alrededor del 40% de las capturas se situarion por debajo de los 50 mm de talla mínima legal de captura, mientras que en Arminza este porcentaje desciende hasta un 30%. Es sabido que los jóvenes, a los que corresponden las medidas inferiores de 50 mm, suelen vivir en lugares más resguardados y a menor profundidad y con parte de sustrato arenoso o blando, de ahí que en el Abra se capturen más individuos jóvenes (Borja, 1987). En cambio las capturas que se llevan a cabo en mar abierto y a algo más de profundidad proporcionan animales de mayor talla (Borja, 1987). Tal es el caso del litoral de San Sebastián en el que el individuo de menor talla capturado tenía 75 mm de anchura de caparazón (Tabla 3). En octubre se capturan individuos de tallas elevadas, pero en noviembre la talla decrece mucho (Figura 17). Hay dos hechos que los explican según Borja (1987). En primer lugar es en noviembre cuando se da la primera incorporación a la pesquería de los individuos nacidos al comienzo del año. En segundo lugar, se da una fuerte mortalidad de las clase de de talla superiores, probablemente debido al elevado esfuerzo de pesca que se aplica en los comienzos de la costera de la nécora. A partir de diciembre se da una nueva recuperación en la talla media, fundamentalmente debido al crecimiento (Figura 17). Teniendo en cuenta los resultados indicados en las Tablas 3 y 10, la pesquería dirige su esfuerzo hacia animales que han superado el segundo año de vida, tanto en Zierbana como en Arminza. En cuanto a las Capturas por Unidad de Esfuerzo (kg/100 nasas), en coincidencia con Borja (1987), se observa que es generalmente elevada a la apertura de la veda, en octubre, para descender posteriormente (Tabla 11). Es de destacar que la CPUE obtenida por Borja (1987) para Zierbana fue de aproximadamente 50 kg/100 nasas en octubre, mientras que en la actualidad dicho esfuerzo se ha reducido hasta los 13,73 kg, lo cual indicaría una menor disponibilidad del recurso en la actualidad. Como consecuencia de ello, el número 5. Resultados 52/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco de barcos habituales para la pesca de nécora en Zierbana se ha reducido de 5 en 1987 a un único barco en la actualidad. Por otra parte, mientras Borja (1987) determinó una media de captura 218 nécoras por cada 100 nasas, en la actualidad dichos valores son notablemente inferiores, con un valor en octubre (al inicio de la campaña de capturas) de 128 y 45 nécoras cada 100 nasas en Zierbana y Arminza (Tabla 11). Así, las capturas estimadas al año de 47 t en la década de los 80 según Borja (1987) serían notablemente menores en la actualidad. 136 AC (mm) 116 96 76 56 10-ago-07 20-jun-07 13-jun-07 12-jun-07 08-jun-07 31-ene-07 30-ene-07 17-ene-07 16-ene-07 21-dic-06 28-nov-06 15-nov-06 31-oct-06 17-oct-06 11-oct-06 10-oct-06 36 134 LC (mm) 114 94 74 54 10-oct-06 11-oct-06 17-oct-06 31-oct-06 15-nov-06 28-nov-06 21-dic-06 16-ene-07 17-ene-07 30-ene-07 31-ene-07 08-jun-07 12-jun-07 13-jun-07 20-jun-07 10-ago-07 34 Figura 17. Box and Whisker Plot de la anchura y longitud del caparazón (AC y LC respectivamente) de los individuos de nécora obtenidos en los litorales de Zierbana, Arminza y san Sebastián tomando de forma conjunta los valores de AC y LC de machos y hembras. 5. Resultados 53/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 11. Capturas por Unidad de Esfuerzo (kg/100 nasas) en el litoral de Zierbana, Arminza y Donostia. Puerto Zierbana Arminza Donostia Fecha 10-oct-06 31-oct-06 15-nov-06 28-nov-06 11-oct-06 17-oct-06 21-dic-06 16-ene-07 17-ene-07 30-ene-07 31-ene-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 Nº Nécoras C.P.U.E. cada 100 nasas (kg/100 nasas) 128,33 13,73 25,83 3,81 37,50 2,58 72,50 --45,00 6,12 46,67 6,74 91,43 3,18 41,11 4,67 22,22 2,81 96,67 11,95 100,00 12,80 11,11 2,09 13,33 2,60 13,33 2,32 3,33 0,49 22,22 2,97 12,22 2,68 5.1.4 Bogavante (Homarus gammarus, Linnaeus, 1758) Existen dos especies de bogavante: Homarus americanus conocido como el bogavante americano y Homarus gammarus, conocido como el bogavante europeo. Mientras la pesquería de la especie americana es bien conocida por medio de multitud de estudios de campo (Beninger et al., 1986; Factor, 1995; Miller y Rodger, 1996; Incze et al., 2000; 2003; Rowe, 2002; Smith y Tremblay, 2003; Wahle, 2003), en el caso de la especie europea, su conocimiento se basa fundamentalmente en estudios llevados a cabo en piscifactorias (Van der Meeren, 2005). 5.1.4.1 Distribución Se distribuye por el Atlántico oriental, desde las islas Lofoten (Noruega) hasta Marruecos, y por el Mediterráneo hasta el Mar Negro. Está presente en todo el litoral español, excepto en Canarias, aunque es una especie rara en todas las zonas, sobre todo en las costas mediterráneas. Suele encontrarse en el infralitoral inferior y en el circalitoral (normalmente entre 20 y 60 m de profundidad), en fondos con grandes bloques rocosos y galerías con arena. Puede encontrarse también en los bosques de laminarias (Templado et al., 2004). 5. Resultados 54/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 18. Distribución geográfica de Hommarus gammarus. Tomado de Cooper y Uzmann (1980). 5.1.4.2 Morfología Es el mayor crustáceo de las costas europeas, cuyo cuerpo alargado y robusto puede alcanzar los 60 cm de longitud (Figura 19). Figura 19. Vista lateral de un individuo de H. gammarus. Tomado de Phillips et al. (1980). Lo más característico son las grandes y robustas pinzas que presenta. La derecha (trituradora) suele ser mayor que la izquierda (cortante) (Figura 19). El segundo y tercer par de patas marchadoras también presentan una pinza terminal, pero en este caso muy pequeña (Figura 19). El caparazón es liso, con un surco medio longitudinal, con una espina encima de cada ojo y otra por debajo y algo más atrás. El segundo par de antenas tiene una longitud similar a la del cuerpo (Figura 19). Presenta un color gris azulado o violeta, jaspeado. Por su cara inferior es amarillento (Templado et al., 2004). 5. Resultados 55/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.1.4.3 Relaciones biométricas En la Tabla 12 se puede observar los resultados obtenidos para cada uno de los parámetros biológicos controlados. Para su cálculo se han tomado de forma conjunta los resultados tanto de hembras como de machos, dado que no se encontraron diferencias significativas entre ambos sexos para ninguno de los parámetros controlados. Debuse et al. (2001) sin embargo, si encontraron un dimorfismo sexual en relación con el tamaño de los quelípedos cortador y triturador. La longitud total de los individuos se situó entre un mínimo de 17 cm y un máximo de 42 cm, con un peso de 0,5 y 3 kg respectivamente. Phillips et al. (1980) mencionan individuos de 65 y 62 cm de longitud máxima y un peso de 9 y 8,4 kg respectivamente, capturados en la década de los sesenta. En el caso del País Vasco, también se han obtenido de forma ocasional ejemplares de gran tamaño, tales como el mostrado en la Figura 20, que midió un metro y pesó 7,2 kg. Tabla 12. Parámetros biométricos (en mm) y peso medio (en gramos) de los individuos de bogavante capturados en el litoral de San Sebastián entre junio y agosto de 2007. n Media Error Est. Min. Max. Ltotal 89 301,06 6,21 170 420 Lcola 94 135,66 2,83 68,3 195 LC 94 135,72 2,85 55 190 AA 94 53,59 1,27 25,8 90 LQC 91 139,03 3,35 55 240 AQC 91 43,50 1,56 17,5 135 LQT 91 26,68 2,95 10 98 AQT 91 52,06 1,60 5 85 PQC 91 73,71 1,74 37,5 135 PQT 90 61,57 1,71 11 95 APT 91 22,45 0,79 8 65 Peso 93 876,15 55,69 50 3000 Con el fin de determinar aquellos parámetros biométricos que explican la mayor parte de la variabilidad de los resultados obtenidos se llevó a cabo un Análisis Factorial. Tal y como se puede observar en la Tabla 13, tan sólo el primer factor aúna más del 70% de la variabilidad de los datos, mientras que los tres primeros factores suponen el 86% de la variabilidad total. En la Tabla 14 se puede observar el peso de cada variable con respecto a cada factor extraído. 5. Resultados 56/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 20. Noticia publicada en el Diario Vasco. Tabla 13. Valores propios para cada uno de los 12 factores extraídos mediante el método de componentes principales. Asimismo se detalla el porcentaje de varianza explicado por cada factor, así como el porcentaje de varianza acumulado entre todos los factores extraídos. Factor nº 1 2 3 4 5 6 7 8 9 10 11 12 5. Resultados Valor propio % de Varianza % Acumulado 71,19 8,96 6,28 4,65 3,71 2,05 0,96 0,81 0,59 0,38 0,26 0,11 71,19 80,15 86,44 91,09 94,81 96,84 97,83 98,65 99,24 99,62 99,88 100,00 8,54 1,08 0,75 0,56 0,45 0,25 0,12 0,10 0,07 0,05 0,03 0,01 57/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 14. Peso de cada variable en relación con cada factor extraído. Peso Ltot Lcola LC AA LQC AQC LQT AQT PQC PQT APT Factor 1 0, 0,85 0, 0,78 0,77 0, 0, 0,82 0,72 0, 0,87 0, 0,35 -0,21 0,37 0, 0,83 0,33 0,37 Factor 2 0,26 0,42 0,40 0,40 0,34 0,26 0,17 -0,24 0,81 0, 0,19 0,90 0, 0,06 Factor 3 0,28 0,28 0,23 0,19 0,13 0,23 0,17 -0,13 0,20 0,24 -0,04 0,90 0, El primero de los factores se encuentra relacionado con el peso, la longitud total del individuo, la cola y el caparazón, así como con la anchura del segundo segmento del abdomen (Tabla 14). Asociado a este factor también se encuentra la longitud y profundidad del quelípedo cortador (LQC y PQC respectivamente) (Tabla 14). El segundo y tercer factor se encuentran relacionados con tres características del quelípedo triturador, su anchura, longitud y anchura de su propodito (Tabla 14). En la Figura 21 se puede observar la disposición de cada individuo muestreado en relación con cada uno de los factores extraídos. En la Tabla 15 se pueden observar las ecuaciones obtenidas en el análisis de las relaciones biométricas entre la longitud del caparazón, total del individuo y la cola con el peso de los individuos. Tabla 15. Relaciones biométricas entre la longitud del caparazón, la cola y total del individuo y el peso del bogavante en el litoral de San Sebastián. Relaciones 5. Resultados ECUACION n r2 Peso(y) – LC(x) y = (-14,312 + 0,3123*x)2 92 0,91 Peso(y) – Lcola(x) y = (-13,3616 + 0,3062*x)2 92 0,88 Peso(y )– Ltotal(x) y = 0,00001*x3,16016 87 0,96 58/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 9 Factor 2 6 3 0 -3 -6 -9 -14 -9 -4 1 6 11 16 6 11 16 Factor 1 7 Factor 3 5 3 1 -1 -3 -5 -14 -9 -4 1 Factor 1 Figura 21. Posición de cada uno de los individuos muestreados en relación con el primer y segundo factor y el primer y tercer factor extraído por el análisis factorial realizado. Como se puede observar, aunque la longitud total del individuo podría ser el mejor estimador del peso, su medición entraña mayor dificultad al tener que extender el individuos sobre un ictiómetro, siendo por ello la longitud del caparazón un estimador más práctico. De acuerdo con las ecuaciones calculadas, un individuo de talla legal de captura (87 mm) tendría un peso húmedo de 165 g. En la Tabla 16 se han calculado el peso húmedo que correspondería a cada individuo para longitudes del caparazón estándar entre 10 y 100 mm. 5. Resultados 59/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 16. Pesos húmedos obtenidos, para longitudes del caparazón estándar a partir de las ecuaciones de regresión calculadas. Por encima y debajo de las líneas punteadas se encuentran resultados teóricos al no haberse medido individuos con dicha anchura. LC (mm) 15 30 45 60 75 90 105 120 135 150 165 180 195 210 225 PESO HÚMEDO (g) 92,69 24,43 0,07 19,59 83,00 190,30 341,49 536,57 775,54 1058,40 1385,14 1755,78 2170,30 2628,72 3131,02 5.1.4.4 Proporción sexual El porcentaje de machos frente a hembras disminuye paulatinamente desde un 81% a principios de junio, hasta un 33% a inicios de agosto, lo cual podría indicar algún tipo de migración asociada a alguna fase del ciclo vital de la especie. Tabla 17. Porcentaje de machos con respecto a hembras en el litoral de San Sebastián. Fecha 07-jun-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 % ƃ frente a Ƃ 81,25 83,33 60,00 62,50 40,00 53,33 33,33 5.1.4.5 Ciclo reproductivo La producción de huevos de una determinada clase de talla depende del tamaño del individuo en la madurez, la frecuencia de las puestas y el número de individuos de la correspondiente clase de talla (Tully et al., 2001). 5. Resultados 60/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco De acuerdo con los resultados obtenidos por Latrouite et al. (1981) en dos poblaciones situadas en la costa de Iroise y en la isla de Yeu en el Golfo de Vizcaya, el porcentaje de hembras ovígeras presenta un marcado ciclo estacional. Éste es máximo entre los meses de enero a marzo. A partir de entonces y hasta abril-mayo el porcentaje desciende a razón aproximada de un 2-3%. Así durante los meses de julio y agosto se alcanzan los valores mínimos, 7 y 8% en la costa de Iroise e Isla de Yeu respectivamente. En las capturas llevadas a cabo en el litoral de San Sebastián durante el mes de junio se obtuvo un 12,5% de las hembras capturadas con hueva. Las hembras empiezan la puesta en los meses de julio y agosto, llevando los huevos por espacio de 10 a 11 meses (Zariquiey, 1968), aunque probablemente dependa de la temperatura del agua (Latrouite et al., 1981) (Tabla 18). En Irlanda, la puesta tiene lugar en junio y julio (Tully et al., 2001), encontrándose una mayor proporción de larvas en los meses de julio y agosto, especialmente durante la noche (Tully y Céidigh, 1987). Según Latrouite et al. (1981), ésta tiene lugar seis semanas después de la cópula y pocos días después de la muda en las hembras, por tanto durante los meses de abril-mayo (Tabla 18). Tabla 18. Representación temporal de las diferentes fases del ciclo vital del bogavante Homarus gammarus (Linnaeus, 1758), así como la época de veda y capturas de la mencionada especie. E F M A M J J A S O N D Capturas Veda Cópula Puesta (Freza) Migración ʑ Migración ʐ ʐ Ovígeras (%) Muda ʑ Muda ʐ Es una especie muy longeva. Las hembras alcanzan la madurez sexual con una talla comprendida entre 85 y 115 cm de longitud del cefalotórax, lo que equivale a una edad entre los 4 y 8 años (Templado et al., 2004). En las costas de Escocia el inicio de la maduración en las hembras se da con una talla comprendida entre los 79 y 98 mm de LC, mientras que en los machos entre 80 y 110 mm de LC (Lizarraga-Cubedo et al., 2003). Según Tully et al. (2001), en las costas de Irlanda el 50% de los individuos de bogavante se considera madura para una longitud del cefalotórax de 96 mm, mientras que en Francia, en las costas de Iroise y la Isla de Yeu dicha longitud es de 99 y 98 mm respectivamente (Latrouite et al., 1981). Tomando como referencia los 98 mm, el 87,50% de las hembras capturadas en el litoral de San Sebastián superaban dicha medida (Tabla 19). 5. Resultados 61/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 19. Porcentaje de hembras capturadas en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007 con una longitud del cefalotórax superior a 98 y 110. mm. Fecha 07-jun-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 Media %>98 mm 100,00 50,00 87,50 100,00 100,00 100,00 75,00 87,50 %>110 mm 100,00 50,00 75,00 100,00 66,67 85,71 50,00 75,34 Según Latrouite et al. (1981), la totalidad de las hembras se encuentran maduras a partir de una longitud del cefalotórax de 110 mm. En el caso de las hembras capturadas en el litoral de San Sebastián, el 75,34% de las mismas superaban dicho límite y por tanto se podían considerar como maduras al 100% (Tabla 19). Las hembras ovadas de menor tamaño obtenidas por Lizarraga-Cubedo et al (2003) en dos poblaciones del litoral de Escocia se situaron en torno a 82-87 mm de LC. En el caso del litoral de San Sebastián, la hembra ovada de menor tamaño obtuvo un valor de LC de 170 mm. Tully et al. (2001) establecieron una relación potencial entre el número de huevos y la longitud del cefalotórax en hembras de bogavante según la siguiente ecuación: Nº Huevos/1000 = 0,0044*LC3,1554 Otros autores como Hepper y Gough (1978) y Latrouite et al. (1984) establecieron una relación lineal según la siguiente ecuación: Nº = 217,74*LC – 12490 (Hepper y Gough, 1978) Nº = 465,87*LC – 21746 (Latrouite et al., 1984) No todos los bogavantes de gran tamaño tienen también una gran edad, ya que algunos de ellos crecen de forma muy rápida. La edad estimada del bogavante de mayor tamaño muestreado por Sheehy et al. (1999) en Cornwall (U.K.) con un LC de 166 mm fue de tan sólo 11 años. Según el mencionado autor, este resultado explicaría la persistencia de individuos de gran tamaño incluso en zonas sometidas a un fuerte esfuerzo pesquero. En el caso particular del País Vasco, con una pesquería claramente en receso se han obtenido también de forma ocasional ejemplares de gran tamaño, tales como el mostrado en la Figura 20. Según Tully et al. (2001), las diferencias geográficas en la talla de primera madurez en Homarus gammarus no son tan evidentes como en la especie americana (H. americanus). 5. Resultados 62/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Asimismo, la producción de huevos y su tamaño está positivamente correlacionada con el tamaño del cuerpo de la hembra, es decir, cuanto más grande sea ésta, mas huevos y de mayor tamaño producirá, y en consecuencia larvas de mayor tamaño que tendrán una mayor probabilidad de sobrevivir (Tully et al., 2001). Existen tres estadios larvarios pelágicos, capaces de realizar lentos desplazamientos verticales diarios en sus fases de desarrollo más maduras siguiendo un comportamiento fotonegativo (Tully y Céidigh, 1987), seguidos de una postlarva con actividad natatoria que es la que buscará un sustrato adecuado para el asentamiento. La duración de la fase pelágica puede oscilar entre uno y tres meses, en función de la temperatura (es más corta en aguas más cálidas). Tal y como se ha comentado anteriormente, Tully y Céidigh (1987), determinaron una mayor proporción de larvas durante los meses de julio y agosto, especialmente durante la noche. Según Templado et al. (2004), la eclosión tiene lugar durante la noche. Durante los dos o tres años de vida bentónica los juveniles permanecen casi todo el tiempo en sus refugios y son capaces de alimentarse de materia orgánica en suspensión. El porcentaje de supervivencia de los juveniles es bastante elevado, lo que compensa la baja fecundidad de esta especie (Templado et al., 2004). Según Mercer et al. (2001) jamás se han encontrado individuos de 4-14 mm de longitud de caparazón, correspondientes a la fase recién incorporada al bentos en ninguna localidad de la amplia distribución geográfica de la especie. En general, la estrategia vital del bogavante es a una maduración tardía, baja fecundidad y una esperanza de vida elevada en poblaciones de baja densidad de individuos (Sheehy et al., 1996; Wahle, 1998). Por tanto, el asentamiento larvario en grandes densidades, tal y como ocurre en otros crustáceos decápodos, no es una característica propia del bogavante (Van der Meeren, 2005) 5.1.4.6 Comportamiento Es una especie territorial, de hábitos nocturnos (Smith et al., 1998) y que se alimenta de un gran abanico de invertebrados bentónicos (Smith et al., 2001), principalmente de crustáceos y moluscos bivalvos. Después de la muda, la actividad en busca de alimento se incrementa, por lo que la entrada de individuos en las nasas es mayor en comparación con individuos que no han mudado (Cobb, 1995). De igual forma, después de la muda las hembras requieren lugares de protección en una fase en la que el caparazón es más sensible, de forma que la competencia entre hembras puede ser tan frecuente como entre machos (Debuse et al., 2001). Los adultos son solitarios y suelen permanecer en su territorio durante largos periodos de tiempo. Es una especie altamente agresiva ante la presencia de otros individuos de la misma especie. Incluso en presencia de depredadores, los 5. Resultados 63/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco individuos presentes en un refugio pelean con agresividad por proteger su espacio frente a otros (Van der Meeren, 2005). Sólo ocasionalmente algunos ejemplares se desplazan distancias superiores a 10 km y no parecen existir migraciones estacionales (Templado et al., 2004). Estudios llevados a cabo por Smith et al. (2001) determinaron que el 95% de los individuos marcados y recapturados no se movieron más allá de 3,8 km del lugar de suelta sobre un espacio temporal de 862 días. Movimientos superiores a 5 km fueron llevados a cabo por individuos de gran tamaño y en su mayor parte en dirección contraria a la dirección principal de las corrientes generadas por la marea y el viento en el canal de la Mancha. Sin embargo, la mayor parte de los individuos marcados por Smith et al. (2001) eran inmaduros, mientras que otros autores (Jensen et al., 1994) indican una mayor capacidad de movimiento en individuos de talla mayor a la estudiada por Smith et al. (2001), aunque aparentemente siguen manteniendo una cierta fidelidad a determinadas zonas durante largos periodos de tiempo. Por otra parte, Howard (1980) estableció una relación significativa entre el tipo de sustrato y el tamaño de los individuos. Las zonas de sustrato rocoso que ofrecen oquedades de pequeño tamaño, albergan individuos de pequeño tamaño y a la inversa. Tal y como describen Cooper y Uzmann (1980), el bogavante tiende a excavar agujeros o túneles bajo las piedras, con una o más salidas (Figura 22). Cuando las rocas yacen sobre un sustrato blando, existe un límite en el tamaño del tunel o agujero capaz de llevar a cabo sin que la piedra caiga y colapse. Estas oquedades estarán ocupadas por pequeños bogavantes, mientras que en zonas donde se da la presencia conjunta de grandes bloques y piedras, la posibilidad de llevar a cabo la construcción de grandes oquedades o túneles permite la presencia de bogavantes de mayor talla (Cooper y Uzmann, 1980). Delante de los túneles excavados, el bogavante construye una pared protectora con diversos desechos, conchas, etc. (Figura 22). Así, en el litoral de San Sebastián los lances realizados por las embarcaciones dedicadas a la pesca de bogavante se situaron en todos los casos en el límite de la zona rocosa (lajas, grandes bloques, etc.) con la zona de grandes bancos de arena, lo cual coincidiría con lo anteriormente indicado (Figura 23). Estudios llevados a cabo en laboratorio, han demostrado que de forma similar a la especie americana, los juveniles recién incorporados a la fase bentónica de H. gammarus prefieren un sustrato constituido por cantos o bloques en vez de arenosos o rocosos (Linnane et al., 2000a; 2000b). Sin embargo, muestreos intensivos llevados a cabo en este tipo de sustrato no obtuvieron ningún individuo perteneciente a esta fase temprana de incorporación al bentos (Mercer et al., 2001). Teniendo en cuenta la importancia de la disponibilidad de refugio para la supervivencia de la especie, especialmente en su fase juvenil, (Van der Meeren, 2005), la escasez de zonas de protección puede dar lugar a que los individuos que 5. Resultados 64/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco carezcan de alguna de sus pinzas sean desplazadas por individuos dominantes en menos de un día (Van der Meeren y Uksnoy, 2000). Figura 22. Esquema del tipo de cavidades que el bogavante excava bajo las piedras: (A) sección longitudinal de la clásica cavidad con una única salida; (B) pared semicircular frente a la cavidad excavada; (C) sección longitudinal de una cavidad con dos aperturas; (D) extensión de la cavidad bajo la roca y (C) cavidad con tres salidas. Tomado de Cooper y Uzmann (1980). San Sebastián Hondarribia Pasajes Figura 23. Posición de los lances de nasa efectuados para la captura de bogavante en el litoral de San Sebastián y Pasajes. 5. Resultados 65/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.1.4.7 Mortalidad Sheehy et al. (1999) estableció en un 8% y un 14% anual la tasa de mortalidad natural de H. gammarus en hembras y machos respectivamente. Similares resultados (10% y 20%) fueron determinados previamente por Bannister (1986). La diferencia entre sexos puede deberse al comportamiento agresivo y territorial de los machos o a una menor exposición de las hembras a diversos peligros en zonas someras cuando se encuentran grávidas (Sheehy et al., 1999). 5.1.4.8 Capturas En la Figura 24 se puede observar la evolución de la CPUE en la pesquería de bogavante en las costas de Devon en Inglaterra, en el que se observan dos picos en primavera (marzo-abril) y otro más corto en otoño (octubre). Figura 24. Evolución de las capturas por unidad de esfuerzo (CPUE) entre enero y diciembre de 1971 en la pesquería de bogavante en Devon (Inglaterra). Adaptado de Bennet (1974). Los resultados obtenidos en San Sebastián durante el mes de junio y agosto son claramente superiores a los observados por Bennet (1974), con una CPUE media en junio de 14,26 kg/100 nasas y un valor único en agosto de 4,30 kg/100 nasas (Tabla 20). Como se puede observar, la CPUE presenta una gran variabilidad de unos días a otros durante el mes de junio. Algunos autores como Drinkwater et al. (2006), en el caso particular del bogavante americano, asocian dicha fluctuación a la temperatura del agua de mar influenciada por los vientos predominantes. En coincidencia con Bennet (1974), se observó que en este tipo de pesquería, cualquier desviación respeto del tiempo medio de inmersión de las largadas entre un día y otro se debe a las malas condiciones de mar que impiden la recogida de las nasas. 5. Resultados 66/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 20. CPUE para el bogavante en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007. CPUE (kg·100nasas-1) 15,30 8,83 24,41 7,74 12,71 16,58 4,30 Fecha 07-jun-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 Según Bennet (1974), las capturas máximas se dan con un periodo de inmersión de un día, especialmente si este se lleva a cabo durante la noche, lo cual coincide con la normativa establecida para la captura de bogavante en la CAPV. En el litoral de San Sebastián, el porcentaje medio de individuos que cumplía con la talla mínima legal de captura (87 mm de LC) fue del 97% (Tabla 21). Hasta mediados de junio, dicho porcentaje se situó en torno a un valor medio de 93%, para incrementarse hasta el 100% a principios de agosto. Tabla 21. Porcentaje individuos capturados en el litoral de San Sebastián entre el 7 de junio y el 10 de agosto de 2007 con una longitud del cefalotórax superior a 87 mm. Fecha 07-jun-07 08-jun-07 12-jun-07 13-jun-07 14-jun-07 20-jun-07 10-ago-07 Media %>98 mm 93,75 91,67 95,00 100,00 100,00 100,00 100,00 97,20 5.1.5 Langosta (Palinurus elephas, Fabricius 1787) 5.1.5.1 Distribución De acuerdo con Hunter (1999), la especie se encuentra en el Mediterráneo (especialmente en las islas Baleares, Córcega, Sardinia y el noroeste de Túnez, así como en el mar Adriático y Egeo) y el Atlántico (Azores y Madeira, por encima de 26ºN en la costa oeste de África, Marruecos, la Península Ibérica y en la costa oeste de Inglaterra e Irlanda) (Figura 25). Común, principalmente en fondos rocosos, entre los 20 y 70 m de profundidad (Zariquiey, 1968). 5. Resultados 67/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 25. Distribución geográfica de la langosta (Palinurus elephas). Tomado de http://www.mnhn.fr/mnhn/bimm/protection/maps/Crustacea/Palinuruselephas.jpg. 5.1.5.2 Morfología La morfología es similar a la de otros grupos de palinúridos. La coloración es roja a marrón en la zona dorsal y blanca en la abdominal, aunque según Hunter et al. (1996) puede mostrar grandes variaciones (Figura 26). Presenta un cuerpo alargado y robusto, de hasta 50 cm de longitud. El caparazón es casi cilíndrico y son muy características las largas antenas, que pueden sobrepasar la longitud total del cuerpo del animal (Templado et al., 2004). 5.1.5.3 Muda Algunos días antes de la muda los individuos dejan de alimentarse y se encuentran en aguas más someras. Después de la muda, no comienzan a alimentarse hasta 719 días después. En el mar Adriático, la muda tiene lugar a lo largo de todo el año cuando la temperatura del agua se sitúa entre 12 y 16ºC (Karlovac, 1965), con algunos picos entre diciembre-enero y mayo (Hunter, 1999). Para individuos de talla 45-49 mm de longitud del caparazón (LC) se han observado tres mudas por año, para individuos de 50-62 mm LC, dos mudas por año, mientras que para individuos de más de 64 mm LC una muda por año (Hunter, 1999). Según Hunter et al. (1996) el 74% de las hembras estudiadas presentaban una muda reciente en septiembre, lo cual indicaría que al reclutamiento en verano (junio-julio) le sigue una muda estival y un periodo de apareamiento (Tabla 22). En la costa Inglesa, la muda de las hembras ha sido descrita entre julio y septiembre (Ansell y Robb, 1977; Hepper, 1965,1977), mientras que en Irlanda la muda para ambos sexos se ha descrito entre el final de la primavera y el inicio del verano (Mercer, 1973). 5. Resultados 68/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 26. Morfología externa de una langosta adulta (Palinurus elephas, Fabricius, 1787). (A) vista dorsal, (B) hembra portadora de huevos, vista ventral, (C) macho, vista ventral, (D) hembra, vista ventral. A1, anténulas; A1, anténas; An, ano, Em, masa de huevois, Fgo, apertura genital de una hembra, Mgo, apertura genital de un macho, P1P5, pereiópodos 1 a 5, Pp, pleópodos, Te, telson, Ur, urópodos. Tomado de Hunter (1999). Tabla 22. Representación temporal de las diferentes fases del ciclo vital de la langosta Palinurus elephas (Fabricius, 1787), así como la época de veda y capturas de la mencionada especie. E Capturas Veda Cópula Eclosión Reclutamiento Migración ʑ Migración ʐ ʐ Ovígeras Muda ʑ Muda ʐ 5. Resultados F M A Ń Ń M 69/143 J J A S O N D Ņ Ņ © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco En el caso de los machos, Hunter et al. (1996) indican indicios de su muda durante el invierno con un pico de incidencia coincidente con la muda de las hembras (Tabla 22). 5.1.5.4 Crecimiento Es una especie longeva que puede vivir más de 10 años. El crecimiento se produce de forma discontinua por medio de mudas (Templado et al., 2004). Basado en el modelo de Von Bertalanffy, la disminución de la frecuencia de muda es más destacada en hembras de más de 6 años, por lo que el crecimiento global es menor que en los machos. La longitud del caparazón (LC) en relación con la edad según Hunter (1996) se expresa de acuerdo con las siguientes ecuaciones: Macho LC = 156.1817*(1-e-0.01669*t) Hembra LC = 122.6306*(1-e-0.2782*t) Teniendo en cuanta que la temperatura del agua puede regular los ciclos de muda en crustáceos (Chittleborough, 1975,1976), es razonable pensar que el crecimiento de P. elephas en el Atlántico sea más reducido que en el Mediterráneo. 5.1.5.5 Ciclo reproductivo La talla de primera maduración en el Mediterráneo es de 67 mm LC y 70-80 mm LC en el Atlántico (Hunter et al., 1996), a los tres años de edad aproximadamente (Templado et al., 2004). El 74% de las hembras estudiadas por Hunter et al. (1996) presentaban una muda reciente en septiembre, lo cual indicaría que a la eclosión de los huevos en verano (junio-julio) le sigue una muda estival y un periodo de apareamiento que se sitúa a finales de junio en Portugal y desde mediados de agosto hasta septiembre en Irlanda (Tabla 22). En el caso de los machos, Hunter et al. (1996) indican indicios de su muda durante el invierno (Tabla 22). Los individuos de talla pequeña mudan más a menudo que los individuos de talla grande. El proceso de ovogénesis se desarrolla desde los meses de verano hasta que los ovarios ocupan de forma completa la cavidad del cefalotórax, entre julio y octubre (Tabla 22). La incubación de los huevos tiene lugar durante 9 meses en el atlántico, por tanto, desde octubre hasta mayo aproximadamente (Ansell y Robb, 1977; Hepper, 1977; Hunter et al., 1996; 1999) (Tabla 22). Según Hunter et al. (1996), en estudios llevados a cabo en Gales y Cornwall, la eclosión de los huevos se inicia en mayo y tiene lugar fundamentalmente durante los meses de junio a julio (Tabla 22). La duración de este proceso se cifra en 2 a 8 días (Karlovac, 1965; Campillo y Amadei, 1978) con un máximo en torno al día 3 y 5 (Hunter, 1999). 5. Resultados 70/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Según (Zariquiey, 1968), se observan hembras ovígeras en septiembre y octubre (Tabla 22). Los huevos de 1,02 x 1,11 mm tardan unos seis meses en avivarse; las larvas phyllosoma son pelágicas. De acuerdo con Campillo y Amadeo (1978), la fecundidad de P. elephas (número de huevos) se incrementa de forma lineal con el tamaño del caparazón de acuerdo con la siguiente ecuación: y = 3033x – 229809 (r = 0,97) Una única puesta es incubada a lo largo del año. Algunos autores cifran en un 2530% la pérdida de huevos durante la incubación mediante técnicas de extrapolación con otros macruros. Mercer (1973) determinó dicha pérdida en un 10% durante la incubación y un 0,05% durante la eclosión. 5.1.5.6 Desarrollo larvario El primer estadio larvario es la larva phyllosoma de 3 mm de diámetro en el momento de la eclosión de la que se han descrito 10 estadios, el último de los cuales tiene un tamaño de 21 mm (Figura 27). En el momento de la eclosión presenta un comportamiento fototrópico positivo, el cual revierte en negativo al cabo de 6-7 días. Figura 27. Desarrollo larvario de Palinurus elephas (Fabricius, 1787). A, estado I phyllosoma (vista dorsal); B, estado X phyllosoma y metamorfosis (vista dorsal); c, puerulus (vista dorsal); d, post-puerulus (vista dorsal). Tomado de Hunter (1999). 5. Resultados 71/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Después de un proceso de metamorfosis, el siguiente estadio es la larva puerulus, la cual ya presenta una cierta capacidad natatoria (Figura 27). La larva puerulus muda 3 veces hasta el momento de la metamorfosis y su transformación en la fase bentónica post-puerulus, de 20 mm de longitud del telson. La duración del desarrollo larvario es de 5 a 6 meses en el Mediterráneo y de un año en el Atlántico (Mercer, 1973). A pesar de que el desarrollo larvario se ha descrito con detalle, no ocurre lo mismo con el desarrollo post larvario y juvenil hasta la aparición de individuos adultos (Hunter, 1999). El periodo de reclutamiento (proceso de asentamiento de los juveniles al fondo) es corto y coincide con los meses de calentamiento más acusado del agua (mayo-junio). Existe una clara preferencia de los juveniles por las paredes rocosas verticales, subverticales o extraplomada, en ambientes umbríos. El reclutamiento parece concentrarse por encima de los 20 m de profundidad, preferentemente en el intervalo de 10 a 15 m (Templado et al., 2004). 5.1.5.7 Sex-ratio Según, Hunter et al. (1996), la presencia de una mayor proporción de hembras en las capturas es una aspecto común a la pesquería de esta especie. La relativa ausencia de machos durante el invierno se relaciona con periodos de migración de la especie, dado que después de la puesta de los huevos en otoño tanto machos, como hembras migran hacia mayores profundidades para volver a aguas someras en la primavera (Mercer, 1973). En cualquier caso, los movimientos migratorios descritos por Mercer (1973) en la costa oeste de Irlanda se restringen hasta la batimétrica de 80 m. 5.1.5.8 Hábitos alimenticios El análisis del contenido estomacal de esta especie muestra la presencia de restos de conchas de moluscos y restos de erizos de hasta 6 mm de tamaño (Ansell y Robb, 1977; Campillo y Amadei, 1978; Hunter, 1999). Otros restos comprenden el tubo de anélidos poliquetos, briozoos, huesos de peces y macroalgas (Hunter, 1999). La predominancia de restos de conchas podría ser indicativo del requerimiento en calcio previo a la muda (Campillo y Amadei, 1978). 5.1.5.9 Comportamiento • Migración De acuerdo con Hunter (1999), las capturas durante la época invernal son escasas en todas las pesquerías. Aunque la disminución de la actividad pesquera y la inactividad de la especie asociada a la temperatura podrían explicar este fenómeno, 5. Resultados 72/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco la mayor parte de los estudios llevados a cabo sugieren una migración mar adentro de la especie. Estudios llevado a cabo por Ansell y Robb (1977) en Escocia, mostraron que las capturas realizadas durante el verano se llevaron a cabo en aguas más someras que las realizadas en invierno. Observaciones llevadas por a cabo por Mercer (1973) mediante buzos en la costa oeste de Irlanda, determinaron una migración de los machos desde las zonas someras de verano hacia aguas profundas durante el final del otoño (a excepción de aquellos de talla superior a 150 mm) donde pasan el invierno hasta la primavera en que vuelven a aguas someras. En este ascenso, se observa un comportamiento independiente de los juveniles. Asimismo, se ha observado una migración hacia profundidades de más de 25 m de forma previa a la generación de tormentas y antes de que se observaran cambios significativos en las condiciones de la mar. Asimismo, durante las fases de muda buscan protección normalmente en aguas más profundas (Templado et al., 2004). A menor escala, las langostas también realizan recorridos nocturnos relacionados con su alimentación, volviendo a sus refugios durante las horas de luz. Además, a lo largo de la vida de esta especie se produce un notable desplazamiento hacia cotas batimétricas más profundas, ya que el asentamiento de juveniles tiene lugar por encima de los 20 m, mientras que los adultos casi siempre se hallan a profundidades mayores de 40-50 m (Templado et al., 2004). Las primeras observaciones realizadas por Goñi et al. (2001) en las islas Columbretes determinaron cambios estacionales en la proporción de sexos y tamaño de los individuos en relación con patrones de migración estacional. Los juveniles son estrictamente nocturnos y muestran una marcada fidelidad por un único orificio o refugio, en el que permanecen inactivos durante las horas de luz. A los pocos meses realizan una rápida migración desde sus refugios superficiales de asentamiento hacia aguas más profundas, presumiblemente entre el invierno y la primavera (Templado et al., 2004). • Comportamiento social Según Mercer (1973), P. elephas es una especie típicamente gregaria. Los adultos habitan en grupos de hasta 10 individuos en oquedades someras, mientras que los juveniles de menos de 50 mm de LC los ocupan en profundidades de más de 20 m. Machos de más de 165 mm de LC viven solitarios en profundidades de más de 15 m (Hunter, 1999). 5. Resultados 73/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.2 MARCO JURÍDICO 5.2.1 De la pesca artesanal costera La pesca artesanal costera en el País Vasco se encuentra regida por reglamentaciones de distintito ámbito. De acuerdo con el sistema autonómico español, la competencia de ordenación pesquera de las aguas territoriales está compartida entre las administraciones del Estado Español y de las Comunidades Autónomas. Así, la Comunidad Autónoma del País Vasco tiene competencia en ordenación pesquera en las denominadas “aguas interiores”. Por fuera de esta zona, hasta las 12 millas del mar territorial (zona conocida como “aguas exteriores”) la competencia en materia de ordenación pesquera corresponde al Estado Español. Además, la legislación de la Unión Europea en materia de pesca es de rango superior a las anteriores y por lo tanto, la legislación estatal y la autonómica tienen que adecuar sus disposiciones a las de la normativa comunitaria. Hechas estas precisiones, se enumeran a continuación las disposiciones normativas más importantes que afectan al sector estudiado, incidiendo sólo en los aspectos considerados más relevantes desde el punto de vista de la práctica de la actividad de pesca. 5.2.1.1 Reglamentación de la Unión Europea • Reglamento 3760/92 del Consejo, de 20 de diciembre de 1992 por el que se fija como objetivo general de la Política Pesquera Común, la protección y organización de los recursos marinos y la organización, sobre una base sostenible, de la explotación racional y responsable de los mismos. Aspectos relevantes: El presente reglamento crea un marco reglamentario para el establecimiento de futuras políticas pesqueras, marcando su orientación y objetivos. • Reglamento (CE) Nº850/98 del Consejo de 30 de marzo de 1998 para la conservación de los recursos pesqueros a través de medidas técnicas de protección de los juveniles de organismos marinos. Aspectos relevantes: Se estipulan, entre otros, las dimensiones mínimas de algunas características de las artes, en particular la malla de las artes fijas, y su relación con las proporciones de especies objetivo retenidas a bordo. 5.2.1.2 Reglamentación del Estado Español 1. Artes fijas 5. Resultados 74/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco • Real Decreto 410/2001 de 20 de abril, por el que se regula la pesca con artes fijos en el Caladero Nacional del Cantábrico y Noroeste. Aspectos relevantes: Define las artes de pesca (de enmalle, aparejos de anzuelo y nasas) y limita sus dimensiones; especifica su modo de utilización; limita la actividad de pesca a cinco días a la semana (no se especifica cuáles); limita la potencia de los motores de las embarcaciones de “artes menores” a 250 CV y su eslora entre perpendiculares a 15 m; se limita la actividad al uso de un único arte o aparejo de pesca por día. Desde el punto de vista de la ordenación de la actividad de pesca artesanal, ésta es la reglamentación más relevante. • Orden de 26 de julio de 2001 por el que se establece un plan de pesca, con “redes costa”, en determinada zona del litoral Cantábrico. Aspectos relevantes: Especifica limitaciones a las características de ciertas artes de pesca y a su cantidad en aguas frente a Gipuzkoa y Bizkaia, así como a las profundidades máximas de calado de las artes de pesca en esta última provincia. 2. Artes móviles • Orden de 28 de junio de 1985 por el que se prohíbe la pesca de “arrastre de fondo” en la zona del Cantábrico central. Aspectos relevantes: prohíbe la pesca de arrastre durante todo el año frente a Bizkaia entre el meridiano de Cabo Villano (Plencia) y el de Punta Santa Catalina (Lekeitio) dentro de las 12 millas. • Real Decreto 1441/1999 de 10 de septiembre por el que se regula el ejercicio de la pesca con arrastre de fondo en el caladero nacional del Cantábrico y Noroeste. Aspectos relevantes: la pesca de arrastre de fondo solo podrá ejercerse en fondos superiores a 100 m. • Orden de 25 de julio de 2001 por el que se establecen determinadas vedas de arrastre de fondo en el caladero nacional del Cantábrico y Noroeste. Aspectos relevantes: Amplía la prohibición de pesca de arrastre frente a Gipuzkoa a un límite superior al de los 100 m en las zonas de Hondarribia, entre los meridianos 1º50,2´W (Cabo de Higuer) y 2º08,0´W (Orio), durante todo el año y en la zona de Guetaria, entre los meridianos 2º08,0´W (Orio) y 2º24,0´W (Punta Saturrarán), de 1 de septiembre al 31 de diciembre. 5. Resultados 75/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.2.1.3 Reglamentación de la CC.AA. del País Vasco Decreto 212/2000 de 24 de octubre, por el que se regula el ejercicio de la pesca con artes menores en el litoral de la Comunidad Autónoma del País Vasco. Recoge a grandes rasgos para las aguas interiores del País Vasco las limitaciones impuestas por el Real Decreto 1683/1997 anteriormente comentado, armonizando así las disposiciones de aguas interiores y exteriores. Entre sus aspectos relevantes cabe destacar los siguientes: o La longitud máxima total de las artes de nasas será de 3.000 m, no pudiendo exceder en ningún caso de un máximo de 350 nasas por embarcación. o Establece un plan de pesca para Gipuzkoa y Bizkaia con las zonas de pesca y las profundidades máximas de calamento. o Prohíbe el calamento de artes a una profundidad inferior a 5,46 brazas (10 m). 5.2.2 Del ejercicio de la pesca El Parlamento Vasco aprobó la Ley 6/1988, de 13 de marzo, de pesca marítima, que configura el marco legal y fija, entre otros, los objetivos y líneas directrices para el ejercicio de la actividad pesquera, dotando a ésta de la necesaria cohesión material y del marco legal adecuado para el desarrollo y práctica de la pesca marítima. Mediante el Decreto 304/1998, de 10 de noviembre, se aprobó el reglamento de pesca marítima recreativa, y se establecieron las normas por las que se regula el ejercicio de esta actividad, desarrollando los principios de la Ley 6/1998, de 13 de marzo, de pesca marítima. No obstante, la aplicación del mencionado Decreto originó la necesidad de adecuar el mismo a la realidad de la actividad pesquera, en atención a las nuevas coordenadas que dan forma al entorno pesquero, siendo conveniente introducir algunos cambios que se derivan de determinadas necesidades sobrevenidas con posterioridad a la entrada en vigor de la mencionada normativa. Actualmente existe una regulación -Anexo II del Decreto 198/2000, de 3 de octubre, por el que se aprueba el Reglamento de Pesca Marítima Recreativa y Anexo I del Decreto 102/1997, de 6 de mayo- que sujeta dicha actividad al respeto de unas épocas determinadas de recogida, de unas tallas mínimas de los ejemplares recogidos y, para el caso de los mariscadores deportivos, de un cupo de capturas diario para aquellas especies que les está permitido recoger (Tabla 23). 5. Resultados 76/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 23. Cuadro de vedas y tallas mínimas de las especies objeto de este estudio para el sector profesional y deportivo, de acuerdo con el Decreto 198/2000, de 3 de octubre, por el que se aprueba el Reglamento de Pesca Marítima Recreativa y el Anexo I del Decreto 102/1997, de 6 de mayo. Mariscadores Profesionales Especie Bogavante (Homarus gammarus) Centollo (Maja squinado) Langosta (Palinurus vulgaris) Nécora (Necora puber) Mariscadores Deportivos Veda Talla Mín. Veda Talla Min. 1 septiembre - 1 junio 87 mm Prohibida su recogida 1 julio – 1 enero 120 mm Prohibida su recogida 1 septiembre - 1 junio 95 mm Prohibida su recogida 1 mayo - 1 octubre 50 mm Prohibida su recogida Por lo que respecta a los mariscadores profesionales, éstos deberán respetar los periodos de veda establecidos en el Anexo I del Decreto 102/1997, de 6 de mayo. Dicho Decreto se encuentra derogado en la práctica totalidad de sus artículos, a excepción del mencionado Anexo. 5. Resultados 77/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.3 ESTADO DEL ARTE El objetivo del presente apartado es llevar a cabo una descripción general del estado del arte de la pesca artesanal costera enfocada a la captura de crustáceos decápodos mediante artes menores en el País Vasco. 5.3.1 La flota La flota artesanal costera del País Vasco, compuesta por 175 embarcaciones, se encuentra distribuida en dos provincias marítimas entre las que suman un total de 16 puertos (Tabla 24), 11 en la provincia de Bizkaia y 5 en la de Gipuzkoa. Tabla 24. Distribución de la flota artesanal costera en los diferentes puertos del País Vasco de Oeste a Este. Provincia Puerto Bizkaia Zierbena Santurtzi Portugalete Getxo Plentzia Lemoiz Bermeo Mundaka Elantxobe Lekeitio Ondarroa Subt. Bizkaia Gipuzkoa Mutriku Getaria Donostia Pasaia Hondarribia Subt. Gipuzkoa Total Número de barcos Total T.R.B3. puerto 5 6 1 1 12 5 66 4 2 13 7 122 2 15 16 9 11 48,1 59,5 4,0 10,0 63,3 39,5 3156,1 65,6 28,0 152,2 267,4 3893,7 55,5 138,0 231,0 141,5 568,2 53 1134,3 175 5028,0 % T.R.B. provincia % T.R.B. total 1,2 1,5 0,1 0,3 1,6 1,0 81,1 1,7 0,7 3,9 6,9 1,0 1,2 0,1 0,2 1,3 0,8 62,8 1,3 0,6 3,0 5,3 77,4 1,1 2,7 4,6 2,8 11,3 4,9 12,2 20,4 12,5 50,1 22,6 La provincia marítima de Bizkaia con 122 barcos y 3893,7 T.R.B. (77,4% del total) es la que cuenta con un mayor número de puertos (11), si bien la distribución de la flota en estos puertos es desigual. Son tres los puertos en Bizkaia que superan la 3 T.R.B: Toneladas de registro bruto 5. Resultados 78/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco decena de barcos, Bermeo (66), Lekeitio (13) y Plentzia (12). Atendiendo a las T.R.B. como característica que indica el porte de los barcos destaca nuevamente Bermeo (81,1 % de la provincia y 62,8% del total), a continuación se encuentra Ondarroa que con tan solo 7 barcos suma el 6,9% de T.R.B. de la provincia y 5,3 del total. El tercer lugar en cuanto a T.R.B. lo ocupa Lekeitio con el 3,9% de la provincia y el 3,0% del total seguido de lejos por el resto de puertos. La provincia marítima de Gipuzkoa con 53 barcos y 1134,3 T.R.B. (22,6% del total) cuenta con cinco puertos, en los que exceptuando Mutriku (2 barcos) la flota se encuentra bien representada en todos ellos. En esta provincia destaca el puerto de Hondarribia que si bien no cuenta con un número elevado de unidades (11 barcos) sobresale por el porte de las mismas con 568,2 T.R.B. (50,1% de la provincia y 11,3 del total). A continuación se encuentra Donostia con 16 barcos y 231,0 T.R.B. (20,4 de la provincia y 4,6 del total) seguido de cerca por Getaria con 15 barcos y 138,0 T.R.B. (12,2 de la provincia y 2,7 del total) y Pasaia con 9 barcos y 141,5 T.R.B. (12,5 de la provincia y 2,8 del total). La flota artesanal costera presenta una amplia variabilidad en cuanto a tipos de barcos, desde embarcaciones tipo “txipironera” de dimensiones reducidas y sin puente de mando, hasta barcos de grandes dimensiones (con esloras cercanas a los 30 m) y con los últimos adelantos tecnológicos en detección de cardúmenes de pescado, telecomunicaciones y navegación. Por otra parte, las características técnicas de las embarcaciones conjuntamente con el número de tripulantes (Tabla 25) determinan en gran medida las artes de pesca utilizadas a lo largo del año y consecuentemente la sucesión de oficios de pesca. Un barco de unas determinadas características técnicas con una tripulación dada, resultará más apropiado para faenar con un determinado arte, una vez haya sido convenientemente aparejado. Tabla 25. Características técnicas de la flota de pesca artesanal costera (175 barcos). Eslora pp (m) Tonelaje (TRB) Potencia (CV) Tripulación (hombres) Año construcción Promedio 13,5 28,7 177,0 3,6 1990 Desv. típica 5,2 26,9 134,5 1,7 9,8 Máx. 26,6 118,3 624,0 8 2003 Mín. 5,1 0,8 9,0 1 1965 5. Resultados 79/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.3.2 El Arte En el presente apartado se describen las características técnicas de las artes de pesca enfocadas a la captura de crustáceos decápodos, así como aquellas en las que la captura de estas especies se lleva a cabo de forma accidental o accesoria. 5.3.2.1 Artes fijos de enmalle: Trasmallo. Son artes de enmalle aquellas formadas por uno o más paños de red armados entre dos relingas, la superior provista de elementos de flotación y la inferior de lastres. Se calan en posición vertical formando un rectángulo entre la relinga inferior y la superior, disponiendo los extremos del arte, (llamados calones o cabeceros) de cabos guía unidos por su parte alta a boyas de superficie y por su parte baja a un sistema de fondeo con el fin de que permanezcan en la misma posición desde que se calan hasta que se levan. El trasmallo es un arte o aparejo de enmalle fijo al fondo, formado por tres paños de red superpuestos y fijados a la misma relinga, siendo los dos paños exteriores de igual malla y siempre de malla superior al paño interior (Figura 28). Dentro del nombre genérico de trasmallo tenemos dos tipos bien diferenciados. El trasmallo propiamente dicho o trasmallo de mallas pequeñas y el miño o trasmallo de mallas grandes. Estos dos tipos de trasmallos, se diferencian además de en el tamaño de las mallas, en la altura de los mismos. La altura máxima permitida del trasmallo dos metros y la del miño de tres metros. Las dimensiones de malla en el paño interior que varían entre 90 y 120 mm, siendo la más representada la malla de 100 mm. El tipo de hilo más utilizado para la construcción del paño es el mono-filamento de poliamida, si bien el multifilamento cableado de poliamida se sigue utilizando aunque en menor medida, dado que su utilización acarrea un mayor trabajo de limpieza de la red, sobre todo después de las mares de fondo, que favorecen el enganche de gran cantidad de algas en las redes. En los paños exteriores o tapas, al igual que en el interior predominan los monofilamentos de poliamida de dimensiones de malla comprendidas entre 500 y 600 mm siendo mayoritarios los de 550 mm. Las mallas de altura para el paño interior oscilan entre 33 y 60 mallas, siendo 35 el número de mallas más frecuente, mientras que los paños exteriores presentan una menor variabilidad, entre 4 y 5 mallas de altura con una mayor representación de los paños con 4,5 mallas de altura. 5. Resultados 80/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 28. Ficha técnica de trasmallo. Abreviaturas: P: paño exterior; p: paño interior; PA: poliamida, PE: polietileno; PB: plomo; mono.: monofilamento; multif.: multifilamento; F: flotabilidad; cabl: cableado. Actualizado de Puente (1993). 5. Resultados 81/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Los coeficientes de colgadura, tanto para el paño interior como para los exteriores, son muy próximos a 0,50. Las relingas utilizadas para este tipo de redes de enmalle son muy similares a las utilizadas para las mallabakarras. La flotabilidad observada para este arte se sitúa en una cifra cercana a 2,4 kgf/100 m. El lastre del que están dotadas estas redes es similar al de las redes de un único paño. Su altura es ligeramente superior a 2 metros, la cual viene delimitada por los paños exteriores, que siempre son de menor altura que el paño interior. Debido a la diferente altura que presentan ambos paños, en este tipo de redes el paño exterior queda tenso, mientras que el paño interior queda holgado entre las grandes mallas exteriores; ésta es la razón por la cual el trasmallo realiza la mayor parte de sus capturas por embolsamiento y enganchado4. 5.3.2.2 Arte de pesca a Nasa Las nasas son artes fijos de fondo compuestas por un armazón rígido de madera o metal en forma de cesto o jaula y recubierto de red. Están provistas de una o más aberturas o bocas de extremos lisos no punzantes que permiten la entrada de las distintas especies al interior del habitáculo que forma el arte, atraídas por el cebo colocado en su interior. En los muestreos realizados se identificaron tres tipos diferentes de nasas (Tabla 26) en función de la especie o grupos de especies que se pretenden capturar. Las cuatro principales especies objetivo de las nasas son el quisquillón, la nécora, el pulpo y la langosta. Cada una de estas especies se captura mayoritariamente en unos determinados fondos, con unas características en cuanto a profundidad y textura del fondo que junto con el tamaño de la especie objetivo determinarán buena parte del oficio de pesca. Así, el quisquillón se captura en fondos de consistencia blanda, generalmente fango, y en profundidades inferiores a 12 brazas. El pulpo y la nécora son capturados en fondos rocosos con profundidades inferiores a 20 brazas. La langosta se captura en fondos duros y profundidades comprendidas entre 20 y 70 brazas. 4 Los modos de captura de las redes de enmalle son cuatro: 1. Enmallado, el pez es retenido por una malla que se le ciñe al cuerpo. 2. Embranquiado, al pasar la cabeza por la malla, el pez queda bloqueado en ella con la malla ceñida a nivel de los opérculos. 3. Enganchado, el pez no atraviesa la malla pero es retenido por el paño de red al engancharse en el hilo con los dientes, maxilares u otras protuberancias del animal. 4. Embolsado, el pez pasa entre las mallas del primer paño, choca contra el segundo y lo arrastra atravesando el tercero, con lo que se forma una bolsa donde el animal queda atrapado (únicamente se da en las redes de tres paños). 5. Resultados 82/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tabla 26. Principales características de las nasas muestreadas. Abreviaturas y unidades de medida: Mat.: material; Diam.: grosor del cabo (mm); Int.: intervalo entre punteras (m); L.P.: longitud de puntera (m); L.N.: longitud de la nasa (cm); Anch.: anchura de la nasa (cm); Alt.: altura de la nasa (cm); Diam. Boca: diámetro de la boca de la nasa (cm); PE: polietileno. Línea madre Puntera Nasa Alt. Diam. Interior Mat. Diam Int. Mat. Diam. L.P. L.N. Anch. Exterior PE PE PE PE PE 10 8 8 8 8 13,5 10,8 10,8 7,2 3,6 PE PE PA PE PE 10 6 4 6 4 6,3 3,6 1,8 2,5 2,7 50 40 35 35 35 35 25 30 25 25 40 20 30 25 22 15 15 15 5 10 12 12 5 5 Pulpo y Nécora PE PE PE PE PE PE PE 10 7 8 10 10 10 10 12,6 10 12,6 8,1 5,4 16,2 10,8 PE PE PE PE PE PE PE 6 7 6 7 7 10 6 5,4 5,4 2,5 1,8 1,8 4,5 7,2 50 50 40 40 40 38 35 37 35 28 30 30 30 25 33 35 28 25 25 25 22 12 12 10 10 10 11 10 12 10 10 10 10 11 10 Langosta PE PE PE PE 8 12 10 7 39,6 48,6 39,6 30,0 PE PE PE PE 6 10 8 7 12,6 21,6 14,4 14,4 75 75 70 70 45 45 40 50 45 45 40 50 24 24 24 22 30 20 Quisquillón Boca Las líneas madre observadas, que unen las diferentes unidades de nasas, observadas son todas ellas de cabo de polietileno trenzado de diámetro comprendido entre 7 y 12 mm, con un diámetro menor en la utilizada para el quisquillón y más gruesa en la utilizada para la langosta. Estas diferencias se deben principalmente a la mayor profundidad y dureza del fondo en que se captura la langosta. El intervalo de separación entre nasas también varía en función de la especie objetivo, siendo mayor en el caso de las nasas a langosta. Las punteras o cabos que unen la nasa a la línea madre son del mismo material que ésta y de diámetro algo menor. La razón por la cual las punteras son de un diámetro menor es que en fondos duros son frecuentes los enganches del arte con el fondo, por lo que si se tira hacia arriba de la madre la puntera se cortará con mayor facilidad que el cabo madre y así no se perderá más que una sola nasa, recuperando el resto del aparejo. La longitud de la puntera también varía en función de la especie objetivo, siendo más cortas las punteras de las nasas a quisquillón, algo más largas las punteras de nasas a pulpo y a nécora, mientras que las punteras de nasas a langosta son las que tienen mayor longitud. 5. Resultados 83/143 © AZTI Tecnalia 2007 22 22 Crustáceos decápodos en el País Vasco En cuanto a las nasas en sí, la primera diferencia reseñable es el material con el que se confecciona el armazón, dado que las nasas de langosta (Figura 29) son todas de armazón de madera, mientras que el resto de las nasas (Figura 30) son de metal ó de material plástico; la malla de recubrimiento del armazón puede ser de materiales diferentes, como paño de red o malla plástica rígida, siempre de una abertura apropiada para retener en su interior a la especie objetivo. La forma de la nasa puede ser variada, predominando las nasas cilíndricas para la langosta y las de forma de paralelepípedo para el resto de las especies objetivo (Figura 31). Otra característica fundamental de la nasa es el diámetro de la boca o abertura por la que entra la especie objetivo al interior de la nasa; dicha boca está formada por un tubo de material plástico y forma cilíndrica o troncocónica con el orificio más estrecho hacia el interior del habitáculo, cuyo orificio debe ser de un diámetro apropiado para permitir la entrada de la especie a capturar; por ello, las diferentes nasas observadas se han agrupado en función del diámetro del mismo, el cual determina en gran medida la especie objetivo, ya que básicamente las formas de las nasas son iguales (Figura 31). Uno de los laterales de la nasa suele estar preparado para ser abierto y poder así extraer del interior la captura y colocar la carnada en una posición idónea para que solo se pueda acceder a ella entrando al interior de la nasa (Figura 31). El cebo es el elemento que atrae a la captura hasta el interior de la nasa; generalmente se utilizan como cebo trozos de chicharro negro y/ó verdel (especies de bajo precio y fáciles de conseguir en el mercado durante prácticamente todo el año). 5.3.2.3 Modo de empleo de las artes de pesca Las maniobras de largado y virado de los artes de pesca, son muy similares para todos aquellos artes fijos empleados en el País Vasco (artes de enmalle, palangres y nasas). Para la operación de virado, hoy en día está totalmente extendida la utilización del halador hidráulico, utilizándose un modelo de halador para artes de enmalle por un lado y nasas y palangres por otro. • Nasa La maniobra de calado de las nasas comienza con la introducción de la carnada en el interior de las mismas de una en una, mientras se van estibando en la cubierta del barco ya anudadas, mediante la puntera, al cabo madre. Una vez están todas las nasas ordenadas y listas para ser caladas, se larga la baliza (Figura 32) y el calamento con el fondeo; en cuanto éste toca fondo se pone el barco en marcha y se van echando al agua las nasas de una en una a la vez que se va sujetando el cabo madre para que éste no salga enredado y se alargue lo suficiente como para que las nasas se mantengan a la distancia deseada (Figura 32). 5. Resultados 84/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 29. Ficha técnica de nasa de langosta. Abreviaturas: PE: polietileno; WD: eucalipto; mono.: monofilamento; multif.: multifilamento; cabl.: cableado. Actualizado de Puente (1993). 5. Resultados 85/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 30. Ficha técnica de nasa de nécora – pulpo. Abreviaturas: PE: polietileno; Fe: hierro; mon: monofilamento; multif.: multifilamento; cabl.: cableado. Actualizado de Puente (1993). 5. Resultados 86/143 © AZTI Tecnalia 2007 C) Figura 31. Diferentes tipos de nasas: (A) nasa de nécora; (B) nasa de langosta con estructura de madera de eucalipto; (C) nasa de quisquillón: detalle de dos modelos de boca diferentes. A) B) d) b) c) e) Figura 32. Modo de empleo del arte de pesca a nasas: a) primera baliza en el agua con el barco acercándose en virada; b) nasas saliendo por la popa; c) halador virando las nasas; d) nasa con pesca saliendo del agua; e) nasas estibadas en cubierta. a) Crustáceos decápodos en el País Vasco Finalizando el largado se reduce la velocidad para que cuando se haya largado la última nasa se pueda estirar el cabo madre y posteriormente echar al agua el fondeo. El cabo de fondeo saldrá de la embarcación y finalmente se largará la baliza. La virada comienza con el embarcado de la baliza y virado del cabo de fondeo ayudándose del halador hasta que emerge el fondeo y se iza a bordo (Figura 32). Éste se desanuda del cabo madre el cual se va estibando en cubierta; según van virando las nasas, se abren de una en una extrayendo de su interior la captura y los restos de cebo; se continúa con esta operación hasta que llega finalmente el segundo fondeo, que se iza a bordo y se vira el calamento hasta la baliza final (Figura 32). • Artes fijos de enmalle En los artes fijos de enmalle la maniobra comienza con el largado en marcha de la baliza (Figura 33) y filado del calamento o cabo que une ésta al fondeo; cuando todo el calamento ha salido por la popa del barco se procede a largar la piedra o rezón, utilizado como fondeo, momento en el cual las redes que están amarradas a él comienzan a salir por la popa del barco (Figura 33). Debido a la marcha del barco las redes continúan saliendo por la popa hasta que llega la última red, el barco reduce su marcha y en cuanto el último tramo de red sale por la popa se larga el segundo fondeo que, con su peso, hace salir al cabo que lo une con la baliza. Para la operación de virado se utiliza el halador hidráulico. Para ello, una vez que se ha embarcado la baliza (Figura 33), el cabo de fondeo se pasa por el halador dándole varias vueltas alrededor del “tambor”, tirando del cabo. En cuanto el fondeo ha llegado a la superficie se quitan las vueltas de cabo del tambor y se embarca el fondeo; entonces se desanuda el cabo que lo une con las redes. Éstas entran a bordo mediante un carro (Figura 33) que facilita su acceso al “tambor” o halador (Figura 33) donde se le dan varias vueltas que facilitan el izado de la red tirando de ella y estibándola posteriormente en la proa del barco. Entre tanto los marineros van despescando la captura hasta que llega el fondeo repitiendo esta vez a la inversa la anterior operación con él. Una vez tenemos todas las redes en la proa, se pasa un extremo por un tubo de material plástico ayudándose de un cabo fino hasta que llega a la popa (Figura 33), allí se estiba el arte dejando en una de las bandas del barco la relinga de corchos y en la otra la de plomos, maniobra denominada como planeo de la red, quedando así desplegada y limpia en las cajonadas (Figura 33), lista para ser nuevamente largada. 5.3.2.4 Oficios de pesca Una vez descritos los diferentes artes de pesca, se definen a continuación los oficios identificados en la flota estudiada. El término oficio de pesca es muy utilizado entre los arrantzales y viene dado por una combinación del arte de pesca, especie objetivo, época y lugar o caladero de pesca. 5. Resultados 89/143 © AZTI Tecnalia 2007 f) e) i) j) g) c) h) d) Figura 33. Modo de empleo de las artes de pesca fijos de enmalle: a) Barco de enmalle con cajonadas; b) Largado de la baliza; c) Redes saliendo por la popa; d) Largado de la baliza; e) Primera baliza en el agua con el barco acercándose para comenzar a virar; f) Carro por el que entra la red a bordo; g) Tambor de halador virando la red con capturas; h) Red entrando por el tubo; i) Despescando y limpiando la red; j) Planeo de la red a las cajonadas. b) a) Crustáceos decápodos en el País Vasco De acuerdo con Arregi et al. (2004), en el País Vasco existen un total de dieciséis oficios significativos, seis de ellos de enmalle (dos de beta y cuatro de miño), tres de nasa, cuatro de palangre, uno de líneas de mano, uno de curricán y uno de rastro dirigido a algas. A continuación se describen aquellos enfocados a la captura de crustáceos decápodos. • Oficios de miño De acuerdo con Arregi et al. (2004), el miño es un arte de pesca polivalente, que captura un amplio número de especies de interés para la flota artesanal costera como consecuencia de que pueden darse diferentes modos de captura en este arte (enganchado, enmallado y embolsado). Los barcos que a lo largo del año trabajan a oficios de miño son 59 (tercer arte en orden de importancia), buena parte de los cuales alternan estos oficios con los de beta. Si bien dada la polivalencia específica de este arte se puede decir que en muchos casos se utiliza sin tener definida claramente una especie objetivo, se han identificado cuatro oficios de miño. Entre los oficios identificados se encuentran el miño dirigido a cabracho (Scorpaena spp.), a lenguado (Solea vulgaris), a langosta (Palinurus elephas) y a rapes (Lophius spp.). El oficio de miño dirigido a langosta se practica en fondos de piedra, con profundidades comprendidas entre 36 y 85 metros. El tiempo en el que el aparejo permanece calado es de 48 a 72 horas, en algunos casos llegando a permanecer incluso 96 horas. Este largo periodo de tiempo que el parejo permanece calado provoca la descomposición de los peces capturados cuyo olor atrae a las langostas y otros organismos carroñeros, principal razón del largo periodo en el que el aparejo permanece calado. La época en la que se practica este oficio va de abril a septiembre. Las principales especies acompañantes de la langosta son el buey (Cancer pagurus) y las rayas (Rajidae spp.). • Oficios de nasa Se identificaron un total de tres oficios de nasa, la nasa dirigida a langosta, la nasa a quisquilla (Crangon crangon y Palaemon spp.) y la nasa a pulpo/nécora (Octopus vulgaris/Necora puber); si bien los dos primeros oficios tienen una especie objetivo clara, el último tiene dos especies objetivo aunque con un pequeño cambio en la operativa de pesca se puede dirigir la captura a la especie deseada. Son 30 los barcos que en algún momento del año practican alguno de los oficios de nasa previamente citados, en buena parte de los casos alternándolos con oficios de palangre. El oficio de nasa dirigida a langosta es un oficio en retroceso en la actualidad debido a la escasez de capturas de la especie objetivo. Este oficio se practica en fondos duros, generalmente de piedra con profundidades comprendidas entre 36 y 5. Resultados 91/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 108 metros de profundidad. El tiempo que el arte de pesca permanece calado varía entre 24 y 48 horas en función del volumen de las capturas; cuando son buenas se vira a diario y en caso contrario se deja el aparejo un día más en la mar. La época de pesca coincide con los meses de verano (junio, julio y agosto) y además de esta especie se captura como especie accesoria principal el bogavante (Homarus gammarus). El oficio de nasa dirigida a pulpo/nécora se caracteriza por ser dos de las especies objetivo en este oficio, aunque con la particularidad de que el pulpo se captura en mayor medida durante el día y la nécora durante la noche. Este hecho abre la posibilidad a que la misma nasa calada en el mismo lugar puede ser objeto de dos viradas, una de ellas al caer el sol y la segunda al amanecer, pudiendo ser la composición de las capturas completamente diferente, capturando por la tarde pulpo y por la mañana nécora. Este oficio se da en fondos de piedra con profundidades que varían entre 3 y 36 metros, siendo el tiempo habitual de calado del aparejo de entre aproximadamente 10 y 24 horas. Con 10 horas es posible realizar la operativa anteriormente descrita (2 viradas); mientras que cuando el aparejo permanece durante 24 horas calado las viradas se realizan por la mañana y poco después del alba y la captura puede ser mixta (pulpo y nécora), en cuyo caso la nécora suele encontrarse deteriorada por la disputa del cebo con el pulpo. La época en la que se practica este oficio coincide con la del oficio de nasa a quisquilla, es decir, de octubre a febrero. Las principales especies asociadas capturadas en este oficio son el congrio y la quisquilla. 5.3.3 Tipologías de actividad de la flota artesanal costera Una vez descritas las artes de pesca de la flota artesanal costera y el modo de empleo de cada una de ellas y caracterizados los oficios practicados, es posible obtener grupos de barcos que presentan similitud en la sucesión de oficios de pesca ejercidos a lo largo de un año. De los 165 barcos con una actividad anual definida, la práctica totalidad (160 barcos) presenta una clara similitud con alguna de las seis tipologías siguientes: • Naseros • Palangreros pequeños • Palangreros grandes • Rederos pequeños • Rederos grandes • Atuneros pequeños Teniendo en cuenta las características de los barcos ya agrupados por tipologías, se observa que la tipología con mayor número de unidades es la de los atuneros pequeños (65 barcos) que componen el 37,1% de la flota artesanal costera. Del mismo modo esta tipología es la de mayor tonelaje total (3635 TRB; 73,0% del total) 5. Resultados 92/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco y potencia total (19861 CV; 65,1% del total). La segunda tipología en orden de importancia es la de los rederos grandes (31 barcos) 17,7% del total de la flota objeto del estudio, con un tonelaje total de 617 TRB (12,4% del total) y una potencia total de 4549 CV (14,9 % del total). La siguiente tipología en número de unidades es la de los rederos pequeños (28 barcos) que agrupan el 16% de la flota, sumando un tonelaje total de 233 TRB (4,7% del total) y una potencia de 2155 CV (7,1% del total). Los palangreros pequeños ocupan el cuarto lugar en número de unidades de esta flota (25 barcos), siendo el 14,3% del total, si bien tanto su tonelaje total (181 TRB; 3,6% del total ) como la potencia total (1555 CV; 5,1% del total) son inferiores a los de los grandes palangreros (5 barcos), que tan solo suponen el 2,9% de la flota aunque aglutinan un tonelaje total de 244 TRB (4,9% del total) y una potencia total de 1731 CV (5,7% del total). Los naseros, a pesar de ocupar el quinto lugar en número de barcos (11 barcos; 6,3% del total), son los que suponen un menor tonelaje (68 TRB; 1,4% del total) y potencia (671 CV; 2,2% del total), debido a que son, como norma general los barcos de menor porte de la flota. La tipología de los “naseros” (Tabla 27) está compuesta por barcos de pequeño porte con tripulación media de 2 hombres. Como su nombre indica, su actividad está ampliamente dominada por la modalidad de pesca con nasas, mientras que el resto de artes de pesca se utilizan de modo marginal (principalmente betas, palangre de superficie y de fondo, así como líneas de mano). El grueso de sus desembarcos en peso está repartido entre el verdel, el alga roja y el pulpo. Tabla 27. Características técnicas de la tipología naseros (11 barcos). Eslora pp (m) Tonelaje (TRB) Potencia (CV) Tripulación (hombres) Año construcción Promedio 8,6 6,2 61 1,8 1993,8 Desv. típica 2,2 6,3 61,3 1,3 10,2 Máx. 13,6 24,0 230,0 5 2002 Mín. 6,0 1,9 12,0 1 1970 5. Resultados 93/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 5.3.4 Caladeros No existen como tales, pero se considera que toda la costa es susceptible de ser sometida a explotación. Así, la pesca con nasas de nécora es la más litoral de todas las modalidades de pesca consideradas. Durante la época en que está permitida la captura de nécora (1 de octubre a 30 de abril) las nasas son largadas en fondos rocosos de profundidad inferior a 10-20 brazas (18-36 m), siendo generalmente las capturas tanto mayores cuanto menor es la profundidad. La profundidad de uso de las nasas ha sido limitada con posterioridad al año 1999, quedando su límite inferior en 5,46 brazas (10 m) según el Decreto 212/2000, de 24 de enero, que regula la pesca con artes menores en el litoral de competencia de la comunidad Autónoma del País Vaco. Borja (1987) definió en 1987 las principales zonas de pesca de la nécora en el País Vasco (Figura 34 a 36). De acuerdo con el mencionado autor, parecen especialmente ricos los lugares batidos con poca profundidad, como por ejemplo entre Zumaia y Deba (Figura 34), incluso hacia Ondarroa (Figura 35) y los bajos alrededor de la isla de Izaro (Figura 36). A pesar de ello, el lugar donde más se pesca es el Abra de Bilbao, en el dique sumergido de Punta Galea y, desde aquí, paralelo a la Galea, hasta la restinga de Algorta (Borja, 1987) (Figura 36). Actualmente, en comparación con la situación descrita por Borja (1987), se estima que la ampliación del puerto exterior de Bilbao, junto con los dragados de mantenimiento derivados del mismo, han podido reducir el área de distribución de la especie en esta zona. Cuando se emplean para la captura de langosta y bogavante (entre el 1 de junio y el 31 de agosto), las nasas se largan en fondos de roca de mayor profundidad, generalmente entre 20 y 60 brazas (36 y 108 m). 5.3.5 Capturas La principal característica de la pesquería de crustáceos decápodos (nécora, langosta, bogavante y centollo) mediante artes menores en el País Vasco es la ausencia de un registro de las capturas debido a que éstas no siguen el circuito de venta en las cofradías estando muy probablemente subestimadas (Borja, 1987; Puente, 1993,2002; Arregi et al., 2004). La ausencia de datos fiables por parte de las cofradías dificulta el estudio sistemático de las capturas de modo que no es posible estudiar su evolución y tendencia a lo largo de los años, lo cual supone una clara dificultad para su posterior gestión (Borja, 1987; Hunter, 1999; Freire et al., 2002b) 5. Resultados 94/143 © AZTI Tecnalia 2007 Figura 34. Principales zonas de pesca de la nécora entre Zarauz y Hondarribia según Borja (1987). Figura 35. Principales zonas de pesca de la nécora entre Getaria y Ea según Borja (1987). Figura 36. Principales zonas de pesca de la nécora entre Elantxobe y el Abra de Bilbao según Borja (1987). Crustáceos decápodos en el País Vasco 6. DISCUSIÓN La actividad pesquera tiene la capacidad potencial de alterar e incluso destruir los hábitats y comunidades del bentos bien por eliminación directa o la inducción de cambios en su estructura (Dayton et al., 1995; Turner et al., 1999; Link, 2002; 2007). De acuerdo con Freire et al. (2002b), la crisis pesquera global constatada en las últimas décadas, debida a la sobre-explotación de un gran número de stocks ha estado motivada principalmente por las limitaciones del conocimiento científico, incertidumbres en las evaluaciones y/o fallos de los sistemas de gestión. Estos problemas son críticos cuando se trata de la gestión de ecosistemas costeros y de pesquerías artesanales, que presentan una gran complejidad debida al elevado número de factores humanos que influencian su funcionamiento (relacionados directamente con la explotación de recursos, pero también con otro tipo de actividades que originan alteraciones de hábitats), y con el elevado número de componentes involucrados en la actividad pesquera (multiespecífica y multiarte, con una flota diversa que presenta una complejo patrón de actividad en el espacio y en el tiempo) (Freire y García-Allut, 2000; Freire et al., 2002b). Adicionalmente, un gran número de stocks explotados por las pesquerías artesanales costeras son invertebrados con una estructura espacial fuerte y persistente y una dinámica poblacional que no se ajusta a los modelos clásicos desarrollados para poblaciones de peces explotados por flotas industriales, que no permiten, en general, una gestión eficiente y sostenible de estos recursos (Freire et al., 2002b). Las pesquerías costeras a pequeña escala presentan una importancia social mucho mayor que las pesquerías industriales, a pesar del mayor valor económico de estas últimas (Freire et al., 2002b). Numerosas especies de invertebrados, principalmente organismos bentónicos costeros con un elevado valor unitario y sometidos a explotación por flotas artesanales, tales como los crustáceos decápodos, han sido sobre-explotados, y, en algunas instancias, han alcanzado un estado de colapso (Freire, 2005). Aunque el volumen desembarcado es pequeño en comparación con el de peces pelágicos (Browne et al., 2001), las pesquerías de crustáceos son globalmente importantes debido a su alto valor económico (Smith y Addison, 2003). Así, entre otros países, Noruega, Suecia y Dinamarca muestran un claro declive en las capturas de bogavante (Homarus gammarus) a lo largo del siglo pasado (Figura 37). En el mediterráneo, el declive de esta especie ha sido igual de catastrófico en Italia, la antigua Yugoslavia y especialmente en Turkia (Browne et al., 2001). En el caso particular del País Vasco, debido a la ausencia de un registro de las capturas, al no seguir el circuito de venta en las cofradías (Borja, 1987), estando muy probablemente subestimadas (Puente, 2002), se desconoce la evolución de la pesquería de especies como la nécora, el bogavante, la langosta o el centollo. 6. Discusión 99/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Figura 37. Capturas de bogavante (H. gammarus) en Noruega, Suceia y Dinamarca entre 1930 y 1996. Tomado de Browne et al. (2001). Sin embargo, existen indicios que podrían indicar un declive de las pesquerías anteriormente citadas. Entre otros, cabría mencionar el número de embarcaciones dedicadas a la pesca de estas especies mediante artes de nasa. Mientras en 1987 éste se cifraba en torno a las 23 (Borja, 1987), en 2003 se reduce aproximadamente a 10 (Arregi et al., 2002) y en 2006-2007 a 3, aunque ocasionalmente pueden ser más. Tabla 28. Número de barcos dedicados a la pesca de la nécora en la Costa Vasca mediante artes de nasa. Nº Barcos Puerto Hondarribia Pasajes San Sebastián Guetaria Mundaca Bermeo Arminza Plentzia Santurce Ciérvana TOTAL 5 Borja (1987)5 Arregi et al. (2002) --0 4 3 4 0 4 --5 3 23 1 --1 3 ----1 4 ----10 Este trabajo 0 0 1 0 0 1 0 1 3 Número de embarcaciones dedicadas a nécora. 6. Discusión 100/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Asimismo, es de destacar que la CPUE obtenida por Borja (1987) para las capturas de nécora en Zierbana fue de aproximadamente 50 kg/100 nasas en octubre, mientras que en la actualidad dicho esfuerzo se ha reducido hasta los 13,73 kg durante el mismo mes (ver apartado 5.1.3.11), lo cual indicaría una menor disponibilidad del recurso en la actualidad. Como consecuencia de ello, el número de barcos habituales para la pesca de nécora en Zierbana se ha reducido de 5 en 1987 a un único barco en la actualidad. Según Freire et al. (2002b), la evaluación de las pesquerías artesanales se ha basado tradicionalmente en modelos clásicos de dinámica de poblaciones de peces desarrollados de acuerdo con el trabajo de Beverton y Holt (1957). Así, el citado autor indica que estos modelos (ver Hilborn & Walters (1992) o Perry et al. (1999) para una revisión) son apropiados para recursos pelágicos o demersales altamente móviles (de acuerdo con la clasificación de Orensanz & Jamieson (1998)) y para la gestión de pesquerías industriales a gran escala. Sin embargo, según Freire et al. (2002b), en coincidencia con lo trabajos desarrollados por Caddy (1999) y Perry et al. (1999), desde un punto de vista biológico, las especies explotadas por las flotas artesanales costeras españolas, presentan un número de características que hacen que los modelos anteriores no sean adecuados para la comprensión de su dinámica poblacional. Estas especies, bentónicas sedentarias o móviles bentónicas/demersales, presentan una estructura espacial fuerte y persistente (en el sentido de Orensanz & Jamieson (1998)) y se caracterizan por las siguientes características, enumeradas por Freire et al. (2002b): 1. Ciclos vitales complejos (fases larvarias planctónicas y postlarvarias demersales o bentónicas sedentarias o de baja movilidad) (Roughgarden et al., 1988). 2. Una distribución espacial caracterizada por la existencia de agregaciones evidentes a diferentes escalas (Orensanz et al., 1998; Prince y Hilborn, 1998). 3. Una estructura poblacional que podría ser definida como “metapoblaciones meroplanctónicas” en que las fases postlarvarias constituyen una cadena de poblaciones locales a lo largo de la costa con bajas tasas de dispersión o migración e interconectadas por las fases larvarias planctónicas (Botsford, 1995; Botsford et al., 1994; 1998; Smith y Addison, 2003). Este aspecto determina un desacoplamiento entre los stocks locales y el reclutamiento subsiguiente en la misma población local. 4. La relación agregada stock-reclutamiento (debida a procesos densodependientes, que constituyen el aspecto central de la regulación poblacional en los modelos clásicos) no es aplicable a un segmento de la metapoblación (Orensanz y Jamieson, 1998). La relación stock6. Discusión 101/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco reclutamiento no se detecta en general aunque se emplee la escala adecuada (Hilborn, 1986) o sólo se hace evidente cuando los stocks se encuentran en niveles muy bajos. Los procesos de transporte físicos de larvas a hábitats apropiados para el asentamiento ha sido definido recientemente como el proceso (independiente de la densidad) clave en el reclutamiento de los invertebrados (Botsford et al., 1994; Wing et al., 1998). Para especies de peces pelágicos o demersales explotadas por flotas industriales, la escala espacial de explotación es con frecuencia similar a la escala espacial del stock (una flota homogénea explota la mayoría o toda el área de distribución), mientras que en el caso de las pesquerías artesanales costeras la flota es heterogénea y cada sector (definido desde un punto de vista geográfico o por el aparejo empleado) explota segmentos específicos de la metapoblación, por lo que la escala espacial de la metapoblación y de la flota (que normalmente se corresponde con el de poblaciones locales) no coinciden (Freire, 2005). Por lo tanto, la gestión debe tener en cuenta la heterogeneidad espacial existente (Freire, 2005). Otro problema de los sistemas de gestión basados en los modelos clásicos se sitúa en el hecho de que se han centrado en la regulación del esfuerzo pesquero, que ha sido considerado como el único impacto humano relevante en el sistema (Freire et al., 2002b). En ecosistemas costeros, por contra, existen un número de actividades que originan alteraciones o destrucción de hábitats clave, que pueden tener un mayor efecto en la abundancia poblacional que la mortalidad por pesca (Freire et al., 2002b). Un segundo punto fundamental sobre el que según Borja (1987) debe sustentarse una regulación eficaz reside en la talla mínima legal de captura. Así, según Bennet (1980) una gestión basada únicamente en la talla mínima se ha caracterizado por su ineficacia. El fracaso en la gestión de una pesquería puede dar lugar a efectos desastrosos a nivel social y económico (Maunder et al., 2006). Las razones de tal fracaso pueden atribuirse a diversos factores, tales como una información científica errónea, la toma de decisiones de gestión inadecuadas o la incapacidad de los responsables de la gestión para actuar. Así, según Maunder et al. (2006) parte del éxito de la gestión reside en una buena información de los responsables de la gestión de las pesquerías. Por tanto, es de vital importancia que la comunidad científica lleve a cabo una correcta información a los responsables de la gestión, usuarios y la sociedad en general, así como incluir una estimación del grado de incertidumbre en la información proporcionada con el fin de que se tenga en cuenta en la toma de decisiones (Maunder et al., 2006). Así, uno de los éxitos en el análisis del stock de un recurso es que la asesoría de la gestión se base en datos científicos del mismo. Los objetivos de dicha gestión 6. Discusión 102/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco pueden ser múltiples, tales como la conservación, u otros objetivos de tipo político, social y económico (Maunder et al., 2006). Según Borja (1987), en el establecimiento de una ordenación pesquera confluyen múltiples intereses que, debidamente contrastados, deben reunirse para una eficaz gestión del recurso: (i) por un lado están los intereses biológicos, que pueden ir dirigidos desde una mera conservación de la especie, hasta la gestión biológica que permita un máximo beneficio, en términos de producción, durante el máximo tiempo posible. En otras palabras, el objetivo más habitual consiste en maximizar el rendimiento de una pesquería (Maunder et al., 2006) de una forma sostenible, es decir, la mejor medida de gestión sería aquella que maximiza el rendimiento de la pesquería sin que el stock sufra una merma significativa que impida su recuperación y sostenimiento a lo largo del tiempo como consecuencia de su explotación (Bald et al., 2006). (ii) Por otro lado se encontrarían los intereses del pescador, que lógicamente deben ir encaminados hacia la obtención del máximo beneficio económico al menor coste. (iii) Por último se encuentran los intereses del legislador que debe procurar armonizar ambos conceptos y cualesquiera otros que concurran en el hecho en si. Por tanto, se hace necesario perfilar o explorar el desarrollo de un nuevo marco de gestión que permita aunar todos los intereses anteriormente indicados consiguiendo una explotación sostenible del recurso. Uno de los objetivos fundamentales de una ordenación pesquera es conseguir un óptimo aprovechamiento y reparto de los recursos existentes, que sea acorde con la conservación de estos y permita la convivencia con rendimientos aceptables del máximo número posible de pescadores (Puente, 1993). Según Puente (1993), la ordenación de la actividad pesquera puede enfocarse desde dos puntos de vista complementarios: 1. Medidas basadas en criterios biológicos para asegurar una correcta explotación de las poblaciones, con vistas a conseguir un máximo rendimiento sostenible. 2. Medidas encaminadas a un ordenamiento de la actividad pesquera que trate de, entre otros aspectos, evitar posibles interacciones negativas entre modalidades de pesca, regular el esfuerzo pesquero, definir zonas de pesca, etc. 6. Discusión 103/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 6.1 Medidas basadas en criterios biológicos El objetivo general debería ser el mantenimiento de las poblaciones en un buen estado incluso bajo unas condiciones medioambientales que pueden dar lugar a grandes fluctuaciones naturales en las mismas. Para que una pesquería sea capaz de superar dichas fluctuaciones necesita de un buen reclutamiento y una biomasa suficiente como para mantener los niveles de captura cuando el reclutamiento sea bajo. Aplicado a nuestros recursos de crustáceos decápodos en la costa del País Vasco, las medidas de conservación a aplicar deben asegurar una buena producción de huevos, una mortalidad por pesca razonable y una biomasa constituida por diferentes clases de talla. 6.1.1 Revisión de las épocas de veda y tallas mínimas de captura El tamaño del individuo al inicio de la madurez sexual es un parámetro clave en el ciclo de vida de los crustáceos y es comúnmente empleado para establecer la talla mínima de captura en la gestión de algunas pesquerías como la de la nécora en Galicia (González-Gurriarán y Freire, 1994b). Según Bennet (1980), lo lógico es establecer una talla mínima legal de captura por encima de la talla de primera maduración del individuo, para así asegurar la presencia de hembras y machos maduros en el stock. En relación con las épocas de veda, el objetivo se centra en limitarlas de forma que la época de captura no afecte a fases del ciclo vital que son importantes para la pervivencia de la especie. A la luz de la información biológica recabada sobre las especies sujeto del presente estudio, cabe realizar una revisión de las épocas de veda y tallas mínimas que se describe a continuación para cada especie. 6.1.1.1 Nécora • Talla Aumentarla de 50 a 55 mm de longitud del caparazón. De esta forma conseguiremos una anchura del caparazón de aproximadamente 70 mm tanto en hembras como en machos. A partir de esta medida se considera que ambos sexos pueden estar maduros al 100% según González-Gurriarán (1985a; 1985b) y González-Gurriarán y Freire (1994b). Asimismo, de acuerdo con las curvas de crecimiento calculadas por Borja (1987), con 70 mm de anchura del caparazón, los individuos tienen aproximadamente 2 años de vida y por tanto, habrán podido emplear 1 año para reproducirse. • Época de veda Del análisis del ciclo biológico que se encuentra resumido en la Tabla 29, recomendamos lo siguiente: 6. Discusión 104/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco • Época de Veda: 1 de Enero a 1 de Agosto y el mes de Septiembre. • Época de Captura: 1 de Octubre al 31 de Diciembre y el mes de Agosto. Eliminar las capturas de enero a abril persigue evitar la pesca de hembras ovígeras que comienzan a estar presentes en el mes de enero, tal y como ha sido descrito por Borja (1987) y ha sido observado en los muestreos realizados en el presente proyecto (ver apartado 5.1.3.8). Tabla 29. Representación temporal de las diferentes fases del ciclo vital de Necora puber, así como la época de veda y capturas de la mencionada especie. Clave: Inco.Juv.Pesq. = incorporación de los juveniles a la pesquería. E F M A M J J A S O N D Capturas Veda Propuesta Capturas Propuesta Veda Cópula Puesta Reclutamiento Incor. Juv. Pesq. ʐ Ovígeras Muda ʑ Muda ʐ Como medida compensatoria a la reducción de 4 meses en la época de captura podría llevarse a cabo una pesca durante el mes de agosto, medida que ha sido reiteradamente solicitada por el sector. En cualquier caso hay diversos factores que deben tenerse en cuenta en caso de adoptar esta medida: 1. Dicha captura coincidirá con la época de cópula de los individuos, por lo que a corto-medio plazo cabe esperar una reducción de la población y en consecuencia de las capturas. 2. Por otra parte, en verano el esfuerzo de pesca podría aumentar, ya que en ésta época los días de buen tiempo son más habituales y por tanto se podría salir en más ocasiones a pescar. Además en esta época habría más personas dispuestas a solicitar permiso de pesca, así como más gente que pescaría ilegalmente. Estos dos aspectos deberían ser controlados estrictamente, impidiendo un aumento del número de licencias y un control efectivo sobre el furtivismo. 3. Las capturas en agosto se iniciarían después del periodo de muda, por lo que el caparazón del individuo todavía podría permanecer blando y no apto para el consumo ya que suelen rechazarse. Asimismo, su descarte no sería efectivo, ya que tras esta manipulación suelen morir con facilidad (Borja, 1987). 6. Discusión 105/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 6.1.1.2 Bogavante • Talla Los datos recabados no justificarían una reducción de la talla de captura. Más del 90% de los individuos capturados superan la talla mínima legal (87 mm). Por otra parte, la talla de 98 mm de cafalotorax, para la cual, según Latrouite et al. (1981), se puede considerar que el 50% de las hembras está madura, se cumple en un 87% de los individuos capturados. • Época de veda El análisis del ciclo biológico de la especie (Tabla 18) no justificaría una modificación de la época de veda ni capturas, las cuales consideramos que se encuentran razonablemente bien situadas al no afectar a ninguna fase del ciclo vital de la especie. 6.1.1.3 Langosta • Talla La talla de primera maduración en el Mediterráneo es de 67 mm LC y 70-80 mm LC en el Atlántico (Hunter et al., 1996), a los tres años de edad aproximadamente (Templado et al., 2004), por lo que la talla mínima legal de 98 mm podría considerarse aceptable, aunque no se dispone de información de campo suficiente para valorar esta hipótesis. Los dos únicos individuos capturados presentaron una longitud del cefalotórax de 160 y 115 mm. • Época de veda Del análisis del ciclo biológico que se encuentra resumido en la Tabla 30, sería recomendable un aumento de la época de veda al mes de junio, con el fin de evitar la época de cópula y muda (julio-septiembre) de la especie. De esta forma, la época de veda se extendería de septiembre a junio. 6.1.1.4 Centollo • Talla La talla de primera maduración se sitúa en 130 mm (Sampedro et al., 1999), mientras que la talla mínima legal de captura en la CAPV se sitúa en 120 mm de longitud del cefalotórax. Por tanto, en coincidencia con Sampedro et al. (1999) sería recomendable aumentar la talla mínima hasta, al menos, los 130 mm anteriormente indicados. • Época de veda Del análisis del ciclo biológico que se encuentra resumido en la Tabla 31, sería recomendable el aumento de la época de veda al mes de enero y febrero con el fin de 6. Discusión 106/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco evitar la época de cópula de la especie y podría ser razonable incluir el mes de diciembre dentro de la época de capturas. Tabla 30. Representación temporal de las diferentes fases del ciclo vital de la langosta Palinurus elephas (Fabricius, 1787), así como la época de veda y capturas de la mencionada especie. E F M A Ń Ń M J J A S O N D Capturas Veda Propuesta capturas Propuesta veda Cópula Eclosión Migración ʑ Migración ʐ ʐ Ovígeras Muda ʑ Muda ʐ Ņ Ņ Tabla 31. Representación temporal de las diferentes fases del ciclo vital de Maja squinado, así como la época de veda y capturas de la mencionada especie. E F M A Ń Ń M J J A S O N D Ņ Ņ Ņ Ņ Ņ Ņ Ņ Capturas Veda Propuesta capturas Propuesta veda Reclutamiento Muda Term. Migración ʐ Ad. Migración ʑ Ad. Apareamiento Cría Ņ 6.1.2 Prohibición expresa de la captura de hembras ovadas La protección de las hembras ovadas frente a la pesquería es una medida de precaución ya señalada por Borja (1987) y una medida de gestión reconocida en países con larga tradición en la captura de crustáceos decápodos. Ungfors et al. (2007) propone para preservar la presencia de hembras ovígeras con ovarios desarrollados (los individuos preferidos en Suecia) las siguientes medidas: (a) la protección de las zonas de puesta o el establecimiento de zonas de protección regularmente espaciadas a lo largo de la costa junto con; (b) el establecimiento de 6. Discusión 107/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco cuotas de captura que garanticen un volumen de hembras migratorias suficiente (el macho tiende a permanecer estático). La relación entre los fenómenos de asentamiento larvario y las disponibilidad de stock explicarían la importancia de las medidas de gestión indicadas por Ungfors et al. (2007). Así, Arteaga-Rios et al. (2007) demostraron que las variaciones en la abundancia de larvas recién asentadas de Panulirus interruptus en Bahía Tortugas (Baja California) tiene una influencia significativa sobre las capturas comerciales 5 años después. 6.1.3 Cultivo y repoblación La repoblación de la costa mediante individuos cultivados en piscifactorías es una de las medidas propuestas para sostener, entre otras, las poblaciones de bogavante sometidas a explotación (Van der Meeren, 2005; IPAC, 2007a,2007b). Sin embargo, poco se sabe en relación con las tasas de supervivencia, el impacto ecológico de la repoblación y como mejorar la eficacia de tales actuaciones (Van der Meeren, 2005). Así, a pesar del éxito en la recuperación de determinadas especies terrestres, no es fácil encontrar resultados exitosos en el medio marino (Van der Meeren, 2005). Algunas experiencias se han llevado a cabo en relación con la langosta por Cannas et al. (Cannas et al., 1997) en Italia y McGarvey (2004) en Australia. Estudios de repoblación llevados a cabo con juveniles de H. gammarus mostraron que aquéllos que sobreviven son capaces de reproducirse y mejorar la pesquería local cuando la población salvaje se encuentra en declive (Addison y Bannister, 1994; Bannister et al., 1994; Bannister y Addison, 1998; Agnalt et al., 2004). Experiencias de repoblación llevadas a cabo en Noruega por el Institute of Marine Research de Bergen entre 1990 y 1994 dieron como resultado que el 43% de las capturas realizadas por el sector profesional en otoño de 1996 se correspondían con individuos introducidos en la repoblación (Agnalt et al., 2004). Los fenómenos de predación son el principal reto que deben superar los individuos liberados en el medio, especialmente en los primeros minutos de la suelta. Observaciones llevadas a cabo por Van der Meeren (2001) en sueltas masivas, determinaron una alta atracción de depredadores en esos primeros momentos. De igual forma se han observado fenómenos de predación por parte de nécoras, pulpos y cnidarios cuando los individuos se desplazan en busca de alimento o zonas de refugio mejores. La predación es más o menos intensa en función de la época del año, ya que los cambios en la temperatura del agua dan lugar a una modificación en la composición faunística potencialmente depredadora, siendo máxima en verano y mínima en invierno (Van der Meeren, 2000). La efectividad de estas medidas depende en gran manera de la existencia de un buen conocimiento sobre la ecología y comportamiento de la especie (selección del hábitat, movilidad, etc.) (Giacalone et al., 2006). Según Giacalone et al. (2006) estos ámbitos de conocimiento han sido poco estudiados en el caso concreto de las especies de crustáceos decápodos como la langosta, aunque en relación con la misma en la última década se ha dado un incremento de dicho esfuerzo 6. Discusión 108/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco investigador (Goñi y Latrouite, 2005), así como en relación con el centollo (Freire y González-Gurriarán, 1998; Freire et al., 1999; Corgos, 2004) y la nécora (GonzálezGurriarán, 1977; 1985a; 1985b; 1994b; Borja, 1987,1988; Choy, 1988,1991; Mene et al., 1991; Norman y Jones, 1992; Valdés, 1991; Lee et al., 2005) Así la liberación de los individuos debe llevarse a cabo en sustratos adecuados. Según Ball et al. (2001) los fondos con bloques o cantos, restos de conchas de mejillón, etc. ofrecen la posibilidad de refugio a los juveniles de bogavante liberados, por lo que son el hábitat preferencial sobre el que se distribuyen una vez liberados. La predación es más intensa en fondos arenosos, lo cual pone de manifiesto la importancia de la disponibilidad de refugios para la supervivencia de la especie frente a depredadores (Van der Meeren, 2000,2005). Por todo ello, es fundamental seleccionar las zonas de suelta de forma adecuada (en función del sustrato presente), así como llevar a cabo la operación en invierno con el fin de reducir la posibilidad de la predación. Así, Tsukamoto et al. (1999) inciden en la importancia de mejorar las técnicas de suelta, la calidad del organismo liberado y las condiciones ambientales sobre las que se realiza la suelta para obtener un buen rendimiento de la misma. Otro reto fundamental al que deben enfrentarse las tareas de repoblación está relacionado con el impacto de los individuos cultivados sobre la diversidad genética de las poblaciones salvajes. Así, Jorstad y Farestveit (1999) incidan la importancia de llevar a cabo una buena selección de las líneas parentales a partir de individuos obtenidos del medio que va a ser repoblado, así como una correcta renovación a lo largo del tiempo de dichas líneas parentales. 6.2 Medidas de ordenación 6.2.1 Establecimiento de zonas de reserva El aumento de la densidad de individuos en zonas de reserva puede dar lugar como resultado una mejora en el rendimiento de las pesquerías adyacentes a la zona de reserva, bien por medio de movimientos migratorios al azar o asociados a determinadas épocas del año (Guénette et al., 1998; Goñi et al., 2006). Multitud de estudios corroboran una mayor densidad de las poblaciones explotadas en el interior de las reservas que en zonas adyacentes (Sánchez et al., 2000; Côté et al., 2001; Jennings, 2001; Halpern y Warner, 2002; Borja et al., 2006) y en el caso concreto de los crustáceos decápodos, cabe mencionar los trabajos desarrollados por Childress (1997), Kelly et al. (2000), Kelly (2001), Goñi y Latruite (2005) y Goñi et al. (2006) en relación con la mejora del tamaño medio y biomasa de especies como la langosta. Sin embargo, trabajos recientes han subrayado la falta de información en relación con el efecto de protección de las reservas fuera de los límites de las mismas 6. Discusión 109/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco (Botsford et al., 2003; Russ et al., 2004; Goñi et al., 2006). La demostración de dicho efecto es difícil debido al reducido tamaño de la mayor parte de las reservas, la ausencia de datos previos a la declaración de las mismas y a que no se declararon como medidas para la gestión de pesquerías (Willis et al., 2003). De acuerdo con Hilborn et al. (2004), la creación de reservas marinas debe de realizarse caso por caso, con una buena planificación y seguimiento de la reserva. En caso contrario, el riesgo de no cumplir con las expectativas marcadas es muy alto. Concretamente, los movimientos migratorios tienen una especial importancia debido a que pueden afectar la permanencia de la especie dentro de las unidades o área de gestión de la misma (Giacalone et al., 2006). El estudio de este comportamiento se ha llevado a cabo mediante dos técnicas diferentes: (a) marcado y recaptura (González-Gurriarán, 1981c; Montgomery y Brett, 1996; Freire y González-Gurriarán, 1998; Sharp et al., 2000; Smith et al., 2001; GonzálezGurriarán et al., 2002; Bell et al., 2003; McGarvey, 2004; Ungfors et al., 2007); (b) el uso de telemetría (González-Gurriarán y Freire, 1994a; González-Gurriarán et al., 2002; Freire y González-Gurriarán, 1998; Smith et al., 1998; Kelly, 2001; Giacalone et al., 2006; Ungfors et al., 2007). Mientras la primera técnica tiene el inconveniente del reducido número de individuos capturados con marca y la baja resolución en los movimientos detectados, la segunda técnica es capaz de detectar movimientos a pequeña escala, hábitos alimenticios y reproductivos, hábitats frecuentados, etc., (Giacalone et al., 2006). Estudios llevados a cabo por Ungfors et al. (2007) con la especie Cancer pagurus, describen una mayor capacidad de migración de las hembras en comparación con los machos (una media de 11 km frente a 5, en el 81 y 52% de los individuos respectivamente). Dicha diferencia no se observó en función del tamaño o edad del individuo. De acuerdo con el mencionado autor, la dirección predominante de la migración guarda relación, entre otros aspectos, con la dirección predominante de la corriente marina en el área de estudio. Así, la migración tiene lugar a “contracorriente” de forma que en el momento de la puesta la fase larvaria pueda colonizar, a merced de las corrientes, el área de procedencia de las hembras y por ende, de la especie. Similares resultados fueron observados por Smith et al. (2001) en relación con el bogavante (Hommarus gammarus) y por Eaton et al. (2003) en relación con C. pagurus en la costa este del Reino Unido. Este último autor indicaba también una relación de la abundancia larvaria con la temperatura del agua, de forma que la puesta se daba en zonas con al menos 7-8ºC de temperatura. En ausencia de un conocimiento más profundo del grado de conexión de las poblaciones en respuesta a los patrones migratorios detectados por Ungfors et al. (2007), el mencionado autor sugiere una gestión adaptativa a pequeña escala (cientos de kilómetros) basada en un seguimiento y evaluación del recurso. Así, la realización de análisis de la variabilidad genética de las poblaciones para establecer el grado de conectividad de las mismas es un aspecto de desarrollo futuro, necesario para complementar los estudios de marcado y recaptura. Existen 6. Discusión 110/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco evidencias de una cierta dispersión genética en especies con estadios larvarios pelágicos en el ámbito de los crustáceos decápodos, tales como, el bogavante y el centollo. Weber et al. (2000) determinaron diferencias significativas entre poblaciones distantes tan sólo en 40 km, lo cual subrayaría la intervención de otros fenómenos que los puramente físicos en la dispersión larvaria, tales como la capacidad de natación de las larvas (Park y Shirley, 2005) o fenómenos locales como los descritos por Garvine et al. (1997) y Tilburg et al. (2007). Jorstad y Farestveit (1999) determinaron una diferencia estadísticamente significativa entre las características genéticas de una población de bogavante del norte de Noruega y el resto de las zonas de pesca situadas al sur, de las cuales se encuentra físicamente aislada. 6.2.2 Establecimiento de zonas de pesca Las zonas de pesca son áreas en las que las características de producción de la población son más o menos homogéneas y por tanto podrían gestionarse de diferente forma, estableciendo para cada una de ellas una estrategia de conservación y la definición de unos objetivos concretos (FRCC, 1995). La definición de zonas de pesca podría ser asimilable al esquema de ordenación de las pesquerías costeras de Japón por derechos territoriales de pesca descritas por Puente (1993). Este país se caracteriza por el elevado desarrollo de su pesca artesanal. Se basa en derechos territoriales de cuasi-propiedad sobre los recursos costeros que se establecen en base a la tradición histórica de las pesquerías. Estos derechos se completan con licencias de pesca que restringen el acceso a las pesquerías a un número determinado de barcos de unas características dadas (exceptuando las pesquerías de cañas y líneas de mano en aguas costeras, la práctica totalidad de las pesquerías japonesas están sujetas a un régimen de licencias). Los derechos son cedidos a las “Cooperativas de pescadores” (similares a las cofradías de nuestro litoral) que se encargan de su administración, promueven una óptima utilización de los caladeros situados en las aguas próximas a la comunidad pesquera (a los que se refieren los derechos de pesca) y velan por el acceso democrático al recurso. La armonía y coordinación entre cooperativas de pescadores está asegurada por organismos de rango superior: “Comités de Coordinación Pesquera”, en los que se encuentran representados delegados de los pescadores de las distintas comunidades pesqueras, representantes de la administración pública y técnicos pesqueros. Sus competencias son asesorar a las dependencias administrativas encargadas de otorgar derechos y licencias de pesca en una zona, así como limitar la actividad pesquera y el uso de los caladeros a nivel local. Finalmente, un “Comité Central de Pesca”, formado por los delegados de los pescadores y de especialistas en pesquerías asesora al ministro del área relacionada con la elaboración e implantación de la legislación pesquera y con la política de licencias de pesca. En este sentido, Borja y Liria (2007) ya indican la conveniencia de desarrollar un modelo de cogestión de determinadas especies marisqueras como el percebe, compartiendo la responsabilidad entre las cofradías (o asociaciones de mariscadores) y la Dirección de Pesca, haciendo anualmente un plan de explotación 6. Discusión 111/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco que incluya el número de pescadores autorizados, las zonas de producción permitidas, los objetivos económicos y productivos, la gestión de los stocks, el número de días de trabajo, las cuotas individuales por día, los lugares designados para controlar las capturas y el programa de financiación. En cualquier caso, la definición de las zonas de pesca depende estrechamente de diversos factores biológicos de la especie (crecimiento, mortalidad, etc.) asociados a procesos oceanográficos (dispersión larvaria, reclutamiento, etc.) y físicos (hábitats y sustratos preferenciales de la especie) que hay que estudiar previamente para poder definir dichas zonas. Así, el estudio de las condiciones oceanográficas y de comportamiento que regulan la dispersión larvaria y el reclutamiento de las especies de invertebrados, es junto con otros, un factor clave para la comprensión de la ecología larvaria de estos organismos marinos y el grado de conexión de las poblaciones anteriormente comentado. El reclutamiento se puede definir de forma general como la incorporación de nuevos individuos a una población como consecuencia de los procesos de crecimiento y reproducción (Queiroga et al., 2007). En el caso de las especies marinas, el reclutamiento suele presentar diversas fases: (i) desarrollo larvario; (ii) dispersión durante el desarrollo; (iii) acceso a hábitats apropiados; (iv) asentamiento; (v) y desarrollo de los juveniles (Queiroga et al., 2007). La dispersión larvaria y el asentamiento dependen de diversos procesos que regulan la producción larvaria y su disponibilidad, así como la interacción del comportamiento larvario con diferentes componentes de la circulación oceánica (Queiroga et al., 2007). La información relacionada en cambio con aquellos factores que afectan al crecimiento y desarrollo larvario, la alimentación y la mortalidad son escasos. La mayor parte de los mismos se ha estudiado en condiciones controladas en laboratorio, con la consiguiente dificultad en la extrapolación de los resultados obtenidos al medio natural. Algunos esfuerzos se han realizado en el seguimiento de las agrupaciones de larvas desde la puesta hasta el asentamiento, fundamentalmente en relación con braquiuros, aunque no han sido capaces de estudiar la cadena de procesos que ocurren a lo largo de todo el periodo o fase planctónica (Natunewicz et al., 2001; Petrone et al., 2005). Entre los principales procesos físicos responsables del transporte larvario de invertebrados costeros se citan el viento, la marea y estructuras frontales, tal y como han sido descritos por diversidad de autores (Roughgarden et al., 1988; 1991; Pineda y Caswell, 1997; Pineda, 1994,1999,2000; Pineda y López, 2002; Almeida y Queiroga, 2003). De acuerdo con ellos, el suministro de larvas a la zona costera aumenta o disminuye en función del aumento o disminución del afloramiento costero respectivamente (Queiroga et al., 2007). 6. Discusión 112/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Como desarrollo futuro será importante llevar a cabo estudios de dispersión larvaria mediante modelización, con el fin de predecir las principales zonas de asentamiento larvario en la costa del País Vasco. En coincidencia con Hunter (1999), otro aspecto fundamental para entender la ecología de las poblaciones de crustáceos decápodos del País Vasco y la conexión entre poblaciones consiste en identificar los hábitats o sustratos preferenciales de los mismos. Su conocimiento es por tanto muy importante para desarrollar esquemas de gestión (Rios-Lara et al., 2007). En años recientes, diversos autores (Orensanz y Jamieson, 1998; Orensanz et al., 1998; Freire et al., 2002b) han señalado la importancia de incorporar un análisis espacial en la evaluación de los stocks y las pesquerías. Así, Hunter (1999) señala como un área fundamental de desarrollo futuro el estudio de los hábitats preferenciales de los crustáceos decápodos, concretamente de la langosta, así como la descripción del comportamiento post-larvario de la especie. Estudios llevados a cabo por Eaton et al. (2003) en relación con el buey (Cancer pagurus) demostraron una relación directa entre las zonas de puesta e invernada de la especie con el tipo de sustrato (zonas de arena gruesa y gravas en el caso de C. pagurus). De igual forma, Rios-Lara et al. (2007) demostraron la preferencia por determinados hábitat de Panulirus aarhus, mientras que Selgrath et al. (en prensa) determinaron una mayor abundancia y supervivencia de juveniles de Homarus americanus en el interior de zonas de bloques rodeadas de algas, mientras que los individuos adultos (>40 mm de LC) preferían estar en el borde de los bloques con la zona de algas o sustrato blando. En el presente estudio, se observó cómo los lances de nasa enfocados a la captura de bogavante en el litoral de San Sebastián se situaron en la mayor parte de los casos en el borde del sustrato rocoso con los fondos blandos de arena (ver apartado 5.1.4.6). 6.2.3 Establecimiento de zonas de pesca rotativas Muy en relación con lo identificado anteriormente, una vez definidos los hábitats preferenciales de cada especie, según Caddy y Seijo (1998) sugieren el establecimiento de zonas de pesca en donde llevar a cabo una pesca rotativa teniendo en cuenta la esperanza de vida y el crecimiento de las mismas. Así según los mencionados autores, para especies longévas (M=0,1) una rotación de 6 años sería adecuada. En el caso de especies longévas (M=0,1) y de rápido crecimiento (K=0,6) el periodo de rotación óptimo sería de 4 años, mientras que en especies con una esperanza de vida corta y rápido crecimiento dicho periodo se ajustaría a dos años. En el caso de la nécora, de acuerdo con Borja (1987) su esperanza de vida se puede situar entre 0,3 y 0,4, mientras que su crecimiento es relativamente rápido con una k=0,5-0,6, por lo que de acuerdo con Caddy (1998) en el caso de establecer diversas zonas de pesca y una actividad rotatoria entre las mismas, el periodo adecuado podría estimarse en 2 años. 6. Discusión 113/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 6.2.4 Diario de pesca Tal y como se ha comentado en la introducción, la principal característica de la pesquería de crustáceos decápodos (langosta, bogavante y centollo) mediante artes menores en el País Vasco es la ausencia de un registro de las capturas, debido a que éstas no siguen el circuito de venta en las cofradías (Borja, 1987) estando muy probablemente subestimadas (Puente et al., 2002). Así, el cumplimiento de un diario de pesca es fundamental en el seguimiento de la pesquería, tal y como indican entre otros autores Bennet (1974) en relación con el bogavante. El mencionado autor llevó a cabo un estudio de la influencia del tiempo de inmersión en el valor de CPUE en la pesquería de bogavante en Devon (Inglaterra). Para ello, seleccionaron cinco embarcaciones que cumplimentaron un diario de pesca en el que se detallaba diariamente: volumen de capturas, número de nasas fondeadas, tiempo pasado entre largada y recogida del lance. De acuerdo con Browne et al. (2001), los pescadores son capaces de detectar el impacto de su actividad al observar un descenso en el número de individuos capturados por nasa (descenso en la CPUE), así como en el tamaño de los mismos. Estos parámetros no pueden ser controlados a menos que por parte del sector se lleve a cabo el cumplimiento de un diario de pesca. En este sentido, Borja (1987) incide en la absoluta necesidad de que los desembarques de nécora, y en general de marisco, pasen por cofradía, es decir que debe existir un censo de capturas. Aunque es comprensible la dificultad que esto entraña, hay que hacerlo, puesto que así se podría ver la evolución del stock, si su situación mejora o empeora, etc. Además se tendría, unido a otros estudios, un medio indirecto de evaluar la biomasa de la población del que actualmente se carece (Borja, 1987). En el Anexo I, se proporciona un modelo de diario que podría ser empleado por el sector de artes menores y una vez debidamente cumplimentado ser remitido a la autoridad competente al finalizar la época de capturas de la especie objetivo. 6.2.5 Competencia entre artes por un mismo recurso Es generalizado el sentir de los pescadores que emplean artes de nasa para la captura de crustáceos sobre la interacción negativa de las artes de enmalle, como el trasmallo, fruto de la competencia por un mismo recurso o por el espacio en los caladeros. Así, junto con otros factores, el auge de las redes de enmalle en las últimas dos décadas podrían explicar en parte el descenso de las capturas de algunas de estas especies. Tal y como se ha comentado en el apartado 5.3.2.4 relativo a los oficios de pesca, el oficio de miño dirigido a langosta se desarrolla entre abril y septiembre, fuera de la época de captura establecida por ley que se establece entre junio y agosto, siendo muy probable por tanto la captura de hembras ovadas. 6. Discusión 114/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco En este sentido, sería muy importante llevar a cabo estudios relativos al impacto sobre las poblaciones de crustáceos del uso de diferentes artes de pesca, tratando de evaluar el grado de interacción entre las mismas, con vistas a proponer medidas que eviten interacciones negativas. 6.2.6 Diseño de artes de pesca más selectivas Tal y como se ha visto en el apartado 5.1.3.11, en torno al 30-40% de las capturas de nécora mediante nasas realizadas en el litoral de Zierbana y Arminza se encuentran por debajo de la talla mínima legal de captura (50 mm de longitud del caparazón). Así, la mejora en la selectividad de las capturas del arte, centrándolas en individuos por encima de dicha talla, sería entre otras, una de las medidas encaminadas a asegurar una pesquería sostenible de estas especies. En el caso de las nasas, dos son los factores que determinan la selectividad interespecífica6 e intraespecífica7 de las nasas (Puente, 1993): 1. Estructura de la nasa: la especificidad de la nasa por una especie viene dada por el tamaño y la disposición de su abertura; la dimensión de los orificios del forro determinarían la selección de unos determinados tamaños de animales. 2. Naturaleza del cebo: determina la selectividad de la nasa por un u otra especie. En este sentido la selectividad de las nasas podría alcanzarse mediante el diseño de artefactos que ofrezcan una vía de escape a los individuos por debajo de la talla mínima legal de captura (Bennett, 1980). Este aspecto ya fue señalado por Borja (1987). Los antecedentes más recientes en relación con este tipo de medidas pueden encontrarse en el trabajo que Corgos (2004) llevó a cabo para el estudio de dos tipos de nasa para las labores de muestreo biológico de la centolla (Maja squinado) en Galicia. Asimismo, Arregi et al. (2004), llevaron a cabo una descripción detallada de la tipología de los oficios de pesca actuales de la pesca artesanal costera, incluido el de las nasas. Por otra parte, Miller (1990) y Miller y Rodger (1996), citan diversos estudios encaminados a evaluar la efectividad de estas vías de escape en especies como el bogavante americano (Homarus americanus) (Templeman, 1939; Wilder, 1949; Krouse y Thomas, 1978; Krouse, 1978; Maynard et al., 1987), el bogavante europeo (Homarus gammarus) (Brown, 1982) y otras especies como Cancer irroratus (Krouse, 1978), Cancer pagurus (Brown, 1982), Cancer magister (Krouse, 1978), 6 7 Cuando la selección se ejerce a nivel de especies capturadas. Cuando la selección tiene lugar entre los individuos de una misma especie. 6. Discusión 115/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Callinectes sapidus (Eldridge et al., 1979) y Pandalus platyceros (Boutillier y Sloan, 1988). En cualquier caso, ninguna de las experiencias llevadas a cabo se ha realizado en relación con la nécora (Necora puber). Por todo ello podrían plantearse experiencias encaminadas a la mejora de la efectividad de las nasas dirigidas a nécora mediante un correcto diseño que incluya, entre otros aspectos, el diseño de vías de escape para los individuos por debajo de la talla mínima legal. Los diferentes diseños que se desarrollasen, junto con las tradicionalmente empleadas, podrían ser probadas en primer lugar en acuarios controlados. Una vez definido el diseño más adecuado, se llevaría a cabo una prueba en la mar para evaluar la efectividad de sus capturas. Éstas se realizarían de forma mensual durante la época de capturas de la especie (octubre de 2008 a abril de 2009), en una zona previamente seleccionada. Con el fin de determinar diferencias significativas entre los diferentes tipos de nasa, se podrían controlar los siguientes parámetros poblacionales de los individuos capturados: (i) sexo (basado en la morfología del abdomen); (ii) longitud y anchura del caparazón (medido con calibre al 0.1 mm más cercano) y (iii) peso total (medido in situ en balanza digital). 6.2.7 Regulación del esfuerzo pesquero En este sentido siguen siendo plenamente válidas las conclusiones obtenidas por Borja (1987) en relación con la estabilización del esfuerzo pesquero actual: 1. Limitar el número de nasas por embarcación a 100-125/barco en zonas de puesta como el Abra de Bilbao y zonas próximas a las desembocaduras de los ríos y 150/barco en mar abierto. 2. Limitar a un lance nocturno el número de operaciones de pesca de las embarcaciones. 3. Controlar enérgicamente la pesca furtiva. Igualmente sería muy recomendable evitar la concesión de permisos excepcionales para la pesca de estas especies en profundidades inferiores a 10 m. De esta forma se evitaría capturar individuos jóvenes que habitan en zonas someras con una talla inferior a la mínima legal de captura. 6.3 Marco de investigación Con el fin de dar cumplimiento a algunas de las medidas de gestión anteriormente indicadas, se hace necesario definir una serie de aspectos de investigación que permitan que las medidas a adoptar se apoyen en un conocimiento científico del recurso suficiente. Entre otros aspectos cabe mencionar los siguientes: 6. Discusión 116/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 1. Avanzar en el conocimiento de la estrategia vital, estructura espacial, y dinámica poblacional de las especies objetivo: o Reproducción. o Crecimiento y maduración. o Patrones de migración. o Distribución y censo. o Dispersión larvaria. o Etc. 2. Identificación de los hábitats preferenciales para cada una de las especies y el grado de conexión de las poblaciones mediante estudios de marcadorecaptura o mediante marcadores genéticos moleculares. 3. Evaluar el grado de interacción entre las diferentes artes de pesca en relación con cada una de las especies. 4. Diseño de artes de pesca más selectivas. La consecución de todas las tareas anteriormente permitirían finalmente el diseño de modelos de gestión que permitan evaluar las consecuencias de diversas medidas de gestión sobre la evolución a medio-largo plazo del recurso. Algunas experiencias se han llevado a cabo en relación con determinados recursos marisqueros como el percebe (Bald et al., 2006) y la almeja fina (Bald y Borja, 2002). En numerosas ocasiones la evaluación de recursos de crustáceos se basa fundamentalmente en la simple descripción de estadísticas de capturas, estructura de la población y el análisis de índices de abundancia. A pesar de que estos aspectos pueden aportar información suficiente sobre el estado relativo de la pesquería y ser útiles para su gestión, no proporcionan sin embargo un conocimiento de la dinámica del stock y la pesquería necesario para llevar a cabo una gestión pro-activa en vez de reactiva, tal y como ocurriría en el primero de los casos (Smith y Addison, 2003). Smith y Addison (2003) en una revisión de los métodos de evaluación de stocks más adecuados para las poblaciones de crustáceos indican el uso de modelos basados en la dinámica de las poblaciones. Cualquier medida de gestión debe de realizar determinadas asunciones basadas en modelos simplificados de la realidad. Estudios comparativos han demostrado que modelos sencillos pueden dar lugar a mejores resultados que modelos complejos al ser más transparentes y más robustos en sus conclusiones (Richards y Schnute, 1998). 6. Discusión 117/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Smith y Addison (2003) indican como futuras líneas de trabajo el desarrollo de modelos que incorporen aspectos relacionados con la biología de las especies. Uno de los grandes problemas es que la mayoría de los modelos se basan en una distribución de tallas, más que en una distribución de edades con la consiguiente dificultad en el establecimiento de la edad en crustáceos de forma rutinaria, a pesar de la existencia de recientes avances en estos aspectos (Sheehy et al., 1999; Sheehy y Bannister, 2002). Según Smith y Addison (2003), un segundo aspecto en el desarrollo futuro de modelos de evaluación de stocks de crustáceos, es la incorporación de la estructura espacial de las poblaciones en dichos modelos. Dicha incorporación puede realizarse en dos escalas: (i) en determinadas especies de crustáceos la dispersión larvaria entre diversos stocks geográficamente definidos obligaría a realizar una aproximación del modelo según un esquema metapoblacional constituido por diversas subpoblaciones interconectadas por dicha dispersión larvaria; (ii) la estructura espacial también se puede incorporar considerando la distribución espacial de las subpoblaciones y en consecuencia la distribución del esfuerzo de pesca en relación con dicha distribución. 6. Discusión 118/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 7. CONCLUSIONES • La explotación de las poblaciones de crustáceos decápodos (langosta, bogavante, nécora y centollo) en la costa del País Vasco mediante artes menores presenta una gran complejidad debida al elevado número de factores humanos que influencian su funcionamiento (relacionados directamente con la explotación de recursos, pero también con otro tipo de actividades que originan alteraciones de hábitats), y con el elevado número de componentes involucrados en la actividad pesquera (multiespecífica y multiarte, con una flota diversa que presenta una complejo patrón de actividad en el espacio y en el tiempo). • Las limitaciones del conocimiento científico, incertidumbres en las evaluaciones y/o fallos de los sistemas de gestión han desembocado en la sobre-explotación de un gran número de stocks de estas especies y, en algunas instancias, han alcanzado un estado de colapso. • Por otra parte, en el caso particular del País Vasco, debido a la ausencia de un registro de las capturas, al no seguir el circuito de venta en las cofradías, se desconoce la evolución de la pesquería de especies como la nécora, el bogavante, la langosta o el centollo, aunque existen indicios que apuntan a un estado de sobre-explotación de las mismas. • Todos estos factores inducen a realizar una reflexión sobre el marco actual de gestión y la necesidad de proponer nuevas medidas que adecuen dicho marco a la situación actual de las especies, con el objetivo de alcanzar un óptimo aprovechamiento y reparto de los recursos existentes, que sea acorde con la conservación de estos y permita la convivencia con rendimientos aceptables del máximo número posible de pescadores. Para ello, cabe proponer dos tipos de medidas: 1. Medidas basadas en criterios biológicos: - Se hace necesaria una modificación de las tallas mínimas de captura y épocas de veda con el fin de adecuarlas al ciclo biológico de las especies la cual quedaría de la siguiente forma: Mariscadores Profesionales Especie Mariscadores Deportivos Veda Talla Mín. 1 septiembre - 1 junio 87 mm Prohibida su recogida 1 julio – 1 diciembre y 1 enero – 1 marzo 130 mm Prohibida su recogida Langosta (Palinurus vulgaris) 1 agosto - 1 junio 95 mm Prohibida su recogida Nécora (Necora puber) 1 enero - 1 agosto y 1-30 septiembre 55 mm Prohibida su recogida Bogavante (Homarus gammarus) Centollo (Maja squinado) 7. Conclusiones 119/143 Veda Talla Min. © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco - Se hace necesaria la prohibición expresa de la captura de hembras ovadas. - Una de las posibles medidas para la recuperación y sostenimiento de las poblaciones se encuentra en las labores de cultivo en piscifactorías y repoblación del medio natural mediante sueltas masivas. 2. Medidas orientadas hacia un ordenamiento de la actividad: • - Definir zonas de reserva cuyo objetivo sería mejorar la productividad del recurso mediante la protección de áreas de puesta y cría de las poblaciones explotadas. - Definir zonas de pesca con el objetivo de restringir y repartir el derecho de acceso al recurso, así como promover las condiciones favorables para una cogestión de la actividad pesquera al originarse una conciencia de propiedad del recurso. - Establecer una pesca rotativa entre diferentes zonas de pesca. - Establecer la obligatoriedad de cumplimentar un diario de pesca con el cual se pueda llevar a cabo un seguimiento de las capturas realizadas y así poder valorar la evolución del recurso y tomar las decisiones oportunas según el caso. - Definir las posibles competencias negativas entre las diferentes artes menores de pesca sobre las poblaciones de crustáceos decápodos. - Diseñar artes de pesca más selectivas. - Regular el esfuerzo pesquero limitando el número de nasas por barco, el tiempo de calado, así como evitando la concesión de permisos excepcionales para llevar a cabo capturas en fondos situados por encima de los 10 m de profundidad, con el objetivo de evitar la captura de individuos jóvenes de talla inferior a la mínima legal de captura. Con el fin de dar cumplimiento a algunas de las medidas de gestión anteriormente indicadas, se hace necesario definir una serie de aspectos de investigación que permitan que las medidas a adoptar se apoyen en un suficiente conocimiento científico del recurso, entre otros: - Avanzar en el conocimiento de la estrategia vital, estructura espacial, y dinámica poblacional de las especies objetivo (reproducción, crecimiento, migración, dispersión larvaria, etc.) - Identificar los hábitats preferenciales para cada una de las especies y el grado de conexión de las poblaciones mediante estudios de marcadorecaptura o mediante marcadores genéticos moleculares. 7. Conclusiones 120/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco - Evaluar el grado de interacción entre las diferentes artes de pesca en relación con cada una de las especies. - Diseño de artes de pesca más selectivas. 7. Conclusiones 121/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco 8. REFERENCIAS Abelló, P., J. P. Pertierra y D. G. Reid, 1990. Sexual size dimorphism, relative growth and handedness in Liocarcinus depurator and Macropipus tuberculatus (Brachyura: Portunidae). Scientia Marina, 54:195-202. 54 Addison, J. T. y R. C. A. Bannister, 1994. Re-stocking and enhancement of clawed 67 lobster stocks: a review. Crustaceana, 67:131-155. Agnalt, A. L., K. E. Jorstad, T. Kristiansen, E. Novtvold, E. Farestveit, H. Naess, O. I. Paulsen y T. Svansand. 2004. Enhancing the European lobster (Homarus gammarus) stock at Kvitsoy Islands: perspectives of rebuilding Norvegian stocks. En: Stock enhancement and sea ranching-developments, pitfalls and opportunities. K. M. Leber,S. Kitada,H. L. NBlankenship y T. Svansand (Ed.). Blackwell Publishing. London, UK. 415-426 pp. Almeida, M. J. y H. Queiroga, 2003. Physical forcing of onshore transport of crab megalopae in the northern Portuguese upwelling system. Estuarine, Coastal and Shelf Science, 57 (5-6):1091-1102. Ansell, A. D. y L. Robb, 1977. The spiny lobster Palinurus elephas in Scotish waters. Marine Biology, 43:63-70. 43 Arregi, L., R. Prellezo y A. Bilbao, 2002. Cambios del patrón de explotación de la flota artesanal costera debidos a la aplicación de las normativas referentes a la pesca con "artes menores" y consecuencias económicas de los mismos. Informe Inédito para la Dirección de Pesca y Acuicultura del Departamento de Agricultura, Pesca y Alimentación del Gobierno Vasco. AZTI-Tecnalia. Sukarrieta (Vizcaya). 94 pp. Arregi, L., A. Bilbao, I. Galparsoro y E. Puente, 2004. Descripción de la tipología de oficios de pesca actuales de la pesca artesanal costera. Informe inédito para Dpto. Industria, Comercio y Turismo del Gobierno Vasco:117. Arteaga-Rios, L. D., J. Carrillo-Laguna, J. Belmar-Perez y S. A. Guzman Del Proo, 2007. Post-larval settlement of California spiny lobster Panulirus interruptus in Bahia Tortugas, Baja California and its relationship to the commercial catch. Fisheries research, 88 (1-3):51-55. Bald, J. y A. Borja, 2002. Modelling the Management of Clam (Ruditapes decussatus) Exploitation in the Plentzia Estuary (Basque Country, Northern Spain). Conference proceedings of the XX International Conference of the System Dynamics Society. July 28 - August 1, 2002. Palermo (Italy) Bald, J., A. Borja y I. Muxika, 2006. A system dynamics model for the management of the gooseneck barnacle (Pollicipes pollicipes) in the marine reserve of Gaztelugatxe (Northern Spain). Ecological Modelling, 194 (1-3):306-315. 8. Referencias 123/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Ball, B., A. Linnane, B. Munday, R. Browne y J. P. Mercer, 2001. The effect of cover on in situ predation in early benthic phase European lobster Homarus gammarus. J.Mar.Biol.Ass.U.K., 81 (4):639-642. Bannister, R. C. A., 1986. Assessment and population dynamics of commercially exploited shellfish in England and Wales. Can. Spec. Publ. Fish. Aquat. Sci., 92:182-194. Bannister, R. C. A., J. T. Addison y S. Lovewell, 1994. Growth, movement, recapture rate and survival of hatchery-reared lobsters( Homarus gammarus Linnaeus, 1758) released into the wild on the English east coast. Crustaceana, 67:156-172. 67 Bannister, R. C. A. y J. T. Addison, 1998. Enhancing lobster stocks: A review of recent European methods, results, and future prospects. Bulletin of Marine Science, 62 (2):369-387. Bell, M. C., D. R. Eaton, R. C. A. Bannister y J. T. Addison, 2003. A mark-recapture approach to estimating population density from continuous trapping data: application to edible crabs, Cancer pagurus, on the east coast of England. Fisheries research, 65 (1-3):361-378. Beninger, P. G., L. Chiasson y R. W. Elner, 1986. The utility of artificial collectors as a technique to study benthic settlement and early juvenile growth of the rock crab, Cancer irroratus. Fisheries research, 4 (3-4):317-329. Bennett, D. B., 1974. The effects of pot immersion time on catches of crabs, Cancer pagurus L. and lobsters, Homarus gammarus (L.). ICES Journal of Marine Science, 35 (3):332-336. Bennett, D. B. 1980. Perspectives on European Lobster Management. En: The Biology and Management of Lobsters. Volume II. Ecology and Management. J. S. Cobb y B. F. Phillips (Ed.). Academic Press, INC. London. 317-331 pp. Beverton, R. J. J. y S. J. Holt, 1957. On the dynamics of exploited fish populations. Ministry of Agriculture, Fisheries and Food, London. Fisheries Investigations, 2 (19). Borja, A., 1987. La población de nécora Liocarcinus puber en la costa vasca. Inf.Tec.Gob.Vas., 10:76. 10 Borja, A., 1988. La población de nécora, Liocarcinus puber Linneo (1767)(Decapoda, Brachyura) en la costa vasca (N España). Inv.Pesq., 52 (2)):277-281. Borja, A., F. Aguirrezabalaga, J. Martínez, J. C. Sola, L. García-Arberas y J. M. Gorostiaga, 2004. Benthic communities, biogeography and resources management. Borja, A. and Collins, M. (Eds.). Oceanography and Marine Environment of the Basque Country, Elsevier Oceanography Series, 70:45570 492. 8. Referencias 124/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Borja, A., I. Muxika y J. Bald, 2006. Protection of the goose barnacle Pollicipes pollicipes, Gmelin, 1790 population: the Gaztelugatxe Marine Reserve (Basque Country, northern Spain). Scientia Marina, 70 (2):235-242. Borja, A. y P. Liria, 2007. El Recurso Marisquero de Percebe (Pollicipes Pollicipes) en la Costa Vasca: Relaciones con la Energía del Oleaje, entre 2004 y 2007. Informe inédito para el Departamento de Agricultura, Pesca y Alimentación, Gobierno Vasco. AZTI-Tecnalia. Pasajes. 53 pp. Botsford, L. W., C. L. Moloney, A. Hastings, J. L. Largier, T. M. Powell, K. Higgins y J. F. Quinn, 1994. The influence of spatially and temporally varying oceanographic conditions on meroplanktonic metapopulations. Deep-Sea Research II, 41:107-145. 41 Botsford, L. W., 1995. Population dynamics of spatially distributed, meroplanktonic, exploited marine invertebrates. ICES marine Science Symposia 199: 118-128. Botsford, L. W., C. L. Moloney, J. L. Largier y A. Hastings, 1998. Metapopulation dynamics of meroplanktonic invertebrates: the Dungeness crab (Cancer magister) as an example. Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management. Can. Spec. Publ. Fish. Aquat. Sci. G. S. Jamieson y A. Campbell (Ed.). 125: 295-306. Botsford, L. W., F. Micheli y A. Hastings, 2003. Principles for the design of marine reserves. Ecological Applications, 13 (1):25-31. Boutillier, J. y N. A. Sloan, 1988. Trap mesh selectivity in relation to the legal size regulation for prawn (Pandalus platyceros) in British Columbia. J. Shellfish Res., 7:427-431. Brosnan, D. M., 1981. Studies on the biology, ecology and fishery of the spider crab Maia squinado Herbst (1768) of the west coast of Ireland. Department of Zoology. University College Galway, Ireland. 133 pp. Brown, C. G., 1982. The effect of scape gaps on trap selectivity in the United Kingdom crab (Cancer pagurus L.) and lobster (Homarus gammarus (L.)) fisheries. J. Cons. Int. Explor. Mer, 40:127-134. 40 Browne, R. M., J. P. Mercer y M. J. Duncan, 2001. An historical overview of the Republic of Ireland's lobster (Homarus gammarus Linnaeus) fishery, with reference to European and North American (Homarus americanus Milne Edwards) lobster landings. Hydrobiologia, 465 (1-3):49-62. Caddy, J. F. y J. C. Seijo. 1998. Application of a spatial model to explore rotating harvest strategies for sedentary species. En: Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management. G. S. Jamieson y A. Campbell (Ed.). Can. Spec.Publ.Fish.Aquat.Sci.125. 359365 pp. 8. Referencias 125/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Caddy, J. F., 1999. Fisheries management in the twenty-first century: will new paradigms apply? Rev Fish Biol Fish, 9:1-43. Campillo, A. y J. Amadei, 1978. Premieres données biologiques sur la langouste de Corse, Palinurus elephas Fabricius. Rev.Trav.Inst.Pêches marit., 42:34742 373. Cannas, A., M. S. R. Pinna, E. Secci y C. Tidu, 1997. Progetto di ripopolamento di aragosta rossa (Palinurus elephas) in un´area del golfo dell´Asinara: aspetti biologici, tecnici e produttivi. Biologia Marina Mediterranea, 5:1442-1449. Castro, R., 1990. Biología y pesca del Besugo (Pagellus bogaraveo, B.). Inf.Tec.Gob.Vas., 30:42. 30 Castro, R., 1992. Biología y pesca de diversas especies demersales de interés comercial secundario para la flota vasca. Informe final del proyecto: <<Estudio de los stocks deespecies de interés comercial para la flota vasca, no estudiados en la actualidad por AZTI/SIO>>. Inst. Invest. y Tecn. para la Oceanografía, Pesca y Alimentación (AZTI/SIO), Sukarrieta (Bizkaia). 46 pp. Childress, M. J., 1997. Marine reserves and their effects on lobster populations: report from a workshop. Marine & Freshwater Research, 48:1111-1114. 48 Chittleborough, R., 1975. Environmental factors affecting growth and survival of juvenile western rock lobsters Panulirus longipes (Milne-Edwards) doi:10.1071/MF9750177. Marine and Freshwater Research, 26 (2):177-196. Chittleborough, R., 1976. Breeding of Panulirus longipes cygnus George under natural and controlled conditions doi:10.1071/MF9760499. Marine and Freshwater Research, 27 (3):499-516. Choy, S. C. 1986. Ecological studies on Liocarcinus puber (L.) and L. holsatus (Fabricius) (Crustacea, BRachyura, Portunidae) around the Gower Peninsula. South Wales. Ph.D. thesis. University of Wales. 341 p. Choy, S. C., 1988. Reproductive biology of Liocarcinus puber and L. holsatus (Decapoda, Brachyura, Portunidae) from the Gower Peninsula, south Wales. PSZNI: Marine Ecology, 9:227-241. Choy, S. C., 1991. Embryonic and larval biology of Liocarcinus holsatus and Necora puber (Crustacea: Brachyura; Portunidae). J.Exp.Mar.Biol.Ecol., 148:77-92. 148 Cobb, J. S. 1995. Interface of ecology, baheviour and fisheries. En: Biology of the lobster, Homarus americanus. J. R. Factor (Ed.). Academic Press. New York. 139-151 pp. 8. Referencias 126/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Cooper, R. A. y J. R. Uzmann. 1980. Ecology of Juvenile and Adult Homarus. En: The biology and mnagement of lobsters. J. S. Cobb y B. F. Phillips (Ed.). Academic Press. New York. 97-142 pp. Corgos, A. 2004. Estrategia vital, estructura espacial y dinámica de la centolla Maja squinado (Decapoda: Majidae). Tesis. Universidade da Coruña., A Coruña. 311 p. Côté, I. M., I. Mosqueira y J. D. Reynolds, 2001. Effects of marine reserve characteristics on the protection of fish populations: a meta-analysis. J. Fish. Biol., 79 (A):178-189. Davidson, R. J. y I. D. Marsden, 1987. Size relationship and relative growth of the New Zealand swimming crab Ovalipes catharus (White, 1843). Journal of Crustacean Biology, 7:308-317. Dayton, P. K., S. F. Thrush, M. T. Agardy y R. J. Hoffman, 1995. Environmental effects of marine fishing. Aquatic Conservation - Marine and Freshwater Ecosystems, 5:205-232. Debuse, V. J., J. T. Addison y A. D. Reynolds, 2001. Morphometric variability in UK populations of the European lobster. Journal of the Marine Biological Association of the United Kingdom, 81 (3):469-474. Drach, P., 1933. Sur la croissance de l´abdomen chez les Brachyoures. Cas de Portunus puber. Comptes Rendues de l´Academie des Sciences de Paris, 197:93-95. Drinkwater, K. F., M. J. Tremblay y M. Comeau, 2006. The influence of wind and temperature on the catch rate of the American lobster (Homarus americanus) during spring fisheries off eastern Canada doi:10.1111/j.1365-2419.2005.00349.x. Fisheries Oceanography, 15 (2):150-165. Eaton, D. R., J. Brown, J. T. Addison, S. P. Milligan y L. J. Fernand, 2003. Edible crab (Cancer pagurus) larvae surveys off the east coast of England: implications for stock structure. Fisheries research, 65 (1-3):191-199. Edwards, E., 1979. Preliminary results of an investigation on a new fishery for spider crabs (Maia squinado) along the south coast of England. ICES, Shellfish Committee, C.M. 1979/K:14 1979/K:14:282. Eldridge, P. J., V. G. Burrel y G. Steele, 1979. Development of a self-culling blue crab pot. Mar. Fish. Rev., 41 (12):21-27. Elner, R. W. y P. G. Beninger, 1995. Multiple reproductive strategies in snow crab, Chionoecetes opilio: physiological pathways and behavioral plasticity. Journal of Experimental Marine Biology and Ecology, 193:93-112. 193 8. Referencias 127/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Eno, N. C., D. S. Macdonald, J. A. M. Kinnear, C. J. Chapman, R. A. Clark, F. Bunker y C. Munro, 2001. Effects of crustacean traps on benthic fauna. ICES Journal of Marine Science, 58:11-20. 58 Factor, J. R., 1995. Biology of the lobster Homarus americanus. Academic Press. San Diego. 528 pp. Frcc, 1995. A Conservation Network for Atlantic Lobster. Report to the Minister of Fisheries and Oceans Fisheries Resource Conservation Council. 38 pp. Freire, J. y E. González-Gurriarán, 1998. New approaches to the behavioural ecology of decapod crustaceans using telemetry and electronic tags. Hydrobiologia, 372:123-132. 372 Freire, J., E. González-Gurriarán y C. Bernárdez, 1999. Migratory patterns in the spider crab Maja squinado using telemetry and electronic tags. ICES, Shellfish Committee, C.M. 1999/AA:14 1999/AA:14:5. Freire, J. y A. García-Allut, 2000. Socioeconomic and biological causes of management failures in European artisanal fisheries: the case of Galicia (NW Spain). Marine Policy, 24:375-384. 24 Freire, J., C. Bernárdez, A. Corgos, L. Fernández, E. González-Gurriarán, M. P. Sampedro y P. Verísimo, 2002a. Management strategies for sustainable invertebrate fisheries in coastal ecosystems of Galicia (NW Spain). Aquatic Ecology, 36:41-50. 36 Freire, J., C. Bernárdez, A. Corgos, L. Fernández, E. González-Gurriarán, M. P. Sampedro y P. Verísimo, 2002b. Management strategies for sustainable invertebrate fisheries in coastal ecosystems of Galicia (NW Spain). Aquatic Ecology, 36:41-50. 36 Freire, J., 2005. Dinámica de poblaciones y gestión de pesquerías de invertebrados. http://www.udc.es/dep/bave/bprm/linea_invest_gestion_esp.htm Garvine, R. W., C. E. Epifanio, C. C. Epifanio y K.-C. Wong, 1997. Transport and Recruitment of Blue Crab Larvae:a Model with Advection and Mortality. Estuarine, Coastal and Shelf Science, 45 (1):99-111. Giacalone, V. M., G. D´Anna, C. Pipitone y F. Badalamenti, 2006. Movements and residence time of spiny lobsters, Palinurus elephas released in a marine protected area: an investigation by ultrasonic telemetry. J.Mar.Biol.Ass.U.K., 86:1101-1106. 86 González-Gurriarán, E., 1977. Algunos aspectos del comportamiento en la nécora 75 Macropipus puber (L.). Bol.R.Soc.Esp.Hist.Nat.(Biol.), 75:473-479. 8. Referencias 128/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco González-Gurriarán, E., 1978a. Introducción al estudio de una población de Macropipus puber (L.)(Decapoda-Brachyura), en la ría de Arosa (GaliciaEspaña). Boletín del Instituto Español de Oceanografía, 4 (241)):71-80. González-Gurriarán, E., 1978b. Introducción al estudio de la alimentación en la nécora, Macropipus puber L. (Decapoda-Brachyura). Boletín del Instituto Español de Oceanografía, 4 (242)):81-93. González-Gurriarán, E., 1981a. La nécora Macropipus puber (L, 1767)(Decapoda, Portunidae), en los polígonos de bateas de la ría de Arousa: Contribución al estudio de su biología. Tesis Doctoral;Universidad de Santiago:62. González-Gurriarán, E., 1981b. La nécora, Macropipus puber (L.)(Decapoda, Brachyura), en los polígonos de bateas de la ría de Arousa (Galicia). Consideraciones generales. Oecol.Aquat., 5:195-205. González-Gurriarán, E., 1981c. Primeros datos sobre el crecimiento en la ecdisis y pruebas de sistemas de marcado de la nécora, "Macropipus puber" (L.)(Decapoda-Brachyura), en el laboratorio. Boletín del Instituto Español de Oceanografía, 6 (300)):115-136. González-Gurriarán, E., 1982. Estudio de la comunidad de crustáceos decápodos (Brachyura) en la ría de Arousa (Galicia-NW España), y su relación con el cultivo de mejillón en batea. Boletín del Instituto Español de Oceanografía, 7 (2)):223-254. González-Gurriarán, E., 1985a. Reproducción de la nécora Macropipus puber (L.)(Decapoda, Brachyura), y ciclo reproductivo en la ría de Arousa (Galicia, NW España). Boletín del Instituto Español de Oceanografía, 2 (1)):10-32. González-Gurriarán, E., 1985b. Crecimiento de la nécora Macropipus puber (L.)(Decapoda, Brachyura) en la ría de Arousa (Galicia, NW España), y primeros datos sobre la dinámica de la población. Boletín del Instituto Español de Oceanografía, 2 (1)):33-51. González-Gurriarán, E., L. Fernández, J. Freire, R. Muiño y J. Parapar, 1993. Reproduction of the spider crab Maja squinado (Brachyura: Majidae) in the southern Galician coast (NW Spain). ICES, Shellfish Committee, C.M. 1993/K:19:15. González-Gurriarán, E. y J. Freire, 1994a. Movement patterns and habitat utilization in the spider crab Maja squinado (Herbst) (Decapoda, Majidae) measured by ultrasonic telemetry. J.Exp.Mar.Biol.Ecol., 184:269-291. 184 González-Gurriarán, E. y J. Freire, 1994b. Sexual maturity in the velvet swimming crab Necora puber (Brachyura, Portunidae): morphometric and reproductive analyses. ICES Journal of Marine Science, 51:133-145. 51 8. Referencias 129/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco González-Gurriarán, E., J. Freire, J. Parapar, M. P. Sampedro y M. Urcera, 1995. Growth at moult and moulting seasonality of the spider crab, Maja squinado (Herbst) (Decapoda: Majidae) in experimental conditions: implications for juvenile life history. J.Exp.Mar.Biol.Ecol., 189:183-203. 189 González-Gurriarán, E., L. Fernández, J. Freire y R. Muiño, 1998. Mating and role of seminal receptacles in the reproductive biology of the spider crab Maja squinado (decapoda, Majidae). J.Exp.Mar.Biol.Ecol., 220:269-285. 220 González-Gurriarán, E., J. Freire y C. Bernardez, 2002. Migratory patterns of female spider crabs Maja squinado detected using electronic tags and telemetry. Journal of Crustacean Biology, 22 (1):91-97. Goñi, R., O. Renones y A. Quetglas, 2001. Dynamics of a protected Western Mediterranean population of the European spiny lobster Palinurus elephas (Fabricius, 1787) assessed by trap surveys. Marine & Freshwater Research, 52 (8):1577-1587. Goñi, R., A. Quetglas y O. Renones, 2003a. Differential catchability of male and female European spiny lobster Palinurus elephas (Fabricius, 1787) in traps and trammelnets. Fisheries research, 65 (1-3):295-307. Goñi, R., A. Quetglas y O. Renones, 2003b. Size at maturity, fecundity and reproductive potential of a protected population of the spiny lobster Palinurus elephas (Fabricius, 1787) from the western Mediterranean. Marine Biology, 143 (3):583-592. Goñi, R. y D. Latrouite, 2005. Review of the biology, ecology and fisheries of Palinurus spp. species of European waters: Palinurus elephas (Fabricius, 1787) and Palinurus mauritanicas (Gruvel, 1911). Cahiers de Biologie Marine, 46 (2):127-142. Goñi, R., A. Quetglas y O. Reñones, 2006. Spillover of spiny lobsters Palinurus elephas from a marine reserve to an adjoining fishery. Mar. Ecol. Prog. Ser., 308:207-219. Guénette, S., T. Lauck y C. Calrck, 1998. Marine reserves: from Beverton and Holt to the present. Rev Fish Biol Fish, 8:251-272. Haefner, P. A., 1985. Morphometry, reproduction, diet, and epizoites of Ovalipes stephensoni Williams, 1º976 (Decapoda, Brachyura). Journal of Crustacean Biology, 5:658-672. Halpern, B. S. y R. R. Warner, 2002. Marine reserves have rapid and long lasting effects. Ecol. Lett., 5:361-366. Hartnoll, R. G., 1965. The biology of spider crabs: a comparison of British and Jamaican species. Crustaceana, 9:1-16. 8. Referencias 130/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Hartnoll, R. G., 1974. Variation in growth pattern between some secondary sexual characters in crabs (Decapoda Brachyura). Crustaceana, 27 (2)):131-136. Hartnoll, R. G., 1978. The determination of relative growth in Crustacea. Crustaceana, 34 (3)):281-293. Hepper, B. T., 1965. Notes on the breeding of the crawfish (palinurus vulgaris) in 96 Cornish waters. ICES Shellfish Committee, 96:1-3. Hepper, B. T., 1966. Measurement of carapace length and total length in the crawfish, Palinurus vulgaris. J.Cons.Perm.Int.Explor.Mer, 30 (3)):316-323. Hepper, B. T., 1977. The fishery of the crawfish, Palinurus elephas, of the coast of Cornwall. J. Mar. Biol. Ass. UK, 57:925-941. 57 Hepper, B. T. y C. J. Gough, 1978. Fecundity and rate of embryonic development of the lobster, Homarus gammarus (L), off the coast of North Wales. ICES Journal of Marine Science, 38 (1):54-57. Hilborn, R., 1986. A comparison of alternative harvest tactics for invertebrate fisheries. North Pacific Workshop on Stock Assessemt and Management of Invertebrates Canadian Special Publication of Fisheries and Aquatic Sciences. G. S. Jamieson y N. Bourne (Ed.). 92: 313-317. Hilborn, R. y C. J. Walters, 1992. Quantitative Fisheries Stock Assessment. Chapman & Hall. New York. pp. Hilborn, R., K. Stokes, J.-J. Maguire, T. Smith, L. W. Botsford, M. Mangel, J. Orensanz, A. Parma, J. Rice, J. Bell, K. L. Cochrane, S. Garcia, S. J. Hall, G. P. Kirkwood, K. Sainsbury, G. Stefansson y C. Walters, 2004. When can marine reserves improve fisheries management? Ocean & Coastal Management, 47 (3-4):197-205. Hines, A. H., T. G. Wolcott, E. González-Gurriarán, J. L. González-Escalante y J. Freire, 1995. Movement patterns and migrations in crabs: telemetry of juvenile and adult behaviour in Callinectes sapidus and Maja squinado. J. Mar. Biol. Assoc. U.K., 75 (27-42). Howard, A. E., 1980. Substrate controls on the size composition of lobster (Homarus gammarus) populations. ICES Journal of Marine Science, 39 (2):130-133. Hunter, E., S. E. Shackley y D. B. Bennett, 1996. Recent studies in the crawfish Palinurus elephas in the south Wales and Cornwall. J.Mar.Biol.Ass.U.K., 76:963-983. Hunter, E., 1999. Biology of the European spiny lobster, Palinurus elephas 72 (Fabricius, 1787) (Decapoda, Palinuridea). Crustaceana, 72:545-565. 8. Referencias 131/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Huxley, J. S. y O. W. Richards, 1931. Relative growth of the abdomen and the carapace of the shore-crab Carcinus maenas. Journal of the Marine Biological Association of the United Kingdom, 17 (3)):1001-1015. Igelmo, A., X. Iribar y S. Lerga, 1984. Inventario de Artes de Pesca de Euskadi. Informe inédito para la Consejería de Comercio, Pesca y Turismo. Gobierno Vasco. Gazteiz. pp. Iglesias, J., F. Sánchez, C. Moxica, L. Fuentes, J. J. Otero y J. L. Pérez, 2002. Datos preliminares sobre el cultivo de larvas y juveniles de centolla Maja squinado (Herbst, 1788) en el Centro Oceanográfico de Vigo del Instituto Español de Oceanografía. Bol.Inst.Esp.Oceanogr., 18 (1-4):25-30. Incze, L. S., R. A. Wahle y A. T. Palma, 2000. Advection and settlement rates in a benthic invertebrate: recruitment to first benthic stage in Homarus americanus. ICES Journal of Marine Science, 57 (2):430-437. Incze, L. S., N. Wolff y R. A. Wahle, 2003. Can scientific observations of early life stages be scaled up to the level of a fished population? A case study using Homarus americanus. Fisheries research, 65 (1-3):33-46. Ipac. 2007a. Entrevista a GONZALO PÉREZ BENAVENTE, COORDINADOR EN GALICIA DEL PROYECTO "RESTOCKING OF LOBSTER". "El preengorde en batea puede ser una alternativa de futuro". Pages 11-12 in IPAC Acuicultura. Ipac. 2007b. Repoblaciones de bogavante en Lira y lenguado en Matalascañas. Pages 24 in IPAC Acuilcultura. Jennings, S., 2001. Patterns and prediction of population recovery in marine reserves. Rev Fish Biol Fish, 10:209-231. 10 Jensen, A. C., K. J. Collins y R. C. A. Bannister. 1994. The potential use of artificial reefs to enhance lobster habitat. En: Artificial reefs in European seas. A. C. Jensen (Ed.). Kluwer Academic Publishers. Dordrecht. 379-401 pp. Jorstad, K. E. y E. Farestveit, 1999. Population genetic structure of lobster (Homarus gammarus) in Norway, and implications for enhancement and sea-ranching operation. Aquaculture, 173 (1-4):447-457. Karlovac, O., 1965. Contribution à la connaissance de la biologie de la langouste commune (Palinurus elephas Fabr.) (Note préliminaire). Rapp.Prc.verb.Réun., Mer Médit., 18:181-184. 18 Kelly, S., D. Scott, A. B. Mac_Diarmid y R. C. Babcock, 2000. Spiny lobster, Jasus edwardsii, recovery in New Zealand marine reserves. Biological Conservation, 92:359-369. 92 8. Referencias 132/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Kelly, S., 2001. Temporal variation in the movement of the spiny lobster Jasus edwardsii. Marine & Freshwater Research, 52:323-331. 52 Kergariou, G., 1975. Contribution à l'étude de la reproduction de l'araignée de mer (Maia squinado H.). ICES, Shellfish and Benthos Committee, C.M. 1975/K:34:8. Kergariou, G. y G. Veron, 1981. Distribution de l'araignée de mer, Maia squinado, sur al pêcherie hivernale du Golfe Normano Breton. ICES, Shellfish Committee, C.M. 1981/K:32 1981/K:32. Kergariou, G., 1984. L'araignée de mer, Maia squinado. H. Biologie et exploitation. La Pêche maritime, 1279:575-583. 1279 Krouse, J. S., 1978. Effectiveness of scape vent shape in traps for catching legalsized lobster, Homarus americanus, and harvestable-sized crabs; Cancer 76 borealis and Cancer irroratus. Fish.Bull., 76:425-432. Krouse, J. S. y J. C. Thomas, 1978. Effects on trap selectivity and some population parameters on size composition of the American lobster, Homarus americanus, catch along Maine coast. Fish.Bull., 73:862-871. 73 DONNEES SUR LA REPRODUCTION ET LA TAILLE DE PREMIERE MATURITE DU HOMARD HOMARUS GAMMARUS D'IROISE ET DU GOLFE DE GASCOGNE. pp. Latrouite, D., M. Léglise y G. Raguenés, 1981. Latrouite, D., Y. Morizur y G. Raguenés, 1984. FECONDITES INDIVIDUELLE ET PAR RECRUE DU HOMARD EUROPEEN Homarus gammarus (L.) DES COTES FRANÇAISES. pp. Latrouite, D., 1989. Etude des araignees des nourriceries de la Baie de SaintBrieuc et de l'Ouest-Contentin. IFREMER. 27 pp. Latrouite, D. y D. L. Foll, 1989. Données sur les migrations des crabes tourteau Cancer paguruset les araignées de mer Maja squinado. Oceanis, 15:133-142. 15 Latrouite, D., 1990. Etude des araignees des nourriceries de la baie de Saint-Brieuc et de l'Ouest-Cotentin. IFREMER. 28 pp. Latrouite, D., 1991. Etude du recrutement en araignees dans le Golfe NormandBreton. IFREMER. 28 pp. Le Foll, D., 1993. Biologie et exploitation de l'araignée de mer Maja squinado Herbst en Manche Ouest. Université de Bretagne Occidentale, IFREMER, RI DRV 93-030. 524 pp. Lebour, M. V., 1927. Studies of the Plymouth Brachyura. I. The rearing of crabs in captivity, with a description of the larval stages of Inachus dorsettensis, 8. Referencias 133/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Macropodia longirostris and Maia squinado. J. Mar. Biol. Assoc. U.K., 14:795-820. Lee, J. T., R. A. Coleman y M. B. Jones, 2005. Vertical migration during tidal transport of megalopae of Necora puber in coastal shallow waters during daytime. Estuarine Coastal and Shelf Science, 65:396-404. 65 Levins, R., 1969. Some demographic and genetic consequences of environmental heterogeneity for biological control. Bulletin of Entomological Society of America, 15:237-240. 15 Levins, R. 1970. Extinction. En: Some Mathematical Problems in Biology. M. Desternhaber (Ed.). American Mathematical Society. Providence. 77-107 pp. Link, J. S., 2002. Ecological considerations in fisheries management: when does it 27 matter? Fisheries Investigations, 27:10-17. Linnane, A., B. Ball, B. Munday y J. P. Mercer, 2000a. On the occurrence of juvenile lobster Homarus gammarus in intertidal habitat. Journal of the Marine Biological Association of the United Kingdom, 80 (2):375-376. Linnane, A., D. Mazzoni y J. P. Mercer, 2000b. A long-term mesocosm study on the settlement and survival of juvenile European lobster Homarus gammarus L. in four natural substrata. Journal of Experimental Marine Biology and Ecology, 249 (1):51-64. Lizarraga-Cubedo, H. A., I. Tuck, N. Bailey, G. J. Pierce y J. A. M. Kinnear, 2003. Comparisons of size at maturity and fecundity of two Scottish populations of the European lobster, Homarus gammarus. Fisheries research, 65 (1-3):137152. Martin, J., 1983. Période d'éclosion des larves d'araignée (Maja squinado, Herbst) en baie d'Audierne (Bretagne sud) en 1979 et 1980. ICES, Shellfish Committee, C.M. 1983/K:30 1983/K:30:10. Maunder, M. N., J. R. Sibert, A. Fonteneau, J. Hampton, P. Kleiber y S. J. Harley, 2006. Interpreting catch per unit effort data to assess the status of individual stocks and communities. ICES Journal of Marine Science, 63 (8):1373-1385. Maynard, D. R., N. Branch, Y. Chiasson y G. Y. Conan, 1987. Comparison of three lobster (Homarus americanus) trap escape mechanism and application of a theoretical retention curve for these devices in the southern Gulf of St. Lawrence lobster fishery. Can. Atl. Fish. Sci. Advis. Comm. Res. Doc.87/87:34. Mcgarvey, R., 2004. Estimating the emigration rate of fish stocks from marine sanctuaries using tag-recovery data. Fishery Bulletin, 102 (3):464-472. 8. Referencias 134/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Mene, L., M. T. Alvarez Ossorio, E. González Gurriarán y L. Valdés, 1991. Effects of temperature and salinity on larval development of "Necora puber" (Brachyura: Portunidae). Marine Biology, 108:73-81. 108 Mene, L. J., 1987. Aspectos morfológicos de las fases larvarias de la nécora, Liocarcinus puber. Boletín del Instituto Español de Oceanografía, 4 (1)):6168. Mercer, J. P. 1973. Studies on the spiny lobster (Crustacea: Decapoda: Palinuridae) of the west coast of Ireland, with particular reference to Palinurus elephas Fabricius, 1787. Ph.D. Thesis. University College Galway, Galway. 331 p. Mercer, J. P., R. C. A. Bannister, G. I. Van Der Meeren, V. Debuse, D. Mazzoni, S. Lovewell, R. Browne, A. Linnane y B. Ball, 2001. An overview of the LEAR (Lobster Ecology and Recruitment) project: results of field and experimental studies on the juvenile ecology of Homarus gammarus in cobble. Marine & Freshwater Research, 52 (8):1291-1301. Meyer, C. G., 1993. The biology and fishery of the spider crab (Maja squinado) around Jersey (Channel Islands). Dept. Biol. Sci., Fac. Sci. Univ. Plymouth, 116. Miller, R. J., 1990. Effectiveness of Crab and Lobster Traps. Can. J. Fish. Aquat. Sci., 47:1228-1251. 47 Miller, R. J. y R. S. Rodger, 1996. Soak times and fishing strategy for American lobster. Fisheries research, 26 (3-4):199-205. Montgomery, S. S. y P. A. Brett, 1996. Tagging eastern rock lobsters Jasus verreauxi: effectiveness of several types of tag. Fisheries research, 27 (4):141-152. Motos, L. y A. Uriarte, 1986. La flota al pincho de Hondarribia. Colección Itsaso n.2. Serv. Cent. Public. Gobierno Vasco. Vitoria-Gazteiz. pp. Natunewicz, C. C., C. E. Epifanio y R. W. Garvine, 2001. Transport of crab larval patches in the coastal ocean. Mar. Ecol. Prog. Ser., 222:143-154. 222 Norman, C. P. 1989. Ecology of the velvet swimming crab Liocarcinus puber (L.) (Brachyura: Portunidae). Ph.D. Thesis. Polytechnic South West. 247 p. Norman, C. P. y M. B. Jones, 1992. Influence of depth, season and moult stage on the diet of the velvet swimming crab Necora puber (brachyura, portunidae). Estuarine, Coastal and Shelf Science, 34 (1):71-83. Orensanz, J. M. y G. S. Jamieson, 1998. The assessment and management of spatially structured stocks: an overview of the North Pacific Symposium on Invertebrate Stock Assessment and Management. Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management 8. Referencias 135/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Canadian Special Publication of Fisheries and Aquatic Sciences. G. S. Jamieson y A. Campbell (Ed.). 125: 441-459. Orensanz, J. M., A. M. Parma y M. A. Hall, 1998. The analysis of concentration and crowding in shellfish research. Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management. Canadian Special Publication of Fisheries and Aquatic Sciences. G. S. Jamieson y A. Campbell (Ed.). 125: 143-157. Pais, A., L. A. Chessa, S. Serra, A. Ruiu, G. Meloni y Y. Donno, 2007. The impact of commercial and recreational harvesting for Paracentrotus lividus on shallow rocky reef sea urchin communities in North-western Sardinia, Italy. Estuarine, Coastal and Shelf Science, 73 (3-4):589-597. Park, W. y T. C. Shirley, 2005. Diel Vertical Migration and Seasonal Timing of the Larvae of Three Sympatric Cancrid Crabs, Cancer spp., in Southeastern Alaska. Estuaries, 28 (2):266-273. Perry, R. I., C. J. Walters y J. A. Boutillier, 1999. A framework for providing scientific advice for the management of new and developing invertebrate fisheries. Rev Fish Biol Fish, 9:125-150. Petrone, C., L. B. Jancaitis, M. Brandon Jones, C. C. Natunewicz, C. E. Tilburg y C. C. Epifanio, 2005. Dynamics of larval patches: spatial distribution of fiddler crab larvae in Delaware Bay and adjacent waters. Mar. Ecol. Prog. Ser., 293:177-190. 293 Phillips, B. F., J. S. Cobb y R. W. George. 1980. General Biology. En: The biology and mnagement of lobsters. J. S. Cobb y B. F. Phillips (Ed.). Academic Press. New York. 1-82 pp. Pineda, J., 1994. Spatial and temporal patterns in barnacle settlement rate along a southern California rocky shore. Mar. Ecol. Prog. Ser., 107:125-138. 107 Pineda, J. y H. Caswell, 1997. Dependence of settlement rate on suitable substrate 129 area. Marine Biology, 129:541-548. Pineda, J., 1999. Circulation and larval distribution in internal tidal bore warm fronts. Limnol. Oceanogr., 44 (6):1400-1414. Pineda, J., 2000. Linking larval settlement to larval transport: assumptions, potentials and pitfalls. Oceanography of the Eastern Pacific, 1:84-105. Pineda, J. y M. López, 2002. Temperature, stratification and barnacle larval 22 settlement in two Californian sites. Continental Shelf Research, 22:11831198. Pope, J. A. y H. J. Thomas, 1967. Some biometric observations on Nephrops norvegicus (L.). J.Cons.Perm.Int.Explor.Mer, 31 (2)):265-271. 8. Referencias 136/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Prince, J. y R. Hilborn, 1998. Concentration profiles and invertebrate fisheries management. Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management Canadian Special Publication of Fisheries and Aquatic Sciences. G. S. Jamieson y A. Campbell (Ed.). 125: 187-196. Puente, E., 1990. La pesca con redes fijas de fondo en aguas vascas. Colección Itxaso nº7. Servicio Central de Publicaciones del Gobierno Vasco. VitoriaGazteiz. 121 pp. Puente, E., 1993. La pesca artesanal costera en aguas vascas. Colección Itsaso nº 11. Servicio Central Publicaciones, Gobierno Vasco (Vitoria). 191 pp. Puente, E., 1997a. Actividad de la flota de pesca con redes de enmalle del País Vasco en 1996. Informe interno AZTI Nº Ref.: RP97000-E20-03. 21 pp. Puente, E., 1997b. Aproximación al nivel de esfuerzo de la flota de pesca de enmalle del País Vasco en 1996. Informe interno AZTI Nº Ref.: RP97000-E20-02. 2 pp. Puente, E., 1997c. Pesca artesanal costera en aguas del País Vasco: Situación actual y consejo de gestión. Informe interno AZTI Nº Ref.: RP97000-E20-01. 42 pp. Puente, E., 2002. Estudio técnico-pesquero y socio-económico de las pesquerías artesanales costeras del País Vasco. Colección Itsaso nº25. Servicio Central Publicaciones, Gobierno Vasco (Vitoria). 152 pp. Queiroga, H., T. Cruz, A. Dos Santos, J. Dubert, J. I. Gonzalez-Gordillo, J. Paula, A. Peliz y A. M. P. Santos, 2007. Oceanographic and behavioural processes affecting invertebrate larval dispersal and supply in the western Iberia upwelling ecosystem. Progress In Oceanography, 74 (2-3):174-191. Rice, A. L. y R. W. Ingle, 1975. A comparative study of the larval morphology of the British Portunid crabs Macropipus puber (L.) and M. holsatus (Fabricius), with a discussion of generic and sub-familial larval characters within the Portunidae. Bull.British Mus., 28 (4)):123-151. Richards, L. J. y J. T. Schnute, 1998. Model complexity and catch-age analysis. Can.J.Fish.Aquat.Sci., 55:949-957. 55 Rios-Lara, V., S. Salas, B.-P. Javier y P. I.-. Ayora, 2007. Distribution patterns of spiny lobster (Panulirus argus) at Alacranes reef, Yucatan: Spatial analysis and inference of preferential habitat. Fisheries research, 87 (1):35-45. Rodhouse, D. M., 1984. Experimental fishing for the spider crab, Maja squinado: 64 sea and laboratory trials. J. Mar. Biol. Assoc. U.K., 64:251-259. 8. Referencias 137/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Roughgarden, J., S. Gaines y H. Possingham, 1988. Recruitment dynamics in complex life cycles. Science, 241:1460-1466. 241 Roughgarden, J., J. T. Pennington, D. Stoner, S. Alexander y K. Miller, 1991. Collision of upwelling fronts with the intertidal zone: the cause of recruitment pulses in barnacle populations of central California. Acta Oecologica, 12:35-51. 12 Rowe, S., 2002. Population parameters of American lobster inside and outside notake reserves in Bonavista Bay, Newfoundland. Fisheries research, 56 (2):167-175. Russ, G. R., A. C. Alcalá, A. P. Maypa, H. P. Calumpong y A. T. White, 2004. Marine reserve benefits local fisheries. Ecol. Applic., 14 (2):597-606. Sainte-Marie, B. y G. A. Lovrich, 1994. Delivery and storage of sperm at first mating of female Chionoecetes opilio (Brachyura: Majidae) in relation to size and morphometric maturity of male parent. Journal of Crustacean Biology, 14:508-521. 14 Sainte-Marie, B. y C. Carriére, 1995. Fertilization of the second clutch of eggs of snow crab, Chionoecetes opilio, from females mated once or twice after their 93 molt to maturity. Fishery Bulletin, 93:760-764. Sampedro, M. P., E. González-Gurriarán, J. Freire y M. R., 1999. Morphometry and sexual maturity in the spider crab Maja squinado (Decapoda : Majidae) in Galicia, Spain. Journal of Crustacean Biology, 19 (3):578-592. Sampedro, M. P., E. González-Gurriarán y J. Freire, 2003. Moult cycle and growth of Maja squinado (Decapoda : Majidae) in coastal habitats of Galicia, northwest Spain. Journal of the Marine Biological Association of the United Kingdom, 83 (5):995-1005. Sánchez, J. L., R. Goñi, O. Reñones, J. A. García Chartón, R. Galzin, J. Bayle, P. Sánchez-Jerez, A. Pérez Ruzafa y A. A. Ramos, 2000. Density dependence in marine protected populations: A review. Environ. Conserv., 27:144-158. 27 Schlegel, M. C., 1911. Sur le développement de Maia squinado. Latr. Comptes Rendues de la Academie des Sciences de Paris, 153:480-482. 153 Selgrath, J. C., K. A. Hovel y R. A. Wahle, en prensa. Effects of habitat edges on American lobster abundance and survival. Journal of Experimental Marine Biology and Ecology, In Press, Corrected Proof Proof. Sharp, W. C., W. A. Lellis, M. J. Butler, M. J. Herrnkind, J. H. Hunt, M. PardeeWoodring y T. R. Matthews, 2000. The use of coded microwire tags in markrecapture studies of juvenile Caribbean spiny lobster, Palinurus argus. Journal of Crustacean Biology, 20:510-521. 20 8. Referencias 138/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Sheehy, M. R. J., P. M. J. Shelton, J. F. Wickins, M. Belchier y E. Gaten, 1996. Ageing the European lobster Homarus gammarus by the lipofucsin in its eyestalk ganglia. Marine Ecology Progress Series, 143:99-111. 143 Sheehy, M. R. J., R. C. A. Bannister, J. F. Wickins y P. M. J. Shelton, 1999. New perspectives on the growth and longevity of the European lobster (Homarus gammarus). Can.J.Fish.Aquat.Sci., 56:1904-1915. 56 Sheehy, M. R. J. y R. C. A. Bannister, 2002. Year-class detection reveals climatic modulation of settlement strengh in the European lobster, Homarus gammarus. Can.J.Fish.Aquat.Sci., 59:1132-1143. 59 Smith, I. P., K. J. Collins y A. C. Jensen, 1998. Movement and activity patterns of the European lobster, Homarus gammarus, revealed by electromagnetic telemetry. Marine Biology, 132 (4):611-623. Smith, I. P., A. C. Jensen, K. J. Collins y E. L. Mattey, 2001. Movement of wild European lobsters Homarus gammarus in natural habitat. MArine EcologyProgress Series, 222:177-186. 222 Smith, M. T. y J. T. Addison, 2003. Methods for stock assessment of crustacean fisheries. Fisheries research, 65 (1-3):231-256. Smith, S. J. y M. J. Tremblay, 2003. Fishery-independent trap surveys of lobsters (Homarus americanus): design considerations. Fisheries research, 62 (1):6575. Stevcic, Z., 1973. Les migrations de l'Araignée de mer. Rapports de la Commision international de la Mer Méditerranée, 21:597-598. 21 Teissier, G., 1948. La relation d'allométrie sa signification statistique et biologique. Biometrics, 4:14-53. Templado, J., M. Calvo, A. Garvía, A. A. Luque, M. Maldonado y L. Moro, 2004. Guía de invertebrados y peces marinos protegidos por la legislación nacional e internacional. Naturaleza y Parques Nacionales. Serie Técnica. J. Templado y M. Calvo (Ed.). Ministerio de Medio Ambiente y Consejo Superior de Investigaciones Científicas. 214 pp. Templeman, W., 1939. Investigations into the life history of the lobster (Homarus americanus) on the west coast of Newfoundland, 1939. . Nfld. Dept. Nat. Resourc. Bull., 7:52. Tidu, C., R. Sarda, M. Pinna, A. Cannas, M. F. Meloni, E. Lecca y R. Savarino, 2004. Morphometric relationships of the European spiny lobster Palinurus elephas from northwestern Sardinia. Fisheries research, 69 (3):371-379. Tilburg, C. E., A. I. Dittel y C. E. Epifanio, 2007. Retention of crab larvae in a coastal null zone. Estuarine, Coastal and Shelf Science, 72 (4):570-578. 8. Referencias 139/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Tsukamoto, K., H. Kuwada, K. Uchida, R. Masuda y Y. Sakakura. 1999. Fish quality and restocking effectiveness: behavioural approach. En: Stock enhancement and sea ranching. B. Howell,E. Moksness y T. Svansand (Ed.). Blackwell Scientific Press. London, Uk. 205-218 pp. Tully, O. y P. O. Céidigh, 1987. The seasonal and diel distribution of lobster larvae (Homarus gammarus (Linnaeus)) in the neuston of Galway Bay. ICES Journal of Marine Science, 44 (1):5-9. Tully, O., V. Roantree y M. Robinson, 2001. Maturity, fecundity and reproductive potential of the European lobster (Homarus gammarus) in Ireland. Journal of the Marine Biological Association of the United Kingdom, 81 (1):61-68. Turner, S. J., S. F. Thrush, J. E. Hewitt, V. J. Cummings y G. Funnell, 1999. Fishing impacts and the degradation or loss of habitat structure. Fisheries Management and Ecology, 6:401-420. Ungfors, A., H. Hallback y P. G. Nilsson, 2007. Movement of adult edible crab (Cancer pagurus L.) at the Swedish West Coast by mark-recapture and acoustic tracking. Fisheries research, 84 (3):345-357. Valdés, L., E. González Gurriarán y M. T. Alvarez Ossorio, 1990. Incubación de huevos de "Necora puber": Desarrollo embrionario e influencia de la temperatura. Actas III Congreso Nacional de Acuicultura:337-341. Valdés, L., 1991. Influence of temperature on embryonic and larval development in 71 Necora puber (Brachyura,Portunidae). J. Mar. Biol. Ass. UK, 71:787-798. Van Der Meeren, G. I., 2000. Predation on hatchery-reared lobsters Homarus gammarus released in the wild. Canadian Journal of Fisheries and Aquatic Sciences, 57:1794-1803. 57 Van Der Meeren, G. I. y L. E. Uksnoy, 2000. A comparison of claw development and dominance between wild and cultured male European lobster Homarus gammarus. Aquaculture International, 8:77-94. Van Der Meeren, G. I., 2001. Effects of experience with shelter in hatchery-reared juvenile European lobsters Homarus gammarus. Marine & Freshwater Research, 52:1487-1494. 52 Van Der Meeren, G. I., 2005. Potential of ecological studies to improve survival of cultivated and released European lobsters, Homarus gammarus. New Zealand Journal of Marine and Freshwater Research, 39:399-424. 39 Wahle, R. A., 1998. A trans-Atlantic perpesctive on Homarus recruitment and enhancement. Proceedings of the seminar at Kvitsoy 1995: the European lobster Homarus gammarus (L.) G. I. Van der Meeren y O. Soldal (Ed.). Fisken og Havet 13: 36-43. 8. Referencias 140/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco Wahle, R. A., 2003. Revealing stock-recruitment relationships in lobsters and crabs: is experimental ecology the key? Fisheries research, 65 (1-3):3-32. Weber, L. I., R. G. Hartnoll y J. P. Thorpe, 2000. Genetic divergence and larval dispersal in two spider crabs (Crustacea: Decapoda). Hydrobiologia, 420:211-219. Wilder, D. G., 1949. Protect short lobsters by widening lath spaces. Fish.Res.Board Can. Atl.Biol.Stn.Circ., 14:1. 14 Wilhelm, G. 1995. Contribution a l´etude de l étrille Necora puber dans le MorBraz: données halieutiques, biologiques et pathologiques. PhD. Thesis. Universite de Rennes I, Rennes. 244 p. Willis, T. J., R. B. Millar, R. C. Babcock y N. Tolimieri, 2003. Burdens of evidence and the benefits of marine reserves: Putting Descartes before des horse? Environ. Conserv., 30:97-103. 30 Wing, S. R., L. W. Botsford y J. F. Quinn, 1998. The impact of coastal circulation on the spatial distribution of invertebrate recruitment, with implications for management. Proceedings of the North Pacific Symposium on Invertebrate Stock Assessment and Management Canadian Special Publication of Fisheries and Aquatic Sciences. G. S. Jamieson y A. Campbell (Ed.). 125: 285-294. Zariquiey, R., 1968. Crustáceos Decápodos Ibéricos. Investigación Pesquera. Consejo Superior de Investigaciones Científicas. Barcelona. 510 pp. 8. Referencias 141/143 © AZTI Tecnalia 2007 Crustáceos decápodos en el País Vasco ANEXO I. Modelo de diario de pesca FECHA: ESFUERZO Número de nasas Hora de salida Hora de llegada Cuando se calaron las nasas Profundidad ESPECIE Langosta Bogavante Nécora Quisquillón Centollo CAPTURAS Kg Número de individuos Kg Número de individuos Kg Número de individuos Kg Número de individuos Kg Número de individuos ZONA DE PESCA (señalar en el mapa) OBSERVACIONES 8. Referencias 143/143 © AZTI Tecnalia 2007 INFORMES TÉCNICOS PUBLICADOS Nº 1. I Reunión sobre la Paratuberculosis en España Nº 2. El alga "Gelidium" en la costa guipuzcoana Nº 3. Estudios sobre forrajes I Diagnóstico de la Pradera Permanente II Fertilización de praderas III Ensayos y Campañas 1986 IV Sistemas de transformación de monte a pradera V Forrajes conservados VI Valoración nutritiva de los alimentos en rumiantes VII Manejo del ganado en pastoreo Nº 4. Jornadas de estudio del Cangrejo de río Nº 5. Encuesta serológica sobre la difusión de algunas enfermedades del ganado Ovino Latxo Nº 6. Curso de implantación y mejora de praderas Nº 7. Encuesta de Helmintos, parásitos del ganado vacuno en Bizkaia Nº 8. El alga "Gelidium" en la Costa Vasca Nº 9. Estudio de la composición de las especies Anchoa, Sardina, Chicharro y Merluza del Golfo de Bizkaia, y su variación estacional Nº 10. La población de Nécora "Liocarcinus puber" en la Costa Vasca Nº 11. Diagnóstico de virus de la patata mediante la técnica E.L.I.S.A. (Enzym Linked Inmunosorbemt Assay) Nº 12. Ensayos de girasol y maíz forrajero en Álava (1987) Nº 13. Estudio de la variación estacional de la calidad y el rendimiento del Agar obtenido del Alga Roja "Gelidium sesquipedale" de la Costa Guipuzcoana Nº 14. Evaluación de la aptitud de la Anchoa del Golfo de Bizkaia "Engraulis encrasicholus" para la congelación Nº 15. Investigación forestal y selvicultura en Nueva Zelanda Nº 16. Estudio de la calidad de los silos de pradera natural elaborados en la Comunidad Autónoma Vasca Nº 17. Estudio anatómico de maderas Nº 18. Jornadas Técnicas. Foresta 1987 Nº 19. Observación sobre la floración, polinización y crecimiento del fruto de la actinidia en Bizkaia 1988 Nº 20. Estudio de la variación temporal de la hidrografía y el placton en la zona nerítica frente a San Sebastián Nº 21. Ensayos comparativos de cereales. Campaña 86/87 y 87/88 en el territorio de Alava Nº 22. Sistema en eje central en manzano y peral Nº 23. Informe técnico de la frigoconservación del kiwi (actinidia deliciosa) de Bizkaia y Gipuzkoa en la campaña 88-89 Nº 24. Estudio de las comunidades de moluscos de las rías de Euskadi (Cartografía y evaluación de la biomasa de los moluscos bivalvos de interés comercial de las rías de Fuenterrabia, Zumaya y Mundaca) Nº 25. Apuntes sobre patología caprina Nº 26. Resultados de un estudio de campo sobre el uso de la intradermorreacción comparativa para el diagnóstico de la tuberculosis bovina Nº 27. Jornadas técnicas sobre cultivos forrajeros. Fraisoro, mayo 1989 Nº 28. II Reunión sobre Paratuberculosis en España, S.I.M.A. Derio, 16-17 julio 1987 Nº 29. Cultivo in vitro de tejidos vegetales. Consideraciones sobre su situación actual 145 Nº 30. Biología y pesca del besugo (Pagellus bogaraveo B.) Nº 31. Ensayos comparativos de cereal. Campaña 88/89 en el Territorio Histórico de Alava Nº 32. Estudio hidrográfico, sedimentológico y de metales pesados en las rías de Bidasoa y Plencia Nº 33. Mamitis bovinas y calidad bacteriológica de la leche Nº 34. III Reunión sobre Paratuberculosis en España Nº 35. III Jornadas en tecnología pesquera y control de calidad de productos de pesca Nº 36. Cultivo fuera de suelo en horticultura Nº 37. Obtención y caracterización de antisueros específicos de bacterias patógenas de la patata Nº 38. El programa de control lechero y de selección en las razas latxa y carranzana de la Comunidad Autónoma Vasca Nº 39. Capacidad de recuperación de las praderas del alga agarofita gelidium sesquipedale sometida a explotación por arranque en el País Vasco Nº 40. Determinación de los aportes agrícolas, domésticos e industriales a los embalses alaveses Nº 41. Fertilización de mantenimiento en base al ciclo de nutrientes para las praderas permanentes de la C.A.P.V. Nº 42. II Workshop de Oceanografía costera del golfo de Vizcaya Nº 43. Resultados de Investigación 1991. Producción Vegetal Nº 44. La gestión de los recursos algales en el país Vasco: Comunidades naturales de Gelidium Sesquipedale, cosecha de arribazones y recuperación tras explotación por arranque y corte Nº 45. Jornadas de valorización de los productos de la pesca Nº 46. Reunión Ibérica. Grupo de sustratos de cultivo. Derio, 19 y 20 de febrero de 1991 Nº 47. Eficacia de la cipermetrina (HIGH-CIS) en el control de ectoparásitos (moscas y garrapatas) en rumiantes: ensayos de campo Nº 48. Departamento de Producción Vegetal. Resultados de Investigación 1992 Nº 49. Optimización de la Germinación y Enraizamiento de Plantas en Cámara Climatizada Nº 50. Calidad de aguas para cultivo de moluscos en el País Vasco, tres años de seguimiento (1990-1993) Nº 51. Teledetección y pesca de atún blanco en el EN Atlántico. Análisis de las campañas de Pesca 1990-1992 Nº 52. Estudio de la variación temporal de la hidrografía y el placton en la zona nerítica frente a San Sebastián entre 1988-1990 Nº 53. Informe sobre el estudio de la biología y cría de la gineta (Genetta Genetta L.) en cautividad Nº 54. Distribución y actividad de los ixodidos presentes en la vegetación de la Comunidad Autónoma Vasca Nº 55. Los nuevos usos del espacio rural. Trabajo de investigación socioeconómico y cultural de Valles Alaveses y de la Montaña Alavesa Nº 56. I Flora del País Vasco y Territorios limítrofes. I.- Claves provisionales de las familias y géneros Nº 57. Utilización de la escoria cristalizada de horno alto como sustrato de cultivo Nº 58. Enfermedades transmitidas por garrapatas al hombre y a los animales: situación en la Comunidad Autónoma del País Vasco Nº 59. Departamento de Producción Vegetal. Resultados de Investigación 1993 (I-II) Nº 60. Ensayos con Bioinsecticidas para el control de la procesionaria del pino (Thaumetopoea pitycampa D. & S.) Nº 61. Enraizamiento del X Cupresscyparis leylandii (Dall. y Sacks.) Dall. (Ciprés de Leyland) 146 Nº 62. Inventario de residuos agroalimentarios y orgánicos en la Comunidad Autónoma Vasca Nº 63. Resultados de Investigación 1994 - CIMA/SIMA (Dos tomos) Nº 64. Caracterización de variedades guipuzcoanas de maíz Nº 65. Patología de la reproducción en el ganado vacuno Nº 66. Evolución de los índices productivos del control lechero ovino (1982-1994) Nº 67. Clasificación de canales de ganado vacuno Nº 68. Estudio del proceso de maduración de la anchoa en salazón Nº 69. Manual de prácticas correctas de manipulación y seguridad para el laboratorio de microbiología de alimentos Nº 70. Manual para el establecimiento, conservación y utilización de material de referencia en un laboratorio de microbiología de alimentos Nº 71. Estudio faunístico del Parque Natural de Valderejo (Alava) Nº 72. Resultados de Investigación 1995. Tomo I Resultados de Investigación 1995. Tomo II (Dpto. de Producción Vegetal) Nº 73. Efectos de la introducción del arrastre pelágico por la flota vasca de bajura en las pesquerías de anchoa y atún blanco Nº 74. La calidad de aguas para cultivo de moluscos en el País Vasco, seis años de seguimiento (1990-1995) Nº 75. Estudio de las variaciones, a corto y largo término, de varios parámetros oceanográficos y meteorológicos de interés para las pesquerías del Golfo de Vizcaya Nº 76. "Lodos". Estudio del aprovechamiento de los lodos compostados de la E.D.A.R. de Crispijana en diversos cultivos de la provincia de Alava Nº 77. Resultados de Investigación 1996. Departamento de Producción Vegetal. Tomo I. CIMA-Arkaute / SIMA-Derio Nº 78. Desarrollo de un protocolo de PCR para la detección de ehrlichia phagocytophila. Primer estudio de prevalencia en el vector Nº 79. Departamento de Producción Vegetal. Resultados de Investigación 1996. Tomo II. Sección Horticultura. SIMA-Derio Nº 80. Departamento de Producción Vegetal. Resultados de Investigación 1997. Tomo I CIMA-Granja Modelo Nº 81. Jornadas de Utilización de Residuos Agrarios, Urbanos y Escorias de Siderurgia en Agricultura. Nº 82. Postproductivismo y medio ambiente. Perspectivas geográficas sobre el espacio rural. IX Coloquio de Geografía Rural Nº 83. Resultados deInvestigación 1998. Departamento de Producción y Protección Vegetal. NEIKER-Granja ModeloEl seguimiento de la calidad de aguas para cultivo de moluscos y marisqueo en el País Vasco. Nº 84. El seguimiento en la calidad de aguas para el cultivo de moluscos y marisqueo en el País Vasco. Nº 85. Resultados de Investigación 1999.Departamento de Producción y Protección Vegetal.NEIKER.Vitoria-Gasteiz,1999 Nº 86. Estado de los recursos marisqueros del País Vasco 1998-1999 (con especial atención a almeja y berberecho). Dpto. Oceanografía y Medio Ambiente Marino Nº 87. Establecimiento de las bases técnicas de cononocimiento del área de San Juan de Gaztelugatxe con vistas a su posible declaración como reserva marina.AZTI-UPVINSUB Nº 88. Establecimiento de las bases técnicas de conocimiento del área de Ízaro-Ogoño con vistas a su posible declaración como biotopo marino. AZTI Nº 89. Establecimiento de las bases técnicas de conocimiento de la rasa mareal de Algorri con viatas a su posible declaración como biotopo marino protegido. AZTI Nº 90. El seguimiento de la calidad de aguas para cultivo de moluscos y marisqueo en el País Vasco(1999-2000) 147 Nº 91. Normativa de Ordenación Territorial e Incidencia sobre el Medio Rural: el ejemplo de Donostialdea-Bidaso Nº 92. Resultados de investigación (Año 2000). Departamento de Producción y Protección Vegetal. NEIKER Nº 93. Estudio de los recursos de almeja y berberecho en Mundaka y Plentzia (19982000). AZTI Nº 94. Los seles: caracterización y análisis ambiental (Dima, Otxandio, Ubidea y Zeanuri Nº 95. Usos agrarios e iniciativas territoriales en Gipuzkoa. Juan Cruz Alberdi Collantes. Nº 96. Resultados de Investigación 2001. Departamento de Producción y Protección Vegetal. NEIKER Nº 97. Inventario de residuos orgánicos de la CAPV. Aritz Lekuona Rekalde et al. Nº 98. Ensayo del efecto de la alteración del sustrato en la explotación de recursos bivalvos. AZTI - Juan Bald Garmendia et al. Nº 99. Resultados de Investigación 2002. Departamento de Producción y Protección Vegetal. NEIKER Nº 100. El seguimiento de la explotación de Gelidum sesquipedale en el País Vasco: el estudio de arran- que y de la recuperación de las algas de Arribazón. Angel Borja Yerro et al. Nº 101. El recurso marisquero de percebe (Pollicipes pollicipes) en el biotipo marino protegido de Gaztelugatxe y en áreas explotadas de Bizkaia. Angel Borja Yerro et al. Nº 102. Los modelos y políticas de desarrollo rural. Claudia Areitio Gimeno et al. Nº 103. Convectividad ecológica del territorio y conservación de la biodiversidad. Nuevas perspectivas en Ecología del Paisaje y Ordenación Territorial. Mikel Gurrutxaga San Vicente Nº 104. Resultados de investigación 2003. Departamento de Biotecnología. NEIKER Nº 105. Estudio del estado de los recursos de almeja y berberecho en los estuarios Mundaka, Plentzia y Txingudi (1998-2004). Juan Bald Garmendia et al. Nº 106. Participación en sede ejecutiva de la CAPV en el ámbito comunitario. La experiencia del sector agropresquero: logros y retos durante el periodo 2000-2006. Maitena Moral Sesma Nº 107. Ordenación del territorio y medio rural en el País Vasco. Actuaciones positivas para una correcta gestión del suelo agrario. Juan Cruz Alberdi Collantes Nº 108 El seguimiento de la calidad de aguas para cultivo de moluscos y marisqueo en el País Vasco (1990-2004). Oihana Solaun Etxebarria Nº 109 Proyecto piloto de ensayo de siembra de almeja fina (Ruditapes Decussatus) en el estuario de Plantzia. Juan Bald Garmendia et al. Nº 110 Ongizatea Gipuzkoako baserrietan. Nº 111 La pesca artesanal de crustáceos decápodos mediante artes menores en el País Vasco. Juan Bald et al. 148 ISBN: 978-84-457-2827-7 Eusko Jaurlaritzaren Argitalpen Zerbitzu Nagusia Servicio Central de Publicaciones del Gobierno Vasco P.V.P.: 10 €