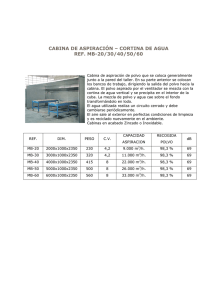
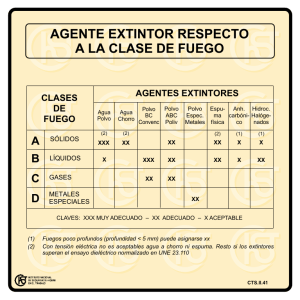
CARRERA DE MICROBIOLOGIA INDUSTRIAL
Anuncio

PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL EFECTO COMBINADO DE LAS ALTAS PRESIONES HIDROSTÁTICAS Y DEL POLVO DE ACEITUNA EN LA INACTIVACION DE Bacillus cereus EN UNA BEBIDA DE VEGETALES LINA MARIA VELASCO CUCAITA Director: ANTONIO MARTINEZ LOPEZ Ph.D. INSTITUTO DE AGROQUIMICA Y TECNOLOGIA DE ALIMENTOS (IATA) VALENCIA. ESPAÑA Codirectora: CARMEN FERRER BERNAT Asesora: ANA KARINA CARRASCO PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL BOGOTÁ, D.C. ENERO 2009 PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL EFECTO COMBINADO DE LAS ALTAS PRESIONES HIDROSTÁTICAS Y DEL POLVO DE ACEITUNA EN LA INACTIVACION DE Bacillus cereus EN UNA BEBIDA DE VEGETALES LINA MARIA VELASCO CUCAITA TRABAJO DE GRADO Presentado como requisito parcial Para optar al título de MICRIOBIÓLOGA INDUSTRIAL PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL BOGOTÁ, D.C. ENERO 2009 NOTA DE ADVERTENCIA Artículo 23 de la Resolución No13 de julio de 1946. "La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia". PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL EFECTO COMBINADO DE LAS ALTAS PRESIONES HIDROSTÁTICAS Y DEL POLVO DE ACEITUNA EN LA INACTIVACION DE Bacillus cereus EN UNA BEBIDA DE VEGETALES APROBADO ______________________ Antonio Martínez López PhD. Director ____________________ Carmen Ferrer Bernat Lic. Tecnología Alimentos U.P.V ____________________ Ana Karina Carrasco MsC. ______________________ Jurado ____________________ Jurado PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL EFECTO COMBINADO DE LAS ALTAS PRESIONES HIDROSTÁTICAS Y DEL POLVO DE ACEITUNA EN LA INACTIVACION DE Bacillus cereus EN UNA BEBIDA DE VEGETALES LINA MARIA VELASCO CUCAITA APROBADO ______________________ Ingrid Schuler PhD. Decana académica Facultad de Ciencias ____________________ Janeth del Carmen Arias M.Sc- M.Ed Directora carrera de Microbiología Industrial DEDICATORIA A mi familia, a mi madre quién con sus oraciones en la distancia siempre supo como animarme a seguir adelante. A mis hermanos, que han sido mi mayor apoyo y un ejemplo a seguir. A Julio R. Sánchez, quién hizo que en tierras lejanas me sintiera como en casa. AGRADECIMIENTOS Al Dr. Antonio Martínez López, vicedirector del Instituto de agroquímica y Tecnología de alimentos IATA, por brindarme la oportunidad de hacer parte de su equipo de trabajo. A la Licenciada Carmen Ferrer Bernat, investigadora del Instituto de agroquímica y Tecnología de alimentos IATA por su colaboración para sacar adelante este trabajo de grado. A la Dra. Aurora Marco, funcionaria del Instituto de agroquímica y Tecnología de alimentos IATA, por su infinita paciencia, su dedicación y su espíritu de colaboración. A Daniela Saucedo Reyes, becaria del Instituto de agroquímica y Tecnología de alimentos IATA, por su valiosa colaboración y su apoyo, más que una compañera de trabajo una amiga incondicional. A la profesora Ana Karina Carrasco, profesora de la Pontificia Universidad Javeriana, Bogotá, por asesorarme y colaborarme con la realización de esta investigación Gracias a todos………… TABLA DE CONTENIDOS Página INTRODUCCIÓN 1 1. JUSTIFICACIÓN Y PLANTEAMIENTO DEL PROBLEMA 4 2. OBJETIVOS 6 2.1. Objetivo general 6 2. 2. Objetivos específicos 6 3. MARCO TEÓRICO 7 3.1. BEBIDA VEGETAL 7 3. 1.1. Inactivación enzimática 8 3. 1. 2. Compuestos bioactivos 9 3. 1. 3. Biodisponibilidad de nutrientes 9 3. 2. CONTROL MICROBIOLOGICO 10 3. 3. TRATAMIENTOS TÉRMICOS DE CONSERVACIÓN 10 3. .3. 1. Esterilización 11 3. 3. 2. Pasteurización 11 3. 3. 3. Escaldado 11 3. 4. CARACTERÍSTICAS DEL ALIMENTO A TENER EN CUENTA PARA ELEGIR EL TRATAMIENTO TÉRMICO 12 3. 4. 1. pH 12 3. 4. 2. Viscosidad 12 3. 4. 3. Caracterización microbiológica del producto 13 3. 5. PROCESADO MÍNIMO DE ALIMENTOS VEGETALES: 13 NUEVAS TECNOLOGIAS DE CONSERVACION NO TERMICAS 3. 5. 1. Aditivos naturales 14 3. 5. 2. Altas Presiones Hidrostáticas (APH) 14 3. 5. 3. Pulsos eléctricos de alta intensidad 14 3. 5. 4. Campos magnéticos oscilatorios 15 3. 5. 5. Ultrasonidos de alta intensidad 15 3. 5. 6. Irradiación 15 3. 6. DESCRIPCIÓN DEL MICROORGANISMO DE ÍNTERES (Bacillus cereus) 16 3. 6. 1. Género Bacillus 16 3. 6. 2. Bacillus cereus 16 3. 6. 3. Características generales 16 3. 6. 4. Hábitat y condiciones de crecimiento 17 3. 6. 5. Aislamiento e identificación 18 3. 6. 6. Infección alimentaria por Bacillus cereus 18 3.7. LA ESPORA BACTERIANA 19 3. 7. 1. Estructura de la espora 21 3. 7. 1. 1. Exosporium 22 3. 7. 1. 2. Cubiertas esporales 22 3. 7. 1. 3. Córtex 22 3. 7. 1. 4. Membrana interna o intina 23 3. 7. 1. 5. Protoplasto 23 3. 8. PROCESO DE ESPORULACIÓN 24 3. 9. PROCESO DE ACTIVACIÓN DE LA ESPORA 27 3. 9. 1. PROCESO DE GERMINACION DE LA ESPORA 28 3. 10. SUSTANCIAS ANTIMICROBIANAS 29 3. 10. 1. Absorción de los biocidas y su respuesta en las células 30 3. 10. 2. Objetivo de acción de un biocida 30 3. 10. 3. Clasificación de los antimicrobianos 31 3. 10. 4. Antimicrobianos de origen químico 31 3. 10. 5. Antimicrobianos de origen natural 32 3. 10. 6. Polifenoles y su efecto antimicrobiano 33 3. 10. 6. 1. Propiedades del polvo de aceitunas como antimicrobiano 35 3. 11. FUNDAMENTOS Y DEFINICIONES DE LAS ALTAS PRESIONES HIDROSTTICAS 36 3. 11. 1. Aspectos técnicos de las Altas Presiones Hidrostáticas 39 3. 11. 1. 1. Generación de la Alta presión 39 3. 11. 1. 2. Operación de una cámara de Alta Presión Hidrostática 42 3. 11. 2. Descripción general de un sistema de Alta Presión industrial 43 3. 12. EFECTOS BIOLÓGICOS DE LA ALTA PRESIÓN 44 3. 12. 1. Efectos sobre los microorganismos 45 3. 12. 2. La alta presión hidrostática y las reacciones bioquímicas 47 3. 3. 13. Efecto de las Altas Presiones sobre los alimentos 51 3. 12. 2. 1. Agua 51 3. 12. 2. 2. Lípidos 51 3. 12. 2. 3. Carbohidratos 52 3. 12. 2. 4. Proteínas 52 3. 12. 2. 5. Enzimas 52 3. 12. 2. 6. Vitaminas 53 3. 12. 4. Aplicación de las Altas Presiones en jugos de frutas y/o vegetales 54 3. 13. MODELOS CINÉTICOS DE INACTIVACIÓN Y CRECIMIENTO MICROBIANO. 54 3. 13. 1. Modelos matemáticos de inactivación 55 3. 13. 1. 1. Modelo de Bigelow 55 3.13. 1. 2. Modelos de Weibull 56 3. 13. 2. Modelos matemáticos de crecimiento 58 3. 13. 2. 1. Modelo de Baranyi 58 3. 13. 2. 2. Modelo de Gompertz 59 4. MATERIALES Y MÉTODOS 61 4.1. Esporulación del microorganismo 61 4. 2. Recuento de Bacillus cereus 62 4. 3. Ingrediente utilizado como antimicrobiano 62 4. 4. Preparación del medio de referencia 63 4. 5. Efecto del polvo de aceitunas sobre el crecimiento de Bacillus cereus en función del tiempo en medio de referencia 63 4.6. Preparación de la bebida vegetal 63 4. 7. Efecto del polvo de aceituna en el crecimiento de Bacillus 64 cereus en sustrato vegetal 4. 8. Prelación de los viales para el tratamiento con APH 64 4. 9. Tratamiento a Altas Presiones Hidrostáticas APH 65 4. 10. Efecto de las Altas Presiones y el polvo de aceitunas en la inactivación de Bacillus cereus en medio de referencia 66 4. 11. Efecto de las Altas Presiones y el polvo de aceitunas en la inactivación de Bacillus cereus en la bebida vegetal 67 4. 12. Modelización 67 4. 12. 1. Desarrollo del modelo 67 4. 13. Análisis estadístico 68 5. DISCUSIÓN DE RESULTADOS 69 5. 1. Efecto del polvo de aceituna en medio de referencia y bebida vegetal 69 5. 2. Efecto de las Altas Presiones Hidrostáticas en medio de referencia y bebida vegetal 77 5. 3. Efecto del tiempo de tratamiento con APH en la bebida de vegetales 82 6. CONCLUSIONES 85 7. RECOMENDACIONES 86 8. REFERENCIAS BIBLIOGRAFICAS 87 9. ANEXOS 100 9.1. ANOVA SIMPLE ENTRE PRESIONES Y CONCENTRACIONES PARA MEDIO DE REFERENCIA 100 9. 2. ANOVA MULTIPLE ENTRE MEDIO DE REFERENCIA Y BEBIDAVEGETAL (10 MINUTOS) 103 9. 3. ANOVA MULTIPLE ENTRE 10 Y 25 MINUTOS DE 105 TRATAMIENTO EN BEBIDA VEGETAL LISTA DE TABLAS Página Tabla 3.1. Resumen de Condiciones de crecimiento para Bacillus cereus 18 Tabla 6.1. Valores medios y desviación estándar de la población de 70 B. cereus (Log N (UFC/ml)) en medio de referencia a diferentes temperaturas y concentraciones de polvo de aceitunas tras 24 horas de almacenamiento Tabla 6. 2. Valores medios y de desviación estándar para la tasa 72 máxima de crecimiento (µmax) y la fase de latencia (λ) a diferentes condiciones de estudio en medio de referencia Tabla 6. 3. Valores medios y desviación estándar de logaritmo de la 76 fracción de recuentos de B. cereus después de 24 horas de almacenamiento a diferentes condiciones de estudio en sustrato vegetal Tabla 6. 4. Valores medios y desviación estándar de la población de 79 B. cereus (N/N0), en medio de referencia y bebida vegetal, sometidos a tratamiento por APH a 200, 400 y 500 MPa (10 min) y con diferentes concentraciones de polvo de aceitunas Tabla 6. 5. Valores medios y desviación estándar de Log N/No de B. cereus, después de 24 horas de almacenamiento en sustrato vegetal con APH con dos tiempos de tratamiento a APH 84 LISTA DE FIGURAS Página Figura 3. 1. Estructuras químicas de compuestos fenólicos identificados en un extracto acuoso procedente de residuos de la industria de las aceitunas. Figura 3. 2. Compresión directa. Figura 3. 3. Compresión indirecta. Figura 3. 4. Sistema de Altas Presiones Hidrostáticas a nivel industrial Figura 3. 5. Productos hechos en base a frutas y verduras en el mercado tratados con APH. Figura 3. 6. Zumos en el mercado tratados con APH. Figura 3. 7. Ejemplo de curva de supervivencia de esporas de B. stearothermophilus a temperatura constante (115 ºC) Figura 4.1 Dilución y siembra de las muestras tratadas Figura 4. 2. Unidad de Altas Presiones Hidrostáticas. Fuente: Instituto de Agroquímica y Tecnología de Alimentos (IATA). 35 40 41 44 49 50 56 62 66 Figura 6. 1. Ejemplo de curvas de crecimiento al 2.5 % de polvo de 70 aceituna a las diferentes temperaturas estudiadas Figura 6. 2. Ejemplo de curva de crecimiento de B. cereus log N 73 (UFC/ml) en la bebida vegetal sin polvo de aceitunas y con una concentración del 2,5% almacenado a una temperatura de 20 ºC. Figura 6. 3. Ejemplo de curva de crecimiento de B. cereus Log N 74 (UFC/ml) en la bebida vegetal sin polvo de aceituna y con una concentración del 1,5% almacenado a una temperatura de 32 ºC. Figura 6. 4. Ejemplo de curva de crecimiento de B. cereus Log N 74 (UFC/ml) en la bebida vegetal sin polvo de aceituna y con una concentración del 1,5% almacenado a una temperatura de 20 ºC. Figura 6. 5. Curva de crecimiento de fracción de B.cereus Log N 75 (UFC/ml), comparando con el control en presencia de 2.5% de polvo de aceituna a 32 ºC de almacenamiento. Figura 6. 6. Comparación del logaritmo de recuento de B. cereus entre medio de referencia bebida de vegetales a diferentes presiones sin polvo de aceitunas Figura 6. 7. Comparación del logaritmo de recuento de B. cereus entre medio de referencia y bebida vegetal a diferentes presiones en presencia de polvo de aceitunas a 200 MPa Figura 6. 8. Comparación del logaritmo de recuento de B. cereus entre medio de referencia y bebida vegetal a diferentes presiones en presencia de polvo de aceitunas a 500 MPa 77 77 78 Figura 6. 9. Efecto de la presión y la concentración de polvo de 80 aceitunas sobre la población de B. cereus en medio de referencia y bebida vegetal, sometidos a 10 min de tratamiento con APH. Figura 6. 10. Comparación del logaritmo de recuento de B. cereus 82 entre dos tiempos de tratamiento con APH diferentes. Figura 6.11 Efecto del tiempo de tratamiento con APH sobre la población de B. cereus (N/N0) en bebida vegetal a las diferentes presiones y concentraciones de polvo de aceitunas estudiadas 83 Resumen La reciente demanda de los consumidores por productos listos para comer que sean similares en apariencia y valor nutricional a los alimentos “frescos”, han conducido a una creciente investigación en el uso de tecnología no térmicas de conservación, como es el caso de las Altas Presiones Hidrostáticas (APH) y el empleo de conservantes de origen natural, como los extractos de plantas, con el objetivo de sustituir el tratamiento térmico y el uso de conservantes químicos que poseen desventajas en términos de calidad de los alimentos. El presente estudio evalúa el efecto antimicrobiano del polvo de aceituna en diferentes concentraciones (0, 1,5, 2,5 y 5%) para el control de esporas de Bacillus cereus en medio de referencia (caldo de infusión cerebro corazón) y en una bebida de vegetales elaborada a partir de zanahorias y judías verdes. Además, se evalúo también el efecto de la APH (Alta Presión Hidroestática) que fue estudiado en 200, 400 y 500 MPa, en los diferentes sustratos y para las diferentes concentraciones de polvo de aceituna. Los resultados obtenidos sugieren que el polvo de oliva tiene un efecto bacteriostático en la concentración del 2.5 %; por lo tanto esto podría ser usado como una medida de control adicional en combinación con tratamientos físicos y el almacenamiento a bajas temperaturas, prolongando la vida útil de la bebida vegetal susceptible a contaminarse por la presencia de esporas de Bacillus cereus, lo cual es un riesgo para la salud humana No obstante los tratamientos con APH, en presencia o ausencia de polvo de aceituna, no presentaron un efecto importante desde el punto de vista microbiológico, ya que el número de reducciones logarítmicas alcanzadas no fue significativo como para garantizar la seguridad microbiológica de bebida. Abstract The recent consumer demands on ready to eat, that they are similar by all appearances and nutritional value to the “like fresh”, products leads to the increasing research in the use of technology not thermal of conservation application of new not thermal technologies of conservation, as is the case of High Hydrostatic Pressures (HHP), and the use of natural preservative compounds, especially plant extracts. With the aim to replace the thermal treatment and the use of chemistry additives that possess disadvantages in field quality food. The present study evaluates the antimicrobial effect of olive powder in different concentrations (0, 1,5, 2,5 and 5%) to control Bacillus cereus spores on reference media (Brain Heart Infusion Broth) and a vegetable beverage based on carrots and green beans. Moreover, the effect of HHP (high hydrostatic pressure) was studied at 200, 400 and 500 MPa, in the different substrates and for the different concentrations of olive powder. The obtained results suggest that olive powder has a bacteriostatic effect at 2.5% concentration; therefore it could be used as an additional control measure in combination with other physical treatments and low temperature storage prolonging the life of the vegetable beverage wich is susceptible to contamination by the presence of Bacillus cereus spores becoming a risk to human health. However, HHP treatments, in the presence or absence of olive powder, did not present an important effect from the microbiological point of view, as the number of logarithm reductions achieved was not significant to ensure the beverage safety. INTRODUCCIÓN La alimentación es un proceso necesario para todos los organismos, que tiene que producirse cumpliendo determinados requisitos en dependencia de requerimientos nutricionales específicos, así la demanda por parte de los consumidores de alimentos sanos que aporten nutrientes y energía necesarios para la vida diaria es un tema de interés científico. Los cambios demográficos y sociales producidos en los últimos diez años, han ejercido un efecto muy marcado sobre el consumo de alimentos tanto en España como en el conjunto de países Europeos. Cada día aumenta el número de consumidores interesados en conocer con exactitud la composición de los alimentos que ingieren y el efecto de la dieta en su salud, bienestar y en la prevención de determinadas enfermedades degenerativas. Resulta necesario pensar en sistemas de conservación de alimentos que eviten la contaminación con microorganismos deteriorantes y patógenos, no obstante muchos métodos de conservación afectan considerablemente a los alimentos, los tratamientos como el calor o la adición de conservantes químicos afectan no solamente el valor nutricional sino las cualidades sensoriales de los alimentos. La gran mayoría de los alimentos que consumimos a diario son perecederos y se deterioran con el paso del tiempo cuando no existe un método adecuado de conservación. Diferentes cambios físicos, químicos y reacciones enzimáticas tienen lugar en los alimentos dando como resultado la proliferación de microorganismos indeseables que pueden alterar los alimentos e incluso causar enfermedad en el ser humano. Muchas de las tecnologías de conservación de microorganismos pueden inhibir el crecimiento microbiano (temperaturas bajas, reducción de la actividad de agua, acidificación, y adición de conservantes). Sin embargo, estas tecnologías no son suficientes ya que no eliminan las formas de resistencia como el caso de las esporas bacterianas. 1 Los frutos y hortalizas han de ser procesados y conservados por conveniencia y razones económicas, lo que implica numerosos cambios desde el momento de la cosecha, durante las operaciones de acondicionamiento, procesamiento, almacenamiento, hasta que es adquirido y consumido fresco o cocinado por el consumidor. Todos estos cambios suponen un impacto potencial en los compuestos fitoquímicos y en las propiedades antioxidantes de estos productos vegetales así como en las propiedades beneficiosas para la salud que poseen en fresco (Cano et al., 2005). En términos de inactivación microbiana el tratamiento térmico es el más utilizado. La eliminación de microorganismos usando altas temperaturas da como resultado alimentos más estables y seguros. Sin embargo el proceso implica altos costos en términos de uso de energía y alteración de las propiedades del alimento como sabor, color y el valor nutricional. Por estas limitaciones y debido a la demanda creciente por parte de los consumidores de alimentos de alta calidad, seguros y agradables al gusto, se han desarrollado nuevas tecnologías para inactivar microorganismos como es el caso de las Altas Presiones Hidrostáticas (APH). Por otra parte en los últimos años se han adelantado muchas investigaciones sobre antimicrobianos de origen natural a modo de alternativa a los antimicrobianos químicos tradicionales. Muchos estudios demuestran que el uso combinado de tecnologías no térmicas como las Altas Presiones Hidrostáticas (APH) y de antimicrobianos de origen natural como aceites esenciales de plantas o extractos en polvo, suponen un efecto sinérgico que permite mantener poblaciones microbianas controladas en alimentos manteniendo niveles permisibles para el consumo humano, cumpliendo con la legislación vigente en cuanto al tema de la seguridad alimentaria y en respuesta de la alta demanda de alimentos seguros. Las investigaciones sobre antimicrobianos de origen natural han aumentado en los últimos años, no obstante muchos aceites esenciales y extractos de plantas con propiedades antimicrobianas no están autorizados para su uso como aditivos en alimentos. Un ejemplo de antimicrobiano de origen natural autorizado por las autoridades sanitarias en España es el olive powder ó polvo de aceitunas. Este ingrediente alimentario se utiliza en panadería. En las aceitunas de este ingrediente hay polifenoles, los cuales han mostrado una interesante actividad antimicrobiana. 2 En el presente trabajo, se estudiará el efecto de las Altas Presiones Hidrostáticas y el polvo de aceitunas a diferentes concentraciones frente a esporas de Bacillus cereus en un medio de referencia caldo BHI y posteriormente en una bebida de vegetales elaborada a base de zanahorias y judías verdes. 3 1. JUSTIFICACION Y PLANTEAMIENTO DEL PROBLEMA Las nuevas demandas de los consumidores por productos saludables y con un valor funcional agregado unido al desarrollo de nuevas tecnologías, está impulsando el desarrollo del sector de aditivos de origen natural. El resultado es una amplia gama de productos que se adaptan a las necesidades de todo tipo de consumidores. Por otro lado la creciente alarma social por el uso de conservantes artificiales en la elaboración de alimentos impulsa a sustituir aditivos artificiales por ingredientes naturales. Numerosos estudios epidemiológicos asocian una dieta rica en productos de origen vegetal con una menor predisposición a padecer ciertas enfermedades degenerativas como cáncer y enfermedades cardiovasculares, Para el desarrollo de este proyecto de investigación se elaborará una bebida con dos ingredientes: zanahorias y judías verdes. Se evaluará en ella la capacidad antimicrobiana de un ingrediente alimentario (polvo de aceitunas) actualmente comercializado como ingrediente en productos de panadería. En estudios previos (Serra y col. 2008 y Pereira y col. 2007) sobre aceitunas demuestran que estás poseen un amplio espectro de actividad antimicrobiana. En el caso de alimentos mínimamente procesados entre ellos bebidas de vegetales, Bacillus cereus es un microorganismo alterador y patógeno difícil de controlar por su capacidad de producir esporas resistentes que pueden germinar durante el almacenamiento de la bebida ó bien si se interrumpe la cadena de frío. Para inactivar esporas de Bacillus cereus se estudiará experimentalmente el efecto combinado de las Altas Presiones Hidrostáticas y diferentes concentraciones de Polvo de aceitunas. Tradicionalmente el tratamiento térmico es el más utilizado para evitar la contaminación y deterioro de muchos alimentos, no obstante dicho tratamiento altera el sabor, la textura, el color y el valor nutricional de los alimentos. Existen también tratamientos térmicos suaves 4 de conservación como la pasteurización con el inconveniente de que los alimentos tratados deben ser inmediatamente almacenados en refrigeración y pueden aparecer después bacterias patógenas esporuladas sin que la refrigeración evite su desarrollo. Bajo estas premisas la industria tiene que adaptarse para desarrollar alimentos sometidos a métodos de conservación menos drásticos para satisfacer las necesidades actuales del consumidor. Es así como las Altas Presiones Hidrostáticas son una alternativa al uso de tratamientos térmicos. La presente investigación tiene un impacto socio- económico en la medida que la materia prima empleada en la elaboración de la bebida es muy asequible en países como Colombia. Conocer acerca de tecnologías como las Altas Presiones Hidrostáticas, hace posible pensar en implementarlas en un futuro, para aumentar la calidad de los productos alimenticios producidos en Colombia y proyectar la incursión en el mercado mundial de alimentos mínimamente procesados. El interés científico de esta investigación gira en torno a obtener resultados que revelen la utilidad de combinar tecnologías nuevas con aditivos alimentarios que puede tener actividad antimicrobiana para prolongar la vida útil de la bebida, además de obtener un producto de origen natural con un valor agregado de poseer compuestos bioactivos (antioxidantes, vitaminas, flavonoides, etc.) 5 2. OBJETIVOS 2.1. Objetivo general Evaluar el efecto conjunto de los tratamientos con altas presiones hidrostáticas y del polvo de aceitunas como posible antimicrobiano sobre el crecimiento e inactivación de esporas Bacillus cereus y su uso potencial en alimentos. 2.1. Objetivos específicos 1 Desarrollo de una nueva bebida de vegetales con características organolépticas agradables y que a su vez, sirva como sustrato de tratamiento para medir el efecto de las Altas Presiones y el Polvo de aceitunas. 2 Aplicar tratamientos de altas presiones con antimicrobiano a escala de laboratorio primero en sustrato de referencia y luego en sustrato vegetal. 3 Aplicar estos tratamientos en alimentos mínimamente procesados (bebida de vegetales) y evaluar su utilidad en términos de alargar la vida útil del producto. 4 Modelizar matemáticamente los datos obtenidos experimentalmente ajustándolos a modelos matemáticos conocidos. 6 3. MARCO TEÓRICO 3.1 BEBIDA VEGETAL Los jugos son una bebida refrescante y nutritiva. Aportando al organismo aquellos nutrientes y además son una forma original de tomar ciertos alimentos entre ellos vegetales que no muy atractivos en su preparación tradicional. Aunque los zumos más comunes sean los de frutas, los zumos de verduras y hortalizas son también un buen complemento a la alimentación y en los últimos años distintas industrias del sector de producción de zumos han sacado al mercado jugos de vegetales por ejemplo, HERO España, Coca cola Company en España con Minute Vergelia, Granini, España. En Latinoamérica el consumo de este tipo de bebidas no es masivo no obstante, Herdez. México que comercializa zumos en toda Latinoamérica con su línea de “jugos de vegetales”. En Colombia estas bebida de vegetales se comercializan en supermercados tipo gourmet, no son bebidas tratadas, puesto que en Colombia hay oferta de vegetales frescos todo el año; sin embrago, al no ser tratadas las bebidas tienen un vida útil muy corta que no permite almacenarlas por intervalos de tiempo muy extensos. La bebida de vegetales utilizada como sustrato en este estudio se compone de dos ingredientes, zanahorias y judías verdes. La zanahoria (Daucus carota) es una fuente de vitaminas A y K, minerales como calcio y potasio, fibra y pigmentos, por otra parte las judías verdes (Phaseolus vulgaris var. vulgaris) contiene vitaminas A, C, B1, B3, B6 y B12; minerales como: potasio, calcio, fósforo, hierro, magnesio, cromo, yodo; también ácido fólico y beta caroteno (Biesalki y Tinz, 2008). Durante el procesado de las zanahorias y las judías ocurren diferentes cambios físicos y químicos por ejemplo la rotura del tejido por el corte supone un incremento de la intensidad respiratoria y transpiración además de favorecer determinadas reacciones enzimáticas (polifenoloxidasa, peroxidasa, pectinasas, ascorbato oxidasa, etc) que conducen a un rápido deterioro del producto, con posible pérdida de alguna de sus características sensoriales, nutricionales y propiedades beneficiosas para la salud. Además, el corte aumenta la superficie de tejido susceptible de alteraciones microbianas, por lo que la seguridad de los 7 frutos mínimamente procesados cortados en fresco es una de las principales preocupaciones de investigadores y productores (Cano et al., 2007) Las bebidas funcionales se pueden definir como productos que poseen componentes fisiológicos que complementan su aporte nutricional y que representan un beneficio extra para la salud de las personas, como por ejemplo en el metabolismo del colesterol, la mineralización ósea y la reducción de riesgos de enfermedad. Existen al menos tres categorías principales de bebidas funcionales; las bebidas enriquecidas (jugos y aguas con vitaminas y minerales), bebidas isotónicas y las bebidas energéticas o estimulantes Las bebidas a base de vegetales sean o no funcionales presentan muchas ventajas en términos de nutrientes y aporte de energía sin embargo, esta son susceptibles a la contaminación microbiana más aún cuando las condiciones de almacenamiento no son adecuadas, B cereus es un microorganismo patógeno en alimentos que se ha asilado con mucha frecuencia de bebidas de este tipo (Chen. J. L. et al. 2008) El procesamiento térmico de jugos cítricos a altas temperaturas si bien elimina la posibilidad de daño microbiológico y reduce la actividad enzimática, afecta la calidad del producto, produce la pérdida de componentes termolábiles y termosensibles responsables de las propiedades sensoriales y nutricionales de los alimentos. La calidad de los alimentos esterilizados difieren mucho de los frescos, particularmente el aroma, las vitaminas y componentes volátiles de estos productos son influenciados dramáticamente por los tratamientos térmicos. Por otra parte tratamientos no térmicos como las APH influyen de manera menos agresiva en los productos vegetales de tal manera que se pueden encontrar una serie de ventajas en diferentes aspectos como: 3. 1. 1. Inactivación enzimática La efectividad de los tratamientos de APH sobre la inactivación enzimática depende de variables del tratamiento (presión, tiempo, temperatura), de la composición del alimento y del tipo de enzima. Para la desactivación de enzimas relacionadas con la pérdida de calidad de los alimentos vegetales (peroxidasas (POD), lipoxigenasas (LOX), pectinmetilesterasas (PME), etc.) (Knorr,1995; Seyderhelm et al., 1996; Cano et al., 1997; Hendrix et al.,1998; 8 Hernández; Cano et al., 1999; Palou et al., 2000; Plaza et al., 2003; Tangwongchai et al., 2000; Crelier et al., 2001). Probablemente las polifenoloxidasas (PPO) sean las enzimas más estudiadas en relación con la efectividad de los tratamientos APH, debido a los graves problemas de calidad sensorial relacionados con su actividad (pardeamiento enzimático) (Weemaes et al., 1998; Cano et al., 1997; Hernández y Cano, 1998). 3. 1. 2. Compuestos Bioactivos. El efecto de los tratamientos de APH sobre los compuestos bioactivos (vitaminas A, C y E, Carotenoides: licopeno, -caroteno, luteína, zeaxantina, criptoxantina y flavonoides) presentes en distintos productos vegetales. En general, los carotenoides con actividad antioxidante (licopeno, criptoxantina, -caroteno, zeaxantina), no son afectados por los tratamientos de APH solos o combinados con calor. 3. 1. 3. Biodisponibilidad de nutrientes. El efecto de los tratamientos de APH sobre los compuestos bioactivos (vitaminas A, C y E, Carotenoides: licopeno, -caroteno, luteína, zeaxantina, criptoxantina y flavonoides) presentes en distintos productos vegetales no se ven afectados por tratamientos a APH. Por lo tanto la biodisponibilidad de compuestos tampoco se ve afectada (Cano et al., 2007). 9 3. 2. CONTROL MICROBIOLÓGICO La contaminación microbiológica es uno de los problemas más importantes en el desarrollo de este tipo de alimentos. Aunque la composición, propiedades físico-químicas y naturaleza del fruto entero de partida determinan en gran medida la predisposición al ataque de un tipo u otro microorganismos será el proceso de elaboración y en especial las fases de pelado y corte de los productos, cuando se destruye la barrera natural de protección del vegetal y se facilita la disponibilidad de nutrientes celulares liberados (azúcares, etc.), favoreciendo la contaminación con microorganismos alterantes y/o patógenos (Nguyen,1994; Bracket, 1997). Los alimentos mínimamente procesados que presentan valores de pH y actividad de agua (aw) altos (pH 4.6 y aw 0.85) son considerados como alimentos altamente perecederos si no se realiza ningún proceso de conservación (Willey, 1997). 3. 3. TRATAMIENTOS DE CONSERVACION TÉRMICA Los zumos de frutas y verduras son productos muy sensibles a la pérdida de sus características organolépticas más importantes: • Pérdida de color. • Modificación del aroma. • Destrucción de vitaminas. • Desnaturalización de proteínas. • Cambios físicos. Por lo general, el almacenamiento de las materias primas y los jugos de fruta frescos, se realiza a temperaturas de refrigeración, ya que se ha observado que a temperaturas superiores se incrementa el pardeamiento no enzimático (reacción de Maillard, caramelización de azúcares, reacción oxidativa de ácido ascórbico) y como resultado una disminución en la calidad sensorial y valor nutritivo de los jugos frescos(Selman. 1994). El tratamiento térmico altera en mayor medida las características del jugo y acelera las reacciones de deterioro descritas anteriormente. 10 Desde hace varias décadas, el tratamiento de conservación por calor, ha sido la tecnología más utilizada para la conservación de alimentos. A través de los años, se ha conseguido la elaboración de alimentos microbiológicamente seguros y con baja actividad enzimática, pero en detrimento de la calidad del producto. Los dos métodos mas utilizados hoy en día para la conservación de alimentos son la esterilización y la pasterización. 3. 3. 1. Esterilización La esterilización comercial es un tratamiento de conservación por calor que tiene como objetivo inactivar la totalidad de microorganismos patógenos y alteradores, y de enzimas presentes en el alimento permitiendo prolongar la vida útil del producto en condiciones microbiológicamente seguras a temperatura ambiente. Por lo general este tratamiento se denomina también HTST (high temperature-short time) o UHT (ultra high temperature) que supone aplicar temperaturas de proceso entre 100-120 ºC durante un periodo corto de tiempo 2-5 segundos (Aleixandre, 1994). 3. 3. 2. Pasteurización La pasteurización es un tratamiento de conservación por calor que tiene como objetivo inactivar la mayoría de microorganismos y enzimas presentes en el alimento pudiendo quedar una fracción residual resistente al tratamiento. Por lo general este proceso se caracteriza por aplicar un rango de temperaturas inferior al de esterilización, no superando los 100 ºC haciéndose necesario su almacenamiento y distribución en condiciones de refrigeración (Aleixandre, 1994). 3. 3. 3. Escaldado El escaldado es un tratamiento térmico que tiene como objetivo reducir la actividad enzimático y modificar la textura de ciertos vegetales. El tratamiento consiste normalmente en la inmersión de los vegetales cortados, en agua a temperaturas entre 80 y 100ºC, este tratamiento se considera previo al procesado de vegetales en conserva. Se utiliza en la conservación de las hortalizas para fijar su color o disminuir su volumen, antes de su congelación, con el fin de destruir enzimas que puedan deteriorarlas durante su 11 conservación. Esta manipulación no constituye un método de conservación, sino un tratamiento aplicado en la preparación de la materia prima. El escaldado reduce el número de microorganismos contaminantes, principalmente mohos, levaduras y formas bacterianas vegetativas de la superficie de los alimentos, y contribuye, por tanto, al efecto conservador de operaciones posteriores. 3. 4. CARACTERÍSTICAS DEL ALIMENTO A TENER EN CUENTA PARA ELEGIR EL TRATAMEINTO TERMICO A la hora de aplicar un tratamiento de conservación por calor, es necesario identificar con claridad las características físico-químicas y microbiológicas del alimento que influyen sobre el proceso como: 3. 4. 1. pH El pH del alimento es un factor determinante a la hora de elegir el tratamiento térmico adecuado para su conservación. Podemos clasificar los alimentos respecto a su valor de pH como: alimentos muy ácidos, cuyo rango de pH es inferior a 3.5 (jugo de limón); alimentos ácidos, cuyo valor de pH se encuentra entre 3.5-4.5 (jugos de frutas y conservas vegetales a las que se adiciona un corrector de la acidez). El valor de pH crítico se sitúa en 4.5. Este es el valor de pH al cual crece Clostridium botulinum, microorganismo esporulado y termorresistente, que se encuentra ampliamente en la naturaleza, cuya toxina es una de las más letales del mundo. Y por último, alimentos de baja acidez serán aquellos con un pH superior a 4.5 (carnes, leche, huevo liquido y productos lácteos) 3. 4 .2. Viscosidad La viscosidad del alimento es también un parámetro importante que definirá el tipo de intercambiador de calor adecuado para la aplicación del tratamiento térmico. El pasteurizador de placas será adecuado para alimentos poco viscosos mientras que un pasteurizador tubular será más idóneo para el tratamiento de alimentos viscosos o con partículas (Montaner, 2007). 12 3. 4 .3. Caracterización microbiológica del producto Es esencial caracterizar la flora natural existente en el producto fresco y materias primas ya que de este modo se definirán las condiciones del tratamiento térmico a aplicar para su conservación. Caracterizaremos también la carga microbiana final tras el tratamiento para asegurar que un producto cumpla con la legislación vigente. (Montaner, 2007). 3. 5. PROCESADO MÍNIMO DE ALIMENTOS VEGETALES. NUEVAS TECNOLOGÍAS DE CONSERVACIÓN NO TÉRMICAS El estudio de nuevas tecnologías de conservación de alimentos (Alta Presión, Pulsos Eléctricos de Alta Intensidad de Campo, radiación ionizante, campos magnéticos oscilantes, envasado en atmósfera modificada, antimicrobianos naturales, etc.) surge en el contexto de las sociedades de países industrializados donde los consumidores valoran positivamente aquellas características de los alimentos que les confieren mayor valor añadido como son: una escasa manipulación en su preparación, el empleo de aditivos naturales o la ausencia de los mismos, conservación de las características sensoriales propias del alimento fresco de partida y la conservación o potenciación de las propiedades nutricionales y las cualidades beneficiosas para la salud de los productos vegetales. Los alimentos de origen vegetal que presentan estas características se han denominado Alimentos Vegetales Mínimamente Procesados (MP). Como “Procesado Mínimo de alimentos”, se entiende la aplicación de una serie de tecnologías (barreras), que combinadas o no, deben mantener las características del alimento lo más cercanas posible a las del producto fresco, además de mejorar su vida comercial útil en términos microbiológicos, sensoriales y nutricionales. Dentro de esta terminología se incluyen dos tipos de productos distintos (Cano et al., 2005). Durante los últimos años se han desarrollado diferentes tecnologías de conservación que han tratado de dar respuesta a las demandas del consumidor por alimentos microbiológicamente seguros y de mayor calidad. Dentro de este grupo podemos encontrar las denominadas “tecnologías de conservación no térmicas” que son aquellas que no utilizan la temperatura como principal forma de inactivación de microorganismos y 13 enzimas. Si bien es cierto que en la mayoría de estos tratamientos se produce un leve incremento de la temperatura, este nunca llega a ser tan elevado como en un tratamiento térmico. El objetivo principal de estas tecnologías no térmicas es lograr alimentos que conserven al máximo todas las características de frescura y sabor sin renunciar a la seguridad alimentaria. Dentro de las nuevas tecnologías las más aplicadas hasta el momento son: 3. 5. 1. Aditivos naturales Los aditivos de origen natural incluyen una gran variedad de compuestos antimicrobianos naturales (canela, lisozimas y diferentes aceites aromáticos) que inhiben el crecimiento de ciertos microorganismos alteradores y patógenos y que son susceptibles de ser combinados con otras tecnologías de conservación. 3. 5. 2. Altas Presiones Hidrostáticas APH Esta tecnología esta adquiriendo mayor relevancia en los últimos años como alternativa al tratamiento térmico en cierto tipo de productos (productos cárnicos, jugos de frutas y salsas), ya que se han obtenido resultados importantes en inactivación de microorganismos y enzimas sin alterar su calidad final (Mertens et al., 1992). 3. 5. 3. Pulsos eléctricos de alta intensidad Esta tecnología es uno de los tratamientos no térmicos desarrollados en la conservación de alimentos líquidos cuyos componentes nutricionales son sensibles al calor, tales como jugos de frutas, leche o huevo liquido, debido a que durante el tratamiento se alcanzan temperaturas inferiores a los tratamientos térmicos convencionales (Quass, 1997). Los pulsos eléctricos de alta intensidad consisten en la aplicación de pulsos de alto voltaje (10-80 kV/cm) directamente sobre el alimento líquido el cual se encuentra entre dos electrodos, durante un periodo de tiempo muy corto (50-2000 microsegundos). Entre otras ventajas, esta tecnología no altera las propiedades sensoriales ni físico-químicas de los alimentos consiguiendo niveles de inactivación de microorganismos considerables (Barbosa et al., 1998). 14 3. 5. 4. Campos magnéticos oscilatorios Esta nueva tecnología se caracteriza por afectar de forma muy variada al microorganismo provocando cambios estructurales y morfológicos en su membrana. El tratamiento tiene como características principales tiempos de tratamiento cortos (25 milisegundos) y fuerzas de campo altas (2-100 teslas) con una frecuencia de 5 a 500 kHz. Dicho tratamiento afecta directamente a la multiplicación de los microorganismos ya que actúa principalmente sobre la membrana provocando un cambio en la fluidez e interfiriendo en el flujo de iones. En algunos casos estas alteraciones no llegan a producir la muerte celular por lo que la eficacia del tratamiento en la inactivación de microorganismos es baja, consiguiendo reducir únicamente dos ciclos logarítmicos en células vegetativas (Hendrickx et al., 2001). 3. 5. 5. Ultrasonidos de alta intensidad Esta técnica se ha desarrollado para la conservación de alimentos ya que es capaz de inactivar microorganismos en forma vegetativa y reducir la resistencia térmica de las esporas. La temperatura es un factor que influye directamente en el tratamiento ya que se produce un efecto sinérgico a temperaturas moderadas, pero al incrementarse la temperatura, el sinergismo se reduce. Para aumentar la efectividad del tratamiento a temperaturas altas, se aplica una ligera sobrepresión sobre el producto. Esta tecnología podría reducir las temperaturas de esterilización y pasterización pero únicamente en alimentos bombeables o con características semisólidas (Earnshaw y et al., 1995; Villamiel et al., 2000). 3. 5. 6. Irradiación Este tratamiento consiste en la aplicación de ondas electromagnéticas o electrones al alimento, utilizándose con mayor frecuencia rayos gamma y rayos X. La tecnología es adecuada para la higienización de sólidos y superficies. Últimamente se esta desarrollando su aplicación en la higienización de vegetales y productos de cuarta gama obteniendo resultados importantes en la reducción de la carga microbiana (Al-Bachir & Zeinou, 2006) 15 3. 6. DESCRIPCIÓN DEL MICROORGANISMO DE INTERES (Bacillus cereus) 3. 6. 1. Género Bacillus El género Bacillus pertenece a la familia Bacillaceae, es un género que hoy en día incluye más de 60 especies de bacilos. Este género está formado por microorganismos bacilares Gram positivos, formadores de endosporas, quimioheterotrofos, que normalmente son móviles y rodeados de flagelos perítricos. Son aerobios o anaerobios facultativos y catalasa positivos. Las células bacterianas de este género tiene un amplio tamaño que varía entre 0,5–2,5×1,2–10µm (Ingraham & Ingraham., 1998). Taxonómicamente, según la segunda edición del Manual Bergey (1982), el género Bacillus pertenece a la Familia I Bacilliaceae, del orden I Bacillales, de la clase III Bacilli, del fillum BXIII Firmicutes del Dominio Bacteria. En la primera edición el género es claramente diverso desde el punto de vista fenotípico y genotípico. Más recientemente, los datos de la secuencia de rRNA se han empleado para dividir el género Bacillus en al menos cinco líneas diferentes. Entre las especies más representativas del género Bacillus se encuentran: B. alkalophilus, B. anthracis, B. azotoformans, B. brevis, B. cereus, B. subtillis, B. coagulans, B. firmus, B. insolitus, B. licheniformis, B. polymixa y B. turingiensis, entre otros (Delgado, 2005). 3. 6. 2. Bacillus cereus En 1887 Frankland y Frankland aislaron y describieron por primera vez la bacteria Bacillus cereus. No fue hasta 1950 cuando se confirmo definitivamente que este microorganismo podría producir una enfermedad transmitida por alimentos. Esto fue gracias a Hauge quien publicó en 1950 y 1955 descripciones de cuatro brotes en salsa de vainilla. (Delgado, 2005). 3. 6. 3. Características generales B. cereus es un microorganismo aerobio, aunque también puede crecer anaerobicamente. Es Gram positivo, catalasa positivo, reduce nitratos a nitritos y positivo en Voges-Proskauer 16 fermentando la glucosa por vía butanodiólica, la sacarosa y el glicerol. Es manitol negativo y produce lecitina. Normalmente es móvil, gracias a sus flagelos perítricos. Aunque existen variables inmóviles (Prescot et al., 2004) 3. 6. 4. Hábitat y condiciones de crecimiento B cereus esta muy difundido en la naturaleza. Se puede encontrar en el suelo, agua y aire, por lo que es frecuente encontrarlo en los vegetales, en cosechas de cereales, en el pelo de los animales y en muchos alimentos, tanto crudos como tratados o industrializados (Kramer y Gilbert, 1989). Las diferentes cepas de B. cereus son muy variables en cuanto a su forma de crecimiento y características de supervivencia. La Tabla 3.1 resume los límites de crecimiento de este microorganismo. Existen cepas mesófilas y que crecen en un intervalo de temperaturas entre 15 ºC y 55 ºC. Pero hay algunas cepas psicrótrofas, que son capaces de crecer a 4 ó 5 ºC (Lechner et al., 1998). Éstas últimas representan un peligro para productos refrigerados (Valero et al., 2003). En general para B. cereus la temperatura óptima de crecimiento es de 30 a 40 ºC. En cuanto al pH ocurre algo muy similar que con la temperatura. El pH mínimo de crecimiento es distinto de unas cepas a otras, aunque en general B. cereus crece a un pH mínimo de 5 y máximo de 8.8 teniendo un intervalo de pH óptimo entre 6 y 7. El efecto de la actividad del agua sobre las cepas causantes de intoxicaciones alimentarías no está bien documentado, pero se acepta que B cereus necesita una (a w) mínima de 0.93. Condiciones Mínimo Óptimo Máximo Temperatura (ºC) 4 30 - 40 55 pH 6.0 6.0-7.0 8.8 aw 0.93 - - Tabla 3.1. Resumen de Condiciones de crecimiento para Bacillus cereus. Adaptado de: Delgado, 2005. 17 3. 6. 5. Asilamiento e identificación Los procedimientos de choque térmico y de selección de esporas con etanol son excelentes métodos para la recuperación cuantitativa de especies de Bacillus de materia fecal y otras muestras (incluidos alimentos) que contengan poblaciones mixtas de microorganismos. 3. 6. 6. Infección alimentaria por Bacillus cereus Las células vegetativas de B. cereus pueden ser eliminadas fácilmente mediante un tratamiento térmico, sin embargo las esporas son más resistentes. Esto garantiza su supervivencia a través de todas las fases de tratamiento de los alimentos (excepto después de un tratamiento con autoclave) y de ahí que el microorganismo se halle en la mayoría de las materias primas que se usan en la elaboración de alimentos. Es normal encontrarlo en concentraciones de 10-2–10-3 por gramo, una concentración inocua, pues se ha estimado que para causar enfermedad es necesaria una concentración mínima de 105 UFC/ gramo (Hobbs y Gilbert, 1974). Pero las esporas que quedan en los alimentos son un peligro potencial, ya que si las condiciones del medio son favorables, se induce la germinación aumentando considerablemente en poco tiempo el número de microorganismos presentes en el alimento; provocando el deterioro del alimento y una posible intoxicación. Aunque, en un principio se pensó que el aumento del número de bacterias era el responsable de la patología intestinal, más tarde se descubrió que las células vegetativas de B. cereus producían una variedad de toxinas y enzimas extracelulares causantes de dicha enfermedad. Estas enzimas son: lecitinasa, proteasas, β-lactamasas, cereolisina (hemolisina I ó primaria) y hemolisina BL. B. cereus se asocia con dos tipos de enfermedades alimentarias o intoxicaciones: una con síndromes diarreicos y otra con síndromes eméticos ocasionados por dos tipos diferentes de toxina que constituyen factores de virulencia en B. cereus (Granum et al., 1997). Por un lado esta la toxina conocida como “cereulidina” causante del síndrome emético, en términos de composición química se trata de una proteína de un dodecapéptido lactónico y lipofílico de aproximadamente 1.2 KDa, posee residuos de aminoácidos como la alanina, 18 leucina y valina que le dan la capacidad de actuar como un potente ionóforo de potasio. (Kuse et al., 2000; Pitchayawasin et al. 2003,2004). Recientemente se ha investigado sobre esta toxina encontrándose su lata termorresistencia así con ciclos de esterilización de 121 ºC por 15 minutos no se inactiva y los residuos hidrofóbicos de esta toxina requieren inactivación química para su inactivación (Rajkovic 2008). El síndrome diarreico está producido por una toxina formada por un complejo tripartido integrado por los componentes B, L1 y L2 que se denominan Hemolisina BL (HB) Esta toxina provoca hemólisis, histólisis, dermonecrosis, permeabilidad vascular y actividad enterotóxica. Y aunque no se ha demostrado que exista una enterotoxina única parece que la HBL es la responsable del síndrome diarregénico (Rajkovic 2008). 3. 7. LA ESPORA BACTERIANA A fines del siglo XIX, Tyndall, Cohn y Koch descubrieron de forma independiente la capacidad de ciertas especies bacterianas para diferenciar estructuras resistentes al calor y a otros agentes letales, que les permitían mantenerse en estado de latencia durante largos periodos de tiempo. Ferdinand Cohn descubrió que dichas estructuras se formaban en el interior de los bacilos del heno, llamándolas endosporos. Cohn descubrió, además el ciclo de vida de B subtilis y la formación y germinación de los endosporos mediante minuciosos estudios microscópicos (Keynan y Sandler, 1983). Basándose en los trabajos de Cohn y en sus propios hallazgos, el inglés John Tyndall desarrolló y método eficaz para la eliminación de los endosporos mediante ciclos sucesivos de ebullición e incubación a 37 ºC durante tres días. Este método de esterilización fraccionada o intermitente es conocido como tindalización. Por su parte Roberth Koch estudió el proceso de esporulación en B anthracis (agente causal del ántrax o carbunco) y la participación de sus esporas en la transmisión de esta enfermedad a animales sanos. Las esporas son consideradas ahora como una de las formas más resistentes en la tierra a la temperatura y la desecación. Son muchas las especies esporofomadoras y están distribuidas 19 principalmente dentro del grupo de la bacterias Gram positivas (Prescott et al., 2004). Esto sugiere que la capacidad de esporulación esta relacionada con la capacidad de síntesis de una pared gruesa, que además es indispensable para desarrollar esporas resistentes (Moat et al., 2002). Las bacterias esporuladas pueden encontrarse en hábitats muy diversos, en el agua y el suelo y es en este último donde se haya en mayor abundancia. Las condiciones del suelo son muy variables con periodos de sequía o escasez de nutrientes. En la primera edición del Bergey´s Manual of Systematic Bacteriology (1982) basado en similitudes fenotípicas, se agrupan a las bacterias formadoras de esporas en la sección 13, que incluye a los géneros Bacillus, Clostridium, Desolfotomaculum, Oscillospirina, Soporolactobacillus y Sporosarcina. La segunda edición del Bergey´s Manual of Systematic Bacteriology (1984) se basa en criterios filogenéticos (secuenciación de ARNr, ADN y proteínas). Esta edición considera esporulados los géneros Bacillus, Desolfotomaculum, Paenibacillus, Sporohalobacter, Soporolactobacillus, Sporosarcina y Thermoactinomyces, pertenecientes a la familia Bacillaceae, y algunos géneros que se encuentran repartidos entre diferentes familias taxonómicas (Prescott et al., 2004). Funcionalmente la formación de la endospora es un claro ejemplo de adaptación de algunas especies bacterianas a la falta de nutrientes. Ante el agostamiento de éstos, una célula vegetativa se verá obligada a producir la endospora, en un proceso que involucra cambios morfológicos, bioquímicos, fisiológicos y una diferenciación funcional clara. De tal modo que puede considerarse a la esporulación como un ejemplo de diferenciación celular en procariotas. En su estado de latencia las esporas no muestran metabolismo detectable (fenómeno conocido como abiosis) y, por tanto, se pueden considerar inertes, mostrando una marcada resistencia a la inactivación por agentes físicos (desecación extrema, vacío, presión hidrostática, temperatura, radiaciones ionizantes) o sustancias químicas (ácidos bases, fenoles, aldehídos, etc.). Sin embargo, en dicho estado de latencia pueden responder ante un 20 incremento de cualquiera de los nutrientes para empezar la germinación, reiniciar el crecimiento vegetativo y dar paso a una un incremento de población activa. Tanto en la industria alimentaria, como en el campo de la microbiología clínica, las esporas tienen una alta relevancia, gracias a su resistencia a casi cualquier método de inactivación, lo cual constituye un problema y por esto se han desarrollado mayor control en los alimentos, bebidas, quirófanos, hospitales, etc. Además de su influencia en el deterioro de lo alimentos, muchas de estas especies esporoformadoras son patógenas, ya sea por transmisión directa por aire o agua o a través de instrumentos quirúrgicos, utensilios de cocina y manipuladores. Debido a la alta resistencia de las esporas hay dificultad a la hora de diseñar y estandarizar métodos de esterilización y conservación que preserve las características físicas y valor nutricional del alimento. Las esporas bacterianas resisten condiciones de esterilización por calor mucho más drásticas que las toleradas por las células vegetativas y esta resistencia es aplicable también cuando se emplean la radiación o sustancias químicas desinfectantes. De hecho, las esporas bacterianas pueden utilizarse como indicadores biológicos en el control de calidad de los procesos de esterilización (Yawger, 1978). 3. 7. 1. Estructura de la espora Las endosporas tienen una serie de características comunes en todos los procariotas y son las siguientes: Tamaño: el tamaño medio de la endospora oscila entre 0.5 µm y 1.5 µm, localización: se forman y se localizan en el citoplasma de la célula, refringencia: gracias a esta propiedad las endosporas pueden verse en el microscopio óptico. Esta refringencia se debe a los bajos valores de aw de las endosporas, debido a la compleja estructura multilaminar de las esporas estas son muy impermeables a los colorantes. En su estructura la espora tiene diferentes capas de proteínas y polisacáridos (Delgado, 2005). 3. 7. 1. 1. Exosporium 21 Es la capa más externa, su tamaño varía mucho entre esporas de diferentes especies, en esporas de B. cereus la capa es muy grande en comparación con el exosporium de B. subtillis que siendo pariente cercano es muy pequeño (Driks, 2002). El exosporium se compone de carbohidratos y proteínas, posee macromoléculas exclusivas de las esporas. La función exacta del exosporium es desconocida aún y no se sabe con certeza si la su estructura juega un rol en la resistencia de las esporas (Setlow, 2006). 3. 7. 1. 2. Cubiertas esporales Se encuentra debajo del exosporium y a su vez se compone de varias capas dichas capas se componen principalmente de proteínas. Se han identificado más de treinta proteínas diferentes únicas de las esporas en las cubiertas de esporas de B. subtillis. La cubierta esporal es importante en la resistencia de la espora frente algunos agentes químicos, quizás reacciona detoxificando el compuesto químico antes de que dañen puntos más profundos de la espora. (Setlow, 2006). La cubierta protege también de la lisis y de ataques enzimáticos (p. e. lisozimas) mediante la restricción del acceso de la enzimas al peptidoglicano. Una gran proporción de la proteína de la cubierta puede ser separada mediante extracción con detergentes sin dañar definitivamente a la espora. En esporas de B. subtilis se ha encontrado que las cubiertas pueden presentar daños a nivel de las proteínas que conforman la estructura de la cubierta. Se ha encontrado que esporas con cubiertas dañadas conservan su capacidad de resistencia a altas presiones hidrostáticas, sugiriendo entonces que esta cubierta no es importante en la resistencia de la espora a altas presiones; sin embargo, estudios recientes han demostrado que esporas con cubiertas defectuosas retienen también la resistencia a destrucción mecánica (Delgado, 2005). 3. 7. 1. 3. Córtex Esta es una capa de grosor variable compuesta de peptidoglicano modificado con enlaces más complejos que en las células vegetativas, lo que le proporciona mayor flexibilidad, el peptidoglicano de las esporas contiene ácido diaminopimélico, mientras que el de células vegetativas es sustituido por el aminoácido L-lisina. Adicionalmente, mucho del ácido murámico en el peptidoglicano del córtex está presente como ácido murámico δ- Lactámico (MAL), con pequeñas cantidades de ácido murámico enlazado solo a L- alanina (Black et al., 2007). El córtex es más rígido y su función en la resistencia a la presión no ha sido 22 investigada aún, pero tiene mucha importancia en mantener a la espora en estado de dormancia, manteniendo bajos los niveles de agua en la región central del protoplasto. El peptidoglicano del córtex es degradado durante estadios tempranos de la germinación y la hidrólisis de este córtex es esencial para que la espora “vuelva a la vida (Black et al., 2007). 3. 7. 1. 4. Membrana interna o intina Se encuentra por debajo del córtex y es la pared que rodea al propoplasto. Es una membrana completa que provee una externa de baja permeabilidad a moléculas pequeñas si están cargadas o son hidrofobicas, inmoviliza lípidos e incluso el paso de agua a través de la membrana (Black et al., 2007). La membrana interna parece estar comprimida en las esporas, con la hidrólisis del córtex durante la germinación, en ausencia de producción de fosfolípidos y síntesis de ATP el volumen abarcado por la membrana aumenta unas 2 a 3veces. La baja permeabilidad de la membrana interna es muy importante como barrera que impide el acceso y posterior daño del ADN contenido en el protoplasto, por parte de agentes químicos (Cortezzo & Setlow, 2005). Dentro de esta membrana están contenida muchas proteínas que intervienen en el procesote germinación (Setlow, 2003). La inusual composición de esta membrana indudablemente influye en el comportamiento de estas proteínas; no obstante la estructura de esta membrana no se conoce. 3 .7. 1. 5. Protoplasto Este núcleo se compone de solo dos constituyentes y tiene dos propiedades bioquímicas importantes, una es que el contenido de agua es muy bajo en comparación con el de una célula vegetativa donde un 80% del peso seco de la célula es agua, en una espora la proporción es de 25% a 55% dependiendo de la especie; este bajo porcentaje de agua es la mayor contribución a la resistencia de la espora al calor, cuanto mayor sea el contenido de agua menor será la resistencia a altas temperaturas. El bajo contenido de agua es sin duda lo que permite el estado de dormancia, en niveles normales de agua las proteínas tienen solubilidad y movilidad, en el protoplasto están inmovilizadas. La segunda propiedad bioquímica del protoplasto es que posee un pH con 1.0 a 1.5 unidades más bajo que la célula vegetativa el cual es generalmente 7.5 a 8.0 (Paidhungat y Setlow, 2002), el pH bajo se mantiene después de la esporulación y es un regulador en la actividad de enzimas clave 23 en el desarrollo de la espora durante la esporulación, el pH aumenta en la germinación en los primeros minutos a través de la excreción de protones al medio. Como se menciono anteriormente, el cortex de la espora tiene una baja cantidad de agua y esto esta relacionado con la presencia de una molécula pequeña, el ácido dipicolínico (acido dicarboxilico 2-6 pirimidina) (DPA), este DPA, esta presente en el citoplasma en una proporción 1:1 como quelato con cationes divalentes donde predomina el Ca+2, formando Ca-DPA, el DPA se hace en etapas tardías de la esporulación y se acumulan un 20% en peso seco, en el protoplasto de la espora. Esporas de cepas mutantes que no sintetizan ni acumulan DPA tiene un mayor contenido de agua y por lo tanto son más sensibles que las cepas normales. El DPA también es importante porque ejerce una barrera de protección a ADN (Setlow et al., 2006) Existen en el protoplasto una serie de proteínas solubles, las SASP proteínas pequeñas ácido solubles tipo α/β, estas proteínas provienen de una familia de genes que se expresan solamente al final de la esporulación. Su tamaño es pequeño y comprenden solo un 5% del total de las proteínas de la espora y se localizan solamente en el protoplasto de la espora, se asocian estructuralmente solamente a ADN de la espora confiriéndole más resistencia a la espora a altas temperaturas, desecación y radiación ultravioleta. En el momento de la germinación las SASP son degradadas rápidamente mediante una proteasa específica (Black et al., 2007) 3. 8. PROCESO DE ESPORULACIÓN Es el proceso por el cual una célula vegetativa se transforma en endospora. Mientras las condiciones ambientales son favorables, el crecimiento de una célula vegetativa continúa hasta que se divide en dos células hijas mediante fisión binaria y no se producirá la esporulación. La esporulación puede iniciarse la final de la fase exponencial probablemente como consecuencia de la falta de nutrientes en el medio de crecimiento. La división o separación asimétrica de la espora depende generalmente, de una señal nutricional, 24 mientras que los eventos que siguen dependen de un control a nivel genético. Durante el crecimiento vegetativo rápido se suprime ele inicio de la esporulación, en apariencia debido a un catabolito de bajo peso molecular que contiene átomos de carbono, nitrógeno y fósforo. Este catabolito podría controlar la síntesis de una enzima necesaria para la esporulación. Cuando la concentración de un nutriente crítico alcanza un nivel limitante, se reduce o se interrumpe la síntesis de esta enzima (Collado, 2000) La esporulación también puede deberse a la acumulación en el medio de productos resultantes del metabolismo de las células bacterianas (Moseel y Moreno, 1985). También puede iniciarse este proceso por la presencia de determinados componentes, como ciertos nucleótidos y antibióticos (Freese, 1981) El crecimiento vegetativo no siempre termina en la esporulación, puesto que esta se ve influenciada por factores como la temperatura, pH, compuestos nitrogenados, oxígeno describió los cambios morfológicos producidos durante la esporulación. La aplicación de la microscopía electrónica ha permitido la identificación de diferentes estadios en la formación de la endospora. Así se han reconocido siete etapas morfológicamente distintas durante la esporulación (Russel, 2003). • Estadío 0. Representa el momento final de la fase logarítmica de la célula vegetativa. La inducción de la esporulación parece estar ligada a un momento temporal en el ciclo de replicación del ADN, pues depende del momento del ciclo de la célula. Una célula puede iniciar la esporulación una vez se ha completado la replicación cromosómica, sí por ejemplo hay limitación de nutrientes. • Estadío 1 o preseptación. Cuando se produce la señal del inicio de la esporulación, se forma un filamento axial de cromatina, que se extiende por la mayor parte de la célula. Sucede en ausencia de síntesis de proteínas o ADN, posiblemente a un cambio iónico en la célula, por falta de determinados iones (Hurst & Gould, 1983). 25 • Estadío 2 o septación. Se inicia cuando una porción del material nuclear migra a un polo de la célula. Se forma un septo asimétrico que da lugar a dos compartimentos celulares separados, conteniendo cada uno parte del material nuclear. A continuación, se inicia el englobamiento de la protoespora por la membrana celular. En B cereus se ha comprobado que el fenómeno de la esporulación es reversible en este punto, pues sí se transfieren las endosporas en este estadío a medio fresco, vuelven a crecer, mientras que, si alcanzan el siguiente estadío, continuarán su ciclo hasta la formación de la espora (Setlow, 1981) • Estadío 3. Comprende la inclusión de la protoepsora por una invaginación de la membrana, que se separa totalmente de la célula madre. La protoespora está rodeada por dos membranas de polaridad opuesta. En este momento, aparecen enzimas específicas de la endospora y se observan gránulos de ácido beta-hidroxibutírico en el citoplasma de las células vegetativas. • Estadío 4. Se produce la deposición del córtex entre las dos membranas. El córtex está constituido por péptidoglicanos distintos de los de la pared celular y aumenta en grosor conforma la espora se desarrolla. En esta etapa empieza a parecer la refringencia típica de la endospora. • Estadío 5. Se produce la síntesis de la cubierta de la endospora. Las proteínas de la cubierta se sintetizan en forma de precursor de célula madre y son depositadas sobre la espora en desarrollo. El DPA se sintetiza también en la célula madre y se acumula en la endospora. Hay una toma de calcio y otros iones metálicos divalentes (magnesio y manganeso), que penetran en la protoespora, siendo esto, un proceso de difusión facilitada. En el protoplasto, el calcio se combina con el DPA, lo que disminuye la concentración de calcio libre y posibilita así una mayor entrada del mismo (Setlow, 1981). En este estadío, aparece la resistencia a alcoholes como el octanol. En algunas especies bacterianas, se desarrolla el exosporium externamente a la cubierta. 26 • Estadío 6 o maduración de la espora. En este paso el córtex y las cubiertas aumentan. Se produce la deshidratación del protoplasto, aumenta la refractibilidad y se desarrolla la resistencia al calor, a la radiación ultra violeta y a la lisozima. • Estadío 7 ó final. Incluye la liberación de la endospora madura por autolisis de la célula vegetativa. Las condiciones para que se produzca la esporulación son precias e incluso más estrictas que las condiciones de crecimiento. Se han revisado los factores medioambientales críticos para la esporulación. Estos factores según Rusell (1982) son: • Temperatura • pH • Potencial de oxidación-reducción. • Composición mineral. • Presencia de determinados compuestos con carbono y nitrógeno. • Composición global del medio de esporulación. 3. 9. PROCESO DE ACTIVACIÓN DE LA ESPORA Es un proceso reversible por el cual la endospora bacteriana termina con el estado de letargo o estadío fisiológico de incapacidad para germinar, sin terminar la criptobiosis (estado fisiológico de metabolismo detenido). Al ser irreversible, la activación, puede conducir a una nueva etapa de letargo conocida como desactivación, o a la pérdida de viabilidad si las condiciones ambientales no son las adecuadas para la germinación (Curran y Evans, 1974) 27 Como consecuencia de la activación, se produce un incremento en la velocidad de germinación y en el porcentaje de endosporas (Cook y Pierson, 1983). Por ello, en los estudios de termorresistencia se recomienda activar las esporas antes del tratamiento térmico. La endospora activada es retráctil, no teñible y mantiene la resistencia a agentes físicos y químicos que pueden dañar la célula. El método más empleado para activar endosporas es el tratamiento térmico a temperaturas no letales, lo cual, no supone una pérdida de resistencia térmica. Otros métodos que permiten activar la endospora son la exposición a niveles de pH ácidos, a radiaciones ionizantes o el empleo de compuestos químicos, aunque son menos efectivos que el calor. 3. 9. 1. PROCESO DE GERMINACION DE LA ESPORA El proceso de germinación es aquel donde la espora abandona definitivamente y de manera irreversible su estado de latencia y sufre una transformación restaurando su actividad metabólica. Se trata de un proceso irreversible, aunque el paso al desarrollo celular puede detenerse incluso durante días si las condiciones no son adecuadas. De esta forma se puede controlar la germinación mediante la adición o eliminación de algunos aminoácidos esenciales. A lo largo de este proceso la espora se hace sensible a la temperatura y a la radiación. En la naturaleza la germinación de las esporas esta indudablemente ligada a la presencia de nutrientes. Dichos nutrientes son específicos y varían de una especie y cepa a otras de microorganismo esporoformadores, no obstante tiene nutrientes en común como: Laminoácidos, D- azucares y nucleósidos tipo purina. Estos nutrientes poseen una forma estereoespecífica de acoplarse a los receptores localizados en la membrana interna de la espora. Los receptores de la germinación se encuentran codificados genéticamente mediante operones tricistrónicos que solo se expresan durante el desarrollo de la espora. Las endopsoras han de ser capaces de germinar para mostrar su viabilidad, algunos tratamientos como el tratamiento térmico por ejemplo pueden dañar este mecanismo. No obstante otros tipos de tratamientos como las Altas Presiones Hidrostáticas pueden inducir 28 la germinación de las endosporas, como se explicará más adelante. La germinación se puede inducir por otros tratamientos con diferentes tipos de germinantes: • Germinantes nutritivos, incluyen aminoácidos como L-alanina, ribósidos, como Rosina o adenosina, azúcares, como la glucosa. • Germinantes no nutritivos, incluyen surfactantes (n.dodecilamina), iones metálicos (calcio, potasio, manganeso), quelatos (etilendiamintetrracético ó dipicolinato cálcico) y bicarbonato (Gould, 1970) • Enzimas, como la sublisina, enzimas líticas de la espora y la lisozima. 3. 11. SUSTANCIAS ANTIMICROBIANAS Se conoce que una serie de factores pueden afectar la actividad antimicrobial: a saber periodo de contacto, concentración, temperatura, pH, presencia de materia sólida orgánica y tipo de microorganismo (Rusell, 2003). La conservación y seguridad en alimentos tiene un récord extenso de descubrimientos e innovaciones para impedir el deterioro y alargar la vida útil de alimentos durante su almacenamiento. Los métodos de preservación de alimentos se pueden clasificar en: físicos, químicos y biológicos. Los métodos físicos incluyen: secado, almacenamiento en frío, congelamientos y empaque en atmósferas modificadas (Ricke et al., 2005). Un biocida puede inactivar a un solo o varios tipos de microorganismo. Es pertinente considerar, si es posible, explicar las similitudes y diferencias en respuesta a biocidas en microorganismos diversos estructural y fisiológicamente. En muchas maneras esto representa un reto para los antibióticos donde un conocimiento claro sobre los mecanismos de inactivación y resistencia permite conocer la especificidad y selectividad de un biocida 29 3. 11. 1. Absorción de biocidas y respuesta en las células La interacción de un biocida con la célula microbiana esta determinada por la absorción. Se conocen cinco clases de absorción: (i) Modelo en forma de S, en el cual la molécula de soluto es monofuncional, está orientado verticalmente y encuentra una fuerte competición con las moléculas del solvente o con otras sustancias que se puedan absorber. (ii) Modelo L (Langmuir) en el cual muchos sitios en la membrana están llenos, esto dificulta al soluto encontrar un sitio vacío por donde penetrar. (iii) Modelo H (High afinity), en este caso el soluto es completamente absorbido. (iv) Modelo C (partición constante) en este caso el soluto penetra más rápidamente que el solvente. (v) Modelo Z hay un punto en el cual el incremento de la respuesta, se cree es causado por la rotura de la estructura y el contacto con el soluto, generando nuevos puntos de absorción (Rusell, 2003). La superficie de la célula microbiana puede actuar como barrera en respuesta a algunos biocidas o a uno solo en especial. La impermeabilidad o disminución de la respuesta es un mecanismo común para reducir la susceptibilidad a antibióticos y biocidas en diferentes microorganismos como mycobacterias, bacterias Gram negativas y esporas bacterianas pero, también en algunos tipos de estafilococos (Rusell, 2003). 3. 11. 2. Objetivo de acción de un biocida A pesar de las variaciones en la estructura celular y fisiología es claro que los sitios de acción pueden estar presentes en células vegetativas de diferentes especies. Muchos de los trabajos publicados se refieren a bacterias. Como ejemplo de un biocida convencional esta el fenol, utilizado como desinfectante o preservante. Los fenoles por ejemplo inducen progresivamente pérdida intracelular de constituyentes, si la concentración de fenol intracelular es alta se producen daños en la membrana induciendo coagulación dentro de la célula. En células fúngicas hay daño en la membrana plasmática, no obstante A. niger y C. albicans son menos susceptibles que las bacterias. Las esporas bacterianas son muy resistentes inclusos a altas concentraciones de fenol, pero la germinación es inhibida por bajas concentraciones de fenol (Rusell, 2003). 30 3. 11. 3. Clasificación de los antimicrobianos La lista de aditivos químicos desarrollados en los últimos años, es muy extensa, los antimicrobianos naturales incluyen por ejemplo ácidos orgánicos, esteres, sales y compuestos específicos como la lisozima (Davidson, 2001). En la naturaleza se dan compuestos usados para la preservación de alimentos incluyendo algunos de origen animal, como la lactoperoxidasa y algunas proteínas férricas, otros derivados de plantas como: especias, aceites y compuestos fenólicos (Davidson, 2001). Los sistemas biológicos que pueden desarrollar o tener potencial para preservar alimentos incluyen el control por acidificación en alimentos con bacterias ácido lácticas que producen ácidos orgánicos provenientes de la fermentación de carbohidratos (Monteville et al., 2001). Bacteriocinas y bacteriófagos están capturando interés por su potencial contra patógenos específicos (Weld et al., 2004). 3. 11. 4. Antimicrobianos de origen químico Los compuestos antimicrobianos tienen aditivos como el lactato de sodio o de potasio, citrato de sodio y una variedad de compuestos antioxidantes que exhiben propiedades antimicrobianas. Otro tipo de antimicrobianos tipo gas (ozono, cloro, dióxido de cloro, que general halógenos oxidados) usualmente son aplicados en solución acuosa dando como resultado una reducción aproximada de 2 a 4 ciclos logarítmicos para algunos patógenos, dependiendo de la concentración, temperatura de aplicación y tiempo de contacto (Ransom et al., 2003). El efecto de esto antimicrobianos no es permanente después del tratamiento, principalmente porque estos compuestos son altamente reactivos en sus enlaces insaturados, de este, modo se desprenden rápidamente del medio acuoso impidiendo la acción contra las células bacterianas después de un tratamiento. Por otra parte el fosfato trisódico en una sal alcalina puede liberar radicales hidroxilo que luego impedirán el crecimiento de células tras el tratamiento (Pohlman et al., 2002). No es de sorprenderse que combinando antimicrobianos se potencie el efecto ya que muchos antimicrobianos actúan sinérgicamente. 31 Algunos antioxidantes sintéticos como hidroxianisol butirato e hidroxitolueno butirato (BHA/BHT) y el ácido benzóico también se pueden utilizar como aditivos antimicrobianos pero su uso está limitado en algunos alimentos lo cual presenta una desventaja. 3. 11. 5. Antimicrobianos de origen natural Se estima que hay de 250.000 a 500.000 especies de plantas en la Tierra, de los cuales más o menos un 1 al 10 % son utilizadas en la alimentación de humanos y animales. Es posible que un porcentaje más grande sea utilizado en medicina. Hipócrates (a finales del siglo v A., C) mencionó la existencia de 300 a 400 especies de plantas medicinales. En el siglo primero después de Cristo, Dioscorides, escribió De Materia Medica, un catalogo de plantas medicinales qué se tomó como modelo para las farmacopeas que conocemos en la actualidad. La Biblia ofrece una descripción de aproximadamente unas 30 plantas curativas; como la mirra que gozó de estatus de planta milagrosa. Se reportó que tenía propiedades antisépticas utilizándose también como enjuagues bucales (Cowan, 1999) Los antimicrobianos naturales pueden definirse como una serie de sustancias químicas que se encuentran repartidas de diversas formas en la naturaleza y que son capaces de inhibir el crecimiento de los microorganismos que alteran alimentos actuando como bacteriostáticos e incluso algunos antimicrobianos tienen acción bactericida (Delgado, 2005). Muchos productos derivados de plantas (especias, preparaciones de frutas y vegetales) han sido usadas desde hace siglos para la conservación y aumento de la vida útil de los alimentos (Draughon, 2004). La mayor parte de la actividad antioxidante se atribuye a varias preparaciones de frutas y vegetales que contienen compuestos fenólicos con grupos hidroxil reactivos (ej. catequinas, ácido gálico, ácido colinérgico), ácido neocolinérgico y otros compuestos como antocianinas, flavoniodes y carotenoides (Stacewicz-Sapuntzakis et al., 2001). Estos compuestos son usados generalmente después de tratamientos superficiales y son conocidos como ingredientes seguros. Muchos de estos antimicrobianos pueden reducir de 1 a 2 ciclos logarítmicos, pero tienen que actuar sinérgicamente con tratamientos térmicos o tratamientos químicos como adición de ácidos. Muchos de estos antimicrobianos de origen natural proporcionan un efecto benéfico en la dieta humana. 32 La combinación de dos o más antimicrobianos en bajas dosis pueden tener un efecto sinérgico reduciendo el número de patógenos manteniendo la calidad de los alimentos. Por ejemplo, fuentes naturales de antioxidantes como extractos de especias tienen actividad antimicrobiana y previenen la oxidación de lípidos por ejemplo en carnes. Sin embargo por sí solo un antimicrobiano natural difícilmente actúa como bactericida y por lo general hay que combinarlo con algún tratamiento como APH, pulsos eléctricos o temperaturas suaves. En comparación con otros tratamientos más agresivos (ácidos orgánicos, tratamiento térmico, tratamiento con vapor) el uso de antimicrobianos de origen natural tiene efecto antimicrobiano y antioxidante, además de no alterar las propiedades organolépticas de los alimentos. Existen dos tipos de antimicrobianos naturales, las bacteriocinas y los aceites esenciales la diferencia entre ambos radica en que las bacteriocinas son de origen bacteriano, mientras que los aceites son de origen vegetal. Las bacteriocinas son péptidos microbianos de reducido tamaño, con una actividad antimicrobiana muy potente. Son resistentes al calor y son hidrolizadas por las proteasas gástricas, lo que permite asegurar su inactivación por ingestión así como su posible utilización como preservantes naturales de los alimentos. Se han aislado bacteriocinas de muchos géneros, siendo la más importante la nisina, sintetizada por Lactococcus lactis. El primer uso alimentario de la nisina lo hizo Hurst en queso suizo para inhibir el crecimiento de Clostridium butyricum (Hurts, 1981). En 1998 la FDA (Food and Drug Administration) reconoció la nisina como sustancia segura y muchos países, entre ellos España, permiten su uso en alimentos en diferentes proporciones (Delgado, 2005) 3. 11. 5. Polifenoles y su efecto antimicrobiano El árbol de oliva Olea europea L, es uno de los árboles frutales más importantes en los países del mediterráneo ya que las olivas de mesa son parte vital de la dieta mediterránea y su consumo se extiende en casi todo el mundo. También son ampliamente conocidas sus propiedades benéficas en la salud humana como por ejemplo la disminución de riesgos de enfermedades cardiovasculares. 33 Existen tres tipos de las olivas de mesa o aceitunas, las verdes de Estilo español, aceitunas negras maduras o Californian style, y aceitunas naturalmente negras. La producción de aceitunas de mesa verdes incluye un tratamiento anterior con cloro. Después del lavado, para eliminar el exceso de álcali, la fermentación de ácido láctico que ocurre espontáneamente en la salmuera. El método de tratamiento de aceitunas negras maduras incluye el almacenaje de la fruta en la salmuera (el 5-10 % NaCl) durante 2-6 meses, con acidificación a pH 4 con ácidos lácticos y acéticos y almacenaje en condiciones anaerobias/ aeróbicas para prevenir la fermentación. Las aceitunas entonces son tratadas con la solución diluida de NaOH y son oxidadas. Después del lavado, las aceitunas son colocadas en la salmuera y se añade gluconato ferroso o lactato ferroso para mantener el color negro (Pereira, 2007). Las aceitunas de mesa son fuentes conocidas de compuestos con importancia biológica, dichas propiedades están relacionadas con los ácidos grasos, especialmente con aquellos monoinsaturados y otros componentes que se encuentran en menor proporción como tocoferoles y compuestos fenólicos. Los polifenoles actúan como antioxidantes naturales, son los principales metabolitos secundarios, representando aproximadamente el 2-2.5 % de la pulpa (Pereira, 2007). El contenido de compuestos fenólicos en la aceituna depende de varios factores, como las condiciones de cultivo, el clima, los regímenes de irrigación, el grado de madurez de la fruta, y el proceso de elaboración. En la figura 3. 1 se observan las diferentes estructuras químicas de los principales compuestos fenólicos aislados de las aceitunas. 34 Figura 3. 1. Estructuras químicas de compuestos fenólicos identificados en un extracto acuoso procedente de residuos de la industria de las aceitunas. Fuente: Pereira, 2007. 3. 11. 5. 1. Propiedades del polvo de aceitunas como antimicrobiano El polvo de aceitunas es un producto nuevo desarrollado por la multinacional farmacéutica Natraceutical S.A. Es un extracto 100% natural de olivas, rico en nutrientes, fibra dietaria, antioxidantes, polifenoles y se espera que ayude a mejorar la salud de los consumidores, porque contiene también ácido oleico, escualeno, tocoferoles y pigmentos naturales Investigaciones recientes señalan que el polvo de aceitunas como ingrediente alimentario, tiene una nueva aplicación como antimicrobiano, este producto se ha utilizado recientemente en España en la elaboración de productos de panadería y repostería. Existe un alto riesgo de contaminación de panes y otros productos por hongos de los géneros Aspergillus y Penicillium. Estos hongos generan defectos muy visibles en los panes, textura más viscosa, cambios en el aroma y en el color. Por otra parte las materias primas de 35 panadería como la harina, la malta, la levadura en barra, los aditivos e incluso la maquinaria y los utensilios se pueden contaminar por esporas termorresistentes de B. cereus y que posteriormente pueden germinar durante el almacenamiento en el producto terminado. En respuesta a este problema se buscan nuevos aditivos capaces de controlar esporas durante periodos de almacenamiento del producto. Actualmente se están estudiando muchos compuestos de olivas y sus derivados, compuestos presentes en las olivas como los secoiriodoides (oleuropeina y derivados) son la clase de polifenoles presentes en mayor proporción, el hidroxitirosol es un derivado fenólico de la oleuropeina que ha sido estudiado en pruebas in Vitro contra bacterias Gram positivas y Gram negativas mostrando una notable actividad antimicrobiana (Serra et al., 2007). La actividad in Vitro de ocho aldehídos alifáticos de cadena larga provenientes de olivas mostraron actividad antimicrobiana contra cepas bacterianas frescas Adicionalmente aldehídos α-β- insaturados mostraron tener un amplio espectro antimicrobiano contra bacterias tanto Gram positivas como Gram negativas (Bisignano et al., 2001). Otro estudio reveló el potencial antimicrobiano de ocho compuestos fenólicos aislados de pasta de oliva, contra E.coli, Klebsiella pnueumoniae, Bacillus cereus, Aspergillus flavus y Aspergillus parasiticus, con resultados bastante promisorios. Los compuestos fenólicos incluían ácidos p-hidroxibenzóico, vainillínico, cafeíco, protocatequico, siringico y p-cumárico; oleuropeina y quercetina (Bisignano et al., 2001). 3. 12. FUNDAMENTOS Y DEFINICIONES DE LAS ALTAS PRESIONES HIDROSTÁTICAS APH Se entiende por Altas Presiones, a la tecnología que utiliza las presiones comprendidas entre 100 y 1000 MPa junto con un liquido presurizante normalmente el medio utilizado para transmitir a presión es el agua, así este tratamiento se le conoce como hidrostático. Existen dos principios fundamentales en los que se basa la aplicación de las Altas Presiones (Cheftel., 1991): 36 • El primero indica que la presión se transmite de manera uniforme e instantánea a través de todo el material biológico tratado, tratándose así de un proceso isostático. Este proceso evita la presencia de zonas sobretratadas, así como la deformación de producto y hace que este sea más homogéneo. • El segundo se refiere al principio de Le Chatelier que indica que los fenómenos acompañados de una disminución de volumen (reacciones químicas modificación de las configuraciones moleculares) son favorecidos por un aumento de presión y viceversa. Según este principio la aplicación de la alta presión desplaza el equilibrio de un proceso hacia el estado que ocupa menos volumen. Por ejemplo en una macromolécula proteica donde hay enlaces tipo puentes de hidrógeno, la aplicación de presión induce la ruptura de interacciones hidrófobas y también pares de iones son acompañados de una restricción de volumen favorecida por la presión (Cheftel., 1991), sin embargo otros estudios suponen que los puentes de hidrógeno de las proteínas son casi insensibles a la presión (Mozhaev, 1994). Los efectos de la disociación iónica son favorecidos en general por el fenómeno de electrostricción. Así la presión causa la separación de cargas eléctricas ya que el agua se organiza de manera más compacta alrededor de las cargas iónicas y de los centros polarizados de las moléculas, lo que causa una reducción del volumen total (Cheftel, 1991). Se ha observado que los enlaces covalentes tiene baja compresibilidad y no se ven afectados por presiones inferiores a 1000 – 2000 MPa (Hayasi, 1992; Tauscher, 1995). De esta manera la estructura de las biomoléculas de bajo peso molecular (carbohidratos, lípidos y proteínas) y la estructura primaria de las moléculas no se ve modificada (Heremans, 1995). Se ha reportado también que diferentes reacciones de Maillard (por ejemplo xilosalisina) son reducidas o inhibidas bajo presión. La alta presión también contribuye a la disociación de grupos ácidos de las cadenas laterales de los aminoácidos y a la ruptura de los puentes salinos intramoleculares (Heremans, 1995). El comportamiento de las Altas Presiones sobre diferentes sistemas alimentarios demuestra la utilidad de la aplicación de esta técnica en la conservación de alimentos, que además de 37 extender su vida útil, mantiene la textura, el sabor, las vitaminas y otros nutrientes naturales en muchos productos. Para conseguir la inactivación de microorganismos y enzimas se utilizan presiones que varían entre 4000-9000atm. Con tiempos relativamente cortos (del orden de varios minutos) y combinación de temperatura moderada (30-50ºC) sin afectar sensiblemente las características sensoriales del producto. Las condiciones de procesado dependen principalmente del alimento a tratar, la tecnología de APH es todavía ineficaz, sin la combinación con temperatura alta, contra algunos microorganismos esporulados, ya que estos presentan una alta tolerancia a las altas presiones (Barbosa et al., 1998; Mills et al., 1998). La efectividad de los tratamientos de APH sobre la inactivación microbiana depende de variables del tratamiento (presión, tiempo, temperatura), de la composición del alimento y de la naturaleza del microorganismo. Existen investigaciones que muestran la inactivación microbiológica de los tratamientos de APH (Patterson, 2000). En general presiones entre 400 y 600 MPa producen importantes reducciones (4 unidades logarítmicas) de la mayoría de los microorganismos de la forma vegetativa, mientras que las esporas pueden resistir presiones superiores a los 1000 MPa. En general los microorganismos Gram negativos son más sensibles a los tratamientos de APH, seguido de las levaduras y hongos, Gram positivos y por último esporas. En productos vegetales de pH 4 es necesaria la combinación de los tratamientos de APH con otras tecnologías de conservación como el calor suave (Smelt, 1998; Patterson, 2000; Plaza et al., 2003). Aditivos como la nisina, la lactoperoxidasa o lisozima (García, Graells et al., 1999, 2000; Cano et al., 2005) En materia de APH hay estudios que datan del siglo XIX que tratamientos relativamente cortos a presiones de 2 a 3000 bares son suficientes para reducir considerablemente el número de microorganismos. Posteriormente un número de investigadores han centrado su atención en formas vegetativas y latentes de los microorganismos, lo cual muestra que evidentemente no es posible por ejemplo eliminar esporas a temperatura ambiente incluso cuando se opera a Altas Presiones por encima de los 17000 bares. (Spilimbergo et al., 2002) 38 La resistencia de las esporas bacterianas a agentes químicos y físicos y su habilidad para estar en dormancia durante largos periodos de tiempo, representan un problema en la industria alimentaria. El método más utilizado para la inactivación de esporas es el tratamiento térmico, pero causa pérdida de nutrientes y modificaciones en el sabor de los alimentos. El principal objetivo de las tecnologías no térmicas es preservar los alimentos sin alterar sus cualidades. El tratamiento con Altas Presiones Hidrostáticas (APH) puede inactivar microorganismos a temperatura ambiente o en combinación con bajas temperaturas en un tratamiento de calentamiento suave manteniendo los nutrientes y las características organolépticas otra ventaja sobre los tratamientos térmicos es que la presión empleada en el tratamiento es independiente de la muestra, porque la presión actúa instantánea y uniformemente en los alimentos; y mantiene la muestra bajo presión por un periodo extendido de tiempo sin requerir energía adicional. (Mertens, 1992). 3. 12. 1. Aspectos técnicos de las Altas Presiones Hidrostáticas La tecnología de la alta presión es la aplicación de una presión uniforme en todo el producto, y se aplica básicamente para presionar de forma isostática en principio se utilizaba en la industria mineral y metalúrgica por ejemplo en la fabricación de cuarzo y reactores químicos. Algunas reacciones químicas se llevan a cabo a alta presión para aumentar el rendimiento de la reacción. Las cámaras de Alta Presión se utilizan también como simuladores para probar equipos que se usan en un ambiente de Alta Presión; por ejemplo, en el fondo del mar. 3. 12. 1. 1. Generación de Alta Presión Las cámaras son vasos de presión que pueden soportar las Altas Presiones se utilizan en la industria del metal y la cerámica. Sin embargo, la industria alimentaría requiere equipos que toleren presiones de más altas de 4000 atm con un ciclo más eficiente y duradero de 100.000 ciclos/año. La alta presión se puede generar del siguiente modo: 39 Compresión directa, que es generada por presurización de un medio con la parte final de un pistón de diámetro pequeño. El diámetro de la parte final del pistón se mueve con una bomba de baja presión este es método de compresión permite una compresión muy rápida, pero las limitaciones del cierre dinámico de alta presión entre el pistón y la superficie interna de la cámara restringe el uso de este método a escala de laboratorio o sistemas de planta piloto la figura 3. 2 ilustra las partes que componen un sistema de compresión directa. Bomba de baja presión Pistón Cámara de presión Medio de presión Cierre del fondo Figura 3. 2. Compresión directa. Fuente: CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Universidad de Talavera, 2006 Compresión indirecta, que utiliza un intensificador de la Alta presión para bombear el medio de presión desde un depósito hacia la cámara de presión cerrada hasta que alcanza la presión deseada la figura 3. 3. muestra un esquema de la estructura de un sistema de compresión indirecta. La mayoría de los sistemas industriales de presión isostática utiliza el método de compresión directa. 40 Cierre superior Medio de presión Cierre inferior Intensificador Depósito del medio de presión Figura 3. 3. Compresión indirecta. Fuente: CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Universidad de Talavera, 2006 Con respecto al aumento de temperatura durante un tratamiento a APH se puede decir que el calentamiento del medio de presión, utiliza la expansión del medio de presión mediante el aumento de temperatura para generar alta presión. Por tanto el calentamiento del medio de presión se usa en combinación con alta temperatura; eso requiere un control muy estrecho de la temperatura con el volumen interno entero de la cámara de presión (Rodrigo 2003). Los sistemas de presión isostática pueden operar como sistemas fríos, templados y calientes: Presurización isostática fría (PIF), que es esencialmente una técnica antigua utilizadas en las industrias del metal, cerámica, carbón, grafito y plástico. Los materiales en polvo se colocan en un molde elastómero y sometido a alta presión. El proceso de PIF utiliza configuraciones de bolsas húmedas y bolsas secas. En el método de bolsa húmeda el molde se llena fuera de la cámara de alta presión. 41 Presurización isostática templada (PIT), la presión se aplica con temperaturas que van desde la temperatura ambiente hasta 200ºC. PIT se usa en situaciones en las que una reacción química tiene lugar durante la pasteurización. Presurización isostática caliente (PIC), el material es uniformemente calentado y presurizado. La temperatura puede llegar a los 2200ºC y la presión es de 1000- 4000 atm. El medio de presión utilizado es un gas, como argón, nitrógeno, helio o aire (Barbosa, 1997) 3. 12. 1. 2. Operación de una cámara de Alta Presión Hidrostática (APH) Las muestras a tratar se colocan en un envase estéril con hielo y posteriormente es sellado y se coloca en la cámara de presurización. Para el envasado de los alimentos en tratamientos con APH se recomiendan películas de alcohol de polivinilo y películas de copolímero de etilén–vinilo. Una vez que la cámara se haya cargado con el alimento envasado y se haya cerrado, se llena con el medio de presión- transmisión. El fundamento para la aplicación de la alta presión en alimentos, es la compresión del agua que rodea el alimento. A temperatura ambiente, el volumen del agua decrece un 4 % a 1000 atm. Debido a la compresión del líquido que provoca un pequeño cambio de volumen., las cámaras de alta presión utilizan agua, ya que no presentan los peligros de operación de las cámaras que utilizan gases comprimidos. El alimento se coloca a presión durante un determinado periodo de tiempo. El tiempo de tratamiento en la cámara de presión depende del tipo de alimento y de la temperatura del proceso. Al final del tiempo de procesado se descomprime la cámara para sacar la carga tratada. Se coloca una nueva carga de alimento en la cámara y se inicia de nuevo el ciclo. Los retos de la ingeniería en la aplicación de APH en la industria alimentaría básicamente son: la fabricación de las cámaras de presión para el manejo de grandes volúmenes de alimentos y la resistencia a presiones elevadas. La cámara de presión debe tener un ciclo de tiempo corto, ser fácil de limpiar y segura de operar. Desde el punto de vista industrial es deseable el desarrollo de procesos continuos de pasteurización con costes de inmovilizado y operación razonablemente bajos. La mayoría de estos retos se han cumplido, pero todavía 42 se llevan a cabo investigaciones para desarrollar tecnología de alta presión y el equipo necesario. 3. 12. 2. Descripción general de un sistema de Alta Presión industrial Un sistema industrial de alta presión consiste en una cámara cerrada, un sistema de generación de presión, un dispositivo de control de la temperatura y un sistema de manejo que puede ser automatizado o no. La cámara de alta presión y su cierre: el corazón del sistema es la cámara de presión, la cámara cilíndrica se construye en acero de baja aleación de resistencia a alta tracción. Generación de la presión: una vez cargada y cerrada, la cámara se llena con el líquido presurizante. Comúnmente en aplicaciones de presión isostática fría o tibia el medio presurizante es simplemente agua mezclada con aceite soluble para lubricar y evitar la corrosión. Alternativamente puede ser usado un aceite mineral de baja viscosidad. También se puede utilizar agua destilada pero requiere que el equipo sea construido en acero inoxidable en la cámara de presión, la tubería y los conductos de todo el sistema. La alta presión hidrostática es generada mediante compresión directa, compresión indirecta o a través del calentamiento del medio de presión. En el caso de compresión directa se hace a través de un pistón, el medio de presión en la cámara de alta presión es presurizado directamente mediante un pistón manejado por una bomba de baja presión. Con respecto a como controlar la temperatura durante el tratamiento durante la fase de carga y del medio de transmisión de presión dentro de la cámara de alta presión existen dos métodos, uno, por calentamiento o enfriamiento de la cámara desde afuera o internamente por una fuente de calor o enfriamiento ubicada dentro de la cámara, la manera más simple de control externo de temperaturas se realiza mediante bandas eléctricas de transmisión de calor que están alrededor de la cámara. Este método solo permite calentar el contenido de la cámara por encima de la temperatura ambiente; cuando se requiere calentar o enfriar la cámara puede tener una chaqueta con medio de calentamiento /enfriamiento en circulación. 43 La figura 3. 4 es una fotografía del equipo de Altas Presiones Hidrostáticas utilizado en industria. Figura 3. 4. Sistema de Altas Presiones Hidrostáticas a nivel industrial CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Universidad de Talavera, 2006 3. 13. EFECTOS BIOLOGICOS DE LA ALTA PRESIÓN La alta presión induce cambios en los sistemas biológicos, morfológicos, bioquímicos y genéticos; así como cambios en la membrana y pared celular de los microorganismos. En general las bacterias Gram negativas se inactivan a una presión menor que las Gram positivas. 44 3. 13. 1. Efecto sobre los microorganismos Los primeros estudios sobre inactivación de microorganismos por efecto de la presión fueron realizados en Francia por Certes en 1884 y en EUA por Hite en 1914 (Hoover, 1993). Las altas presiones inducen cambios de tipo morfológico, bioquímico y genético que tiene lugar en la membrana y en la parte celular de los microorganismos, además provocan cambios en la reproducción de los microorganismos (Cheftel, 1999). Se han observado varios cambios de la célula bajo el efecto de la presión como la compresión de las vacuolas de gas, la elongación de la célula, la contracción con formación de poros y la modificación del núcleo (Cheftel, 1992). En cuanto al material genético este se ve afectado a nivel de las enzimas implicadas en la replicación y la trascripción del ADN (Cheftel, 1992). Algunos sistemas enzimáticos son inhibidos por la presión como es el caso de las deshidrogenasas en E.coli a 100 MPa y las carboxilasas de las levaduras a 400MPa (Cheftel, 1992). Según Cheftel (1992) la destrucción celular puede ser causada por la inhibición de la ATPasa o por la cristalización de la membrana de fosfolípidos en cambios irreversibles en la permeabilidad celular y el intercambio iónico. En resumen los cambios que ocurren en la célula se pueden resumir así: Inactivación microbiana: las altas presiones moderadas disminuyen la velocidad de crecimiento y reproducción, las presiones muy elevadas provocan la inactivación de los microorganismos. El umbral de presión para el retraso en la reproducción e inactivación depende de cada microorganismo y especie. Aunque las esporas son altamente resistentes a las altas presiones, estas pueden ser germinadas bajo presión. Este proceso lleva a la aparición de células vegetativas que son más sensibles a la presión y a otros métodos de inactivación (Earnshaw, 1996). Presiones 45 de 50 a 300 MPa son suficientes para inducir la germinación de las esporas (Wuytak et al, 1997). Los efectos en las esporas bacterianas se pueden resumir así: Un aumento en la sensibilidad al calor y a la radiación, a la actividad respiratoria, a la turbidez y coloración de la suspensión de esporas. Pérdida de la refractibilidad. Pérdida de peso, liberación de calcio y ácido dipicolínico al medio circundante. Con un tratamiento de APH, las esporas germinan en células vegetativas, entonces las células vegetativas son inactivadas. A bajas temperaturas, una presión baja causa la germinación y una sensibilidad al calor pero no se aprecia inactivación de las esporas germinadas. Presiones medias causan una considerable germinación y gran producción de esporas germinadas se inactivan. Presiones altas causan menor germinación y solo una pequeña porción de las esporas germinadas se inactivan. Por encima de los 65 ºC, la inactivación de esporas es debido al calor y no a la presión. Los intervalos de temperatura y presión para la germinación e inactivación dependen de la clase de esporas. La pérdida de resistencia el calor durante la germinación se asocia con el aumento de hidratación de las células, y la transformación de sol a gel (Barbosa, 1997) La inactivación de esporas por presión está fuertemente influenciada por la temperatura y menos fuertemente por el pH, actividad del agua y fuerza iónica. La temperatura óptima para la iniciación de la germinación de esporas difiere a diferentes presiones. La inactivación de esporas es mayor cerca de la neutralidad y más pequeña a niveles extremos de pH. Los solutos no iónicos a baja actividad del agua (a w) tienen un pequeño efecto en la activación de esporas por presión, mientras que la presencia de solutos como NaCL y más efectivamente CaCL2 disminuyen la inactivación. La mayoría de esporas no pueden germinar por altas presiones en ausencia de iones inorgánicos. Los iones pueden afectar la degradación catalizada por enzimas de peptidoglicano durante la germinación. La prioridad efectiva de iones en la germinación inducida por presión es H> K > Mn> Ca, Mg, Na. Los iones también causan un aumento de la pérdida de la resistencia al calor de esporas en soluciones tampón con respecto a suspensiones en agua destilada a la misma presión y temperatura (Raso y col. 1998) 46 La germinación iniciada por presiones bajas es afectada por los constituyentes del medio en suspensión. Por ejemplo, los aminoácidos alanina e inosina ribosita son potenciadores efectivos de la germinación por presión de esporas de B. cereus. Los potenciadotes e inhibidores de la germinación se vuelven menos efectivos en la aceleración o prevención de la germinación, respectivamente, a medida que la presión aumenta. Los inhibidores alcohol octilo (10 mM) y cloruro de mercurio (1 mM y 10 mM) previene completamente la germinación de B. cereus y B. coagulans a 400 y 600 atm, respectivamente, a medida que la presión aumenta. El azúcar y la sal son entonces inhibidores de la inactivación de esporas (Delgado, 2005). 3. 13. 2. La Alta Presión Hidrostática y las reacciones bioquímicas Las reacciones químicas que más deben afectarse por la alta presión son las reacciones con reactantes que experimentan o bien un aumento o un descenso del volumen. La presión provoca un descenso en el espacio molecular disponible, o un aumento en las interacciones en cadena. La Alta Presión favorece las reacciones afectadas con formación de puentes de hidrógeno debido a que los enlaces provocan un descenso en el volumen. La alta presión desnaturaliza las moléculas de proteína. La desnaturalización de las proteínas por la presión es un fenómeno complejo que depende de la estructura de la proteína, del intervalo de presión, del pH y de la composición del disolvente El principal interés de la aplicación de las APH en los alimentos se centra esencialmente en introducir cambios positivos en ellos como la mejora de su conservación, textura y sabor sin variar el valor nutricional del producto original. El tratamiento con Altas Presiones Hidrostáticas se utiliza desde la década de los noventa en diferentes países y en distintos productos tal como lo muestran las figuras 3. 5 y 3. 6 que muestran un resumen de la evolución de las APH en el mercado mundial y los efectos de estas en diferentes alimentos disponibles en el mercado. La tecnología de la APH se puede aplicar para alargar la vida comercial de los alimentos y modificar la textura y propiedades sensoriales de los alimentos y para el almacenamiento de alimentos sin necesidad de congelación. La vida comercial de los alimentos se aumenta por inactivación de los microorganismos esporas y enzimas indeseables, utilizando las 47 presiones apropiadas. Es deseable descongelar los alimentos congelados de modo uniforme. La Alta Presión Hidrostática puede descongelar uniformemente los alimentos. La descongelación con presión es más rápida cuando los alimentos contienen más sólidos, tales como NaCL o azúcares. Al exponer los alimentos a alta presión se producen cambios sensoriales dependiendo del tipo de alimento. Por ejemplo, la estructura interna de los tomates se vuelve más firme, los tejidos de pollo y filetes de pescado se vuelven opacos y la ternera se ablanda. La alteración de la estructura del almidón y la proteína por alta presión se puede utilizar para que el arroz se pueda cocinar en pocos minutos. Bajo la influencia de la alta presión, los enlaces covalentes permanecen intactos, mientras que los no covalentes se rompen. El tratamiento de presión aumenta la digestibilidad de las proteínas cárnicas. El valor aparente biológico de las proteínas y la razón de eficacia proteica de la carne tratada con presión son equivalentes a las proteínas cárnicas ablandadas a presión atmosférica. Generalmente las enzimas de las hortalizas se inactivan mediante escaldado con agua caliente. Las desventajas del escaldado incluyen el deterioro térmico, extracción de nutrientes y la posible contaminación medioambiental debido a la producción de efluentes con alta demanda bioquímica de oxígeno. El escaldado con agua reduce los recuentos totales de microorganismos en 3 ciclos, mientras que la reducción de recuentos totales por Ultra Alta Presión (UHP) es generalmente de 4 ciclos logarítmicos (Universidad de Talavera, 2006) País producto Proceso envasado Vida útil Interés de las APH (año) Japón 1990 Mermeladas (fresa, Indirecto 400 Vidrio con 2 a 3 meses a Higiniezación, mejora manzana) MPa 10–30 cubierta plástica 4ºC del proceso de minutos gelificación Salsas (naranja, cebolla y manzana) 48 Japón 2000 Arroz precocido 400 MPa hipoalergénico Italia Postres de fruta Envases Indireto 600MPa 3-5 triangulares minutos a 17ºC plástico 2001 USA Conservado a Desnaturalización por Tº ambiente APH de proteínas hipoalergénicas seguido de una esterilización térmica 1 a 2 meses de Productos derivados Indirecto del aguacate Inactivación enzimática PPO higienización, mantenimiento de las propiedades sensoriales, sustitución del tratamiento térmico Ensalada vegetales Inactivación enzimática PPO higienización, mantenimiento de las propiedades sensoriales, sustitución del tratamiento térmico, incremento de vida útil 2002 USA Inactivación enzimática PPO , higienización, mantenimiento de las propiedades sensoriales de Indirecto 2003 Canadá 2003 Cebollas loncheadas Indirecto USA 2004 Productos de soja, tofú España 2005 Platos preparados 500 MPa de verduras “listos para consumir” Bolsas (225g) plásticas 45 días Eliminación del sabor amargo, aumento de la frescura y alargamiento de vida útil Higienización, aumento de vida útil Envasados al vacío Skin pack Higienización, aumento de vida útil Figura 3. 5. Productos hechos en base a frutas y verduras en el mercado tratados con APH. Fuente: CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Universidad de Talavera, 2006 49 País producto Proceso envasado Vida útil Interés de las APH (año) Botellas de vidrio 6 a 12 meses a Inactivación 300 ml 4ºC levaduras mantenimiento sabor original 400 MPa 15 producto minutos 30ºC Japón Sake (licor de arroz) Indirecto (bolsas PE) 1993 Francia 1994 Zumos de cítricos Botellas de PE de 18 días a 4ºC 75 cl y 1L Indirecto 400 MPa 1 minuto Tº ambiente Líbano sin sus Indirecto MPa 500 Botellas de plástico 0,25, 0,5, 1 y 2L Higienización alteración de propiedades sensoriales sin sus Zumos de citricos Indirecto MPa 500 Botellas plástico Higienización alteración de propiedades sensoriales sin sus de 2 o 3 veces del Higienización zumo normal alteración de propiedades sensoriales sin sus de 2000 USA Higienización alteración de propiedades sensoriales Zumos de frutas 2001 México de , del del Zumo de manzana Directo y Botellas orgánico semicontinuo plástico 2001 Portugal 2001 Zumo de manzana y Indirecto 450 Bolsas cítricos MPa 20 a 90 (225g) segundos a 12ºC Italia 2001 Zumos de frutas: Indirecto 600 Bolsas plásticas manzana, cítricos y MPa 3-5 zanahoria minutos 17ºC República Zumo de brócoli y Indirecto Checa 2004 manzana MPa minutos plásticas 28 días 600 PET botellas 10 Higienización alteración de propiedades sensoriales sin sus 1 a 2 meses Higienización, aumento de vida útil 21 días Higienización sin alteración de sus propiedades sensoriales. Anticarcinógenos Figura 3. 6. Zumos en el mercado tratados con APH. Fuente: CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Universidad de Talavera, 2006 50 3. 13. 3. Efecto de las Altas Presiones sobre los alimentos 3. 13. 3. 1 Agua La presión modifica muchas propiedades del agua. El volumen de agua disminuye a un 4% con 100 MPa y un 15% a 600 MPa a una temperatura de 22 ºC (Cheftel, 1992). Esta disminución de volumen implica un aumento en la densidad y como consecuencia, los coeficientes de difusión de los solutos disminuyen. La compresión adiabática del agua causa un aumento de 2 a 3ºC por cada 100 MPa, aumento que depende de la temperatura inicial del agua y de la velocidad de compresión. Este cambio es reversible cuando se realiza la descompresión ya que se produce una disminución de la temperatura de la misma magnitud (Cheftel y Culioli, 1997). El punto de fusión del agua disminuye con la presión, de –5ºC a 70 MPa y –20ºC a 200 MPa. El pH del agua disminuye bajo presión de 7 a 6.27 cuando la presión aumenta de 0.1 MPa a 1000 MPa. 3. 13. 3 2. . Lípidos La temperatura de fusión de los lípidos en especial de los triglicéridos, aumenta con la presión de manera reversible en más de 10 ºC por cada 100 MPa. Por esta razón los lípidos en estado líquido a temperatura ambiente pueden cristalizar bajo presión. La presión induce la formación de cristales densos y más estables que tiene un nivel de baja energía y alta temperatura de fusión. Esto puede explicar algunas de las causas de la destrucción de microorganismos por la presión debido a los cambios en los fosfolípidos de la membrana celular (Cheftel, 1995). El aumento de presión puede producir un aumento en la oxidación de lípidos insaturados del alimento. Se ha observado que el tratamiento de Alta Presión en alimentos con alto contenido proteico produce un aumento en la oxidación lipídica. Se cree que el aumento de oxidación esta relacionado con la desnaturalización de las proteínas causadas por la presión así en algunos casos libera iones metálicos que pueden catalizar la oxidación lipídica (Beltran et al., 2003). 51 3. 13. 3. 4. Carbohidratos Cheftel, 1992 asegura que los azúcares simples no resultan afectados por este tratamiento. Las reacciones de Maillard son inhibidas por la aplicación de Alta presión entre 50 y 200 MPa (Sangonis et al., 1997). En consecuencia el color y sabor típicos de esta reacción no se producen. La alta presión afecta el paso de sol a gel de los polisacáridos formándose geles diferentes a los que se forman por calor. 3. 13. 3 .4. Proteínas Las modificaciones de las proteínas se deben a modificaciones a nivel inter e intramolecular entre grupos funcionales de los aminoácidos. Resultan efectos como el aumento de las interacciones hidrofóbicas a presiones de 300 a 400 MPa, debido a la alta compresibilidad del agua libre comparada con la de los puentes de hidrógeno. Por otra parte los grupos sulfíhidrilo pueden oxidarse dando lugar a puentes disulfuro en presencia de oxígeno (Funtenberger et al., 1995), aunque en muchos casos este tipo de enlace son los responsables de mantener la estructura de algunos tipos de proteínas debido a su gran estabilidad frente a la presión. En general la aplicación de presiones superiores a 100-200 MPa a temperatura ambiente provocan la disociación de macroestructuras en subunidades, así como el despliegue y desnaturalización de estructuras monómericas, probablemente debido al debilitamiento de las interacciones hidrofóbicas y la separación de los puentes salinos intermoleculares e intramoleculares (Cheftel, 1992). La desnaturalización inducida por la presión es a veces reversible, pero la renaturalización puede ocurrir después de que se haya liberado la presión. Los efectos de la alta presión en la estabilidad proteica están gobernados por el principio de Le Chatelier: los cambios positivo/negativos en el volumen con un aumento en la presión provocan un desplazamiento del equilibrio hacia la rotura/formación de enlaces. Aplicación de las altas presiones hidrostáticas en el procesado de alimentos. 3. 13. 3. 5. Enzimas La alta presión induce cambios en la velocidad de las reacciones que catalizan las enzimas así como cambios estructurales. La función enzimática puede verse afectada de diferentes 52 maneras; la inactivación puede ser parcial o total dependiendo del tipo de enzima, del nivel de presión, del tiempo y la temperatura o el pH del medio. Se ha sugerido que la eficiencia de la alta presión en la inactivación de enzimas se puede aumentar mediante la aplicación de ciclos de presión. Se trata de aplicaciones sucesivas de altas presiones produciendo una mayor inactivación enzimática y una menor actividad residual que la obtenida después de un proceso de presión continuo durante el mismo tiempo total del tratamiento (Basak et al.,, 2001). El trabajo realizado por Seyderhelm et al., 1996 sobre el efecto de la alta presión sobre algunas enzimas en tampón fosfato, observaron que la sensibilidad a la presión en orden ascendente fue: lipoxigeneas, lactoperoxidasa, pectiesterasa, lipasa, fosfatas, catalasa, polifenoloxidasa y peroxidasa. El aumento en la temperatura indujo una mayor inactivación de estas enzimas. La alta presión podría afectar la interacción sustrato enzima, sí el sustrato es una macromolécula la alta presión podría modificar la conformación de la macromolécula o la disociación en subunidades afectando su actividad (Balny y Masson, 1993). 3. 13. 3. 6. Vitaminas El efecto de las altas presiones sobre la estabilidad de las vitaminas ha sido uno de los estudios que más interés ha suscitado entre los diferentes autores que evalúan este proceso en comparación a los tratamientos térmicos (Mertens, 1993; Kübel et al., 1997 y Taukis et al., 1998). En una investigación desarrollada por Sancho et al., 1999 sobre el efecto de la alta presión en vitaminas hidrosolubles B1, B6 y C diluidas en tampón fosfato a pH 6.67 mostraron que los tratamientos a 200, 400 y 600 MPa durante 30 minutos a 20ºC no tuvieron ningún efecto significativo sobre las vitaminas B1 y B6, mientras que la vitamina C fue afectada y mostró un 87.8% y 88.6% de retención después del tratamiento de 200 y 600MPa, respectivamente. En otro estudio sobre el efecto de las altas presiones sobre la vitamina C en jugo de frutas ácidas se observó una ligera degradación de esta vitamina después de un tratamiento a 600 MPa a 40ºC durante 40 minutos la cual fue del orden del 15 al 26% (Taukis et al., 1998). 53 3. 13. 4. Aplicaciones en jugos de frutas y/o vegetales Gran número de investigaciones muestran que es posible estabilizar productos ácidos como jugos de frutas y derivados del tomate a partir de 300 MPa a temperatura ambiente (Castellari et al., 2000). Las bebidas de vegetales tradicionales en países mediterráneos como España se demoninan “Gazpachos” y son una especie de sopas que se sirven frías. Tienen como ingredientes gran variedad de hortalizas, que contienen gran número de vitaminas, compuestos antioxidantes, son fuente de fibra vegetal o dietética soluble que se encuentra principalmente en los vegetales e incluye también gomas, pectinas, mucílagos, algunos tipos de hemicelulosa y carbohidratos de reserva (Bellaterra, 2004). Los gazpachos poseen un alto contenido en minerales y glúcidos así como una serie de sustancias de interés fisiológico como los compuestos fenólicos presentes en hortalizas que en muchos casos contribuyen al sabor y color que estos poseen. Los compuestos fenólicos presentes en las plantas poseen acciones farmacológicas y antioxidantes tal como se demuestra al inhibir en ensayos in Vitro la peroxidación de los lípidos y lipoxigenasas (Bellaterra, 2004) 3. 14. MODELOS CINÉTICOS DE INACTIVACIÓN Y CRECIMIENTO MICROBIANO. Habitualmente, para el estudio de la resistencia microbiana a distintos agentes letales se utilizan las denominadas curvas de supervivencia en las que se representa el logaritmo decimal del número de supervivientes frente al tiempo de tratamiento. Estas gráficas se suelen describir mediante distintos modelos matemáticos a partir de los cuales se obtienen diferentes parámetros que permiten cuantificar y predecir la resistencia bacteriana. La obtención de modelos y parámetros cinéticos son básicos para el desarrollo de nuevos procesos de conservación de alimentos. Su aplicación directa en la industria se aprovecha para optimizar procesos y mejorar la seguridad microbiológica de los alimentos, así como para implementar planes de análisis de peligros y puntos de control críticos (APPCC) 54 también permite realizar estimaciones cuantitativas, considerando la acción simultánea de diversos factores limitantes extrínsecos e intrínsecos; lo cual implica una gran ventaja, en tiempo y costo, comparado a los métodos utilizados tradicionalmente en microbiología de alimentos Las técnicas de modelación matemática están siendo gradualmente aceptadas y reconocidas para estimar la vida útil y seguridad en muchos productos alimentarios. El desarrollo Muchos modelos de crecimiento para patógenos han sido reportados en la literatura desde la pasada década e incluyen modelos para Aeromonas hydrophila, Clostridium botulinum, Listeria monocytogenes, Salmonella spp, Shigella flexneri, Staphylococcus aureus y Yersinia enterocolitica. No obstante no existen muchos informes para bacterias esporoformadoras (Meng y Schaffner, 1997). El conjunto de estos modelos y simulaciones en microbiología creció al punto de ser reconocida como una disciplina de la microbiología de alimentos, denominada “microbiología predictiva”, concepto introducido por McMeekin et al., 1993. 3. 14. 1. Modelos matemáticos de inactivación Una gran parte de las investigaciones en inactivación microbiana se refieren a tratamiento térmico y varios autores como Vijay & Eblen (1999), desarrollaron modelos matemáticos que describen el efecto del pH y la temperatura en tratamientos térmicos, tomando como parámetros D que es el tiempo de reducción decimal definido como el tiempo requerido para reducir un ciclo logarítmico la concentración de microorganismos sumiendo una relación lineal y logarítmica entre el número de microorganismos sobrevivientes y el tiempo, después de un tratamiento térmico. Sin embargo no siempre se puede asumir esta relación lineal por la presencia de colas y hombros en la curva de sobrevivientes. Por lo tanto se pueden utilizar modelos matemáticos de distribución probabilística (Fernández, 2002) 3. 14. 1. 1. Modelo de Bigelow Los modelos cinéticos clásicos asumen una relación de primer orden entre la población microbiana y la intensidad de tratamiento. El modelo desarrollado por Bigelow, Ball y 55 Stumbo (Stumbo, 1973) (Ecuación 1) se ha usado principalmente para explicar las curvas de supervivencia debidas al tratamiento térmico: Log S = − t D Ecuación 1 donde S es la fracción de supervivientes calculada como la fracción entre el número de microorganismos vivos tras un tratamiento especifico y el numero inicial de microorganismos; D es el tiempo de reducción decimal definido como el tiempo requerido para reducir un ciclo logarítmico la concentración de microorganismos (figura 7) y t es el tiempo de tratamiento (en segundos). El valor de D o tiempo de reducción decimal se calcula a partir de la pendiente de la recta. Figura 3. 7. Ejemplo de curva de supervivencia de esporas de B. stearothermophilus a temperatura constante (115 ºC). 3. 14. 1. 2. Modelo de Weibull La distribución de Weibull se ha aplicado en la industria mecánica para inquirir el tiempo de fallo de un determinado componente. Este modelo consiste en una distribución de frecuencias que considera al microorganismo como una población, donde cada individuo 56 tiene una resistencia al tratamiento, por lo tanto las curvas de inactivación representan la distribución de la resistencia del conjunto de la población al tratamiento. Bajo esta perspectiva es más fácil explicar que no exista una relación lineal entre el tiempo de tratamiento y la muerte del microorganismo. Aparte de su sencillez, puede interpretar curvas con hombros y colas, y líneas rectas. S ( t ) = exp − n t a Ecuación 2 Donde S es la fracción de supervivientes, t es el tiempo de tratamiento expresado en µs, a es el parámetro de escala expresado en µs relacionado con la intensidad del tratamiento y n es el parámetro de forma, cuyo valor depende de la forma de la curva de supervivencia. Cuando el valor de n<1 las curvas de supervivencia presentan colas, es decir, la fracción residual de células que quedan por inactivar tienen menos probabilidades de morir, son las mas resistentes o las que mejor se han adaptado al estrés producido por los tratamientos. Cuando el valor de n>1, las curvas de supervivencia presentan hombros indicando que durante las primeras condiciones del tratamiento las células son resistentes al tratamiento y conforme aumentamos la intensidad del tratamiento se produce un aumento de la inactivación. En el caso que el valor de n sea igual a 1 la probabilidad que el microorganismo muera no depende del tiempo de tratamiento, en otras palabras, cada célula es igual de sensible al tratamiento sin importar lo que dure el mismo. Otro de los parámetros utilizados en el modelo de Weibull es el tiempo crítico que se puede definir como el tiempo donde se produce la mayor muerte del microorganismo tras el tratamiento y se puede expresar con la siguiente ecuación: tcw = a * Γ (1 + b − 1 ) Ecuación 3 Donde a y b son los parámetros de la ecuación 1.3 y Γ es la función gamma. 57 3. 14. 2. Modelos matemáticos de crecimiento 3. 14. 2. 1. Modelo de Baranyi El modelo de Baranyi fue desarrollado originalmente para curvas de crecimiento microbiano (Baranyi et al.1993; Baranyi et al. 1994), sin embargo Xiong et al. 1999 adaptaron el modelo a las curvas de supervivencia, obteniendo la siguiente ecuación: log N = log(q B + (1 − q B )e − k max ( t − B ( t )) ) N0 Ecuación 4 Siendo, B (t ) = (r + t ) 2 r 1 ( ln 2 + 3 2 r − rt + t 2 3 arctan 2t − r r 3 + 3 arctan 1 ) 3 Ecuación 5 Este modelo se adapta bien a curvas de supervivencia sigmoidales, donde qB puede ser usado como indicador de la existencia de colas en las curvas de supervivencia. El parámetro kmax es el índice de muerte máximo y puede ser considerado como una constante en la fase lineal de la curva de supervivencia. B(t) es una función que explica la fase lag (hombro) de la curva y viene definida por el parámetro r. Este modelo también se adapta a curvas de supervivencia no sigmoidales. En caso de la no existencia de colas en las curvas (qB=0), la Ecuación 1.5 se transformaría en: log( N t − B (t ) )= − N0 Dmin Ecuación 6 Donde Dmin=2.303/kmax., siendo Dmin el tiempo de reducción decimal. Como kmax se puede considerar como una aproximación del índice de muerte para la fase lineal de la curva, Dmin se define como el tiempo mínimo requerido para disminuir un ciclo logarítmico la población de microorganismos a una temperatura de referencia. En caso de no presentar la 58 curva fase de latencia, entonces el modelo se puede simplificar a un modelo cinético lineal de primer orden: log( N t )= − N0 D Ecuación 7 Donde D es el tiempo de reducción decimal. Definido como el tiempo requerido para reducir un ciclo logarítmico la concentración de microorganismos. 3. 14. 2. 2. Modelo de Gompertz El modelado matemático es realizado, generalmente, asumiendo condiciones constantes para determinar los valores de los parámetros cinéticos de crecimiento. Sin embargo, condiciones tales como temperatura, pH o composición de la atmósfera gaseosa no se mantienen constantes durante el almacenamiento refrigerado de los alimento. Debido a este hecho, en la actualidad el modelado matemático está orientado a la obtención de modelos dinámicos, es decir, modelos que permitan predecir la seguridad o vida útil de los alimentos bajo condiciones fluctuantes. En microbiología predictiva se distinguen tres niveles entre los modelos matemáticos: los modelos de nivel primario describen los cambios en el número de microorganismos en el tiempo; los de nivel secundario brindan datos acerca del efecto de las condiciones ambientales y los modelos de nivel terciario combinan los dos primeros (Whitin, 1995) Modelo de Gompertz: es considerado como un modelo primario esta definido por la siguiente ecuación log(Nt) = Log(N0) + C . e -e[-B(t-M)] Ecuación 8 Donde: t es el tiempo en horas, Nt y N0 son la densidad de población expresada como UFC/ ml, a tiempo final e inicial respectivamente, C es el logaritmo de la población que cambia desde la inecuación hasta la fase estacionaria, B es la tasa de crecimiento relativo la cual es adimensional, M es el tiempo en horas en el cual se alcanza la máxima tasa de crecimiento. 59 Las ecuaciones de cinética de crecimiento en este modelos se pueden determinar mediante dos parámetros la µ (velocidad específica de crecimiento) y λ (factor de latencia). 60 4. MATERIALES Y MÉTODOS 4. 1. Esporulación del microorganismo Para inducir la esporulación de B cereus se tomaron dos matraces de 50ml que contendrán 20ml de caldo nutritivo para inocular con colonias de B cereus. Se incubaron en un baño termostatado a 32ºC con agitación durante 24 horas al cabo de las cuales se observarán colonias características de B. cereus. (Barbosa y col., 1998) La cepa de B cereus utilizada fue la ATCC 14579 proveniente de la Colección Española de Cultivos Tipo. La esporas se obtuvieron usando el medio de esporulación descrito por Mazas y col (1995), ligeramente modificado en su composición: Caldo nutritivo(g/L) de acuerdo con la British Pharmacopoeia (Scharlau Chemie), 13 g: agar bacteriológico (Scharlau Chemie) 0.05g; CaCl2 (Panreac, Montplet and Esteban) 0.06 g; glucosa (Panreac, Monplet and Esteban) 0.1 g; (NH4)2S (Merck) 0.08 g; MnCl2 4H2O (Merck) 0.008 g; CuSO45H2O (Panreac, Montplet & Esteban) 0.005 g y ZnSO47H2O (Panreac, Montplet & Esteban) 0.005g y se distribuirá en frascos Roux esterilizándose durante 20 minutos a 121ºC. Se utilizaron aproximadamente 20 frascos Roux con 0,5 ml del cultivo de células vegetativas de B cereus. La suspensión de microorganismos se extenderá con un asa de vidrio estéril. Posteriormente los frascos Roux se incubaran en una estufa a 30 ºC durante 24 horas (Delgado, 2005). A partir de las 48 horas se realizaron tinciones diarias para controlar la esporulación. Cuando la tasa de esporulación sea aproximadamente del 90% se procedió a recoger las esporas. Para ello la superficie de agar se lavó con una mínima cantidad de agua estéril y se rasparon cuidadosamente con un asa estéril. El agua con las esporas se depositó en frascos de centrifuga de 250 ml esterilizados, centrifugándose posteriormente en una centrifuga Beckman J2-21 a 2500 g durante 15 minutos a una temperatura de 5 ºC, se eliminó el sobrenadante, se resuspendío el sedimento en agua destilada y se volverá a centrifugar en las mismas condiciones (Larsen, 1999) 61 Las esporas limpias se almacenaron a 4 ºC en agua destilada estéril hasta su uso. Con este procedimiento se alcanzó una concentración de 10 8 esporas por ml. (Delgado, 2005) 4. 2. Recuento de Bacillus cereus Para determinar el número de microorganismos sobrevivientes se hicieron diluciones seriadas, se sembró en agar BHI (profundidad) 100 µl de las diluciones 10-3 hasta 10-7 las siembras se hicieron cada 24 horas, se incubaron a 32 ºC y todos los ensayos fueron realizados por duplicado, teniendo en cuanta solo los recuentos que se encontraran en el rango del microorganismo (30-300 UFC/ml). La misma técnica fue utilizada en todos los ensayos de este estudio. Figura 4.1 Figura 4.1 Dilución y siembra de las muestras tratadas (IATA., 2006) 4. 3. Ingrediente utilizado como antimicrobiano Se utilizará un ingrediente comercial a base de polvo de aceitunas denominado Olive Powder comercializado por la multinacional Natraceutical S.A., España. Este aditivo fue almacenado se mantuvo almacenado a temperatura ambiente a lo largo del estudio. 62 4. 4. Preparación del medio de referencia: Como medio de cultivo de referencia se utilizará BHIB (caldo de infusión cerebro corazón). Se prepararon frascos con un contenido de 30 ml de caldo BHIB (1.1 g x 30ml de agua) para los controles del experimento. Frascos con 30 ml de caldo BHI a los que se les agregarán diferentes concentraciones de polvo de aceituna: 1,5% (0.45 g/30ml de caldo BHIB), 2.5% (0,75 g/30ml de caldo BHI), 5% (1,5 g/30ml de caldo BHI) y 10% (3g/30ml de caldo BHI). 4. 5. Efecto del polvo de aceitunas sobre el crecimiento de B cereus en función del tiempo en medio de referencia Se estudió el comportamiento de las esporas de B cereus en medio de referencia (caldo BHI) en presencia de diferentes concentraciones de polvo de aceitunas 0, 1,5, 2,5 y 5%. Se evaluó el crecimiento del microorganismo a tres temperaturas diferentes de almacenamiento 7, 20 y 32 ºC. La temperatura de 7 ºC se utilizó como temperatura promedio de refrigeración para observa la influencia del polvo de aceitunas sobre las esporas de B cereus. La temperatura de 20 ºC fue una manera de simular una interrupción en un sistema de almacenamiento en refrigeración y 32 ºC es una temperatura muy cercana a la temperatura óptima de crecimiento de B cereus. El crecimiento del microorganismo en estas condiciones se siguió en el tiempo hasta 30 horas, tomándose muestras en los intervalos de tiempo 0, 1, 2, 3, 6, 10, 24, 27 y 30 horas, el recuento de Bacillus cereus se realizo según la metodología descrita anteriormente. 4. 6. Preparación de la bebida vegetal Para preparar la bebida de vegetales se utilizaron 2 kilogramos de zanahorias frescas y 2 kilogramos de judías verdes frescas embolsadas adquiridas en un mercado local. Se lavaron y picaron por separado, posteriormente se escaldaron a 90ºC durante tres minutos. El proceso de escaldado tuvo como propósito inactivar enzimas y eliminar la flora acompañante natural que esta presente en los vegetales. Tras el escaldado se pasaron por un triturador de alimentos (Moulinex, Barcelona, España) tres veces con el fin de extraer la mayor cantidad de zumo en volumen. La bebida obtenida se pasó por tres veces por un 63 tamiz. Finalmente se mezclo el zumo de judías verdes y el de zanahoria en una proporción 50:50 sin agregar agua. Se midió pH inicial. La bebida mezcla de vegetales resultantes se distribuyó en tubos Falcon de 50ml que pasaron a congelación a 4º C para posteriores ensayos. 4. 7. Efecto del polvo de aceitunas en el crecimiento de Bacillus cereus en sustrato vegetal Se estudió el efecto del polvo de aceitunas a distintas concentraciones (0, 1.5 y 2,5%) en el sustrato vegetal sobre el crecimiento de B. cereus, se evaluaron solamente dos temperaturas de almacenamiento 20 y 32 ºC. Se utilizaron controles negativos con bebida y sin ingrediente (polvo de aceitunas) se utilizaron frascos de 50 ml con perlas de vidrio (dos por cada concentración de polvo de aceitunas se colocaron 2 ml de bebida de vegetales para los controles y 2ml más con polvo de olivas), se inocularon con 10µl de la suspensión de esporas refrigerada directamente a los frascos 10 µl de suspensión de esporas previamente agitada, se procederá a agitar durante dos minutos y se tomarán 100µl que fueron transferidos a viales con 900 µl de agua peptonada y se realizarán diluciones seriadas con un factor de dilución de 1:10 (de 10 -2 a 10-7), se sembrarán las diluciones de 10-3 hasta 10-7. El crecimiento del microorganismo se siguió en el tiempo hasta las 72 horas y se tomaron muestras en las horas 0, 6, 24, 30, 48, 55 y 72. Para la realización de los recuentos se siguió la metodología descrita previamente. 4. 8. Preparación de los viales para el tratamiento a Altas Presiones Hidrostáticas Previo a cada experiencia, la bebida mezcla de vegetales fue descongelada e inmediatamente esterilizada a 121 ºC por 21 minutos, permitiendo climatizarse a temperatura ambiente. Treinta minutos antes de los tratamientos con APH, las suspensiones de esporas fueron sacadas del refrigerador y se agitaron durante dos minutos. Se tomaron dos viales (tubos Ependorf de 2ml) para cada tratamiento y control, así: dos viales para tratamiento a altas presiones APH con caldo BHI sin polvo de aceitunas, dos para tratamiento a APH con caldo BHI y polvo de aceitunas (2 por cada concentración), dos viales de control con caldo BHI sin polvo de aceitunas y dos más con BHI. Se utilizarán tubos capilares de vidrio 10 µl para inocular en los eppendorf con 10 µl de la suspensión de 64 esporas refrigeradas a los eppendorf que contenían los 10 µl de esporas de B. cereus se les adicionaron 1.8 µl de caldo BHI en el caso de los controles y 1.8 µl de caldo BHI con polvo de aceitunas en el resto de los eppendorf. Una vez preparados los viales se colocaron en bolsas de polieteileno llenas de agua y se termosellaron (Thermosealer MULTIVAC) antes de ser introducidas al equipo de APH. 4. 9. Tratamiento a Altas Presiones Hidrostáticas APH La unidad de Altas presiones hidrostáticas utilizada para este estudio fue High Pressure Food Processor EPSI NV, Walgoedstraat 19, Temse, Belgium (figura 4. 2) Este equipo alcanza presiones nominales de hasta 680 MPa con 2,35 litros de capacidad. La vasija contenedora de la presión hidrostática (diámetro interno de 100 mm y altura de 300 mm) está rodeada de una doble cámara por la que fluye el líquido refrigerante y que la mantiene a la temperatura de trabajo deseada, para este estudio la temperatura de tratamiento en todos los ensayos fue de 20 ºC (baño termostatado externo). El líquido de presurización es una mezcla de agua y glicol. El nivel de presión, el tiempo de presurización y la temperatura son controlados automáticamente. La velocidad del incremento de la presión es de 300 MPa/min y el tiempo de despresurización es menor a 1 min. El tiempo de tratamiento descrito en este estudio no incluye los tiempos de subida y bajada. Se utilizaron presiones de 200, 400 y 500 MPa, tiempos de tratamiento de 10 minutos para el medio de referencia y la bebida vegetal, 25 minutos solamente para la bebida de vegetales y para las concentraciones de polvo de aceitunas (0, 1,5 y 2,5%) 65 Figura 4. 2. Unidad de Altas Presiones Hidrostáticas. Fuente: Instituto de Agroquímica y Tecnología de Alimentos (IATA). Valencia 4. 10. Efecto de las Altas Presiones y el polvo de aceitunas en la inactivación de Bacillus cereus en medio de referencia Para esta parte del estudio se utilizaron presiones de 200, 400 y 500 MPa con un tiempo de tratamiento de 10 minutos. Se tomaron 12 viales de 2ml y se inocularon con 10µL de suspensión de esporas de B. cereus. De estos viales 8 fueron tratados con APH, 4 viales para la concentración 1.5% y 4 para la de 2.5% los 4 viales restantes fueron utilizados como controles, La toma de muestra se tomó únicamente tras 24 horas después de los tratamientos. 66 4. 11. Efecto de las Altas Presiones y el polvo de aceitunas en la inactivación de Bacillus cereus en la bebida vegetal Para evaluar el efecto de las APH y del polvo de aceitunas se utilizaron presiones de 200, 400 y 500 MPa con un tiempos de tratamiento de 10 minutos para las presiones 200, 400 y 500MPa con concentraciones de polvo de aceituna (0,1,5 y 2,5%), por otra parte se ensayó un tiempo de tratamiento más largo de 25 minutos pero solo con las presiones de 200 y 400MPa, ya que 500MPa con 25 minutos de tratamiento conducen a una sobrecarga de presión en la máquina de APH. La toma de muestras se tomó únicamente tras 24 horas después de los tratamientos. 4. 12. Modelización Para este experimento se definieron tres variables independientes: Concentración de polvo de aceitunas (0, 1,5, 2,5, 5%), presión (200, 400y 500 MPa) y temperatura de almacenamiento (20 y 30 ºC) las variables de respuesta para el caso del efecto del polvo de aceitunas en el medio de referencia en la cinética de crecimiento fueron velocidad máxima específica de crecimiento µmax y Factor Lag (Factor de latencia) simbolizado con la letra λ. Todos lo experimentos se realizaron por duplicado. 4. 12. 1. Desarrollo del modelo: los recuentos en palca fueron transformados a valores de Log10 y la curva de crecimiento fue determinada mediante la prueba de Gompertz (Zwietering et al., 1990) mediante el software GraphPad prisma 4.0. La ecuación de Gompertz modificada definida como: Ecuación 1 67 Donde: Y0, es el logaritmo del número inicial de células Y max, es el logaritmo del número final de células µ max, es la tasa máxima específica de crecimiento λ, es el factor de latencia t, tiempo 4. 13. Análisis estadístico Los estudios estadísticos se realizaron utilizando el software Statgraphics plus XV. Para determinar el efecto de la concentración de polvo de aceitunas, la presión de tratamiento y la temperatura de almacenamiento, se realizó un análisis de la varianza por ANOVA factorial. En los casos en que los efectos fueron significativos, se aplicó el estudio de las menores diferencias significativas de Fisher (LSD) (P<0.05). 68 5. DISCUSIÓN DE RESULTADOS 5. 1. Efecto del polvo de aceituna en medio de referencia BHI y bebida vegetal Se estudió el efecto de diferentes concentraciones de polvo de aceitunas (0, 1,5, 2,5 y 5%) en el crecimiento y supervivencia de B. cereus incubado a 7, 20 y 32 ºC. La figura 5.1 muestra las curvas de crecimiento de B. cereus a las diferentes temperaturas de estudio en presencia de 2,5% de polvo de aceitunas, concentración recomendada por los fabricantes. El polvo de aceitunas mostró un efecto bacteriostático, ya que tras 24 horas de almacenamiento el crecimiento fue menor en las muestras con polvo de aceitunas, que en aquellas que no contenían dicho ingrediente, para todas las temperaturas y concentraciones (tabla 5.1). En general se observó un mayor crecimiento a 32 ºC que a 20 y 7 ºC para todas las concentraciones de polvo de aceitunas debido a que esta temperatura es muy cercana a la óptima del microorganismo. Del mismo modo, a todas las temperaturas se observó un menor crecimiento con el tiempo de incubación al aumentar la concentración de polvo de aceitunas, si bien las diferencia observadas fueron mayores a la temperatura más baja. 7ºC, es una temperatura tan baja que apenas hubo crecimiento de B.cereus, sin embargo la reducción microbiana fue mayor que en las muestras que contenían el polvo de aceitunas. Esto indica que aunque la temperatura fue muy baja el polvo de aceitunas tuvo un efecto de control lo cual tiene relevancia en los procesos de conservación de alimentos en refrigeración. Estos resultados concuerdan con los observados por Tassou et al., (1991) quienes observaron una inhibición de la germinación y crecimiento de esporas de B. cereus en presencia de oleuropeina y otros compuestos fenólicos extraídos de la aceituna. 69 Log N (UFC/ml) 8 7 6 5 4 3 2 1 0 0 10 20 30 40 50 60 tiempo (h) 7ºC 20ºC 32ºC Figura 6. 1. Ejemplo de curvas de crecimiento al 2.5 % de polvo de aceituna a las diferentes temperaturas estudiadas Tabla 6.1. Valores medios y desviación estándar de la población de B. cereus (Log N (UFC/ml)) en medio de referencia a diferentes temperaturas y concentraciones de polvo de aceitunas tras 24 horas de almacenamiento Concentración polvo de aceitunas (%) T (ºC) 0 1.5 2.5 5 32 8,20 a2 ± 0,01 8,20 a1 ± 0,04 8,12 ab1 ± 0,05 8,02 b1 ± 0,07 20 8,72 a1 ± 0,04 7,80 b1 ± 0,04 7,48 c2 ± 0,02 6.0 d2 ± 0,3 7 5,8 a3 ± 0,1 4,7 d2 ± 0,4 5,13 b3 ± 0,04 4,83 bc3 ± 0,05 1-3 : valores con diferente número indican diferencias significativas entre temperaturas de almacenamiento a la misma concentración. a-d: valores con letras diferentes indican diferencias significativas entre concentraciones a la misma temperatura Posteriormente se modelizó el crecimiento y la cinética de inactivación de B. cereus en presencia de polvo de aceitunas, los datos experimentales fueron ajustados a la ecuación de 70 Gompertz modificada (ecuación 1) descrita en materiales y métodos, utilizando el programa estadístico Statgraphics plus XV. La ecuación de Gompertz ha sido utilizada en diversas investigaciones para diferentes microorganismos (McKellar y Lu, 2004). Chorin y et al., (1997) utilizaron este modelo para describir el crecimiento de B. cereus en caldo BHI. La tabla 6. 2 muestra los valores medios y la desviación estándar para la velocidad específica de crecimiento μmax y la fase de latencia λ. En el caso de µmax, el análisis ANOVA indicó diferencias significativas (p<0.05) con un intervalo de confianza del 95% entre los valores de µmax a las distintas temperaturas para cada concentración de polvo de aceitunas, excepto en el control, donde no se añadió polvo de aceitunas. A 32 ºC el análisis ANOVA indicó que no hubo diferencias significativas entre las concentraciones, excepto al 1,5 y 2,5% de polvo de aceituna. A 20 ºC, el análisis indicó diferencias significativas (p<0.05) entre todas las concentraciones excepto entre 1,5 y 2,5%. De acuerdo con estos resultados, la concentración de polvo de aceitunas no afecta a la velocidad de crecimiento del B. cereus a la temperatura óptima de crecimiento (32 ºC) utilizada en este estudio. Sin embargo, a 20 ºC, que puede ser considerada como una temperatura de rotura de la cadena de frío, se observó una disminución del valor µmax al aumentar la concentración del ingrediente comparado con el control, al que no se le añadió el ingrediente. Respecto a los valores medios y la desviación estándar para el factor de latencia (λ, tabla 6. 2), el análisis de la varianza para las distintas condiciones del estudio indicó que hubo diferencias significativas entre 0 y 1,5% de polvo de aceitunas a 32 y a 20 ºC. En general, al aumentar la concentración de polvo de aceitunas aumentó el factor de latencia. La fase de latencia es el periodo durante el cual las células se modifican para poder iniciar el crecimiento exponencial. Desde el punto de la vista de la seguridad alimentaria, ese aumento en la fase de latencia es importante por ejemplo en caso de que se interrumpa la cadena de frío, ya que las fluctuaciones de temperatura son un factor importante en la conservación de los alimentos. Una manera de simular una interrupción de la cadena de frío, por ejemplo en muchos lugares de Colombia la temperatura ambiente sobrepasa los 20 ºC, o bien no se utilizan condiciones de almacenamiento a bajas temperaturas, de esta 71 manera la presencia de polvo de aceitunas permitiría mantener la población de B.cereus en niveles considerados seguros, en caso de condiciones inadecuadas. Es razonable decir que a temperaturas desde 8 hasta 12 ºC el comportamiento de B.cereus en presencia de polvo de aceitunas es similar a temperaturas de almacenamiento mayores. Medidas en la temperatura de refrigeradores de uso doméstico en Europa, muestran que los alimentos son almacenados a temperaturas no adecuadas (≥9 ºC) (Sergelidis et al., 1997; Bakalis et al., 2004). Estas determinaciones de la temperatura sugieren la necesidad de aplicar barreras como la adición de ingredientes con propiedades bacteriostáticas o bactericidas en alimentos que requieren refrigeración. Tabla 6. 2. Valores medios y de desviación estándar para la tasa máxima de crecimiento (µmax) y la fase de latencia (λ) a diferentes condiciones de estudio en medio de referencia Tasa máxima de crecimiento Fase de Latencia (λ) específico (µmax) Temperatura Temperatura 32ºC 20ºC 32ºC 20ºC 0 0.56 ab ± 0.08 0.50 a ± 0.03 1.5 c2 ± 0.1 5.8 c1 ± 0.7 1.5 0.473 b1 ± 0.006 0.183 c2 ± 0.006 1.6 c2 ± 0.2 5.9 c1 ± 0.2 2.5 0.59 a1 ± 0.08 0.133 c2 ± 0.006 3.5 b2 ± 0.2 8.3 b1 ± 0.6 5 0.55 ab1 ± 0.04 0.28 b2 ± 0.09 9.5 a2 ± 0.7 21.05a1 ± 2.4 1-3 : valores con diferente número indican diferencias significativas entre temperaturas de almacenamiento a la misma concentración. a-d: valores con letras diferentes indican diferencias significativas entre concentraciones a la misma temperatura El efecto bacteriostático del polvo de aceitunas se observó también en la bebida de vegetales, respecto a la concentración 2,5 % de polvo de aceitunas se encontró un efecto de 72 control sobre el crecimiento de B. cereus desde la hora 6 hasta la hora 54 para las dos temperaturas de almacenamiento (figura 2 y 3) La causa probable del incremento de la concentración de microorganismos es la recuperación de algunas células que sufrieron daño por parte del polvo de aceitunas y que la temperatura de 32 ºC es cercana a la temperatura óptima de B. cereus. Por otra parte la concentración de 1.5% mostró también un efecto de control sobre B. cereus a 20 ºC de almacenamiento (figura 4). En la figura 5 se observa una diferencia con respecto al control a 32 ºC el comportamiento de B. cereus fue diferente en presencia de 1,5 % de polvo de aceitunas, la curva correspondiente al polvo de aceitunas creció más que el control, esto debido probablemente a que 32 ºC es una temperatura muy cercana a la óptima al microorganismo, o bien que 1,5% de polvo de aceituna no es suficiente para disminuir el número de microorganismos a una temperatura de abuso extremo en materia de almacenamiento como lo son 32 ºC. 8 Log N (UFC/ml) 7 6 5 4 3 2 1 0 0 10 20 30 40 50 60 tiempo (h) sin polvo de aceitunas 2,5% polvo de aceituna Figura 6. 2. Ejemplo de curva de crecimiento de B. cereus log N (UFC/ml) en la bebida vegetal sin polvo de aceitunas y con una concentración del 2,5% almacenado a una temperatura de 20 ºC. 73 8 Log N (UFC/ml) 7 6 5 4 3 2 1 0 0 20 40 60 80 tiempo (h) sin polvo de aceitunas 2,5% polvo de aceituna Log N (UFC/ml) Figura 6. 3. Ejemplo de curva de crecimiento de B. cereus Log N (UFC/ml) en la bebida vegetal sin polvo de aceituna y con una concentración del 1,5% almacenado a una temperatura de 32 ºC. 7,2 7,1 7,0 6,9 6,8 6,7 6,6 6,5 6,4 6,3 6,2 0 10 20 30 40 50 60 tiempo (h) sin polvo de aceituna 1,5%polvo de aceituna Figura 6. 4. Ejemplo de curva de crecimiento de B. cereus Log N (UFC/ml) en la bebida vegetal sin polvo de aceituna y con una concentración del 1,5% almacenado a una temperatura de 20 ºC. 74 Log N (UFC/ml) 9,0 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 0,0 0 10 20 30 40 50 60 tiempo (h) sin polvo de aceituna 1,5% polvo de aceituna Figura 6. 5. Curva de crecimiento de fracción de B.cereus Log N (UFC/ml), comparando con el control en presencia de 2.5% de polvo de aceituna a 32 ºC de almacenamiento. Los resultados del análisis ANOVA (Tabla 3) muestran que existen diferencias significativas (p<0.05) con un intervalo de confianza del 95% entre las concentraciones de polvo de aceitunas de 0, 1,5 y 2,5%, no obstante no hay diferencias significativas entre las temperaturas de almacenamiento 20 y 32 ºC. Los recuentos correspondientes a la temperatura 20 ºC en presencia de 1,5% de polvo de aceituna muestran una desviación estándar mayor que en los demás experimentos pero aún así se aprecia un efecto de control bajo estas condiciones. 75 Tabla 6. 3. Valores medios y desviación estándar de logaritmo de la fracción de recuentos de B. cereus después de 24 horas de almacenamiento a diferentes condiciones de estudio en sustrato vegetal Temperatura de almacenamiento % Polvo de aceitunas 0 20ºC 7.389ª1± 0,020 32ºC 6,730ª1 ± 0,098 1.5 6.519b1± 0,051 6,568b1 ± 0,126 2.5 6.441c1 ± 0.069 4.852c1 ± 0.057 1-3 : valores con diferentes números indican diferencias significativas entre temperaturas de almacenamiento a la misma concentración. a-d: valores con letras diferentes indican diferencias significativas entre concentraciones a la misma temperatura. Las propiedades antimicrobianas de extractos de olivas han sido investigadas, Serra y col (2008) reportan que el contenido de polifenoles: quercetina, hidroxitirosal y oleuropeina tienen efecto antimicrobiano frente a B. cereus, otras dos especies de bacterias como E. coli, S. ponna y dos especies de levaduras S. cerevisiae y C. albicans. Una concentración de 500 mg/L de oleuropeina pueden inhibir considerablemente a B. cereus. Otras investigaciones como la de Pereira et al (2007) utilizaron el extracto de olivas para evaluar su actividad antimicrobiana. La capacidad antimicrobiana de los compuesto fenólicos es conocida, pero la de los extractos pueden ser mas benéficos que los constituyentes aislados se habla entonces de un efecto sinérgico de sustancias fitoquímicas en frutas y vegetales es responsable de las propiedades bioactivas, lo cual explica porque un solo antimicrobiano no puede inhibir o controlar diferentes microorganismos. 76 5. 2. Efecto de las Altas Presiones Hidrostáticas en medio de referencia y bebida vegetal Se estudió el efecto del tratamiento por APH sobre las esporas de B. cereus. Los resultados obtenidos muestran que las presiones estudiadas no tienen un efecto significativo en cuanto a la reducción del número de esporas presentes en la muestra y por tanto en la población de microorganismos viables. Las figura 6,6, 6,7 y 6,8 muestra el efecto de las APH solas sobre el número de microorganismos 1,40 1,20 1,00 N/N0 0,80 0,60 0,40 0,20 0,00 200 400 500 Presión (MPa) MR BV Figura 6. 6. Comparación del logaritmo de recuento de B. cereus entre medio de referencia bebida de vegetales a diferentes presiones sin polvo de aceitunas 200 MPa 1,00 0,90 0,80 0,70 N/N0 0,60 0,50 0,40 0,30 0,20 0,10 0,00 0 1,5 2,5 COP (%) MR BV 77 Figura 6. 7. Comparación del logaritmo de recuento de B. cereus entre medio de referencia y bebida vegetal a diferentes presiones en presencia de polvo de aceitunas a 200 MPa 500 MPa 1,40 1,20 1,00 N/N0 0,80 0,60 0,40 0,20 0,00 0 1,5 2,5 polvo de aceituna (%) MR BV Figura 6. 8. Comparación del logaritmo de recuento de B. cereus entre medio de referencia y bebida vegetal a diferentes presiones en presencia de polvo de aceitunas a 500 MPa En la tabla 6. 4 se resume el efecto de las altas presiones y la concentración de polvo de aceituna sobre la población de B. cereus en los diferentes sustratos, medio de referencia y bebida vegetal. En general, tanto en el medio de referencia como en la bebida vegetal, se observan diferencias significativas (Anexos 9.1 y 9.2) debidas a la concentración de polvo de aceituna (p<0,01) que indican una mayor supervivencia de las esporas a mayores concentraciones de polvo de aceituna. En cuanto al efecto de la presión, también es significativo (p<0,001) en ambos sustratos, observándose generalmente una menor inactivación de las esporas de B. cereus a la presión de 400 MPa. Sin embargo, debido al efecto de la interacción entre presión y concentración de polvo de aceituna (p<0,001) estos 78 efectos no se observan con claridad en todas las combinaciones de presión y polvo de aceituna Tabla 6. 4. Valores medios y desviación estándar de la población de B. cereus (N/N0), en medio de referencia y bebida vegetal, sometidos a tratamiento por APH a 200, 400 y 500 MPa (10 min) y con diferentes concentraciones de polvo de aceitunas % P.A 0 1.5 2.5 P CPA Px CPA Altas Presiones Hidrostáticas Medio de referencia Bebida vegetal 200 200 400 400 500 0,59 ±0,24 1,02ab1±0,14 0,73b12±0.28 0,54a2±0,15 0,84a1±0,05 0,901± 0,02 0,892± 0,02 0,84b2±0,01 1,13a1± 0,11 *** *** 0,61b3±0,05 0,29b2±0,10 0,38ab2±0,12 0,30b2±0,06 0,68ab1±0,18 *** ** 2 *** 1,10 a1 ±0,19 500 0,40b2±0,06 0,59a1±0,05 0,43b12±0,03 *** 1-3 : valores con números diferentes indican diferencias significativas efecto de las diferentes presiones a la misma concentración de polvo de aceituna y en el mismo substrato. a-c : valores con letras diferentes indican diferencias significativas defecto de las diferentes concentraciones de polvo de aceitunas a la misma presión y en el mismo substrato. P: efecto de la presión, CPA: efecto de la concentración de polvo de aceituna, PxCPA: efecto de la interacción entre la concentración de polvo de aceituna y las altas presiones. ***: p<0.001, **: p<0.01. Los resultados referentes al efecto de la presión obtenidos en este estudio coinciden con los de otros autores que observaron que a presiones relativamente bajas se puede inducir la germinación de las esporas (Rasso et al., 1998), así podría ser que la mayor inhibición observada a 200 MPa pudiera ser debida a la germinación de las esporas que se transformarían en células vegetativas, volviéndose más sensibles al tratamiento por APH. Por otra parte, 500 MPa es una presión alta que sí puede afectar a las esporas y disminuir su supervivencia, sin embrago estas disminuciones no garantizan la calidad microbiológica de la bebida de vegetales ya que son menores de un ciclo logarítmico. En cuanto al efecto de la concentración de polvo de aceituna, los resultados parecen indicar un posible efecto protector en el tratamiento por APH, que podría ser debido al efecto inhibidor de la germinación, anteriormente descrito para este ingrediente (Tassou et al., 1991). Sin embargo, este efecto podría ser de interés durante la vida útil del producto, por tanto sería 79 necesario estudiar la evolución de los diferentes sustratos a lo largo del periodo de almacenamiento. La figura 6. 9. permite observar las diferencias en la población de B. cereus debidas a los diferentes sustratos. En general, a todas las presiones se puede observar que, en ausencia de polvo de aceituna no hay diferencias significativas entre el número de esporas viables en el medio de referencia y la bebida vegetal, sin embargo al 1,5 y 2,5% de polvo de aceituna se observa que la supervivencia de las esporas es mayor en el medio de referencia que en la bebida vegetal. Esto pueda deberse probablemente a que el comportamiento de algunos microorganismos en sustratos vegetales muestran que algunos alimentos pueden tener un efecto protector propio innato contra microorganismos, esto puede ser debido a los componentes naturales como fitoatoalexinas presentes fluidos celulares y vasculares son liberados a consecuencia del rompimiento de las células de zanahoria durante un tratamiento como el de Altas Presiones (Pilavtepe-Çelik1 et al., 2008), estos resultados son relevantes en comparación con los obtenidos en este estudio ya que las fitoalexinas están presentes en la zanahoria del sustrato vegetal. 1,40 1,20 1,00 N/N 0 0,80 0,60 0,40 0,20 0,00 200 400 500 Presión (MPa) 0 1,5 2,5 BV 0% BV 1,5% BV 2,5% 80 Figura 6. 9. Efecto de la presión y la concentración de polvo de aceitunas sobre la población de B. cereus en medio de referencia y bebida vegetal, sometidos a 10 min de tratamiento con APH. La temperatura de tratamiento en Altas Presiones es un factor importante así, con temperaturas superiores a los 40 ºC pueden inactivar hasta un ciclo completo a 100 MPa para esporas de B. cereus (Black et al., 2008). El sustrato en el cual se realizan los tratamientos puede influir en la inactivación de los microorganismos, en alimentos por ejemplo los microorganismos son más resistentes a la presión que en sistemas de referencia como búferes (Alpas et al., 2003; Chen y Hoover 2003; Van, Opstal et al., 2005); así la composición del medio de referencia puede estar relacionada con la resistencia del microorganismo a las APH, así algunos aminoácidos como la glicina y la betaina (presente en el BHI) puede actuar como agente osmoprotector impidiendo que la membrana de las células se vea afectada por las APH (Jofré et al., 2007). La bebida de vegetales de este estudio tiene una composición sencilla (zanahorias y judías verdes) presento un pH de 6.32 muy cercano a la neutralidad de tal manera que el pH del sustrato no es una barrera extra contra microorganismos. 81 1,40 1,20 1,00 N/N 0 0,80 0,60 0,40 0,20 0,00 200 400 500 Presión (MPa) 0 1,5 2,5 BV 0% BV 1,5% BV 2,5% Figura 6. 10. Comparación del logaritmo de recuento de B. cereus entre dos tiempos de tratamiento con APH diferentes. 5. 3. Efecto del tiempo de tratamiento con APH en la bebida de vegetales El tiempo y la temperatura son factores clave a la hora de aplicar cualquier tecnología para disminuir carga microbiana. Otros autores han observado que un incremento del tiempo de tratamiento con APH conduce a un aumento en la inactivación de células vegetativas (Bellaterra, 2004). En este estudio se consideró alargar el tiempo de tratamiento a 25 minutos para ver si esto tendría un efecto mayor sobre las esporas de B. cereus. En la figura 6. 11. se pueden observar los resultados en la bebida vegetal tras tratarla con APH durante 10 y 25 min. Como se ve en la figura no se observaron diferencias significativas debidas al tiempo de tratamiento. 82 1,20 1,00 N/N 0 0,80 0,60 0,40 0,20 0,00 200 400 Presión (MPa) 10 min, 0% 25 min, 0% 10 min, 1.5% 25 min, 1,5% 10 min, 2,5 % 25 min, 2,5% Figura 6. 11. Efecto del tiempo de tratamiento con APH sobre la población de B. cereus (N/N0) en bebida vegetal a las diferentes presiones y concentraciones de polvo de aceitunas estudiadas En la tabla 6.5 se pueden apreciar En general, tanto en el medio de referencia como en la bebida vegetal, no se observaron diferencias significativas en respuesta al aumento del tiempo de tratamiento a Altas Presiones ni (p>0,001) y a la concentración de polvo de aceituna (p>0,01) respectivamente (anexo 9.3 ). Para esta experiencia se sigue observando una leve disminución de la carga microbiana para la presión de 200 MPa porque el polvo de aceitunas puede inhibir en algún grado la germinación de las esporas. 83 Tabla 6. 5. Valores medios y desviación estándar de Log N/No de B. cereus, después de 24 horas de almacenamiento en sustrato vegetal con APH con dos tiempos de tratamiento a APH Tratamiento 10 min % P.A Tratamiento 25min 200MPa 400Mpa 200MPa 400Mpa 0 0.59± 0.24 1.02± 0.14 0.20 ±1,09 1.06 ± 0.59 1.5 0.90± 0.02 0.84± 0.01 0.61 ±1,09 0.49 ± 0.11 2.5 0.89± 0.02 0.68± 0.12 0.22 ±1,09 0.66 ± 0.08 Esta tabla solo presenta datos de medias y desviaciones estándar, porque no hay diferencias significativas. 6. CONCLUSIONES Mediante los datos obtenidos para las diferentes concentraciones de polvo de aceitunas en medio de referencia y en sustrato vegetal se puede decir que el polvo de aceitunas en concentraciones de 1.5 % ó de 2.5%, se puede utilizar como aditivo en alimentos para 84 controlar B. cereus junto a otros sistemas de preservación físicos como almacenamiento a bajas temperaturas. A las temperaturas de almacenamiento 20 y 32ºC el polvo de aceitunas mostró una capacidad de controlar poblaciones de B. cereus, lo cual es importante en caso de que se interrumpa la cadena de frío de un alimento o bien hayan problemas durante el transporte de la bebida de vegetales. El tratamiento de APH no tuvo influencia importante sobre el número de reducciones de B. cereus en medio de referencia y sustrato vegetal. En consecuencia, la tecnología de APH sola o combinada con el polvo de aceituna no fue suficiente para garantizar la seguridad microbiológica de la bebida de vegetales. Un aumento en el tiempo de tratamiento tampoco mostró una disminución importante en el número de microorganismos. La temperatura de tratamiento del estudio fue para todo los ensayos 20 ºC, dicha temperatura se considera baja, puesto que las esporas son termorresistentes, con lo cual se indujo la germinación pero no la destrucción significativa de esporas de B. cereus 7. RECOMENDACIONES Se considera necesario pensar en un efecto conjunto de las APH y el ingrediente, para controlar al B. cereus durante el almacenamiento; es decir, estudiar la influencia de los tratamientos con APH´s, una concentración de 2,5% de polvo de aceitunas y los 85 componentes de la bebida (sustancias fotoquímicas) a través del tiempo a diferentes condiciones de almacenamiento. Como se menciono en la discusión de resultados, la temperatura de tratamiento influye en la reducción de microorganismos, un aumento de la temperatura de tratamiento junto con las APH y la adición del polvo de aceitunas pueden inhibir el crecimiento de Bacillus cereus o mantenerlo bajo niveles que no causen deterioro en la bebida vegetal ni nocivos para el consumidor. En materia de seguridad alimentaria es importante tener en cuenta la manipulación de los alimentos durante su preparación, sí se mantienen condiciones de higiene, Buenas Prácticas de Manufactura se puede disminuir el riesgo de contaminación en los alimentos. En muchas ocasiones se piensa que una tecnología muy avanzada garantiza seguridad microbiológica, pero si no se manejan condiciones aptas durante el proceso de preparado de un alimento cualquiera será más difícil garantizar calidad y alargar la vida útil de un producto. Con respecto al uso de antimicrobianos de origen natural, cabe mencionar que en el mercado europeo y colombiano existen muchos condimentos y especias, permitidos por las respectivas legislaciones y que pueden tener actividad antimicrobiana, por lo tanto las investigaciones en el área de aditivos y antimicrobianos se debería tener en cuantos aquellos ingredientes que ya son conocidos. El mercado de las bebidas vegetales actualmente tiene demanda por sectores muy específicos, en Colombia por ejemplo existe una gran variedad de hortalizas que pueden combinarse para hacer bebidas refrescantes, por lo que se debería pensar en investigar más 9. REFERENCIAS BIBLIOGRAFICAS Alpas, H., Kalchayanand, N., Bozoglu, F., Sikes, A., Dunne, C.P., y Ray, B. 1999. 303 Variation in resistance to hydrostatic pressure among strains of food-borne 304 pathogens. Applied and Environmental Microbiology, 65, 4248-4251 86 Alpas, H., Lee, J., Bozoglu, F., y Kaletunç, G. 2003. Evaluation of high hydrostatic 306 pressure sensitivity of Staphylococcus aureus and Escherichia coli O157:H7 by 307 differential scanning calorimetry. International Journal of Food Microbiology, 87,308: 229237. Angelo, R., & Ibarra. A. 2007. Sensory and antimicrobial effect of the olive powder in tradictional bread. Natraceutical S.A. departament of Innovation And Research & Development Al-Bachir, M. & Zeinou, R. 2006. Effect of gamma irradiation on some characteristics of shell eggs and mayonnaise prepared from irradiated eggs. Journal of Food Safety, 26. 48360. Aleixandre, J. L.1994. Fundamentos de los procesos de conservación de alimentos. SPUPV-94.018 Aymerich, T., Picouet, P.A., y Monfort. J.M. 2008. Deccontamination technologies for meat products. Meat Science, 78: 114-129. Aziz,N., Farag, S. ,Mousa, L.,&Abo-Zaid, M. 1998. Comparative antibacterial and antifungal effects of some phenolic compounds. Microbios. 93, 43−54. Balny, C. L., y Masson. P. 1993. Effectof high pressure of proteins. Food Reviews International, 9: P.511-512. Barbosa- Cánovas, G.V., Gongora- Nieto, M., Pothakamury U. y Swanson B. 1998. Preservation of foods with pulsed electric fields. 5-10, Academic Press, San Diego,USA. Barbosa- Cánovas, G.V., Gongora- Nieto, M., Pothakamury U. y Palou. E. 1997. Nonthermal Preservation of Foods. (ed) CRS Press. San Diego,USA. 87 Basak, S., Ramaswamy, H.S. y Simpson, B.K. 2001. High pressure inactivation of pectin methyl esterase in orange juice using combination treatments. Journal of Food Biochemistry, 25 (6): p. 509-526. Baranyi, J. & Roberts, T.A. 1994. A dynamic approach to predicting bacterial growth in food. International Journal of Food Microbiology, 23: p.277-294. Baranyi, J., Roberts, T. A. & McClure, J. P. 1993. A non-autonomous differential equation to model bacterial growth. Food Microbiology, 10:43-59. Bellaterra. D. 2004. Efecto de las altas presiones hidrostáticas sobre el gazpacho y el zumo de uva. Planta de tecnología de los alimentos. Universidad Autónoma de Barcelona. 101102 Beltran. E, R. Plaza, J. Yuste and M. Mor-Mury col. 2003. Lipid oxidation of pressurized and cooked chicken. Role of sodium chloride and mechanical processing on TBARS and hexanal values. Meat Science, 64:P. 19-25 Biesalki H & Tinz. J. 2008. Nutritargeting. Adavances in Food and Nutrition Research. 54, 179-217. Bisignano, G., Laganà, M.G., Trombetta, D., Arena, S., Nostro, A., Uccella, N., Mazzanti., G, & Saija., A. 2001. In vitro antibacterial activity of some aliphatic aldehydes from Olea europaea L. FEMS Microbiology Letters, 198: 1, 20, p 9-13 Black., E.P, Setlow. P., Hocking. D., Stewart., M., Alan. K., & Hoover. D.G. 2007. Response of Spores to High-Pressure Processing.Comprehensive Reviews in Food Science and Food Safety. 6: 4, 103-119 Brackett RE. 1997. Microbiological spoilage and pathogens in minimally processed refrigerated fruits and vegetables, En: Minimally processed refrigerated fruits and vegetables, Willey RC (ed), pp 226-268. Chapman and Hall, New York, NY 88 Cano .M, De Ancos.B y Sanchéz-Moreno, C. 2005. Altas presiones. Nueva alternativa para la mejora de la calidad y seguridad en vegetales frescos cortados. Instituto del frío. Departamento de Ciencia y Tecnología de Productos Vegetales. Madrid, España. P 1-6. Castellari, M., Matricardi. L., Arfelli. L., Carpi. G., & Galassi. 2000. Effects of high hydrostatis pressure processing nad glucose-catalase adition on the stability and sensorial score of grape juice. Food Science Technology International, 6: 17-23 Chen, H. (2007). Use of linear, Weibull, and log-logistic functions to model pressure inactivation of seven foodborne pathogens in milk. Food Microbiology. 24, p.197-204. Chorin, E., Thuault, D., Cleret, J. J. and Bourgeois, C. M., 1997. Modelling B. cereus growth. International Journa of . Food Microbiology. 38: pp. 229–234 Cortezzo, D.E. y Setlow, P. 2005. Analysis of factors influencing the sensitivity of spores of Bacillus subtilis to DNA damaging chemicals. Journal of Applied Microbiology,98, 606–617. Cowan, M. 1999. Plant Products as Antimicrobial Agents. Clinical Microbiology Reviews,. (12): 4. p 564–582 Cheftel, J. C.1991. Aplication des hautes pressures en tecnologie alimentaire. Actualités des Industries Alimentaires et Agro-Alimentaire, 108: 141-143 Cheftel, J. C.1992. Effect of High hidrostatic pressure on food constituends: An overview. High Pressure and Biotechnology C. Balny, R. Hayashi, K. Heremans, & P. Masson. (ed), 195-209. editions John Libery Eurotext, Montrouge. Cheftel, J. C.1995. Review: High Pressure, microbial inactivation and food preservation. Food Science and Technology international, 1: 75-90 Cheftel, J. C. & Cullioli. 1997. Effect of high pressure of meat: An overview. Meat Science, 3: 216-236. 89 Crelier S, Robert MC, Claude J, Juillerat M.A. 2001. Tomato (Lycopersicon esculentum) pectin methylesterase and polygalacturonase behaviours regarding heat and pressureinduced inactivation Journal of Agriculture. Food Chemestry. 49, 5566-5575. Curran. H. & Evans. F. 1947. The viability of heat activable spores in nutrient and non nutrient substitutes as influenced by storage or poststorage heating and other factors. Journal of Bacteriology. 53, p. 55-59. Davidson, P. M. 2001. Chemical preservatives and natural anti microbial compounds. Food Microbiology: Fundamentals and Frontiers. 2nd ed. M. P. Doyle, L. R. Beuchat, and T. J. Montville, ed. ASM Press, Washington, DC. P 593–627 Delgado, 2005. Evaluación de la seguridad microbiológica en alimentos mínimamente procesados mediante el uso de aceites esenciales en procesos combinados. Tesis doctoral. Universidad Politécnica de Cartagena. Departamento de ingeniería de los Alimentos y del Equipamiento Agrícola. Cartagena, España. P 267 Draughon, F. A. 2004. Use of botanical as biopreservatives in food. Food Technology, 58 (2): 20-28 Driks, A. 2002. Proteins of the spore core and coat. In Bacillus subtilis and Its Closest Relatives. Sonenshein, A.L., Hoch, J.A., and Losick, R. (eds). Washington, DC :American Society for Microbiology. 527–536. Earnshaw, R., G. 1996. High pressure food processing. Nutrition and Food Science. 2:8-11. Earnshaw, R.G., Appleyard, J., & Hurst, R.M. 1995. Understanding physical inactivation processes: combined preservation opportunities using heat, ultrasound and pressure. International Journal of Food Microbiology, 28:197-219. Fernández, A., Collado J., Cuhna L.M., Ocio M.J. &, Martínez A. 2002. Empirical model building based on Weibull distribution to describe the joint effect of pH and temperature on the thermal resistance of Bacillus cereus in vegetable substrate. International Journal of Food Microbiology, 77.p 147-153 90 Fresse. E. 1981. Inhibition of bacterial sporulation “sporulation germination”. Amerycan society of Microbiology. Washington. EE.UU. Funtenberger. S, Dumay, E. & Cheftel, J.C., 1995. Presurre agregation of β-lactoglobulin isolate in different pH 7 buffers. Lebensem. Wiss. Technol,. 28: p. 410-418 García-Graells C, Valckx C, Michiels CW. 2000. Inactivation of Escherichia coli and Listeria innocua in milk by combined treatment with hydrostatic-pressure and the lactoperoxidase system. Applied Environmental Microbiology. 66, p.4173- 4179. Gerardo, S., Barzarini, R; Bigliardi, D., Trifiro, A., & Montarani, A. 1983. Envasado y Calidad. Alimentaria, 139: p.231-236 Gould. G. 1970. Germination and the problem of dormancy. Journal of Applied Microbiology. 33, p. 34-49. Granum. J.P.E. y Lund T. 1997. Bacillus cereus. En: Food Microbiology: Fundamentes and frontiers, M.P Doyle, L. R. Beuchat, T.J. Montville (eds), Massachusetts, Washington D.C. American Society for Microbiology. P. 327-336. Hayashi, R. 1992. Utilization of pressure in adition to temperature in food science and technology. High Pressure and Biotechnology, 185-193. Hendrix, M. E. G., & Knorr, D. 2001. Ultra high pressure treatments of foods. Kluwer Academic . New York, USA. pp 3-18. Heremans, K. 1995. High pressures effects of biomolecules. High Pressure Processing of Foods. 81-89. (eds), Ledward L. A., Johnston, D. E., Ernshaw, R., G & Hasting A.P. M,. Notthigham University Press. Leicestershire. Hobbs, B.C & Gilbert, R.J. 1974. Microbiological counts in relation to food posioning. IV International Congress of Food Science Technology, 3: p.159. Hoover. 2003. Pressures effects on biologycal systems. Food Technology, 47: p. 150-157. 91 Ingraham, J.L. e Ingraham, C.A. 1998. Introducción a la microbiología. Ed. Reverté S.A., Barcelona. Jofré. A, Champomier-Verge. M., Anglade, P., Baraige. Martín. B., Garriga. M., Zagorec. M., y Aymerich. T. 2007. Protein synthesis in lactic acid and pathogenic bacteria during recovery from a high pressure treatment. Research in Microbiology. 158, 512-520 Keynan, A. & Sandler, N. 1983. Spores Research in Historical perspective, En: Rhe Bacterial Spore. Vol 2 (A Hurts & G.W. Gould, eds.) Academic Press Inc., Londres. 2-49. Knorr D. 1995. High Pressure Processing of Foods. Ledward, , D. A., Johnson, D.E., Earnshaw, R.G. y Hasting, A.P.G. Eds. Nottingan University Press. pp. 123-135. Kramer, J.M. y Glibert, R.J. 1989. Bacillus cereus and other Bacillus species. Foodborne Bacterial patogen. Ed. M.P.Doyle. Nueva York. P 21-27. Kübel, J., Ludwig. H, & Tausher, B. 1997. Influence of UPH on vitamine A acetate content. High Pressure Research in the Biosciences and Biotechnology.(ed) Heremans. Leuven Univsrsity Press. Leuven, Bélgica. P 331-334 Kuse. M., Franz. T., Koga. K., Sowan. S., Isobe. N., Agata. N.,& Otha. M. 2000. Hogh incorporation of L amino acids to cereulide and emetic toxin from Bacillus cereus. Bioorganization Medicine and Chemestry Letters. 10, p. 735-739. Lafuente, B. 1985. Factores que afectan la calidad y la estabilidad del zumo de naranja semielaborado. Revista de Agroquímica y Tecnología de Alimentos, 25:334-352. Larsen. H.D., Jorgensen. K. 1999. Growth of Bacillus cereus in pasteurized milk products. International Journal of Food Microbiology, 46: 173-176. Lechner, S., Mayr, R., Farncis, K.P., Prüs, B.M., Kalpan, T., Wiessner-Gunkel, E., Stewart, G.S & Scherer, S. 1998. Bacillus wiehenstephanensis sp nov. Is a new psychrotolerant species of the Bacillus cereus group. International Journal of Sistematyc Bacteriology, 55 (1-3): 181-186. 92 Mazas, M., González, I., López, M., González, J. and Martín, R., 1995. Effects of sporulation media and strain on thermal resistance of Bacillus cereus spores. International Journal of Food Science Technology. 30 (1): 71-78. McMeekin, T., Olley J., Ross T. &, Ratkowsky D. 1993 Predictive Microbiology: Theory and application. John Wiley & Sons, Chichester, UK. McKellar, R. C. and X. Lu., 2004. Modelling microbial responses in food. CRC Press, Boca Raton, Fla.Van Hoek, P., Van Dijken, P. and Pronk, J. T., 1998. Effect of specific growth rate on fermentative capacity of baker’s yeast. Applied Environmental. Microbiology. 64: 4226-4233. Meng N.G., Schaffner. D.W. 1997. Mathematical models for the effects of pH, temperature and sodium chloride ohn the growth of Bacillus stearothermophilus in salty carrots. Applied and Environmental Microbiology. 63:4,1237-1243 Mertens, B., & Knorr, D. 1992 . Developments of nonthermal processes for food preservation. Food Technology, 46:124-133. Mertens., B., & Deplace. G.1993. Engineering aspects of high pressures technology in the food industry. Food Technology. June, 164-169 Mills, G., Earnshaw, R. & Patterson, M.F. 1998. Effects of high hydrostatic pressure on Clostridium sporogenes. Letters in Applied Microbiology, 26:227-230. Moat, A.G., Foster, J.W. & Spector, M.P. 2002. Microbial Physiology. 4ª Edition. Ed. Wiley-Liss, Inc. Nueva York. Montaner, B. 2007. Impacto de los pulsos eléctricos de alta intensidad y tratamiento térmico sobre la calidad y seguridad de un producto mezcla de zumo de naranja y leche. Universidad Politécnica de Valencia. Escuela Técnica Superior de Ingenieros Agrónomos. p 123 93 Montville, T. J., K. Winkowski, M. L. Chikindas. 2001. Biologi cally based preservation systems. Food Microbiology: Fundamentals and Frontiers. 2nd ed. M. P. Doyle, L. R. Beuchat, and T. J. Washington, DC Montville, ed. ASM Press. p 629–647. Mossel. D. A. & Moreno. B. 1985. Microbiología de los alimentos. Ed. Acribia S. A. España. Mozahev.V, V. Heremans. K., Frank, J., Masson. P & Blany., C. 1994. Exploting the effect of hidrostatic pressure in biotechnologycal aplications. Tibtech,12: 493-501 Nguyen C, Carlin F. 1994. The microbiology of minimally processed fresh fruits and vegetables. Crit. Rev. Food Sci. Nutr. 34:371-401 [OMS] Organizacion Mundial de la Salud, 2003. Diet, nutrition and the prevention of chronical diseases. WHO Technical Report Series. 916: p.1-148 Paidhungat. M., & Setlow. P. 2002. Role of Ger Proteins in Nutrient and Nonnutrient Triggering of Spore Germination in Bacillus subtilis. Journal of Bacteriology. 182: 9. p. 2513-2519. Palou E, López-Malo A, Barbosa-Cánovas G, Welti-Chanes J. 2000. High Hydrostatic Pressure and minimal processing, En: Minimally Processed Fruits and Vegetables. Fundamentals Aspects and Applications. Eds. SM Alzamora. Papdopoulou, C., Soulti, K., & Roussis, I.G. 2005. POntencial antimicrobial activity of red and white wine extracts against strains of Staphylococcus aureus, Escherichia coli and Candida albicans. Food Technology and Biotechnology, 43 (1): p. 41-46. Patterson M. 2000. High pressure treatments of foods. In TK Robinson, CA Batt, PD Patel (Eds) Encyclopedia of food microbiology. San Diego. Academic Press. p 1059-1060 Pereira, J. A, Pereira., P. J., Ferreira., I, Valentao., P, Andrade., P, Seabra., R, Estevhino., L, & Bento., A. 2006. Table Olives from Portugal: Phenolic Compounds, Antioxidant 94 Potential, and Antimicrobial Activity. Jorunal of Agricultural Food Chemestry. 54, 84258431 Pilavtepe-Celik. M, Buzrul. S., Alpas. H., & Bozoglu. F.2008. Development of a new mathematical model for inactivation of Escherichia coli O157:H7 and Staphylococcus aureus by high hydrostatic pressure in carrot juice and peptone water. Journal of Food Engineering. Manuscript Pina, M.C., Rodrigo, D., Saucedo, D. & Martínez., A. 2007. Pressure inactivation kinetics of enterobaxter sakazakii in infant formula milk. Journal of Food Protection, 70: 10, p 2281-2289. Pitchayawasin. S., Kuse. M., Franz. T., Koga. K., Sowan. S., Isobe. N., Agata. N.,& Otha. M. 2003. Complexation of cyclic dodecapepsipeptide, cereulide with amonium salts. Bioorganization Medicine and Chemestry Letters. 13, p. 3507-3512. Pitchayawasin. S., Kuse. M., Franz. T., Sowan. S., Isobe. N., Agata. N.,& Otha. M. 2004. Molecular diversity of cereulide detected by means of nano HPLC ESI Q TOF MS. International Journal of Mass Spectrometry. 235, p. 123-129 Plaza L, Muñoz M, De Ancos B, Cano MP. 2003. Effect of combined treatments of highpressure, citric acid and sodium chloride on quality parameters of tomato pure. Eurean Food Researchs Technology. 216: p.514-519. Pophan, D.L., Helin, J. Costello, C. E., Aetlos, P., 1996. Muramic lactam in peptidoglycan of Bacillus subtilis spores in required for spore outgrowth but not for spore dehydration or heat resistance. Proc. Natl. Acad. Sci. USA 93, 15405-15410. Pohlman, F. W., M. R. Stivarius, K. S. McElyea, Z. B. Johnson, and M. G. Johnson. 2002. The effects of ozone, chlorine dioxide, cetylpyridium chloride and trisodium phosphate as multiple antimicrobial interventions on microbiological, instrumental color, and sensory color and odor characteristics of ground beef. Meat Science. 61:p. 307–313. Pophan, D.L., Helin, J. Costello, C. E., Aetlos, P., 1996. Muramic lactam in peptidoglycan of Bacillus subtilis spores in required for spore outgrowth but not for spore dehydration or 95 heat resistance. Procedings of the National Academy of Science of the United Sates of America. 93, p.15405-15410. Prescott, L. M . Hartley, J. P & K l e in, D. A . 2004. M i c robiología. 5ª Edición. Ed. M c G r aw- H i l l. M a d r id Q u ass. D. W . 1997. Pulsed electric field processing in the food industry. A status report. P E F Electric Power Research Institute. Palo A l to, California. E E . U U . 46, p. 536-541. Ra jkovic. A., U y t tendaele. M . , Vermeulen. A., A ndjelkovic. A., Fitz James. I., Veld. P., Denon. Q ., Vehe. R., & Devebere. J. 2008. Heat resistence of Bacilluscereusemetic toxine cereulide. Letters in A p plied M i c robiology. 46, p. 536-541. Ransom, J. R., Belk, J. N. Sofos, D. Stopforth, J. A. Scanga, and G. C. Smith. 2003. Comparison of intervention technolog ies for reducing Escherichia coli O157:H7 on beef cuts and trimmings. Food Protection Trends 23:24–34. Rasso. J, Góngora-Nieto. M, Barbosa-Cánovas. G & Swanson. 1998. Influence of several environmental of the initiation of germination of inactivation on Bacillus cereus by High Hidrostatic Pressures. International Journal of Food Microbiology. 44,125-132. Ricke. S. C., Kundinger. M. M., Miller, D.R, & Keeton. J.T. 2005. Alternatives to Antibiotics: Chemical and Physical Antimicrobial Interventions and Foodborne Pathogen Response. Poultry Science 84, p. 667–675. Rodrigo, D., Barbosa-Cánovas, G.V., Martínez, A. & Rodrigo, M. 2003. Pectinmethylesterase and natural microflora of fresh mixed orange and carrot juice treated with pulsed electric fields. Journal of Food Protection, 66: p.2336-2342. Rusell, A.D. 2003. Similarities and differences in the responses of microorganism to biocides. Journal of Antimicrobial Chemotherapy, 52: P. 750-763. Sancho., F, Lambert., Y., Demazeau, G., Lagerteau. A., Bouvier. J.M & Narbonne. J.F. 1999. Effect of ultrahigh hydrostatic pressure of hydrosoluble vitamins. Journal of engineering. 39: P. 247-253. 96 Sangonis. E., Pothakamury. U, Ribas M., Ramos. A. M, Barbosa-Cánovas., G & Swanson. 1997. La alta presión hidrostática: una alternativa en el procesamiento no térmico de alimentos, Alimentaria, 35: P.33-43 Selman. J. D. 1994. Vitamin retention during blanching of vegetables. Food Chemistry. 49, P. 137-147 Sheyderhelm. I., Bugulosvki, S., Michaelis. G. & Knorr. D. 1996. Pressure induced inactivation of selected food enzymes. Journal of Food Science, 61: P. 308-310. Serra., A, Matias, A., Nunes, V.M., Leitão, M.C., Brito, D., Bronze, R., Silva, S., Antonio P., Crespo, M.T., San Romão M.V & Duarte C.M. 2008. In vitro evaluation of olive- and grape-based natural extracts as potential preservatives for food Innovative Food Science & Emerging Technologies. 9, 3: P. 311-319. Sergelidis, D.M., Abrahim, A., Sarimvei, A., Panoulis, C., Karaioannoglou, P. and Genigeorgis, C. 1997. Temperature distribution and prevalence of Listeria spp. in domestic, etail and industrial refrigerators in Greece. International Journal of Food Microbioliogy, 34: p.171-177 Setlow, P. 2006. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. Journal of Applied Microbiology. 101: p. 514–525. Setlow, P. 2003. Spore germination. Currently Opinion Microbiology. 6. p. 550–556. Smelt JPPM. 1998. Recent advances in the microbiology of high pressure processing. Trends of Food Science Technoly. p. 152-158. Seyderhelm. I., Boguslosvsky. S., Micahelis. G., & Knoor. D. 1996. Pressure induced inactivation of selected food enzymes. Journal of Food Science. 61, p. 308-310. Spilimbergo. S, Elvassore, N., & Bertucco, A., 2002. Microbial inactivation by highpressure. Journal of Supercritical Fluids. 22: p 55-53 Stacewicz-Sapuntzakis., M, Longwen. M, Claudine Duncan., S, Ghosh,. L, Breemen., M, Ashton,. D, &. Bowen, E.P. Oxidative DNA Damage in Prostate Cancer Patients 97 Consuming Tomato Sauce-Based Entrees as a Whole-Food Intervention. Journal of the National Cancer Institute, 93 (24): p. 1872-1879. Stumbo. C. 1973. Thermobacteriology in Food Processing. Academic Press, New York. Tangwongchai R, Ledward DA, Ames JM. 2000. Effect of high-pressure treatment on the texture of cherry tomato. Journal of Agriculture Food Chemestry. 48, p.1434-1441. Taukins, P., S, Panagiotidis., P, Stoforos,. N.G, Butz, P., Fister , H, & Tausher, B,. 1998. Kinetics of vitamin C degradation under the high pressure moderate- temperature processing in model systems and fruit juices. High Pressure Food Science. Bioscience and Chemestry. (ed) N.S Isaacs. The Royal Society of Chemestry. Cambrige, Reino Unido. p. 310-136. Tassou. C., Nychas. G. y Board. R. 1991. Effect of phenolic compounds and oleuropein on the germination of Bacillus cereus spores. Biotechnology and Applied Biochemistry.13, p. 231- 237 Tausher, B. 1995. Pasteurization of food by high hidrostatic pressure. Chemical Aspects, Z. Lebensm Unters Forsch, 200, p3-13. Universidad de Talavera. 2006. CURSO DOCTORADO: PROCESADO DE ALIMENTOS POR CALOR Y NUEVAS TECNOLOGÍAS: ALTAS PRESIONES HIDROSTÁTICAS. Valero, M., Fernández, P.S & Salmerón, M.C. 2003. Influence of pH and temperature on growth of Bacillus cereus in vegetable substrates. International Journal of Food Microbiology, 19, p. 491-499. Van Netten. P., Moosdick. A., Van Hoelsen. D., Mossel. A., y Perales. I. 1990. Psychrotrophic strains of Bacillus cereus producing enterotoxin. Journal of Applied Microbiology. 69. p. 73-79. Van Opstal, I., Vanmuysen, S.C.M., Wuytack, E.Y., Masschalck, B., y Michiels, C.W. 376 2005. Inactivation of Escherichia coli by high hydrostatic pressure at different 377 98 temperatures in buffer and carrot juice. InternationalJournalof FoodMicrobiology, 378 (98): 179191. Vijay. J., & Eblen. B. 1996. Predictive thermal inactivation model for Listeria monocytogenes with temperature, pH, NaCl and sodium pyrophosphate as controlling factors. Journal of Food Protection. 62:9, p. 986-993. Villamiel, M., & Jong, P. 2000. Inactivation of Pseudomonas fluorescens and Streptococcus thermophilus in Trypticase Soy Broth and total bacteria in milk by continuous-flow ultrasonic treatment and conventional heating. Journal of Food Engineering, 45:171-179. Weemaes C, Ludikhuyce L, Van Den Broeck I, Hendrickx M. 1998. High pressure inactivation of poliphenoloxidases. Journal of Food Science. 63:873-876. Weld, R. J., C. Butts, and J. A. Heinemann. 2004. Models of phage growth and their applicability to phage therapy. J. Theor. Biol. 227:1–11. Willey RC. 1997. Preservation methods for minimally processed refrigerated foods and vegetables. En: Minimally processed refrigerated fruits and vegetables, Willey R.C.(ed). pp 66-134, Chapman and Hall, New York, NY. Whiting. R.C. 1995. Microbial modeling in foods. FoodScienceof Nutrition. 35, 467-494 Wytack 1997. Rapid measurenment of pressure induced germination of Bacillus subtillis espores expressing green flourescent protein. High Research in the Biosciences and Biotechnology, (ed) K. Heremans. Leuven Univsersity Press. p 261-264. Xiong. R., Xie. G., Edmonson. A., Lindton. R., & Sheard. M. 1999. Comparision of the Baranyi model with the modify Gompertz ecuation for modelling thermal inactivation of Listeria monocytogenes Scott A. Food Microbiology. 16, p. 269-279. Yawger, E.S. 1978. Bacteriologycal evaluation for thermal process desing. Food Technology, 32, 6): p.59-63 Zwietering, M.H., I. Jongenburger, F.M. Rombouts and K. Van’t Riet., 1990. Modelling of the bacterial growth curve. Applied Environmental Microbiology 56 (6): p. 1875-1881. 99 9. ANEXOS 9 .1 ANOVA SIMPLE ENTRE PRESIONES Y CONCENTRACIONES PARA MEDIO DE REFERENCIA Dependent variable: RECUENTO Factor: CONCENTRACION Selection variable: HHP=200 Number of observations: 7 Number of levels: 3 ANOVA Table for RECUENTO by CONCENTRACION Source Sum of Squares Df Mean Square Between groups 0,155411 2 0,0777054 Within groups 0,168275 4 0,0420688 Total (Corr.) 0,323686 6 F-Ratio 1,85 P-Value 0,2703 Multiple Range Tests for RECUENTO by CONCENTRACION Method: 95,0 percent LSD CONCENTRACION Count 0 4 2,5 1 1,5 2 Mean 0,5925 0,88 0,9 Homogeneous Groups X X X Contrast Sig. Difference +/- Limits 0 - 1,5 -0,3075 0,493175 0 - 2,5 -0,2875 0,636686 1,5 - 2,5 0,02 0,697454 • denotes a statistically significant difference. Dependent variable: RECUENTO Factor: CONCENTRACION Selection variable: HHP=400 ANOVA Table for RECUENTO by CONCENTRACION Source Sum of Squares Df Mean Square Between groups 0,144171 1 0,144171 Within groups 0,0238 5 0,00476 Total (Corr.) 0,167971 6 F-Ratio 30,29 P-Value 0,0027 Multiple Range Tests for RECUENTO by CONCENTRACION Method: 95,0 percent LSD CONCENTRACION Count 1,5 4 2,5 3 Contrast Sig. Difference Mean 0,84 1,13 Homogeneous Groups X X +/- Limits 100 1,5 - 2,5 * -0,29 0,135455 * denotes a statistically significant difference. Dependent variable: RECUENTO Factor: CONCENTRACION Selection variable: HHP=500 ANOVA Table for RECUENTO by CONCENTRACION Source Sum of Squares Df Mean Square Between groups 0,382831 2 0,191415 Within groups 0,725462 12 0,0604552 Total (Corr.) 1,10829 14 F-Ratio 3,17 P-Value 0,0787 Multiple Range Tests for RECUENTO by CONCENTRACION Method: 95,0 percent LSD CONCENTRACION Count 1,5 3 0 8 2,5 4 Mean 0,61 0,77625 1,0625 Homogeneous Groups X XX X Contrast Sig. Difference +/- Limits 0 - 1,5 0,16625 0,362684 0 - 2,5 -0,28625 0,32806 1,5 - 2,5 * -0,4525 0,409163 * denotes a statistically significant difference. Dependent variable: RECUENTO Factor: HHP Selection variable: CONCENTRACION=0 ANOVA Table for RECUENTO by HHP Source Sum of Squares Df Mean Square Between groups 0,647009 2 0,323504 Within groups 0,769663 25 0,0307865 Total (Corr.) 1,41667 27 Multiple Range Tests for RECUENTO by HHP Method: 95,0 percent LSD HHP Count Mean 200 4 0,5925 500 8 0,77625 0 16 1,0 F-Ratio 10,51 P-Value 0,0005 F-Ratio 217,33 P-Value 0,0000 Homogeneous Groups X X X Contrast Sig. Difference +/- Limits 0 - 200 * 0,4075 0,202011 0 - 500 * 0,22375 0,156477 200 - 500 -0,18375 0,221292 * denotes a statistically significant difference. Dependent variable: RECUENTO Factor: HHP Selection variable: CONCENTRACION=1,5 ANOVA Table for RECUENTO by HHP Source Sum of Squares Df Mean Square Between groups 0,341047 3 0,113682 Within groups 0,0068 13 0,000523077 101 Total (Corr.) 0,347847 16 Multiple Range Tests for RECUENTO by HHP Method: 95,0 percent LSD HHP Count Mean Homogeneous Groups X 500 3 0,61 X 400 4 0,84 X 200 2 0,9 X 0 8 1,0 Contrast Sig. Difference +/- Limits 0 - 200 * 0,1 0,0390617 0 - 400 * 0,16 0,0302571 0 - 500 * 0,39 0,0334505 200 - 400 * 0,06 0,04279 200 - 500 * 0,29 0,0451046 400 - 500 * 0,23 0,0377372 • denotes a statistically significant difference. Dependent variable: RECUENTO Factor: HHP Selection variable: CONCENTRACION=2,5 ANOVA Table for RECUENTO by HHP Source Sum of Squares Df Mean Square Between groups 0,063825 3 0,021275 Within groups 0,141075 12 0,0117562 Total (Corr.) 0,2049 15 Multiple Range Tests for RECUENTO by HHP Method: 95,0 percent LSD HHP Count Mean 200 1 0,88 0 8 1,0 500 4 1,0625 400 3 1,13 Contrast 0 - 200 0 - 400 0 - 500 200 - 400 200 - 500 400 - 500 Sig. F-Ratio 1,81 P-Value 0,1990 Homogeneous Groups X X X X Difference 0,12 -0,13 -0,0625 -0,25 -0,1825 0,0675 +/- Limits 0,250571 0,159936 0,144667 0,272788 0,264125 0,180432 102 9. 2. ANOVA MULTIPLE ENTRE MEDIO DE REFERENCIA Y BEBIDAVEGETAL (10 MINUTOS) Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=0 Selection variable: hhp=200 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=0 0,00016309 1 0,00016309 MAIN EFFECTS A:DISTINTIVO 0,410803 1 0,410803 RESIDUAL 0,580313 14 0,0414509 TOTAL (CORRECTED) 1,01917 16 All F-ratios are based on the residual mean square error. Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 10 0,394294 1 7 0,722473 Contrast 1-2 • Sig. Difference 0,328179 LS Sigma 0,0654281 0,0787312 F-Ratio P-Value 0,00 0,9509 9,91 0,0071 Homogeneous Groups X X +/- Limits 0,447173 denotes a statistically significant difference Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=1,5 Selection variable: hhp=200 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=1,5 0,00236612 1 0,00236612 MAIN EFFECTS A:DISTINTIVO 0,437594 1 0,437594 RESIDUAL 0,57811 14 0,0412936 TOTAL (CORRECTED) 1,01917 16 All F-ratios are based on the residual mean square error. F-Ratio P-Value 0,06 0,8143 10,60 0,0058 Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 10 0,395177 1 7 0,721211 LS Sigma 0,0642632 0,0768109 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 1-2 0,326034 0,464041 • denotes a statistically significant difference 103 Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=2,5 Selection variable: hhp=200 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=2,5 0,00415365 1 0,00415365 MAIN EFFECTS A:DISTINTIVO 0,427949 1 0,427949 RESIDUAL 0,576322 14 0,0411659 TOTAL (CORRECTED) 1,01917 16 All F-ratios are based on the residual mean square error. Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 10 0,391244 1 7 0,72683 LS Sigma 0,0652555 0,0785494 F-Ratio P-Value 0,10 0,7554 10,40 0,0061 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 1-2 0,335586 0,482242 • denotes a statistically significant difference Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=0 Selection variable: hhp=400 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=0 0,0796036 1 0,0796036 MAIN EFFECTS A:DISTINTIVO 0,561718 1 0,561718 RESIDUAL 0,573182 17 0,0337166 TOTAL (CORRECTED) 1,29648 19 All F-ratios are based on the residual mean square error. Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 9 0,632954 1 11 0,973861 LS Sigma 0,0616119 0,0556636 F-Ratio P-Value 2,36 0,1428 16,66 0,0008 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 1-2 0,340907 0,382606 * denotes a statistically significant difference. Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=1,5 Selection variable: hhp=400 104 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=1,5 0,332658 1 0,332658 MAIN EFFECTS A:DISTINTIVO 0,672619 1 0,672619 RESIDUAL 0,320128 17 0,018831 TOTAL (CORRECTED) 1,29648 19 All F-ratios are based on the residual mean square error. Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 9 0,617609 1 11 0,986416 LS Sigma 0,0457546 0,0413846 F-Ratio P-Value 17,67 0,0006 35,72 0,0000 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 1-2 * 0,368807 0,271596 • denotes a statistically significant difference Dependent variable: recuento Factors: DISTINTIVO Covariates: CONCENTRACION=2,5 Selection variable: hhp=400 Analysis of Variance for recuento - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=2,5 0,0984018 1 0,0984018 MAIN EFFECTS A:DISTINTIVO 0,714896 1 0,714896 RESIDUAL 0,554384 17 0,0326108 TOTAL (CORRECTED) 1,29648 19 All F-ratios are based on the residual mean square error Multiple Range Tests for recuento by DISTINTIVO Method: 95,0 percent LSD DISTINTIVO Count LS Mean 2 9 0,608001 1 11 0,994278 LS Sigma 0,060741 0,0548528 F-Ratio P-Value 3,02 0,1005 21,92 0,0002 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 1-2 * 0,386277 0,363104 * denotes a statistically significant difference. 9. 3. ANOVA MULTIPLE ENTRE 10 Y 25 MINUTOS DE TRATAMIENTO EN BEBIDA VEGETAL Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=0 Selection variable: HHP=200 105 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=0 1,68497 1 1,68497 MAIN EFFECTS A:TRATAMIENTO TIEMPO 2,37258 1 2,37258 RESIDUAL 7,31913 19 0,385217 TOTAL (CORRECTED) 11,2392 21 All F-ratios are based on the residual mean square error. Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Count 10 12 LS Mean 0,384215 1,04416 LS Sigma 0,196338 0,179221 F-Ratio P-Value 4,37 0,0502 6,16 0,0226 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 10 - 25 -0,659944 1,19001 * denotes a statistically significant difference. Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=1,5 Selection variable: HHP=200 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=1,5 0,575187 1 0,575187 MAIN EFFECTS A:TRATAMIENTO TIEMPO 2,3137 1 2,3137 RESIDUAL 8,42892 19 0,443627 TOTAL (CORRECTED) 11,2392 21 All F-ratios are based on the residual mean square error. Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Count 10 12 LS Mean 0,388709 1,04041 LS Sigma 0,210698 0,192329 F-Ratio P-Value 1,30 0,2690 5,22 0,0341 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 10 - 25 -0,651704 1,27705 * denotes a statistically significant difference. Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=2,5 Selection variable: HHP=200 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=2,5 3,97869 1 3,97869 F-Ratio P-Value 15,04 0,0010 106 MAIN EFFECTS A:TRATAMIENTO TIEMPO 2,65394 1 2,65394 RESIDUAL 5,02542 19 0,264496 TOTAL (CORRECTED) 11,2392 21 All F-ratios are based on the residual mean square error. Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Count 10 12 LS Mean 0,362801 1,062 LS Sigma 0,162845 0,148624 10,03 0,0051 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 10 - 25 -0,699202 0,95643 * denotes a statistically significant difference. Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=0 Selection variable: HHP=400 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=0 0,706632 1 0,706632 MAIN EFFECTS A:TRATAMIENTO TIEMPO 0,0251791 1 0,0251791 RESIDUAL 0,665523 18 0,0369735 TOTAL (CORRECTED) 1,4413 20 All F-ratios are based on the residual mean square error. Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Count 9 12 LS Mean 0,648093 0,718588 LS Sigma 0,0643698 0,0556865 F-Ratio P-Value 19,11 0,0004 0,68 0,4200 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 10 - 25 -0,0704951 0,393202 * denotes a statistically significant difference. Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=1,5 Selection variable: HHP=400 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=1,5 0,584107 1 0,584107 MAIN EFFECTS A:TRATAMIENTO TIEMPO 0,069143 1 0,069143 RESIDUAL 0,788048 18 0,0437804 TOTAL (CORRECTED) 1,4413 20 All F-ratios are based on the residual mean square error. F-Ratio P-Value 13,34 0,0018 1,58 0,2249 107 Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Contrast 10 - 25 Sig. Difference -0,11595 Count 9 12 LS Mean 0,622118 0,738069 LS Sigma 0,0697459 0,0604017 Homogeneous Groups X X +/- Limits 0,406984 Dependent variable: RECUENTO Factors: TRATAMIENTO TIEMPO Covariates: CONCENTRACION=2,5 Selection variable: HHP=400 Analysis of Variance for RECUENTO - Type III Sums of Squares Source Sum of Squares Df Mean Square COVARIATES CONCENTRACION=2,5 0,0011904 1 0,0011904 MAIN EFFECTS A:TRATAMIENTO TIEMPO 0,0662306 1 0,0662306 RESIDUAL 1,37096 18 0,0761647 TOTAL (CORRECTED) 1,4413 20 All F-ratios are based on the residual mean square error. F-Ratio P-Value 0,02 0,9019 0,87 0,3634 Multiple Range Tests for RECUENTO by TRATAMIENTO TIEMPO Method: 95,0 percent LSD TRATAMIENTO TIEMPO 10 25 Count 9 12 LS Mean 0,623109 0,737325 LS Sigma 0,0923339 0,0798898 Homogeneous Groups X X Contrast Sig. Difference +/- Limits 10 - 25 -0,114217 0,52446 * denotes a statistically significant difference. 108 109