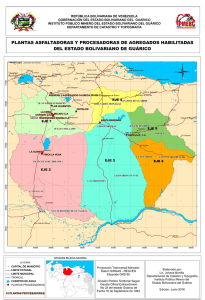
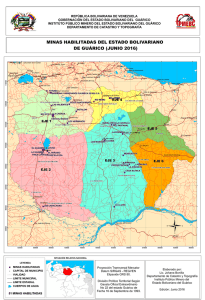
relación entre el contenido de aflatoxinas totales y aflatoxina b1 en
Anuncio

UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN EN CIENCIA DE LOS ALIMENTOS Y NUTRICIÓN MAESTRÍA EN CIENCIA DE LOS ALIMENTOS RELACIÓN ENTRE EL CONTENIDO DE AFLATOXINAS TOTALES Y AFLATOXINA B1 EN MAÍZ BLANCO DE COSECHA EN VENEZUELA Trabajo de Grado presentado a la Universidad Simón Bolívar por Ana Daniela Arrieta Claramonte Como requisito parcial para optar al grado académico de Magister en Ciencia de los Alimentos Con la asesoría de los Prof. Marleny Chavarri Alexia Torres Enero de 2012 ii iii DEDICATORIA A Dios por siempre iluminarme el camino y darme la fe y fortaleza para lograr las metas que me propongo en la vida. A mi madre por ser siempre el apoyo que necesito en los momentos más difíciles, y por motivarme a seguir progresando… Gracias eternas mami!. Y a mi padre, que desde el cielo me sigue apoyando en todos mis proyectos… te extraño gordito. A mi abuela Rosa y mi abuelo Normando, que también desde el cielo nos siguen bendiciendo. A mi hermana, mis tías y primos por ser siempre el apoyo que necesitamos en la familia. A mi sobrina Ana Sofía por ser la alegría de nuestra familia. Te amo beba. Al abuelo Reyes y Mary por su constante preocupación por nuestro bienestar y por su apoyo incondicional en mi formación profesional, y en mi crecimiento personal y espiritual. A todos los que no he nombrado pero saben que ocupan un lugar especial en mi corazón, porque es gratificante saber que puedo contar siempre con gente especial. iv AGRADECIMIENTO A mi tío Claudio Rivera por su apoyo en la recolección de la información meteorológica, porque sin tu ayuda habría sido muy difícil concretar este objetivo… Gracias! A Antonio Capobianco por su entusiasmo en las investigaciones científicas y por el apoyo en toda mi formación académica, desde mi tesis de pregrado hasta mi tesis de maestría. Gracias Capo. A las profesoras Marleny y Alexia por su apoyo y respaldo como excelentes tutoras durante todo el desarrollo del trabajo. Aprecio mucho su disposición y conocimientos para el trabajo. A Norelis Aguiar y María Milagros González, que más que supervisoras han sido amigas y guías en el camino. Gracias por darme el apoyo para poder concluir mis estudios profesionales. A Graciela Troncone y el equipo de soporte científico por su apoyo y disposición para llevar a cabo los análisis del trabajo. Como siempre dispuestos a apoyar la investigaciones científicas y promoviendo el desarrollo de la gente. A todos los que de alguna manera colaboraron y no he nombrado, porque sin el apoyo de todos no habría sido posible concluir esta etapa de mi formación profesional v UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN EN CIENCIA DE LOS ALIMENTOS Y NUTRICIÓN MAESTRÍA EN CIENCIA DE LOS ALIMENTOS RELACIÓN ENTRE EL CONTENIDO DE AFLATOXINAS TOTALES Y AFLATOXINA B1 EN MAÍZ BLANCO DE COSECHA EN VENEZUELA Por: Arrieta Ana Carnet N°: 06-85491 Tutores: Marleny Chavarri y Alexia Torres Enero de 2012 RESUMEN El proceso de almacenamiento de cereales en silos surge de la necesidad de garantizar el suministro de materias primas inocuas para la alimentación humana y animal, por lo que se desarrollan técnicas para conservar los granos y mantener su calidad; en tal sentido se plantea el desarrollo de una investigación asociada a la conservación y manejo post-cosecha de maíz blanco, para establecer su influencia con la síntesis de aflatoxinas totales y la asociación con el contenido de aflatoxinas B1 en maíz blanco de cosecha, ya que dicho metabolito es el hepatocancerígeno más potente conocido y por lo tanto se establecen regulaciones para su concentración. La metodología se basa en un muestreo estratificado de afijación proporcional al aporte de materia prima por estado (Guárico, Cojedes, Calabozo y Anzoátegui), en el centro de recepción seleccionado en el Estado Aragua, de las cosechas 2009-2010 y 2010-2011 para realizar la determinación de aflatoxinas totales y aflatoxinas B1 a fin de establecer estadísticamente mediante la correlación de Pearson y una regresión simple la asociación entre ambas, empleando HPLC; y adicionalmente se desea evaluar la incidencia de los factores postcosecha como condiciones ambientales y pluviométricas, uso de maquinaria agrícola para la cosecha y tiempo transcurrido hasta el acondicionamiento de la materia prima en la síntesis de la toxina a fin de establecer las causas y generar las recomendaciones necesarias para reducirla en las próximas cosechas. Se obtuvo que sólo el 21,5% de las muestras presentó valores mayores a cero en aflatoxina total, no se detectaron aflatoxinas G1 y G2 en ninguna de las muestras; sólo el 44,83% de las muestras que presentaron aflatoxina cumplen con lo establecido en la norma Covenin 1935-87 de máximo 5 ng/g de B1; las condiciones ambientales de temperatura, humedad y precipitación total presentaron diferencias significativas entre meses y entre los años analizados; así mismo se encontró que entre el contenido de aflatoxina B1 y aflatoxina total existe regresión y es significativa. En tal sentido la recomendación va dirigida a minimizar la práctica de cosecha manual y emplear mayor tecnificación, así como semillas de alta calidad y resistentes al ataque de mohos. Palabras clave: maíz, aflatoxinas, aflatoxinas totales, aflatoxina B1, cuantificación, post-cosecha. vi ÍNDICE GENERAL APROBACIÓN DEL JURADO ................................................................................................ ii DEDICATORIA ......................................................................................................................... ii AGRADECIMIENTO ............................................................................................................... iv RESUMEN .................................................................................................................................. v ÍNDICE DE FIGURAS ...........................................................................................................viii ÍNDICE DE TABLAS ............................................................................................................... ix INTRODUCCIÓN ...................................................................................................................... 1 CAPÍTULO I PLANTEAMIENTO DEL PROBLEMA ........................................................ 3 1.1 1.2 1.3 1.4 1.5 DESCRIPCIÓN DEL PROBLEMA........................................................................................... 3 FORMULACIÓN DEL PROBLEMA ....................................................................................... 3 OBJETIVOS .............................................................................................................................. 4 JUSTIFICACIÓN....................................................................................................................... 5 LIMITACIONES ....................................................................................................................... 6 CAPÍTULO II MARCO TEÓRICO REFERENCIAL .......................................................... 7 2.1 2.2 2.3 2.4 2.5 EL MAÍZ (ZEA MAYS L.) ............................................................................................................. 7 MANEJO DEL GRANO .......................................................................................................... 12 MOHOS Y MICOTOXINAS ................................................................................................... 13 CUANTIFICACIÓN DE MICOTOXINAS ............................................................................. 16 ANTECEDENTES ................................................................................................................... 17 CAPÍTULO III MARCO METODOLÓGICO ..................................................................... 22 3.1 TIPO DE INVESTIGACIÓN ...................................................................................................22 3.2 UNIVERSO, POBLACIÓN Y MUESTRA .............................................................................23 3.3 EVALUACIÓN DE LAS CONDICIONES DE MANEJO POST-COSECHA DE MAÍZ BLANCO .............................................................................................................................................24 3.4 EVALUACIÓN DEL COMPORTAMIENTO DE LA PRESENCIA DE AFLATOXINAS EN MAÍZ BLANCO ............................................................................................................................26 3.5 DETERMINACIÓN DEL CONTENIDO DE AFLATOXINA B1 Y AFLATOXINAS TOTALES, EN MAÍZ BLANCO DE COSECHA ...............................................................................26 3.6 CORRELACIÓN DEL CONTENIDO DE AFLATOXINA B1 CON EL CONTENIDO DE AFLATOXINA TOTAL Y LA CALIDAD DEL GRANO ..................................................................31 vii 3.7 RECOMENDACIONES POST-COSECHA PARA MINIMIZAR LA INCIDENCIA DE AFLATOXINAS TOTALES EN MAÍZ BLANCO NACIONAL .......................................................32 CAPÍTULO IV RESULTADOS Y ANÁLISIS ...................................................................... 33 EVALUACIÓN DE LAS CONDICIONES DE MANEJO POSTCOSECHA DE MAÍZ 4.1 BLANCO .............................................................................................................................................33 4.2 EVALUACIÓN DEL COMPORTAMIENTO DE LA PRESENCIA DE AFLATOXINAS EN MAÍZ BLANCO ............................................................................................................................44 4.3 DETERMINACIÓN DEL CONTENIDO DE AFLATOXINA B1 Y AFLATOXINAS TOTALES EN MAÍZ BLANCO DE COSECHA ................................................................................45 4.4 CORRELACIÓN DEL CONTENIDO DE AFLATOXINA B1 CON EL CONTENIDO DE AFLATOXINA TOTAL Y LA CALIDAD DEL GRANO ..................................................................50 4.5 RECOMENDACIONES POSTCOSECHA PARA MINIMIZAR LA INCIDENCIA DE AFLATOXINAS TOTALES EN MAÍZ BLANCO NACIONAL .......................................................51 CONCLUSIONES .................................................................................................................... 55 RECOMENDACIONES .......................................................................................................... 56 REFERENCIAS........................................................................................................................ 57 viii ÍNDICE DE FIGURAS FIGURA 2.1 ESTRUCTURAS FÍSICAS FUNDAMENTALES DEL CARIOPSIS DE MAÍZ. ........................................................................................................................................... 8 FIGURA 3.1 CROMATOGRAMA DE ESTÁNDARES A LA MAYOR CONCENTRACIÓN. ................................................................................................................. 30 FIGURA 4.1 MAPA POLÍTICO DEL ESTADO GUÁRICO. .................................................. 34 FIGURA 4.2 COMPORTAMIENTO DE TEMPERATURA AMBIENTAL PROMEDIO DEL ESTADO GUÁRICO. ....................................................................................................... 35 FIGURA 4.3 COMPORTAMIENTO DE HUMEDAD AMBIENTAL PROMEDIO DEL ESTADO GUÁRICO. ................................................................................................................ 36 FIGURA 4.4 COMPORTAMIENTO DE PRECIPITACIÓN AMBIENTAL PROMEDIO DEL ESTADO GUÁRICO. ....................................................................................................... 38 FIGURA 4.5 COMPORTAMIENTO DE LAS HORAS DE COLA EN EL CENTRO DE RECEPCIÓN SELECCIONADO EN EL ESTADO ARAGUA, PARA LAS COSECHAS 2009-2010 Y 2010-2011. ............................................................................................................ 40 FIGURA 4.6 COMPORTAMIENTO EN LA CONCENTRACIÓN DE AFLATOXINA TOTAL EN MAÍZ BLANCO. ................................................................................................... 45 FIGURA 4.7 CROMATOGRAMA DE MUESTRA SIN METABOLITOS DETECTADOS. ......................................................................................................................... 48 FIGURA 4.8 CROMATOGRAMA DE MUESTRA POSITIVA PARA METABOLITOS B1 Y B2. ..................................................................................................................................... 48 FIGURA 4.9 DIAGRAMA CAUSA-EFECTO DE LA PRESENCIA DE AFLATOXINAS EN MAÍZ BLANCO DE COSECHA. ....................................................................................... 52 ix ÍNDICE DE TABLAS TABLA 2.1 COMPOSICIÓN QUÍMICA PROXIMAL DE LAS PARTES PRINCIPALES DE LOS GRANOS DE MAÍZ. .................................................................................................. 10 TABLA 2.2 TOXICIDAD DE LOS METABOLITOS PRODUCIDOS POR ASPERGILLUS FLAVUS. .......................................................................................................... 14 TABLA 3.1 PORCENTAJE DE PARTICIPACIÓN POR ESTADO, EN LA RECEPCIÓN DE MATERIA PRIMA. ............................................................................................................. 24 TABLA 3.2 CRITERIOS DE AGRUPACIÓN, POR MUNICIPIO, PARA GRUPOS HOMOGÉNEOS. ....................................................................................................................... 25 TABLA 3.3 VOLUMEN DE LA SOLUCIÓN PATRÓN NECESARIO PARA LA PREPARACIÓN DE LOS ESTÁNDARES............................................................................... 27 TABLA 3.4 PARÁMETROS DEL DETECTOR DE FLUORESCENCIA. ............................ 28 TABLA 3.5 PROGRAMA DE LA DISTRIBUCIÓN DE SOLVENTES UTILIZADO EN HPLC. ......................................................................................................................................... 28 TABLA 3.6 DATOS DE LAS CURVAS DE CORRELACIÓN PARA EL CÁLCULO DE CONCENTRACIÓN DE TOXINA. .......................................................................................... 30 TABLA 4.1 TEMPERATURA AMBIENTAL PROMEDIO ( °C) DEL ESTADO GUÁRICO. ................................................................................................................................. 34 TABLA 4.2 HUMEDAD AMBIENTAL PROMEDIO (%) DEL ESTADO GUÁRICO. ........ 35 TABLA 4.3 PRECIPITACIÓN AMBIENTAL PROMEDIO (MM) DEL ESTADO GUÁRICO. ................................................................................................................................. 37 TABLA 4.4. RESUMEN DE PROCEDIMIENTO ANOVA PARA CONDICIONES AMBIENTALES (TEMPERATURA, HUMEDAD Y PRECIPITACIÓN). ............................ 38 TABLA 4.5 RESUMEN DE PRUEBA DE RANGO DE TUKEY PARA VARIABLES AMBIENTALES. ....................................................................................................................... 39 TABLA 4.6 VARIABLES DE LA TIPIFICACIÓN EFECTUADA A LAS MUESTRAS DE MAÍZ EN ESTUDIO. .......................................................................................................... 41 x TABLA 4.7 DETERMINACIÓN DEL CONTENIDO DE AFLATOXINAS EN LAS MUESTRAS ESTUDIADAS. .................................................................................................... 47 TABLA 4.8 PROCEDIMIENTO FREQ PARA AFLATOXINA TOTAL Y GRUPO DE TECNIFICACIÓN...................................................................................................................... 49 TABLA 4.9 PROCEDIMIENTO FREQ PARA AFLATOXINA TOTAL Y LA PROCEDENCIA. ....................................................................................................................... 49 TABLA 4.10 REGRESIONES SIMPLES DE VARIABLES DE INTERÉS CON EL CONTENIDO DE AFLATOXINA B1. ..................................................................................... 51 1 INTRODUCCIÓN Los cereales constituyen los principales cultivos agrícolas del país y éstos pueden ser deteriorados por la acción o presencia de los mohos, los cuales disminuyen el valor nutricional del grano como materia prima; y adicional a ello algunas especies de mohos son capaces de producir micotoxinas, las cuales pueden causar daños a la salud de animales y humanos. La colonización de los granos de maíz por mohos producen pérdidas importantes a nivel económico y especialmente en países tropicales como Venezuela en donde la temperatura y humedad relativa de la mayoría de las zonas productoras son favorables para el desarrollo de mohos y sus toxinas (González, 1995). El conocimiento de los mohos toxigénicos y sus micotoxinas es muy importante debido a que de allí se derivan los controles que se deben llevar a cabo para asegurar que la materia prima empleada para consumo humano y animal sea inocua. La presencia de micotoxinas es un problema permanente que debe mantenerse monitoreado desde el campo y hasta las industrias procesadoras ya que la prevención es la manera más segura y económica de garantizar la calidad del producto. Esta investigación se realizó con la finalidad de conocer la relación que existe entre el contenido de aflatoxinas totales y aflatoxina B1 en el maíz blanco de cosecha en Venezuela para lo que se evaluaron las principales condiciones de manejo postcosecha y el comportamiento en la concentración de aflatoxinas totales en un centro de recepción, ubicado en el Estado Aragua, en los últimos 3 años para así poder establecer las recomendaciones en cuanto al manejo postcosecha para garantizar la calidad e inocuidad del producto. La investigación se presenta dividida en capítulos: el primero es el planteamiento del problema y contiene una descripción del caso a estudiar, una breve exposición, su formulación, los objetivos que se desean alcanzar y la justificación y limitaciones del presente 2 estudio; el segundo contiene referencias de textos consultados que poseen relación con el estudio, y además se presentan las bases teóricas que sustentan y facilitan la comprensión del fenómeno analizado; en el tercer capítulo se delimita el tipo de trabajo científico y de investigación en que se basa la realización del estudio, y se presenta el desarrollo de la metodología de la investigación; el cuarto comprende resultados experimentales y sus correspondientes análisis; y por último se presentan las conclusiones y recomendaciones. 3 CAPÍTULO I PLANTEAMIENTO DEL PROBLEMA En el presente capítulo se esboza el problema o caso a estudiar, mediante una breve descripción, su formulación, los objetivos a alcanzar y la justificación y limitaciones del presente estudio. 1.1 DESCRIPCIÓN DEL PROBLEMA Existen investigaciones de referencia de la presencia de mohos toxigénicos en granos de maíz blanco en Venezuela, evidenciando la incidencia de aflatoxinas en los granos de cosecha empleados luego en la fabricación de alimentos para consumo humano y animal. 1.2 FORMULACIÓN DEL PROBLEMA 1.2.1 Situación actual El maíz es una de las principales materias primas para producción de alimentos en Venezuela, actualmente la Norma Covenin 1935 correspondiente a Maíz para uso industrial fue actualizada hasta el año 1987 y el método establecido en dicha norma para la determinación de aflatoxinas es mediante el uso de la lámpara de luz UV y de presentarse fluorescencia establece la cuantificación de la toxina con un límite máximo permitido de 5ng/g de aflatoxina B1. Estudios han demostrado que la aparición de puntos de fluorescencia se deben a la presencia del ácido kojico y no son un indicativo confiable de la concentración de la toxina en la muestra, por lo que se ha procedido en estados Unidos y Europa a cuantificar y normar el contenido de aflatoxinas totales; y adicionalmente se han establecido regulaciones para el 4 contenido de aflatoxina B1 debido a su potencial efecto tóxico en humanos y animales (Scussel, 1998). En tal sentido, en Venezuela se hace imperante la actualización de dichas normas de referencia a fin de establecer la detección de aflatoxinas totales, mundialmente aceptada, sin olvidar la regulación del contenido de B1 tal como actualmente está establecido. 1.2.2 Situación deseada Establecer la relación entre el contenido de aflatoxinas totales y aflatoxina B1 en el maíz de cosecha en Venezuela a fin de mantener en las plantas procesadoras de maíz las determinaciones de aflatoxinas totales, empleadas como referencia en Estados Unidos y Europa, pero conociendo el cumplimiento de la normativa nacional vigente. Adicionalmente se evaluará la influencia del manejo post-cosecha y las condiciones climáticas, entre otros aspectos, sobre la incidencia de las toxinas en la materia prima. 1.3 OBJETIVOS 1.3.1 Objetivo general Relacionar el contenido de aflatoxinas totales y aflatoxina B1 en maíz blanco de cosecha en Venezuela. 1.3.2 Objetivos específicos Evaluar las condiciones de manejo post-cosecha de maíz blanco, en los principales estados productores del país, en los últimos 3 años. Evaluar el comportamiento de la presencia de aflatoxinas en maíz blanco en los últimos tres períodos de cosecha. Determinar el contenido de aflatoxina B1 y aflatoxinas Totales, en maíz blanco de cosecha 2009-2010 y 2010-2011. 5 Correlacionar el contenido de aflatoxina B1 con el contenido de aflatoxina Total y la calidad del grano, para establecer recomendaciones en las especificaciones de recepción de materia prima. Establecer recomendaciones post-cosecha para minimizar la incidencia de aflatoxinas totales en maíz blanco nacional. 1.4 JUSTIFICACIÓN La presente investigación posee relevancia a nivel social ya que se estaría aportando la información necesaria para efectuar una revisión o actualización de la normativa venezolana sobre la cuantificación de aflatoxinas en maíz para uso industrial, beneficiando a los consumidores al asegurar la inocuidad de los productos derivados del maíz y a las empresas procesadoras al facilitar la detección de dicha toxina a través del uso de métodos rápidos al validarlos con un método de referencia. En cuanto a la conveniencia del estudio se puede mencionar el diagnóstico sobre la distribución de aflatoxinas, en el maíz proveniente de diferentes zonas de producción, así como la relación entre las aflatoxinas totales y el contenido de aflatoxina B1 y la influencia de las condiciones post-cosecha en dicha incidencia. Las implicaciones prácticas van orientadas a la relación entre las toxinas mencionadas, aportando el conocimiento necesario para adaptar la versatilidad de los métodos de detección rápidos empleados en los centros de recepción de materia prima. De igual manera la investigación presenta el aporte metodológico ya que las detecciones serán llevadas a cabo empleando el método por cromatografía líquida con detección por fluorescencia (HPLC-fluorescencia). Y desde el punto de vista teórico se aportará el conocimiento de la relación entre el contenido de aflatoxina B1 y aflatoxina total en el maíz de cosecha venezolano empleado en un centro de recepción del Estado Aragua, lo cual puede resultar de interés para futuras investigaciones a realizarse en la industria de procesamiento de cereales. 6 1.5 LIMITACIONES La mayor limitante se presentó al momento de recolectar la información de condiciones ambientales y manejo post-cosecha, cuya procedencia fuera confiable a fin de establecer las conclusiones adecuadas con los resultados obtenidos. 7 CAPÍTULO II MARCO TEÓRICO REFERENCIAL En esta sección se presentan conceptos de interés y relevancia para la investigación, así como trabajos realizados en el área que sustentan y facilitan la comprensión de la problemática presentada. 2.1 EL MAÍZ (Zea mays L.) Es uno de los cereales más importantes del mundo, botánicamente perteneciente a la familia de las gramíneas y considerada una planta anual. El grano maduro posee un peso promedio de 350 mg en donde aproximadamente el 82% corresponde al endospermo, 12% al germen, 5% al pericarpio y menos de 1% a la punta (González, 1995). Botánicamente el grano de maíz es también denominado cariopsis debido a que posee un pericarpio delgado y se encuentra soldado al tegumento seminal, por lo que se dice que posee todo lo necesario estructural, nutricional y enzimáticamente requerido para iniciar el crecimiento y desarrollo del embrión. Dicho grano se divide generalmente en cuatro estructuras físicas básicas: pericarpio o cáscara, endospermo, germen y pilorriza (Figura 2.1) (ONU, 1993). 2.1.1 Aplicaciones del maíz Básicamente existen tres aplicaciones fundamentales: alimento, forraje y materia prima para la industria. El uso fundamental y de mayor interés es el asociado con la alimentación, debido a su alto impacto, en donde se puede incluir el grano entero o bien se pueden elaborar productos intermedios como sémola o productos terminados como harinas. 8 La elaboración de los productos mencionados incluye diversas técnicas de procesamiento pero en donde la calidad de la materia prima es de gran importancia para calidad de los productos que de allí se deriven. En tal sentido, la inocuidad y calidad de la materia prima debe ser de vital atención para asegurar que los alimentos obtenidos no causen daño alguno a la población que lo consume. Figura 2.1 Estructuras físicas fundamentales del cariopsis de maíz. FUENTE: El maíz en la nutrición humana (ONU, 1993). 2.1.2 Propiedades físicas y detalles estructurales. El maíz absorbe agua rápidamente, la cual ingresa primero por la capa más externa y se mueve a través de espacios vacíos en el pericarpio por la acción capilar y entra al endospermo. Es por ello que el humedecimiento del contenido celular de endospermo y germen es un proceso de difusión lento que aumenta proporcionalmente con la temperatura (Watson y Ramstad, 1987). Germen: representa 10-12% del peso del grano seco y está compuesto por el embrión y el escutelo, el cual funciona como órgano nutritivo para el embrión porque almacena nutrientes y hormonas que son movilizados por enzimas elaboradas durante los estados iniciales de la 9 germinación. Todas estas células son, de manera potencial, activas metabólicamente en la hidratación, y se ha encontrado que contienen enzimas que hidrolizan y sintetizan lípidos. Las paredes de las células del escutelo son delgadas y contienen numerosos huecos y espacios intercelulares que facilitan el movimiento del material entre las células, su parte superior es sólo una capa de células secretoras que forman el primer contacto entre el germen y el endospermo. Durante la germinación del grano, las capas exteriores de las células se hinchan, las paredes celulares se vuelven delgadas y las enzimas hidrolíticas son secretadas y difundidas en el endospermo para digerir almidón y proteína; mientras que azúcares y aminoácidos resultantes son luego transportados a través del escutelo para la nutrición del embrión. Endospermo: constituye 82-84% en peso del grano seco y está compuesto por 86-89% en peso de almidón. Posee un recubrimiento externo (aleurona), que es sólo una capa de células de una apariencia completamente diferente, conformado por proteínas pero no almidones y cubre completamente el endospermo harinoso y germen. Pericarpio: estructura externa de la semilla que posee 5-6% del peso del grano seco, es una capa delgada y casi invisible que se adhiere herméticamente a la superficie exterior de la capa de aleurona con la intención de concederle propiedades semipermeables al grano de maíz (Watson y Ramstad, 1987). 2.1.3 Composición química Como se muestra en la Tabla 2.1, las partes principales del grano de maíz difieren considerablemente en su composición química. El pericarpio se caracteriza por un elevado contenido de fibra cruda que a su vez está formada fundamentalmente por hemicelulosa, celulosa y lignina. El endospermo, en cambio, contiene un nivel elevado de almidón, 8% de proteínas y un contenido relativamente bajo de los otros componentes. El germen se caracteriza por un elevado contenido de grasas crudas y contiene también un nivel relativamente elevado de proteínas y minerales. Por otra parte, el contenido de hidratos de 10 carbono y proteínas de los granos de maíz depende en medida considerable del endospermo; el de grasas crudas y, en menor medida, proteínas y minerales, del germen (ONU, 1993). Tabla 2.1 Composición química proximal de las partes principales de los granos de maíz. Componente químico Pericarpio (%) Endospermo (%) Germen (%) Proteínas 3,7 8,0 18,4 Extracto etéreo (grasa) 1,0 0,8 33,2 Fibra cruda 86,7 2,7 8,8 Cenizas 0,8 0,3 10,5 Almidón 7,3 87,6 8,3 Azúcar 0,34 0,62 10,8 Fuente: Watson y Ramstad, 1987. Almidón: es el componente químico principal del grano de maíz, formado por dos polímeros de glucosa: amilosa y amilopectina, aunque también se hallan otros hidratos de carbono como azúcares sencillos en forma de glucosa, sacarosa y fructosa. Proteínas: se considera como el segundo componente químico del grano por orden de importancia. En las variedades comunes, el contenido de proteínas puede oscilar entre 8 y 11% del peso del grano, y en su mayor parte se encuentran en el endospermo. Aceite y ácidos grasos: el aceite del grano de maíz está fundamentalmente en el germen, posee un bajo nivel de ácidos grasos saturados y niveles relativamente elevados de ácidos grasos poliinsaturados como ácido linoleico, mientras que sólo se han encontrado cantidades reducidas de ácidos linolénico y araquidónico. Fibra dietética: es el componente que se halla en mayor cantidad después de los hidratos de carbono (principalmente almidón), las proteínas y las grasas. Los hidratos de carbono complejos del grano de maíz se encuentran en el pericarpio y la pilorriza, aunque también en las paredes celulares del endospermo y, en menor medida, en las del germen. 11 Minerales: la concentración de cenizas en el grano es aproximadamente del 1,3%, sólo ligeramente menor que el contenido de fibra cruda. El germen es relativamente rico en minerales, con un valor medio de 11%, frente a menos del 1% en el endospermo y además proporciona cerca del 78 % de todos los minerales del grano. El mineral que más abunda es el fósforo, encontrándose en su totalidad en el embrión con valores de aproximadamente 0,90 % (dependiendo del híbrido que se estudie), pero como sucede con la mayoría de los granos de cereal su contenido de calcio y oligoelementos es bajo (ONU, 1993). Vitaminas liposolubles: en este grupo se encuentran la provitamina A (carotenoide), distribuida mayormente en el endospermo duro del grano y únicamente pequeñas cantidades en el germen; y la vitamina E que se halla principalmente en el germen y su fuente en general son cuatro tocoferoles. Es importante acotar que El β-caroteno se destruye gradualmente por oxidación, junto con otros pigmentos carotenoides, durante el almacenamiento prolongado. Vitaminas hidrosolubles: se encuentran sobre todo en la capa de aleurona del grano de maíz, y en menor medida en el germen y el endospermo. Sustancias diversas: además de las sustancias ya mencionadas, el maíz contiene muchos otros compuestos químicos y materiales en muy bajas concentraciones; muchas de estas sustancias, como enzimas o sus precursores, son vitales para el crecimiento del embrión. Por ejemplo, el maíz maduro y seco tiene bajos niveles de actividad de α-amilasa que aumentan en la germinación (se desarrolla únicamente en el escutelo) y están ausentes en el grano seco, donde su papel en las etapas iniciales de conversión es disminuir la viscosidad del almidón gelatinizado. La enzima lipasa del maíz está presente en los cuerpos de lípidos de semillas germinadas (no sin germinar), y su función es hidrolizar los triacilglicéridos a 3 ácidos grasos por β-oxidación. Existe otra enzima denominada lipooxigenasa, cuyo rol en plantas no ha sido 12 muy estudiado; aunque se sabe que la oxidación con lipooxigenasa como catalizador de ácidos grasos poliinsaturados produce hidroperóxidos, los cuales son altamente reactivos y potencialmente dañinos para los componentes celulares (Belitz y col., 1999). 2.2 MANEJO DEL GRANO Básicamente las etapas que integran el manejo del grano son: cosecha, transporte, recepción y acondicionamiento, almacenamiento y conservación. La cosecha comienza cuando el grano alcanza su madurez fisiológica, en donde el contenido de humedad es aproximadamente 30%, y puede realizarse manual o mecánicamente. La cosecha manual consiste en la recolección de las mazorcas con personal contratado quienes deshojan y apilan en el suelo o en sacos el producto para posteriormente efectuar el desgranado; y la cosecha mecánica normalmente es empleada cuando se tienen grandes extensiones de tierra sembrada y consiste en recolectar el producto con una máquina cosechadora con lo cual se recoge, trilla y limpia el grano en una sola pasada y sin mantener contacto con el suelo. En la medida en que se va cosechando el grano, es necesario enviarlo a los centros de recepción, para lo cual se emplean camiones para transporte a granel. Usualmente dichos transportes poseen compuertas en el fondo que se abren para efectuar la descarga de los granos en los centros de acopio (Bragachini y col., 2003). En los centros de recepción se efectúa un muestreo, lo cual constituye la parte más importante de la inspección de la materia prima ya que se debe asegurar recolectar una muestra representativa para efectuarle los análisis con lo cual se establecerá la calidad del lote. En Venezuela se cuenta con la Norma COVENIN 612-82 Cereales-Oleaginosas y Productos Derivados Muestreo en donde se establecen las condiciones a cumplir para asegurar un muestreo aleatorio en base a la cantidad de producto recibido, y la Norma COVENIN 1935-87 13 Maíz para uso industrial que rige las variables de calidad para la tipificación y clasificación de la materia prima en la recepción. En caso de recibir materia prima directo del campo, se efectúa el proceso de acondicionamiento antes del almacenamiento y conservación, para disminuir el porcentaje de humedad y asegurar la calidad del producto durante el periodo de almacenamiento antes de su utilización en la obtención de productos intermedios o terminados. 2.3 MOHOS Y MICOTOXINAS A nivel mundial, después de los insectos, los mohos son los principales causantes de la reducción de calidad de los cereales almacenados y también de las cosechas. Básicamente los mohos que atacan los cereales se dividen en dos grandes grupos: de campo y de almacén. Los mohos de campo requieren altos contenidos de humedad para desarrollarse (aproximadamente 20%) e invaden y atacan a los granos antes de la cosecha afectando su apariencia y calidad (Scussel y col., 2002). Las micotoxinas son metabolitos producidos por diferentes mohos sobre los alimentos, que pueden causar enfermedades e inclusive la muerte al ser ingeridos por humanos o animales. Estas sustancias permanecen en los alimentos aun después que el moho muere y son relativamente estables bajo las condiciones usuales de cocción y procesamiento de dichos alimentos (Duarte, 2005). Las micotoxinas pueden causar daños a la salud humana cuando son ingeridas en forma gradual y constante en pequeñas dosis. Como princip C), de bajo peso molecular, resistentes a químicos, biológicos, inactivación física y existen más de 500 tipos diferentes (Scussel, 1998). La contaminación de los granos por micotoxinas es un grave problema, ya que la ingestión de micotoxinas por parte de humanos y animales causa daños variables dependiendo 14 del tipo de toxinas y de su concentración. El daño puede ser leve y pasar desapercibido o hacerse cada vez más severo hasta ocasionar la muerte del individuo (Mazzani, 1996). Las aflatoxinas fueron descubiertas en el año 1961 en Inglaterra; aunque 15 especies de Aspergillus y varias de Penicillum se sabe que producen aflatoxinas, solamente Aspergillus flavus y Aspergillus parasiticus han sido confirmados consistentemente como productores de aflatoxinas y la toxicidad se puede observar en la Tabla 2.2. El metabolito más importante es el B-1 ya que es el hepatocancerígeno más potente conocido, con una DL50 (dosis letal que mata a la mitad de la población) en hamsters de 10,2 mg/kg. La importancia en el estudio de las aflatoxinas radica en que su presencia en alimentos ingeridos por animales es dañino tanto para éstos como para los productos obtenidos como carne, leche y huevos. Para la ingesta en humanos se conoce que de los metabolitos producidos por A. flavus, el B-1 es el más abundante por ser carcinogénico, teratogénico y mutagénico por lo que se establecen regulaciones para éste. Tabla 2.2 Toxicidad de los metabolitos producidos por Aspergillus flavus. METABOLITO TOXICIDAD RELATIVA B-1 1 G-1 ½ B-2 ¼ G-2 ¼ FUENTE: González, 1995. Los derivados de aflatoxinas más comúnmente asociados con A. flavus y A. parasiticus son la B-1 y B-2 que presentan fluorescencia azul bajo luz ultravioleta de 365 nm de longitud de onda; la G-1 y G-2 que presentan fluorescencia verde a la misma longitud de onda. aflatoxinas M-1 y M-2 son productos metabólicos de mohos y animales, al metabolizar o consumir alimento contaminado con aflatoxinas; fueron descubiertos inicialmente en leche de vaca pero se han encontrado en orina de animales y del hombre, y en el hígado de ratas alimentadas con aflatoxinas (Miller y col., 1994). 15 Según González (1995) el maíz procedente de áreas con estrés de sequía contiene 1,4 veces más aflatoxinas que el maíz producido en áreas que no poseen esta problemática. La sequía es considerada uno de los mayores factores que predispone a ciertos cultivos a la infección por mohos productores de micotoxinas. Cuando la sequía se presenta en la última fase de crecimiento, los factores que favorecen la infestación son ideales debido a que la temperatura es elevada, la humedad relativa alrededor del grano es alta y la humedad del grano es lo bastante baja como para favorecer dicha condición. En tal se indica que los niveles altos de aflatoxinas generalmente están relacionados al estrés causado por elevadas temperaturas, lluvia escasa, baja capacidad de retención de humedad de los suelos arenosos e infestación. Según Scussel y col. (2002) los mohos, inclusive los toxigénicos, pueden crecer en el campo y durante la cosecha y almacenamiento debido a varios factores, que favorecen la presencia de ellos y también de sus micotoxinas, que son físicos, químicos y biológicos. Éstos están relacionados a las condiciones del grano y al ambiente en el que se encuentra, siendo los principales: el contenido de humedad, humedad relativa, temperatura, tipo de moho y competencia microbiana; también en el período de almacenamiento influyen las impurezas, luz, infestación, daño mecánico por las cosechadoras, microclimas, fungicidas y composición del sustrato. En cuanto a la humedad los mohos de campo atacan el producto con valores de 22% y los del almacenamiento con 15% aproximadamente; A. flavus es clasificado dentro de este grupo y es mesófilo. La humedad relativa para el desarrollo de A. flavus es a partir de 70%, siendo la óptima 80-85%, y las condiciones que favorecen dichas humedades son: los climas lluviosos, cosecha de granos con alta humedad y almacenamiento con poca ventilación, granos secos almacenados con poca ventilación en clima lluvioso y si se presenta alto porcentaje de granos partidos y el ataque de plagas. Si existen diferencias de temperatura en la masa de granos, puede presentarse transferencia de humedad favoreciendo la proliferación fúngica (Martín, 2004). 16 2.4 CUANTIFICACIÓN DE MICOTOXINAS Ellis y col. (1999) dividen los métodos para la determinación de aflatoxinas en dos grupos: los fisicoquímicos y los biológicos. En cualquier método que se emplee, el proceso analítico es el mismo, donde se encuentran involucrados el muestreo, preparación de la muestra, extracción, purificación-limpieza, desarrollo-separación y cuantificación- confirmación. Los fisicoquímicos: métodos cromatográficos (cromatografía en capa fina, líquida de alta resolución y de gases), métodos instrumentales (fluorometría, espectrofotometría) y métodos rápidos (fluorescencia amarilla-verdosa y detección por minicolumnas); y los biológicos: bioensayos (cultivo de células y tejidos, animales microorganismos), Inmunoensayos (Radioinmunoensayo, columnas de inmunoafinidad y ELISA). La cromatografía comprende un grupo de métodos de separación variados e importantes que permiten al científico separar, identificar y determinar compuestos afines en mezclas complejas que no podrían separarse de otra manera. Resulta difícil definir rigurosamente el término cromatografía debido a la variedad de sistemas y técnicas a los que se ha aplicado; en cualquier caso, todos estos métodos utilizan una fase estacionaria y una fase móvil. Los componentes de una mezcla son arrastrados a través de una fase estacionaria mediante el flujo de una fase móvil; las separaciones se basan en las diferencias de las velocidades de migración de los componentes de la mezcla. Una clasificación básica de los métodos cromatográficos es la que se basa en la fase móvil, según sea un líquido (cromatografía líquida) o un gas (cromatografía de gases) (Skoog y col., 2005). La separación de los componentes de la muestra (llamados solutos o analitos) entre sí se basa en las presiones de vapor relativas y su afinidad por la fase estacionaria; este tipo de proceso cromatográfico es llamado Elusión. La definición oficial de la Unión Internacional de Química Pura y Aplicada (IUPAC) es: “cromatografía es un método físico de separación en el cual los componentes a ser separados son distribuidos en dos fases, una de las cuales es estacionaria mientras que la otra se mueve en una dirección definida” (McNair y col., 1998). 17 Si se complementa el cromatógrafo colocando un detector al final de la columna, el cual responda a las concentraciones de soluto y su señal en función del tiempo, se obtiene un registro con ciertos picos simétricos denominado cromatograma. Éste es útil tanto para el análisis cualitativo como el cuantitativo, ya que la posición de los picos en el eje del tiempo puede servir para identificar los componentes de la muestra, mientras que las áreas de los picos proporcionan una medida cuantitativa de la cantidad de cada una de las especies (Skoog y col., 2005). La cromatografía líquida de alta resolución (HPLC) se ha convertido en una herramienta analítica indispensable por ser el tipo de cromatografía de elución más versátil y ampliamente utilizado. Básicamente se emplea para separar y determinar especies de diversos materiales orgánicos, inorgánicos y biológicos. En cromatografía líquida la fase móvil es un disolvente líquido que contiene la muestra como mezcla de solutos (Fennema, 1998). 2.5 ANTECEDENTES Raybaudi y col. (2000) realizaron una investigación con la finalidad de determinar la incidencia de mohos en granos de maíz, así como también caracterizar la micobiota presente y comparar la eficacia de diferentes medios de cultivo para la determinación de mohos toxigénicos en 50 muestras de maíz de la cosecha 1995-1996. La micobiota detectada estuvo constituida por 25 cepas diferentes en donde se incluyen Aspergillus flavus, otras 7 especies de Aspergillus y Fusarium verticillioides, entre otros. El porcentaje más alto de cepas identificadas fue para el Aspergillus flavus con 37,77%, y detectaron la presencia de mohos de campo y de almacenamiento; en tanto se deja en evidencia un gran número de cepas de mohos toxigénicos de gran importancia ya que sus toxinas causan daños a la salud de animales y humanos. La presencia de los mohos toxigénicos, tanto de campo como de almacenamiento, sugiere la necesidad de profundizar en el conocimiento de las toxinas que producen debido a la 18 influencia sobre la inocuidad del cereal al ser empleado como materia prima y la necesidad de establecer las causas que promueven su presencia a fin de ejercer controles más estrictos sobre el cultivo y conservación del maíz en Venezuela. En el año 2004 Mazzani y col. publicaron una investigación sobre la incidencia de Aspergillus flavus asociado a Epitragus sp. (Coleóptera: Tenebrionidae) en maíz bajo riego en Turén, estado Portuguesa, Venezuela. Describen que en la época seca del año 2001 realizaron el muestreo durante la cosecha de híbridos de maíz blanco para su estudio micotoxicológico, en donde la siembra había sido producida bajo riego por aspersión en parcelas semicomerciales en Turén. En esa ocasión observaron una inusualmente alta población de insectos dentro de las mazorcas, que posteriormente fue identificada como Epitragus sp., diferente a las plagas comunes de maíz en ese estado de desarrollo de los granos El insecto identificado en el estudio se asocia comúnmente con materiales vegetales en descomposición como madera y otros desechos de plantas podridos; durante la investigación sembraron insectos previamente desinfectados en placas preparadas con malta sal agar para la detección, aislamiento y cuantificación de A. flavus. De esta manera determinaron que la especie de moho predominante aislada de colonias esporulantes originadas a partir del cuerpo de los insectos fue Aspergillus flavus Link ex Fries; así mismo en el 97% de los insectos se observó la formación de las colonias de A. flavus en el medio de cultivo. En tal sentido concluyen que el alto porcentaje de insectos contaminados hace presumir su participación como vector en la epidemiología de A. flavus, es decir que parece tener buen potencial en la dispersión del moho de una mazorca a otra durante el secado de los granos en la planta los días previos a la cosecha, lo cual podría generar que una mayor cantidad de granos colonizados por el moho vaya a los silos y por consiguiente mayor sea la cantidad de inóculo durante el periodo de almacenamiento. Para el mismo año 2004, Mazzani y col. publican una investigación que se llevó a cabo con el objetivo de identificar y cuantificar la micobiota predominante en granos de maíz cosechados en siete estados de Venezuela, obtener diferentes aislamientos de A. flavus, evaluar su capacidad in vitro para producir aflatoxinas y determinar la concentración de 19 inóculo del moho y el contenido de humedad de los granos óptimos para la síntesis de estas toxinas en maíz. Las muestras empleadas en el estudio corresponden a los estados Anzoátegui, Aragua, Barinas, Cojedes, Guárico, Portuguesa y Yaracuy. La mayoría de mohos identificados fueron especies referibles al género Aspergillus, sin embargo la especie más frecuente y de mayor incidencia fue Fusarium verticillioides seguida en orden de importancia por A. flavus. Reportaron que la frecuencia de A. flavus fue alta en todos los estados y su incidencia promedio fue moderadamente baja aún cuando se encontraron muestras hasta con 83% en Portuguesa y 71% en la muestra correspondiente a Barinas; y las mayores incidencias promedio por estado se hallaron en Portuguesa y Yaracuy, confirmando que la especie mencionada ha demostrado ser endémica en el cultivo de maíz de dichos estados en los que consistentemente se han presentado incidencias desde intermedias hasta altas, mientras que ha sido común la baja incidencia en las muestras provenientes del estado Guárico. En cuanto a la producción de aflatoxinas en maíz indican que el promedio varió desde 0,47 hasta 1113,3 ng/g en los tratamientos de 14% y 24% de humedad respectivamente; en los tratamientos con 14% de humedad el contenido de aflatoxinas fue <1 ng/g, independientemente de la concentración de inóculo, así como bajos contenidos de aflatoxinas <2,52 ng/g fueron detectados en los tratamientos con 18% de humedad. Raybaudi y col. (2005) llevaron a cabo una investigación para evaluar la posible correlación entre las concentraciones de hierro, cobre y zinc en muestras de suelo y de granos, y la incidencia de Aspergillus flavus, Fusarium verticillioides, aflatoxinas y fumonisinas en maíz de tres localidades de Venezuela. El transporte y las condiciones de almacenamiento del grano incrementan la incidencia de mohos y sus toxinas. Indican que las aflatoxinas son producidas principalmente por Aspergillus flavus y Aspergillus parasiticus siendo los metabolitos de mayor interés B1, B2, G1, G2 y M1. Los factores ambientales juegan un papel importante en la contaminación de granos con micotoxinas tales como la temperatura, actividad de agua, pH, tipo de sustrato, concentración de gases y competencia microbiana y mencionan que diversos estudios han demostrado que existe relación entre los niveles de ciertos metales en el suelo y en los granos de cereales y la concentración de micotoxinas. 20 Entre otros hallazgos, básicamente obtuvieron correlación positiva y significativa entre los contenidos de hierro y cobre en el suelo, tanto en la siembra como en cosecha, con el contenido de aflatoxinas en los granos cosechados en Turén; correlación positiva y significativa entre los contenidos de hierro y aflatoxinas en los granos de maíz cosechados en Sabana de Parra; e indican la falta de correlación entre el contenido de zinc en el suelo y en los granos con el contenido de aflatoxinas a pesar de que otros autores indican que han obtenido correlación entre la presencia de aflatoxina B1 y el contenido de zinc en los granos de maíz mas no con el contenido del mineral en el suelo. Mazzani y col. (2000) evaluaron veinte híbridos experimentales y comerciales de maíz blanco y amarillo fueron evaluados en el estado Guárico, por incidencia natural de F. verticillioides, fumonisinas y de A. flavus. La incidencia de F. verticillioides fue detectado en las 60 muestras analizadas, con diferencias significativas entre híbridos, la incidencia de A. flavus fue baja. La incidencia de fumonisinas presentó valores intermedios a altos. Mazzani y col. (2004) realizaron una investigación sobre la micobiota asociada a granos de maíz en Venezuela. Utilizaron 46 muestras de las cuales las especies más frecuentes y con mayor incidencia fueron Aspergillus flavus, A. tamarii, Fusarium verticillioides, Eurotium chevalierii y Penicillium citrinum con 11,28; 8,57; 20,87; 10,26 y 10,17% respectivamente. A. flavus ha mostrado ser endémica en el cultivo de maíz en los estados Yaracuy y Portuguesa debido a que se han determinado consistentemente desde intermedias hasta altas incidencias al igual que ha sido común su baja incidencia en muestras provenientes del estado Guárico con 2,75% de granos colonizado. Mazzani y col. (2006) desarrollaron una metodología in vitro para evaluar la susceptibilidad de cultivares de maíz a la contaminación de sus granos con aflatoxinas, para ser cuantificadas directamente por un método inmunoquímico, como alternativa accesible a cualquier laboratorio. El estudio empleó 5 híbridos diferentes y se obtuvieron resultados satisfactorios en razón de haberse detectado in vitro marcadas diferencias entre cultivares en su respuesta a la acumulación de aflatoxinas, aun cuando el contenido de estas micotoxinas fue elevado para todos los genotipos y excedió la tolerancia sugerida en maíz. 21 Luzón y col. (2007) efectuaron una investigación sobre los principales mohos y micotoxinas asociados a granos de maíz en campos de los estados Guárico, Portuguesa y Yaracuy, Venezuela, para determinar la incidencia natural de A. flavus, de aflatoxinas, de F. verticillioides y de fumonisinas en muestras de granos de un considerable número de genotipos de maíz blanco, de los estados mencionados, y sometidas a un rápido acondicionamiento para evitar cualquier alteración de calidad micotoxicológica causada por factores favorables al desarrollo de mohos y a la síntesis de micotoxinas durante la postcosecha temprana. Determinaron que las especies fúngicas predominantes fueron A. flavus y F. verticillioides, las cuales son las principales especies que afectan al maíz desde el campo en las zonas productoras más importantes; y la baja contaminación con aflatoxinas encontrada en la mayoría de los híbridos, a pesar de la alta incidencia del moho, se debe a que se efectuó el traslado inmediato de las muestras para el secado y acondicionamiento, reflejando la situación real del campo. La síntesis de aflatoxinas se acelera con el manejo ineficiente durante la postcosecha temprana antes del acondicionamiento, periodo en el cual la humedad de los granos se torna favorable para la síntesis de la toxina. En el año 2009 Chavarri y col. Evaluaron la influencia del riego y del genotipo sobre la incidencia natural de A. flavus, aflatoxinas, F. verticillioides y fumonisinas, en un grupo de cultivares de maíz blanco, en cuatro localidades de Venezuela. Para ello emplearon muestras de Yaracuy y Portuguesa, recolectadas en la época seca del año 2005, y muestras de Yaracuy del ciclo 2006-2007. Reportaron que las especies de A. flavus y F. verticillioides fueron las de mayor frecuencia e incidencia en las muestras de granos de maíz en todas las localidades bajo estudio. En los análisis de varianza se corroboró un marcado efecto ambiental en el comportamiento de los genotipos; siendo la incidencia de las dos especies mencionadas y la contaminación con aflatoxinas significativamente mayor en Portuguesa. Además de la suplencia de agua, existen otros factores involucrados en la colonización de los granos y como consecuencia en la contaminación con aflatoxinas; la temperatura, la disponibilidad de algunos metales en el suelo, la capacidad toxigénica de los mohos y la incidencia de plagas son algunos de ellos. 22 CAPÍTULO III MARCO METODOLÓGICO En este capítulo se delimita el tipo de trabajo científico y de investigación en que se basó el estudio, y se presentan las actividades llevadas a cabo mediante el desarrollo sistemático de la investigación con lo cual se logra cumplir los objetivos planteados. 3.1 TIPO DE INVESTIGACIÓN El tipo de trabajo científico empleado en la investigación fue de campo, ya que la recolección de datos del hecho o evento se efectuó tal y como ocurre en la realidad. Es decir, que se efectuó la observación y análisis de la situación tal y como ocurre para el momento del estudio, por lo cual las fuentes de información se consideran de tipo primaria. El tipo de investigación, según el nivel de profundidad del estudio, es explicativa ya que en ella se establecen las causas y relaciones entre distintos eventos, sucesos o fenómenos que se estudian. Se busca explicar la relación entre el contenido de aflatoxinas totales y aflatoxinas B1 para comparar con la regulación nacional e internacional. Por lo antes expuesto la investigación se considera de campo-explicativa, ya que los datos son obtenidos de fuentes primarias y luego de efectuar el análisis de éstos se establecerán las relaciones internas entre el contenido de aflatoxina B1 y aflatoxinas totales, así como la influencia de otras variables obtenidas en la recepción de la materia prima a fin de obtener un conocimiento más profundo de la situación y de esta forma establecer las condiciones post-cosecha a controlar para asegurar el cumplimiento de la normativa nacional. La investigación se apoyó en la realización de entrevistas a personal del centro de recepción de la materia prima, así como a productores de donde provienen las muestras del 23 estudio con el objeto de conocer las condiciones empleadas en el manejo y conservación de cereales, y de la misma manera se apoya en la consulta bibliográfica especializada presentada en el capítulo anterior. Para el desarrollo sistemático de la investigación se emplean las siguientes etapas: Evaluación de las condiciones de manejo post-cosecha de maíz blanco. Evaluación del comportamiento de la presencia de aflatoxinas en maíz blanco. Determinación del contenido de aflatoxina B1 y aflatoxinas totales, en maíz blanco de cosecha. Correlación del contenido de aflatoxina B1 con el contenido de aflatoxina total y la calidad del grano. Recomendaciones post-cosecha para minimizar la incidencia de aflatoxinas totales en maíz blanco nacional. 3.2 UNIVERSO, POBLACIÓN Y MUESTRA Del total de maíz blanco nacional de las cosechas 2009-2010 y 2010-2011, entregado en un centro de recepción del Estado Aragua, se seleccionaron 135 muestras provenientes de diferentes estados mediante la aplicación de un muestreo estratificado de afijación proporcional. De los vehículos que transportaban el producto a granel, las muestras se extrajeron de la profundidad total del producto mediante el uso de un toma muestra cilíndrico que se inserta verticalmente y distanciados unos 50 cm de las paredes del camión; para vehículos de hasta 15 ton se toman 5 puntos y para camiones de 15 a 50 ton se seleccionan 8 puntos como mínimo en ambos casos, tal como lo indica la norma Covenin 612-82, hasta completar 5 kg; y los análisis estadísticos se llevan a cabo con el software de análisis estadístico SAS, módulo SAS/STAT. 24 3.3 EVALUACIÓN DE LAS CONDICIONES DE MANEJO POST-COSECHA DE MAÍZ BLANCO A objeto de estudio se seleccionó un centro de recepción de maíz de cosecha en el Estado Aragua y con base en el porcentaje de participación por estado, mostrado en la Tabla 3.1, se realizó el muestreo proporcional al estado. Tabla 3.1 Porcentaje de participación por estado, en la recepción de materia prima. ESTADO DE PARTICIPACIÓN PROCEDENCIA (%) Guárico 89,6 Cojedes 4,6 Carabobo 3,3 Anzoátegui 1,6 Aragua 0,9 TOTAL RECIBIDO 100 FUENTE: Propia. Del total recibido se analizaron 135 muestras, compuestas y recolectadas cumpliendo la Norma Covenin 612-82 Cereales-Leguminosas-Oleaginosas y Productos Derivados Muestreo, distribuidas de la siguiente manera: 125 muestras de Guárico, 4 muestras de Cojedes, 3 muestras de Carabobo, 2 muestras de Anzoátegui y 1 muestra de Aragua. Se efectuaron entrevistas para conocer las características de siembra y manejo postcosecha para determinar el grado de tecnificación por zona y establecer grupos homogéneos para el análisis de datos y comparación de resultados (Tabla 3.2). Adicionalmente se analizaron las condiciones ambientales y pluviométricas del Estado Guárico por poseer el mayor aporte de materia prima en el centro mencionado, el tiempo transcurrido desde la recepción en el centro hasta el acondicionamiento y las características de calidad de la materia prima establecidas en la Norma Covenin 1935-87 Maíz para uso industrial (1ra Revisión), a fin de establecer mediante un análisis de varianza si existen diferencias estadísticamente significativas que pudieran influir en la incidencia de la toxina. 25 Tabla 3.2 Criterios de agrupación, por municipio, para grupos homogéneos. GRUPO MUNICIPIOS 1 CRITERIOS DE AGRUPACIÓN Alta tecnificación: maquinaria de tecnología avanzada (neumáticas y de alta precisión). La siembra la realizan a una separación entre hileras de 75 a 80 cm y de 5 a 6 semillas por metro lineal a una profundidad de 2 a 3 cm. Área sembrada: 600ha promedio. Sistema de siembra convencional: preparación del terreno (1 o 2 pases de big rome), luego un pase de rastra, aplicación de cal agrícola de forma mecanizada, 2 pases de rastra más. Semillas: híbridas importadas (diferentes trasnacionales) Pioneer, Dekalb y Cristiani Burkald. Preparación de la Semilla: previo a la siembra envenenamiento de la Mellado, semillas con un insecticida que permite protegerlas hasta después de Roscio, germinada. Miranda, Ortiz, Fumigación: 15 días posteriores a la germinación de las semillas para Girardot y controlar las malezas. Libertador Abono: urea y abonos foliares a los 25 días posteriores a la germinación o una semana después de la fumigación, si las lluvias lo permiten o si hay humedad en el suelo. Cosecha: mecanizada totalmente, sin embargo, se realiza un repase o cosecha manual en aquellos potreros donde todavía queda producto en el suelo, ya sea por caída natural de las plantas o tumbado por las brisas o las cosechadoras. Transporte: gandolas o vehículos más pequeños contratados o propiedad de los mismos agricultores. Recepción: El 90% de la cosecha de esta zona es recibida en el centro seleccionado. 2 Monagas, Chaguaramas, Las Mercedes, Infante, El Socorro Tecnificación media: sembradoras muy precisas que poseen discos o cinceles en la parte anterior de la misma para romper el suelo en el momento de la siembra. Área sembrada: 300ha aproximadamente. Siembra convencional: 1 pase de rastra pesada y 3 pases de rastra. Siembra directa con un pase de rotativa, a una altura de 15-20 cm, luego se fumiga con herbicida para eliminar el follaje presente en el área. La siembra se realiza con abono incorporado y las demás actividades de manejo agronómico son iguales para los productores de las dos zonas. Ribas, Zaraza, Cajigal, Mc Gregor Baja tecnificación: tecnología o manejos agronómicos similar a los productores de la zona II, un porcentaje mecanizada y otro porcentaje de forma manual (recolección a mano por lo irregular de los terrenos, formación de arrumas o pilas de mazorcas y utilizan desgranadoras acopladas al tractor). Área sembrada: 200ha aproximadamente. Transporte: a través de intermediarios. Cosecha: manual y más tardía debido a que las lluvias comienzan al final de la temporada. Recepción: este maíz es recibido hacia el final de la temporada de cosecha. 3 26 3.4 EVALUACIÓN DEL COMPORTAMIENTO DE LA PRESENCIA DE AFLATOXINAS EN MAÍZ BLANCO Para el centro de recepción seleccionado se efectuó la recolección de información sobre la detección y cuantificación de aflatoxinas totales para los 3 últimos años, con lo que se genera un gráfico de dispersión y un análisis descriptivo del comportamiento. Se realizó la revisión de los métodos de cuantificación empleados y el comportamiento de la presencia de la toxina y su relación con las condiciones del manejo post-cosecha determinadas en el objetivo anterior. 3.5 DETERMINACIÓN DEL CONTENIDO DE AFLATOXINA B1 Y AFLATOXINAS TOTALES, EN MAÍZ BLANCO DE COSECHA A las 135 muestras recolectadas se les realizó la tipificación de calidad completa establecida en la Norma Covenin 1935-87 Maíz para uso industrial y se determinó el contenido de aflatoxinas empleando el método oficial por cromatografía líquida con detección por fluorescencia (HPLC-fluorescencia) del ICONTEC (NTC 1232). El límite de cuantificación para AFB1 y AFG1 es de 0,5 ng/g mientras que para AFG2 y AFB2 es de 0,375 ng/g. El análisis de datos comprende la estadística descriptiva de los resultados obtenidos y mediante el software de análisis estadístico SAS, módulo SAS/STAT se lleva a cabo el procedimiento denominado FREQ entre las distintas variables, a fin de comparar mediante el test exacto de Fisher si están asociadas o son independientes 3.5.1 Metodología para determinación de aflatoxinas por HPLC Preparación de soluciones y reactivos Acetonitrilo: agua 84:16: Preparar el volumen total de la solución considerando que cada muestra requiere 50ml de esta solución, y que cada muestra debe realizarse por triplicado. 27 para preparar 1 litro de solución, mezclar 840 ml de acetonitrilo y 160 ml de agua bidestilada. Transferir a una botella de vidrio debidamente identificada para su almacenamiento. Reactivo de derivatización: solución ácido trifluoroacético:ácido acético:agua 2:1:7, para preparar 10 ml de solución mezclar 2 ml de ácido trifluoroacético, 1 ml de ácido acético glacial y 7 ml de agua bidestilada. Transferir a un vial ámbar debidamente identificado para su almacenamiento. Fase móvil para HPLC: para preparar 1 litro, mezclar 750 ml de agua bidestilada filtrada por 0,22 micras y 250 ml de metanol grado HPLC. Desgasificar en el baño ultrasónico y conectar al cromatógrafo. Transferir a una botella de vidrio debidamente identificada para su almacenamiento. Preparación del patrón de aflatoxinas de concentración 25 ng/ml en B1 y G1 y 7,5 ng/ml en B2 y G2: para la preparación de este patrón se parte del estándar con las cuatro aflatoxinas (250 ng/ml en B1 y G1 y 75 ng/ml en B2 y G2, MICOTOX LTDA). Se toma una alícuota de 100 µl de la solución patrón y se afora hasta 1 ml con acetonitrilo. Transferir la solución a un vial de vidrio color ámbar debidamente identificado para su almacenamiento. Estándares de aflatoxinas 0,375ng/ml – 12,5 ng/ml: se toman alícuotas de la solución patrón descrita anteriormente y se completa el volumen hasta 300µl con acetonitrilo, según la tabla siguiente: Tabla 3.3 Volumen de la solución patrón necesario para la preparación de los estándares. Concentración Concentración Volumen de aflatoxinas B1 y aflatoxinas B2 y la solución G1 (ng/ml) G2 (ng/ml) patrón (µl) 1:2 12,5 3,75 150 1:5 5,0 1,5 60 1:10 2,5 0,75 30 1:20 1,25 0,375 30a a En el caso de la dilución 1:20 se toma una alícuota de la dilución 1:2. Dilución Especificaciones del sistema cromatográfico Columna: XTerra RP18, 5µm (3,9 mm x 150 mm), Waters 186000480. Fase móvil: 75:25 Agua:Metanol. Flujo: 1 ml/min, isocrático. Temperatura Columna: 40°C Volumen de inyección: 10 L Tiempo de corrida: 16 min muestras y estándares. Condiciones de la detección: Fluorescencia λex 380 nm, λem 450 nm. Volumen de acetonitrilo (µl) 150 240 270 270 28 Parámetros del detector de fluorescencia (Tabla 3.4). Programa de la distribución de solventes utilizado en HPLC (Tabla 3.5). Tabla 3.4 Parámetros del detector de fluorescencia. Parámetro λ ex (longitud de onda de excitación) λ em (longitud de onda de emisión) Ancho de banda (bandwidth) Respuesta de filtro (filter response) Tiempo de apagado de la lámpara Rata de muestreo (sampling rate) Offset Ganancia (gain) Atenuación Auto zero Polaridad Valor 380 nm 450 nm 18nm fast 30min 1 0 mV 100 64 auto + Tabla 3.5 Programa de la distribución de solventes utilizado en HPLC. Tiempo (min) 1 30 45 55 70 100 103 Flujo (ml/min) 1 1 1 1 1 1 0 %Agua %Metanol %Acetonitrilo 25 25 100 100 0 0 0 75 75 0 0 0 0 0 0 0 0 0 100 100 100 Eventos Lamp=off Temp=off Extracción de las aflatoxinas 1. Moler la muestra en molino IKA hasta obtener una harina fina. 2. Pesar 25 g de la muestra previamente molida en un erlenmayer de 250 ml, realizar este procedimiento por triplicado. 3. Agregar a cada erlenmeyer 50 ml de la solución Acetonitrilo:Agua (84:16). 4. Agitar vigorosamente durante una hora usando el agitador orbital. 5. Preparar un recipiente plástico con 5-6 litros de hipoclorito de sodio al 5%. 29 6. Filtrar toda la muestra en un vial de 100ml, utilizando un embudo de vidrio y un papel de filtro whatman N°40. 7. Descartar todos los materiales utilizados en la extracción en el recipiente con la solución de hipoclorito de sodio al 5%. Limpieza de la solución filtrada 8. Cada cartucho MICOTOX M2002 contiene un tubo de ensayo y el cartucho con el medio para la extracción en fase sólida, después del proceso de extracción de la muestra, colocar 8 ml del extracto en el tubo de ensayo provisto. 9. Introducir lentamente el cartucho en el tubo de ensayo con el extracto, presionar lentamente para que la solución fluya a través del cartucho hasta obtener aproximadamente 0,5 ml de solución purificada en el interior del cartucho. 10. En el caso de que las muestras presenten una cantidad mayor de pigmentos o impurezas (como es el caso de maíz amarillo) utilizar cartuchos M2006. Tomar en cuenta que estos cartuchos cuentan con mayor volumen, por esta razón debe colocarse un volumen mayor a 8 ml en el tubo de ensayo, para que haya suficiente extracto disponible para la extracción. Derivatización de las muestras y estándares 11. Transferir 200µl del extracto purificado obtenido en el paso anterior a un vial ámbar de 2ml. 12. Adicionar 700µL del reactivo de derivatización, tapar y agitar en vortex. 13. Calentar en un baño termostático durante 10 min a una temperatura mayor a 65°C. 14. Dejar enfriar, transferir a un vial de HPLC e inyectar en el equipo. Condiciones de inyección por HPLC 15. Inyectar todos los estándares por duplicado y las muestras (una vez). 16. Construir las curvas de calibración graficando concentración del estándar en el eje “x” y área en el eje “y”. 17. La calibración puede hacerse cada seis meses, siempre que se esté utilizando la misma columna y no se hayan cambiado las lámparas de los detectores. 30 18. La calibración debe hacerse con estándares que no hayan sobrepasado la fecha de vencimiento establecida por el proveedor. El cálculo de la concentración de toxina de las muestras se efectuó mediante la integración de los picos del cromatograma, mediante el uso de las curvas de calibración. En la Tabla 3.6 se presentan las los datos de las curvas de correlación con el área bajo la curva y el coeficiente de correlación, y en la Figura 3.1 se presenta el cromatograma de la inyección de los estándares de mayor concentración para los 4 metabolitos (B1, B2, G1, G2) en el HPLC. Tabla 3.6 Datos de las curvas de correlación para el cálculo de concentración de toxina. B1 B2 G1 G2 6,6 13,445 4,668 7,955 Ecuación de la curva R2 y = 1,52x105 x – 5,36x103 y = 1,63x105 x – 3,57x104 y = 9,60x104 x – 7,30x104 y = 1,50x105 x – 2,74x104 0,999902 0,999372 0,996785 0,999363 AFB1 AFG1 6,50 AFG1 - 4,808 6,00 5,50 4,50 AFG2 4,00 AFG2 - 8,572 5,00 AFB1 - 7,170 Tiempo de retención (min) Metabolito 3,00 AFB2 AFB2 - 13,498 EU 3,50 2,50 2,00 1,50 1,00 0,50 0,00 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 Minutes 9,00 10,00 11,00 12,00 13,00 14,00 15,00 16,00 Figura 3.1 Cromatograma de estándares a la mayor concentración. Para conocer la recuperación del método empleado se efectuó la inyección de cantidades conocidas de analitos, por triplicado. En la Tabla 3.7 se presentan los resultados de la recuperación de dos muestras de cantidad conocida de aflatoxinas totales (AFT), que se 31 inyectaron dos veces cada una por triplicado y se procedió a efectuar el cálculo mediante las curvas de calibración realizadas, hasta obtener que el porcentaje de recuperación promedio del método fue de (83 ± 8) %. El valor obtenido de la recuperación del método es aceptado según lo reportado por Huber (1998), ya que para las concentraciones empleadas se esperaban valores entre 80% y 110%; por lo cual se aceptan los valores determinados en las muestras como el contenido real de aflatoxinas. Tabla 3.7 Ensayo de recuperación para metabolitos B1 y B2 a dos concentraciones de AFT Contenido B1 B2 AFT Promedio Promedio 3,2 2,8 ± 0,9 19,5 14,0 ± 1,0 n.d.: No detectado 3.6 CORRELACIÓN DEL n.d. 1,4 ± 0,1 Contenido Recuperación Recuperación calculado promedio (%) B1 + B2 (%) 2,8 88,6 83 ± 8 15,4 77,3 CONTENIDO DE AFLATOXINA B1 CON EL CONTENIDO DE AFLATOXINA TOTAL Y LA CALIDAD DEL GRANO La cuantificación de aflatoxina B1 se emplea para diagnosticar el comportamiento, ya que ésta es la única toxina contemplada en la Norma COVENIN 1935-87 y adicionalmente se desea validar si existe una correlación entre el contenido de aflatoxina B1 con el contenido de aflatoxinas totales para evaluar la necesidad de establecer nuevos lineamientos de recepción para asegurar el cumplimiento de las normas en cuanto al contenido de toxina en el maíz. Adicionalmente se realizaron comparaciones de los resultados basados en el muestreo realizado, a fin de establecer si el contenido de aflatoxinas totales y aflatoxina B1 se atribuye a condiciones específicas de manejo o si se debe a la condición general del producto. Con base en el muestreo realizado, siendo aleatorio y proporcional al aporte por estado, y en resultados obtenidos se efectúa una correlación de Pearson sólo si los resultados obtenidos cumplen con las condiciones que establece el análisis, y de no ser así se plantea un 32 análisis de correlación vía no paramétrica. Adicionalmente se establecen regresiones simples, entre las variables de interés para conocer la magnitud de la asociación en caso de existir 3.7 RECOMENDACIONES POST-COSECHA PARA MINIMIZAR LA INCIDENCIA DE AFLATOXINAS TOTALES EN MAÍZ BLANCO NACIONAL En función al análisis de los datos obtenidos se procedió a realizar un análisis causaefecto para establecer la incidencia de cada variable sobre el defecto. Se estableció un diagnóstico de la situación actual sobre el comportamiento de aflatoxinas B1 (contempladas en la norma COVENIN 1935-87) para aportar los lineamientos y recomendaciones sobre el control de las micotoxinas necesarios para asegurar la inocuidad de dicha materia prima en las próximas temporadas de cosecha. 33 CAPÍTULO IV RESULTADOS Y ANÁLISIS En esta sección se presentan los resultados obtenidos durante la fase experimental del estudio y los análisis efectuados con su respectiva discusión. 4.1 EVALUACIÓN DE LAS CONDICIONES DE MANEJO POSTCOSECHA DE MAÍZ BLANCO Aún cuando el objetivo planteado sólo contemplaba 3 años, fue posible obtener 6 años de data, por lo que se proceden a incluir en el análisis. A través del servicio de meteorología de la FAV, sistema clicom, se obtuvo el resumen climatológico de los años 2005, 2006, 2007, 2008, 2009 y 2010 correspondientes al estado Guárico debido a que éste posee el 90% de participación en las muestras analizadas. Dichos datos están basados en promedios mensuales de la estación meteorológica Valle de La Pascua Cnel. Pedro José Timaure, válido para los municipios Infante, Ribas, Las Mercedes, Chaguaramas, El Socorro y Santa María, que debido a su ubicación serán empleados para la totalidad del estado según lo que se muestra en la Figura 4.1. En las Tablas 4.1 a 4.3 se presentan las temperaturas promedio, humedades y precipitaciones para los años mencionados; y en las Figuras 4.2 a 4.4 se presentan los datos graficados. En cuanto al comportamiento de la temperatura ambiental (Figura 4.2) no se evidencian mayores cambios entre los 6 años en estudio; se puede apreciar que todos los datos se encuentran entre 25 °C y 31 °C y la diferencia entre los promedios anuales no supera 1 °C. Para los meses de mayo a diciembre del año 2009 se evidencian temperaturas consistentemente mayores a los otros años, así como para los meses de enero a marzo del 2010 con un máximo en marzo, todas óptimas para el desarrollo de mohos según Scussel y col. (2002). 34 Figura 4.1 Mapa político del Estado Guárico. FUENTE: http://www.a-venezuela.com/mapas/map/html/estados/guarico.html. Tabla 4.1 Temperatura ambiental promedio ( °C) del Estado Guárico. MES ENERO FEBRERO MARZO ABRIL MAYO JUNIO JULIO AGOSTO SEPTIEMBRE OCTUBRE NOVIEMBRE DICIEMBRE PROMEDIO AÑO 2005 2006 2007 2008 26,7 26,2 26,8 25,7 27,4 26,5 26,9 26,3 28,9 28,0 27,8 26,9 29,3 29,1 28,7 27,9 28,0 27,1 28,4 27,3 26,4 26,2 26,0 26,0 25,8 25,6 25,7 25,2 26,2 25,9 25,5 25,9 26,8 26,2 25,8 26,3 27,2 25,8 25,9 26,4 26,4 27,0 26,0 26,6 25,9 26,6 25,4 26,0 27,1 26,7 26,6 26,4 FUENTE: Servicio de meteorología de la FAV. 2009 26,3 26,5 27,0 28,6 29,1 27,7 26,7 26,2 27,4 27,5 28,5 27,4 27,4 2010 27,1 28,9 30,2 28,9 28,0 26,5 26,0 26,2 26,3 27,1 26,3 25,8 27,3 35 Figura 4.2 Comportamiento de Temperatura Ambiental promedio del Estado Guárico. Tabla 4.2 Humedad ambiental promedio (%) del Estado Guárico. MES ENERO FEBRERO MARZO ABRIL MAYO JUNIO JULIO AGOSTO SEPTIEMBRE OCTUBRE NOVIEMBRE DICIEMBRE PROMEDIO AÑO 2005 2006 2007 2008 75 75 68 71 72 71 64 65 67 69 62 61 70 68 63 84 81 75 68 71 88 83 85 82 89 90 83 86 88 87 87 84 88 83 85 84 84 83 85 84 85 75 82 71 77 75 79 71 80 78 76 76 FUENTE: Servicio de meteorología de la FAV. 2009 71 66 65 60 62 69 79 84 76 75 69 68 70 2010 63 59 56 67 75 85 86 84 74 80 84 84 75 36 En la Figura 4.3 se observa el comportamiento en los resultados de humedad ambiental; se aprecia que oscilan entre 54% y 90% siendo éstos valores óptimos para el desarrollo de mohos, sobre todo en los meses de Agosto a Diciembre, época de cosecha del maíz en Venezuela. Según lo reportado por Scussel y col. (2002) la humedad relativa para el desarrollo de A. flavus es a partir de 70%, siendo la óptima 80-85% Figura 4.3 Comportamiento de Humedad Ambiental promedio del Estado Guárico. Respecto a la precipitación (Figura 4.4), oscila entre 0 mm y 500 mm aproximadamente, se evidencian valores atípicos para el mes de Agosto 2007 y Noviembre 2010 lo cual puede influir en la humedad, mientras que el resto de los valores presentan tendencias similares. Según Scussel y col. (2002) los climas lluviosos favorecen la humedad ambiental y por ende el desarrollo de mohos, y el maíz procedente de áreas con estrés de sequía contiene 1,4 veces más aflatoxinas que el maíz producido en áreas que no poseen esta 37 problemática ya que la sequía es considerada uno de los mayores factores que predispone a ciertos cultivos a la infección por mohos productores de micotoxinas. Tabla 4.3 Precipitación ambiental promedio (mm) del Estado Guárico. MES ENERO FEBRERO MARZO ABRIL MAYO JUNIO JULIO AGOSTO SEPTIEMBRE OCTUBRE NOVIEMBRE DICIEMBRE PROMEDIO AÑO 2005 2006 2007 2008 6 8 2 7 0 1 1 0 0 0 116 5 21 0 17 5 196 245 139 178 212 237 217 179 120 280 145 179 185 145 509 67 93 197 159 203 48 99 97 90 87 7 95 18 9 25 55 1 81 104 129 78 FUENTE: Servicio de meteorología de la FAV. 2009 25 6 0 2 25 103 71 151 57 74 9 11 45 2010 5 0 10 75 229 238 133 165 129 43 281 51 113 El resumen del análisis estadístico para las tres variables ambientales presentadas, se muestra en la Tabla 4.4, lo cual es una aproximación debido a que la recolección de datos climatológicos no es un experimento diseñado sino la recolección de información disponible para las fechas, en donde se evidencian diferencias estadísticamente significativas en las tres variables (precipitación, humedad y temperatura) en cuanto a los 12 meses del año y respecto a los 6 años estudiados. Las diferencias entre los meses es de esperar y se debe a las variaciones por las estaciones, mientras que las variaciones respecto a los años en estudio explican que el comportamiento anual ha sido diferente entre cada periodo estudiado. En cuanto a los coeficientes de varianza, se evidencian valores menores al 30% en las variables Temperatura y Humedad, lo cual es aceptable, pero se presenta 70% para la precipitación lo cual indica el grado de variación de los valores registrados y el poco control sobre dicha variación. De hecho no se controló ninguna variable en la recolección de dichos datos ya que se tomaron tal como los presenta el sistema en condiciones ambientales normales. 38 Figura 4.4 Comportamiento de Precipitación Ambiental promedio del Estado Guárico. Tabla 4.4. Resumen de Procedimiento ANOVA para condiciones ambientales (temperatura, humedad y precipitación). EFECTO MES AÑO R2 COEF.VARIACIÓN α = 0,05 TEMPERATURA P<0,0001 P=0.0005 0,752909 2,332897 HUMEDAD P<0,0001 P=0,0001 0,795593 6,070832 PRECIPITACIÓN P<0,0001 P=0,0328 0,663728 70,19961 En la Tabla 4.5 se presenta la prueba del rango estudentizado de Tukey, observando las medias ordenadas para cada variable ambiental estudiada, y las medias que poseen la misma letra no son significativamente diferentes. Básicamente los dos últimos años (2009 y 2010) en cuanto a las tres variables, las medias no son significativamente diferentes; y en cuanto al año 2008 se tiene que la temperatura si presenta diferencias con las medias de los años 2009 y 39 2010, para la humedad presenta diferencias sólo respecto al año 2009 y en cuanto a la temperatura no presenta diferencia con los años 2009 y 2010. Tabla 4.5 Resumen de prueba de rango de Tukey para variables ambientales. TUKEY AGRUPAMIENTO MEDIA PERIODO A 27,4083 Temperatura 2009 B A 27,2750 Temperatura 2010 B A C 27,0833 Temperatura 2005 B A C 26,6833 Temperatura 2006 B C 26,5750 Temperatura 2007 C 26,3750 Temperatura 2008 A 80,333 Humedad 2005 B A 77,833 Humedad 2006 B A 76,167 Humedad 2008 B A 75,917 Humedad 2007 B C 74,750 Humedad 2010 C 70,333 Humedad 2009 A 129,33 Precipitación 2007 B A 113,25 Precipitación 2010 B A 103,67 Precipitación 2006 B A 81,42 Precipitación 2005 B A 77,67 Precipitación 2008 B 44,50 Precipitación 2009 α = 0,05 Medias con la misma letra no son significativamente diferentes Las temperaturas para los años 2009 y 2010 son las mayores del periodo estudiado, las humedades para dichos años son los menores valores y en cuanto a las precipitaciones las correspondientes al 2009 es el menor valor del periodo y las correspondientes al año 2010 duplican en valor del año anterior pero aún el análisis arrojó que las medias no son significativamente diferentes y se debe a que el coeficiente de variación es muy elevado. Marín y col. (2010) estudiaron la influencia de factores ambientales en el crecimiento y síntesis de micotoxinas de Fusarium y la perspectiva de las condiciones climáticas en España concluyendo que el aumento de la temperatura y sequía son causadas por el cambio climático previsto y en tal sentido, bajo dichas condiciones, puede aumentar el riesgo en la producción de fumonisinas especialmente debido a F. verticillioides. Dichos hallazgos pueden extrapolarse al cambio climático a nivel mundial y por tanto es posible que se aprecie en 40 Venezuela; F. verticillioides y F. proliferatum toleraron altas temperaturas y estrés hídrico a diferencia de F. graminearum, mostrando las tres especies marcadas diferencias en la biosíntesis de la toxina y en especial el metabolito FUM1 de F. verticillioides que presentó mayor incidencia debido a las condiciones estudiadas. En cuanto al tiempo transcurrido desde la recepción del maíz a granel, denominado horas de cola, se tienen los datos de las dos últimas cosechas para relacionar con las determinaciones de aflatoxinas a efectuar. Para la cosecha 2009-2010 se tienen valores desde octubre hasta enero dado que éste fue el lapso de tiempo en el que se recibió maíz de cosecha en el centro seleccionado para el estudio, mientras que para la cosecha 2010-2011 la recepción estuvo comprendida entre los meses de septiembre y enero. En la Figura 4.5 se presenta el comportamiento de las horas de cola para ambas cosechas. Figura 4.5 Comportamiento de las horas de cola en el centro de recepción seleccionado en el Estado Aragua, para las cosechas 2009-2010 y 2010-2011. 41 Se evidencia que para la cosecha 2009-2010 el promedio de horas de cola fue de 28,63 mientras que para la cosecha 2010-2011 fue de 34,29 horas lo cual puede influir en la producción de toxinas debido al plazo de espera de la materia prima para ser acondicionada, permitiendo que se formen puntos calientes en los vehículos debido a la humedad del producto, afectando la calidad del mismo y promoviendo el desarrollo de micotoxinas. Sobre las características de calidad de las muestras seleccionadas para el estudio, en la Tabla 4.6 se presentan las variables más importantes de las determinaciones efectuadas, que fueron correlacionadas con el contenido de aflatoxinas que sea determinado para conocer si se puede establecer una correlación o regresión entre dichas variables. Tabla 4.6 Variables de la tipificación efectuada a las muestras de maíz en estudio. Muestra Nro. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Cosecha Estado Municipio Humedad (%) Impurezas GDT (%) 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Mellado Mellado Mellado Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz 13,30 13,00 13,00 17,10 17,60 16,20 17,30 17,00 16,30 15,40 15,40 14,70 16,70 15,50 19,70 19,30 18,40 19,60 19,70 19,50 18,40 18,20 18,10 17,00 17,50 16,40 19,00 16,30 19,00 17,80 2,91 1,84 1,47 1,43 1,89 1,60 1,80 1,37 1,40 1,50 1,67 2,30 1,58 1,24 0,99 0,87 0,70 0,77 0,66 1,42 0,80 1,30 1,00 1,31 1,37 0,50 1,40 1,39 1,90 0,60 4,35 4,80 3,20 3,05 3,00 3,80 2,50 2,26 3,30 4,70 3,42 3,40 5,20 2,80 4,00 2,63 2,10 2,40 3,00 2,60 2,60 2,20 3,30 2,00 5,50 2,00 4,30 2,40 2,80 5,66 Granos partidos (%) 2,30 2,20 1,70 2,90 3,40 1,90 2,10 2,20 3,13 1,56 2,27 2,50 2,90 1,80 1,99 2,36 2,41 2,28 2,00 2,00 2,92 2,40 1,48 2,80 4,30 2,37 1,90 1,60 2,12 1,32 Granos cristalizados (%) 3,70 4,00 2,10 4,00 4,11 2,50 2,50 3,22 3,42 2,97 3,20 2,10 3,60 2,90 3,26 3,12 2,40 3,36 3,90 2,96 3,30 3,66 2,00 3,29 3,97 3,26 2,10 3,40 3,00 2,97 42 Tabla 4.6 Variables de la tipificación efectuada a las muestras de maíz en estudio (cont.). 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Aragua Guárico Guárico Carabobo Carabobo Carabobo Cojedes Cojedes Cojedes Cojedes Guárico Guárico Guárico Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Roscio Roscio Roscio Roscio Roscio Urdaneta Zaraza Zaraza Libertador Libertador Libertador Girardot Girardot Girardot Girardot Mellado Miranda Miranda 14,90 17,00 15,40 17,20 16,00 16,00 16,30 18,60 17,00 15,00 18,70 15,70 15,60 15,10 15,40 16,30 14,60 15,40 18,00 17,40 16,30 16,00 17,10 15,40 16,30 15,70 15,60 16,30 13,80 13,80 17,30 14,30 14,50 13,00 15,00 15,40 16,20 14,60 14,00 13,30 23,20 23,60 16,10 18,90 16,10 19,00 18,20 17,70 17,40 16,50 18,80 19,20 2,20 0,74 0,68 0,92 1,30 1,16 1,03 1,18 1,00 1,30 1,39 0,60 0,95 0,85 1,09 1,15 1,37 2,34 1,82 0,82 1,30 1,10 0,88 0,99 1,17 1,00 2,70 1,00 1,84 1,00 1,50 1,00 1,58 2,39 1,42 0,71 0,76 2,79 0,50 5,00 1,95 1,99 1,50 1,60 1,40 1,40 1,30 1,30 1,36 1,60 2,39 1,90 3,80 2,40 2,60 2,40 3,40 3,30 2,50 2,67 5,10 3,80 2,70 2,70 3,10 3,20 3,70 3,70 2,65 2,70 3,40 2,00 3,50 3,90 2,00 9,90 3,00 4,00 2,60 4,00 3,50 4,23 2,80 2,60 3,40 3,20 4,10 2,50 3,95 4,20 2,29 4,40 3,90 3,39 3,10 3,06 1,70 4,50 3,70 4,80 7,40 4,00 2,86 3,00 2,10 1,58 2,17 2,91 3,69 2,30 2,30 1,67 1,66 2,82 1,40 1,60 1,55 1,60 2,60 1,85 1,70 2,64 5,70 2,70 1,50 1,60 3,23 1,60 1,51 3,30 4,06 2,00 1,80 2,23 7,00 1,20 2,90 6,84 2,40 1,70 1,60 3,80 2,46 7,00 5,70 2,60 1,00 1,50 0,90 3,80 2,20 3,00 3,30 2,60 3,14 2,50 3,00 3,14 2,66 3,20 4,10 3,70 2,90 2,76 2,37 3,41 2,90 2,60 2,65 2,40 3,70 2,70 2,60 3,10 4,88 3,36 2,40 2,10 4,11 3,20 2,00 3,26 3,11 2,59 3,90 2,10 4,26 2,10 4,20 4,12 2,90 2,40 1,90 2,90 2,77 5,26 2,50 3,90 0,30 0,00 0,80 0,00 0,00 0,00 0,00 0,70 1,78 0,40 43 Tabla 4.6 Variables de la tipificación efectuada a las muestras de maíz en estudio (cont.). 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Miranda Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Ortiz Roscio Roscio Roscio Chaguarama El Socorro Monagas Cajigal Anzoátegui Anzoátegui Mac Gregor Guárico Guárico Guárico Guárico Guárico Guárico Ribas Ribas Ribas Ribas Zaraza Zaraza 18,60 17,60 17,90 17,30 18,30 18,90 22,00 19,10 19,40 17,90 19,50 20,30 20,30 21,30 19,50 21,20 19,70 17,10 18,50 19,60 19,30 20,00 20,20 18,50 18,80 19,60 17,20 16,20 17,30 17,10 17,90 21,90 18,40 17,90 19,10 15,80 15,80 18,30 19,30 17,40 17,10 14,90 18,90 16,90 16,40 15,20 18,10 19,20 1,60 1,30 1,80 1,60 1,30 1,30 1,30 2,00 0,80 0,80 0,77 1,07 2,71 1,00 0,85 0,80 0,86 1,40 0,90 1,00 1,00 1,10 1,50 1,20 0,80 0,97 0,50 1,40 0,60 0,70 1,00 0,80 0,50 1,80 1,40 0,60 2,84 1,10 1,10 1,30 1,00 2,00 0,50 1,30 2,10 1,10 0,10 1,40 3,30 4,40 6,80 3,30 4,30 5,60 5,30 2,30 5,40 6,60 2,70 2,21 6,30 1,75 6,02 3,80 1,28 2,40 3,90 3,30 2,30 4,10 4,70 4,10 2,70 2,80 2,00 5,56 5,92 3,60 7,10 6,98 1,30 7,80 1,75 1,60 3,00 5,60 2,20 1,20 1,40 2,80 1,50 3,00 7,50 4,90 4,00 2,40 2,50 3,00 3,00 2,80 3,00 3,20 3,00 2,40 0,90 2,30 1,70 3,07 3,85 2,40 3,00 2,40 2,30 2,60 3,40 3,00 2,20 2,00 3,00 1,60 1,50 2,00 1,00 2,00 1,50 2,00 1,80 1,20 1,80 4,00 6,90 1,20 7,47 3,20 2,20 2,20 0,80 4,00 2,90 2,00 0,80 1,20 2,90 2,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 2,40 0,95 0,90 0,00 1,20 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,50 0,00 0,00 0,00 0,00 0,00 0,70 0,00 0,00 0,30 0,00 0,40 5,34 0,00 0,00 0,00 0,20 2,20 1,00 0,50 0,00 0,20 0,00 0,00 44 Tabla 4.6 Variables de la tipificación efectuada a las muestras de maíz en estudio (cont.). 131 132 133 134 135 2010 2010 2010 2010 2010 Guárico Guárico Guárico Guárico Guárico Zaraza Zaraza Zaraza Zaraza Zaraza GDT: Granos Dañados Totales 4.2 EVALUACIÓN DEL 18,20 17,20 17,20 17,60 17,70 0,90 1,50 1,10 1,70 1,40 COMPORTAMIENTO 3,70 6,70 6,50 2,40 4,40 DE 1,70 2,00 3,50 1,50 1,60 LA 0,00 0,00 2,00 0,00 0,00 PRESENCIA DE AFLATOXINAS EN MAÍZ BLANCO Desde Diciembre de 2008 hasta Marzo de 2011, se evalúa el comportamiento en la concentración de aflatoxinas totales efectuado en el centro de recepción seleccionado para el estudio. Dichas determinaciones se llevan a cabo mediante kits rápidos para aflatoxinas totales, comercialmente disponibles, basados en métodos ELISA y en columnas de inmunoafinidad para mayor sensibilidad del método cuando es requerido. Se tienen 962 determinaciones en maíz blanco acondicionado, con valores que oscilan de no detectados (< 2 ng/g) a 98,52 ng/g de aflatoxinas totales y un promedio de 2,47 ng/g; sólo 5 valores exceden el límite de 20 ng/g establecido para dicha toxina por el Reglamento técnico de Mercosur (Figura 4.6). Es importante destacar que un riguroso control en el contenido de aflatoxina en la recepción y durante el almacenamiento, asegura la calidad de la materia prima almacenada y posteriormente empleada en los procesos productivos. En la Figura 4.6 se aprecia que a partir de la observación 710, correspondientes al mes de Octubre 2010 en adelante, se hace evidente una tendencia al aumento en la concentración de la toxina, lo cual coincide con la temporada de cosecha 2010-2011, y hay una mayor frecuencia de valores positivos aun cuando sólo 4 valores superan los 20 ng/g. En tal sentido, se evidencia un comportamiento en extremo irregular por lo que se dificulta que sea modelado matemáticamente aun cuando se observa la tendencia al incremento de la concentración de aflatoxina total. El aumento en la incidencia de la toxina podría estar relacionado con el aumento en las horas de cola desde Octubre 2010, en donde se presenta el máximo de 104 45 horas de cola para el comienzo del mes de Noviembre 2010, tal como indican Luzón y col. (2007) que la síntesis de aflatoxinas se acelera con el manejo ineficiente durante la postcosecha temprana antes del acondicionamiento, el cual es el periodo en donde la humedad de los granos se torna favorable para la síntesis de la toxina. Figura 4.6 Comportamiento en la concentración de aflatoxina total en maíz blanco. 4.3 DETERMINACIÓN DEL CONTENIDO DE AFLATOXINA B1 Y AFLATOXINAS TOTALES EN MAÍZ BLANCO DE COSECHA En la Tabla 4.7 se presentan los resultados obtenidos de la determinación de aflatoxinas por HPLC, sólo para las muestras en las que se detectaron valores positivos de aflatoxina total y se mantiene el número de muestra para correlacionar con la tabla anterior. En cuanto a la clasificación de grupos homogéneos se tiene para el primer grupo 116 muestras (85,93%), para el grupo 2 se tienen 3 muestras (2,22%) y finalmente para el grupo 3 se tienen 16 46 muestras (11,85%), 72 correspondientes a la cosecha 2009-2010 y 63 correspondientes a la cosecha 2010-2011. Sólo en 29 muestras se detectaron valores de aflatoxinas totales, lo cual representa aproximadamente el 21,48% del total analizado; en el 78,52% restante de las muestras no se detectó la presencia de aflatoxinas. De las muestras en las que se detectó la presencia de aflatoxinas, sólo 13 muestras (44,83%) cumplen con lo establecido en la norma Covenin 19351987 y 16 muestras (55,17%) superan el límite de máximo 5 ng/g de aflatoxina B1 establecido en la norma Venezolana. En cuanto a las aflatoxinas totales, si se establece el límite de 20 ng/g se tiene que el 72,41% de las muestras poseen concentraciones de aflatoxina total menor a 20 ng/g mientras que sólo el 27,59% superan el límite mencionado. En investigaciones previas en de Venezuela, se han encontrados que varias muestras de maíz de cosecha exceden el nivel máximo permitido de aflatoxinas (Mazzani y col., 2000, 2006; Chavarri y col., 2009). Según lo antes expuesto se tiene que de acuerdo con lo establecido en la norma Covenin 1935-87, el 55,17% de las muestras no cumplen con la normativa y por tal motivo no están aptas para la recepción y su respectivo procesamiento. Valores de aflatoxina G1 y G2 no fueron detectados en ninguna de las muestras y puede deberse a que A. parasiticus, que predomina en los países templados, es considerado uno de los principales productores activos de las aflatoxinas B1, B2, G1 y G2, mientras que A. flavus produce B1 y B2 (Scussel, 1998), que predomina en zonas tropicales y subtropicales. Estos resultados coinciden con los reportados por Luzón y col. (2003), Rondón (2008), Chavarri y col. (2009), en donde A. flavus es la especie fúngica asociada al maíz blanco de cosecha procedente del estado Guárico y otros estados de Venezuela. Consistentemente Luzón y col. (2003) estudiaron el comportamiento de genotipos de grano de maíz en las localidades de San Javier (Yaracuy) y El Sombrero (Guárico) y las especies de mohos identificadas fueron Aspergillus flavus, A. niger, A. parasiticus, A. tamarii, Fusarium verticillioides, Alternaria sp., Penicillium spp, donde F. verticillioides fue la especie que mostró mayor frecuencia e incidencia, lo cual se puede asociar a los bajos niveles de 47 aflatoxinas reportados en esta investigación debido a que Aspergillus y Fusarium se han considerado antagónicos. Tabla 4.7 Determinación del contenido de aflatoxinas en las muestras estudiadas. Muestra Nro. Cosecha Estado Municipio 3 10 12 15 41 47 49 59 65 71 72 76 79 84 93 103 105 110 123 124 126 127 128 129 130 131 132 133 134 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2009 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 2010 Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Cojedes Cojedes Guárico Guárico Guárico Guárico Guárico Anzoátegui Anzoátegui Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Guárico Mellado Miranda Miranda Ortiz Ortiz Ortiz Ortiz Ortiz Roscio Zaraza Zaraza Girardot Girardot Miranda Ortiz Ortiz Ortiz Ortiz Cajigal Mac Gregor Ribas Ribas Ribas Zaraza Zaraza Zaraza Zaraza Zaraza Zaraza n.d.: No detectado B1 5,166 2,111 3,005 2,786 130,660 1,422 24,069 17,744 9,209 5,259 7,504 4,627 1,961 3,016 23,774 2,659 3,016 224,320 7,956 7,956 132,427 78,808 1,799 44,218 3,583 49,591 6,796 1,895 3,569 Metabolito B2 G1 n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. 7,959 n.d. n.d. n.d. 3,258 n.d. 1,059 n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. 1,867 n.d. n.d. n.d. n.d. n.d. 7,554 n.d. 0,856 n.d. 0,856 n.d. 21,776 n.d. 7,942 n.d. n.d. n.d. 5,032 n.d. n.d. n.d. 4,029 n.d. n.d. n.d. n.d. n.d. n.d. n.d. G2 n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. n.d. Aflatoxina Total 5,166 2,111 3,005 2,786 138,619 1,422 27,327 18,803 9,209 5,259 7,504 4,627 1,961 3,016 25,641 2,659 3,016 231,874 8,812 8,812 154,203 86,750 1,799 49,250 3,583 53,620 6,796 1,895 3,569 En las Figuras 4.7 y 4.8 se presentan de modo explicativo el cromatograma correspondiente a una muestra en la que no se detectaron los metabolitos en estudio y otra muestra en la que se detectaron simultáneamente B1 y B2. 48 AFB1 AFG1 AFG2 AFB2 Figura 4.7 Cromatograma de muestra sin metabolitos detectados. 40,00 35,00 30,00 AFB1 AFB1 - 7,043 EU 25,00 20,00 15,00 AFB2 AFB2 - 13,271 10,00 5,00 0,00 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 Minutes 9,00 10,00 11,00 12,00 13,00 14,00 15,00 16,00 Figura 4.8 Cromatograma de muestra positiva para metabolitos B1 y B2. Mediante el software de análisis estadístico SAS, módulo SAS/STAT, se llevó a cabo un procedimiento denominado FREQ entre el grupo asignado en base al grado de tecnificación y el contenido de aflatoxina total estableciendo mediante el test exacto de Fisher que al rechazar la hipótesis nula se consideran ambas variables asociadas. En la Tabla 4.8 se presenta el resumen del análisis mencionado, y el contenido de aflatoxina se evidencia que fue subdividido en grupos para efectos del análisis estadístico. 49 Tabla 4.8 Procedimiento FREQ para aflatoxina total y Grupo de tecnificación. AFLATOXINA (ng/g) 1 GRUPO DE TECNIFICACIÓN 2 3 0 100 3 3 >0 16 0 13 TOTAL 116 85,93% 3 2,22% 16 11,85% α = 0,05 TOTAL 106 78,52% 29 21,48% 135 100% Test exacto de Fisher p=4,227E-07 Tabla 4.9 Procedimiento FREQ para aflatoxina total y la procedencia. AFLATOXINA (ng/g) PROCEDENCIA 0 >0 Cajigal 0 1 Chaguaramas 1 0 Girardot 2 2 Libertador 3 0 Mac Gregor 0 1 Mellado 3 1 Miranda 20 2 Monagas 1 0 Ortiz 65 10 Ribas 1 2 Roscio 7 1 Socorro 1 0 Urdaneta 1 0 Zaraza 1 8 TOTAL 106 78,52% 29 21,48% α = 0,05 Test exacto de Fisher p=2,453E-04 TOTAL 1 0,74% 1 0,74% 4 2,96% 3 2,22% 1 0,74% 4 2,96% 22 16,30% 1 0,74% 75 55,56% 4 2,96% 8 5,93% 1 0,74% 1 0,74% 9 6,67% 135 100% El mismo procedimiento fue aplicado para el contenido de aflatoxina total y el año de la cosecha, obteniendo una probabilidad de 0,1162 por lo que en este caso las variables son 50 independientes; mientras que para el contenido de aflatoxina y la procedencia se obtuvo una probabilidad de 2,452E-04 estableciendo que están asociadas (Tabla 4.9). Esto último coincide con lo reportado por Mazzani y col. (2004) en donde compararon la incidencia de A. flavus y aflatoxinas en 7 estados de Venezuela, obteniendo diferentes incidencias según el estado de procedencia de las muestras. Finalmente se establece mediante el test exacto de Fisher que el contenido de aflatoxina total está asociado al grupo de tecnificación y como consecuencia a la procedencia de las muestras de maíz de cosecha. Es decir que en los grupos de alta tecnificación el porcentaje de muestras con presencia de aflatoxinas no alcanza el 15% mientras que para el grupo de baja tecnificación la incidencia de la toxina es superior al 80%. 4.4 CORRELACIÓN DEL CONTENIDO DE AFLATOXINA B1 CON EL CONTENIDO DE AFLATOXINA TOTAL Y LA CALIDAD DEL GRANO Al calcular el coeficiente de correlación momento de Pearson para el contenido de aflatoxina B1 con el contenido de aflatoxina total, sólo para las 29 muestras en la que se detectó la presencia de micotoxinas, se obtiene un r = 0,9986 lo cual indica el grado de asociación entre ambas variables. En tal sentido se procedió a realizar regresiones simples del contenido de aflatoxina B1 respecto al contenido de aflatoxina total y adicionalmente respecto a: humedad, impurezas, granos dañados totales, granos partidos y granos cristalizados para estimar si existe regresión entre ellas y para conocer la magnitud de la asociación. Solamente existe regresión y es significativa entre el contenido de aflatoxina B1 y aflatoxina total para un 95% de confianza. En la Tabla 4.10 se presenta el resumen de las regresiones efectuadas. 51 Tabla 4.10 Regresiones simples de variables de interés con el contenido de aflatoxina B1. EFECTO Aflatoxina total Humedad Impurezas Granos dañados totales Granos Partidos Granos cristalizados Horas de cola α = 0,05 Término independiente P=0,7995 P=0,4848 P=0,2486 P=0,5953 P=0,0296 P=0,0123 P=0,0136 Variable independiente P<0,0001 P=0,7576 P=0,7504 P=0,6054 P=0,2769 P=0,4242 P=0,2774 R2 0,9972 0,0036 0,0038 0,0100 0,0436 0,0238 0,0435 Coeficiente de variación 9,91179 186,64281 186,62185 186,03954 182,85416 184,73919 182,86364 Se puede apreciar que solamente el efecto de aflatoxina total es significativo, por lo que existe con el contenido de aflatoxina B1. La tasa de cambio obtenida de B1 respecto de aflatoxina total es de 0,933378 y el término independiente de la regresión por no ser significativo se puede considerar igual a cero con lo que el modelo se describe como una línea recta que pasa por el origen del sistema de coordenadas. En la bibliografía consultada no se evidenciaron valores o modelos matemáticos que describan el comportamiento del metabolito B1 basado en el contenido de aflatoxina total. 4.5 RECOMENDACIONES POSTCOSECHA PARA MINIMIZAR LA INCIDENCIA DE AFLATOXINAS TOTALES EN MAÍZ BLANCO NACIONAL La Figura 4.9 se presenta el análisis causa-efecto en donde se consideran los 5 aspectos macro más importantes y se procede al desglose de cada uno en base a los resultados obtenidos, anteriormente presentados. En el medio ambiente las variables que influyen son la humedad, temperatura y precipitación total, y tal como se evidenció en el análisis estadístico presentan diferencias estadísticamente significativas entre los meses y los años evaluados; adicionalmente las condiciones de humedad y temperatura coinciden con las óptimas reportadas en la literatura para el crecimiento de mohos y el desarrollo de toxinas desde el campo. Las condiciones 52 ambientales no es posible controlarlas, por lo que se debe hacer énfasis en las causas controlables conociendo que las anteriormente nombradas son óptimas para la incidencia de mohos y toxinas en maíz blanco de cosecha en Venezuela. MATERIAL GENÉTICO MANO DE OBRA Incidencia de aflatoxinas totales en maíz blanco de cosecha MEDIO AMBIENTE MÉTODOS MAQUINARIA Figura 4.9 Diagrama causa-efecto de la presencia de aflatoxinas en maíz blanco de cosecha. Para este estudio en particular la mano de obra y maquinaria están relacionados o podrían agruparse, dado que la mano de obra que se emplee estará en concordancia con el grado de tecnificación empleado en la cosecha. Fue presentado el análisis realizado en donde se demuestra que el contenido de aflatoxina en las muestras está asociado al grupo de tecnificación, ésto debido a que la práctica de cosecha manual y recolección de mazorcas del suelo permiten la rápida colonización y por consiguiente la producción de micotoxinas, mientras que una alta tecnificación o uso de maquinaria especializada recolecta las mazorcas directamente de la planta sin que toque el suelo e inmediatamente es desgranada y vertida en los vehículos de transporte. Se han estudiado diferentes métodos y medios micológicos para la recuperación de mohos micotoxigénicos en el cultivo de maíz en Venezuela, encontrándose que las muestras 53 presentaban aflatoxina B1 en niveles que variaron entre 1 a 10 ng/g y otras tenían aflatoxina B1 y G2 donde los niveles máximos detectados estaban por debajo de los niveles mundialmente permitidos, que son 20 ng/g. Se realizó un análisis de correlación entre los niveles de A. flavus, niveles de aflatoxinas y porcentaje de humedad, resultando que posiblemente las aflatoxinas se produjeron después de la cosecha, durante cualquiera de los procesos de recolección, transporte, almacenamiento, entre otros (Raybaudi, 1999). En las pequeñas explotaciones existe menor acceso de insumos, menor información del productor, baja inversión y mal manejo durante el ciclo de desarrollo de las plantas que favorece la presencia de las diferentes especies de mohos que disminuyen considerablemente la calidad de los granos cosechados (Fernández, 2006; Mazzani y col., 2008). En los métodos se pueden considerar otros factores como el tiempo transcurrido entre la recolección y el acondicionamiento, que aun cuando en el estudio resultó que no existe regresión entre el contenido de aflatoxina y las horas de cola, durante dicho tiempo se mantienen las condiciones favorables para el crecimiento de los mohos y aún cuando no se produzcan toxinas es posible que se presenten problemas posteriores durante el periodo de almacenamiento de la materia prima a granel tal lo indican Luzón y col. (2007). Adicionalmente se debe considerar como factor determinante los planes de muestreo de los vehículos ya que de esto depende el número de falsos positivos y falsos negativos según lo reportado por Verenzuela (2007). Sobre los materiales genéticos se puede mencionar la importancia de emplear semillas de alta calidad y resistentes al ataque de diferentes tipos de mohos para minimizar la incidencia de éstos y de las toxinas como una manera preventiva de manejar la problemática de calidad e inocuidad asociada, tal como se evidencia en los estudios realizados por Mazzani y col. (2006) que detectaron diferencias entre cultivares en su respuesta a la acumulación de aflatoxinas. El estudio del control de los mohos en granos y semillas almacenadas es una actividad multidisciplinaria debido a la gran variedad de factores que influencian su deterioro. Desde hace muchos años, se han planteado diferentes alternativas para prevenir la invasión de mohos 54 en granos y semillas, así como para remover o inactivas las micotoxinas contenidas en los mismos. De todas las alternativas propuestas, la selección y el mejoramiento para la resistencia resulta la alternativa más favorable (Mazzani, 1989). 55 CONCLUSIONES Las variables ambientales no pueden relacionarse al aumento en la incidencia de aflatoxinas en las muestras, mientras que las condiciones de manejo post-cosecha como grado de tecnificación y horas de cola evidentemente propician la consecuente producción de los mohos y micotoxinas. A pesar de la ausencia de significación en las medias de humedad y precipitación, los valores correspondientes al año 2010 son superiores a los del año anterior y evidentemente son condiciones que favorecen la producción de mohos de campo y por consecuencia sus micotoxinas. Se demostró que existe regresión significativa entre el contenido de aflatoxina B1 y aflatoxina total, con lo que los centros de recepción pueden mantener las metodologías de detección de aflatoxina total y con éste estimar el contenido de aflatoxina B1 para comparar con el límite establecido en la Norma Covenin 1935-87, al momento de la recepción de la materia prima. Se evidenció que no es posible estimar el contenido de aflatoxina B1 a través de las variables de calidad como humedad, impurezas, horas de cola, porcentaje de granos dañados, partidos y cristalizados de las muestras. La incidencia de aflatoxinas puede disminuirse al minimizar la práctica de cosecha manual y al emplear híbridos resistentes a la colonización de mohos. 56 RECOMENDACIONES Minimizar el uso de baja tecnificación, aún cuando se trate de pequeños productores, a fin de garantizar la calidad de la materia prima. Efectuar el acondicionamiento del producto en el menor tiempo posible, preferiblemente en el sitio de cosecha, para asegurar la calidad del producto durante el periodo de almacenamiento. Monitoreo frecuente de los mohos y micotoxinas en maíz de cosecha, para conocer la situación real de éstas al momento de la cosecha y la verdadera influencia de las horas de cola. Uso de genotipos de maíz resistentes a la incidencia fúngica. 57 REFERENCIAS Belitz, H. y Grosch, W. 1999. Food chemistry. 2nd ed. Germany. Springer. 1070 p. Bragachini, M., Bongiovanni, R., Martini, A., Mendez, A., Casini, C. y Rodríguez, J. 2003. Eficiencia de cosecha y almacenamiento de granos. Argentina. Ediciones INTA. 259p. Chavarri, M., Luzón, O., Mazzani, C., González, C., Alezones, J. y Garrido, M. 2009. Mohos toxigénicos y micotoxinas en maíz de grano blanco cosechado bajo riego en los estados Yaracuy y Portuguesa, Venezuela. Fitopatología Venezolana. 22:2-7. Duarte, E. 2005. The mycotoxin blue book. 1a ed. United kingdom. Nottingham University Press. 349 p. Ellis, W., Smith, J. and Simpson, B. 1999. Aflatoxins in food: occurrence, byosynthesis, effects on organisms, detection and methods of control. Critical Reviews in Food Sci. and Nutr. 30(3):403-439. Fennema, O. 1998. Química de los alimentos. 2a ed. España. Editorial Acribia. 1258p. Fernández, 2006. Incidencia de Aspergillus flavus y aflatoxinas en granos de maíz (Zea mays L.) cosechado en pequeñas explotaciones de algunos estados centro-occidentales de Venezuela. Universidad Central de Venezuela. Facultad de Agronomía. Trabajo de grado. Maracay. 101 p. González, U. 1995. El maíz y su conservación. 1a ed. Mexico. Editorial trillas. 399 p. Huber, L. 1998. Validation of analytical methods: Review and strategy. LC-GC Int. 11 (2), 96-105. Luzón, O., Martínez, A., Mazzani, C., Figueroa, R. y Barrientos, V. 2003. Comportamiento de genotipos de maíz de grano amarillo ante Fusarium moniliforme y fumonisinas en dos localidades de Venezuela. Fitopatol. Venez, 16:17-21. Luzón, O., Chavarri, M., Mazzani, C., Barrientos, V. y Alezones, J. 2007. Principales mohos y micotoxinas asociadas a granos de maíz en campos de los estados Guárico, Portuguesa y Yaracuy, Venezuela. Fitopatología venezolana. 20:25-30. Marín, P., Cruz, A., Magan, N., Jurado, M., Vázquez, C. y González, M. 2010. Influence of environmental factors on growth and mycotoxin biosynthesis of Fusarium. Perspectives on future climatic conditions in Spain. VI Latin American congress of mycotoxicology and 58 II international symposium on algal and fungal toxins for industry. Yucatan, Mexico. p 225. Martín, J. 2004. Fundamentos del análisis microbiológico de los alimentos. Alimentación Equipos y Tecnología. 195: 58-62. Mazzani, C. 1989. Evaluación de resistencia de genotipos de maní (Arachis hypogaea L.) maíz (Zea mays L.) y cacao (Theobroma cacao L.) almacenado en Venezuela. Universidad Central de Venezuela. Facultad de Agronomía. Trabajo de ascenso. Maracay. 113 p. Mazzani, C. 1996. Ocurrencia de hongos toxigénicos en granos. En micotoxinas: Perspectiva Latinoamericana. L.C.H. da Cruz (editores). Seropédica. Universidad Federal Rural do Rio de Janeiro. Brasil. 21-27 pp. Mazzani, C., Borges, O., Luzón, O. y Quijada, P. 2000. Fusarium moniliforme, fumonisinas y Aspergillus flavus en granos de híbridos de maíz en el Estado Guárico, Venezuela. Revista de la Facultad de Agronomía de la Universidad del Zulia. 17:185-195. Mazzani, C., Luzón, O. y Chavarri, M. 2004. Aspergillus flavus asociado a Epitragus sp. (Coleoptera: Tenebrionidae) en maíz bajo riego en Turén, estado Portuguesa, Venezuela. Entomotropica. 19:157-159. Mazzani, C., Luzón, O., Beomont, P. y Chavarri, M. 2004. Micobiota asociada a granos de maíz en Venezuela y capacidad aflatoxigénica in vitro de los aislamientos de Aspergillus flavus. Fitopatología Venezolana. 17:19-23. Mazzani, C., Luzón, O., Chavarri, M. y Alezones, J. 2006. Metodología rápida para evaluar in vitro la respuesta de genotipos de maíz a la acumulación de aflatoxinas. Fitopatología Venezolana. 19:10-14. Mazzani, C., Luzón, O., Chavarri, M., Fernández, M. y Hernández, N. 2008. Fusarium verticillioides y fumonisinas en maíz cosechado en pequeñas explotaciones y conucos de algunos estados de Venezuela. Fitopatología Venezolana. 22:18-22. Mc. Nair, H. y Miller, J. 1998. Basic gas chromatography techniques in analytical chemistry. USA. Wiley interscience publication. John Wiley & Sons, Inc. 239 p. Miller, J. y Trenholm, H. 1994. Mycotoxins in grain. USA. Eagen press. 552 p. Norma Técnica Colombiana. 1996. Método de Análisis de Aflatoxinas de Ocurrencia Natural (B1, B2, G1 y G2). NTC-1232. 9 p. Norma Venezolana Covenin. 1982. Cereales – Leguminosas – Oleaginosas y productos derivados. Muestreo. 612-82. 25 p. Norma Venezolana Covenin. 1987. Maíz para uso industrial. 1935-87. Gaceta oficial la República Bolivariana de Venezuela Nº 34230. 19 p. ONU para la Agricultura y la Alimentación. 1993. El maíz en la nutrición humana. Roma. 172 p. 59 Raybaudi, R. y Martínez, A. 2000. Incidencia e identificación de la micobiota en granos de maíz y comparación de medios de cultivo para la determinación de mohos toxigénicos. Fitopatología venezolana. 13:15-18. Raybaudi, R., Mazzani, C., Benítez, I., Martínez, A., Luzón, O. y González, C. 2005. Relación entre las concentraciones de hierro, cobre y zinc y la incidencia de Aspergillus flavus, Fusarium moniliforme, aflatoxinas y fumonisinas en maíz. Fitopatología venezolana. 18:15-19. Raybaudi, R. 1999. Evaluación de diferentes métodos y medios micológicos para la recuperación de mohos totales y mohos micotoxigénicos a partir de maíz y determinación de aflatoxinas y fumonisinas. Universidad Central de Venezuela. Facultad de Ciencias, Trabajo de ascenso. Caracas. 159 p. Reglamento técnico Mercosur. 2002. Límites máximos de Aflatoxinas Admisibles en Leche, Maní y Maíz. 25/02. 7 p. Rondón, M. 2008. Mohos asociados al maíz blanco (Zea mays L.) de cosecha y almacenado procedente del estado Guárico, Venezuela. Universidad Central de Venezuela. Facultad de Agronomía, Tesis de grado. Maracay. 46 p. Scussel, V., Hiroshi, L. y Lorini, I. 2002. Armazenagem de grãos. 1a ed. Campinas. Instituto Bio Geneziz. 983 p. Scussel, V. 1998. Micotoxinas em Alimentos. Brasil. Editora Insular. 144 p. Skoog, D. y West, D. 2005. Química analítica. 8a ed. International thomson editores. 1184 p. Verenzuela, L. 2007. Planes de muestreo durante la recepción y almacenamiento de maíz (Zea mays L) para monitoreo de aflatoxinas. Universidad Central de Venezuela. Facultad de Agronomía, Tesis de grado. Maracay. 78 p. Watson, S. y Ramstad, P. 1987. Corn. Chemistry and technology. USA. Autor. AACC. 605 p.