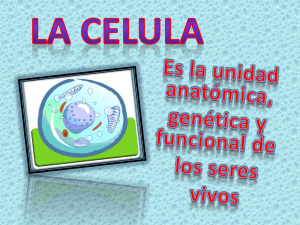
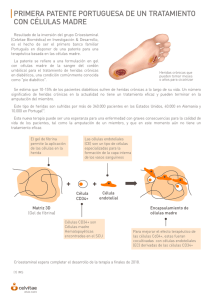
Get cached
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE BIOANALISIS E INSTITUTO NACIONAL DE CANCEROLOGIA ESTUDIO INMUNOFENOTlPICO COMPARAT1VO DE SUBPOBLACIONES HEMATOPOYtTICAS PROVENIENTES DE SANGRE DE CORDON C t L U L A S MOVILIZADAS QUE UMBILICAL A LA PARA OBTENER UCENCIADO VANIHAMIN EN HUMANO (SCUH) Y SANGRE PERIFERICA (CMSP) EL GRADO ACADEMICO DE QUIMICA DOMfNGUEZ CLINICA MEL&IDEZ DIRECTOR DE TESIS: DR. ALEJANDRO MARCH£ COVA APOYADA POR EL PROYECTO CONACYT 36873-M MEXICO, D.F. ENERO DEL 2004 COMITE TUTORAL: PRESIDENTE: Dr. RAFAEL GUERRERO GARCIA SECRETARIO: Q.C JORGE SIGFRIDO GONZALEZ HERNANDEZ. VOCAL Dra. MA. LUISA SOLANO GARCIA. SUPLENTE: M en C. MARIA LOPEZ HERNANDEZ DIRECTOR DETESIS: DR ALEJANDRO MARCHE COVA. A medida que vamos creciendo nuestras metas profesionales, se vuelven mas importantes y la mayoria de las veces mas dif idles. este es un proceso que a algunos nos cuesta mas y a otros menos. pero finalmente, es el caracter de cada persona el que lo impulsa a terminar dichas metas, cada vez que uno logra una meta ya sea profesional o personal quiere estar rodeado de los seres a los que mas ama o que de alguna manera han dejado huella en el para compartir su felicidad. En este caso es una meta profesional se que no me bastaria una o dos hojas para poder poner a todas las personas que mi mente llegue a recordar y que de alguna manera son importantes para mi pero deben saber que aunque no lleguen a aparecer en estas hojas, estan en mi corazon. Este momento se lo dedico a los cimientos y pilares de mi vida. A mis queridos padres Victor y Ruth y a mi hermano Victor: a ustedes, a los cuales dedico este t r i u n f o y debo todo lo que llegue a realizar en el f uturo por que ustedes son los cimientos de vida gracias por tocarme en esta vida, ya que son maravillosos ya que siempre me han dado lo necesario para poder vivir feliz y su regalo mas grande, personalmente, siempre, siempre me han hecho sentir su apoyo y eso t r a e como consecuencia la seguridad que tengo, la cual me ayuda a salir adelante siempre, GRACIAS Mami chula y GRACIAS viejo eres el mejor padre del mundo. Y a t i hermano simplemente no tengo palabras para poder explicar lo que significas para mi, pero debes saber que siempre estas en mi corazon y me das fuerzas en mis momentos diffciles y creeme no son pocos. Se que algun dfa, en algun momento o en algun lugar tendre la oportunidad de decfrtelo personalmente pero por ahora sera de esta manera, nos vemos y t e quiero mucho. A M I S HERMANOS A mi querida hermana Ruth, gracias por todo t u apoyo y por hacerme sentir protegido. A mi hermano Daneskiu, a t i quiero agradecerte t u apoyo amistad, y gracias por sor un ejemplo para mi, t e quiero mucho hermano. A mi hermanita Ihulema, gracias por estar conmigo, y por ser mi compinche, t u sabes en realidad cuanto vales para mi.(nooooo, mucho hermanita... mucho) A mis pequenas hermanas Yharos y Ihoana, a ustedes por ocupar una gran parte de mi corazon, y por ser mis pequenas. A mis tios Isaac y mi super tia Celia, mi abuelita Anita a ustedes principalmente por que de alguna y o t r a manera han dejado huella en mi vida o me han dado apoyo y algun consejo, los quiero y respeto mucho. AGRADECIMIENTOS I N S T I T U T O N A C I O N A L DE CANCEROLOGI-A. Dr. Pedro Sobrevilla Calvo J e f e del Departamento de Hematologia. Dra. Rita Rivas Gonzales. J e f a del Banco de Sangre. Q.F.B. Alejandro Enrique Velasco Escobar. J e f e de seccion del Laboratorio clinico Q.F.B. Aurora Acosta Barreda. Biol.. Rocio Susana Mendez Martinez. Esp. M.E Maria del Pilar Ramos Godines. Por su apoyo y colaboracion para la realizacion de esta tesis. HOSPITAL GENERAL MANUEL GEA GONZALEZ Dra. Ana Flisser. Directora de investigacion. Dr. Luis A l b e r t o Villanueva Egan Subdirector de ginecologfa y obstetricia. Por todo el apoyo brindado y su valiosa colaboracion para la realizacion de esta tesis. FACULTAD DE B I O A N A L I S I S . Sobre todo a aquellos maestros que personalmente dejaron huella en mi me ayudaron y me inspiraron a terminar mi carrera. Q.C Jorge Sigfrido Gonzalez, Q.C Sandra Luz Gonzalez Herrera. Q.F.B Patricia Silvia Rosales Pastrana, Q.C. Francisco Solis Paez., Dra. Ma Luisa Solano Garda. Dr. Rafael Guerrero Garcia, M en C. Maria Lopez Hernandez. CONACYT Agradecimientos especiales a CONACYT por la beca N ° 4 8 8 0 otorgada para el apoyo a esta tesis, la cual esta comprendida dentro del proyecto N ° 3 6 8 7 3 - M "Estudio I n t e g r a l de la Enfermedad Minima Residual en pacientes con Leucemia Mieliode Cronica Alotransplantados" DR ALEJANDRO MARCHE COMA Gracias principalmente por compartir un poco de su gran conocimien+o conmigo, asi mismo por soportarme y por reafirmar mis valores eticos dentro de este mundo cientifico, tambien por ensenarme a hacer las cosas bien (aunque a veces me cueste mas). Gracias Doctor personalmente es un gran investigador. "ESTUDIO INMUNOFENOTIPICO HEMATOPOYETICAS COMPARATIVO PROVENIENTES DE SANGRE DE SUBPOBLACIONES DE CORDON UMBILICAL HUMANO (SCUH) Y CELULAS MOVILIZADAS A LA SANGRE PERIFERICA (CMSP)." INDICE GENERAL Pag. ABREVIATURAS i RESUMEN ii 1.- I N T R O D U C C I O N 1.1.-HEMATOPOYESIS 1 1 1.1.1.-Ontogenia Hematopoyetica 2 1.1.2.-Subpoblaciones Celulares 3 1.1.3.-Estroma Celular 6 1.1.4.- Factores de Crecimiento y Citocinas 1.2.- ANTIGENOS DE DIFERENCIACION CELULAR EN LA HEMATOPOYESIS 7 11 1.3.-ANTICUERPOS MONOCLONALES 14 1.4.- FUENTES DE CELULAS TALLO Y SUBPOBLACIONES CELULARES 14 1.4.1.- Medula Osea 15 1.4.2.- Celulas Movilizadas a la Sangre Periferica (CMSP) 17 1.4.3.- Sangre de Cordon Umbilical Humano (SCHU) 19 1.5.- MICROSCOPIA DE EPIFLUORESCENCIA 22 1.6.- PLANTEAMIENTO DEL PROBLEMA 25 2.-OBJETIVOS 27 3.-HIPOTESIS 27 Pag. 4.-MATERIALES Y METODOS 4.1.- OBTENCION DE MUESTRAS 28 28 4.1.1.-Muestras de SCUH 28 4.1.2.-Muestras de CMSP de alodonadores 28 4.2.-FASE DE ESTANDARIZACION 29 4.2.1.- Procesamiento de las muestras de SCUH 29 4.2.2.- Obtencion de la SCUH 29 4.2.3.- Concentrado leucocitario pobre en plaquetas (buffy-coat-lp) 30 4.3.- FASE DE ANALISIS 31 4.3.1.- Estudio inmunofenotipico de las muestras 31 4.3.2.- Procedimiento 31 5.- R E S U L T A D O S 32 6.- D I S C U S I O N Y C O N C L U S I O N E S 50 7.- B I B L I O G R A F I A 54 ... INDICE DE FIG U R AS Y TABLAS Pag. Figura 1. HEMATOPOYESIS 5 Tabla 1. PRINCIPALES CARACTERISTICAS DE FACTORES DE CRECIMIENTO E INTERLEUCINAS 9 Figura 2. ANTIGENOS DE DIFERENCIACION DE LAS CELULAS PROGENITORAS Y PRECURSORAS 13 Tabla 2. FLUOROFOROS MAS COMUNES EN MICROSCOPIA DE EPIFLUORESCENCIA 24 Figura 3. CASO REPRESENTATIVO DE LA SECUENCIA DE OBTENCION DEL CORDON UMBILICAL HUMANO 33 Figura 4. CASO REPRESENTATIVO DE LA SECUENCIA DE OBTENCION DE LA SANGRE DE CORDON UMBILICAL HUMANO (SCUH) 34 Figura 5. CASO REPRESENTATIVO DE LA FORMA EN LA QUE SE ION REALIZA LA AFERESIS DE FLUJO CONTINUO 35 Tabla 3. DATOS GENERALES SOBRE LAS CMSP 36 Tabla 4. DATOS GENERALES SOBRE LOS CORDONES UMBILICALES 37 Tabla 5. PORCENTAJES DE LAS DIFERENTES SUBPOBLACIONES ESTUDIADAS EN LAS MUESTRAS DE CMSP 38 Tabla 6. PORCENTAJES DE LAS DIFERENTES SUBPOBLACIONES ESTUDIADAS EN LAS MUESTRAS DE SCUH 39 Tabla 7. CANTIDAD DE LAS DIFERENTES SUBPOBLACIONES EN EL VOLUMEN TOTAL DE SCUH DE LOS CORDONES ANALIZADOS .. 40 Tabla 8. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD34+/CD45RA+, CD34+/CD71 Y CD34+ TOTALES EN CMSP DE ALODONADORES Tabla 9. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD45RA+/CD71 + Y CD45RA+ TOTALES EN CMSP DE ALODONADORES 42 43 Pag. Tabla 10. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD71+ TOTALES DE CMSP DE ALODONADORES 44 Tabla 11. VALORES DE REFERENCIA POR ME PARA LAS SUBPOBLACIONES CD34+/CD45RA+, CD34+/CD71+ Y CD34+ TOTALES EN SCUH DE NEONATOS A TERMINO 45 Tabla 12. VALORES DE REFERENCIA POR ME PARA LAS SUBPOBLACIONES CD45RA+/CD71+ Y CD45RA+ TOTALES EN SCUH DE NEONATOS A TERMINO 46 Tabla 13. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD71+TOTALES EN SCUH DE NEONATOS A TERMINO 47 Tabla 14. COMPARACION FINAL DE LOS VALORES DE REFERENCIA DE LAS SUBPOBLACIONES DE CMSP VERSUS SCUH 48 Figura 6. CASO REPRESENTATIVO DE CELULAS CD34+ (ROJA) Y CD34+/ CD45RA+ (ROJA-VERDE) DE UNA MUESTRA DE SCUH 49 ABREVIATURAS UFC, unidad formadora de colonias; UFC-E, unidad formadora de colonias eritrociticas; UFC-GM , unidad formadora de colonias granulo-monociticas; UFC-GEMM, unidad formadora de colonias mixtas (granulocitos, eritrocitos monocitos y megacariocitos); UFC-Meg, unidad formadora de megacariocitos; UFC-L , unidad formadora de la serie linfoide; CD, cluster of direntation; UFB-E, unidad formadora de bursas eritroides; MO, medula osea; SCUH, sangre de cordon umbilical humano; CMSP, celulas movilizadas a la sangre periferica; CHT = celula totipotencial hematopoyetica.;L,linfoide.; EG , eritrocitos y granulocitos; M , monocitos; G, granulocitos; Bas, basofilos; Eo, eosinofilos; LB linfocitos B; LT , linfocitos T; LGG, linfocitos grandes granulares; FC, factores de crecimiento; FEC, factor estimulante de colonias; IL, interleucina; AcMs, anticuerpos monoclonales; FITC, isotiocianato de fluoresceina; rpm = revoluciones por minuto; nm, nanometro; pL, microlitro. RESUMEN En la actualidad para poder obtener celulas CD34+ se hace a traves de su movilizacion de la medula osea a la sangre periferica (CMSP) por medio de factores de crecimiento, recientemente una fuente alternativa de gran impacto es la sangre de cordon umbilical humano (SCUH). La SCUH esta aun bajo estudio para poder observar sus ventajas y desventajas respecto a las CMSP. Existe una gran diversidad entre ambas muestras en cuanto a los resultados reportados tanto en la cantidad de celulas CD34+ totales como de las diferentes subpoblaciones celulares, como las CD34/CD45RA+, CD34+/CD71+ y CD45RA+/CD71+. Por tal motivo y considerando ademas que en la actualidad en nuestro pais existe muy poca informacion reportada sobre el tema, en el presente trabajo, mediante el estudio comparativo de las subpoblaciones existentes en SCUH y CMSP obtuvimos datos estadisticos que pueden servir como valores de referenda. De tal forma, para la SCUH fueron: CD34+, 1.1- 2.3%, CD45RA+, 84.9-97.3%; CD71+, 1.31.7%; CD34/CD45RA+, 0.5-1.7%; CD34+/CD71+, 0.4-1.2%; CD45RA+/CD71+, 0.61.4%. Y para las de CMSP: CD34+, 0.5-1.3%; CD45RA+, 72.4-85.8%; CD71+, 0.71.1%; CD34/CD45RA+, 0.3-1.1%; CD34+/CD71+, 0.2-0.6%; CD45RA+/CD71+, 0.20.8%. Nuestro estudio es el primero que muestra y aporta valores de referencia para las diferentes subpoblaciones estudiadas tanto para muestras de SCUH como para muestras de CMSP, que si bien fueron obtenidos por microscopia de epifluorescencia, marcan la pauta para conocer datos estadisticamente significativos en futuros estudios relacionados con el tema. 1.- I N T R O D U C C I O N 1.1.-HEMATOPOYESIS La hematopoyesis es definida como el proceso mediante el cual las celulas pluripotenciales se autoperpetuan y diferencian. Estas celulas pluripotenciales tambien conocidas como celulas madre, tallo, progenitoras o "stem" son las que dan origen a las distintas series celulares cuando se van diferenciando. Esto es, la celula pluripotente puede dar origen a una celula similar o bien a otra celula mas diferenciada, a esta celula se le conoce como precursora o unidad formadora de colonias (UFC), la cual puede tener diferentes destinos: UFC-E que es la que da origen a la serie eritroide, la UFC-GM que produce la granulo-monocitica, las UFC-GEMM que originan la mixta, las UFC-Meg que producen la megacariocitica, y las UFC-L, que son las que dan origen a la serie linfoide. La progenie derivada de cada una de estas UFC se le conoce como subpoblacion celular. Estas subpoblaciones celulares continuan con su proceso de diferenciacion, hasta llegar a una celula terminalmente diferenciada y por lo tanto comprometida a una linea especifica (1- 3). Las celulas hematopoyeticas tanto progenitoras como precursoras son incapaces de distinguirse por medio de microscopia de campo claro. Estas celulas solo pueden estudiarse mediante tecnicas de cultivo in vitro asi como mediante el marcaje de sus antigenos de diferenciacion, conocidos como "cluster of diferentiation" (CD), por anticuerpos monoclonales. Estos antigenos estan presentes en la superficie de la membrana celular y conforman el inmunofenotipo especifico (4). 1.1.1.- Ontogenia Hematopoyetica Alrededor del comienzo de la tercera semana, las celulas mesodermicas situadas en el mesodermo visceral de la pared del saco vitelino se diferencian en celulas, llamadas Hemangioblastos, formando grupos y cordones aislados (cumulos angiogenicos celulares) que gradualmente se van canalizando por confluencia de las hendiduras intercelulares. Las celulas centrales dan origen a las celulas primitivas, en tanto las de la periferia se aplanan y forman las celulas endoteliales que revisten los islotes sanguineos. La hematopoyesis hepatica se desarrolla a partir de la sexta semana hasta el nacimiento, a pesar de que la eritropoyesis predomina se pueden empezar a detectar celulas de la serie granulocitica y megacariocitica. La actividad del higado disminuye gradualmente en los dos ultimos meses de la vida intrauterina y en el momento del nacimiento solo restan ya pequenos islotes hematopoyeticos. La hematopoyesis esplenica se desarrolla en el mismo periodo que la hepatica aunque su contribution es menor, ambos organos son importantes para el desarrollo de la linfopoyesis. A partir de la onceava semana se establece la hematopoyesis medular que es el organo hematopoyetico definitivo. Durante los dos primeros anos de vida la medula osea activa (medula roja) se localiza en todos los huesos y gradualmente es remplazada por tejido medular inactivo (medula amarilla o grasa). Este proceso se inicia en la diafisis de los huesos largos y en los adultos jovenes la medula roja se localiza en la epifisis de los huesos largos, esternon, costillas, craneo, las vertebras y pelvis. La expansion del tejido hematopoyetico finaliza en la infancia. En situaciones de necesidad de incremento de hematopoyesis se produce una expansion de la medula roja hacia la medula grasa e inclusive se Neva a cabo extramedularmente como en el bazo y el higado. En el adulto la hematopoyesis se desarrolla en la medula osea (MO). Las celulas hematopoyeticas hallan en la medula osea el microambiente adecuado para su desarrollo y diferenciacion hacia las celulas maduras. La medula osea es un tejido blando contenido en el interior de los huesos, el tejido hematopoyetico se situa en los espacios intravasculares, donde los distintos tipos celulares adoptan una distribution topografica muy constante en funcion de su capacidad de desplazamiento. Asi por ejemplo, los eritroblastos tienden a acomodarse cerca del sinusoide y se agrupan en islotes alrededor de los macrofagos, la granulopoyesis se desarrolla en la parte mas central de los espacios intersinusoidales, las celulas linfoides se distribuyen de manera irregular por todo el tejido hematopoyetico y los megacariocitos se localizan en la proximidad de los sinusoides de la medula osea. El microambiente medular engloba a un conjunto de substancias quimicas, hormonales, diversos tipos celulares asi como otros factores menos conocidos. Ademas, interviene en el proceso de diferenciacion celular y ofrece a la celula hematopoyetica soporte fijo y adhesion (5, 6). 1.1.2.- Subpoblaciones Hematopoyeticas Los progenitores hematopoyeticos son celulas mononucleadas pequenas, agranulares, semejantes a linfocitos T, no se les encuentra en sangre periferica a gran escala sino una por cada dos mil elementos nucleados. Como antes se comento, estas celulas solo pueden estudiarse mediante tecnicas de cultivo in vitro asi como mediante el marcaje de sus antigenos de diferenciacion por anticuerpos monoclonales. Gracias a estas tecnicas actualmente se sabe que existe una celula madre o "stem" pluripotente tambien conocida como celula CD34+CD90+, con capacidad de proliferation, diferenciacion y autorenovacion. La celula pluripotente estimulada por su microambiente da lugar a otras celulas que se iran diferenciacion paulatinamente hasta que se comprometeran a las diferentes lineas celulares existentes en sangre periferica. A estas celulas se les denomina unidades formadoras de colonias (UFC), ademas de las mencionadas en la section 3.1 se conocen tambien las UFC-Eo que producen eosinofilos y las UFC-Bas que dan origen a los basofilos (Figura 1). En estudios comparativos previos entre muestras de MO y sangre de cordon umbilical humano (SCHU) se identificaron por citometria de flujo los inmunofenotipos de las tres subpoblaciones principales existentes en ambas muestras: las UFC-GM presentan el inmunofenotipo CD34+/ CD45Ra low / CD71 low, las UFC-E el CD34+/ CD45Ra low / CD71+ y las UFC-GEMM el CD34+/ CD45RA+ / CD71 low (7, 8). yFC^GEfilM x. X IS UFC'I / UFC-GM UFC-Eyeg I UFB-E UFC-y i UFC^i * UFB-iieg UF&Bm UFG-Eo UFC-1 m ftoeritiDbiatlo UMfeteto MMobt^io MtatoWasta Mitloblasio LM^ato LirvfetoT LiifaoGG t I. Eritrcdto Mopoeito Hsr Basfiio Eosinfifilo Neuttfftla iPiaqueta UnteciteS LinfeciloT OnfocHoGG Mastocito Maaofago Figura 1. HEMATOPOYESIS. d e colonias. eritrocitos, UFB-E monocitos, = unidad C T H = c e l u l a totipotencial h e m a t o p o y e t i c a . U F C = u n i d a d f o r m a d o r a formadora megacariocitos.. EG de b u r s a s eritroides. L = linfoide. = eritrocitos y granulocitos, Meg GEMM = granulocitos, = megacariocitos. M - monocitos. G = granulocitos. M e g = m e g a c a r i o c i t o s . B a s = basofilos. Eo = eosinofilos. LB = linfocitos B. L T = linfocitos T . L G G = linfocitos g r a n d e s g r a n u l a r e s . 1.1.3.- Estroma Celular El estroma celular se considera como un soporte que esta compuesto por celulas que tienen la capacidad de unirse y formar una especie de red a la cual las celulas hematopoyeticas se adhieren y llevan acabo sus funciones. Junto a los efectos mediados por las citocinas, las interacciones directas de celula-celula tienen un papel importante en la hematopoyesis medular. Las celulas del estroma medular ejercen su action pro-hematopoyetica mediante el contacto directo con los progenitores, junto a la action de las citocinas y de las proteinas moduladoras de la matriz extracelular, secretadas por ellas. Si este proceso falla la hematopoyesis tambien fracasa. Entre las celulas del estroma celular se incluyen a los fibroblastos, las celulas reticulares, osteoblastos, adipocitos, celulas endoteliales, celulas dendriticas y los macrofagos. Las celulas del estroma secretan proteinas que forman la matriz extracelular: como la fibronectina, laminina y colagena entre las mas representativas, asi como glucosaminoglucanos. Algunos de estos componentes, como la fibronectina y la hemonectina, proporcionan el sustrato esencial al que se adhieren los progenitores eritroides y mieloides durante su desarrollo. Durante la hematopoyesis las celulas del estroma pueden actuar por action directa de los Factores de Crecimiento (FC) localizados en su membrana celular o por action de los FC localizados en la matriz extracelular. Estos mecanismos configuran el concepto de pequenos microambientes anatomicos, donde se localizan FC que ejercen una action de forma preferente hacia cada una de las lineas celulares (5, 9). El crecimiento y maduracion de las celulas hematopoyeticas pueden ser modulados, en parte por los factores de crecimiento, aunque no son los unicos componentes de su regulation. Las moleculas de adhesion y las de asentamiento pueden ser moduladas por citocinas, estas tambien tienen un papel en la determination de las interacciones entre las celulas del estroma y las celulas hematopoyeticas. 1.1.4.- Factores de Crecimiento y Citocinas La supervivencia, autorrenovacion, proliferation y diferenciacion de las celulas stem esta controlada por glucoproteinas especificas denominadas factores de crecimiento hematopoyeticos, los cuales desempenan una funcion importante para regular la production celular sanguinea a traves de la supresion de la apoptosis o referida tambien como muerte celular programada (10). Como ya se comento previamente, las celulas sanguineas se originan de celulas progenitoras pluripotenciales en la medula osea bajo la influencia de factores de crecimiento hematopoyeticos especificos, que favorecen que las celulas stem se autoperpetuen, proliferen y se diferencien en todos los tipos hematopoyeticos. Los factores de crecimiento hematopoyeticos incluyen factores estimulantes de colonias (FEC) e interleucinas (IL) estas interactuan sobre su celula bianco mediante receptores celulares transmembrana unicos. Despues de la union del factor de crecimiento a su receptor, su serial se envia a lo largo de la membrana celular al citoplasma y por ultimo al nucleo. Estos factores tienden a ejercer su funcion en el microambiente de la medula y junto con el estroma desempenan una funcion vital en la proliferation y diferenciacion celular. Se conoce que basta un bajo nivel de receptores a los que se una el factor para que este tenga efecto en la celula. En la Tabla 1 se muestran algunos de los factores de crecimiento mas importantes y su funcion. Las citocinas son proteinas solubles, polipeptidos o glicoproteinas con un peso molecular entre 6000 y 60,000 Daltones, que trasmiten senales de una celula emisora a otra celula receptora, la cual por lo general esta cercana de la primera, pero no necesariamente unida a ella. Esta ultima caracteristica las hace diferentes a las hormonas, las cuales pueden actuar en una forma sistemica porque se distribuyen por todo el cuerpo a traves de la circulation sanguinea. En cambio, el efecto de las citocinas generalmente es local, salvo el caso de IL-1, IL-6 y TNFa que pueden actuar a distancia cuando son producidas en grandes cantidades por celulas no linfoides (11,12). Los primeros estudios sobre estas proteinas comenzaron en los anos 50-70, la etapa de los anos 70 se caracterizo por la purification parcial de muchas citocinas individuales, se conocio que diferentes efectos estudiados eran provocados por la misma molecula. La edad de oro de las citocinas la constituyo la decada de los 80 que se caracterizo individuales, por la transfeccion genetica y la expresion de moleculas de citocinas asi como la sfntesis de anticuerpos monoclonales espetificos neutralizadores, en este periodo nuevas citocinas salieron a la luz. Se continuo investigando en los 90, los efectos particulares de cada citocina in vivo (13). Actualmente se han encontrado mas de 40 citocinas que se han agrupado en 1) « factores de crecimiento, 2) interleucinas, 3) interferones, 4) quimiocinas y 5) otras, dependiendo del tipo celular que la secreta. Y de acuerdo a su action en: 1) Mediadores de la inmunidad natural, 2) Mediadores de la actividad de los linfocitos, crecimiento y diferenciacion, 3) Reguladores de la inflamacion inmune y 4) Citocinas que estimulan la hematopoyesis (14). 15-20 14-30 15-19 21.5 21 - 2 8 25 8 JL-2 IL-3 IL-4 IL-5 IL-6 IL-7 IL-8 4 8q12-13 7p15 5q31 5q31 5q23-31 4q 2q LOC. CROM PRODUCTORA Monocitos, LT, fibroblastos, celulas endoteliales, epiteliales, queratinocitos, hepatocitos, condrocitos, neutrofilos. LT, monocitos, fibroblastos, hepatocitos, celulas endoteliales y neuronales. Celulas del estroma de medula osea, leucocitos. LT, celulas del epitelio timico, queratinocitos, celulas del estroma de medula osea. LT, macrofagos, bas6filos, LB, celulas del estroma de medula osea, mastocitos. LT, mastocitos Celulas endoteliales, piteliales, gliales y neuronales,monocitos, macrofagos, fibroblastos, queratinocitos. LT CtLULA BLANCO LT, neutrofilos, LB. LT y B, U F C - G M , U F C - G E M M , UFB-E, hepatocitos, celulas neuronales. LTy'B, UFC-GEMM, UFC-GM LT y B, mastocitos. LT LT Timocitos, celulas endoteliales, hipotalamo, higado, musculo, adipocito. CELULA BIOL6GICA Estimula el crecimiento y diferenciacion de eosinbfilos Posee efecto quimiotactico y activador de eosin6filos. Activa progenitores hematopoyeticos, induce crecimiento y diferenciacion de LT, LB, hepatocitos y celulas. del sistema nervioso, estimula la produccion de proteinas de fase aguda. Favorece la diferenciacion de L. pre B y LB. Estimula la proliferacion y la actividad citotbxica de LT y favorece la produccion de c6lulas Killer Actividad quimiotactica para neutrofilos, basofilos y LT. . Induce la adhesion de neutrofilos a celulas endoteliales Estimula la proliferacion y diferenciacion de LT. Favorece la action citolitica de NK y la Produccion de cel. LAK. Promueve la proliferacion y la secretion de IgG, de LB activados y ayuda a la sintesis de citocinas. Estimula la produccion y diferenciacion de macrbfagos, neutrofilos, eosinofilos, basofilos, mastocitos, megacariocitos y eritrocitos. Induce a la diferenciacion de Lth2, induce a la proliferacion y diferenciacion de los LB. Estimula la expresion de factores de crecimiento mediante otras cel. intervienen en la inflamacion, coagulation ACCI6N kDa, kilo Dalton; EPO, eritropoyetina; TPO, trombopoyetina; LOC C R O M , localization cromosomica ; FCH-G, factor de crecimiento hematopoyetico de granulocitos; FCH-GM, factor de crecimiento hematopoyetico granulo-monocitico; FCH-M, factores de crecimiento de monocitos; LT, linfocitos T; LB , linfocitos B: U F C - E , unidades formadoras de colonias eritroides; U F C - G E M M , unidad formadora de colonias mixtas; U F C - G M unidad formadora de colonias granulo-monciticas; UFB-E, unidad formadora de bursas eritroides. PESO MOL. (kDa) 17.5 INTERLEUCINA IL-1 Tabla 1. PRINCIPALES CARACTERISTICAS DE FACTORES DE CRECIMIENTO E INTERLEUCINAS 23 35 - 40 15 53-54 14 22 kD 18-22 45-70 IL-11 IL-12 1L-13 IL-14 1L-15 FCH-GM FCH-G FCH-M 4 -- -- -- -- -- - — -- LOC. CROM 5q31 -- - LT, macrofagos, neutr6filos, eosinofilos, fibroblastos, placenta, eel endoteliales, monocitos. Cel endo, mono, fibroblastos, macrofagos, neutro, LT. Medula osea, cel del estroma Macr6fagos, LT, eel endoteliales, mastocitos, neutrofilos, eosinofilos, fibroblastos. Cel endoteliales, musculares, placenta LT LT Macrofagos, LB Fibroblastos, trofoblastos, macrbfagos. LT. LT, macrofagos, queratinocitos CELULA P R O D U C T O R A Cel progenitoras, Basofilos, eosinofilos, neutrofilos, cel endoteliales, fibroblastos, blastos leucemicos Monocitos Eosinofilos, basofilos, neutr6filos, eritrocitos, cel progenitoras y leucemicas LB, U F C - G E M M , U F C - G M , UFC-E, UFB-E, megacariocitos, blastos leuc. LT, NK. UFB-E, U F C - G E M M Lin B , monocitos CELULA BLANCO Promueve el crecimiento y desarrollo de macrofagos. promueve el crecimiento y diferenciacion de cel. "stem" estimula todas las cel. del linajes granulocitico y a los macrofagos Favorece la diferenciacion y activacion de neutrofilos. Activa Lth 1. Estimula el crecimiento y la actividad de NK. Inhibe la produccion de citocinas inflamatorias. Induce el crecimiento y diferenciacion de Lb. Induce la proliferacion y la activacion de LB en reposo. Inhibe la secrecidn de Inmunoglobulinas Estimula la proliferacion y diferenciacion de LT. Favorece la action citolitica de cel NK y la producci6n de cel. LAK Favorece la hematopoyesis. Inmunosupresor de la actividad del macrofago. Promueve la proliferacion y la secretion de la Ig'G de LB activados. Favorece la megacariocitosis. Estimula la sintesis de proteinas de fase aguda. ACClON BIOL0GICA Activacion de progenitoras primitivas. Sinergiza con Fac. de crecimiento para estimular la formation de colonias en las etapas tempranas de la hematopoyesis EPO Rinon, Eritrocitos Promueve la produccion de eritrocitos, UFB-E. TPO Megacariocitos Estimula la maduracion de megacariocitos. Influye en la produccion de plaquetas. kDa, kilo Dalton; EPO, eritropoyetina; TPO, trombopoyetina; L O C C R O M , localization cromosomica ; F C H - G , factor de crecimiento hematopoyetico de granulocitos; FCH-GM, factor de crecimiento hematopoyetico granulo-monocitico; FCH-M, factores de crecimiento de monocitos; LT, linfocitos T; LB , linfocitos B: U F C - E , unidades formadoras de colonias eritroides; UFC-GEMM, unidad formadora de colonias mixtas; U F C - G M unidad formadora de colonias granulo-monciticas; UFB-E, unidad formadora de bursas eritroides c-KIT ligando IL-9 IL-10 PESO MOL. (kDa) 32 - 39 19 INTERLEUCINA Tabla 1 (CONTINUACION) Es muy importante senalar que recientes estudios han demostrado que el destino que han de tomar las celulas progenitoras hematopoyeticas depende de la manipulation de las citocinas y de los factores de crecimiento que estan en el medio, de ahi la gran importancia del conocimiento de los mismos. 1.2.- ANTIGENOS DE DIFERENCIACION CELULAR EN LA HEMATOPOYESIS Estos antigenos se encuentran en la superficie externa de la membrana de las celulas hematopoyeticas y son especificos de acuerdo a la etapa de diferenciacion en la que se encuentre la celula, por lo que sirven como marcadores de las mismas. Las celulas pueden presentar mas de uno de estos antigenos. Se sabe por ejemplo que las progenitoras mas indiferenciadas estan englobadas dentro de una pequena poblacion medular muy heterogenea que se caracteriza por tener los antigenos CD34 y CD90, a medida de que las celulas stem se van diferenciando hacia celulas precursoras estas van presentando otros antigenos los cuales conformaran asi su inmunofenotipo especifico, comentado anteriormente en la section 1.1.2. Otros de los marcadores que podemos encontrar en la membrana de las celulas y tambien puede formar parte de su inmunofenotipo, es el HLA (Human leukocyte antigen). Los genes del HLA estan situados en el cromosoma 6. un conjunto de estos genes, los genes HLA-A, HLA-B y HLA-C regulan el rechazo o aceptacion de trasplantes a traves de las proteinas HLA clase I. Esta es la base de la designation de genes en este cromosoma como parte del HLA. La primera description de estas proteinas de histocompatibilidad como antigenos leucocitarios humanos explica su designation como proteina HLA. Un seg'undo conjunto de genes de este mismo cromosoma regulan la capacidad de respuesta inmunitaria de un individuo. Estos son los genes de respuesta inmunitaria, los cuales determinan las proteinas de clase II productos de genes humanos DP, DQ y DR. El gen DR tiene cuatro subgenes que codifican para peptido beta y para peptido alfa. Es posible una considerable variation en el gen DR debido a que el peptido alfa puede acoplarse como cualquiera de los cuatro peptidos beta. El numero total de especificidades DP, DQ y DR todavia no se conoce por completo (5). La diferenciacion hacia las celulas HLA+ va asociada a la perdida de CD34 y al initio de la expresion de otros antigenos caracteristicos de estadios de diferenciacion mas avanzados. La Figura 2 ilustra los antigenos mas conocidos de las celulas progenitoras y precursoras. •f 90 34* w123 45 R A 33 GlyC L /» 34 45 RA w123 DR Figura 2.- ANTIGENOS DE PROGENITORAS Y DIFERENCIACION PRECURSORAS. DE LAS CELULAS 1.3.- ANTICUERPOS MONOCLONALES Hace aproximadamente un siglo, Erlich (15) estudio el sistema inmune y postulo la potencial actividad de los anticuerpos (Acs) frente al cancer, denominandolos "magicbullets" (balas magicas). Los anticuerpos monoclonales (AcMo) son Acs producidos por una clona unica de celulas B, a diferencia de los Acs policlonales, los AcMs son monoespecificos y homogeneos, siendo muy eficaces para el desarrollo de nuevas terapias y metodos diagnosticos. En 1975, Kohler y Milstein (16) desarrollaron la tecnica de los hibridomas, que permitio la obtencion de AcMs frente a un antigeno (Ag) determinado en grandes cantidades. Demostraron que, aun siendo imposible cultivar linfocitos productores de Acs (obtenidos del bazo de ratones previamente inmunizados con el Ag) fuera del cuerpo humano, estos se podian inmortalizar mediante la hibridacion con lineas celulares de mieloma, obteniendo los hibridomas. La inmunizacion de ratones, primer paso en la via anteriormente descrita, actualmente ya no es necesaria al disponer de tecnicas de inmunizacion de linfocitos o esplenocitos in vitro, por lo cual se les concedio el Premio Nobel de Medicina y Fisiologia en 1984. Actualmente los AcMs pueden obtenerse mediante tecnicas de ingenieria genetica (17). 1.4.- FUENTES DE CELULAS TALLO Y SUBPOBLACIONES CELULARES La obtencion tanto de las celulas tallo como de las diferentes subpoblaciones celulares derivadas de ellas, puede ser de tres fuentes: la medula osea, movilizandolas de la medula osea hacia la sangre periferica (CMSP) mediante factores de crecimiento y de la sangre de cordon umbilical humano. Es importante mencionar que en nuestro estudio solamente utilizamos CMSP y celulas de SCHU. 1.4.1-Medula Osea El tejido productor de la sangre localizado entre las trabeculas del hueso esponjoso se conoce como medula osea. En el humano, este importante tejido ocupa un volumen de 30 a 50 mL/Kg de peso corporal y esta compuesto por dos principals compartimentos, el hematopoyetico y el vascular, donde el compartimiento hematopoyetico es el sitio de formation y maduracion de celulas sanguineas, aqui se encuentran tambien las celulas estromales. Las celulas hematopoyeticas son solo residentes pasajeros de la medula y cuando maduran, se movilizan hacia los senos, estas celulas maduras atraviesan la barrera celular endotelial del seno y al cabo del tiempo logran llegar a la sangre periferica por medio del compartimiento vascular (5). La medula osea esta compuesta por medula roja hematopoyeticamente activa y la medula amarilla grasa hematopoyeticamente inactiva. La primera se encuentra adyacente al endocito; contiene tanto precursores mieloides como eritroides, con una relation normal mieloide: eritroide de 1.5:1 a 4:1 la medula amarilla grasa ocupa la cavidad central, rodea los vasos sanguineos y esta compuesta por adipocitos. La celularidad de la medula osea hematopoyetica se mide en terminos relativos como el porcentaje de medula roja hematopoyetica de la celularidad total de la medula osea. En los adultos aproximadamente la mitad de la medula es roja y la otra mitad es amarilla. Por lo tanto, la celularidad normal es del 50%. Durante los primeros cuatro anos de vida, casi todas las cavidades medulares estan compuestas por medula roja hematopoyetica. Despues de esa edad, la medula roja en la cavidad de huesos largos se reemplaza de manera gradual por tejido graso amarillo. La irrigation vascular de la medula osea es proporcionada por una arteria nutriente y una vena Jongitudinal central, la cual atraviesa el hueso a traves de la foramina osea y abarca la cavidad medular. La arteria nutriente se ramifica y se curva alrededor de la vena longitudinal central. Las arteriolas irradian hacia fuera, desde la arteria nutriente hacia el endocito. Otra fuente de sangre arterial para la medula son los capilares periostiales. Estos capilares periostiales y las ramificaciones de la arteria nutriente forman una union con los senos venosos, en el momento en que los capilares regresan a la medula. Los senos, delineados por celulas endoteliales unicas, se reunen dentro de senos colectores mas amplios, los cuales entran en la vena longitudinal central; esta vena continua a lo largo de la medula osea y sale a traves de la foramina, donde ingresa la arteria nutriente, la vena central se conoce como vena concomitante. Aun se desconoce el mecanismo por el cual la celula hematopoyetica madura realiza su viaje desde los cordones hematopoyeticos mas alia de la barrera de la pared sinusal dentro del seno ganando asi acceso hacia la sangre. La utilization de los factores de crecimiento en combination apenas empieza a evaluarse. La terapeutica con lnterleucina-3 (IL-3) y el factor estimulador de coloniasgranulo-monociticas (FEC-GM) produce un aumento espectacular de las celulas progenitoras en la sangre periferica, por tanto, este podria utilizarse para aumentar las celulas progenitoras de los pacientes despues de una quimioterapia muy intensa a altas dosis. El examen de la medula osea es importante en el diagnostico y la vigilancia de una amplia variedad de trastornos hematologicos que incluyen la leucemia aguda, los sindromes mielodisplasicos y otros trastornos proliferativos. El aspirado de la medula osea con uso de una aguja de Jamshidi o de una aguja de Illinois o ambas.(19 ,31,97) en el adulto y en la mayoria de los ninos, asi como la biopsia de la medula osea se pueden obtener facilmente de la cresta iliaca posterosuperior. De manera alterna, en el adulto se puede obtener aspirado de medula osea del esternon con el uso de la aguja de Illinois, aunque no puede obtenerse una biopsia de medula osea de este lugar. En los ninos hay dos sitios adicionales de donde puede obtenerse un aspirado de MO, de la tibia en los menores de dos anos de edad o de las apofisis espinosas de los segmentos vertebrales mas prominentes (18,19). La preparation de la medula osea para su donation en transplantes es mediante factores de crecimiento. El uso de los factores de crecimiento logra acelerar la recuperation de los neutrofilos en pacientes sometidos a transplante autologo o alogenico de medula osea, con lo cual reduce la morbilidad que acompana a la neutropenia. La eritropoyetina tambien esta bajo estudio para el tratamiento de estos pacientes. Parece ser que el uso clinico de factores de crecimiento hematopoyetico permitira manipular y regular todo el sistema hematopoyetico. 1.4.2.- Celulas Movilizadas a la Sangre Periferica (CMSP) El adulto tiene en promedio aproximadamente 3 Kg (de 1.5 a 4 Kg) de medula osea, la cual es el organo mas grande dentro del cuerpo superando al higado tanto en peso como en volumen. Cerca de la mitad de la medula osea es hematopoyeticamente activa. La medula llena por completo la diafisis de los huesos largos y es divisible en dos porciones distinguibles la medula blanca o amarilla y la medula roja.. La medula blanca consiste en principalmente en celulas grasas y tiende a estar colocada en una position mas central. En la medula roja los percusores de eritrocitos estan mezclados junto con celulas precursoras de linfocitos, granulocitos y monocitos. Los factores estimuladores de colonias provenientes de los macrofagos, fibroblastos, linfocitos T y otras celulas son necesarios para la maduracion y diferenciacion de estas celulas. La actividad de 'estas sustancias fue observada por primera vez en cultivos celulares. Estos estimulan a la medula osea para que las celulas aun en estadio inmaduro salgan a la sangre periferica (5). Dado que la mayoria de las formas de fracaso de la medula osea o de los trastornos neoplasicos son trastornos de celulas madre, existe un gran interes por los mecanismos fisiologicos que regulan la proliferacion y diferenciacion de las celulas progenitoras. En estos procesos participan tanto factores solubles como las celulas del estroma de la medula osea. Entre los factores de crecimiento hematopoyetico, el factor de las celulas madre, tambien conocido como c-kit ligando, actua sobre la celula madre progenitora. Otros como el factor estimulador de colonias de granulocitos y macrofagos actuan sobre la CFU-GM. Debido a que se han clonado los genes de la mayoria de los factores de crecimiento, pueden generarse grandes cantidades de proteinas recombinantes. Algunos factores recombinanates se utilizan en la actualidad para estimular la hematopoyesis, en este grupo se incluyen la eritropoyetina, el GM-CSF y el G-CSF (20). La medula osea no es solo un reservorio de celulas madre si no que proporciona un microambiente unico en el cual tiene lugar la proliferacion y diferenciacion ordenada de las celulas precursoras. Ademas regula la liberation de celulas completamente diferenciadas a la circulation. La medula osea parece ser una basta red de sinusoides de pared fina revestido de una monocapa de celulas endoteliales. Existe una membrana basal, y celulas de la adventicia, pero forma una capa discontinua fuera del endotelio. Entre la red de los sinusoides se situan celulas hematopoyeticas y adipositos. Las celulas sanguineas diferenciadas entran en los sinusoides por migration transcelular a traves de las celulas endoteliales y posteriormente pasar a la circulation general (21). Los concentrados de CMSP y SCUH son de gran utilidad clinica debido a que estos contienen una gran cantidad de celulas progenitoras hematopoyeticas las cuales tienen la capacidad para diferenciarse y autoperpetuarse, suma importancia en el campo clinico ya que esa cualidad las hace de incrementan la hematopoyesis en el individuo que ha sido expuesto a una quimioterapia, asi mismo para curar desordenes hematologicos de pacientes. Las CMSP son obtenidas de pacientes normales mediante la aplicacion de un factor de crecimiento el cual induce a una hematopoyesis acelerada dando como resultado la salida de celulas en estadio inmaduro a sangre periferica, la recoleccion de estas celulas se hace mediante aferesis de flujo continuo, obteniendo asi un paquete de CMSP. Los factores de crecimiento logran acelerar la estimulacion de la medula osea, se ha utilizado la IL-3 para la insuficiencia de la medula osea, asi mismo la eritropoyetina esta bajo estudio para el tratamiento. La terapeutica con IL-3 y FEC producen un aumento espectacular de las celulas progenitoras de la sangre periferica (2). 1.4 3.- Sangre de Cordon Umbilical Humano (SCUH) La linea de reflexion entre el amnios y el ectodermo embrionario es ovalada y se denomina anillo umbilical primitivo. En la quinta semana de desarrollo pasan por este anillo las siguientes estructuras: a) el pediculo de fijacion que incluye a la alantoides y los vasos umbilicales que consisten en dos arterias y una vena b) el pediculo del saco vitelino acompanado por los vasos vitelinos y c) el conducto que comunica las cavidades celomicas intraembrionaria y extraembrionaria. Durante el desarrollo ulterior la cavidad amniotica crece rapidamente a expensas de la cavidad corionica y el amnios comienza a envolver a los pediculos de fijacion y del saco vitelino, agrupandolos y formando el cordon umbilical primitivo. En sentido distal el cordon comprende entonces el pediculo del saco vitelino y los vasos umbilicales. En sentido proximal incluye algunas asas intestinales y el resto de la alantoides. Estas asas intestinales forman la llamada hernia umbilical fisiologica. El cordon umbilical mide aproximadamente entre 30 y 60 cm de largo pero se han llegado a encontrar algunos que miden 150 cm de longitud. Se inserta en la cara fetal de la placenta en situation central o excentrica. Su diametro es de 1 a 1.5 cm, de color blanquecino mate, generalmente retorcida en espiral y con pliegues en forma de nodulos llamados Hoboken. Posee dos arterias y una vena de gran calibre que se aprecian por transparencia, de un color azul oscuro, posee una muscular propia, que se halla incluida en un tejido mesenquimatOso llamado Gelatina de Wharton. Entra las dos arterias hay una anastomosis, cerca de la superficie placentaria conocida como Dyrtl. La cubierta externa delgada y rigida que le proporciona el amnios facilita la circulation sanguinea. La sangre de cordon umbilical despliega las caracteristicas de la sangre fetal, la cual provee la nutrition para el desarrollo del feto durante el embarazo. Durante los ultimos dias de la gestation un gran numero de celulas progenitoras hematopoyeticas estan presentes, no solo en la medula osea sino en la circulation del feto. La sangre de cordon umbilical despliega las caracteristicas de la sangre fetal, la cual provee la nutrition para el desarrollo del feto durante el embarazo. Durante los ultimos dias de la gestation un gran numero de celulas progenitoras hematopoyeticas estan presentes, no solo en la medula osea sino en la circulation del feto (22, 23) Hace algunos anos, los cientificos se percataron que en un sistema animal de experimentation, concentraciones la sangre de los animates recien nacidos contenia altas de celulas que al ser transplantadas eran capaces de regenerar la hematopoyesis. Este trabajo se extendio a la sangre de cordon umbilical humano, y se observo que las celulas de cordon tenian un potential substantial para ser utilizadas en transplante (24) La presencia de celulas progenitoras hematopoyeticas en la SCUH se demostro por primera vez en los anos 70's (25) diez anos mas tarde se demostro la presencia de celulas progenitoras hematopoyeticas primitivas. Sin embargo no fue hasta el ano de 1988 cuando Gluckman realizo el primer transplante de estas celulas de SCUH entre hermanos HLA identicos, para tratar a uno de ellos con anemia de Fanconi (26). Desde entonces, el conocimiento de las caracteristicas biologicas de las celulas progenitoras en la SCUH ha aumentado y las ventajas de su utilization para el transplante son cada vez mayores. El exito del transplante de progenitores hematopoyeticos de SCUH initio un campo nuevo de posibilidades en el dominio de los transplantes de progenitores hematopoyeticos alogenicos, ademas la SCUH contiene una cantidad suficiente de progenitores hematopoyeticos para reconstituir el comportamiento linfohematopoyetico del receptor. La principal desventaja de esta fuente es su bajo volumen de muestra de una unidad de SCUH. Esto ha dificultado su uso en adultos, sin embargo, la expansion celular ex vivo y el empleo de varias unidades en un mismo receptor parece constituir alternativas viables (27- 30). 1.5.- MICROSCOPIA DE EPIFLURESCENCIA Se define como luminiscencia a la emision de luz que no es causada por el aumento de temperatura del objeto que la emite. Un ejemplo es la fotoluminiscencia que aparece en especimenes vivos o no, organicos o inorganicos que absorben la luz y luego la emiten. Cuando esta emision persiste por un tiempo luego de interrumpir la iluminacion, por el fenomeno es conocido como fosforescencia, termino derivado del fosforo, elemento que presenta este fenomeno. Si la emision cesa al interrumpirse la iluminacion, el fenomeno es conocido como fluorescencia, palabra acunada en 1852 y que proviene de la fluorita (fluoruro de calcio, CaF2) que exhibe este fenomeno. La microscopia de epifluorescencia se basa practicamente en un procedimiento similar al de la microscopia optica convencional, excepto por que la luz incidente, procedente de una lampara de gran intensidad de iluminacion, atraviesa dos o mas series de filtros-uno intercepta la luz antes de que llegue ala muestra y el otro filtra la luz obtenida a partir de la muestra-. El primer filtro (llamado de excitation) se selecciona para permitir solo el paso de la luz con longitudes de onda que excitan a un determinado fluoroforo, el segundo filtro (llamado de barrera), bloquea esta luz esta luz y permite el paso de las longitudes de onda emitidas por el fluoroforo excitado. El fluoroforo absorbe la luz de una determinada longitud de onda (espectro de excitation) y la emite a otra longitud de onda mas larga (su espectro de emision), .por lo tanto, cuando es iluminada a su longitud de onda de excitation y observada a traves de un filtro que solo permite pasar la luz con la longitud de onda emitida, la sustancia aparecera brillante sobre un fondo obscuro generando asi una imagen de alto contraste. La intensidad y el color de la luz emitida son caracteristicos de la molecula fluorescente. Frecuentemente, la microscopia de epifluorescencia se utiliza para detectar moleculas a las que se les ha unido quimicamente un fluoroforo. Por ejemplo, ciertos fluoroforos pueden asociarse con anticuerpos. Lo que permite que se asocien selectivamente a otras macromoleculas Habitualmente, de las celulas, tornandolas fluorescentes. se utilizan con esta finalidad la fluoresceina, que cuando es excitada por la luz azul emite fluorescencia amarillo-verdosa intensa y la rodamina, que cuando > es excitada con luz verde-amarilla emite fluorescencia de color rojo intenso. Acoplando la fluoresceina a un anticuerpo monoclonal y la rodamina a otro, puede determinarse la distribution de dos antigenos diferentes en la misma celula, ya que las dos marcas son detectadas separadamente en el microscopio, cambiando las dos series de filtros de modo de hacerlos especificos para cada fluorocromo (31). En el presente trabajo los fluoroforos utilizados fueron la rodamina y el isotiocianato de fluoresceina (FITC) estos fluoroforos presentan diferentes niveles de excitation y de emision (Tabla 2). Tabla 2. FLUOROFOROS MAS EPIFLUORESCENCIA. COMUNES EN MICROSCOPIA DE Fluoroforo Excitacion (nm) Emision (nm) Fluoroforo Excitacion (nm) Emision (nm) Fluor de Alexa 346 442 Azulcascada 372 456 lndo-1 350 405/480 BFP 380 440 Amarillo diabolico 430 535 GFP 488 507 CFP 433/455 475/501 FITC 490 520 Naranja de acridina 490 530/640 TRITC 541 572 Calceina 495 520 Dil 550 565 Rodamina 500 540 Fluoresceina 500 520 Verde de calcio 506 526 Cy3 552 565 YFP 513 527 Rojo Texas 596 620 Azul de Evans 550 675 Cy5 650 667 nm, nanometres. 1.6.- PLAtiTEAMIENTO DEL PROBLEMA Mayani et al (8) realizaron un estudio funcional cuantificando y caracterizando diferentes subpoblaciones con anticuerpos especificos por citometna de flujo, observando asi tres diferentes precursores: CD34+/ CD45RA low / CD71 low para la serie mixta, CD34+/ CD45RA+/CD71 low para la serie mieloide y CD34+/ CD45RA low / CD71+ para la eritroide. Kinniburgh D et al (32) realizaron un estudio comparativo por citometna de flujo entre SCHU y MO cuantificando la expresion de celulas CD34+ y CD34+/ CD45RA+, encontrando un mayor porcentaje de ambas en las muestras de SCUH respecto a las de MO. G. Fritsch et al (33) efectuaron un estudio comparativo utilizando los marcadores CD34+/ CD45RA+ entre las muestras de CMSP movilizadas con diferentes factores de crecimiento, MO y SCUH, encontrando un mayor indice de estas celulas en la CMSP versus MO y en contraste un menor numero de UFC-GM en CMSP versus SCUH. Mayani y Lansdorp (34) realizan un estudio de celulas de SCUH en el cual identifican diferentes antigenos para diferentes subpoblaciones hematopoyeticas y posteriormente las expanden en un cultivo a largo plazo observando su capacidad de expansion, entre las principales subpoblaciones encontradas fueron, CD34+/ CD45RA+/ CD71 low, CD34+/CD45RA low / CD71 + y CD34+/ CD45RA low / CD71 low. Fritsch et al (35) realizaron un estudio comparativo entre MO, CMSP y SCUH mediante citometna de flujo con los antigenos CD34 y el CD45RA. Encontrando diferencias cuantitativas entre las muestras, como un mayor porcentaje de CD34+ totales en MO y menor proportion de estas en CMSP y SCUH, pero un mayor porcentaje de celulas CD34+/CD45RA+ en SCUH respecto a las de MO y CMSP. D'Arena Giovanni et al (36) evaluaron el perfil fenotipico de los progenitores CD34+ en SCUH en base a los antigenos CD33, CD13, CD71, CD45RA, CD117, CD14, CD15 and CD41. Si bien encontraron un elevado porcentaje (40%) de celulas CD34+ CD45RA+, concluyeron que al igual que en MO y CMSP el fenotipo de celulas CD34+ es absolutamente heterogeneo. .Al comparar los reportes previos podemos observar resultados discordantes \ respecto a las cantidades de las subpoblaciones hematopoyeticas entre las muestras de SCUH y CMSP. Por tal motivo y considerando ademas que en la actualidad en nuestro pais existe muy poca information reportada sobre el tema, en el presente trabajo, mediante el estudio comparativo de las subpoblaciones existentes en SCUH y CMSP pretendemos obtener datos estadisticos que puedan servir como valores de referencia y puedan ser utilizados para futuros estudios relacionados con el tema. 2.- O B J E T I V O S 2.1.- OBTENER VALORES DE REFERENCIA PARA LAS CD34+, CD45RA+ Y CD71+, ASI COMO PARA CELULAS TOTALES: LAS SUBPOBLACIONES: CD34+/CD45RA+, CD34+/CD71+ Y CD45RA+/CD71+ CUANTIFICADAS EN LAS MUESTRAS DE CMSP Y SCUH. 2.2.-COMPARAR OBTENIDOS ESTADISTICAMENTE EN AMBAS LOS VALORES DE REFERENCIA MUESTRAS IDENTIFICANDO ASI LA MUESTRA MAS ADECUADA PARA FUTUROS ESTUDIOS RELACIONADOS CON LAS SUBPOBLACIONNES HEMATOPOYETICAS. 3.- H I P O T E S I S 3.1.-EXISTE UNA MAYOR CANTIDAD DE SUBPOBLACIONNES CELULARES HEMATOPOYETICAS EN LAS MUESTRAS DE SCUH, COMPARADAS CON LAS DE CMSP. 3.2.-LA SCUH ES LA OPTIMA PARA FUTUROS ESTUDIOS RELACIONADOS CON LAS SUBPOBLACIONES HEMATOPOYETICAS 4.- M A T E R I A L E S Y M E T O D O S 4.1. - OBTENCION DE MUESTRAS 4.1.1.- Muestras de SCUH Se emplearon un total de 60 muestras de sangre de cordon umbilical humano de productos sanos. Las muestras fueron obtenidas del area de Ginecologia del Hospital General Dr. Manuel Gea Gonzalez, los criterios de exclusion para las muestras fueron: a ) Madres no clinicamente sanas b ) Productos no clinicamente sanos c ) Productos no a termino de gestation Los cordones fueron obtenidos con el consentimiento de la madre y bajo los lineamientos del Comite de Etica de la Institucion. 4.1.2.- Muestras de CMSP de alodonadores. Se emplearon un total de 15 muestras de celulas movilizadas a sangre periferica de alodonadores. Las muestras fueron obtenidas del Instituto Nacional de Cancerologia bajo los criterios de la Unidad de Transplante. Este numero de muestras se considero en base a que en el Instituto se hacen un promedio estimado de 15 transplantes al ano. Las muestras Institucion. fueron obtenidas bajo los lineamientos del Comite de Etica de la 4.2.- FASE DE ESTANDARIZACION 4.2.1.- Procesamiento de las muestras de SCUH Para esta fase se emplearon 30 cordones con los cuales se estandarizo lo siguiente: a ) Obtencion de la SCUH: No obstante que el "metodo cerrado" (obtencion de la sangre por medio de puncion y recoleccion en bolsas de alodonador) es el mas citado, nosotros optamos por el "metodo de goteo" debido a que al querer sangre exclusiva del cordon, el primer metodo no es el mas adecuado debido a que se mezclan tanto la sangre de cordon como la materna, mientras que por goteo se obtiene exclusivamente sangre de cordon. b ) Concentrado leucocitario pobre en plaquetas (buffy-coat-lp): Se estandarizo la centrifugacion mas conveniente para la obtencion de una poblacion mas heterogenea y un volumen mayor de leucocitos libre de plaquetas, para obtener frotis mas adecuados. c ) Cantidad de pL por frotis: En esta fase comparamos diferentes volumenes (pL) de buffy-coat-lp en frotis separados para elegir el mas conveniente, de acuerdo a la distribution celular mas adecuada en el frotis. 4.2.2.- Obtencion de la SCUH a) Seleccionar a la madre. b ) Una vez que el medico extrae la placenta con el cordon pinzado se procede a: c) Pinzar el cordon umbilical en la parte mas proxima a la placenta d) Limpiar el cordon umbilical con agua destilada y esterilizada. e) Seccionar el cordon por la parte mas proxima a la placenta. f ) Extraer la sangre del cordon por gravedad y mediante goteo, depositar 4.5 ml_ de la SCUH en tubos de 13 x 100 mm con anticoagulante EDTA. g ) Procesar la muestra en los primeros 60 min para obtener el buffy-coat-lp. 4.2.3.- Concentrado leucocitario pobre en plaquetas (buffy-coat-lp) Este procedimiento fue necesario ya que al principio se observaba un gran numero de plaquetas en los frotis y lo que podia alterar los resultados al propiciar un pegado inespecifico de los anticuerpos. Nosotros quisimos mantener nuestros frotis lo mas limpios posibles. Procedimiento: a) Centrifugar la muestra de SCUH a 600 rpm por 5 min, para la obtencion del plasma rico en plaquetas y el buffy-coat-lp. b) Centrifugar el plasma rico en plaquetas por 5 min a 3000 rpm c) Separar el plasma libre de plaquetas d ) Tomar el buffy-coat-lp y centrifugarlo a 3000 rpm por 10 min en tubo de Wintrobe a 2500 rpm. e) Lavar el buffy-coat-lp con solution de cloruro de amonio al 3% - EDTA al 0.05% para eliminar la presencia de eritrocitos. f ) Resuspender el buffy-coat-lp en el plasma libre de plaquetas para el frotis. g ) Realizar frotis con 12 pL de buffy-coat-lp en cubre objetos de 1 8 x 1 8 mm. 4.3.- FASE DE ANALISIS 4.3.1.- Estudio inmunofenotipico de las muestras Se analizaron 15 muestras de CMSP y 30 de SCUH por microscopia de epifluorescencia. Utilizando en cada caso 10 pL por frotis de anticuerpos monoclonales marcados con FITC (BECTON-DICKSON) dirigidos contra los antigenos CD45RA y CD71, asi como el AcMo marcado con ficoeritrina (PE) dirigido contra el CD34. Para identificar adecuadamente a las celulas negatives se utilizo el fluorocromo nuclear DAPI y para controlar la fluorescencia inespecffica se utilizo la mezcla de AcMo y1-FITC / y2PE. En todos los casos se realizaron dobles marcajes, esto es, se busco identificar los siguientes inmunofenotipos: • CD34+/45RA+. Para observar celulas precursoras de la serie granulocitica. • CD34+/CD71+.Para observar celulas precursoras de la serie eritroide. • CD45RA+/CD71+. Para observar celulas precursoras de la serie mixta. Asi como sus correspondientes combinaciones negativas 4.3.2.- Procedimiento 1. - Realizar el frotis de paquete leucocitario (12 pL de muestra). 2. - Agregar 10 pL del anti-CD34-PE (primer Ac) en camara humeda por 40 min. 3. - Lavar el frotis con agua bidestilada. 4. - Agregar 10 |jL del anti-CD45RA-FITC o del anti-CD71-FITC (segundo Ac) en camara humeda por 40 min. 5. - Lavar el frotis con agua bidestilada 6. - Agregar 0.5 pL de DAPI y dejarlo 2 H en camara humeda. 7. - Lavar el frotis y montarlo. . 8.- Leer las muestras con el microscopio de epifluorescencia con el objetivo de 100x, contando 500 celulas / frotis en todos los casos. 5.- R E S U L T A D O S La forma en la que se obtuvo el cordon umbilical humano asi como su correspondiente SCUH, se ejemplifica en las Figuras 3 y 4 respectivamente. La manera en que se concentran las celulas por aferesis de flujo continuo se ejemplifica en la Figura 5. Los resultados de las 30 muestras de SCUH y de las 15 de CMSP analizadas, se muestran en las Tablas 3 a 14. Finalmente, en la Figura 6 se muestra un caso representative con celulas CD34+ y CD34+/CD45RA+. A) B) Figura 3. CASO REPRESENTATIVO DE LA SECUENCIA DE OBTENCION DEL CORDON UMBILICAL HUMANO. A) B) Figura 4. CASO REPRESENTATIVO DE LA SECUENCIA DE OBTENCION DE LA SANGRE DE CORDON UMBILICAL HUMANO (SCUH). Figura 5. CASO REPRESENTATIVO DE LA FORMA EN QUE SE R E A U Z A LA AFERESIS DE FLUJO CONTINUO. Tabla 3. DATOS GENERALES SOBRE LAS CMSP MUESTRA ft 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 LEU-PRE (x 10%L) 35.5 35.9 45.1 40.8 30.8 63.0 44.6 39.1 35.3 28.4 32.8 34.2 37.4 16.2 48.1 LEU-POS (x 10%L) 38.2 29.9 49.8 35.9 21.1 50.1 28.9 29.2 28.2 21.0 25.5 27.1 11.3 44.5 COSECHA (x 10 9 /L) 314 370 381 314 346 303 774 381 406 329 422 192 352 425 66 VIABILIDAD (%) 92.7 95 97 98 98 96 100 99 100 98 96 88 VT (mL) 60 100 60 60 58 30 60 56 55 77 58 58 70 70 9 .EU-PRE, leucocitos precosecha; LEU-POS, leucocitos postcosecha; C O S E C H A , C M S P x 10 /L movilizadas con FEC-G y ecolectadas por aferesis de flujo continuo; VIABILIDAD, porcentaje de leucocitos vivos; V T , volumen total obtenido de la nuestra en mililitros. Tabla 4. DATOS GENERALES SOBRE LOS CORDONES UMBILICALES CORDON # LONGITUD (cm) VT (ML) 1.2.3.4.5.6.78.9.10.11.12.13.14.15.16.17.18.1920.21.22.2324.25.26.27.28.29.30.- 10 12 10 9 15 8 12 12 10 15 15 12 8 7 10 . 09 10 13 14 8 5 15 8 12 8 10 9 10 10 14 10 12 9 9 14 8 11 12 10 15 15 15 8 7 10 9 10 12 14 8 5 15 8 10 8 10 10 9 10 14 L O N G I T U D , longitud del cordon umbilical. LT x 10 3 / ML 12.6 20.1 14.1 17.2 24.5 7.48 24.5 8.37 10.4 24.5 11.7 12.2 11.3 10.5 15.3 7.68 12.8 13.2 15.9 14.5 9.90 11.8 11.4 17.4 17.3 17.4 18.0 18.2 14.1 13.4 GESTACION (semanas) PARTO (N o C) EDAD* (anos) 40.0 40.3 37.4 38.5 39.3 38.6 38.0 40 0 38.0 40,1 41.0 39.4 38.6 38.0 40.0 41.0 41.3 40.0 41.1 40.0 41.0 40.2 41.0 38.5 38.0 39.1 40.0 38.3 40.0 41.5 N N N N C C C N C N N N N N C N C N N C N N N N C N N N N N 19 26 37 36 15 32 38 34 21 18 26 26 19 22 32 30 30 29 38 35 35 21 19 18 20 20 23 20 18 27 VT, volumen total de S C U H obtenido por goteo; itotales cuantificados en las muestras de SCUH; N. normal; LT, leucocitos C, cesarea. * corresponde a la edad de la madre. Tabla 5. PORCENTAJES DE LAS DIFERENTES EN LAS MUESTRAS DE CMSP. tA SUBPOBLACIONES ESTUDIADAS CD34+ CD45RA- CD34+ CD45RA+ CD45RA+ CD34- CD34CD45RA- CD34+ CD71- CD34+ CD71+ CD71+ CD34- CD34CD71- CD45RA+ CD71- CD45RA+ CD71+ CD71 + CD45RA- 0.2 0.4 0.4 0.4 0.6 0.2 0.2 0.2 0.4 0.4 0.2 0.4 0.6 0.4 0.6 0.8 0.6 1.0 0.4 0.4 0.8 0.6 0.8 0.8 0.4 0.4 0.8 1.0 0.8 0.4 82 82 83 78 81 80 80 74 73 78 80 77 84 78 80 7.0 7.0 15.6 21.2 18.0 19.0 19.2 25.0 25.8 21.2 19.4 21.8 14.4 20.8 19.0 0.4 0.4 0.4 0.4 0.4 0.4 0.2 0.2 0.4 0.4 0.4 0.4 0.6 0.2 0.4 0.4 0.6 0.4 0.2 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.2 0.4 0.4 0.6 0.8 0.4 0.4 0.6 0.4 0.8 0.4 0.4 0.4 0.6 0.6 0.4 0.4 98.8 98.2 98.4 99.0 98.8 98.6 99.0 98.6 98.8 98.8 98.8 98.6 98.4 99.2 98.8 83 81 82 77 80 80 79 73 72 77 80 78 83 77 79 0.4 0.4 0.4 0.4 0.6 0.4 0.4 0.4 0.6 0.8 0.4 0.4 0.8 0.4 0.8 0.4 0.6 0.4 0.4 0.4 0.4 0.4 0.6 0.4 0.4 0.4 0.4 0.4 0.4 0.4 . CD45R CD71 16.2 18.0 17.2 22.2 19.0 19.2 20.2 26.0 27.0 21.8 19.2 21.2 15.8 22.2 19.8 Tabla 6. PORCENTAJES DE LAS DIFERENTES SUBPOBLACIONES ESTUDIADAS EN LAS MUESTRAS DE SCUH •N CD34+ CD45RA- 0.6 0.8 0.8 0.8 0.8 1.2 0.8 0.4 0.8 0.8 0.8 0.6 0.8 0.8 • 0.8 0.8 0.4 0.8 0.8 1.2 0.4 0.8 0.8 0.8 0.6 1.2 1.2 0.8 0.8 0.8 CD34+ CD45RA+ 1.6 0.8 0.8 0.8 0.8 1.2 1.6 1.21.2 1.2 1.6 0.8 1.6 0.8 0.8 1.2 0.8 1.6 1.2 1.2 0.8 1.6 0.8 1.2 1.2 1.2 1.2 0.8 1.2 0.8 CD45RA+ CD34- 92 90 88 86 90 87 91 78 91 90 90 88 84 88 88 . 86 88 84 87 90 80 84 85 89 87 90 92 89 86 88 CD34CD45RA- CD34+ CD71- CD34+ CD71+ CD71+ CD34- CD34CD71- CD45RA+ CD71- CD45RA+ CD71+ 5.8 8.4 10.4 12.4 8.4 10.6 6.6 20.4 7.0 8.0 7.6 10.6 13.6 10.4 10.4 12.0 10.8 13.6 0.6 0.8 0.8 0.8 0.8 1.0 0.8 0.4 0.8 0.8 0.8 0.4 0.8 0.8 0.8 0.8 0.4 0.8 0.6 1.0 0.4 0.8 0.8 0.8 0.8 1.0 1.2 0.8 0.8 0.6 0.8 0.8 1.2 0.6 0.8 0.8 0.8 0.8 0.8 . 0.8 0.4 0.8 0.8 0.6 0.8 0.8 0.4 0.8 0.8 1.0 0.8 0.8 0.8 0.8 0.6 1.2 0.8 0.8 0.4 0.4 0.6 0.8 0.6 0.8 0.4 1.0 0.8 1.2 0.8 0.8 0.4 0.8 0.4 0.4 0.8 0.8 0.8 0.6 0.8 0.8 0.8 0.4 0.4 0.4 0.4 0.4 0.8 0.8 0.6 0.4 98.0 97.6 97.4 97.8 98.0 97.2 97.6 97.6 97.6 97.6 98.4 98.0 98.0 98.2 97.6 97.6 98.4 97.8 97.8 97.2 98.0 98.0 98.0 98.0 98.2 97.4 97.2 97.6 98.2 98.6 93 92 89 85 88 85 92 80 83 91 88 86 87 87 85 87 86 84 84 88 78 85 86 88 82 91 91 89 85 89 0.8 1.2 0.8 0.4 1.0 0.8 1.2 0.8 1.2 0.8 0.4 1.0 1.2 0.6 0.8 0.8 1.2 0.8 1.0 0.8 0.8 1.2 0.8 0.8 1.0 0.8 1.2 0.8 0.8 0.8 11.0 7.6 18.8 13.6 13.4 9.0 11.2 7.6 5.6 9.4 12.0 10.4 CD71 + CD45RA- 0.8 0.6 0.4 0.8 0.6 0.8 0.8 0.8 0.6 0.6 0.6 0.8 .0.6 0.4 0.8 0.8 0.8 0.6 0.6 0.6 0.4 0.6 0.6 0.8 0.8 0.4 0.8 0.6 0.8 0.6 CD45RACD71- 5.4 6.2 9.8 13.8 10.4 13.4 6.0 18.4 15.2 7.6 11.0 12.2 11.2 12.0 13.4 11.4 12.0 14.6 14.4 10.6 20.8 13.2 12.6 10.4 16.2 7.8 7.0 9.6 12.4 9.6 Tabla 7. CANTIDAD DE LAS DIFERENTES SUBPOBLACIONES EN EL VOLUMEN TOTAL DE SCUH DE LOS CORDONES ANALIZADOS. *DON # 1.2.3.4.5.- •6.7.- 0.1.2.34.5.- -6.7.- 89->0.- -11.12•24-25•26.-27.-28?9 -30- VI <mL> 10 12 9 9 14 8 11 12 10 15 15 15 8 7 10 9 10 12 14 8 5 15 8 10 8 10 10 9 10 14 C D 4 5 R A + Total PROMED x 10 x !0 6 /jiL en VT (%) 93.7 1181 11810 92.0 1849 22188 89.4 1260 11340 86 1 1480 13320 89.9 2202 30828 86.8 649.2 5193.6 92.7 2271 24981 80.0 669.6 8035.2 84 7 880.8 8808 91.5 2241 33615 90.0 1053 15795 87.9 1072 16080 1007 89.2 8056 6482.7 882 926.1 87.3 1335 13350 87.5 672.0 6048 88.0 1126 11260 1124 13488 85.2 19264 86.6 1376 90.0 1305 10440 79.8 790.0 3950 85.9 15195 1013 983 8 86.3 7870.5 1494 14940 85 9 11840 85.6 1480 91.5 15920 1592 92.7 1668 16680 1634 89.8 14706 86 5 1219 12190 1196 16744 89.3 C D 7 1 + Total PROMF.D x 10* x I0 6 /\iL en V T (%) C D 3 4 + Total PROMED x!0J x 106 <%) /*iL en VT 1.5 18.90 189.0 1.8 22.68 226.8 1.7 34.17 410.0 1.6 32.16 385.9 1.5 21.15 190.3 1.8 25.38 228.4 1.3 22 36 201.2 1.5 25.8 232.2 1.4 34.30 480.2 1.6 39.2 548.8 137.6 . 1.7 12.71 101.7 2.3 17.20 1.8 44.10 485.1 2.2 53.9 592.9 1.8 15.06 180.7 1.4 11.71 140.6 1.7 17.68 176.8 1.8 18.72 187.2 1.5 36.75 551.2 1.6 39.2 588.0 0.9 10.53 157.9 1.8 21.06 315.9 1.7 20.74 311.1 1.3 15.86 2379 1.5 16.95 1356 2.0 22.6 180.8 0.8 8.40 58.8 1.5 15.75 110.2 1.6 24 48 244 8 1.6 2448 244.8 1.6 12.28 110.5 1.8 13 8 2 124.4 1.6 20.48 204.8 1.0 12.8 128.0 1.4 18.48 221.7 2.0 26.4 316.8 1.6 25.44 356.1 1.7 27.03 3784 1.6 23.2 185.6 2.2 31.9 255.2 1.4 13.86 69.3 1.2 11.88 59.40 1.5 17.7 265.5 2.0 23.6 354.0 1.3 14.82 118.5 1.6 18.24 146 0 1.4 24 36 243.6 1.6 27.84 278.4 1.4 24.22 193 7 1.6 27.68 221.4 1.4 24.36 243.6 2.3 40.02 400.2 1.8 32.4 324 0 22 39.6 396.0 1.5 27.3 245 7 1.2 21.84 196.5 1.3 18.33 183.3 1.2 16.92 169.2 1.1 14 7 4 206 3 1.3 17.42 243.8 . volumen total de la muestra en mililitros; PROMED, porcentaje promedio de las celulas con el inmunofenotipo indicado, obtenido •artir de la Tabla 6; x10 3 / pL, concentraci6n de leucocitos con el inmunofenotipo indicado, obtenida multiplicando los valores de 3MED con los de los leucocitos respectivos mostrados en la Tabla 4; -I volumen total de la muestra. x10 6 en VT, cantidad de c6lulas con el inmunofenotipo respectivo Tabla 7 (CONTINUACION). CD34+/45RA+ CD34+/CD71+ CD45RA+/CD71 + 6 3 )RDON VT CELULAS x 10 CELULAS x 10 x 10 x 10^ C E L U L A S *10J x 106 # (%) (mL) /jiL en VT (%) /nL en V T /yL en VT (%) 1.- 10 12 9 9 14 8 11 12 10 15 15 15 8 7 10 9 10 12 14 8 5 15 8 10 8 10 10 9 10 14 2.3.4.5.67.8.9.10.11.12.13.14.15.16.17.1819.2021.2223.24.25.2627.28.29.30.- 16 20.16 201.6 0 8 10 08 100 8 0.8 10.08 100.8 0.8 16 08 192.9 08 1608 192 9 1.2 2412 289 4 0 8 11.28 101.5 1.2 16 92 152.2 0.8 11.28 101.5 0.8 13 76 123 8 0.6 10.32 92.88 0.4 6.88 61.92 08 19.60 2744 0.8 1960 2744 1.0 24.50 3430 1.2 8 97 71.80 08 598 47.87 0.8 5.98 47 87 16 39 20 431.2 08 1960 215.6 1.2 29.40 323.4 1.2 10.04 120.5 0.8 669 80.35 0.8 6.69 80.35 1.2 12.48 124 8 08 8.32 83.20 1.2 12.48 124 8 08 19.60 2940 08 1960 294 0 0.8 19.60 2940 1.6 18 72 280 8 0.4 468 7020 0.4 4 68 70 20 08 9 760 146 4 0 8 9.76 146.4 1.0 1220 1830 1.6 18 08 144 6 0.8 9 04 72.32 1.2 13.56 1084 0 8 8 40 58 80 0.6 630 44.10 0.6 6 30 44.10 08 12.24 122.4 08 1224 122 4 0.8 12.24 122 4 1.2 9.21 82 94 0.8 6.14 55 29 0.8 6.14 55 29 153.6 0 8 10 24 102.4 04 5 12 51.20 1.2 15.36 1.6 21.12 2534 08 10.50 126.7 08 10.56 126.7 1.2 19.08 267.1 08 12.70 1780 1.0 15 90 222.6 92 80 1.2 17.40 139.2 10 14 50 116.0 0 8 11 60 0.8 7 920 39.60 08 792 39.60 0 8 7.92 39 60 16 18 88 2832 08 944 141.6 1.2 14 16 212.4 08 9.120 72.96 08 9.12 72 96 0 8 9.12 72.96 0.8 13.92 1392 0 8 13.90 139.2 0.8 13 92 139.2 1.2 20.76 166 0 06 1040 83 04 1.0 17.30 138 4 1.2 20 88 208 8 1.2 20 80 208.8 0.8 13 92 1392 216 0 12 21 60 216 0 08 1440 144 0 0.8 14.56 131.0 08 1450 131.0 1.2 16.92 169.2 04 5.64 0.8 10 72 150 0 0 4 5 36 volumen total de la muestra en mililitros; •la 6, • 1.2 21.60 0 8 14.56 131.0 56.40 0.8 11.28 1128 75.04 0.8 10.72 150 0 ' CELULAS, porcentaje de las c6lulas con el inmunofenotipo indicado, obtenido a partir de la x10 I pL, concentracibn de leucocitos con el inmunofenotipo indicado, obtenida multiplicando los valores de CELULAS con los DS leucocitos respectivos mostrados en la Tabla 4; •a muestra. x10 6 en VT, cantidad de c6lulas con el inmunofenotipo respectivo en el volumen total 0.4 0.4 0.1 • 25:0 0.2-0.6 M X S CV X ± 2S 0.8 0.7 0.2 25 0.3-1.1 CD34+/CD45RA+ 0.8 0.6 1.0 0.4 0.4 0.8 0.6 0.8 0.8 0.4 0.4 0.8 1.0 0.8 0.4 - - - - - Fa 1.0 1.0 1.4 0.8 1.0 1.0 0.8 1.0 1.2 0.8 0.6 1.2 1.6 1.2 1.0 0.4 0.4 0.1 25.0 0.2-0.6 CD34+ 0.4 0.4 0.4 0.4 0.4 0.4 0.2 0.2 0.4 0.4 0.4 0.4 0.6 • 0.2 0.4 0.4 0.4 0.1 25.0 0.2 - 0.6 CD34+/CD71+ 0.4 0.6 0.4 0.2 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.2 0.4 0.9 0.9 0.2 22.2 0.5-1.3 _ - - - - CD34+ TOT 0.9 1.0 1.1 0.7 0.9 0.9 0.7 0.8 1.0 0.8 0.7 1.0 1.3 0.8 0.9 Fb 0.8 1.0 0.8 0.6 0.8 0.8 0.6 0.6 0.8 0.8 0.8 0.8 1.0 0.4 0.8 ME, microscopia de epifluorescencia; CMSP, celulas movilizadas a sangre periferica; Fa, suma de los porcentajes de las celulas C D 3 4 + y CD34+/ CD45RA+ en los frotis de las muestras respectivas; Fb, suma de los porcentajes de las celulas C D 3 4 + y C D 3 4 + / C D 7 1 + en los frotis de las muestras respectivas. TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variacion. CD34+ 0.2 0.4 0.4 0.4 0.6 0.2 0.2 0.2 0.4 0.4 0.2 0.4 0.6 0.4 0.6 MUESTRA 1 2 3 4 5 6 7 8 9 10 11 12 13 . 14 15 Tabla 8. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD34+/CD45RA+, CD34+/CD71 Y CD34+ TOTALES EN CMSP DE ALODONADORES. 80.0 79.3 3.0 3.9 73.1 - 8 5 . 5 83 78 81 80 80 74 73 78 80 77 84 78 80 82 82 CD45RA+ 0.8 0.8 0.2 25 0.3 - 1.1 1..0 0.4 0.4 0.8 0.6 0.8 0.8 0.4 0.4 0.8 1.0 0.8 0.4 0.6 0.8 CD34+/CD45RA+ - - 84.0 78.4 81.4 80.8 80.6 74.8 73.8 78.4 80.4 77.8 85.0 78.8 80.4 82.6 82.8 Fa 79 0 78.7 3.2 4.1 72.3 - 8 5 . 1 82 77 80 80 79 73 72 77 80 78 83 77 79 81 83 CD45+ LAS 04 05 02 40 0 0.1-0.9 - ' Fb 83.4 81.4 82.4 77.4 80.6 80.4 79.4 73.4 72.6 77.8 80.4 78.4 83.8 77.4 79.8 CD45RA+/CD71+ CD45RA+/CD71 + CELULAS 80.1 79.6 3.1 3.9 73.4 - 85.8 CD45RA+ TOT 83.1 82.0 83.2 77.9 81.0 80.6 80.0 74.1 73.2 78.1 80.4 78.1 84.4 78.1 80.1 Y CD45RA+ Xc"lC1TCOpia de fP ifluorescencia ; C M S P , celulas movilizadas a sangre periferica; Fa, suma de los porcentajes de las celulas CD45RA+ y CD34+/ CD45RA+ en los frotis de las muestras respect,vas; Fb, suma de los porcentajes de las celulas C D 4 5 R A + y C D 4 5 R A + / C D 7 1 + en los fro^s de las muestras resDect,vas TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variacion respect,vas. M X S CV X±2S 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1 MUESTRA Tabla 9. VALORES DE REFERENCIA POR ME PARA TOTALES EN CMSP DE ALODONADORES. 0.4 0.5 0.1 20.0 0.3 - 0.7 M X s CV X ± 2S 0.4 0.4 0.1 25.0 0.2-0.6 CD34+/CD71+ .0.4 0.6 0.4 0.2 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.2 0.4 - - - - _ Fa 0.8 1.2 1.2 0.6 0.8 1.0 0.8 1.2 0.8 0.8 0.8 1.0. 1.0 0.6 0.8 0.4 0.4 0.1 25.0 0.2-0.6 CD71+ 0.4 0.6 0.4 0.4 0.4 0.4 0.4 0.6 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.4 0.5 0.2 40.0 0 . 1 - 0 . *9 CD45RA+/CD71+ 0.4 0.4 0.4 0.4 0.6 0.4 0.4 0.4 0.6 0.8 0.4 0.4 0.8 0.4 0.8 _ _ Fb 0.8 1.0 0.8 0.8 1.0 0.8 0.8 1.0 1.0 1.2 0.8 0.8 1.2 0.8 1.2 0.9 0.9 0.1 11.0 0vF». 7/ - 1JL«. 1J. CD71+ TOT 0.8 1.1 1.0 0.7 0.9 0.9 0.8 1.1 0.9 1.0 0.8 0.9 1.1 0.7 1.0 M E , microscopia de epifluorescencia; CMSP, celulas movilizadas a sangre periferica; Fa, suma de los porcentajes de las celulas CD71+ y C D 3 4 + / C D 7 1 + en los frotis de las muestras respectivas; Fb, suma de los porcentajes de las celulas C D 7 1 + y C D 4 5 R A + / C D 7 1 + en los frotis de las muestras respectivas. TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variation. ^ CD71+ 0.4 0.6 0.8 0.4 0.4 0.6 0.4 0.8 . 0.4 0.4 0.4 0.6 0.6 0.4 0.4 MUESTRA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Tabla 10. VALORES DE REFERENCIA POR ME PARA LAS CELULAS CD71+TOTALES DE CMSP DE ALODONADORES. 0.8 0.8 0.2 25.0 0.4—1.2 M X 0.8 1.1 0.3 27.3 0.5 — 1 . 7 CD34+/CD45RA+ 1.2 0.8 0.8 0.8 0.8 0.8 1.2 1.2 1.6 1.6 1.6 0.8 0.8 0.8 1.2 - - - - . Fa 2.4 1.6 1.6 1.6 1.6 1.6 2.4 1.8 .2.4 2.4 2.4 1.2 1.6 1.6 2.0 0.8 0.8 0.1 12.5 0.6—1.0 CD34+ 1.0 0.8 0.8 0.8 0.8 0.8 1.0 0.8 0.8 0.8 0.8 0.4 0.8 0.8 0.6 0.8 0.8 0.2 25.0 0.4 — 1 . 2 CD34+/CD71+ 1.2 0.8 0.8 0.8 0.8 1.2 1.0 0.6 0.8 0.8 0.8 0.4 0.8 0.8 0.8 1.6 1.7 0.3 17.6 1.1—2.3 _ - - - - CD34+ T O T 2.3 1.6 1.6 1.6 1.6 1.8 2.2 1.6 2.0 2.0 2.0 1.0 1.6 1.6 1.7 Fb 2.2 1.6 1.6 1.6 1.6 2.0 2.0 1.4 1.6 1.6 1.6 0.8 1.6 1.6 1.4 Se seleccionaron 15 muestras al azar de S C U H para poder realizar la comparacion final (Tabla 14) con las 15 de CMSP, el numero en parentesis indica el numero correspondiente de cordon en la Tabla 4 ME, microscopia de epifluorescencia; S C U H , sangre de cordon umbilical humano; Fa, suma de los porcentajes de las celulas CD34+ y C D 3 4 + / CD45RA+ en los frotis de las muestras respectivas; Fb, suma de los porcentajes de las celulas C D 3 4 + y C D 3 4 + / C D 7 1 + en los frotis de las muestras respectivas. TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variation. CV X ± 2S s CD34+ 1.2 0.8 0.8 0.8 0.8 0.8 1.2 0.6 0/8 0.8 0.8 0.4 0.8 0.8 0.8 MUESTRA 1 (26) 2 (24) 3 (28) 4 (15) 5 (10) 6 (3) 7 (20) 8 (25) 9 (7) 10 (22) 11 (13) 12 (17) 13 ( 2 ) 14 (5) 15 (19) Tabla 11. VALORES DE REFERENCIA POR ME PARA LAS SUBPOBLACIONES CD34+/CD45RA+, CD34+/CD71+ Y CD34+ TOTALES EN SCUH DE NEONATOS A TERMINO. 1.2 ' 1.1 0.3 27.3 0.5-1.7 CD34+/CD45RA+ 1.2 1.2 0.8 0.8 1.2 0.8 1.2 1,2 1.6 1.6 1.6 0.8 0.8 0.8 1.2 - - - - - Fa 91.2 90.2 89.8 88.8 91.2 88.8 91.2 88.2 92.6 85.6 85.6 88.8 90.8 90.8 88.2 88 87.8 3.0 3.4 81.8-93.8 CD45RA+ 91 88 89 85 91 89 88 82 92 85 87 86 92 88 84 1.0 1.0 0.2 20.0 0.6-1.4 CD45RA+/CD71+ 0.8 0.8 0.8 0.8 0.8 0.8 0.8 1.0 1.2 1.2 1.2 1.2 1.2 1.0 1.0 - - _ Fb 91.8 88.8 89.8 85.8 91.8 89.8 88.8 83.0 93.2 86.2 88.2 87.2 93.2 89.0 85.0 89.8 89.3 2.2 2.5 84.9 - 93.7 CD45RA+ T O t 91.5 89.5 89.8 87.3 91.5 89.4 90.0 85.6 92.9 85.9 90.2 88.0 92.0 89.9 86.6 Y Se seleccionaron 15 muestras al a z a r d e S C U H para poder realizar la comparacion final numero correspondiente de cordon en la Tabla 4 (Tabla 14) con las 15 de CMSP, el numero en parentesis indica el M E , microscopia de epifluorescencia; SCUH, sangre de cord6n umbilical humano; Fa, suma de los porcentajes de las celulas CD45RA+ y C D 3 4 + / CD45RA+ en los frotis de las muestras respectivas; Fb, suma de los porcentajes de las celulas CD45RA+ y C D 4 5 R A + / C D 7 1 + en los frotis de las muestras respectivas. TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variation. CV X ± 2S x s 89 88.3 2.1 '2.4 : 84.1 - 9 2 . 5 M . CD45RA+ 90 89 89 88 90 88 90 87 91 84 84 88 90 90 87 MUESTRA 1 (26) 2 (24) - 3 (28) 4 (15) 5 (10) 6 (3) 7 (20) 8 (25) 9 (7) 10 (22) 11 (13) 12 (17) 13 ( 2 ) 14 (5) 15 (19) Tabla 12. VALORES DE REFERENCIA POR ME PARA LAS SUBPOBLACIONES CD45RA+/CD71+ CD45RA+ TOTALES EN SCUH DE NEONATOS A TERMINO. 0.8 0.6 • 0.2' 33.3 0.2-1.0 0.8 0.8 0.2 25.0 0.4-1.2 CD34+/CD71+ 1.2 0.8 0.8 0.8 0.8 1.2 1.0 0.6 0.8 0.8 0.8 0.4 0.8 0.8 0.8 0.6 0.6 0.1 16.7 0.4-0.8 . - - - - CD71+ 0.4 0.8 0.6 0.8 0.6 0.4 0.6 0.8 0.8 0.6 0.6 0.8 0.6 0.6 0.6 1.0 1.0 0.2 20.0 0.6-1.4 CD45RA+/CD71+ 0.8 0.8 0.8 0.8 0.8 0.8 0.8 1.0 1.2 1.2 1.2 1.2 1.2 1.0 1.0 _ - - - Fb 2.2 1.6 1.6 1.6 1.6 2.0 2.0 1.4 1.6 1.6 . 1.6 0.8 1.6 1.6 1.4 1.5' 1.5 0.1 6.7 1.3-1.7 CD71+ TOT 1.4 1.4 1.5 1.6 1.5 1.5 1.6 1.4 1.8 1.5 1.5 1.6 1.7 1.4 1.6 PARA LAS CELULAS CD71+ TOTALES EN SCUH Fa 1.6 1.2 1.6 1.6 1.6 1.8 1.8 1.0 1.6 1.2 1.2 1.2 1.6 1.2 1.6 ME M E , microscopia de epifluorescencia; SCUH, sangre de cordon umbilical humano; Fa, suma de los porcentajes de las celulas C D 7 1 + y C D 3 4 + / C D 7 1 + en los frotis de las muestras respectivas; Fb, suma de los porcentajes de las celulas C D 7 1 + y C D 4 5 R A + / C D 7 1 + en los frotis de las muestras respectivas. TOT, suma de los promedios de Fa y Fb; M, mediana; X, media; S, desviacion estandar; CV, coeficiente de variation. Se seleccionaron 15 muestras al a z a r d e S C U H para poder realizar la comparacion final (Tabla 14) con las 15 de CMSP, el numero en parentesis indica el numero correspondient'e de cordon en la Tabla 4 CV X ± 2S s (26) (24) (28) (15) (10) (3) (20) (25) (7) (22) (13) (17) (2) (5) (19) M X 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 CD71+ 0.4 0.4 0.8 0.8 0.8 0.6 0.8 0.4 0.8 0.4 0.4 0.8 0.8 0.4 0.8 MUESTRA Tabla 13. VALORES DE REFERENCIA POR DE NEONATOS A TERMINO. 0.6-1.4 20 0.2 1 1 0.2 - 0.8 40 0.2 , u r c pcriicricti: S ( T I I . sanyre de cordon umbilical humano: M. medians: X, media: S. desviacion estandar: CV, coeficiente de variation. 0.5 0.4 CD45RA+/CD71 + 0.4-1.2 25 0.2 0.8 0.8 0.2 - 0.6 25 0.1 0.4 0.4 CD34+/CD71 + 1.0-1.6 27.3 0.3 1. 1.0 0.3-1.1 28.5 0.2 0.7 0.4 CD34+/CD45RA+ 1.3-1.7 7 0.1 1.5 1.5 0.7-1.1 15.5 0.I 0.9 0.9 CD71+ TOT 84.9 - 93.7 ~> 2.5 89.3 84.4 72.4 - 85.8 3.8 3.1 79.6 80.1 CD45RA+ TOT 1.1-2.3 17.6 0.3 1.7 1.6 0.5-1.3 22.2 0.2 0.9 0.9 X ± 2S c:v X M CD34+ TO I X±2S X M INMUNOFKNOT1PO CV LAS SUBPOBLACIONES DE CMSP SCUH . S DE REFERENCIA DE CMSP S Tabla 14. COMPARACION FINAL DE LOS VALORES VERSUS SCUH. Figura 6. CASO REPRESENTATIVO DE CELULAS CD34+ (ROJA) Y CD34+/ CD45RA+ (ROJA-VERDE) DE UNA MUESTRA DE SCUH. 6.- D I S C U S I O N Y C O N C L U S I O N E S Se analizaron un total de 45 muestras de las cuales 30 eran de SCUH y 15 de CMSP. De las 30 muestras de SCUH, se presento una similitud en cuanto a la etapa de gestacion que fue de 38 semanas a 41.5, la edad de la madre vario un poco mas teniendo una minima de 15 anos y una maxima de 38, en cuanto al tipo de parto la mayoria de estos fue parto normal con excepcion de 8 que fueron por cesarea, y los mililitros de sangre obtenida vario de acuerdo a el tamano del cordon (Tabla 4). En cuanto a las subpoblaciones estudiadas (CD34+ / CD45RA+. CD34+ / CD71+, CD45RA+ / CD71+) . Se utilizaron estos inmunofenotipos ya que la combinacion de estos permite identificar claramente a las subpoblaciones que son de nuestro interes teniendo que el inmunofenotipo CD34+/CD45RA+ es caracteristico de la subpoblacion de la serie granulo-monocitica, el CD34+/ CD71+ es caracteristico de la serie eritrocitica y el CD34+/CD45RA+/CD71+ es caracteristico de la serie mixta, estos inmunofenotipos ya han sido estudiados previamente y concuerdan con los resultados de nuestras subpoblaciones estudiadas (2,8,10). En los resultados presentados anteriormente (Tablas 8 a la 13) observamos que en la cantidad de celulas de una sola subpoblacion (CD34+, CD45RA+ o CD71+) de diferentes frotis de la misma muestras (SCUH o CMSP), las cantidades no variaban considerablemente (como lo indican los CV respectivos), por lo regular siempre se mantenia en un rango de la misma cantidad, como ejemplo estan las celulas CD34+ y CD71 + de diferentes frotis pero de la misma muestra, donde era constante ver la misma cantidad de celulas, no obstante tambien observamos frotis donde vario la cantidad de estas, pero esta variacion fue minima y por consiguiente no significativa. En cuanto a las celulas CD45RA se observo una mayor variacion en las cantidades de las celulas por frotis, sin ser tampoco significativa. Ni incluso al hacer el analisis poblacional. Por lo tanto, podemos tomar estos datos (CV respectivos) como una medida de control interno, ya que si nuestro coeficiente de variacion entre un frotis y otro de ia misma muestra no fue considerable, se supone que se trabajaron las muestras adecuada y optimamente. Situacion similar se observo en las subpoblaciones con el doble inmunofenotipo observadas en SCUH: CD34+/CD45RA+, CD34+/CD71 + , CD45RA+/CD71+, ya que sus CV fueron 27.3, 20 y 25 respectivamente. Las subpoblaciones CD34-/CD45RA+ y CD34-/CD71+, pensamos que son celulas ya maduras tanto CD45RA-/CD71-, de la estirpe mieloide como eritroide. CD34+/CD45RA- , CD34+/CD71- En cuanto consideramos que a las estan relacionadas entre si. De tal forma que al tomar las CD34+/CD45RA- y CD34+/CD71-, podemos pensar que el resto eran celulas CD45RA + leucocitos, CD71 + eritrocitos o ambas y en le caso de las CD45RA- / CD71- que estaban presentes podemos pensar que el resto eran celulas CD34+. Posteriormente apareamos 15 muestras de SCUH escogidas al azar, con las 15 de CMSP, con el fin de obtener los valores de referenda en ambas muestras con su respectivo analisis estadistico. Asi, observamos que al comparar la cantidad de celulas CD34+ totales en ambas muestras se encontro una mayor cantidad de estas en las muestras de SCUH que en las de CMSP (Tabla 14). Siendo casi del doble, este dato es muy significativo y de importancia, ya que como diversos autores han mostrado (1-8), las celulas CD34+ totales son las que potencialmente dan origen a las subpoblaciones. En cuanto a las celulas CD45RA+ totales los valores obtenidos para las SCUH fueron de 84.9 - 93.7% (Tabla 12) y para CMSP fueron tambien menores 73.4 - 85.8% (Tabla 9). Por io que se vuelve a observar lo que antes se discutio para ios valores de las celulas CD34+. El porcentaje en las celulas CD71+ totales fue mayor tambien en SCUH, 1.3 -1.7% (Tabla 13) que en CMSP 0.7 - 1.1%. (Tabla 10). Asi mismo tambien observamos la misma situacion con los valores de las subpoblaciones CD34+/CD45RA+, CD34+/CD71+ y CD45RA+/CD71+, encontrado siempre mayores porcentajes en las muestras de SCUH respecto a las de CMSP. Asi, en la subpoblacion CD34+/CD45RA+ el valor para SCUH fue de 0.5-1.7% (Tabla 11) y para CMSP fue de 0.3 - 1.1% (Tabla 8). Para la subpoblacion CD34+/CD71 de SCUH el valor fue de 0.4 - 1.2% (Tabla 11) significativamente mayor que el mostrado en las CMSP, 0.2 - 0.6% (Tabla 8). Finalmente en la subpoblacion CD45RA+/CD71+ el valor obtenido fue para la SCUH de 0.6 - 1.4% (Tabla 12) comparado con el valor de CMSP que fue de 0.1 - 0.9% (Tabla 9) observando tambien un menor valor de estas. Como se observo a io largo de este estudio comparativo, las subpoblaciones hematopoyeticas varian en cuanto a porcentajes como a cantidad total de un tipo de muestra a otra, siendo ambos parametros siempre mayores en las muestras de SCUH, lo que la hace una fuente muy importante para obtener celulas CD34+ para transplantes hematopoyeticos alogenicos. Al confrontar nuestros resultados aqui presentados con los realizados por otros autores, observamos que en la gran mayoria de los casos coinciden (32-35) y en algunos no (36). Sin embargo, en los casos donde coinciden las cantidades de celulas totales o de subpoblaciones no son similares, pensamos que esto puede depender posiblemente de varios factores, como por ejemplo: • La metodologia para obtener las celulas precursoras, • El procesamiento de las muestras, • La metodologia para analizar las muestras. Aunque cabe senalar que ninguno de estos autores enfocaron sus estudios a la obtencion de valores de referenda, por lo que su numero de muestras con el que trabajaron no fue estadisticamente significativo. Nuestro estudio es el primero que muestra y aporta valores de referencia para las diferentes subpoblaciones estudiadas tanto para muestras de SCUH como para muestras de CMSP, que si bien fueron obtenidos por microscopia de epifluorescencia, marcan la pauta para conocer datos estadisticamente significativos en futuros estudios relacionados con el tema. 7.- B I B L I O G R A F I A 1.- Shirlyn B. McKenzie. Hematologia Clinica. 2a Edicion, Mexico; El Manual Moderno. 2001. p. 18-45. 2.- Williams GT,Smith CA . Spooncer E , Dexter TM, Taylor DR. Hematopoietic colony stimulating factors promote cell survival by suppressing apoptosis. Nature.1990; 343(6253): 76-9. 3.- Stites, Stobo, Fundenberg y Wells. Inmunologia Basica y Clinica. 5ta ed. Mexico; El Manual Moderno; 2000. p. 85-9. 4.- L. Florensa, M.T. Coll y S Woessner. Hematologia Clinica 1998; 470-477 5 - Michel Punzen and Anthony D. Ho. Divisional History and Pluripotency of Human Hematopoietic Stem Ceils. Ann N Y Acad Sci. 2001; 938: 72-81. 6.- Cherry, Yasumizu R, Toki J, Asou H, Nishino T, Komatsu Y. Production of hematopoietic stem cells chemotactic factor by bone marrow stromal cells. Blood 1994; 83(4): 964-71. 7- Lansdorp PM, Sutherland HJ, Eaves CJ. Selective expression of CD45 isoforms on functional subpopulation of CD34+ hematopoietic cells from human bone marrow. J Exp Med. 1990; 172(1): 363-75 8.-Mayani H, Drawogska W, Lansdorp PM. Characterization of functionally distinct subpopulation of CD34+ cord blood cells in serum free long-term cultures supplemented with hematopoietic cytokines. Blood. 1993; 82(9): 2664-72. 9.- Ricardo Anibal Margini. Fundamentos de Inmunologia e Inmunoquimica. 5ta ed. Mexico; El Manual Moderno; 2001. p 231-250. 10.- Eilliam E Paul. Fundamental Immunology. 2nd ed. New York; Raven Press; 2001.p. 640-1.. 11.- Las Citocinas. http://wwwsanidadanimal.info/inmuno/sexto1 .htm 12- Zandstra PW, Conneally E, Petzer AL, Piret JM, Eaves CJ. Cytokine manipulation of primitive human hematopoietic cell self-renewal. Proc Natl Acad Sci USA 1997; 94 (9): 4698-4703. 13.- James T Barrett. Inmunologia de Barrett. Mexico ; Interamericana McGraw-Hill; 2002.p. 11-13. 14.- Citocinas: http7Zw.ww.fmeclic.unr edu.ar/catedras/inmunoloqia/Himuno/capl^ 15 - Erlich P. On immunity with specific reference to cell life. Proc R Soc Lond. 1900: 66:424 16.- Kholer G, Milstein C. Continuous culture of fused cells secreting antibody of predefined specificity. Nature 1975; 236:495. 17 - Breedveld FC. Therapeutic monoclonal antibodies. Lancet 2000: 355(9205):735-40. 18 - Brynes RK, McKenna, R.W. Sundenberg RD. Bone marrow aspiration and trephine biopsy: an approach to a thorough study. Am J Clin Pathol. 1978 ;70(5):753-9. 19 - Koepe JA Practical laboratory hematology. New York: Churchill Livingstone, 1991 20. Gabrilove JL Introduction and overview of hematopoietic grow factors. Sem Hemat. 1989; 26 (2 suppl 2) 1-4. 2 1 - Williams WJ, Nelson DA, Morris MW. Examination of the blood.In Hematology 4lh Ed. Edited by WJ, Williams. New York: Mc Grraw Hill, 1989. 22.- Smith SP, Yee GC. Hematopoiesis. Pharmacotherapy 1992; 12 (2pt. 2) 11S-19S. 23 - A.M.H.G.O. # 13 DEL IMSS. Ginecologia y Obstetricia, 3a ed. Mexico Mendez Editores S.A de C.V ; 1999. p. 47-49. 24.- Rubinstein P, Carrier C, Scaradavou A, Kurtzberg J, Adamson J, Migliaccio A, et al Outcomes among 562 recipients of placental-blood transplants from unrelated donors. N Engl J Med. 1998: 339(22): 1565-77. 25.- Alexander J Indrikovs. Transplante de celulas progenitoras hematopoyeticas de sangre de cordon umbilical. Gac Med Mex 2002; 138 (supll). 26.- Gluckman E, Broxmeyer HE, Auerbach AD. Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical cord blood from HLA -identical sibling. N Engl J Med. 1989; 321: 1174. 27.- Cairo MS, Wagner JE .Placental and/or umbilidcal cord blood : an alternative source of hematopoietic stem cells for transplantation. Blood 1997; 90: 4665-78. 28.- Arcese W, Aversa F, Bandini G, De Vicentiis A, Falda M, Lanata L et al. Clinical, uses of allogenic hematopoietic stem cells fron source other than bone marrow Haematologica.1998; 83: 159-182. 29.- Carlos Martinez Murillo. El banco de celulas madre hematopoyeticas de cordon umbilical para transplante. Gac Med Mex 2003;139 (supl. 3) 30.- Gluckman E. Current status of umbilical cord blood hematopoietic stem cells transplantation. Exp Hematol 2000: 28(11): 1197-205. 31.- Javier F, Adur, Fernando D, Juan C.Garcia, Jose F. Vila, Ma. Fernada Izaguirre Y Victor H. Casco. La observacion tridimensional. La nueva era en la microscopia de epiflurescencia. Ciencia Hoy. 2001; 11: 64 32 - Kinnburgh D, Russell NH. Comparative study of CD34 positive cells and subpopulation in numan umbilical cord blood and bone marrow. Bone Marrow Transplant. 1993; 12(5):489-94 33 - Fri'tsch G, Buchinger P, Printz D, Fink FM, Mann G, Peters C, etal. Rapid discrimination of early CD34+ myeloid progenitors using CD45-RA analysis Blood 1993 ,81(9): 2301-9 34 - Mayani H, Lansdrop P. Proliferation of individual hematopoietic progenitors purified from umbilical cord blood. Exp Hematol. 1995 ; 23(14): 1453-62. 35 - Fritsch G, Stimpfl M, Kurz M, Printz D, Buchinger P, Fischmeister G, Hoecker P, G a d n e r H. The composition of CD34 subpopulations differs between bone marrow, blood and cord blood. Bone Marrow Transplant. 1996; 17(2): 169-78. 36.- Giovanni Di Arena , Musto P, Cascavilla N, Di Giorgio G, Zendoli F, Carotenuto M. human umbilical cord blood: immunophenotipic heterogeneity of CD34+ hematopoietic progenitors cells. Hematologica. 1996 ; 81(5): 404-9.